需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
免疫组化检测异常朊蛋白
摘要
使用免疫组织化学方案对异常朊蛋白进行免疫标记需要特定的样品和抗PrP抗体制备方法。本协议描述了表位去掩膜的关键步骤,以确保适当的PrP免疫标记并最大限度地减少非特异性背景染色。此外,这种方法在对朊病毒感染的组织进行免疫组织化学研究时考虑了生物安全措施。
摘要
异常朊蛋白 (PrPSc) 是细胞朊蛋白的疾病相关亚型,也是传染性海绵状脑病 (TSE) 的诊断标志物。这些神经退行性疾病影响人类和几种动物物种,包括搔痒症、人畜共患牛海绵状脑病 (BSE)、宫颈慢性消耗性疾病 (CWD) 和新发现的骆驼朊病毒病 (CPD)。TSE的诊断依赖于通过对脑组织(即脑干)应用免疫组织化学(IHC)和西方免疫印迹法(WB)对PrPSc 进行免疫检测。IHC是一种广泛使用的方法,它使用一抗(单克隆或多克隆)来对抗组织切片细胞中的目标抗原。抗体-抗原结合可以通过颜色反应来可视化,该颜色反应仍局限于抗体靶向的组织或细胞区域。因此,在朊病毒疾病中,与其他研究领域一样,免疫组织化学技术不仅用于诊断目的,还用于发病机制研究。此类研究涉及从先前描述的模式和类型中检测PrPSc 模式和类型,以鉴定新的朊病毒菌株。由于疯牛病可以感染人类,建议使用生物安全实验室3级(BSL-3)设施和/或实践来处理TSE监测中包含的牛,小反刍动物和宫颈样本。此外,建议尽可能使用密闭和朊病毒专用设备,以限制污染。PrPSc IHC程序包括甲酸表位去掩蔽步骤,也作为朊病毒灭活措施,因为该技术中使用的福尔马林固定和石蜡包埋组织仍然具有传染性。在解释结果时,必须注意区分非特异性免疫标记和靶标标记。为此,重要的是要识别在已知的TSE阴性对照动物中获得的免疫标记伪影,以区分这些伪影与特定的PrPSc 免疫标记类型,其可以在TSE菌株,宿主物种和 prnp 基因型之间变化,本文进一步描述。
引言
根据朊病毒假说,异常亚型(PrPSc)是传染性海绵状脑病(TSE)中感染因子的主要或唯一成分。TSE 的诊断确认依赖于通过应用脑组织的免疫组织化学 (IHC) 方案和/或蛋白质免疫印迹法 (WB) 对 PrPSc 进行免疫检测1。
IHC是一种采用单克隆抗体或在某些情况下使用多克隆抗体(作为一抗)作为对位于组织切片细胞中的特定目标抗原进行免疫染色的第一步的方法。然后使用针对一抗的二抗观察任何有效的一抗-抗原结合。这些二抗与辣根过氧化物酶(HRP)或碱性磷酸酶(AP))偶联。然后通过向这些酶添加底物来实现可视化,产生位于一抗与靶抗原结合的区域的不溶性颜色产物。改进的可视化可以通过复染来实现,其中染料用于在免疫标记和非免疫标记的组织之间产生对比2。
对于使用福尔马林固定石蜡包埋组织 (FFPE) 的 IHC,福尔马林固定可能会由于甲醛交联以及石蜡包埋过程中的加热和脱水而使一抗的有效性失效。这些改变蛋白质的构象,破坏、变性或掩盖表位,从而减少或取消其检测3。因此,这需要抗原修复(AR)。AR技术破坏抗原分子中与甲醛相关的化学基团交联,从而恢复或揭示原始的抗原 - 蛋白质构象。这导致恢复抗体-抗原(表位)亲和力以进行免疫标记。AR的最终疗效取决于靶向抗原和/或一抗的质量2。
热诱导抗原(表位)修复(HIER)是AR3 的一个程序,常规用于PrPScIHC 检测,如本文所述。IHC 对于诊断至关重要,在研究实验室中用于确定病理相关抗原的组织分布。它广泛用于诊断和研究癌症、神经科学和传染病4 等。对于TSEs,IHC在诊断和研究中起着重要作用,以确认和研究PrPSc 在自然宿主和实验模型中的分布。IHC有助于朊病毒发病机制研究和PrPSc 沉积类型和模式的分析,即在神经组织中5中,以检测与常规描述的感染的偏差并识别推定的新朊病毒株。
由于牛海绵状脑病(BSE)的朊病毒可以感染人类,因此涉及BSE工作的某些实验室方案可能需要使用BSL-3设施和实践6。这些措施包括使用密封的二级容器在研究所和实验室内运输潜在的BSE感染组织样本。它还包括尽可能为疯牛病研究和分析指定遏制区域和朊病毒专用设备。这样做是为了防止工作区域以外的污染,并提供一个密闭的空间,因为净化程序变得必要。
因此,INIAV 病理学实验室遵循推荐的生物安全 3 级 (BSL-3) 设施和实践6 ,以管理与 TSE 监测相关的牛、小反刍动物和子宫颈的潜在朊病毒感染组织样本。
TSE诊断或研究程序中包含的福尔马林固定和石蜡包埋组织,特别是在中枢神经系统中,可能具有潜在的传染性。因此,在组织处理之前,必须用甲酸处理这些固定组织,以降低朊病毒(如果存在)的感染性。这是通过将固定的,修剪的组织(约2-4毫米厚)放置在处理盒中来完成的。然后将盒浸入98%甲酸中(1小时)。浸泡后,将带有组织的盒在流动的自来水中洗涤30分钟,并在进一步处理之前返回固定剂。如果在处理前未处理组织切片,则在组织学染色之前,必须将切片后的切片浸入未稀释的甲酸中至少5分钟7。PrPSc 的IHC方案包括常规的甲酸表位去掩蔽步骤,也用于灭活朊病毒7。在这些朊病毒灭活步骤之后,可以使用标准的BSL-2实践在BSL-2下处理所得的固定组织。
TSE监测中包含的任何动物TSE诊断的最低组织采样要求是收集脑干(在obex水平)。此外,为了检测非典型疯牛病和搔痒症,建议还应收集部分小脑1,8。对于CWD诊断,应检测脑干(obex)和咽后淋巴结,因为PrPSc可以在淋巴组织中检测到,而在obex9中没有检测到PrPSc,由Machado等人审查10。
脑干的obex部分包括诊断性TSE靶位点,即迷走神经背侧核(DVN)、孤立束核(STN)和三叉神经的脊髓束核(V)。这些区域始终呈现双侧PrPSc 积累,即使在疯牛病和经典搔痒症的早期阶段也是如此。在晚期 TSE 的临床病例中,脑干内的所有灰质区域都显示出广泛的 PrPSc 分布11。
在切片和处理之前,对脑样本进行评估(图1),以确定自溶水平和是否存在任何可能损害样本适用于基于IHC的确认性诊断的组织损伤8。为了验证制备方案和分析结果的完整性,将TSE阳性和阴性组织样品作为对照包括在内,并在每次测定中从测试用例制备组织。
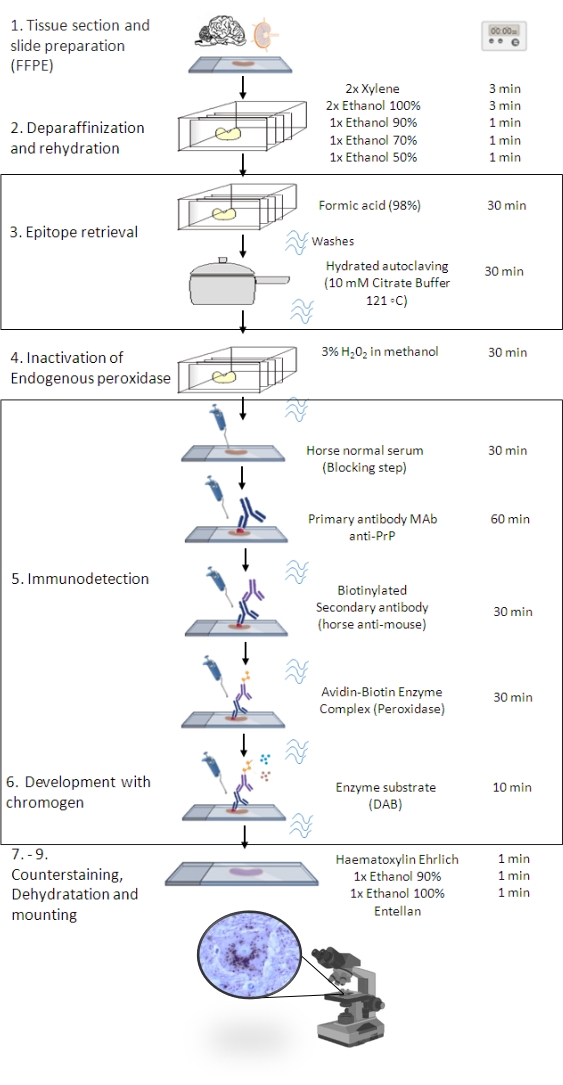
图1:PrPSc免疫 接种程序。 表示显示从组织切片脱蜡到最终免疫染色和检测的 PrPSc IHC 程序的分步顺序(FFPE - 福尔马林固定石蜡包埋;Mab - 单克隆抗体;DAB - 3,3' 二氨基联苯胺)。这个数字是在 BioRender.com 年创建的。 请点击此处查看此图的大图。
研究方案
本文所述的IHC程序是研究项目FAIRJ-CT98-7021的组成部分,"建立欧洲反刍动物TSE监测网络以及识别疑似病例的程序和标准的标准化和协调"。它遵循世界动物卫生组织、WOAH(以前称为国际动物卫生组织办公室,OIE)1 和欧洲动物 TSE8,11 参考实验室定义的诊断标准。自2008年以来,所述的IHC程序也根据NPISOIEC17025(测试和校准实验室能力的一般要求)进行了认证。这种认证意味着一个高质量的管理体系,包括标准操作程序、合格人员、精确校准的设备、对数据和试剂的严格控制、参与实验室间能力测定、不合格工作和风险评估,以提高管理体系的有效性,实现改进的结果,并防止实验室危害。从各种来源收集朊病毒感染的BSE,经典搔痒,非典型搔痒和CWD的组织对照(福尔马林固定,石蜡包埋,FFPE)。牛和羊部分来自根据动物TSE监测计划诊断的病例。CWD部分来自Stefanie Czub教授(加拿大食品检验局,国家动物疾病中心)于2003年提供的对照样本,以及由欧洲TSE参考实验室(APHA,Weybridge)组织的2008年CWD能力测试。
1. 组织切片和玻片制备
- 使用切片机切割福尔马林固定的石蜡包埋 (FFPE) 组织切片,厚度为 3-5 μm。
- 将切片漂浮到纯净水上,温度比所用石蜡的熔点低约10°C。将切片从水中提起到经过特殊处理的显微镜载玻片上(见 材料表)。让水从滑梯上彻底排出。
- 将载玻片在50°C孵育过夜,以增强组织的载玻片粘附。
注意:最好为IHC方案准备新鲜切片的组织,尽管TSE阳性和阴性对照切片可以提前制备并储存。步骤 2 到 4 必须在化学通风橱中进行。
2. 脱蜡和补液
- 将带有组织切片的载玻片放入不锈钢染色篮中(见 材料表)。将篮子浸入二甲苯浴(不锈钢染色容器)中3分钟,取出并再次浸入。
- 通过将二甲苯浸入无水乙醇浴中3分钟来除去二甲苯和再水化部分。取出并再次浸入。
- 风干切片并置于90%乙醇浴中1分钟。转移到70%乙醇浴中再发酵一分钟,然后最终转移到50%乙醇浴中1分钟。对于每次乙醇浴处理,轻轻搅拌载玻片篮两次,并在下一次转移之前排干篮子。
3. 表位修复
- 小心地将组织切片在室温下浸入98%甲酸中30分钟。用自来水冲洗切片5分钟,然后在蒸馏水中冲洗两次。
注意:甲酸具有很强的腐蚀性。必须佩戴护目镜和手套。 - 按照以下步骤执行热诱导抗原修复 (HIER)。
注意:此步骤通过在121°C下在特定压力室中水合高压灭菌30分钟来执行(参见 材料表)。- 将柠檬酸盐缓冲液(10mM,pH 6.1,参见 材料表)在98°C下预热约20分钟,置于充满500mL蒸馏水的压力室内的压力室内。
注意:对于本研究,对于所使用的特定设备,程序设定点为1(SP1)。 - 在警报指示设备达到编程的时间和温度后,用载玻片浸入篮子并启动程序至设定点 2(121° C 30 分钟)。出于质量控制目的,在篮子上放置一段粘性高压釜指示胶带以监测温度和压力,并记录该程序的初始和最终压力。
- 如果要免疫染色的载玻片数量未达到篮子的容量,请使用干净的空白载玻片占据任何空位。程序终止后,允许腔室被动返回环境压力(至少30分钟)。
注意:较长的持续时间可能会减少非特异性背景染色。 - 小心地将载玻片篮转移到装有蒸馏水的不锈钢染色容器中5分钟。
- 将柠檬酸盐缓冲液(10mM,pH 6.1,参见 材料表)在98°C下预热约20分钟,置于充满500mL蒸馏水的压力室内的压力室内。
4.内源性过氧化物酶失活
- 将装有样品部分的载玻片篮浸入3%过氧化氢(H2O2)的甲醇浴中30分钟。在流水下冲洗切片(5分钟)。将切片沥干并浸入 1x Tris 缓冲盐水 (TBS) 中再浸泡 5 分钟。
5. 免疫检测
注意:对于本研究,使用市售的玻片夹组装系统使用毛细管间隙格式7 执行免疫检测(参见 材料表)。其他免疫组织化学玻片系统也适用。
- 将每张载玻片放在市售的盖板支架(参见 材料表)上,用TBS预先润湿,避免气泡,组织面朝向支架,滑块边缘与支架的两个下点重合。
- 将载玻片支架组件夹在拇指和食指之间,一根手指放在样品载玻片顶部,另一根手指放在支架底部。然后,将程序集放在系统的库中。
- 为确保套件组装良好,请用TBS填充样品载玻片和支架之间的孔,TBS不得立即溢出。从这一点开始,确保支架和载玻片之间必须保留大约 80 μL TBS。不要让切片干燥。
- 一旦进入系统,为了在用一抗(抗PrP,参见 材料表)处理之前减少背景染色,将样品载玻片与用于免疫染色的二抗宿主(在本例中为马血清)相同物种的20%正常血清预孵育在TBS中30分钟。
- 根据所分析的动物种类解冻要使用的抗体等分试样的数量、要检查的样品切片的数量以及工作稀释量。
注意:为获得最佳效果,请使用来自同一物种的 10% 正常血清作为二抗和一抗溶液的来源。如果可能,为获得最佳结果,正常血清和二抗的宿主来源应来自同一物种。 - 在不清洗切片的情况下,将一抗溶液直接(200μL)涂在载玻片支架组的每个孔中,并在室温下孵育60分钟。
- 洗涤时,用TBS填充载玻片支架组的孔并等待5分钟。 重复两次。
- 用10%马血清在TBS中以1/200稀释生物素化的二抗(单克隆抗鼠Horse Ab,参见 材料表)。根据要处理的部分数量准备所需的体积。
- 将二抗溶液(200 μL)应用于载玻片支架组的每个孔中。在室温下孵育30分钟。
- 按照步骤5.5中的说明洗涤。
- 为了与亲和素 - 生物素复合物过氧化物酶(ABC / HRP复合物,参见 材料表)孵育,在使用前30分钟准备试剂。在滑板支架组的每个孔中应用 ABC/HRP 复合溶液 (200 μL)。在室温下孵育30分钟。
- 按照步骤5.5中的说明洗涤。
6. DAB显色剂的发展
注意:DAB是一种潜在的致癌物。因此,在使用这种试剂时需要适当的护理,包括眼睛保护、实验室外套、手套和良好的实验室程序。按照当地法规进行处理。
- 使用前立即根据制造商的说明(见 材料表)稀释色原。将色原溶液(400μL)施加到滑板组的每个孔中。
- 在室温下孵育长达30分钟。在PrPSc 阳性切片中,10分钟的潜伏期通常就足够了。
- 通过在蒸馏水中洗涤载玻片来除去残留的色原溶液。从盖板支架上取下载玻片,并将它们放入装有蒸馏水的塑料容器中。
7. 苏木精复染
- 将带有切片的不锈钢染色篮浸入苏木精溶液浴(见 材料表)中1分钟。用冷流水轻轻冲洗10分钟或温水冲洗5分钟。
- 通过将切片置于90%乙醇中1分钟,然后在无水乙醇中浸泡1分钟来脱水切片。然后,将载玻片放入二甲苯浴中1分钟。
- 用市售的安装介质安装这些部分(参见 材料表)。
注意:这些步骤在室温(19°C-24°C)的化学通风橱中进行。此过程包括测试记录(补充文件1),用于记录所有步骤的完成,使用的设备和实验室技术人员。此外,还设计了一个工作表(补充文件2),可根据每次测定中的切片数、工作稀释度和制造商的说明轻松确定试剂的体积,并记录室温、设备和试剂批次。
结果
鉴于非特异性靶标免疫标记是可能的,因此确定已知TSE阴性对照动物的非特异性免疫标记水平非常重要。这是正确解释特异性PrPSc免疫标记7的重要步骤(图2)。 抗 PrP 抗体的非靶标标记表现为离散的神经元内细颗粒染色(在舌下核和辅助楔形核中更明显)、神经枕中不规则的细线染色(STN、V、寡核、附属楔形核、侧束核、寡核背侧网状形成...
讨论
TSE是潜在的人畜共患疾病。1986年英国出现疯牛病后,葡萄牙成为该病发病率较高的欧盟成员国之一14,15。为了控制这种疾病,已经出现的其他TSE(经典和非典型搔痒症,疯牛病变体,以及目前对宫颈慢性消耗性疾病的监测),食品和兽医总局(DGAV)和国家农业和兽医研究所(IP)开发了监测机制,该研究所作为TSE国家兽医实验室进行TSE诊断。该实验室...
披露声明
作者没有什么可透露的。
致谢
本文由FCT(科学和技术基金会)支持的POCI-01-0145-FEDER-029947项目"葡萄牙的慢性消耗性疾病风险评估"资助 - FEDER-Balcão2020。此外,研究单位CECAV的作者在UIDB / CVT / 0772 / 2020项目下获得了FCT的资助.我们感谢美国农业部西部区域研究中心研究主任(退休)Bruce C. Campbell的帮助。
材料
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase | Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use | ||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum | Gibco | 16050-122 | Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. | ||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. | ||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
参考文献
- . WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. - Scrapie (Version May 2022) Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022)
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M., Oliver, C., Jamur, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466 (2021).
- . Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020 Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022)
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。