A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
زرع وتقييم سرطان الجلد في المشيمية الفئران عن طريق التصوير المقطعي للتماسك البصري
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول زرع وتقييم سرطان الجلد في المشيمية الفئران باستخدام التصوير المقطعي للتماسك البصري.
Abstract
يعد إنشاء نماذج تجريبية لسرطان الجلد المشيمي أمرا صعبا من حيث القدرة على تحفيز الأورام في التوطين الصحيح. بالإضافة إلى ذلك ، فإن الصعوبات في مراقبة سرطان الجلد المشيمي الخلفي في الجسم الحي تحد من موقع الورم وتقييم النمو في الوقت الفعلي. يعمل النهج الموصوف هنا على تحسين تقنيات إنشاء سرطان الجلد المشيمي في الفئران عبر إجراء حقن الخلايا B16LS9 المشيمية متعدد الخطوات. لتمكين الدقة في الحقن في الأبعاد الصغيرة للعنبية الفأرية ، يتم تنفيذ الإجراء الكامل تحت المجهر. أولا ، يتم تشكيل محيط الملتحمة في المنطقة الظهرية الزمنية للعين. بعد ذلك ، يتم إنشاء مسار في الفضاء المشيمي الفرعي عن طريق إدخال إبرة من خلال الصلبة المكشوفة. ويتبع ذلك إدخال إبرة حادة في القناة وحقن خلايا سرطان الجلد في المشيمية. بعد الحقن مباشرة، يتم استخدام التصوير المقطعي للتماسك البصري غير الباضع (OCT) لتحديد موقع الورم وتقدمه. يتم تقييم انفصال الشبكية كمؤشر لموقع الورم وحجمه. تتيح الطريقة المقدمة الحث القابل للتكرار للورم الميلانيني الموضعي المشيمي في الفئران والتصوير الحي لتقييم نمو الورم. على هذا النحو ، فإنه يوفر أداة قيمة لدراسة أورام العين.
Introduction
الورم الميلانيني العنبي (UM) هو الورم الخبيث الأولي داخل العين الأكثر شيوعا لدى البالغين. ما يقرب من 90 ٪ من الأورام الميلانينية العينية تنشأ من الخلايا الصباغية في منطقة المشيمية في القناة العنبية1. UM هو سبب رئيسي للمراضة والوفيات ، حيث تشير التقديرات إلى أن ما يقرب من 50 ٪ من المرضى يصابون بمرض نقيلي ، مع كون الكبد هو الموقع الرئيسي للورم الخبيث2. قد يقلل العلاج المبكر للآفات الأولية من فرصة حدوث النقائل ، ولكن لا يوجد علاج فعال يمنع تكوين النقائل3.
يشمل العلاج القياسي لسرطان الجلد العنبي العلاج الإشعاعي ، والذي يرتبط بفقدان الرؤية بسبب اعتلال الأعصاب البصرية ، واعتلال الشبكية ، ومتلازمة العين الجافة ، وإعتام عدسة العين. عادة ما يتأخر الاستئصال الجراحي حتى يتم التعرف على نمو الآفة وتوصيفها. ومع ذلك ، فإن مثل هذا التأخير قد يسمح بتطور المرض النقيلي4. في بعض الحالات ، مطلوب استئصال غير مجدي. بالطبع ، هذا الإجراء الجذري يضر بالرؤية ويؤدي إلى تدهور جمالي كبير.
كانت هناك العديد من الجهود المكرسة لتطوير نماذج تجريبية لدراسة سرطان الجلد العنبي. تعد النماذج الحيوانية قبل السريرية التي تسمح بالتقييم الدقيق لهذا الورم الخبيث أساسية للتحقيق في الاستراتيجيات التشخيصية والعلاجية الجديدة لسرطان الجلد العنبي. تعتمد النماذج الحيوانية التجريبية لسرطان الجلد العيني بشكل أساسي على تلقيح الخلايا السرطانية في الفئران والجرذان والأرانب 5,6. نماذج الفئران فعالة من حيث التكلفة وتستخدم على نطاق واسع لدراسات سرطان الجلد بسبب معدل تكاثرها السريع وتشابه الجينوم العالي مع البشر. يستخدم خط خلايا سرطان الجلد الجلدي B16 بشكل شائع لتلقيح الفئران C57BL6 وإحداث أورام وراثية. عند استخدام هذا النموذج للحث على سرطان الجلد العنبي ، تحتاج العيون الحاملة للورم عادة إلى استئصالها بعد 7-14 يوما من التلقيح. علاوة على ذلك ، B16 هو نموذج شديد التوغل. تدعم الطبيعة المناعية للعين ورم خبيث ، ويمكن عادة اكتشاف النقائل بعد 3-4 أسابيع من تلقيح الخلايا السرطانية. تعرض الثقافات الفرعية لخط B16 الأصلي خصائص نقيلية مميزة6. على سبيل المثال ، يحتوي خط سرطان الجلد في كوينز على معدل نقيلي مرتفع 7,8. يحتوي خط الخلية B16LS9 على مورفولوجيا الخلايا المتغصنة وتم اشتقاقه من نقائل الكبد للفئران C57BL / 6 المحقونة بخط سرطان الجلد الجلدي الأبوي B16F19. عند حقنها في المقصورة الخلفية للعين ، تبين أن هذه الخلايا تشكل أوراما داخل العين ، والتي تشبه نسيجيا سرطان الجلد العنبي البشري وتشكل نقائل خاصة بالكبد في C57BL / 6 ، ولكن ليس Balb / C ، الفئران10،11،12. وراثيا ، تتميز الخلايا بتعبير أعلى عن الجين الورمي الأولي c-met ، والذي يعمل كمستقبل خلوي لعامل نمو خلايا الكبد13. في المقابل ، ينتقل B16F10 ،الممر العاشر من B16 الأبوي ، بشكل أساسي إلى الرئتين عند تلقيحه داخل العين14. كل من B16F10 و B16LS9 مصطبغان12.
تحد العديد من التحديات الرئيسية من نجاح نماذج سرطان الجلد العنبي الفأر. أولا ، قد يؤدي ارتجاع الخلايا السرطانية إلى سرطان الجلد خارج العين أو تحت الملتحمة. ثانيا ، غالبا ما يكون نمو الورم بعد التلقيح داخل العين لخلايا سرطان الجلد متغيرا للغاية ، مما يشكل صعوبات في تقييم العلاج والتقدم. صعوبة رئيسية أخرى هي القدرة المحدودة على متابعة نمو الورم في الجسم الحي. في حين أن التصوير الحيوي ، مثل الأورام التي تعبر عن لوسيفيراز ، يستخدم بشكل شائع لمراقبة نمو ورم العين15,16 ، إلا أنه لا يمكنه توفير معلومات عن موقع الورم داخل العين. لذلك ، يتم إجراء تقييم الورم عادة بعد استئصال العين10,17. هذا يحد بشكل كبير من القدرة على توصيف تطور الورم والاستجابة للعلاجات على نطاق واسع. عقبة رئيسية أخرى في دراسة سرطان الجلد العنبي هي صعوبة مراقبة الآفات في الفئران المصطبغة. هناك حاجة إلى نهج جديدة ، للتغلب على هذه الصعوبات ، لتعزيز البحث عن سرطان الجلد العنبي في النماذج الحيوانية.
يوفر التصوير المقطعي للتماسك البصري (OCT) قدرات مميزة للتصوير بعمق في أقسام العين المختلفة بدقة عالية ، وهو أمر لا مثيل له في المنهجيات الأخرى ، بما في ذلك الموجات فوق الصوتية18,19. تم استخدام التصوير المقطعي المحوسب في النماذج الحيوانية لدراسة أمراض العين المختلفة20. في الآونة الأخيرة ، تم عرض التصوير المقطعي المحوسب كوسيلة غير جراحية لتقييم نمو الورم داخل العين21. يصور البروتوكول الموصوف هنا زرع خلايا سرطان الجلد في مشيمية الفئران واستخدام OCT للتنبؤ بتوطين الورم داخل العين وحجمه في وقت تلقيح الخلايا.
Protocol
تمت الموافقة على التجارب في البروتوكول من قبل المجلس الوطني الإسرائيلي للتجارب على الحيوانات والامتثال لبيان ARVO لاستخدام الحيوانات في أبحاث العيون والرؤية. تم استخدام إناث الفئران C57BL / 6 ، الذين تتراوح أعمارهم بين 8-10 أسابيع ، في الدراسة الحالية وتعرضوا لدورات الضوء والظلام لمدة 12/12 ساعة. تم الحصول على الحيوانات من مصدر تجاري (انظر جدول المواد).
1. ثقافة الخلية
- زراعة خلايا B16LS9 في وسط RPMI 1640 ، مكملة بمصل بقري جنيني 10٪ ، 2 mM L-glutamine ، 1 mM بيروفات الصوديوم ، 25 mM HEPES ، 1٪ خليط فيتامين أساسي ، 200 وحدة / مل بنسلين ، و 200 مجم / مل ستربتومايسين (انظر جدول المواد) ، في حاضنة مرطبة 37 درجة مئوية مع 5٪ CO2.
- حصاد الخلايا للحقن عند التقاء 70٪ -80٪.
2. إعداد الحيوان
- تحضير خليط مخدر من الكيتامين (75 ملغ/كغ من وزن الجسم) وميديتوميدين (0.5 ملغ/كغ من وزن الجسم). تخدير الفئران عن طريق حقن خليط التخدير داخل الصفاق في حقنة واحدة.
- تطبيق مخدر العيون الموضعي أوكسيبوبروكائين (0.4٪) على كلتا العينين.
- تمدد تلاميذ الفأر عن طريق تطبيق تروبيكاميد موضعيا (0.5٪).
3. إنشاء محيط الملتحمة والمسالك الصلبة في الفضاء تحت المشيمية
- ضع 1.4٪ هيدروكسي إيثيل سلولوز (انظر جدول المواد) كمواد تشحيم لكلتا العينين لتجنب الجفاف. ضع 0.5٪ تروبيكاميد على العين اليمنى.
- راقب العين التي تعمل بالماوس تحت مجهر التشغيل (انظر جدول المواد). امسك الجفون مفتوحة بملقط معقم داخل العين.
- باستخدام ملقط داخل العين ، أمسك الملتحمة الطرفية فوق الصدغية واسحب نحو وضع تحت الأنف22. قم بتأمين هذا الموضع عن طريق الاحتفاظ به طوال الإجراء بأكمله (الشكل 1 أ).
- باستخدام طرف إبرة 30 جم ، قم بعمل محيط ملتحمة صغير (1-2 مم) في المنطقة الظهرية الصدغية ، حوالي 1-2 مم خلف الطرف.
ملاحظة: يمكن أن يؤدي استخدام إبر أدق إلى منع الثقب المفرط والسماح بدقة أفضل لموقع الورم. - إزالة كبسولة تينون الزائدة من فتحة الصفاق.
ملاحظة: كبسولة تينون هي طبقة من النسيج الضام الكثيف الذي يحيط بكرة العين22. - في هذا الموقع ، أدخل طرف الإبرة لاختراق الصلبة. قم بإجراء استئصال لإنشاء مسار في الفضاء المشيمي الفرعي حتى يظهر اللون البني للمشيمية من خلال المادة البيضاء المكشوفة للصلبة (الشكل 1 ب).
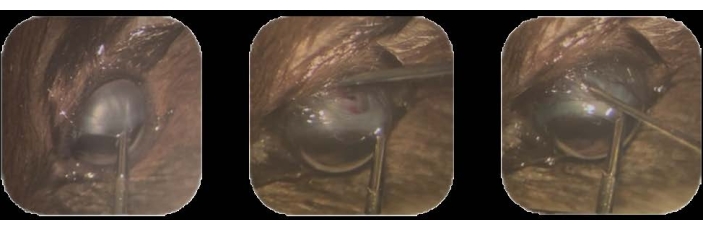
الشكل 1: تلقيح الخلايا السرطانية . (أ) تمسك الملتحمة الحفية فوق الصدغية باستخدام ملقط داخل العين وتسحب نحو موضع تحت الأنف. (ب) يدخل طرف إبرة مقدارها 30 G لاختراق الصلبة، ويتم الاستئصال لإنشاء مسار في الفضاء تحت المشيمية. (ج) تدخل حقنة محملة بخلايا ومثبتة بإبرة 32 G في المسار، وتحقن الخلايا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تلقيح خلايا سرطان الجلد
- أعد تعليق 70000 خلية B16LS9 في 2 ميكرولتر من PBS. ويقدر هذا المبلغ لكل عين.
- قم بتحميل الخلايا في حقنة هاملتون زجاجية معقمة سعة 10 ميكرولتر (انظر جدول المواد) مثبتة بإبرة حادة 32 جم ملتوية بزاوية 45 درجة.
- أدخل إبرة المحقنة المحملة حوالي 2 مم في المسار الذي تم إنشاؤه في الخطوة 3.
- حقن 2 ميكرولتر من تعليق الخلية.
- ثبت الإبرة في مكانها بعد الحقن لمدة 2-3 ثوان حتى يتم التخلص من كل السوائل.
- قم بإزالة الإبرة عن طريق سحبها برفق وببطء لتجنب التسرب من المسار (الشكل 1C).
ملاحظات: يمكن أن يؤثر ضبط سرعة وقوة الحقن على نمط تطور الورم. يقترح أن تتم معايرة هذه المعلمات من قبل الأفراد الذين يجربون لتحديد القوة والسرعة المناسبتين المطبقتين. تم تحديد ما مجموعه 70000 خلية في التجارب الأولية. ومع ذلك ، نظرا لأنه قد تكون هناك اختلافات في أنواع أو دفعات زراعة الخلايا أو بين سلالات الفئران ، فإن معايرة هذا الرقم ضرورية.
5. تقييم موقع الحقن
- راقب العين المحقونة بواسطة فحوصات OCT مباشرة بعد تلقيح خلايا سرطان الجلد لتحديد مظهر انفصال الشبكية (RD) وتلف الشبكية و / أو الخلايا في الجسم الزجاجي23.
ملاحظات: أعد تطبيق تروبيكاميد وأوكسيبوبروكائين وإيثيل سلولوز حسب الضرورة. - استنادا إلى عمليات مسح OCT من الخطوة 5.1 ، صنف أنماط RD21 وفقا لما يلي: (1) موقع RD-one المحلي ل RD ؛ (2) تسرب إلى مادة خلية مراقبة الجسم الزجاجي في الجسم الزجاجي ؛ (3) مواقع RD متعددة ممتدة من RD.
- توقع توطين الورم بناء على: (1) أورام المشيمية المحلية المتوقعة من RD ؛ (2) تسرب في الأورام الزجاجية المتوقعة في الجسم الزجاجي. (3) الأورام المتغيرة والمشتتة الممتدة المتوقعة من RD (الشكل 2).
ملاحظة: من المتوقع فقط أن تصاب الفئران المصابة ب RD المحلي (حوالي 50٪) بأورام تقتصر على المشيمية.
6. التنبؤ بحجم الورم على أساس ارتفاع RD
- قم بقياس ارتفاع RD المحلي في عمليات مسح OCT باستخدام برنامج تجزئة / تحليل OCT (انظر جدول المواد) وتصنيفها وفقا للمجموعات التالية: صغير = <300 ميكرومتر ؛ متوسط = 300-400 ميكرومتر ؛ كبير = >400 ميكرومتر.
- تقييم الحجم المتوقع أن تصل إليه الأورام في غضون 5 أيام من الحقن وفقا للمعايير التالية:
عادة ما يلاحظ ارتفاع RD صغير في الأورام صغيرة الحجم (يتراوح حجم الورم من 0.0059 مم3 إلى 0.07 مم 3 بمتوسط حجم 0.027 ± 0.005 مم3).
تم العثور على ارتفاع RD متوسط في كل من الأورام الصغيرة والمتوسطة الحجم (يتراوح حجم الورم من 0.015 مم3 إلى 0.15 مم 3 بمتوسط حجم 0.056 ± 0.016 مم3).
يرتبط ارتفاع RD الكبير بمجموعة واسعة من أحجام الورم تصل إلى 0.36 مم3.
ملاحظة: تم الحصول على نطاق أحجام الورم المتوقعة من النتائج السابقة وتقسيمها إلى ثلاث مجموعات من الأورام الصغيرة والمتوسطة والكبيرة.
7. إجراءات ما بعد الجراحة
- تطبيق العيون أوفلوكساسين 0.3 ٪ موضعيا.
- عكس التخدير عن طريق حقن أتيباميزول هيدروكلوريد (3 ملغ / كغ) تحت الجلد.
- حقن البوبرينورفين تحت الجلد (0.05 ملغم / كغم من وزن الجسم) مرتين في اليوم لمدة 3 أيام للحد من آلام ومعاناة الحيوانات.
- في 5 أيام بعد حقن خلايا سرطان الجلد ، قم بتقييم حجم الورم باتباع الخطوات أدناه.
- تخدير الفئران كما هو موضح في الخطوة 2.1. تطبيق تروبيكاميد (0.5 ٪).
- افحص العينين عن طريق فحوصات OCT الطولية والسهمية واستخدم برنامج تجزئة / تحليل OCT لقياس حجم الورم وتوطينه.
- احسب حجم الورم باستخدام الصيغة24: V = a * b * c * 6/π (a و b و c = الطول والعرض والارتفاع على التوالي).
- افحص حجم الورم كل 2-3 أيام كما هو موضح في الخطوات 7.4.1-7.4.3.
ملاحظة: يجب تحسين الإجراء في حالة استخدام سلالات ماوس أو خطوط خلايا مختلفة.
النتائج
تم فحص العيون عبر OCT مباشرة بعد حقن خلايا B16LS9. لوحظ انفصال الشبكية المحلي بعد الحقن. أظهرت الفئران ثلاثة أنماط من RD: البؤري (الشكل 2 ، اللوحة العلوية) ، والتسرب إلى الجسم الزجاجي (الشكل 2 ، اللوحة الوسطى) ، و RD الممتد (الشكل 2 ، اللوحة السفلية).
Discussion
سرطان الجلد العنبي هو مرض مدمر هناك حاجة ماسة إلى أساليب علاجية جديدة له. ومع ذلك ، فإن البحث عن سرطان الجلد العنبي والعلاجات المحتملة محدود بسبب التحديات التقنية للنماذج الحيوانية للورم الميلانيني العنبي1،25. أورام العين ، التي يسببها الحقن داخل العين للخل...
Disclosures
ماركوفيتش إيه إل: ستيبا بيوتيك (P) ، Yeda Weizmann (P) ، EyeYon Medical (C ، P) ، Mor Isum (P). (ج) = استشاري؛ (ع) = براءة الاختراع. جميع المؤلفين الآخرين ليس لديهم مصالح متنافسة.
Acknowledgements
تم دعم هذه الدراسة جزئيا من خلال المنحة 1304/20 من مؤسسة العلوم الإسرائيلية (ISF) ، إسرائيل ، لآري ماركوفيتش. نشكر شاهار إيشالوم وآدي يوسيبوفيتش ، من قسم علم الأمراض ، مركز كابلان الطبي ، رحوفوت ، إسرائيل ، على تحليل الأنسجة.
Materials
| Name | Company | Catalog Number | Comments |
| 10 μL glass syringe (Hamilton Co., Bonaduz, Switzerland) | Hamilton | 721711 | |
| 30 G needles | BD Microbalance | 2025-01 | |
| Atipamezole hydrochloride | Orion Phrma | ||
| B16LS9 cells | from Hans Grossniklaus USA | ||
| Buprenorphine | richter pharma | 102047 | |
| C57BL/6 female mice | Envigo | ||
| Essential vitamin mixture | satorius | 01-025-1A | |
| Fetal bovine serum | rhenium | 10270106 | |
| HEPES | satorius | 03-025-1B | |
| Hydroxyethylcellulose 1.4% eye drops | Fisher Pharmaceutical | 390862 | |
| InSight OCT segmentation software | Phoenix Micron, Inc | ||
| Ketamine | bremer pharma GMBH (medimarket) | 17889 | |
| L-glutamine | satorius | 03-020-1B | |
| Medetomidine | zoetis (vetmarket) | 102532 | |
| Ofloxacin 0.3% eye drops | allergan | E92170 | |
| Optical coherence tomography | Phoenix Micron, Inc | ||
| Oxybuprocaine 0.4% | Fisher Pharmaceutical | 393050 | |
| Penicillin-streptomycin-amphoteracin | satorius | 03-033-1B | |
| Phosphate buffered saline (PBS) | satorius | 02-023-1a | |
| RPMI cell media | satorius | 01-104-1A | |
| Sodium pyruvate | satorius | 03-042-1B | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Tropicamide 0.5% | Fisher Pharmaceutical | 390723 |
References
- Jager, M. J., et al. Uveal melanoma. Nature Reviews Disease Primers. 6 (1), 1-25 (2020).
- Bustamante, P., Piquet, L., Landreville, S., Burnier, J. V. Uveal melanoma pathobiology: Metastasis to the liver. Seminars in Cancer Biology. 71, 65-85 (2021).
- Damato, B. Ocular treatment of choroidal melanoma in relation to the prevention of metastatic death-A personal view. Progress in Retinal and Eye Research. 66, 187-199 (2018).
- Jouhi, S., et al. The small fatal choroidal melanoma study. A survey by the European Ophthalmic Oncology Group. American Journal of Ophthalmology. 202, 100-108 (2019).
- Cao, J., Jager, M. J. Animal eye models for uveal melanoma. Ocular Oncology and Pathology. 1 (3), 141-150 (2015).
- Uner, O. E., Gandrakota, N., Azarcon, C. P., Grossniklaus, H. E. Animal models of uveal melanoma. Annals of Eye Science. 7, 21-30 (2022).
- Yang, H., Dithmar, S., Grossniklaus, H. E. Interferon alpha 2b decreases hepatic micrometastasis in a murine model of ocular melanoma by activation of intrinsic hepatic natural killer cells. Investigative Ophthalmology & Visual Science. 45 (7), 2056-2064 (2004).
- Yang, H., Grossniklaus, H. E. Combined immunologic and anti-angiogenic therapy reduces hepatic micrometastases in a murine ocular melanoma model. Current Eye Research. 31 (6), 557-562 (2006).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Diaz, C. E., Rusciano, D., Dithmar, S., Grossniklaus, H. E. B16LS9 melanoma cells spread to the liver from the murine ocular posterior compartment (PC). Current Eye Research. 18 (2), 125-129 (1999).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Ashur-Fabian, O., et al. Tetrac delayed the onset of ocular melanoma in an orthotopic mouse model. Frontiers in Endocrinology. 12, 632335 (2019).
- Elia, G., et al. Mechanisms regulating c-met overexpression in liver-metastatic B16-LS9 melanoma cells. Journal of Cellular Biochemistry. 81 (3), 477-487 (2001).
- Harning, R., Szalay, Z. Ocular metastasis of in vivo and in vitro derived syngeneic murine melanoma. Investigative Ophthalmology & Visual Science. 28 (9), 1599-1604 (1987).
- Ezra-Elia, R., et al. Can an in vivo imaging system be used to determine localization and biodistribution of AAV5-mediated gene expression following subretinal and intravitreal delivery in mice. Experimental Eye Research. 176, 227-234 (2018).
- Notting, I. C., et al. Whole-body bioluminescent imaging of human uveal melanoma in a new mouse model of local tumor growth and metastasis. Investigative Ophthalmology & Visual Science. 46 (5), 1581-1587 (2005).
- Yang, H., et al. In-vivo xenograft murine human uveal melanoma model develops hepatic micrometastases. Melanoma Research. 18 (2), 95-103 (2008).
- Murthy, R. K., Haji, S., Sambhav, K., Grover, S., Chalam, K. V. Clinical applications of spectral domain optical coherence tomography in retinal diseases. Biomedical Journal. 39 (2), 107-120 (2016).
- Drexler, W., et al. Ultrahigh-resolution ophthalmic optical coherence tomography. Nature Medicine. 7 (4), 502-507 (2001).
- Ochakovski, G. A., Fischer, M. D. Phenotyping of mouse models with OCT. Methods in Molecular Biology. 1834, 285-291 (2019).
- Zaks, O., et al. In-vivo imaging for assessing tumor growth in mouse models of ocular melanoma. Experimental Eye Research. 204, 108431 (2021).
- Brar, V. S. American Academy of Ophthalmology 2022-2023 BCSC. 2. Fundamentals and principles of ophthalmology. , (2022).
- Duker, J. S., Waheed, N. K., Goldman, D. . Handbook of Retinal OCT: Optical Coherence Tomography, 2nd Edition. , (2021).
- Tomayko, M. M., Reynolds, C. P. Determination of subcutaneous tumor size in athymic (nude) mice. Cancer Chemotherapy and Pharmacology. 24 (3), 148-154 (1989).
- Richards, J. R., Yoo, J. H., Shin, D., Odelberg, S. J. Mouse models of uveal melanoma: Strengths, weaknesses, and future directions. Pigment Cell & Melanoma Research. 33 (2), 264 (2020).
- Chen, R., et al. Photoacoustic molecular imaging-escorted adipose photodynamic-browning synergy for fighting obesity with virus-like complexes. Nature Nanotechnology. 16 (4), 455-465 (2021).
- Yu, Q., et al. Label-free visualization of early cancer hepatic micrometastasis and intraoperative image-guided surgery by photoacoustic imaging. Journal of Nuclear Medicine. 61 (7), 1079-1085 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved