このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
光干渉断層撮影 による マウス脈絡膜への黒色腫の移植と評価
* これらの著者は同等に貢献しました
要約
本プロトコールは、光干渉断層撮影を利用したマウス脈絡膜における黒色腫の移植および評価を記載する。
要約
実験的脈絡膜黒色腫モデルを確立することは、正しい局在で腫瘍を誘導する能力の観点から困難である。さらに、 生体内で 後脈絡膜黒色腫を観察することが困難であるため、腫瘍の位置と成長評価がリアルタイムで制限されます。ここで説明するアプローチは、多段階脈絡膜下B16LS9細胞注入手順 を介して マウスに脈絡膜黒色腫を確立するための技術を最適化します。マウスのuveaの小さな寸法に正確に注入できるようにするために、完全な手順は顕微鏡下で実行されます。第一に、結膜腹膜切開術が眼の背側頭領域に形成される。次に、露出した強膜に針を挿入することにより、脈絡膜下腔への管が作成されます。これに続いて、鈍い針を管に挿入し、黒色腫細胞を脈絡膜に注入します。注射直後に、非侵襲的光干渉断層撮影(OCT)イメージングを利用して、腫瘍の位置と進行を決定します。網膜剥離は、腫瘍部位およびサイズの予測因子として評価される。提示された方法は、マウスにおける脈絡膜局在性黒色腫の再現性のある誘導および腫瘍増殖評価のライブイメージングを可能にする。このように、それは眼内腫瘍を研究するための貴重なツールを提供します。
概要
ブドウ膜黒色腫(UM)は、成人で最も頻度の高い眼内原発性悪性腫瘍です。眼の黒色腫の約90%は、ブドウ膜路の脈絡膜領域のメラノサイトに起因します1。UMは、患者の50%近くが転移性疾患を発症し、肝臓が転移の主要な部位であると推定されているため、罹患率と死亡率の主な原因です2。原発巣の早期治療は転移の可能性を減らす可能性がありますが、転移の形成を防ぐ効果的な治療法はありません3。
ブドウ膜黒色腫の標準治療には、視神経障害、網膜症、ドライアイ症候群、白内障による視力喪失を伴う照射療法が含まれます。外科的切除は通常、病変の成長が認識され特徴付けられるまで延期されます。しかし、そのような遅延は転移性疾患の発症を可能にする可能性がある4。場合によっては、無駄な除核が必要です。もちろん、この根本的な手順は視力を損ない、劇的な美的劣化をもたらします。
ブドウ膜黒色腫を研究するための実験モデルの開発に捧げられた多くの努力がありました。この悪性腫瘍の正確な評価を可能にする前臨床動物モデルは、ブドウ膜黒色腫の新しい診断および治療戦略を研究するための鍵となります。眼黒色腫の実験動物モデルは、主にマウス、ラット、およびウサギにおける腫瘍細胞の接種に基づいている5,6。マウスモデルは費用対効果が高く、繁殖速度が速く、ヒトとのゲノム類似性が高いため、黒色腫の研究に広く使用されています。マウス皮膚黒色腫細胞株B16は、C57BL6マウスに接種し、同系腫瘍を誘導するために一般的に利用されています。このモデルを使用してブドウ膜黒色腫を誘発する場合、腫瘍を持った眼は通常、接種後7〜14日で除核する必要があります。さらに、B16は非常に侵襲的なモデルです。眼の免疫特権の性質は転移をサポートし、転移は通常、腫瘍細胞接種後3〜4週間で検出される可能性があります。元のB16系統の継代培養は、明確な転移特性を示します6。例えば、クイーンズ黒色腫ラインは高い転移率7,8を有する。B16LS9細胞株は樹状細胞形態を有し、親皮膚黒色腫株B16F19を注射したC57BL/6マウスの肝転移に由来する。眼の後部コンパートメントに注射すると、これらの細胞は眼内腫瘍を形成し、組織学的にはヒトブドウ膜黒色腫に似ており、C57BL / 6では肝臓特異的転移を形成しますが、Balb / Cでは形成されません、マウス10、11、12。遺伝的には、細胞は、肝細胞増殖因子13の細胞受容体として作用するc-met癌原遺伝子のより高い発現によって特徴付けられる。対照的に、親B16の10回目の継代であるB16F10は、眼内接種すると主に肺に転移する14。B16F10とB16LS9の両方が12に着色されています。
いくつかの重要な課題が、マウスブドウ膜黒色腫モデルの成功を制限しています。第一に、腫瘍細胞の逆流は、眼外または結膜下黒色腫を引き起こし得る。第二に、メラノーマ細胞の眼内接種後の腫瘍増殖はしばしば非常に多様であり、治療と進行の評価が困難である。別の大きな困難は、in vivoで腫瘍の成長を追跡する能力が限られていることです。ルシフェラーゼ発現腫瘍などの生物発光イメージングは、眼腫瘍の成長を監視するために一般的に使用されていますが15,16、腫瘍の眼内位置に関する情報を提供することはできません。したがって、腫瘍の評価は、典型的には、眼10、17の除核に続いて行われる。これは、腫瘍の進行と治療への反応を広範囲に特徴付ける能力を大幅に制限します。ブドウ膜黒色腫を研究する際のもう一つの大きなハードルは、色素性マウスの病変を監視することの難しさです。これらの困難を克服する新しいアプローチは、動物モデルにおけるブドウ膜黒色腫の研究を促進するために求められています。
光干渉断層撮影(OCT)は、超音波を含む他の方法論では比類のない高解像度で目のさまざまなセクションの奥深くを画像化する独自の機能を提供します18,19。OCTイメージングは、様々な眼疾患を研究するために動物モデルで使用されています20。最近、OCTイメージングは、眼内腫瘍の成長を評価するための非侵襲的手段として実証された21。ここで説明するプロトコルは、マウス脈絡膜への黒色腫細胞の移植と、細胞接種時の眼内腫瘍の局在とサイズを予測するためのOCTの利用を示しています。
プロトコル
プロトコルの実験は、イスラエルの動物実験評議会によって承認され、眼科および視覚研究における動物の使用に関するARVOステートメントに準拠しています。本研究には、8〜10週齢の雌C57BL / 6マウスを使用し、12/12時間の明暗サイクルに曝露しました。動物は商業的な供給源から入手した( 材料表を参照)。
1. 細胞培養
- B16LS9細胞をRPMI 1640培地で培養し、10%ウシ胎児血清、2 mM L-グルタミン、1 mMピルビン酸ナトリウム、25 mM HEPES、1%必須ビタミン混合物、200 U/mLペニシリン、および200 mg/mLストレプトマイシン( 材料の表を参照)を添加し、5%CO2を含む加湿37°Cインキュベーターで培養します。
- 注射用の細胞を70%〜80%のコンフルエントで回収する。
2.動物の準備
- ケタミン(75 mg / kg体重)とメデトミジン(0.5 mg / kg体重)の麻酔薬混合物を調製します。.単回注射で麻酔薬混合物を腹腔内に注射することによりマウスを麻酔する。
- 局所眼科麻酔薬オキシブプロカイン(0.4%)を両眼に塗布する。
- トロピカミド(0.5%)を局所的に塗布することにより、マウスの瞳孔を拡張します。.
3. 結膜腹膜と強膜路を脈絡膜下腔に作成する
- 乾燥を避けるために、潤滑剤として1.4%ヒドロキシエチルセルロース( 材料の表を参照)を両眼に塗布します。右目に0.5%トロピカミドを塗ります。
- マウスの操作された目を手術顕微鏡で観察します( 材料の表を参照)。滅菌眼内鉗子でまぶたを開いたままにします。
- 眼内鉗子を使用して、上側頭辺縁結膜を保持し、鼻下位置に向かって引っ張ります22。手順全体を通してこの位置を保持して固定します(図1A)。
- 30 Gの針先を使用して、辺縁の後方約1〜2 mmの背側頭領域に小さな(1〜2 mm)結膜腹膜を作成します。
注:より細い針を使用すると、過度の穿刺を防ぎ、腫瘍の位置をより正確にすることができます。 - 腹膜の開口部から余分なテノンのカプセルを取り除きます。
注:テノンのカプセルは、目の地球22を囲む密な結合組織の層です。 - この場所に、強膜を貫通するように針先を挿入します。脈絡膜の茶色が強膜の露出した白質を通して現れるまで、脈絡膜下腔に管を作るために切除を行います(図1B)。
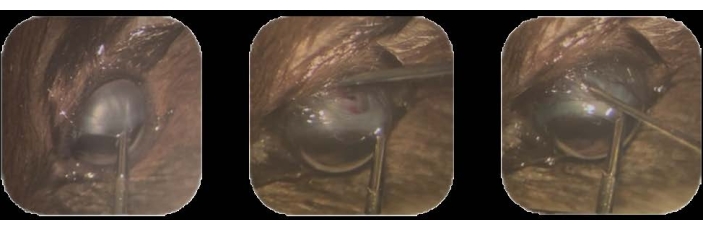
図1:腫瘍細胞接種 。 (A)上側頭辺縁結膜は、眼内鉗子を使用して保持され、鼻下位置に向かって引っ張られます。(B)30Gの針の先端を挿入して強膜を貫通し、脈絡膜下腔への軌跡を作るために切除を行う。(C)細胞を装填し、32Gの針を装着した注射器をトラックに挿入し、細胞を注入する。 この図の拡大版を表示するには、ここをクリックしてください。
4.メラノーマ細胞の接種
- 70,000個のB16LS9細胞を2 μLのPBSに再懸濁します。この量は目ごとに推定されます。
- 細胞を滅菌済みの10 μLガラス製ハミルトンシリンジ( 材料表を参照)にロードし、32 Gの鈍い針を45°の角度でねじります。
- 装填したシリンジ針を、手順3で作成したトラックに約2mm挿入します。
- 2 μLの細胞懸濁液を注入します。
- 注射後、すべての液体がなくなるまで2〜3秒間針を所定の位置に保持します。
- トラックからの漏れを防ぐために、針をゆっくりとゆっくりと引き出して取り外します(図1C)。
注:注射の速度と力を調整すると、腫瘍の発生パターンに影響を与える可能性があります。これらのパラメータは、適用される適切な力と速度を特定するために実験している個人によって較正されることが示唆されています。合計70,000個の細胞を予備実験で決定した。ただし、細胞培養の種類やバッチ、またはマウスの系統間でばらつきがある可能性があるため、この数のキャリブレーションが必要です。
5.注射の位置を評価する
- メラノーマ細胞接種直後にOCTスキャンで注射された眼を観察し、網膜剥離(RD)、網膜損傷、および/または硝子体の細胞の出現を特定します23。
注意: 必要に応じて、トロピカミド、オキシブプロカイン、エチルセルロースを再塗布します。. - 手順 5.1 の OCT スキャンに基づいて、RD パターン21 を次のように分類します。(2)硝子体内の硝子体観察用細胞材料への漏出;(3) RD の拡張 RD - 複数のサイト。
- に基づいて腫瘍局在を予測する:(1)局所RD予想脈絡膜腫瘍;(2)硝子体内の硝子体予想腫瘍への漏出;(3)拡張RD予想変数および分散腫瘍(図2)。
注:局所RD(約50%)を有するマウスのみが、脈絡膜に限定された腫瘍を発症すると予想されます。
6.RDの高さに基づく腫瘍サイズの予測
- OCTセグメンテーション/分析ソフトウェア( 材料表を参照)を使用してOCTスキャンのローカルRDの高さを測定し、次のグループに従って分類します:小さい= <300 μm;ミディアム= 300-400μm;大きい= >400μm。
- 以下の基準に従って、注射から5日以内に腫瘍が到達すると予想される量を評価します。
小さなRD高さは、通常、小さなサイズの腫瘍(腫瘍体積が0.0059 mm 3から0.07 mm 3の範囲で、平均体積が0.027 ± 0.005 mm3)で観察されます。
中程度のRD高さは、中小規模の腫瘍の両方に見られます(腫瘍体積は0.015 mm 3から0.15 mm 3の範囲で、平均体積は0.056±0.016 mm3)。
大きなRD高さは、最大0.36 mm3の広範囲の腫瘍体積と関連しています。
注:予想される腫瘍サイズの範囲は、以前の結果から得られ、小、中、大の腫瘍の3つのグループに分けられました。
7.術後処置
- 眼科用オフロキサシン0.3%を局所的に塗布する。
- 塩酸アチパメゾール(3 mg / kg)を皮下注射して麻酔を逆転させます。.
- 動物の痛みや苦しみを軽減するために、ブプレノルフィン(0.05 mg / kg体重)を1日2回3日間皮下注射します。.
- メラノーマ細胞注入後5日目に、以下の手順に従って腫瘍サイズを評価します。
- ステップ2.1に記載されているようにマウスを麻酔します。トロピカミド(0.5%)を塗布します。
- 縦方向および矢状OCTスキャンで眼を検査し、OCTセグメンテーション/分析ソフトウェアを使用して腫瘍の体積と局在を測定します。
- 式24を使用して腫瘍体積を計算します:V = a * b * c * 6 / π(a、b、およびc =それぞれ長さ、幅、および高さ)。
- 手順7.4.1〜7.4.3で説明されているように、2〜3日ごとに腫瘍のサイズを調べます。
注:異なるマウス系統または細胞株を使用する場合は、手順を最適化する必要があります。
結果
B16LS9細胞を注射した直後にOCTを介して眼を検査した。注射後に局所網膜剥離が観察された。マウスは、焦点(図2、上のパネル)、硝子体への漏出(図2、中央のパネル)、および拡張RD(図2、下のパネル)の3つのRDパターンを示しました。拡張RDは、注射による損傷によって引き起こされる可能性があります。注射直後のRDのパ?...
ディスカッション
ブドウ膜黒色腫は壊滅的な病気であり、新しい治療アプローチが非常に必要とされています。しかし、ブドウ膜黒色腫と潜在的な治療法に関する研究は、ブドウ膜黒色腫動物モデルの技術的課題によって制限されています1,25。がん細胞の眼内注射によって誘発される眼腫瘍は、おそらくマウスの目の寸法が小さいため、局在とサイズの両方で非常?...
開示事項
マルコビッチA.L.:ステババイオテック(P)、イェダワイツマン(P)、アイヨンメディカル(C、P)、モルイスム(P)。(C) = コンサルタント;(P) = 特許。他のすべての著者には競合する利害関係はありません。
謝辞
この研究は、イスラエルのイスラエル科学財団(ISF)からのアリー・マルコビッチのための助成金1304/20によって部分的に支援されました。組織学分析のために、イスラエルのレホヴォトにあるカプラン医療センター病理学部のShahar Ish-ShalomとAdy Yosipovichに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 10 μL glass syringe (Hamilton Co., Bonaduz, Switzerland) | Hamilton | 721711 | |
| 30 G needles | BD Microbalance | 2025-01 | |
| Atipamezole hydrochloride | Orion Phrma | ||
| B16LS9 cells | from Hans Grossniklaus USA | ||
| Buprenorphine | richter pharma | 102047 | |
| C57BL/6 female mice | Envigo | ||
| Essential vitamin mixture | satorius | 01-025-1A | |
| Fetal bovine serum | rhenium | 10270106 | |
| HEPES | satorius | 03-025-1B | |
| Hydroxyethylcellulose 1.4% eye drops | Fisher Pharmaceutical | 390862 | |
| InSight OCT segmentation software | Phoenix Micron, Inc | ||
| Ketamine | bremer pharma GMBH (medimarket) | 17889 | |
| L-glutamine | satorius | 03-020-1B | |
| Medetomidine | zoetis (vetmarket) | 102532 | |
| Ofloxacin 0.3% eye drops | allergan | E92170 | |
| Optical coherence tomography | Phoenix Micron, Inc | ||
| Oxybuprocaine 0.4% | Fisher Pharmaceutical | 393050 | |
| Penicillin-streptomycin-amphoteracin | satorius | 03-033-1B | |
| Phosphate buffered saline (PBS) | satorius | 02-023-1a | |
| RPMI cell media | satorius | 01-104-1A | |
| Sodium pyruvate | satorius | 03-042-1B | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Tropicamide 0.5% | Fisher Pharmaceutical | 390723 |
参考文献
- Jager, M. J., et al. Uveal melanoma. Nature Reviews Disease Primers. 6 (1), 1-25 (2020).
- Bustamante, P., Piquet, L., Landreville, S., Burnier, J. V. Uveal melanoma pathobiology: Metastasis to the liver. Seminars in Cancer Biology. 71, 65-85 (2021).
- Damato, B. Ocular treatment of choroidal melanoma in relation to the prevention of metastatic death-A personal view. Progress in Retinal and Eye Research. 66, 187-199 (2018).
- Jouhi, S., et al. The small fatal choroidal melanoma study. A survey by the European Ophthalmic Oncology Group. American Journal of Ophthalmology. 202, 100-108 (2019).
- Cao, J., Jager, M. J. Animal eye models for uveal melanoma. Ocular Oncology and Pathology. 1 (3), 141-150 (2015).
- Uner, O. E., Gandrakota, N., Azarcon, C. P., Grossniklaus, H. E. Animal models of uveal melanoma. Annals of Eye Science. 7, 21-30 (2022).
- Yang, H., Dithmar, S., Grossniklaus, H. E. Interferon alpha 2b decreases hepatic micrometastasis in a murine model of ocular melanoma by activation of intrinsic hepatic natural killer cells. Investigative Ophthalmology & Visual Science. 45 (7), 2056-2064 (2004).
- Yang, H., Grossniklaus, H. E. Combined immunologic and anti-angiogenic therapy reduces hepatic micrometastases in a murine ocular melanoma model. Current Eye Research. 31 (6), 557-562 (2006).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Diaz, C. E., Rusciano, D., Dithmar, S., Grossniklaus, H. E. B16LS9 melanoma cells spread to the liver from the murine ocular posterior compartment (PC). Current Eye Research. 18 (2), 125-129 (1999).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Ashur-Fabian, O., et al. Tetrac delayed the onset of ocular melanoma in an orthotopic mouse model. Frontiers in Endocrinology. 12, 632335 (2019).
- Elia, G., et al. Mechanisms regulating c-met overexpression in liver-metastatic B16-LS9 melanoma cells. Journal of Cellular Biochemistry. 81 (3), 477-487 (2001).
- Harning, R., Szalay, Z. Ocular metastasis of in vivo and in vitro derived syngeneic murine melanoma. Investigative Ophthalmology & Visual Science. 28 (9), 1599-1604 (1987).
- Ezra-Elia, R., et al. Can an in vivo imaging system be used to determine localization and biodistribution of AAV5-mediated gene expression following subretinal and intravitreal delivery in mice. Experimental Eye Research. 176, 227-234 (2018).
- Notting, I. C., et al. Whole-body bioluminescent imaging of human uveal melanoma in a new mouse model of local tumor growth and metastasis. Investigative Ophthalmology & Visual Science. 46 (5), 1581-1587 (2005).
- Yang, H., et al. In-vivo xenograft murine human uveal melanoma model develops hepatic micrometastases. Melanoma Research. 18 (2), 95-103 (2008).
- Murthy, R. K., Haji, S., Sambhav, K., Grover, S., Chalam, K. V. Clinical applications of spectral domain optical coherence tomography in retinal diseases. Biomedical Journal. 39 (2), 107-120 (2016).
- Drexler, W., et al. Ultrahigh-resolution ophthalmic optical coherence tomography. Nature Medicine. 7 (4), 502-507 (2001).
- Ochakovski, G. A., Fischer, M. D. Phenotyping of mouse models with OCT. Methods in Molecular Biology. 1834, 285-291 (2019).
- Zaks, O., et al. In-vivo imaging for assessing tumor growth in mouse models of ocular melanoma. Experimental Eye Research. 204, 108431 (2021).
- Brar, V. S. American Academy of Ophthalmology 2022-2023 BCSC. 2. Fundamentals and principles of ophthalmology. , (2022).
- Duker, J. S., Waheed, N. K., Goldman, D. . Handbook of Retinal OCT: Optical Coherence Tomography, 2nd Edition. , (2021).
- Tomayko, M. M., Reynolds, C. P. Determination of subcutaneous tumor size in athymic (nude) mice. Cancer Chemotherapy and Pharmacology. 24 (3), 148-154 (1989).
- Richards, J. R., Yoo, J. H., Shin, D., Odelberg, S. J. Mouse models of uveal melanoma: Strengths, weaknesses, and future directions. Pigment Cell & Melanoma Research. 33 (2), 264 (2020).
- Chen, R., et al. Photoacoustic molecular imaging-escorted adipose photodynamic-browning synergy for fighting obesity with virus-like complexes. Nature Nanotechnology. 16 (4), 455-465 (2021).
- Yu, Q., et al. Label-free visualization of early cancer hepatic micrometastasis and intraoperative image-guided surgery by photoacoustic imaging. Journal of Nuclear Medicine. 61 (7), 1079-1085 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved