需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
通过光学相干断层扫描 在 小鼠脉络膜中植入和评估黑色素瘤
* 这些作者具有相同的贡献
摘要
本协议描述了利用光学相干断层扫描在小鼠脉络膜中植入和评估黑色素瘤。
摘要
建立实验性脉络膜黑色素瘤模型在正确定位诱导肿瘤的能力方面具有挑战性。此外, 在体内 观察后脉络膜黑色素瘤的困难限制了肿瘤的实时定位和生长评估。这里描述的方法优化了通过多步骤亚脉络膜B16LS9细胞注射 程序在 小鼠中建立脉络膜黑色素瘤的技术。为了能够精确地注射到小鼠葡萄膜的小尺寸中,在显微镜下进行完整的程序。首先,在眼睛的背颞区形成结膜围膜。然后,通过将针插入暴露的巩膜来创建进入脉络膜下空间的束。随后将钝针插入尿道并将黑色素瘤细胞注射到脉络膜中。注射后立即利用无创光学相干断层扫描(OCT)成像来确定肿瘤的位置和进展。视网膜脱离被评估为肿瘤部位和大小的预测指标。所提出的方法能够可重复地诱导小鼠脉络膜局部黑色素瘤和肿瘤生长评估的实时成像。因此,它为研究眼内肿瘤提供了有价值的工具。
引言
葡萄膜黑色素瘤 (UM) 是成人中最常见的眼内原发性恶性肿瘤。大约 90% 的眼部黑色素瘤起源于葡萄膜束脉络膜区域的黑色素细胞1。UM是发病和死亡的主要原因,因为据估计,近50%的患者发展为转移性疾病,肝脏是转移的主要部位2。原发性病变的早期治疗可能会减少转移的机会,但没有有效的治疗方法可以防止转移的形成3。
葡萄膜黑色素瘤的标准治疗包括放射治疗,该放射治疗与视神经病变、视网膜病变、干眼综合征和白内障导致的视力丧失有关。手术切除通常延迟到病变的生长被识别和表征。然而,这种延迟可能会使转移性疾病发展4。在某些情况下,需要徒劳的眼球摘除。当然,这种激进的程序会损害视力并导致美学急剧恶化。
已经有许多努力致力于开发研究葡萄膜黑色素瘤的实验模型。能够准确评估这种恶性肿瘤的临床前动物模型是研究葡萄膜黑色素瘤新诊断和治疗策略的关键。眼部黑色素瘤的实验动物模型主要基于小鼠、大鼠和兔5,6中肿瘤细胞的接种。小鼠模型具有成本效益,由于其快速的繁殖速度和与人类的高基因组相似性,广泛用于黑色素瘤研究。小鼠皮肤黑色素瘤细胞系B16通常用于接种C57BL6小鼠并诱导同系肿瘤。当使用该模型诱导葡萄膜黑色素瘤时,荷瘤的眼睛通常需要在接种后7-14天进行眼球摘除。此外,B16是一种高度侵入性的模型。眼睛的免疫特权性质支持转移,转移通常在肿瘤细胞接种后 3-4 周检测到。原始B16系的传代培养物显示出不同的转移特性6。例如,皇后区黑色素瘤系具有高转移率7,8。B16LS9细胞系具有树突状细胞形态,来源于注射亲本皮肤黑色素瘤系B16F19的C57BL / 6小鼠的肝转移。当注射到眼睛的后室时,这些细胞被显示形成眼内肿瘤,其组织学类似于人葡萄膜黑色素瘤,并在C57BL / 6中形成肝脏特异性转移,但不是Balb / C,小鼠10,11,12。在遗传学上,这些细胞的特征在于c-met原癌基因的更高表达,其作为肝细胞生长因子13的细胞受体。相比之下,B16F10是亲本B16的第10代,主要在眼内接种时转移到肺部14。B16F10和B16LS9都是色素12。
几个关键挑战限制了小鼠葡萄膜黑色素瘤模型的成功。首先,肿瘤细胞反流可能导致眼外或结膜下黑色素瘤。其次,黑色素瘤细胞眼内接种后的肿瘤生长通常变化很大,给评估治疗和进展带来了困难。另一个主要困难是跟踪体内肿瘤生长的能力有限。虽然生物发光成像,例如表达荧光素酶的肿瘤,通常用于监测眼部肿瘤的生长15,16,但它不能提供有关肿瘤眼内位置的信息。因此,肿瘤的评估通常在眼球摘除后进行10,17。这极大地限制了表征肿瘤进展和对治疗反应的能力。研究葡萄膜黑色素瘤的另一个主要障碍是难以监测色素小鼠的病变。需要克服这些困难的新方法来促进动物模型中葡萄膜黑色素瘤的研究。
光学相干断层扫描(OCT)提供了独特的功能,可以高分辨率深入眼睛的不同部分成像,这是其他方法(包括超声18,19)无法比拟的。OCT成像已在动物模型中用于研究各种眼部疾病20。最近,OCT成像被证明是评估眼内肿瘤生长的非侵入性手段21。这里描述的方案描述了黑色素瘤细胞在小鼠脉络膜中的植入以及利用OCT来预测细胞接种时的眼内肿瘤定位和大小。
Access restricted. Please log in or start a trial to view this content.
研究方案
协议中的实验已获得以色列国家动物实验委员会的批准,并符合ARVO关于在眼科和视觉研究中使用动物的声明。雌性C57BL / 6小鼠,年龄为8-10周,用于本研究,并暴露于12/12小时明暗循环。这些动物是从商业来源获得的(见 材料表)。
1. 细胞培养
- 在RPMI 1640培养基中培养B16LS9细胞,补充有10%胎牛血清,2mM L-谷氨酰胺,1mM丙酮酸钠,25mM HEPES,1%必需维生素混合物,200U / mL青霉素和200mg / mL链霉素(参见 材料表),在加湿的37°C培养箱中,CO2。
- 以70%-80%汇合度收获注射细胞。
2. 动物制备
- 准备氯胺酮(75毫克/千克体重)和美托咪定(0.5毫克/千克体重)的麻醉剂混合物。通过在单次注射中腹膜内注射麻醉混合物来麻醉小鼠。
- 双眼使用局部眼用麻醉剂奥布普卡因(0.4%)。
- 通过局部施用托吡卡胺(0.5%)扩大小鼠瞳孔。
3. 将 结膜围切开术和巩膜束创建到脉络膜下间隙
- 将1.4%羟乙基纤维素(见 材料表)作为润滑剂涂抹在双眼上,以避免干燥。将0.5%托吡卡胺涂抹在右眼。
- 在手术显微镜下观察鼠标的操作眼睛(见 材料表)。用无菌眼内钳保持眼睑张开。
- 使用眼内钳,握住颞上角膜缘结膜并向鼻下位置拉动22。通过在整个过程中保持该位置来确保该位置(图1A)。
- 使用 30 G 针尖,在背颞区(距角膜缘后方约 1-2 mm)处进行小的 (1-2 mm) 结膜周围切开术。
注意:使用更细的针头可以防止过度穿刺,并允许更精确地定位肿瘤。 - 从腹膜开口处取出多余的榫卯胶囊。
注意:榫头囊是一层密集的结缔组织,环绕着眼球22。 - 在此位置,插入针尖以穿透巩膜。进行切除以在脉络膜下空间形成一条束,直到脉络膜的棕色通过巩膜的暴露白质出现(图1B)。
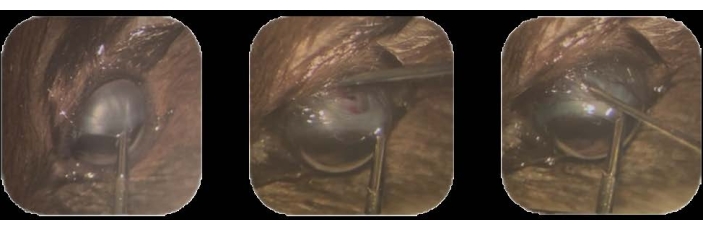
图1:肿瘤细胞接种 。 (A)使用眼内钳固定颞上角结膜并拉向鼻下位置。(B)插入30G针的尖端以穿透巩膜,并进行切除以在脉络膜下空间中形成一条轨迹。(C)将装有细胞并装有32G针头的注射器插入轨道,并注射细胞。 请点击此处查看此图的大图。
4.黑色素瘤细胞接种
- 将 70,000 个 B16LS9 细胞重悬于 2 μL PBS 中。这个数量是每只眼睛估计的。
- 将细胞加载到无菌 10 μL 玻璃汉密尔顿注射器(参见 材料表)中,该注射器装有以 45° 角扭转的 32 G 钝针。
- 将装载的注射器针头插入步骤3中创建的轨道约2毫米。
- 注入 2 μL 细胞悬液。
- 注射后将针头固定到位2-3秒,直到所有液体清除。
- 轻轻缓慢地将其拉出,以避免从轨道泄漏,从而取出针头(图1C)。
注意:调整注射的速度和力量会影响肿瘤发展的模式。建议由个人进行实验来校准这些参数,以确定施加的正确力和速度。在初步实验中总共确定了70,000个细胞。然而,由于细胞培养类型或批次或小鼠品系之间可能存在差异,因此需要校准该数量。
5. 评估注射位置
- 黑色素瘤细胞接种后立即通过OCT扫描观察注射的眼睛,以确定玻璃体23处视网膜脱离(RD),视网膜损伤和/或细胞的外观。
注意:根据需要重新涂抹托吡卡胺、奥布卡因和乙基纤维素。 - 基于步骤5.1中的OCT扫描,根据以下条件对RD模式21 进行分类:(1)RD的本地RD-one位点;(2)渗漏到玻璃体观察细胞材料中;(3)RD的扩展-多个站点。
- 根据以下因素预测肿瘤定位:(1)局部RD预期的脉络膜肿瘤;(2)渗漏到玻璃体预期肿瘤;(3)RD预期变量和分散性肿瘤的扩展(图2)。
注意:只有具有局部RD(约50%)的小鼠预计会出现仅限于脉络膜的肿瘤。
6. 根据RD高度预测肿瘤大小
- 使用OCT分割/分析软件(参见 材料表)测量OCT扫描中局部RD的高度,并根据以下组进行分类:小= <300μm;培养基 = 300-400 μm;大 = >400 μm。
- 根据以下标准评估肿瘤在注射后5天内预计达到的体积:
在小尺寸肿瘤中通常观察到较小的RD高度(肿瘤体积范围为0.0059mm 3至0.07mm 3,平均体积为0.027±0.005mm 3)。
在中小型肿瘤中均发现中等RD高度(肿瘤体积范围为0.015mm 3至0.15mm 3,平均体积为0.056±0.016mm 3)。
较大的RD高度与高达0.36mm的宽肿瘤体积相关3。
注意:预期肿瘤大小的范围是从先前的结果中获得的,分为小,中和大肿瘤三组。
7. 术后程序
- 局部应用0.3%的眼用氧氟沙星。
- 通过皮下注射盐酸阿替美唑(3mg / kg)来逆转麻醉。
- 皮下注射丁丙诺啡(0.05mg / kg体重),每天两次,持续3天,以减轻动物的疼痛和痛苦。
- 在黑色素瘤细胞注射后5天,按照以下步骤评估肿瘤大小。
- 如步骤2.1所述麻醉小鼠。使用托吡卡胺(0.5%)。
- 通过纵向和矢状 OCT 扫描检查眼睛,并使用 OCT 分割/分析软件测量肿瘤体积和定位。
- 使用公式24计算肿瘤体积:V = a * b * c * 6 / π(分别为a,b和c =长度,宽度和高度)。
- 如步骤7.4.1-7.4.3中所述,每2-3天检查肿瘤大小。
注意:如果使用不同的小鼠品系或细胞系,则必须优化该程序。
Access restricted. Please log in or start a trial to view this content.
结果
注射B16LS9细胞后立即通过OCT检查眼睛。注射后观察到局部视网膜脱离。小鼠表现出三种RD模式:局灶性(图2,上图),玻璃体渗漏(图2,中图)和扩展RD(图2,下图)。延长的RD可能是由注射损伤引起的。注射后立即的RD模式与注射后5-7天的肿瘤定位之间存在关联。如图2所示,局灶性RD与仅限于脉络膜?...
Access restricted. Please log in or start a trial to view this content.
讨论
葡萄膜黑色素瘤是一种毁灭性的疾病,非常需要新的治疗方法。然而,葡萄膜黑色素瘤和潜在治疗方法的研究受到葡萄膜黑色素瘤动物模型1,25的技术挑战的限制。由眼内注射癌细胞诱导的眼部肿瘤在定位和大小上变化很大,可能是由于小鼠眼睛的尺寸小。这种变异性是全面评估肿瘤进展的障碍。本文描述的实验方法允许人们基于实时OCT成像
Access restricted. Please log in or start a trial to view this content.
披露声明
Marcovich A.L.: Steba Biotech (P), Yeda Weizmann (P), EyeYon Medical (C, P), Mor Isum (P).(c) = 顾问;(P) = 专利。所有其他作者都没有竞争利益。
致谢
这项研究得到了以色列以色列科学基金会(ISF)为Arie Marcovich提供的1304/20赠款的部分支持。我们感谢来自以色列雷霍沃特卡普兰医疗中心病理学系的Shahar Ish-Shalom和Ady Yosipovich进行组织学分析。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 10 μL glass syringe (Hamilton Co., Bonaduz, Switzerland) | Hamilton | 721711 | |
| 30 G needles | BD Microbalance | 2025-01 | |
| Atipamezole hydrochloride | Orion Phrma | ||
| B16LS9 cells | from Hans Grossniklaus USA | ||
| Buprenorphine | richter pharma | 102047 | |
| C57BL/6 female mice | Envigo | ||
| Essential vitamin mixture | satorius | 01-025-1A | |
| Fetal bovine serum | rhenium | 10270106 | |
| HEPES | satorius | 03-025-1B | |
| Hydroxyethylcellulose 1.4% eye drops | Fisher Pharmaceutical | 390862 | |
| InSight OCT segmentation software | Phoenix Micron, Inc | ||
| Ketamine | bremer pharma GMBH (medimarket) | 17889 | |
| L-glutamine | satorius | 03-020-1B | |
| Medetomidine | zoetis (vetmarket) | 102532 | |
| Ofloxacin 0.3% eye drops | allergan | E92170 | |
| Optical coherence tomography | Phoenix Micron, Inc | ||
| Oxybuprocaine 0.4% | Fisher Pharmaceutical | 393050 | |
| Penicillin-streptomycin-amphoteracin | satorius | 03-033-1B | |
| Phosphate buffered saline (PBS) | satorius | 02-023-1a | |
| RPMI cell media | satorius | 01-104-1A | |
| Sodium pyruvate | satorius | 03-042-1B | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Tropicamide 0.5% | Fisher Pharmaceutical | 390723 |
参考文献
- Jager, M. J., et al. Uveal melanoma. Nature Reviews Disease Primers. 6 (1), 1-25 (2020).
- Bustamante, P., Piquet, L., Landreville, S., Burnier, J. V. Uveal melanoma pathobiology: Metastasis to the liver. Seminars in Cancer Biology. 71, Academic Press. 65-85 (2021).
- Damato, B. Ocular treatment of choroidal melanoma in relation to the prevention of metastatic death-A personal view. Progress in Retinal and Eye Research. 66, 187-199 (2018).
- Jouhi, S., et al. The small fatal choroidal melanoma study. A survey by the European Ophthalmic Oncology Group. American Journal of Ophthalmology. 202, 100-108 (2019).
- Cao, J., Jager, M. J. Animal eye models for uveal melanoma. Ocular Oncology and Pathology. 1 (3), 141-150 (2015).
- Uner, O. E., Gandrakota, N., Azarcon, C. P., Grossniklaus, H. E. Animal models of uveal melanoma. Annals of Eye Science. 7, 21-30 (2022).
- Yang, H., Dithmar, S., Grossniklaus, H. E. Interferon alpha 2b decreases hepatic micrometastasis in a murine model of ocular melanoma by activation of intrinsic hepatic natural killer cells. Investigative Ophthalmology & Visual Science. 45 (7), 2056-2064 (2004).
- Yang, H., Grossniklaus, H. E. Combined immunologic and anti-angiogenic therapy reduces hepatic micrometastases in a murine ocular melanoma model. Current Eye Research. 31 (6), 557-562 (2006).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Diaz, C. E., Rusciano, D., Dithmar, S., Grossniklaus, H. E. B16LS9 melanoma cells spread to the liver from the murine ocular posterior compartment (PC). Current Eye Research. 18 (2), 125-129 (1999).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Ashur-Fabian, O., et al. Tetrac delayed the onset of ocular melanoma in an orthotopic mouse model. Frontiers in Endocrinology. 12, 632335(2019).
- Elia, G., et al. Mechanisms regulating c-met overexpression in liver-metastatic B16-LS9 melanoma cells. Journal of Cellular Biochemistry. 81 (3), 477-487 (2001).
- Harning, R., Szalay, Z. Ocular metastasis of in vivo and in vitro derived syngeneic murine melanoma. Investigative Ophthalmology & Visual Science. 28 (9), 1599-1604 (1987).
- Ezra-Elia, R., et al. Can an in vivo imaging system be used to determine localization and biodistribution of AAV5-mediated gene expression following subretinal and intravitreal delivery in mice. Experimental Eye Research. 176, 227-234 (2018).
- Notting, I. C., et al. Whole-body bioluminescent imaging of human uveal melanoma in a new mouse model of local tumor growth and metastasis. Investigative Ophthalmology & Visual Science. 46 (5), 1581-1587 (2005).
- Yang, H., et al. In-vivo xenograft murine human uveal melanoma model develops hepatic micrometastases. Melanoma Research. 18 (2), 95-103 (2008).
- Murthy, R. K., Haji, S., Sambhav, K., Grover, S., Chalam, K. V. Clinical applications of spectral domain optical coherence tomography in retinal diseases. Biomedical Journal. 39 (2), 107-120 (2016).
- Drexler, W., et al. Ultrahigh-resolution ophthalmic optical coherence tomography. Nature Medicine. 7 (4), 502-507 (2001).
- Ochakovski, G. A., Fischer, M. D. Phenotyping of mouse models with OCT. Methods in Molecular Biology. 1834, 285-291 (2019).
- Zaks, O., et al. In-vivo imaging for assessing tumor growth in mouse models of ocular melanoma. Experimental Eye Research. 204, 108431(2021).
- Brar, V. S. American Academy of Ophthalmology 2022-2023 BCSC. 2. Fundamentals and principles of ophthalmology. , (2022).
- Duker, J. S., Waheed, N. K., Goldman, D. Handbook of Retinal OCT: Optical Coherence Tomography, 2nd Edition. , Elsevier Health Sciences. (2021).
- Tomayko, M. M., Reynolds, C. P. Determination of subcutaneous tumor size in athymic (nude) mice. Cancer Chemotherapy and Pharmacology. 24 (3), 148-154 (1989).
- Richards, J. R., Yoo, J. H., Shin, D., Odelberg, S. J. Mouse models of uveal melanoma: Strengths, weaknesses, and future directions. Pigment Cell & Melanoma Research. 33 (2), 264(2020).
- Chen, R., et al. Photoacoustic molecular imaging-escorted adipose photodynamic-browning synergy for fighting obesity with virus-like complexes. Nature Nanotechnology. 16 (4), 455-465 (2021).
- Yu, Q., et al. Label-free visualization of early cancer hepatic micrometastasis and intraoperative image-guided surgery by photoacoustic imaging. Journal of Nuclear Medicine. 61 (7), 1079-1085 (2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。