Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Implantation und Beurteilung des Melanoms in der Aderhaut der Maus mittels optischer Kohärenztomographie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt die Implantation und Beurteilung des Melanoms in der murinen Aderhaut mittels optischer Kohärenztomographie.
Zusammenfassung
Die Etablierung experimenteller Aderhautmelanommodelle ist eine Herausforderung in Bezug auf die Fähigkeit, Tumore an der richtigen Lokalisation zu induzieren. Darüber hinaus schränken Schwierigkeiten bei der Beobachtung des Melanoms der hinteren Aderhaut in vivo die Tumorlokalisation und die Wachstumsbewertung in Echtzeit ein. Der hier beschriebene Ansatz optimiert Techniken zur Etablierung eines Aderhautmelanoms bei Mäusen durch ein mehrstufiges subchoroidales B16LS9-Zellinjektionsverfahren. Um eine präzise Injektion in die kleinen Abmessungen der Maus zu ermöglichen, wird der gesamte Eingriff unter dem Mikroskop durchgeführt. Zunächst wird eine konjunktivale Peritomie im dorsal-temporalen Bereich des Auges gebildet. Dann wird ein Trakt in den subchoroidalen Raum geschaffen, indem eine Nadel durch die freiliegende Lederhaut eingeführt wird. Es folgt das Einstechen einer stumpfen Nadel in den Trakt und die Injektion von Melanomzellen in die Aderhaut. Unmittelbar nach der Injektion wird eine nichtinvasive optische Kohärenztomografie (OCT) eingesetzt, um die Lokalisation und das Fortschreiten des Tumors zu bestimmen. Die Netzhautablösung wird als Prädiktor für die Lokalisation und Größe des Tumors ausgewertet. Die vorgestellte Methode ermöglicht die reproduzierbare Induktion von Aderhaut-lokalisierten Melanomen bei Mäusen und die Live-Bildgebung der Tumorwachstumsauswertung. Als solches bietet es ein wertvolles Werkzeug für die Untersuchung von intraokularen Tumoren.
Einleitung
Das Uvealmelanom (UM) ist die häufigste intraokulare primäre Malignität bei Erwachsenen. Etwa 90 % der okulären Melanome stammen von Melanozyten in der Aderhautregion des Adergangs1. UM ist eine der Hauptursachen für Morbidität und Mortalität, da schätzungsweise fast 50 % der Patienten eine metastasierende Erkrankung entwickeln, wobei die Leber der Hauptort der Metastasierungist 2. Eine frühzeitige Behandlung von primären Läsionen kann die Wahrscheinlichkeit von Metastasen verringern, aber keine wirksame Behandlung verhindert die Bildung von Metastasen3.
Die Standardbehandlung des Aderhautmelanoms umfasst die Strahlentherapie, die mit dem Verlust des Sehvermögens aufgrund von Optikusneuropathie, Retinopathie, Syndrom des trockenen Auges und Katarakt verbunden ist. Die chirurgische Resektion wird in der Regel verzögert, bis das Wachstum der Läsion erkannt und charakterisiert ist. Eine solche Verzögerung kann jedoch die Entwicklung von Metastasen ermöglichen4. In einigen Fällen ist eine vergebliche Enukleation erforderlich. Natürlich beeinträchtigt dieser radikale Eingriff das Sehvermögen und führt zu einer dramatischen ästhetischen Verschlechterung.
Es wurden viele Anstrengungen unternommen, um experimentelle Modelle zur Untersuchung des Aderhautmelanoms zu entwickeln. Präklinische Tiermodelle, die eine genaue Beurteilung dieser Malignität ermöglichen, sind der Schlüssel zur Erforschung neuer diagnostischer und therapeutischer Strategien für das Aderhautmelanom. Experimentelle Tiermodelle des okulären Melanoms basieren hauptsächlich auf der Inokulation von Tumorzellen bei Mäusen, Ratten und Kaninchen 5,6. Mausmodelle sind kostengünstig und werden aufgrund ihrer schnellen Reproduktionsrate und der hohen Genomähnlichkeit zum Menschen häufig für Melanomstudien verwendet. Die murine kutane Melanomzelllinie B16 wird häufig zur Inokulation von C57BL6-Mäusen und zur Induktion syngener Tumore verwendet. Bei Verwendung dieses Modells zur Induktion eines Aderhautmelanoms müssen tumortragende Augen in der Regel 7-14 Tage nach der Inokulation enukleiert werden. Darüber hinaus ist B16 ein hochinvasives Modell. Die immunprivilegierte Natur des Auges begünstigt die Metastasierung, und Metastasen können in der Regel 3-4 Wochen nach der Inokulation der Tumorzellen entdeckt werden. Subkulturen der ursprünglichen B16-Linie weisen ausgeprägte metastatische Eigenschaftenauf 6. Zum Beispiel hat die Queens-Melanomlinie eine hohe Metastasierungsratevon 7,8. Die B16LS9-Zelllinie weist eine dendritische Zellmorphologie auf und wurde aus Lebermetastasen von C57BL/6-Mäusen gewonnen, denen die elterliche kutane Melanomlinie B16F19 injiziert wurde. Bei der Injektion in das hintere Kompartiment des Auges bildeten diese Zellen intraokulare Tumore, die histologisch dem humanen Aderhautmelanom ähneln und leberspezifische Metastasen in C57BL/6, aber nicht in Balb/C, Mäusen bilden10,11,12. Genetisch sind die Zellen durch eine höhere Expression des c-met-Proto-Onkogens gekennzeichnet, das als zellulärer Rezeptor für den Hepatozyten-Wachstumsfaktor13 fungiert. Im Gegensatz dazu metastasiert B16F10, die 10. Passage des elterlichen B16, bei intraokularer Inokulation hauptsächlich in die Lunge14. Sowohl B16F10 als auch B16LS9 sind pigmentiert12.
Mehrere zentrale Herausforderungen schränken den Erfolg von murinen Aderhautmelanommodellen ein. Erstens kann ein Tumorzellreflux zu einem extraokularen oder subkonjunktivalen Melanom führen. Zweitens ist das Tumorwachstum nach intraokularer Inokulation von Melanomzellen oft sehr variabel, was die Beurteilung der Behandlung und des Fortschritts erschwert. Eine weitere große Schwierigkeit ist die eingeschränkte Fähigkeit, das Tumorwachstum in vivo zu verfolgen. Während die biolumineszente Bildgebung, z. B. von Luciferase-exprimierenden Tumoren, häufig zur Überwachung des okulären Tumorwachstums verwendet wird15,16, kann sie keine Informationen über die intraokulare Lage des Tumors liefern. Daher wird die Beurteilung des Tumors in der Regel nach der Enukleation des Auges durchgeführt10,17. Dies schränkt die Fähigkeit, die Tumorprogression und das Ansprechen auf Behandlungen umfassend zu charakterisieren, stark ein. Eine weitere große Hürde bei der Untersuchung des Aderhautmelanoms ist die Schwierigkeit, Läsionen bei pigmentierten Mäusen zu überwachen. Neue Ansätze, die diese Schwierigkeiten überwinden, sind erforderlich, um die Erforschung des Aderhautmelanoms im Tiermodell voranzutreiben.
Die optische Kohärenztomographie (OCT) bietet einzigartige Möglichkeiten, in hoher Auflösung tief in die verschiedenen Bereiche des Auges einzudringen, was von anderen Methoden, einschließlich Ultraschall, nicht erreichtwird 18,19. Die OCT-Bildgebung wurde in Tiermodellen verwendet, um verschiedene Augenerkrankungen zu untersuchen20. Kürzlich wurde die OCT-Bildgebung als nicht-invasives Mittel zur Beurteilung des intraokularen Tumorwachstums demonstriert21. Das hier beschriebene Protokoll beschreibt die Implantation von Melanomzellen in die murine Aderhaut und die Verwendung der OCT zur Vorhersage der intraokularen Tumorlokalisation und -größe zum Zeitpunkt der Zellinokulation.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Die Experimente im Protokoll wurden vom israelischen Nationalen Rat für Tierversuche genehmigt und entsprechen der ARVO-Erklärung für die Verwendung von Tieren in der Augen- und Sehforschung. Weibliche C57BL/6-Mäuse im Alter von 8-10 Wochen wurden für die vorliegende Studie verwendet und 12/12 h Hell-Dunkel-Zyklen ausgesetzt. Die Tiere stammen aus einer kommerziellen Quelle (siehe Materialtabelle).
1. Zellkultur
- Kultivieren Sie B16LS9-Zellen in RPMI 1640-Medium, ergänzt mit 10 % fötalem Kälberserum, 2 mM L-Glutamin, 1 mM Natriumpyruvat, 25 mM HEPES, 1 % essentieller Vitaminmischung, 200 U/ml Penicillin und 200 mg/ml Streptomycin (siehe Materialtabelle), in einem befeuchteten 37 °C-Inkubator mit 5 % CO2.
- Ernten Sie die Zellen für die Injektion bei 70%-80% Konfluenz.
2. Vorbereitung der Tiere
- Bereiten Sie eine Betäubungsmittelmischung aus Ketamin (75 mg/kg Körpergewicht) und Medetomidin (0,5 mg/kg Körpergewicht) vor. Betäuben Sie die Mäuse, indem Sie die Anästhetikamischung in einer einzigen Injektion intraperitoneal injizieren.
- Tragen Sie topisches ophthalmologisches Anästhetikum Oxybuprocain (0,4%) auf beide Augen auf.
- Erweitern Sie die Pupillen der Maus durch topische Anwendung von Tropicamid (0,5%).
3. Schaffung einer konjunktivalen Peritomie und eines Skleratrakts in den subchoroidalen Raum
- Tragen Sie 1,4 % Hydroxyethylcellulose (siehe Materialtabelle) als Gleitmittel auf beide Augen auf, um ein Austrocknen zu vermeiden. Tragen Sie 0,5% Tropicamid auf das rechte Auge auf.
- Beobachten Sie das operierte Auge der Maus unter dem Operationsmikroskop (siehe Materialtabelle). Halten Sie die Augenlider mit einer sterilen Augenzange offen.
- Halten Sie mit einer intraokularen Zange die supero-temporale limbale Bindehaut fest und ziehen Sie sie in eine infranasale Position22. Sichern Sie diese Position, indem Sie sie während des gesamten Vorgangs halten (Abbildung 1A).
- Machen Sie mit einer 30-G-Nadelspitze eine kleine (1-2 mm) konjunktivale Peritomie im dorsal-temporalen Bereich, etwa 1-2 mm hinter dem Limbus.
HINWEIS: Die Verwendung feinerer Nadeln kann eine übermäßige Punktion verhindern und eine bessere Präzision der Tumorlokalisation ermöglichen. - Entfernen Sie die überschüssige Tenon-Kapsel aus der Öffnung der Peritomie.
ANMERKUNG: Die Tenon-Kapsel ist eine Schicht aus dichtem Bindegewebe, die den Globus des Auges umgibt22. - Führen Sie an dieser Stelle die Nadelspitze ein, um durch die Lederhaut einzudringen. Machen Sie eine Exzision, um einen Trakt in den subchoroidalen Raum zu schaffen, bis die braune Farbe der Aderhaut durch die freiliegende weiße Substanz der Sklera erscheint (Abbildung 1B).
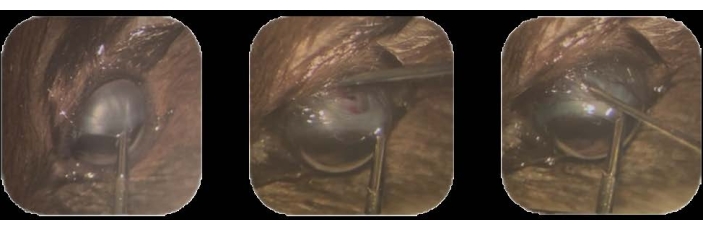
Abbildung 1: Inokulation von Tumorzellen . (A) Die supero-temporale limbale Bindehaut wird mit einer intraokularen Pinzette gehalten und in eine infranasale Position gezogen. (B) Die Spitze einer 30-G-Nadel wird eingeführt, um durch die Lederhaut zu dringen, und es wird eine Exzision vorgenommen, um eine Spur in den subchoroidalen Raum zu erzeugen. (C) Eine mit Zellen beladene Spritze, die mit einer 32-G-Nadel befestigt ist, wird in die Schiene eingeführt, und die Zellen werden injiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Inokulation von Melanomzellen
- Resuspendieren Sie 70.000 B16LS9-Zellen in 2 μl PBS. Dieser Betrag wird pro Auge geschätzt.
- Laden Sie die Zellen in eine sterile 10-μl-Hamilton-Glasspritze (siehe Materialtabelle), die mit einer stumpfen 32-G-Nadel befestigt ist, die in einem Winkel von 45° gedreht ist.
- Führen Sie die geladene Spritzennadel ca. 2 mm in die in Schritt 3 erstellte Spur ein.
- Injizieren Sie 2 μl Zellsuspension.
- Halten Sie die Nadel nach der Injektion 2-3 s lang fest, bis die gesamte Flüssigkeit verschwunden ist.
- Entfernen Sie die Nadel, indem Sie sie vorsichtig und langsam herausziehen, um ein Auslaufen aus der Schiene zu vermeiden (Abbildung 1C).
HINWEISE: Die Anpassung der Geschwindigkeit und Kraft der Injektion kann das Muster der Tumorentwicklung beeinflussen. Es wird vorgeschlagen, dass diese Parameter von Personen kalibriert werden, die experimentieren, um die richtige Kraft und Geschwindigkeit zu ermitteln. In Vorversuchen wurden insgesamt 70.000 Zellen bestimmt. Da es jedoch zu Abweichungen bei den Zellkulturtypen oder -chargen oder zwischen Mausstämmen kommen kann, ist eine Kalibrierung dieser Zahl erforderlich.
5. Beurteilung des Ortes der Injektion
- Beobachten Sie das injizierte Auge unmittelbar nach der Inokulation der Melanomzellen durch OCT-Scans, um das Auftreten einer Netzhautablösung (RD), einer Netzhautschädigung und/oder von Zellen am Glaskörper23 zu erkennen.
ANMERKUNGEN: Tragen Sie Tropicamid, Oxybuprocain und Ethylcellulose bei Bedarf erneut auf. - Klassifizieren Sie auf der Grundlage der OCT-Scans aus Schritt 5.1 die RD-Muster21 nach: (1) lokalem RD-One-Standort von RD; (2) Austritt in das glaskörperbeobachtende Zellmaterial im Glaskörper; (3) erweiterte RD-Mehrfachstandorte von RD.
- Vorhersage der Tumorlokalisation auf der Grundlage von: (1) lokalen RD-erwarteten Aderhauttumoren; (2) Leckage in den Glaskörper, zu erwartende Tumore im Glaskörper; (3) ausgedehnte RD-erwartete variable und disperse Tumoren (Abbildung 2).
HINWEIS: Es ist zu erwarten, dass nur Mäuse mit lokaler RD (ca. 50%) Tumore entwickeln, die auf die Aderhaut beschränkt sind.
6. Vorhersage der Tumorgröße basierend auf der RD-Höhe
- Messen Sie die Höhe der lokalen RD in den OCT-Scans mit einer OCT-Segmentierungs-/Analysesoftware (siehe Materialtabelle) und klassifizieren Sie sie nach den folgenden Gruppen: klein = <300 μm; mittel = 300-400 μm; Groß = >400 μm.
- Beurteilen Sie das Volumen, das die Tumore voraussichtlich innerhalb von 5 Tagen nach der Injektion erreichen werden, anhand der folgenden Kriterien:
Eine geringe RD-Höhe wird typischerweise bei kleinen Tumoren beobachtet (Tumorvolumen im Bereich von 0,0059 mm3 bis 0,07 mm3 mit einem mittleren Volumen von 0,027 ± 0,005 mm 3).
Eine mittlere RD-Höhe findet sich sowohl bei kleinen als auch bei mittelgroßen Tumoren (Tumorvolumen von 0,015 mm3 bis 0,15 mm3 mit einem mittleren Volumen von 0,056 ± 0,016 mm 3).
Eine große RD-Höhe ist mit einem breiten Spektrum von Tumorvolumina bis zu 0,36 mmverbunden 3.
HINWEIS: Der Bereich der zu erwartenden Tumorgrößen wurde aus den vorherigen Ergebnissen ermittelt und in drei Gruppen von kleinen, mittleren und großen Tumoren unterteilt.
7. Postoperative Eingriffe
- Tragen Sie ophthalmisches Ofloxacin 0,3% topisch auf.
- Kehren Sie die Anästhesie um, indem Sie Atipamezolhydrochlorid (3 mg/kg) subkutan injizieren.
- Zweimal täglich 3 Tage lang zweimal täglich Buprenorphin (0,05 mg/kg Körpergewicht) subkutan injizieren, um die Schmerzen und das Leiden der Tiere zu lindern.
- Beurteilen Sie 5 Tage nach der Injektion von Melanomzellen die Tumorgröße, indem Sie die folgenden Schritte ausführen.
- Betäuben Sie die Mäuse wie in Schritt 2.1 beschrieben. Tragen Sie Tropicamid (0,5%) auf.
- Untersuchen Sie die Augen durch longitudinale und sagittale OCT-Scans und verwenden Sie eine OCT-Segmentierungs-/Analysesoftware, um das Tumorvolumen und die Lokalisation zu messen.
- Berechnen Sie das Tumorvolumen mit der Formel24: V = a*b*c*6/π (a, b und c = Länge, Breite bzw. Höhe).
- Untersuchen Sie die Tumorgröße alle 2-3 Tage, wie in den Schritten 7.4.1-7.4.3 beschrieben.
HINWEIS: Das Verfahren muss optimiert werden, wenn verschiedene Mausstämme oder Zelllinien verwendet werden.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die Augen wurden unmittelbar nach Injektion der B16LS9-Zellen mittels OCT untersucht. Nach der Injektion wurde eine lokale Netzhautablösung beobachtet. Die Mäuse zeigten drei RD-Muster: fokale (Abbildung 2, oberes Bild), Leckage in den Glaskörper (Abbildung 2, mittleres Bild) und erweiterte RD (Abbildung 2, unteres Bild). Eine verlängerte RD wird wahrscheinlich durch eine Schädigung durch die Injektion verursacht. Es b...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Das Uvealmelanom ist eine verheerende Erkrankung, für die neue Therapieansätze dringend benötigt werden. Die Forschung zum Aderhautmelanom und zu möglichen Therapien ist jedoch durch die technischen Herausforderungen von Aderhautmelanom-Tiermodellen begrenzt 1,25. Augentumoren, die durch intraokulare Injektion von Krebszellen induziert werden, sind sowohl in ihrer Lokalisation als auch in ihrer Größe sehr variabel, was wahrscheinlich auf die geringen Abmess...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Marcovich A.L.: Steba Biotech (P), Yeda Weizmann (P), EyeYon Medical (C, P), Mor Isum (P). (C) = Berater; (P) = Patent. Alle anderen Autoren haben keine konkurrierenden Interessen.
Danksagungen
Diese Studie wurde zum Teil durch das Stipendium 1304/20 der Israel Science Foundation (ISF), Israel, für Arie Marcovich unterstützt. Wir danken Shahar Ish-Shalom und Ady Yosipovich von der Abteilung für Pathologie des Kaplan Medical Center, Rehovot, Israel, für die histologische Analyse.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 10 μL glass syringe (Hamilton Co., Bonaduz, Switzerland) | Hamilton | 721711 | |
| 30 G needles | BD Microbalance | 2025-01 | |
| Atipamezole hydrochloride | Orion Phrma | ||
| B16LS9 cells | from Hans Grossniklaus USA | ||
| Buprenorphine | richter pharma | 102047 | |
| C57BL/6 female mice | Envigo | ||
| Essential vitamin mixture | satorius | 01-025-1A | |
| Fetal bovine serum | rhenium | 10270106 | |
| HEPES | satorius | 03-025-1B | |
| Hydroxyethylcellulose 1.4% eye drops | Fisher Pharmaceutical | 390862 | |
| InSight OCT segmentation software | Phoenix Micron, Inc | ||
| Ketamine | bremer pharma GMBH (medimarket) | 17889 | |
| L-glutamine | satorius | 03-020-1B | |
| Medetomidine | zoetis (vetmarket) | 102532 | |
| Ofloxacin 0.3% eye drops | allergan | E92170 | |
| Optical coherence tomography | Phoenix Micron, Inc | ||
| Oxybuprocaine 0.4% | Fisher Pharmaceutical | 393050 | |
| Penicillin-streptomycin-amphoteracin | satorius | 03-033-1B | |
| Phosphate buffered saline (PBS) | satorius | 02-023-1a | |
| RPMI cell media | satorius | 01-104-1A | |
| Sodium pyruvate | satorius | 03-042-1B | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Tropicamide 0.5% | Fisher Pharmaceutical | 390723 |
Referenzen
- Jager, M. J., et al. Uveal melanoma. Nature Reviews Disease Primers. 6 (1), 1-25 (2020).
- Bustamante, P., Piquet, L., Landreville, S., Burnier, J. V. Uveal melanoma pathobiology: Metastasis to the liver. Seminars in Cancer Biology. 71, Academic Press. 65-85 (2021).
- Damato, B. Ocular treatment of choroidal melanoma in relation to the prevention of metastatic death-A personal view. Progress in Retinal and Eye Research. 66, 187-199 (2018).
- Jouhi, S., et al. The small fatal choroidal melanoma study. A survey by the European Ophthalmic Oncology Group. American Journal of Ophthalmology. 202, 100-108 (2019).
- Cao, J., Jager, M. J. Animal eye models for uveal melanoma. Ocular Oncology and Pathology. 1 (3), 141-150 (2015).
- Uner, O. E., Gandrakota, N., Azarcon, C. P., Grossniklaus, H. E. Animal models of uveal melanoma. Annals of Eye Science. 7, 21-30 (2022).
- Yang, H., Dithmar, S., Grossniklaus, H. E. Interferon alpha 2b decreases hepatic micrometastasis in a murine model of ocular melanoma by activation of intrinsic hepatic natural killer cells. Investigative Ophthalmology & Visual Science. 45 (7), 2056-2064 (2004).
- Yang, H., Grossniklaus, H. E. Combined immunologic and anti-angiogenic therapy reduces hepatic micrometastases in a murine ocular melanoma model. Current Eye Research. 31 (6), 557-562 (2006).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Diaz, C. E., Rusciano, D., Dithmar, S., Grossniklaus, H. E. B16LS9 melanoma cells spread to the liver from the murine ocular posterior compartment (PC). Current Eye Research. 18 (2), 125-129 (1999).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Ashur-Fabian, O., et al. Tetrac delayed the onset of ocular melanoma in an orthotopic mouse model. Frontiers in Endocrinology. 12, 632335(2019).
- Elia, G., et al. Mechanisms regulating c-met overexpression in liver-metastatic B16-LS9 melanoma cells. Journal of Cellular Biochemistry. 81 (3), 477-487 (2001).
- Harning, R., Szalay, Z. Ocular metastasis of in vivo and in vitro derived syngeneic murine melanoma. Investigative Ophthalmology & Visual Science. 28 (9), 1599-1604 (1987).
- Ezra-Elia, R., et al. Can an in vivo imaging system be used to determine localization and biodistribution of AAV5-mediated gene expression following subretinal and intravitreal delivery in mice. Experimental Eye Research. 176, 227-234 (2018).
- Notting, I. C., et al. Whole-body bioluminescent imaging of human uveal melanoma in a new mouse model of local tumor growth and metastasis. Investigative Ophthalmology & Visual Science. 46 (5), 1581-1587 (2005).
- Yang, H., et al. In-vivo xenograft murine human uveal melanoma model develops hepatic micrometastases. Melanoma Research. 18 (2), 95-103 (2008).
- Murthy, R. K., Haji, S., Sambhav, K., Grover, S., Chalam, K. V. Clinical applications of spectral domain optical coherence tomography in retinal diseases. Biomedical Journal. 39 (2), 107-120 (2016).
- Drexler, W., et al. Ultrahigh-resolution ophthalmic optical coherence tomography. Nature Medicine. 7 (4), 502-507 (2001).
- Ochakovski, G. A., Fischer, M. D. Phenotyping of mouse models with OCT. Methods in Molecular Biology. 1834, 285-291 (2019).
- Zaks, O., et al. In-vivo imaging for assessing tumor growth in mouse models of ocular melanoma. Experimental Eye Research. 204, 108431(2021).
- Brar, V. S. American Academy of Ophthalmology 2022-2023 BCSC. 2. Fundamentals and principles of ophthalmology. , (2022).
- Duker, J. S., Waheed, N. K., Goldman, D. Handbook of Retinal OCT: Optical Coherence Tomography, 2nd Edition. , Elsevier Health Sciences. (2021).
- Tomayko, M. M., Reynolds, C. P. Determination of subcutaneous tumor size in athymic (nude) mice. Cancer Chemotherapy and Pharmacology. 24 (3), 148-154 (1989).
- Richards, J. R., Yoo, J. H., Shin, D., Odelberg, S. J. Mouse models of uveal melanoma: Strengths, weaknesses, and future directions. Pigment Cell & Melanoma Research. 33 (2), 264(2020).
- Chen, R., et al. Photoacoustic molecular imaging-escorted adipose photodynamic-browning synergy for fighting obesity with virus-like complexes. Nature Nanotechnology. 16 (4), 455-465 (2021).
- Yu, Q., et al. Label-free visualization of early cancer hepatic micrometastasis and intraoperative image-guided surgery by photoacoustic imaging. Journal of Nuclear Medicine. 61 (7), 1079-1085 (2020).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten