A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
השתלה והערכה של מלנומה בכורואיד מורין באמצעות טומוגרפיה קוהרנטית אופטית
* These authors contributed equally
In This Article
Summary
הפרוטוקול הנוכחי מתאר את ההשתלה וההערכה של מלנומה בכורואיד מורין תוך שימוש בטומוגרפיה קוהרנטית אופטית.
Abstract
הקמת מודלים ניסיוניים למלנומה כורואידית מאתגרת מבחינת היכולת לגרום לגידולים במיקום הנכון. בנוסף, קשיים בתצפית על מלנומה כורואידית אחורית in vivo מגבילים את מיקום הגידול ואת הערכת הצמיחה בזמן אמת. הגישה המתוארת כאן מייעלת טכניקות לביסוס מלנומה כורואידית בעכברים באמצעות הליך הזרקת תאים תת-כורואידי B16LS9 רב-שלבי. כדי לאפשר דיוק בהזרקה לממדים הקטנים של העכבר uvea, ההליך המלא מבוצע תחת מיקרוסקופ. ראשית, פריטומיה הלחמית נוצרת באזור הגבי-טמפורלי של העין. לאחר מכן, נוצרת מערכת לתוך החלל התת-כורואידי על ידי החדרת מחט דרך הסקלרה החשופה. זה ואחריו החדרת מחט קהה לתוך דרכי והזרקת תאי מלנומה לתוך choroid. מיד לאחר ההזרקה, נעשה שימוש בהדמיית טומוגרפיה קוהרנטית אופטית לא פולשנית (OCT) כדי לקבוע את מיקום הגידול והתקדמותו. היפרדות הרשתית מוערכת כמנבא של אתר הגידול וגודלו. השיטה המוצגת מאפשרת השראת שחזור של מלנומה מקומית כורואידית בעכברים והדמיה חיה של הערכת צמיחת גידול. ככזה, הוא מספק כלי רב ערך לחקר גידולים תוך עיניים.
Introduction
מלנומה של Uveal (UM) היא הממאירות הראשונית התוך עינית השכיחה ביותר במבוגרים. כ-90% מהמלנומות של העין מקורן במלנוציטים באזור הכורואידי של דרכי הענבל1. UM הוא גורם עיקרי לתחלואה ותמותה, שכן ההערכה היא כי קרוב ל -50% מהחולים מפתחים מחלה גרורתית, כאשר הכבד הוא האתר העיקרי של גרורות2. טיפול מוקדם בנגעים ראשוניים עשוי להפחית את הסיכוי לגרורות, אך אין טיפול יעיל המונע היווצרות גרורות3.
הטיפול המקובל במלנומה של הענבל כולל הקרנות, הקשורות לאובדן ראייה עקב נוירופתיה אופטית, רטינופתיה, תסמונת העין היבשה וקטרקט. כריתה כירורגית מתעכבת בדרך כלל עד לזיהוי ואפיון צמיחת הנגע. עם זאת, עיכוב כזה עלול לאפשר התפתחות מחלה גרורתית4. במקרים מסוימים, נדרשת אינוקלציה חסרת תוחלת. כמובן שהליך רדיקלי זה פוגע בראייה וגורם להידרדרות אסתטית דרמטית.
מאמצים רבים הוקדשו לפיתוח מודלים ניסיוניים לחקר מלנומה של הענבה. מודלים פרה-קליניים של בעלי חיים המאפשרים הערכה מדויקת של ממאירות זו הם המפתח לחקר אסטרטגיות אבחון וטיפול חדשניות למלנומה של הענבה. מודלים ניסיוניים של מלנומה עינית בבעלי חיים מבוססים בעיקר על חיסון תאי גידול בעכברים, חולדות וארנבות 5,6. מודלים של עכברים הם חסכוניים ונמצאים בשימוש נרחב במחקרי מלנומה בשל קצב ההתרבות המהיר שלהם ודמיון גנומי גבוה לבני אדם. קו תאי המלנומה העורית B16 משמש בדרך כלל לחיסון עכברי C57BL6 ולגרימת גידולים סינגניים. כאשר משתמשים במודל זה כדי לגרום למלנומה של העגלה, עיניים נושאות גידול בדרך כלל צריכות לעבור אינקולציה 7-14 יום לאחר החיסון. יתר על כן, B16 הוא מודל פולשני מאוד. האופי החיסוני של העין תומך בגרורות, וגרורות עשויות בדרך כלל להתגלות 3-4 שבועות לאחר חיסון תאי הגידול. תת-תרבויות של קו B16 המקורי מציגות תכונות גרורתיות מובהקות6. לדוגמה, לקו המלנומה של קווינס יש שיעור גרורתי גבוה 7,8. לקו התאים B16LS9 יש מורפולוגיה של תאים דנדריטיים והוא נגזר מגרורות בכבד של עכברי C57BL/6 שהוזרקו לקו המלנומה העורית של ההורים B16F19. כאשר הוזרקו לתא האחורי של העין, תאים אלה הוכחו כיוצרים גידולים תוך עיניים, אשר דומים היסטולוגית למלנומה של הענבל האנושי ויוצרים גרורות ספציפיות לכבד ב- C57BL/6, אך לא Balb/C, עכברים10,11,12. מבחינה גנטית, התאים מאופיינים בביטוי גבוה יותר של הפרוטו-אונקוגן c-met, הפועל כקולטן תאי לגורם גדילה של הפטוציטים13. לעומת זאת, B16F10, המעברהעשירי של B16 ההורי, שולח גרורות בעיקר לריאות כאשר הוא מחוסן תוך עינית14. גם B16F10 וגם B16LS9 הם פיגמנט12.
מספר אתגרים מרכזיים מגבילים את ההצלחה של מודלים של מלנומה של מורין uveal. ראשית, ריפלוקס של תאי הגידול עלול להוביל למלנומה חוץ-עינית או תת-לחמית. שנית, צמיחת הגידול לאחר חיסון תוך עיני של תאי מלנומה היא לעתים קרובות משתנה מאוד, ומציבה קשיים בהערכת הטיפול והתקדמותו. קושי מרכזי נוסף הוא היכולת המוגבלת לעקוב אחר צמיחת הגידול in vivo. בעוד הדמיה ביולומינסנטית, כגון של גידולים המבטאים לוציפראז, משמשת בדרך כלל למעקב אחר צמיחת הגידול העיני15,16, היא אינה יכולה לספק מידע על המיקום התוך עיני של הגידול. לכן, הערכה של הגידול מבוצעת בדרך כלל לאחר enucleation של העין10,17. זה מגביל מאוד את היכולת לאפיין את התקדמות הגידול ואת התגובה לטיפולים באופן נרחב. מכשול מרכזי נוסף בחקר מלנומה של הענבל הוא הקושי בניטור נגעים בעכברים עם פיגמנטציה. גישות חדשות, המתגברות על קשיים אלה, נדרשות כדי לקדם את המחקר של מלנומה ענבית במודלים של בעלי חיים.
טומוגרפיה קוהרנטית אופטית (OCT) מספקת יכולות ייחודיות לתמונה עמוק לתוך חלקי העין השונים ברזולוציה גבוהה, שאין דומה לה במתודולוגיות אחרות, כולל אולטרסאונד18,19. הדמיית OCT שימשה במודלים של בעלי חיים לחקר מחלות עיניים שונות20. לאחרונה, הדמיית OCT הודגמה כאמצעי לא פולשני להערכת צמיחת גידול תוך עיני21. הפרוטוקול המתואר כאן מתאר את השתלת תאי המלנומה בכורואיד המוריני ואת השימוש ב-OCT לחיזוי לוקליזציה וגודל הגידול התוך-עיני בזמן חיסון התא.
Access restricted. Please log in or start a trial to view this content.
Protocol
הניסויים בפרוטוקול אושרו על ידי המועצה הלאומית הישראלית לניסויים בבעלי חיים ועומדים בהצהרת ARVO לשימוש בבעלי חיים בחקר העיניים והראייה. נקבות עכברי C57BL/6, בגילאי 8-10 שבועות, שימשו במחקר הנוכחי ונחשפו למחזורי אור-חושך של 12/12 שעות. בעלי החיים התקבלו ממקור מסחרי (ראו טבלת חומרים).
1. תרבית תאים
- תרבית תאי B16LS9 במדיום RPMI 1640, בתוספת סרום בקר עוברי 10%, 2 מ"מ L-גלוטמין, 1 מ"מ נתרן פירובט, 25 מ"מ HEPES, תערובת ויטמינים 1% חיונית, 200 U/מ"ל פניצילין ו-200 מ"ג/מ"ל סטרפטומיצין (ראו טבלת חומרים), באינקובטור לח של 37 מעלות צלזיוס עם 5% CO2.
- קצרו את התאים להזרקה במפגש של 70%-80%.
2. הכנת בעלי חיים
- הכינו תערובת הרדמה של קטמין (75 מ"ג/ק"ג משקל גוף) ומדטומידין (0.5 מ"ג/ק"ג משקל גוף). מרדימים את העכברים על ידי הזרקת תערובת ההרדמה תוך צפקית בזריקה אחת.
- החל הרדמה אופתלמית מקומית oxybuprocaine (0.4%) על שתי העיניים.
- להרחיב את אישוני העכבר על ידי יישום מקומי tropicamide (0.5%).
3. יצירת פריטומיה של הלחמית ומערכת סקלרלית לחלל תת-כורואידי
- יש למרוח 1.4% הידרוקסיאתילצלולוז (ראו טבלת חומרים) כחומר סיכה על שתי העיניים כדי למנוע ייבוש. יש למרוח 0.5% טרופיקמיד על עין ימין.
- התבוננו בעין המופעלת של העכבר תחת מיקרוסקופ הפעלה (ראו טבלת חומרים). החזיקו את העפעפיים פתוחים בעזרת מלקחיים תוך עיניים סטריליות.
- באמצעות מלקחיים תוך עיניים, החזיקו את לחמית הגפיים הסופרו-טמפורלית ומשכו לכיוון מנח אינפרא-אף22. אבטחו את המיקום הזה על-ידי החזקתו לאורך כל התהליך (איור 1A).
- בעזרת קצה מחט של 30 גרם, יש לבצע פריטומיה קטנה (1-2 מ"מ) של הלחמית באזור הגב-טמפורלי, כ-1-2 מ"מ אחורית ללימבוס.
הערה: שימוש במחטים עדינות יותר יכול למנוע ניקוב יתר ולאפשר דיוק טוב יותר של מיקום הגידול. - מוציאים את עודפי הקפסולה של טנון מפתח הצפק.
הערה: הקפסולה של טנון היא שכבה של רקמת חיבור צפופה המקיפה את כדור הארץ של העין22. - במיקום זה, הכנס את קצה המחט כדי לחדור דרך הסקלרה. בצעו כריתה כדי ליצור מערכת לתוך החלל התת-כורואידי עד שהצבע החום של הכורואיד יופיע דרך החומר הלבן החשוף של לובן העין (איור 1B).
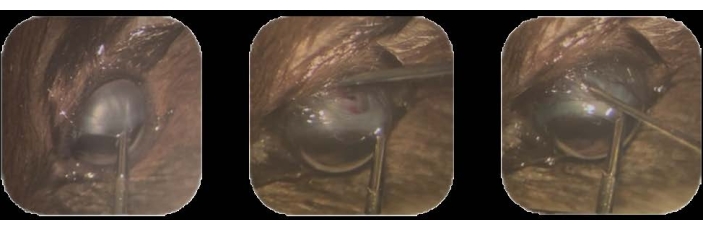
איור 1: חיסון תאי גידול . (A) הלחמית הלימבלית הסופרו-טמפורלית מוחזקת באמצעות מלקחיים תוך עיניים ונמשכת לכיוון מנח אינפרא-אף. (B) קצה של מחט 30 גרם מוכנס כדי לחדור דרך הסקלרה, וכריתה נעשית כדי ליצור מסילה לתוך החלל התת-כורואידי. (C) מזרק עמוס תאים ומורכב במחט 32 G מוכנס למסילה, והתאים מוזרקים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. חיסון תאי מלנומה
- השהה מחדש 70,000 תאי B16LS9 ב-2 μL של PBS. סכום זה מוערך לפי עין.
- טען את התאים לתוך מזרק המילטון סטרילי מזכוכית 10 μL (ראה טבלת חומרים) המורכב עם מחט קהה 32 G מסובבת בזווית של 45 מעלות.
- הכנס את מחט המזרק הטעונה כ -2 מ"מ לתוך הרצועה שנוצרה בשלב 3.
- להזריק 2 μL של השעיית התא.
- החזיקו את המחט במקומה לאחר ההזרקה למשך 2-3 שניות עד שכל הנוזלים התפנו.
- הסירו את המחט על-ידי משיכת המחט החוצה בעדינות ובאיטיות כדי למנוע דליפה מהמסילה (איור 1C).
הערות: התאמת מהירות וכוח ההזרקה יכולה להשפיע על דפוס התפתחות הגידול. מוצע כי פרמטרים אלה יכוילו על ידי אנשים המתנסים כדי לזהות את הכוח והמהירות הנכונים המופעלים. בסך הכל נקבעו 70,000 תאים בניסויים מקדימים. עם זאת, מכיוון שייתכנו שינויים בסוגי תרביות תאים או באצוות או בין זני עכברים, יש צורך בכיול של מספר זה.
5. הערכת מיקום ההזרקה
- יש להתבונן בעין המוזרקת על ידי סריקות OCT מיד לאחר חיסון תאי מלנומה כדי לזהות את המראה של היפרדות רשתית (RD), נזק לרשתית ו / או תאים בזגוגית23.
הערות: יש למרוח מחדש טרופיקמיד, אוקסיבופרוקאין ואתילצלולוז לפי הצורך. - בהתבסס על סריקות OCT משלב 5.1, סווג את דפוסי RD21 לפי: (1) אתר RD-one מקומי של RD; (2) דליפה לתוך חומר התא צופה הזגוגית בזגוגית; (3) אתרים מרובים RD מורחבים של RD.
- לחזות את לוקליזציה הגידול בהתבסס על: (1) גידולים כורואידים מקומיים צפויים RD; (2) דליפה לתוך גידולי הזגוגית הצפויים בזגוגית; (3) גידולים משתנים ומפוזרים מורחבים הצפויים על ידי RD (איור 2).
הערה: רק עכברים עם RD מקומי (כ -50%) צפויים לפתח גידולים המוגבלים לכורואיד.
6. חיזוי גודל הגידול בהתבסס על גובה RD
- למדוד את הגובה של RD מקומי בסריקות OCT באמצעות תוכנת סגמנטציה/ניתוח OCT (ראה טבלת חומרים) ולסווג לפי הקבוצות הבאות: קטן = <300 מיקרומטר; בינוני = 300-400 מיקרומטר; גדול = >400 מיקרומטר.
- להעריך את הנפח אליו צפויים להגיע הגידולים תוך 5 ימים מההזרקה על פי הקריטריונים הבאים:
גובה RD קטן נצפה בדרך כלל בגידולים קטנים (נפח הגידול נע בין 0.0059 מ"מ 3 ל 0.07 מ"מ 3 עם נפח ממוצע של 0.027 ± 0.005 מ"מ3).
גובה RD בינוני נמצא בגידולים קטנים ובינוניים כאחד (נפח הגידול נע בין 0.015 מ"מ 3 ל 0.15 מ"מ 3 עם נפח ממוצע של 0.056 ± 0.016 מ"מ3).
גובה RD גדול קשור למגוון רחב של נפחי גידול עד 0.36 מ"מ3.
הערה: טווח גדלי הגידול הצפויים התקבל מהתוצאות הקודמות וחולק לשלוש קבוצות של גידולים קטנים, בינוניים וגדולים.
7. הליכים לאחר הניתוח
- יש למרוח אופלוקסצין אופתלמי 0.3% באופן מקומי.
- הפוך את ההרדמה על ידי הזרקת atipamezole hydrochloride (3 מ"ג / ק"ג) תת עורית.
- להזריק תת עורית buprenorphine (0.05 מ"ג / ק"ג משקל גוף) פעמיים ביום במשך 3 ימים כדי להפחית את הכאב והסבל של בעלי חיים.
- לאחר 5 ימים לאחר הזרקת תאי מלנומה, להעריך את גודל הגידול על ידי ביצוע השלבים הבאים.
- הרדימו את העכברים כמתואר בשלב 2.1. החל tropicamide (0.5%).
- לבחון את העיניים על ידי סריקות OCT אורכיות וסגיטליות ולהשתמש בתוכנת סגמנטציה/ניתוח OCT למדידת נפח הגידול ולוקליזציה.
- חשב את נפח הגידול באמצעות הנוסחה24: V = a*b*c*6/π (a, b ו- c = אורך, רוחב וגובה, בהתאמה).
- יש לבחון את גודל הגידול כל 2-3 ימים כמתואר בשלבים 7.4.1-7.4.3.
הערה: יש למטב את ההליך אם אתה משתמש בזני עכבר שונים או בקווי תאים שונים.
Access restricted. Please log in or start a trial to view this content.
תוצאות
העיניים נבדקו באמצעות OCT מיד לאחר הזרקת תאי B16LS9. היפרדות רשתית מקומית נצפתה לאחר ההזרקה. העכברים הציגו שלוש תבניות של RD: מוקד (איור 2, פאנל עליון), דליפה לזגוגית (איור 2, פאנל אמצעי) ו-RD מורחב (איור 2, פאנל תחתון). RD מורחב נגרם ככל הנראה על ידי ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
מלנומה של ענבל היא מחלה הרסנית שעבורה יש צורך רב בגישות טיפוליות חדשניות. עם זאת, המחקר על מלנומה ענביה וטיפולים פוטנציאליים מוגבל על ידי האתגרים הטכניים של מלנומה uveal מודלים בעלי חיים 1,25. גידולים עיניים, הנגרמים על ידי הזרקה תוך עינית של תאים סרטניים, משתני?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
מרקוביץ א.ל.: סטבה ביוטק (P), ידע ויצמן (P), EyeYon Medical (C, P), מור איסום (P). (ג) = יועץ; (P) = פטנט. לכל שאר המחברים אין אינטרסים מתחרים.
Acknowledgements
מחקר זה נתמך בחלקו על ידי מענק 1304/20 מהקרן הלאומית למדע (ISF), ישראל, עבור אריה מרקוביץ. אנו מודים לשחר איש-שלום ולעדי יוסיפוביץ, מהמחלקה לפתולוגיה, המרכז הרפואי קפלן, רחובות, ישראל, על ניתוח היסטולוגיה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 10 μL glass syringe (Hamilton Co., Bonaduz, Switzerland) | Hamilton | 721711 | |
| 30 G needles | BD Microbalance | 2025-01 | |
| Atipamezole hydrochloride | Orion Phrma | ||
| B16LS9 cells | from Hans Grossniklaus USA | ||
| Buprenorphine | richter pharma | 102047 | |
| C57BL/6 female mice | Envigo | ||
| Essential vitamin mixture | satorius | 01-025-1A | |
| Fetal bovine serum | rhenium | 10270106 | |
| HEPES | satorius | 03-025-1B | |
| Hydroxyethylcellulose 1.4% eye drops | Fisher Pharmaceutical | 390862 | |
| InSight OCT segmentation software | Phoenix Micron, Inc | ||
| Ketamine | bremer pharma GMBH (medimarket) | 17889 | |
| L-glutamine | satorius | 03-020-1B | |
| Medetomidine | zoetis (vetmarket) | 102532 | |
| Ofloxacin 0.3% eye drops | allergan | E92170 | |
| Optical coherence tomography | Phoenix Micron, Inc | ||
| Oxybuprocaine 0.4% | Fisher Pharmaceutical | 393050 | |
| Penicillin-streptomycin-amphoteracin | satorius | 03-033-1B | |
| Phosphate buffered saline (PBS) | satorius | 02-023-1a | |
| RPMI cell media | satorius | 01-104-1A | |
| Sodium pyruvate | satorius | 03-042-1B | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Tropicamide 0.5% | Fisher Pharmaceutical | 390723 |
References
- Jager, M. J., et al. Uveal melanoma. Nature Reviews Disease Primers. 6 (1), 1-25 (2020).
- Bustamante, P., Piquet, L., Landreville, S., Burnier, J. V. Uveal melanoma pathobiology: Metastasis to the liver. Seminars in Cancer Biology. 71, Academic Press. 65-85 (2021).
- Damato, B. Ocular treatment of choroidal melanoma in relation to the prevention of metastatic death-A personal view. Progress in Retinal and Eye Research. 66, 187-199 (2018).
- Jouhi, S., et al. The small fatal choroidal melanoma study. A survey by the European Ophthalmic Oncology Group. American Journal of Ophthalmology. 202, 100-108 (2019).
- Cao, J., Jager, M. J. Animal eye models for uveal melanoma. Ocular Oncology and Pathology. 1 (3), 141-150 (2015).
- Uner, O. E., Gandrakota, N., Azarcon, C. P., Grossniklaus, H. E. Animal models of uveal melanoma. Annals of Eye Science. 7, 21-30 (2022).
- Yang, H., Dithmar, S., Grossniklaus, H. E. Interferon alpha 2b decreases hepatic micrometastasis in a murine model of ocular melanoma by activation of intrinsic hepatic natural killer cells. Investigative Ophthalmology & Visual Science. 45 (7), 2056-2064 (2004).
- Yang, H., Grossniklaus, H. E. Combined immunologic and anti-angiogenic therapy reduces hepatic micrometastases in a murine ocular melanoma model. Current Eye Research. 31 (6), 557-562 (2006).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Diaz, C. E., Rusciano, D., Dithmar, S., Grossniklaus, H. E. B16LS9 melanoma cells spread to the liver from the murine ocular posterior compartment (PC). Current Eye Research. 18 (2), 125-129 (1999).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Ashur-Fabian, O., et al. Tetrac delayed the onset of ocular melanoma in an orthotopic mouse model. Frontiers in Endocrinology. 12, 632335(2019).
- Elia, G., et al. Mechanisms regulating c-met overexpression in liver-metastatic B16-LS9 melanoma cells. Journal of Cellular Biochemistry. 81 (3), 477-487 (2001).
- Harning, R., Szalay, Z. Ocular metastasis of in vivo and in vitro derived syngeneic murine melanoma. Investigative Ophthalmology & Visual Science. 28 (9), 1599-1604 (1987).
- Ezra-Elia, R., et al. Can an in vivo imaging system be used to determine localization and biodistribution of AAV5-mediated gene expression following subretinal and intravitreal delivery in mice. Experimental Eye Research. 176, 227-234 (2018).
- Notting, I. C., et al. Whole-body bioluminescent imaging of human uveal melanoma in a new mouse model of local tumor growth and metastasis. Investigative Ophthalmology & Visual Science. 46 (5), 1581-1587 (2005).
- Yang, H., et al. In-vivo xenograft murine human uveal melanoma model develops hepatic micrometastases. Melanoma Research. 18 (2), 95-103 (2008).
- Murthy, R. K., Haji, S., Sambhav, K., Grover, S., Chalam, K. V. Clinical applications of spectral domain optical coherence tomography in retinal diseases. Biomedical Journal. 39 (2), 107-120 (2016).
- Drexler, W., et al. Ultrahigh-resolution ophthalmic optical coherence tomography. Nature Medicine. 7 (4), 502-507 (2001).
- Ochakovski, G. A., Fischer, M. D. Phenotyping of mouse models with OCT. Methods in Molecular Biology. 1834, 285-291 (2019).
- Zaks, O., et al. In-vivo imaging for assessing tumor growth in mouse models of ocular melanoma. Experimental Eye Research. 204, 108431(2021).
- Brar, V. S. American Academy of Ophthalmology 2022-2023 BCSC. 2. Fundamentals and principles of ophthalmology. , (2022).
- Duker, J. S., Waheed, N. K., Goldman, D. Handbook of Retinal OCT: Optical Coherence Tomography, 2nd Edition. , Elsevier Health Sciences. (2021).
- Tomayko, M. M., Reynolds, C. P. Determination of subcutaneous tumor size in athymic (nude) mice. Cancer Chemotherapy and Pharmacology. 24 (3), 148-154 (1989).
- Richards, J. R., Yoo, J. H., Shin, D., Odelberg, S. J. Mouse models of uveal melanoma: Strengths, weaknesses, and future directions. Pigment Cell & Melanoma Research. 33 (2), 264(2020).
- Chen, R., et al. Photoacoustic molecular imaging-escorted adipose photodynamic-browning synergy for fighting obesity with virus-like complexes. Nature Nanotechnology. 16 (4), 455-465 (2021).
- Yu, Q., et al. Label-free visualization of early cancer hepatic micrometastasis and intraoperative image-guided surgery by photoacoustic imaging. Journal of Nuclear Medicine. 61 (7), 1079-1085 (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved