A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد امتصاص ونقل وتوزيع إيميداكلوبريد في القمح
In This Article
Summary
يظهر هنا بروتوكول لتحديد امتصاص ونقل وتوزيع إيميداكلوبريد في القمح تحت ظروف الزراعة المائية باستخدام قياس الطيف الكتلي الترادفي اللوني السائل (LC-MS-MS). أظهرت النتائج أنه يمكن امتصاص إيميداكلوبريد بواسطة القمح ، وتم اكتشاف إيميداكلوبريد في كل من جذور القمح وأوراقه.
Abstract
تستخدم مبيدات النيونيكوتينويد ، وهي فئة من المبيدات الحشرية ، على نطاق واسع بسبب طرق عملها الجديدة ، ونشاطها العالي في المبيدات الحشرية ، وامتصاص الجذور القوي. إيميداكلوبريد ، المبيد الحشري الأكثر استخداما في جميع أنحاء العالم ، هو ممثل للجيل الأول من النيونيكوتينويد ويستخدم في مكافحة الآفات للمحاصيل والخضروات وأشجار الفاكهة. مع هذا التطبيق الواسع للإيميداكلوبريد ، اجتذبت بقاياه في المحاصيل تدقيقا متزايدا. في هذه الدراسة تم وضع 15 شتلة قمح في وسط استزراع يحتوي على 0.5 ملغم/لتر أو 5 ملغم/لتر إيميداكلوبريد للاستزراع المائي. تم تحديد محتوى إيميداكلوبريد في جذور وأوراق القمح بعد 1 يوم و 2 أيام و 3 أيام من الزراعة المائية لاستكشاف هجرة وتوزيع إيميداكلوبريد في القمح. أظهرت النتائج أنه تم اكتشاف إيميداكلوبريد في كل من جذور وأوراق نبات القمح ، وكان محتوى إيميداكلوبريد في الجذور أعلى من ذلك الموجود في الأوراق. علاوة على ذلك ، زاد تركيز إيميداكلوبريد في القمح مع زيادة وقت التعرض. بعد 3 أيام من التعرض، احتوت جذور وأوراق القمح في مجموعة المعالجة 0.5 مغ/ل على 4.55 مغ/كغ ± 1.45 مغ/كغ و1.30 مغ/كغ ± 0.08 مغ/كغ إيميداكلوبريد، على التوالي، في حين احتوت جذور وأوراق مجموعة المعالجة 5 مغ/ل على 42.5 مغ/كغ ± 0.62 مغ/كغ و8.71 مغ/كغ ± 0.14 مغ/كغ إيميداكلوبريد، على التوالي. وتسمح نتائج الدراسة الحالية بفهم أفضل لمخلفات مبيدات الآفات في المحاصيل وتوفر مرجعا للبيانات لتقييم المخاطر البيئية لمبيدات الآفات.
Introduction
في الهندسة الزراعية الحالية ، يعد استخدام المبيدات أمرا ضروريا لزيادة غلة المحاصيل. تعمل المبيدات الحشرية Neonicotinoid على تغيير توازن إمكانات الغشاء عن طريق التحكم في مستقبلات الأسيتيل كولين النيكوتين في الجهاز العصبي للحشرات ، وبالتالي تثبيط التوصيل الطبيعي للجهاز العصبي المركزي للحشرات ، مما يؤدي إلى شلل وموت الحشرات1. بالمقارنة مع المبيدات الحشرية التقليدية ، تتمتع مبيدات النيونيكوتينويد بمزايا مثل طرق العمل الجديدة ، والنشاط العالي للمبيدات الحشرية ، وامتصاص الجذور القوي ، مما يجعلها ناجحة للغاية في سوق المبيدات 2,3. تم الإبلاغ عن أن حجم مبيعات مبيدات النيونيكوتينويد يمثل 27٪ من سوق مبيدات الآفات العالمية في عام 2014. كان متوسط معدل النمو السنوي للنيونيكوتينويدات 11.4٪ من 2005 إلى 2010 ، منها حوالي 7٪ تم تسجيلها في الصين 4,5,6. من نهاية عام 2016 إلى النصف الأول من عام 2017 ، بدأت مبيعات المبيدات في الصين في الانتعاش بعد انخفاضها ، واستمرت أسعار المبيدات في الارتفاع ، ومن بينها مبيدات الحشرات neonicotinoid أظهرت زيادة كبيرة في الأسعار7. حتى الآن ، تم تطوير ثلاثة أجيال من المبيدات الحشرية neonicotinoid ، كل منها يحتوي على كلوريد البيريدين ، ثيازوليل ، ومجموعات رباعي هيدروفيوران من النيكوتين ، على التوالي8.
يمثل Imidacloprid الجيل الأول من المبيدات الحشرية neonicotinoid ، التي صيغتها الجزيئية هي C9H10ClN5O2 ، وهي بلورة عديمة اللون. يستخدم Imidacloprid بشكل أساسي لمكافحة الآفات ، مثل حشرات المن ، ونطاطات النبات ، وديدان الوجبة ، والتريبس9 ويمكن تطبيقه على محاصيل مثل الأرز والقمح والذرة والقطن والخضروات مثل البطاطس وكذلك أشجار الفاكهة. بسبب الاستخدام طويل الأجل والكبير والمستمر لمبيدات الآفات ، تم تقليل كل من الحشرات النافعة والأعداء الطبيعيين للآفات بسرعة ، وأصبحت بعض الآفات الزراعية مقاومة للمبيدات ، مما أدى إلى حلقة مفرغة من استخدام كميات مستمرة ومتزايدة من المبيدات10. بالإضافة إلى ذلك ، أدى الاستخدام المكثف لمبيدات الآفات إلى تدهور جودة التربة ، وبقايا مبيدات الآفات المستمرة في المنتجات الزراعية ، والمشاكل البيئية الأخرى ، التي لا تسبب أضرارا كبيرة للبيئة الإيكولوجية الزراعية فحسب، بل تشكل أيضا تهديدا خطيرا لصحة الإنسان12. يؤثر رش المبيدات بشدة على نمو وجودة ميكروبات التربة التربة13. تسبب الاستخدام غير المعقول أو المفرط لمبيدات الآفات في مخاطر أمنية كبيرة على التربة والبيئة المائية والحيوانات والنباتات وحتى حياة الإنسان14. في السنوات الأخيرة ، أصبحت مشكلة بقايا المبيدات المفرطة في المحاصيل أكثر حدة مع الاستخدام المكثف لمبيدات الآفات. عندما تم استخدام إيميداكلوبريد لزيادة محصول الخضروات ، زاد معدل امتصاص إيميداكلوبريد في الخضروات مع زيادة كمية وبقايا إيميداكلوبريد15. كمحصول غذائي رئيسي ، يعد إنتاج القمح وسلامته أمرا بالغ الأهمية. لذلك ، يجب توضيح سياسات المخلفات والتوزيع للمبيدات المستخدمة في القمح.
في السنوات الأخيرة ، تم تطوير العديد من الطرق لاستخراج بقايا إيميداكلوبريد من الماء والتربة والنباتات. طريقة QuEChERS (سريعة وسهلة ورخيصة وفعالة ومتينة وآمنة) هي طريقة جديدة تجمع بين تقنية الاستخراج الدقيق للمرحلة الصلبة وتكنولوجيا استخراج الطور الصلب المشتت وتتضمن استخدام الأسيتونيتريل كمذيب استخراج وإزالة الشوائب المختلطة والماء في العينة باستخدام كلوريد الصوديوم و MgSO4 اللامائي ، على التوالي16. تتطلب طريقة QuEChERS الحد الأدنى من الأواني الزجاجية ولها خطوات تجريبية بسيطة ، مما يجعلها واحدة من أكثر طرق استخراج المبيدات شيوعا17. للكشف عن إيميداكلوبريد ، تم تحقيق حد كشف منخفض يصل إلى 1 × 10−9 جم18 باستخدام كروماتوغرافيا سائلة (LC) ، وتم تحقيق 1 × 10−11 g 19 باستخدام كروماتوغرافيا الغاز (GC). نظرا لدقتها العالية وحساسيتها ، أظهرت LC-MS و GC-MS حدودا أقل للكشف عن إيميداكلوبريد من 1 × 10-13 إلى 1 × 10-14 جم20,21 ؛ وبالتالي ، فإن هذه التقنيات مناسبة تماما لتحليل بقايا إيميداكلوبريد النزرة.
في هذه الدراسة ، تم اختيار إيميداكلوبريد كملوث مستهدف ، وتم اختيار القمح كمحصول اختبار لدراسة توزيع بقايا إيميداكلوبريد في القمح. يفصل هذا البروتوكول طريقة للتحليل الشامل لتخصيب ونقل مبيد الآفات إيميداكلوبريد في القمح من خلال استكشاف امتصاص وتخزين إيميداكلوبريد في أجزاء مختلفة من نباتات القمح المزروعة في ظل ظروف الزراعة المائية. تهدف هذه الدراسة إلى توفير أساس نظري لتقييم مخاطر بقايا مبيدات الآفات في القمح ، وتوجيه التطبيق الرشيد لمبيدات الآفات في أنشطة الإنتاج الزراعي لتقليل بقايا المبيدات ، وتحسين سلامة إنتاج المحاصيل.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. إنبات بذور القمح
- اختر 1000 بذرة قمح (Jimai 20) مع حبيبات كاملة وأجنة سليمة وحجم موحد (الطول: 6 مم ± 0.5 مم).
- انقل 333.3 مل من محلول 30٪ H 2O 2 إلى دورق حجمي سعة 1 لتر وخفف بالماء منزوع الأيونات لتحضير 1 لتر من محلول H2 O2 10٪. اغمر بذور القمح في محلول 10٪ H 2 O2لمدة 15 دقيقة لتطهير سطح البذور (الشكل 1).
- شطف بذور القمح 5x بالماء المعقم الجاري لمدة 10 ثوان في كل مرة.
- انشر بذور القمح بالتساوي مع توجيه الأجنة لأعلى في طبق بتري زجاجي يحتوي على ورق ترشيح معقم رطب (الشكل 2). ضع طبق بتري في حاضنة مناخ اصطناعي عند 30 درجة مئوية ورطوبة نسبية 80٪. استزرع بذور القمح في الظلام لمدة 3 أيام حتى تنبت وتتجذر.

الشكل 1: تطهير بذور القمح. تم نقع بذور القمح في محلول 10٪ H 2 O2(في دورق) لمدة 15 دقيقة لتطهير سطح البذور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 2: إنبات بذور القمح. تم نشر بذور القمح بالتساوي في طبق بتري زجاجي يحتوي على ورق ترشيح معقم رطب. تم وضع طبق بتري في حاضنة مناخية اصطناعية لإنبات بذور القمح. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. زراعة شتلات القمح
- قم بإذابة 551 مجم من خليط الملح القاعدي Hoagland في 1 لتر من الماء منزوع الأيونات لتحضير 1/2 محلول مغذي Hoagland (يحتوي على 0.75 مليمول / لتر K2SO 4 ، 0.1 مليمول / لتر KCl ، 0.6 مليمول / لتر MgSO 4 ، 4.0 × 10−2 مليمول / لتر FeEDTA ، 1.0 × 10−3 مليمول / لتر H 3 BO3 ، 1.0 × 10−3 مليمول / لتر MnSO4 ، 1.0 × 10−3 ملليمول/لتر ZnSO 4، 1.0 × 10−4 ملليمول/لتر CuSO 4، و5.0 × 10−6 ملليمول/لتر Na2 MoO 4).
- بعد أن تنبت بذور القمح (الخطوة 1.4) ، ضع 15 شتلة قمح في معدات الزراعة المائية (انظر جدول المواد) تحتوي على 100 مل من 1/2 محلول مغذي Hoagland للزراعة المائية (الشكل 3). ضع جهاز الزراعة المائية بالكامل في حاضنة مناخية اصطناعية (انظر جدول المواد) واحتضانها لمدة 7 أيام عند 25 درجة مئوية ورطوبة نسبية 80٪ مع فترة ضوئية مظلمة لمدة 16 ساعة / 8 ساعات.

الشكل 3: الزراعة المائية لشتلات القمح. تمت زراعة شتلات القمح في الماء لمدة 0 يوم و 3 أيام و 7 أيام في 100 مل من محلول مغذي Hoagland. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. تجربة تعريض نباتات القمح لمحلول إيميداكلوبريد
- بعد فترة الزراعة المائية لمدة 7 أيام ، قم بزرع نباتات القمح في محلول مغذي Hoagland يحتوي على 0.5 مجم / لتر أو 5 مجم / لتر إيميداكلوبريد لإجراء تجارب التعرض لإيميداكلوبريد. تنمو 15 نبات القمح في كل جهاز مائي. قم بإعداد 15 جهازا مائيا لكل مجموعة تركيز إيميداكلوبريد لضمان أخذ عينات كافية أثناء أخذ العينات.
- ضع معدات الزراعة المائية بأكملها في حاضنة مناخ اصطناعي لمدة 3 أيام عند 25 درجة مئوية ورطوبة نسبية 80٪ مع فترة ضوئية مظلمة لمدة 16 ساعة / 8 ساعات.
- طوال فترة التعرض ، اجمع جذور القمح (0.2 جم لكل نبات قمح) والأوراق (0.5 جم لكل نبات قمح) يوميا. دمج عينات القمح من كل جهاز مائي خامس كمجموعة متوازية وتحديد محتوى إيميداكلوبريد للعينات.
4. إجراء استخراج إيميداكلوبريد من القمح
- استخراج إيميداكلوبريد من جذور القمح
- لتجنب الأخطاء التجريبية ، اغسل جذور القمح 4x بالماء المعقم الجاري لمدة 10 ثوان في كل مرة لإزالة أي إيميداكلوبريد ممتز على سطح الجذر.
- قطعي جذور القمح إلى قطع حوالي 1 سم بالمقص (الشكل 4). تزن 10.00 جم من جذور القمح المبشورة وتوضع في أنبوب طرد مركزي سعة 50 مل.
- أضف 10 مل من الأسيتونيتريل إلى أنبوب الطرد المركزي ودوامة الأنبوب على دوامة لمدة 1 دقيقة. ثم أضف 4 جم من MgSO4 اللامائي و 1.5 جم من كلوريد الصوديوم إلى أنبوب الطرد المركزي ودوامة الأنبوب على الفور لمدة 30 ثانية. جهاز طرد مركزي الأنبوب لمدة 5 دقائق عند 6000 × جم.
- نضح المادة الطافية بحقنة يمكن التخلص منها وتمريرها عبر مرشح حقنة (حجم مسام 0.22 ميكرومتر) للحصول على العينة.
- استخراج إيميداكلوبريد من أوراق القمح (الشكل 5)
- قطعي أوراق القمح الطازج إلى قطع بحجم 1 سم تقريبا بالمقص (الشكل 4). تزن 10.00 جم من أوراق القمح المقطعة وتوضع في أنبوب طرد مركزي سعة 50 مل.
- أضف 10 مل من الأسيتونيتريل إلى أنبوب الطرد المركزي ودوامة الأنبوب على دوامة لمدة 1 دقيقة.
- أضف 4 جم من MgSO4 اللامائي و 1.5 جم من كلوريد الصوديوم إلى أنبوب الطرد المركزي ودوامة الأنبوب على الفور لمدة 30 ثانية.
- جهاز طرد مركزي الأنبوب لمدة 5 دقائق عند 6000 × جم.
- بعد الطرد المركزي ، أضف 2 مل من المادة الطافية إلى أنبوب طرد مركزي سعة 5 مل يحتوي على 50 مجم من أسود الكربون الجرافيتي (GCB) و 150 مجم من MgSO4 اللامائي (لإزالة الصباغ والرطوبة من العينة) ، ودوامة أنبوب الطرد المركزي لمدة 30 ثانية (الشكل 6). جهاز طرد مركزي الأنبوب لمدة 5 دقائق عند 6000 × جم.
- نضح المادة الطافية بحقنة يمكن التخلص منها وتمريرها عبر مرشح حقنة (حجم مسام 0.22 ميكرومتر) للحصول على العينة.

الشكل 4: جذور وأوراق القمح المبشورة. تم تمزيق جذور وأوراق القمح الطازج باستخدام المقص إلى قطع حوالي 1 سم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: استخلاص إيميداكلوبريد في أوراق القمح. تم استخراج إيميداكلوبريد في العينات باستخدام طريقة QuEChERS (الخطوات 4.2.1-4.2.4 من البروتوكول). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: تنقية إيميداكلوبريد في أوراق القمح. كان التطهير 50 ملغ GCB + 150 ملغ MgSO4. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. القياس الكمي للإيميداكلوبريد
- تحديد كمية الإيميداكلوبريد في العينة باستخدام مطياف الكتلة الترادفي اللوني السائل (LC-MS-MS) ، بناء على منحنى قياسي (y = 696.61x + 56.411 ، R = 1) تم الحصول عليه من 0.2-250 ميكروغرام / لتر تركيزات إيميداكلوبريد. (الشكل 7). تم تجهيز مطياف الكتلة بعمود C18 (100 مم × 2.1 مم ، 3 ميكرومتر) ومصدر تأين بالرش الكهربائي (ESI +). يتم عرض برنامج الشطف ومعلمات مصدر الأيونات في الجدول 1.
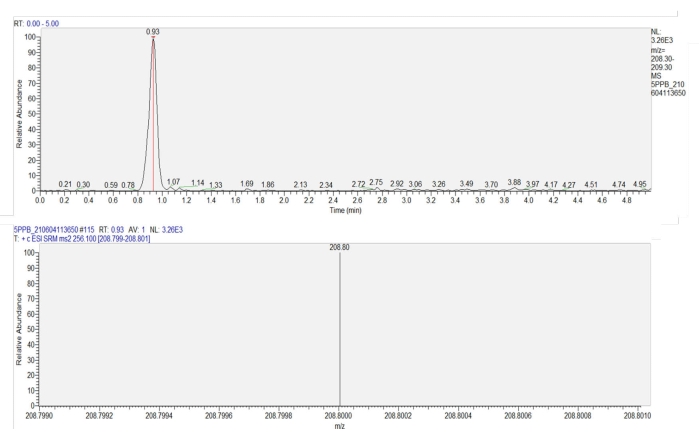
الشكل 7: مخطط كروماتوجرام ومطياف كتلي للإيميداكلوبريد في أوراق القمح. تظهر اللوحة العلوية كروماتوجرام إيميداكلوبريد (وقت الاحتفاظ = 0.93 دقيقة). تظهر اللوحة السفلية مخطط الطيف الكتلي للإيميداكلوبريد عند 0.93 دقيقة ، مما يدل على شدة استجابة إنتاج (م / ض = 208.8) من إيميداكلوبريد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| درجة حرارة العمود | 40 درجة مئوية |
| المذيب أ | 99.9٪ ماء / 0.1٪ حمض الفورميك (V / V) |
| المذيب ب | الأسيتونيتريل |
| برنامج الشطف | 0-0.5 دقيقة ، أ = 20٪ |
| 0.5-2 دقيقة ، أ = 20٪ - 50٪ | |
| 2-3 دقائق ، أ = 50٪ | |
| 3-3.1 دقيقة ، أ = 50٪ - 20٪ | |
| 3.1-5 دقائق، A=20٪ | |
| معدل التدفق (مل / دقيقة) | 0.3 |
| حجم الحقن (ميكرولتر) | 5 |
| درجة حرارة الشعيرات الدموية (°C) | 330 |
| درجة حرارة المرذاذ (°C) | 350 |
| معدل تدفق الغاز غمد (Arb) | 40 |
| معدل تدفق غاز Aux (Arb) | 20 |
| رذاذ الجهد (V) | 3900 |
| ضغط غاز الاصطدام (mTorr) | 1.5 |
| أيون السلائف | 256.1 |
| طاقة أيون المنتج / الاصطدام (eV) | 208.8/16 |
الجدول 1: برنامج الشطف ومعلمات مصدر الأيونات لطريقة كروماتوغرافيا السائل - قياس الطيف الكتلي.
Access restricted. Please log in or start a trial to view this content.
النتائج
وكان حد أداة الكشف (LOD) للإيميداكلوبريد 5.76 × 10-14 غرام، وكان متوسط ضغط الدم في طريقة إيميداكلوبريد في جذر القمح أو ورقته 0.01 ميكروغرام/كغ؛ لم يلاحظ أي تأثير مصفوفة. ويبين الجدول 2 غلة استرداد الإيميداكلوبريد في القمح. كانت غلة استرداد إيميداكلوبريد من جذور القمح المعرضة لتركيز?...
Access restricted. Please log in or start a trial to view this content.
Discussion
في السنوات الأخيرة ، تم الإبلاغ بشكل متكرر عن طرق المعالجة المسبقة والكشف عن بقايا مبيد الآفات إيميداكلوبريد. استخدم بدوي وآخرون 23 كروماتوغرافيا سائلة عالية الأداء لتحديد محتوى إيميداكلوبريد في ثمار الطماطم المزروعة في ظروف الدفيئة وأبلغوا عن خطية جيدة للإيميداكلوبريد في ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم تضارب في المصالح. لقد قرأ جميع المؤلفين المخطوطة ووافقوا عليها. لم يتم نشر هذا العمل من قبل ، ولا يتم النظر فيه من قبل أي مجلة أخرى تمت مراجعتها من قبل الأقران.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 42277039).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | 01-06-1995 | Suitable for HPLC, gradient grade, >99.9% |
| Analytical balance | Sartorius Lab Instruments Co.Ltd. | GL124-1SCN | |
| Artificial climate incubator | Shanghai Badian Instrument Equipment Co. Ltd. | HK320 | |
| Centrifuge | Eppendorf China Co. Ltd. | Centrifuge5804 | |
| Disposable syringe | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Z116866 | Capacity 5 mL, graduated 0.2 mL, non-sterile |
| Formic acid | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Y0001970 | European pharmacopoeia reference standard |
| Graphitized carbon black (GCB) | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | V900058 | 45 μm |
| H2O2 | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | 31642 | 30% (w/w) |
| Hoagland’s Basal Salt Mixture | Shanghai Yu Bo Biotech Co. Ltd. | NS1011 | Anhydrous, reagent grade |
| Hydroponic equipment | Jiangsu Rongcheng Agricultural Science and Technology Development Co.Ltd. | SDZ04BD | |
| Hypersil BDS C18 column | Thermo Fisher Scientific (China) Co. Ltd. | 28103-102130 | |
| Imidacloprid | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Y0002028 | European pharmacopoeia reference standard |
| MgSO4 | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | 208094 | Anhydrous, reagent grade, >97% |
| NaCl | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | S9888 | Reagent grade, 99% |
| pH meter | Shanghai Thunder Magnetic Instrument Factory | PHSJ-3F | |
| Phytotron box | Harbin Donglian Electronic Technology Co. Ltd. | HPG-280B | |
| Pipettes | Eppendorf China Co. Ltd. | Research plus | |
| Syringe filter | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | SLGV033N | Nylon, 0.22 µm pore size, 33 mm, non-sterile |
| Ultra performance liquid chromatography tandem triple quadrupole mass spectrometry | Thermo Fisher Scientific (China) Co. Ltd. | UltiMate 3000 | |
| TSQ Quantum Access MAX | |||
| Vortex mixer | Shanghai Yetuo Technology Co. Ltd. | Vortex-2 | |
| Wheat seed | LuKe seed industry | Jimai 20 |
References
- Lin, P. C., Lin, H. J., Liao, Y. Y., Guo, H. R., Chen, K. T. Acute poisoning with neonicotinoid insecticides: A case report and literature review. Basic & Clinical Pharmacology & Toxicology. 112 (4), 282-286 (2013).
- North, J. H., et al. Value of neonicotinoid insecticide seed treatments in Mid-South corn (Zea mays) production systems. Journal of Economic Entomology. 111 (1), 187-192 (2018).
- Simon-Delso, N., et al. Systemic insecticides (neonicotinoids and fipronil): Trends, uses, mode of action and metabolites. Environmental Science and Pollution Research. 22 (1), 5-34 (2015).
- Bass, C., Denholm, I., Williamson, M. S., Nauen, R. The global status of insect resistance to neonicotinoid insecticides. Pesticide Biochemistry and Physiology. 121, 78-87 (2015).
- Craddock, H. A., Huang, D., Turner, P. C., Quiros-Alcala, L., Payne-Sturges, D. C. Trends in neonicotinoid pesticide residues in food and water in the United States, 1999-2015. Environmental Health. 18 (1), 7(2019).
- Shao, X. S., Liu, Z. W., Xu, X. Y., Li, Z., Qian, X. H. Overall status of neonicotinoid insecticides in China: Production, application and innovation. Journal of Pesticide Science. 38 (1-2), 1-9 (2013).
- Zhao, Y., et al. Urinary neonicotinoid insecticides in children from South China: Concentrations, profiles and influencing factors. Chemosphere. 291, 132937(2022).
- Kurwadkar, S., Evans, A. Neonicotinoids: Systemic insecticides and systematic failure. Bulletin of Environmental Contamination and Toxicology. 97 (6), 745-748 (2016).
- Sadaria, A. M., et al. Passage of fiproles and imidacloprid from urban pest control uses through wastewater treatment plants in northern California, USA. Environmental Toxicology and Chemistry. 36 (6), 1473-1482 (2017).
- Damalas, C. A., Eleftherohorinos, I. G. Pesticide exposure, safety issues, and risk assessment indicators. International Journal of Environmental Research and Public Health. 8 (5), 1402-1419 (2011).
- Hayes, T. B., et al. Demasculinization and feminization of male gonads by atrazine: Consistent effects across vertebrate classes. Journal of Steroid Biochemistry and Molecular Biology. 127 (1-2), 64-73 (2011).
- Rani, L., et al. An extensive review on the consequences of chemical pesticides on human health and environment. Journal of Cleaner Production. 283, 124657(2021).
- Xu, Y. Q., et al. Ecotoxicity evaluation of azoxystrobin on Eisenia fetida in different soils. Environmental Research. 194, 110705(2021).
- Yavari, S., Malakahmad, A., Sapari, N. B. Biochar efficiency in pesticides sorption as a function of production variables-A review. Environmental Science and Pollution Research. 22 (18), 13824-13841 (2015).
- Delcour, I., Spanoghe, P., Uyttendaele, M. Literature review: Impact of climate change on pesticide use. Food Research International. 68, 7-15 (2015).
- Zhang, C. Y., et al. The application of the QuEChERS methodology in the determination of antibiotics in food: A review. TrAC-Trends in Analytical Chemistry. 118, 517-537 (2019).
- Wiilkowska, A., Biziuk, M. Determination of pesticide residues in food matrices using the QuEChERS methodology. Food Chemistry. 125 (3), 803-812 (2011).
- Ishii, Y., et al. HPLC determination of the new insecticide imidacloprid and its behavior in rice and cucumber. Journal of Agricultural and Food Chemistry. 42 (12), 2917-2921 (1994).
- Ko, A. Y., et al. Development of a simple extraction and oxidation procedure for the residue analysis of imidacloprid and its metabolites in lettuce using gas chromatography. Food Chemistry. 148, 402-409 (2014).
- Yuan, W. L., et al. Application of imidacloprid controlled-release granules to enhance the utilization rate and control wheat aphid on winter wheat. Journal of Integrative Agriculture. 19 (12), 3045-3053 (2020).
- Phugare, S. S., Kalyani, D. C., Gaikwad, Y. B., Jadhav, J. P. Microbial degradation of imidacloprid and toxicological analysis of its biodegradation metabolites in silkworm (Bombyx mori). Chemical Engineering Journal. 230, 27-35 (2013).
- Li, Y., et al. Uptake, translocation and accumulation of imidacloprid in six leafy vegetables at three growth stages. Ecotoxicology and Environmental Safety. 164, 690-695 (2018).
- Badawy, M. E. I., Ismail, A. M. E., Ibrahim, A. I. H. Quantitative analysis of acetamiprid and imidacloprid residues in tomato fruits under greenhouse conditions. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes. 54 (11), 898-905 (2019).
- Zhai, R. Q., et al. Residue, dissipation pattern, and dietary risk assessment of imidacloprid in Chinese chives. Frontiers in Nutrition. 9, 846333(2022).
- Aria, M. M., et al. Uptake and translocation monitoring of imidacloprid to chili and tomato plants by molecularly imprinting extraction - ion mobility spectrometry. Microchemical Journal. 144, 195-202 (2019).
- Chen, Y., et al. Translocation and metabolism of imidacloprid in cabbage: Application of C-14-labelling and LC-QTOF-MS. Chemosphere. 263, 127928(2021).
- Wild, S., Jones, K. Organic chemicals entering agricultural soils in sewage sludges: Screening for their potential to transfer to crop plants and livestock. Science of the Total Environment. 119, 85-119 (1992).
- Gong, W. W., et al. Uptake and dissipation of metalaxyl-M, fludioxonil, cyantraniliprole and thiamethoxam in greenhouse chrysanthemum. Environmental Pollution. 257, 113499(2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved