Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Buğdayda Imidacloprid'in Emiliminin, Translokasyonunun ve Dağılımının Belirlenmesi
Bu Makalede
Özet
Burada, sıvı kromatografi-tandem kütle spektrometresi (LC-MS-MS) kullanılarak hidroponik koşullar altında buğdayda imidaklopridin emiliminin, translokasyonunun ve dağılımının belirlenmesi için bir protokol sunulmaktadır. Sonuçlar, imidacloprid'in buğday tarafından emilebileceğini ve imidacloprid'in hem buğday köklerinde hem de yapraklarında tespit edildiğini gösterdi.
Özet
Bir insektisit sınıfı olan neonikotinoidler, yeni etki tarzları, yüksek böcek öldürücü aktiviteleri ve güçlü kök alımları nedeniyle yaygın olarak kullanılmaktadır. Dünya çapında en yaygın kullanılan insektisit olan imidakloprid, temsili bir birinci nesil neonikotinoiddir ve mahsuller, sebzeler ve meyve ağaçları için haşere kontrolünde kullanılır. Bu kadar geniş bir imidakloprid uygulamasıyla, mahsullerdeki kalıntısı giderek artan bir inceleme çekmiştir. Bu çalışmada, hidrokültür için 0.5 mg / L veya 5 mg / L imidacloprid içeren bir kültür ortamına 15 buğday fidesi yerleştirildi. Buğday kökleri ve yapraklarındaki imidacloprid içeriği, buğdayda imidacloprid'in göçünü ve dağılımını araştırmak için 1 gün, 2 gün ve 3 günlük hidrokültürden sonra belirlenmiştir. Sonuçlar, imidacloprid'in buğday bitkisinin hem köklerinde hem de yapraklarında tespit edildiğini ve köklerdeki imidacloprid içeriğinin yapraklardakinden daha yüksek olduğunu göstermiştir. Ayrıca, buğdaydaki imidacloprid konsantrasyonu, maruz kalma süresinin artmasıyla artmıştır. 3 günlük maruziyetten sonra, 0.5 mg / L tedavi grubundaki buğdayın kökleri ve yaprakları sırasıyla 4.55 mg / kg ± 1.45 mg / kg ve 1.30 mg / kg ± 0.08 mg / kg imidakloprid içerirken, 5 mg / L tedavi grubunun kökleri ve yaprakları 42.5 mg / kg ± 0.62 mg / kg ve 8.71 mg / kg ± 0.14 mg / kg imidakloprid içeriyordu, sırasıyla. Bu çalışmanın sonuçları, ürünlerdeki pestisit kalıntılarının daha iyi anlaşılmasını sağlamakta ve pestisitlerin çevresel risk değerlendirmesi için bir veri referansı sağlamaktadır.
Giriş
Günümüz tarımında, pestisitlerin kullanımı mahsul verimini artırmak için esastır. Neonikotinoid insektisitler, böcek sinir sistemindeki nikotinik asetilkolin reseptörlerini kontrol ederek membran potansiyel dengesini değiştirir, böylece böcek merkezi sinir sisteminin normal iletimini inhibe eder, böceklerin felce ve ölümüne yol açar1. Geleneksel insektisitlerle karşılaştırıldığında, neonikotinoidlerin yeni etki modları, yüksek böcek öldürücü aktivite ve güçlü kök emilimi gibi avantajları vardır, bu da onları pestisit pazarında oldukça başarılı kılar 2,3. Neonikotinoidlerin satış hacminin 2014 yılında dünya pestisit pazarının% 27'sini oluşturduğu bildirilmiştir. Neonikotinoidlerin yıllık ortalama büyüme oranı 2005'ten 2010'a kadar% 11.4 idi ve bunun yaklaşık% 7'si Çin'de kaydedildi 4,5,6. 2016'nın sonundan 2017'nin ilk yarısına kadar, Çin'deki pestisit satışları düştükten sonra toparlanmaya başladı ve neonikotinoid insektisitlerin önemli bir fiyat artışı gösterdiği pestisit fiyatları artmaya devam etti7. Şimdiye kadar, her biri sırasıylapiridin klorür, tiyazolil ve tetrahidrofuran nikotin grupları içeren üç nesil neonikotinoid insektisit geliştirilmiştir 8.
Imidacloprid, moleküler formülü C9H10ClN5O2 olan ve renksiz bir kristal olan ilk nesil neonikotinoid insektisitleri temsil eder. Imidacloprid, esas olarak yaprak bitleri, planthoppers, mealworms ve thrips9 gibi zararlıları kontrol etmek için kullanılır ve pirinç, buğday, mısır, pamuk gibi ürünlere ve patates gibi sebzelere ve meyve ağaçlarına uygulanabilir. Pestisitlerin uzun vadeli, önemli ve sürekli uygulanması nedeniyle, hem faydalı böcekler hem de zararlıların doğal düşmanları hızla azalmış ve bazı tarımsal zararlılar pestisitlere karşı dirençli hale gelmiş, bu da sürekli ve artan miktarlarda pestisit uygulama kısır döngüsüne neden olmuştur10. Buna ek olarak, pestisitlerin yaygın olarak uygulanması, toprak kalitesinin bozulmasına, tarım ürünlerinde kalıcı pestisit kalıntılarına ve sadece tarımsal ekolojik çevreye önemli zararlar vermekle kalmayıp aynı zamanda insan sağlığı için de ciddi bir tehdit oluşturan diğer ekolojik sorunlara yol açmıştır112. Pestisit püskürtme, toprak mikroplarının ve toprak hayvanlarının büyümesini ve kalitesini ciddi şekilde etkiler13. Pestisitlerin mantıksız veya aşırı kullanımı, toprak ve su ortamı, hayvanlar ve bitkiler ve hatta insan yaşamı için önemli güvenlik risklerine neden olmuştur14. Son yıllarda, pestisitlerin yaygın olarak uygulanması ile ürünlerde aşırı pestisit kalıntıları sorunu daha da şiddetlenmiştir. Sebze verimini arttırmak için imidacloprid kullanıldığında, sebzelerde imidacloprid'in emilim oranı, imidacloprid15'in miktarındaki ve kalıntısındaki artışla artmıştır. Önemli bir gıda ürünü olarak, buğdayın hem üretimi hem de güvenliği kritik öneme sahiptir. Bu nedenle buğday için kullanılan pestisitlerin kalıntı ve dağıtım politikalarının netleştirilmesi gerekmektedir.
Son yıllarda, imidacloprid kalıntılarını sudan, topraktan ve bitkilerden çıkarmak için birçok yöntem geliştirilmiştir. QuEChERS yöntemi (hızlı, kolay, ucuz, etkili, sağlam ve güvenli), katı fazlı mikroekstraksiyon teknolojisini ve dağınık katı faz ekstraksiyon teknolojisini birleştiren ve ekstraksiyon çözücüsü olarak asetonitril kullanımını ve sırasıyla NaCl ve susuz MgSO4 kullanılarak numunedeki karışık safsızlıkların ve suyun uzaklaştırılmasını içeren yeni bir yöntemdir16. QuEChERS yöntemi minimum cam eşya gerektirir ve basit deneysel adımlara sahiptir, bu da onu en popüler pestisit ekstraksiyon yöntemlerinden biri haline getirir17. İmidaklopridin tespiti için, sıvı kromatografisi (LC) ile 1 × 10−9 g18 kadar düşük bir tespit sınırına ve gaz kromatografisi (GC) ile 1 × 10−11 g19 kadar düşük bir tespit sınırına ulaşılmıştır. Yüksek çözünürlükleri ve hassasiyetleri nedeniyle, LC-MS ve GC-MS, 1 × 10-13 ila 1 × 10-14 g20,21 arasında daha düşük imidakloprid tespit sınırları göstermiştir; Bu nedenle, bu teknikler eser imidacloprid kalıntılarının analizi için çok uygundur.
Bu çalışmada, hedef kirletici olarak imidacloprid seçildi ve buğdaydaki imidacloprid kalıntılarının dağılımını incelemek için test ürünü olarak buğday seçildi. Bu protokol, hidroponik koşullar altında yetiştirilen buğday bitkilerinin farklı kısımlarında imidacloprid'in emilimini ve depolanmasını araştırarak, buğdaydaki pestisit imidacloprid'in zenginleştirilmesi ve transferinin kapsamlı analizi için bir yöntemi detaylandırmaktadır. Bu çalışma, buğdaydaki pestisit kalıntılarının risk değerlendirmesi için teorik bir temel sağlamayı, pestisit kalıntılarını azaltmak için pestisitlerin tarımsal üretim faaliyetlerinde akılcı uygulamasına rehberlik etmeyi ve bitkisel üretimin güvenliğini artırmayı amaçlamaktadır.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Buğday tohumlarının çimlenmesi
- Tam granüllere, bozulmamış embriyolara ve homojen boyuta (uzunluk: 6 mm ± 0,5 mm) sahip 1.000 buğday tohumu (Jimai 20) seçin.
- 333.3 mL% 30 H2 O2 çözeltisini 1 L'lik bir hacimsel şişeye aktarın ve 1 L% 10 H2O2 çözeltisi hazırlamak için deiyonize su ile seyreltin. Tohum yüzeyini dezenfekte etmek için buğday tohumlarını 15 dakika boyunca% 10H2O2 çözeltisine daldırın (Şekil 1).
- Buğday tohumlarını her seferinde 10 s boyunca akan steril suyla 5 kat durulayın.
- Buğday tohumlarını, embriyolar nemli steril filtre kağıdı içeren bir cam Petri kabına bakacak şekilde eşit olarak yayın (Şekil 2). Petri kabını yapay bir iklim inkübatörüne 30 ° C ve% 80 bağıl nemde yerleştirin. Buğday tohumlarını çimlenene ve kök salana kadar 3 gün boyunca karanlıkta kültürleyin.

Resim 1: Buğday tohumlarının dezenfeksiyonu. Buğday tohumları, tohum yüzeyini dezenfekte etmek için 15 dakika boyunca% 10 H2O2çözeltisine (bir beherde) batırıldı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Şekil 2: Buğday tohumlarının çimlenmesi. Buğday tohumları, nemli steril filtre kağıdı içeren bir cam Petri kabına eşit olarak yayıldı. Petri kabı, buğday tohumlarını çimlendirmek için yapay bir iklim inkübatörüne yerleştirildi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
2. Buğday fidanı yetiştiriciliği
- 1/2 Hoagland besin çözeltisi hazırlamak için 551 mg Hoagland'ın bazal tuz karışımını 1 L deiyonize suda çözün (0.75 mmol / L K2SO 4, 0.1 mmol / L KCl, 0.6 mmol / L MgSO 4, 4.0 × 10−2 mmol / L FeEDTA, 1.0 × 10−3 mmol / L H 3 BO 3, 1.0 × 10−3 mmol / L MnSO 4, 1.0 × 10−3 mmol/L ZnSO 4, 1.0 × 10−4 mmol/L CuSO 4 ve 5.0 × 10−6 mmol/L Na2 MoO 4).
- Buğday tohumları (adım 1.4) çimlendikten sonra, hidroponik için 100 mL 1/2 Hoagland besin çözeltisi içeren hidroponik ekipmana (Malzeme Tablosuna bakınız) 15 buğday fidesi yerleştirin (Şekil 3). Tüm hidroponik aparatı yapay bir iklim inkübatörüne yerleştirin ( Malzeme Tablosuna bakınız) ve 7 gün boyunca 25 ° C'de ve% 80 bağıl nemde 16 saat ışık / 8 saat karanlık fotoperiyotta inkübe edin.

Şekil 3: Buğday fidelerinin topraksız yetiştiriciliği. Buğday fideleri, 100 mL 1/2 Hoagland besin çözeltisinde 0 gün, 3 gün ve 7 gün boyunca hidroponik olarak yetiştirildi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
3. Buğday bitkilerini imidacloprid çözeltisine maruz bırakan deney
- 7 günlük bir hidroponik periyottan sonra, imidacloprid maruz kalma deneylerini yürütmek için buğday bitkilerini 0.5 mg / L veya 5 mg / L imidacloprid içeren 1/2 Hoagland besin çözeltisine nakledin. Her hidroponik cihazda 15 buğday bitkisi yetiştirin. Numune alma sırasında yeterli numunenin alındığından emin olmak için her imidacloprid konsantrasyon grubu için 15 hidroponik cihaz kurun.
- Tüm hidroponik ekipmanı, 16 saat ışık / 8 saat karanlık fotoperiyot ile 25 ° C'de ve% 80 bağıl nemde 3 gün boyunca yapay bir iklim inkübatörüne yerleştirin.
- Maruz kalma süresi boyunca, günlük buğday kökleri (buğday bitkisi başına 0.2 g) ve yaprakları (buğday bitkisi başına 0.5 g) toplayın. Her beşinci hidroponik cihazdan alınan buğday örneklerini paralel bir grup olarak entegre edin ve numunelerin imidacloprid içeriğini belirleyin.
4. Buğdaydan imidacloprid ekstraksiyonu prosedürü
- Buğday köklerinden imidacloprid ekstraksiyonu
- Deneysel hataları önlemek için, kök yüzeyinde adsorbe edilen imidacloprid'i çıkarmak için buğday köklerini her seferinde 10 saat boyunca akan steril suyla 4 kat yıkayın.
- Buğday köklerini makasla yaklaşık 1 cm'lik parçalara ayırın (Şekil 4). Parçalanmış buğday köklerinin 10.00 gramını tartın ve 50 mL'lik bir santrifüj tüpüne yerleştirin.
- Santrifüj tüpüne 10 mL asetonitril ekleyin ve tüpü 1 dakika boyunca bir vorteks üzerinde vorteks edin. Daha sonra, santrifüj tüpüne 4 g susuz MgSO4 ve 1.5 g NaCl ekleyin ve tüpü hemen 30 s boyunca vorteks edin. Tüpü 6.000 x g'de 5 dakika boyunca santrifüjleyin.
- Süpernatantı tek kullanımlık bir şırınga ile aspire edin ve numuneyi elde etmek için bir şırınga filtresinden (0.22 μm gözenek boyutu) geçirin.
- Buğday yapraklarından imidacloprid ekstraksiyonu (Şekil 5)
- Taze buğday yapraklarını makasla yaklaşık 1 cm'lik parçalara ayırın (Şekil 4). 10.00 g rendelenmiş buğday yaprağını tartın ve 50 mL'lik bir santrifüj tüpüne yerleştirin.
- Santrifüj tüpüne 10 mL asetonitril ekleyin ve tüpü 1 dakika boyunca bir vorteks üzerinde vorteks edin.
- Santrifüj tüpüne 4 g susuz MgSO4 ve 1.5 g NaCl ekleyin ve tüpü hemen 30 s boyunca vorteks.
- Tüpü 6.000 x g'de 5 dakika boyunca santrifüjleyin.
- Santrifüjlemeden sonra, 50 mg grafitize karbon siyahı (GCB) ve 150 mg susuz MgSO4 (numuneden pigment ve nemi çıkarmak için) içeren 5 mL'lik bir santrifüj tüpüne 2 mL süpernatant ekleyin ve santrifüj tüpünü 30 s boyunca vorteks edin (Şekil 6). Tüpü 6.000 x g'de 5 dakika boyunca santrifüjleyin.
- Süpernatantı tek kullanımlık bir şırınga ile aspire edin ve numuneyi elde etmek için bir şırınga filtresinden (0.22 μm gözenek boyutu) geçirin.

Resim 4: Rendelenmiş buğday kökleri ve yaprakları. Taze buğday kökleri ve yaprakları makas kullanılarak yaklaşık 1 cm'lik parçalara ayrılırdı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 5: Buğday yapraklarında imidacloprid ekstraksiyonu. Örneklerdeki imidacloprid, QuEChERS yöntemi kullanılarak ekstrakte edildi (protokolün 4.2.1-4.2.4 adımları). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 6: Buğday yapraklarındaki imidacloprid'in saflaştırılması. Dekontaminant 50 mg GCB + 150 mg MgSO4 idi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
5. İmidacloprid'in nicelleştirilmesi
- 0.2-250 μg / L imidakloprid konsantrasyonlarından elde edilen standart bir eğriye (y = 696.61x + 56.411, R = 1) dayanan sıvı kromatografi-tandem kütle spektrometresi (LC-MS-MS) kullanarak numunedeki imidacloprid'i sayın. (Şekil 7). Kütle spektrometresi bir C18 sütunu (100 mm x 2,1 mm, 3 μm) ve bir elektrosprey iyonizasyon kaynağı (ESI+) ile donatılmıştır. Elüsyon programı ve iyon kaynağı parametreleri Tablo 1'de gösterilmiştir.
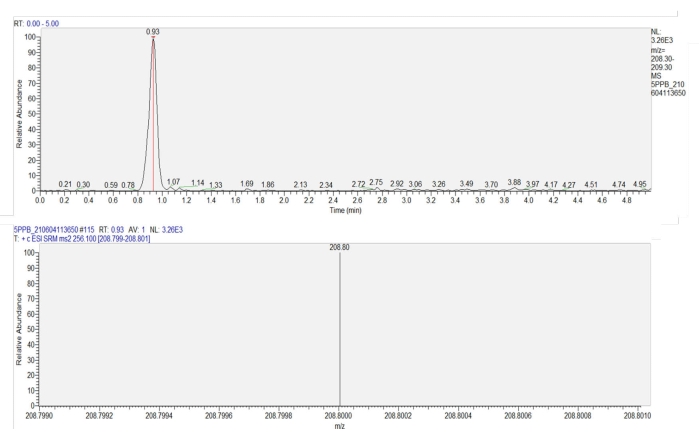
Resim 7: Buğday yapraklarındaki imidacloprid'in kromatogramı ve kütle spektrogramı. Üst panelde imidacloprid'in kromatogramı gösterilir (tutma süresi = 0.93 dakika). Alt panel, imidaklopridin kütle spektrogramını 0.93 dakikada gösterir ve imidakloprid üretiminin (m / z = 208.8) tepki yoğunluğunu gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Kolon sıcaklığı | 40 °C |
| Solvent A | %99,9 su/%0,1 formik asit (v/v) |
| Çözücü B | asetonitril |
| Elüsyon programı | 0–0,5 dakika, A = %20 |
| 0,5–2 dakika, A = %20–%50 | |
| 2–3 dakika, A = %50 | |
| 3–3,1 dakika, A = %50–%20 | |
| 3,1–5 dakika, A=%20 | |
| Akış hızı (mL/dak) | 0.3 |
| Enjeksiyon hacmi (μL) | 5 |
| Kılcal sıcaklık (°C) | 330 |
| Buharlaştırıcı sıcaklığı (°C) | 350 |
| Kılıf gazı akış hızı (Arb) | 40 |
| Aux gaz akış hızı (Arb) | 20 |
| Püskürtme voltajı (V) | 3900 |
| Çarpışma gazı basıncı (mTorr) | 1.5 |
| Öncü iyon | 256.1 |
| Ürün iyonu/Çarpışma enerjisi (eV) | 208.8/16 |
Tablo 1: Sıvı kromatografisi-kütle spektrometresi yönteminin elüsyon programı ve iyon kaynağı parametreleri.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
İmidacloprid'in cihaz tespit sınırı (LOD) 5.76 × 10−14 g idi ve yöntemin buğday kökü veya yaprağındaki imidacloprid'in LOD'si 0.01 μg / kg idi; Matris etkisi gözlenmedi. Buğdayda imidacloprid'in geri kazanım verimleri Tablo 2'de gösterilmiştir. 0.5 mg/L ve 5 mg/L imidakloprid konsantrasyonlarına maruz kalan buğday köklerinden imidacloprid'in geri kazanım verimleri sırasıyla %94.0-%97.6 ve %98.8-%99.2; Varyasyon katsayıları sırasıyla %1.92 ve %0.20 idi. 0.5 mg/L ve ...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Son yıllarda, pestisit imidacloprid'in kalıntılarının ön arıtımı ve tespiti için yöntemler sıklıkla bildirilmiştir. Badawy ve ark.23, sera koşullarında yetiştirilen domates meyvelerinde imidacloprid içeriğini belirlemek için yüksek performanslı sıvı kromatografisi kullanmış ve 0.0125-0.15 μg / mL aralığında imidacloprid için iyi doğrusallık bildirmiştir. Zhai ve ark.24, Çin frenk soğanlarında imidacloprid kalıntılarını incelemek içi...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler. Tüm yazarlar makaleyi okumuş ve onaylamıştır. Bu çalışma daha önce yayınlanmamıştır ve başka bir hakemli dergi tarafından değerlendirilmemektedir.
Teşekkürler
Bu çalışma Çin Ulusal Doğa Bilimleri Vakfı (No. 42277039) tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | 01-06-1995 | Suitable for HPLC, gradient grade, >99.9% |
| Analytical balance | Sartorius Lab Instruments Co.Ltd. | GL124-1SCN | |
| Artificial climate incubator | Shanghai Badian Instrument Equipment Co. Ltd. | HK320 | |
| Centrifuge | Eppendorf China Co. Ltd. | Centrifuge5804 | |
| Disposable syringe | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Z116866 | Capacity 5 mL, graduated 0.2 mL, non-sterile |
| Formic acid | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Y0001970 | European pharmacopoeia reference standard |
| Graphitized carbon black (GCB) | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | V900058 | 45 μm |
| H2O2 | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | 31642 | 30% (w/w) |
| Hoagland’s Basal Salt Mixture | Shanghai Yu Bo Biotech Co. Ltd. | NS1011 | Anhydrous, reagent grade |
| Hydroponic equipment | Jiangsu Rongcheng Agricultural Science and Technology Development Co.Ltd. | SDZ04BD | |
| Hypersil BDS C18 column | Thermo Fisher Scientific (China) Co. Ltd. | 28103-102130 | |
| Imidacloprid | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Y0002028 | European pharmacopoeia reference standard |
| MgSO4 | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | 208094 | Anhydrous, reagent grade, >97% |
| NaCl | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | S9888 | Reagent grade, 99% |
| pH meter | Shanghai Thunder Magnetic Instrument Factory | PHSJ-3F | |
| Phytotron box | Harbin Donglian Electronic Technology Co. Ltd. | HPG-280B | |
| Pipettes | Eppendorf China Co. Ltd. | Research plus | |
| Syringe filter | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | SLGV033N | Nylon, 0.22 µm pore size, 33 mm, non-sterile |
| Ultra performance liquid chromatography tandem triple quadrupole mass spectrometry | Thermo Fisher Scientific (China) Co. Ltd. | UltiMate 3000 | |
| TSQ Quantum Access MAX | |||
| Vortex mixer | Shanghai Yetuo Technology Co. Ltd. | Vortex-2 | |
| Wheat seed | LuKe seed industry | Jimai 20 |
Referanslar
- Lin, P. C., Lin, H. J., Liao, Y. Y., Guo, H. R., Chen, K. T. Acute poisoning with neonicotinoid insecticides: A case report and literature review. Basic & Clinical Pharmacology & Toxicology. 112 (4), 282-286 (2013).
- North, J. H., et al. Value of neonicotinoid insecticide seed treatments in Mid-South corn (Zea mays) production systems. Journal of Economic Entomology. 111 (1), 187-192 (2018).
- Simon-Delso, N., et al. Systemic insecticides (neonicotinoids and fipronil): Trends, uses, mode of action and metabolites. Environmental Science and Pollution Research. 22 (1), 5-34 (2015).
- Bass, C., Denholm, I., Williamson, M. S., Nauen, R. The global status of insect resistance to neonicotinoid insecticides. Pesticide Biochemistry and Physiology. 121, 78-87 (2015).
- Craddock, H. A., Huang, D., Turner, P. C., Quiros-Alcala, L., Payne-Sturges, D. C. Trends in neonicotinoid pesticide residues in food and water in the United States, 1999-2015. Environmental Health. 18 (1), 7(2019).
- Shao, X. S., Liu, Z. W., Xu, X. Y., Li, Z., Qian, X. H. Overall status of neonicotinoid insecticides in China: Production, application and innovation. Journal of Pesticide Science. 38 (1-2), 1-9 (2013).
- Zhao, Y., et al. Urinary neonicotinoid insecticides in children from South China: Concentrations, profiles and influencing factors. Chemosphere. 291, 132937(2022).
- Kurwadkar, S., Evans, A. Neonicotinoids: Systemic insecticides and systematic failure. Bulletin of Environmental Contamination and Toxicology. 97 (6), 745-748 (2016).
- Sadaria, A. M., et al. Passage of fiproles and imidacloprid from urban pest control uses through wastewater treatment plants in northern California, USA. Environmental Toxicology and Chemistry. 36 (6), 1473-1482 (2017).
- Damalas, C. A., Eleftherohorinos, I. G. Pesticide exposure, safety issues, and risk assessment indicators. International Journal of Environmental Research and Public Health. 8 (5), 1402-1419 (2011).
- Hayes, T. B., et al. Demasculinization and feminization of male gonads by atrazine: Consistent effects across vertebrate classes. Journal of Steroid Biochemistry and Molecular Biology. 127 (1-2), 64-73 (2011).
- Rani, L., et al. An extensive review on the consequences of chemical pesticides on human health and environment. Journal of Cleaner Production. 283, 124657(2021).
- Xu, Y. Q., et al. Ecotoxicity evaluation of azoxystrobin on Eisenia fetida in different soils. Environmental Research. 194, 110705(2021).
- Yavari, S., Malakahmad, A., Sapari, N. B. Biochar efficiency in pesticides sorption as a function of production variables-A review. Environmental Science and Pollution Research. 22 (18), 13824-13841 (2015).
- Delcour, I., Spanoghe, P., Uyttendaele, M. Literature review: Impact of climate change on pesticide use. Food Research International. 68, 7-15 (2015).
- Zhang, C. Y., et al. The application of the QuEChERS methodology in the determination of antibiotics in food: A review. TrAC-Trends in Analytical Chemistry. 118, 517-537 (2019).
- Wiilkowska, A., Biziuk, M. Determination of pesticide residues in food matrices using the QuEChERS methodology. Food Chemistry. 125 (3), 803-812 (2011).
- Ishii, Y., et al. HPLC determination of the new insecticide imidacloprid and its behavior in rice and cucumber. Journal of Agricultural and Food Chemistry. 42 (12), 2917-2921 (1994).
- Ko, A. Y., et al. Development of a simple extraction and oxidation procedure for the residue analysis of imidacloprid and its metabolites in lettuce using gas chromatography. Food Chemistry. 148, 402-409 (2014).
- Yuan, W. L., et al. Application of imidacloprid controlled-release granules to enhance the utilization rate and control wheat aphid on winter wheat. Journal of Integrative Agriculture. 19 (12), 3045-3053 (2020).
- Phugare, S. S., Kalyani, D. C., Gaikwad, Y. B., Jadhav, J. P. Microbial degradation of imidacloprid and toxicological analysis of its biodegradation metabolites in silkworm (Bombyx mori). Chemical Engineering Journal. 230, 27-35 (2013).
- Li, Y., et al. Uptake, translocation and accumulation of imidacloprid in six leafy vegetables at three growth stages. Ecotoxicology and Environmental Safety. 164, 690-695 (2018).
- Badawy, M. E. I., Ismail, A. M. E., Ibrahim, A. I. H. Quantitative analysis of acetamiprid and imidacloprid residues in tomato fruits under greenhouse conditions. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes. 54 (11), 898-905 (2019).
- Zhai, R. Q., et al. Residue, dissipation pattern, and dietary risk assessment of imidacloprid in Chinese chives. Frontiers in Nutrition. 9, 846333(2022).
- Aria, M. M., et al. Uptake and translocation monitoring of imidacloprid to chili and tomato plants by molecularly imprinting extraction - ion mobility spectrometry. Microchemical Journal. 144, 195-202 (2019).
- Chen, Y., et al. Translocation and metabolism of imidacloprid in cabbage: Application of C-14-labelling and LC-QTOF-MS. Chemosphere. 263, 127928(2021).
- Wild, S., Jones, K. Organic chemicals entering agricultural soils in sewage sludges: Screening for their potential to transfer to crop plants and livestock. Science of the Total Environment. 119, 85-119 (1992).
- Gong, W. W., et al. Uptake and dissipation of metalaxyl-M, fludioxonil, cyantraniliprole and thiamethoxam in greenhouse chrysanthemum. Environmental Pollution. 257, 113499(2020).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır