Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bestimmung der Absorption, Translokation und Verteilung von Imidacloprid in Weizen
In diesem Artikel
Zusammenfassung
Hier wird ein Protokoll zur Bestimmung der Absorption, Translokation und Verteilung von Imidacloprid in Weizen unter hydroponischen Bedingungen mittels Flüssigchromatographie-Tandem-Massenspektrometrie (LC-MS-MS) vorgestellt. Die Ergebnisse zeigten, dass Imidacloprid von Weizen aufgenommen werden kann, und Imidacloprid wurde sowohl in den Weizenwurzeln als auch in den Blättern nachgewiesen.
Zusammenfassung
Neonicotinoide, eine Klasse von Insektiziden, werden aufgrund ihrer neuartigen Wirkungsweisen, ihrer hohen insektiziden Aktivität und ihrer starken Wurzelaufnahme häufig eingesetzt. Imidacloprid, das weltweit am häufigsten eingesetzte Insektizid, ist ein repräsentatives Neonicotinoid der ersten Generation und wird zur Schädlingsbekämpfung von Nutzpflanzen, Gemüse und Obstbäumen eingesetzt. Mit einer derart breiten Anwendung von Imidacloprid sind seine Rückstände in Nutzpflanzen zunehmend in den Fokus gerückt. In der vorliegenden Studie wurden 15 Weizenkeimlinge in ein Nährmedium gesetzt, das 0,5 mg/L oder 5 mg/L Imidacloprid für die Hydrokultur enthielt. Der Gehalt an Imidacloprid in den Weizenwurzeln und -blättern wurde nach 1 Tag, 2 Tagen und 3 Tagen Hydrokultur bestimmt, um die Migration und Verteilung von Imidacloprid im Weizen zu untersuchen. Die Ergebnisse zeigten, dass Imidacloprid sowohl in den Wurzeln als auch in den Blättern der Weizenpflanze nachgewiesen wurde und der Gehalt an Imidacloprid in den Wurzeln höher war als in den Blättern. Des Weiteren stieg die Imidacloprid-Konzentration im Weizen mit zunehmender Expositionszeit an. Nach 3-tägiger Exposition enthielten die Wurzeln und Blätter des Weizens in der Behandlungsgruppe mit 0,5 mg/l 4,55 mg/kg ± 1,45 mg/kg bzw. 1,30 mg/kg ± 0,08 mg/kg Imidacloprid, während die Wurzeln und Blätter der Behandlungsgruppe mit 5 mg/l 42,5 mg/kg ± 0,62 mg/kg und 8,71 mg/kg ± 0,14 mg/kg Imidacloprid enthielten. beziehungsweise. Die Ergebnisse der vorliegenden Studie ermöglichen ein besseres Verständnis von Pestizidrückständen in Nutzpflanzen und stellen eine Datenreferenz für die Umweltrisikobewertung von Pestiziden dar.
Einleitung
In der heutigen Agronomie ist der Einsatz von Pestiziden unerlässlich, um den Ernteertrag zu steigern. Neonicotinoid-Insektizide verändern das Gleichgewicht des Membranpotentials, indem sie nikotinische Acetylcholinrezeptoren im Nervensystem der Insekten kontrollieren und dadurch die normale Leitung des zentralen Nervensystems der Insekten hemmen, was zur Lähmung und zum Tod der Insekten führt1. Im Vergleich zu herkömmlichen Insektiziden haben Neonicotinoide Vorteile wie neuartige Wirkmechanismen, eine hohe insektizide Aktivität und eine starke Wurzelabsorption, was sie auf dem Pestizidmarkt sehr erfolgreich macht 2,3. Das Verkaufsvolumen von Neonicotinoiden machte 2014 Berichten zufolge 27 % des Weltmarktes für Pestizide aus. Die durchschnittliche jährliche Wachstumsrate von Neonicotinoiden betrug von 2005 bis 2010 11,4 %, von denen etwa 7 % in China registriert wurden 4,5,6. Von Ende 2016 bis zum ersten Halbjahr 2017 erholten sich die Verkäufe von Pestiziden in China nach einem Rückgang, und die Preise für Pestizide stiegen weiter an, wobei die Preise für Neonicotinoid-Insektizide einen deutlichen Preisanstieg verzeichneten7. Bisher wurden drei Generationen von Neonicotinoid-Insektiziden entwickelt, die jeweils Pyridinchlorid-, Thiazolyl- und Tetrahydrofuran-Nikotingruppen enthalten8.
Imidacloprid repräsentiert die erste Generation von Neonicotinoid-Insektiziden, deren Summenformel C9H10ClN5O 2 lautet und ein farbloser Kristall ist. Imidacloprid wird hauptsächlich zur Bekämpfung von Schädlingen wie Blattläusen, Zikaden, Mehlwürmern und Thripsenverwendet 9 und kann auf Nutzpflanzen wie Reis, Weizen, Mais, Baumwolle und Gemüse wie Kartoffeln sowie Obstbäume angewendet werden. Aufgrund der langfristigen, umfangreichen und kontinuierlichen Anwendung von Pestiziden wurden sowohl nützliche Insekten als auch die natürlichen Feinde von Schädlingen schnell reduziert, und einige landwirtschaftliche Schädlinge sind resistent gegen Pestizide geworden, was zu einem Teufelskreis der kontinuierlichen und zunehmenden Anwendung von Pestiziden führt10. Darüber hinaus hat der umfangreiche Einsatz von Pestiziden zu einer Verschlechterung der Bodenqualität, zu persistenten Pestizidrückständen in landwirtschaftlichen Erzeugnissen und zu anderen ökologischen Problemen geführt, die nicht nur erhebliche Schäden an der ökologischen Umwelt der Landwirtschaft verursachen11, sondern auch eine ernsthafte Bedrohung für die menschliche Gesundheit darstellen12. Das Versprühen von Pestiziden beeinträchtigt das Wachstum und die Qualität von Bodenmikroben und Bodentierenerheblich 13. Der unangemessene oder übermäßige Einsatz von Pestiziden hat zu erheblichen Sicherheitsrisiken für die Boden- und Wasserumwelt, für Tiere und Pflanzen und sogar für das menschliche Leben geführt14. In den letzten Jahren hat sich das Problem der übermäßigen Pestizidrückstände in Nutzpflanzen durch den umfangreichen Einsatz von Pestiziden verschärft. Wenn Imidacloprid zur Steigerung des Gemüseertrags angewendet wurde, stieg die Absorptionsrate von Imidacloprid im Gemüse mit der Zunahme der Menge und des Rückstands von Imidacloprid15. Da es sich um eine wichtige Nahrungspflanze handelt, sind sowohl die Produktion als auch die Sicherheit von Weizen von entscheidender Bedeutung. Daher müssen die Rückstands- und Verteilungspolitik von Pestiziden, die für Weizen verwendet werden, geklärt werden.
In den letzten Jahren wurden viele Methoden entwickelt, um Imidacloprid-Rückstände aus Wasser, Boden und Pflanzen zu extrahieren. Die QuEChERS-Methode (schnell, einfach, billig, effektiv, robust und sicher) ist eine neue Methode, die die Festphasen-Mikroextraktionstechnologie und die dispergierte Festphasenextraktionstechnologie kombiniert und die Verwendung von Acetonitril als Extraktionslösungsmittel und die Entfernung von gemischten Verunreinigungen und Wasser in der Probe mit NaCl bzw. wasserfreiem MgSO4 beinhaltet16. Die QuEChERS-Methode erfordert nur minimale Glaswaren und hat einfache experimentelle Schritte, was sie zu einer der beliebtesten Methoden zur Extraktion von Pestizidenmacht 17. Für den Nachweis von Imidacloprid wurde mit der Flüssigchromatographie (LC) eine Nachweisgrenze von nur 1 × 10−9 g18 und mit der Gaschromatographie (GC) 1 × 10−11 g 19 erreicht. Aufgrund ihrer hohen Auflösung und Sensitivität haben LC-MS und GC-MS noch niedrigere Imidacloprid-Nachweisgrenzen von 1 × 10-13 bis 1 × 10-14 ggezeigt 20,21; Diese Techniken eignen sich daher gut für die Analyse von Imidacloprid-Rückständen.
In der vorliegenden Studie wurde Imidacloprid als Zielschadstoff und Weizen als Versuchspflanze ausgewählt, um die Verteilung von Imidacloprid-Rückständen in Weizen zu untersuchen. Dieses Protokoll beschreibt eine Methode zur umfassenden Analyse der Anreicherung und des Transfers des Pestizids Imidacloprid in Weizen, indem die Absorption und Lagerung von Imidacloprid in verschiedenen Teilen von Weizenpflanzen untersucht wird, die unter hydroponischen Bedingungen angebaut werden. Ziel der vorliegenden Studie ist es, eine theoretische Grundlage für die Risikobewertung von Pestizidrückständen in Weizen zu schaffen, den rationellen Einsatz von Pestiziden in der landwirtschaftlichen Produktion zu steuern, um Pestizidrückstände zu reduzieren, und die Sicherheit der Pflanzenproduktion zu verbessern.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Keimung von Weizensamen
- Wählen Sie 1.000 Weizensamen (Jimai 20) mit vollständigem Granulat, intakten Embryonen und einheitlicher Größe (Länge: 6 mm ± 0,5 mm) aus.
- 333,3 ml 30%ige H2O2-Lösung in einen 1-Liter-Messkolben überführen und mit deionisiertem Wasser verdünnen, um 1 L 10%igeH2O2-Lösungherzustellen. Tauchen Sie die Weizenkörner 15 Minuten lang in 10%igeH2O2-Lösung, um die Samenoberfläche zu desinfizieren (Abbildung 1).
- Spülen Sie die Weizenkörner 5x mit fließendem sterilem Wasser für jeweils 10 s ab.
- Verteilen Sie die Weizensamen gleichmäßig mit den Embryonen nach oben in einer Petrischale aus Glas mit feuchtem sterilem Filterpapier (Abbildung 2). Stellen Sie die Petrischale in einen künstlichen Klimainkubator bei 30 °C und 80 % relativer Luftfeuchtigkeit. Kultivieren Sie die Weizensamen 3 Tage lang im Dunkeln, bis sie keimen und Wurzeln schlagen.

Abbildung 1: Desinfektion der Weizenkörner. Die Weizenkörner wurden 15 min in 10%igerH2O2-Lösung(in einem Becherglas) eingeweicht, um die Samenoberfläche zu desinfizieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung 2: Keimen der Weizenkörner. Die Weizenkörner wurden gleichmäßig in einer Glas-Petrischale mit feuchtem, sterilem Filterpapier verteilt. Die Petrischale wurde in einen künstlichen Klimainkubator gestellt, um die Weizensamen zum Keimen zu bringen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Anbau von Weizensetzlingen
- Lösen Sie 551 mg der Hoagland-Basalsalzmischung in 1 l deionisiertem Wasser auf, um 1/2 Hoagland-Nährlösung herzustellen (enthält 0,75 mmol/LK2SO4, 0,1 mmol/L KCl, 0,6 mmol/L MgSO4, 4,0 × 10−2 mmol/L FeEDTA, 1,0 × 10−3 mmol/L H3 BO3, 1,0 × 10−3 mmol/LMnSO4, 1,0 × 10−3 mmol/L ZnSO4, 1,0 × 10−4 mmol/L CuSO4 und 5,0 × 10−6 mmol/LNa2MoO4).
- Nachdem die Weizensamen (Schritt 1.4) gekeimt sind, setzen Sie 15 Weizensämlinge in hydroponische Geräte (siehe Materialtabelle), die 100 ml 1/2 Hoagland-Nährlösung für Hydrokulturen enthalten (Abbildung 3). Stellen Sie das gesamte hydroponische Gerät in einen Inkubator mit künstlichem Klima (siehe Materialtabelle) und inkubieren Sie es 7 Tage lang bei 25 °C und 80 % relativer Luftfeuchtigkeit mit einer Photoperiode von 16 h hell und 8 h dunkel.

Abbildung 3: Hydroponische Kultivierung der Weizensetzlinge. Die Weizensämlinge wurden 0 Tage, 3 Tage und 7 Tage in 100 ml 1/2 Hoagland-Nährlösung hydroponisch kultiviert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Experimentieren Sie, indem Sie die Weizenpflanzen der Imidacloprid-Lösung aussetzen
- Nach einer 7-tägigen Hydrokulturperiode werden die Weizenpflanzen in 1/2 Hoagland-Nährlösung mit 0,5 mg/L oder 5 mg/L Imidacloprid umgepflanzt, um die Imidacloprid-Expositionsexperimente durchzuführen. Züchte 15 Weizenpflanzen in jedem hydroponischen Gerät. Stellen Sie 15 hydroponische Geräte für jede Imidacloprid-Konzentrationsgruppe auf, um sicherzustellen, dass während der Probenahme ausreichend Proben entnommen werden.
- Legen Sie die gesamte hydroponische Ausrüstung für 3 Tage bei 25 °C und 80 % relativer Luftfeuchtigkeit mit einer Photoperiode von 16 Stunden hell und 8 Stunden dunkel in einen Inkubator mit künstlichem Klima.
- Während des gesamten Expositionszeitraums sind täglich Weizenwurzeln (0,2 g pro Weizenpflanze) und Blätter (0,5 g pro Weizenpflanze) zu sammeln. Integrieren Sie die Weizenproben von jedem fünften Hydrokulturgerät als Parallelgruppe und bestimmen Sie den Imidacloprid-Gehalt der Proben.
4. Verfahren zur Extraktion von Imidacloprid aus Weizen
- Extraktion von Imidacloprid aus Weizenwurzeln
- Um experimentelle Fehler zu vermeiden, waschen Sie die Weizenwurzeln jedes Mal 4x mit fließendem sterilem Wasser für jeweils 10 s, um an der Wurzeloberfläche adsorbiertes Imidacloprid zu entfernen.
- Die Weizenwurzeln mit einer Schere in ca. 1 cm große Stücke zerkleinern (Abbildung 4). 10,00 g der zerkleinerten Weizenwurzeln abwiegen und in ein 50-ml-Zentrifugenröhrchen geben.
- Geben Sie 10 ml Acetonitril in das Zentrifugenröhrchen und wirbeln Sie das Röhrchen 1 min lang auf einem Vortexer. Geben Sie dann 4 g wasserfreiesMgSO4 und 1,5 g NaCl in das Zentrifugenröhrchen und wirbeln Sie das Röhrchen sofort für 30 s vortex. Zentrifugieren Sie das Röhrchen 5 Minuten lang bei 6.000 x g.
- Saugen Sie den Überstand mit einer Einwegspritze ab und passieren Sie ihn durch einen Spritzenvorsatzfilter (0,22 μm Porengröße), um die Probe zu erhalten.
- Extraktion von Imidacloprid aus Weizenblättern (Abbildung 5)
- Die frischen Weizenblätter mit einer Schere in ca. 1 cm große Stücke zerkleinern (Abbildung 4). 10,00 g der zerkleinerten Weizenblätter abwiegen und in ein 50-ml-Zentrifugenröhrchen geben.
- Geben Sie 10 mL Acetonitril in das Zentrifugenröhrchen und wirbeln Sie das Röhrchen 1 min lang auf einem Vortexer.
- Geben Sie 4 g wasserfreiesMgSO4 und 1,5 g NaCl in das Zentrifugenröhrchen und wirbeln Sie das Röhrchen sofort für 30 s.
- Zentrifugieren Sie das Röhrchen 5 Minuten lang bei 6.000 x g.
- Geben Sie nach der Zentrifugation 2 ml des Überstands in ein 5-ml-Zentrifugenröhrchen, das 50 mg graphitisierten Ruß (GCB) und 150 mg wasserfreies MgSO4 enthält (um Pigment und Feuchtigkeit aus der Probe zu entfernen), und wirbeln Sie das Zentrifugenröhrchen 30 s lang vor (Abbildung 6). Zentrifugieren Sie das Röhrchen 5 Minuten lang bei 6.000 x g.
- Saugen Sie den Überstand mit einer Einwegspritze ab und passieren Sie ihn durch einen Spritzenvorsatzfilter (0,22 μm Porengröße), um die Probe zu erhalten.

Abbildung 4: Geschredderte Weizenwurzeln und -blätter. Frische Weizenwurzeln und -blätter wurden mit einer Schere in ca. 1 cm große Stücke zerkleinert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Extraktion von Imidacloprid in den Weizenblättern. Imidacloprid in den Proben wurde mit der QuEChERS-Methode extrahiert (Schritte 4.2.1-4.2.4 des Protokolls). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: Reinigung von Imidacloprid in den Weizenblättern. Das Dekontaminationsmittel betrug 50 mg GCB + 150 mgMgSO4. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
5. Quantifizierung von Imidacloprid
- Quantifizierung des Imidacloprids in der Probe mittels Flüssigchromatographie-Tandem-Massenspektrometrie (LC-MS-MS) auf der Grundlage einer Standardkurve (y = 696,61x + 56,411, R=1), die aus Konzentrationen von 0,2 bis 250 μg/l Imidacloprid ermittelt wurde. (Abbildung 7). Das Massenspektrometer wurde mit einer C18 Säule (100 mm x 2,1 mm, 3 μm) und einer Elektrospray-Ionisationsquelle (ESI+) ausgestattet. Das Elutionsprogramm und die Parameter der Ionenquelle sind in Tabelle 1 dargestellt.
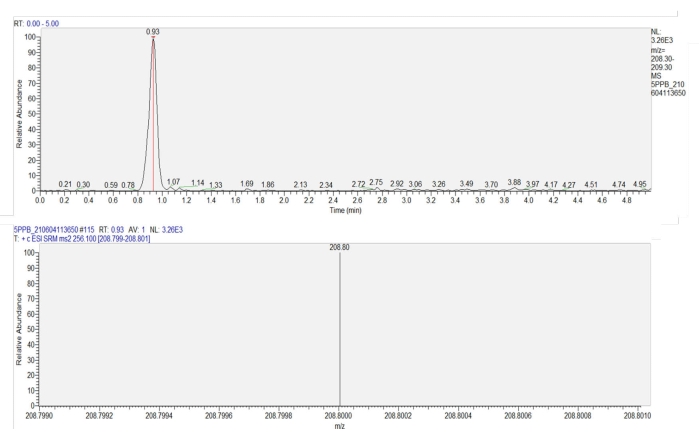
Abbildung 7: Chromatogramm und Massenspektrogramm von Imidacloprid in den Weizenblättern. Das obere Bild zeigt ein Chromatogramm von Imidacloprid (Retentionszeit = 0,93 min). Das untere Bild zeigt das Massenspektrogramm von Imidacloprid bei 0,93 min, das die Ansprechintensität der Produktion (m/z = 208,8) von Imidacloprid zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Temperatur der Säule | 40 °C |
| Lösungsmittel A | 99,9 % Wasser/0,1 % Ameisensäure (v/v) |
| Lösungsmittel B | Acetonitril |
| Elutionsprogramm | 0–0,5 min, A = 20 % |
| 0,5–2 min, A = 20%–50% | |
| 2–3 min, A = 50% | |
| 3–3,1 min, A = 50%–20% | |
| 3,1–5 min, A=20% | |
| Durchflussrate (ml/min) | 0.3 |
| Injektionsvolumen (μL) | 5 |
| Kapillartemperatur (°C) | 330 |
| Verdampfertemperatur (°C) | 350 |
| Mantelgasdurchfluss (Arb) | 40 |
| Aux-Gas-Durchflussrate (Arb) | 20 |
| Sprühspannung (V) | 3900 |
| Kollisionsgasdruck (mTorr) | 1.5 |
| Vorläufer-Ion | 256.1 |
| Produkt Ionen/Kollisionsenergie (eV) | 208.8/16 |
Tabelle 1: Elutionsprogramm und Ionenquellenparameter der Flüssigchromatographie-Massenspektrometrie-Methode.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die instrumentelle Nachweisgrenze (LOD) von Imidacloprid lag bei 5,76 × 10−14 g, und die LOD der Methode für Imidacloprid in der Weizenwurzel oder im Weizenblatt betrug 0,01 μg/kg; Es wurde kein Matrixeffekt beobachtet. Die Wiederfindungsraten von Imidacloprid in Weizen sind in Tabelle 2 dargestellt. Die Wiederfindungsraten von Imidacloprid aus den Weizenwurzeln, die Imidacloprid-Konzentrationen von 0,5 mg/l bzw. 5 mg/l ausgesetzt waren, betrugen 94,0 %-97,6 % bzw. 98,8 %-99,2 %; Die Vari...
Access restricted. Please log in or start a trial to view this content.
Diskussion
In den letzten Jahren wurde häufig über Methoden zur Vorbehandlung und zum Nachweis von Rückständen des Pflanzenschutzmittels Imidacloprid berichtet. Badawy et al.23 verwendeten Hochleistungsflüssigkeitschromatographie, um den Gehalt an Imidacloprid in Tomatenfrüchten zu bestimmen, die unter Gewächshausbedingungen angebaut wurden, und berichteten über eine gute Linearität für Imidacloprid im Bereich von 0,0125-0,15 μg/ml. Zhai et al.24 verwendeten LC-MS-MS, um di...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen. Alle Autoren haben das Manuskript gelesen und genehmigt. Diese Arbeit wurde bisher noch nicht veröffentlicht und wird auch von keiner anderen Fachzeitschrift mit Peer-Review in Betracht gezogen.
Danksagungen
Diese Arbeit wurde von der National Natural Science Foundation of China (Nr. 42277039) unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | 01-06-1995 | Suitable for HPLC, gradient grade, >99.9% |
| Analytical balance | Sartorius Lab Instruments Co.Ltd. | GL124-1SCN | |
| Artificial climate incubator | Shanghai Badian Instrument Equipment Co. Ltd. | HK320 | |
| Centrifuge | Eppendorf China Co. Ltd. | Centrifuge5804 | |
| Disposable syringe | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Z116866 | Capacity 5 mL, graduated 0.2 mL, non-sterile |
| Formic acid | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Y0001970 | European pharmacopoeia reference standard |
| Graphitized carbon black (GCB) | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | V900058 | 45 μm |
| H2O2 | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | 31642 | 30% (w/w) |
| Hoagland’s Basal Salt Mixture | Shanghai Yu Bo Biotech Co. Ltd. | NS1011 | Anhydrous, reagent grade |
| Hydroponic equipment | Jiangsu Rongcheng Agricultural Science and Technology Development Co.Ltd. | SDZ04BD | |
| Hypersil BDS C18 column | Thermo Fisher Scientific (China) Co. Ltd. | 28103-102130 | |
| Imidacloprid | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Y0002028 | European pharmacopoeia reference standard |
| MgSO4 | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | 208094 | Anhydrous, reagent grade, >97% |
| NaCl | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | S9888 | Reagent grade, 99% |
| pH meter | Shanghai Thunder Magnetic Instrument Factory | PHSJ-3F | |
| Phytotron box | Harbin Donglian Electronic Technology Co. Ltd. | HPG-280B | |
| Pipettes | Eppendorf China Co. Ltd. | Research plus | |
| Syringe filter | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | SLGV033N | Nylon, 0.22 µm pore size, 33 mm, non-sterile |
| Ultra performance liquid chromatography tandem triple quadrupole mass spectrometry | Thermo Fisher Scientific (China) Co. Ltd. | UltiMate 3000 | |
| TSQ Quantum Access MAX | |||
| Vortex mixer | Shanghai Yetuo Technology Co. Ltd. | Vortex-2 | |
| Wheat seed | LuKe seed industry | Jimai 20 |
Referenzen
- Lin, P. C., Lin, H. J., Liao, Y. Y., Guo, H. R., Chen, K. T. Acute poisoning with neonicotinoid insecticides: A case report and literature review. Basic & Clinical Pharmacology & Toxicology. 112 (4), 282-286 (2013).
- North, J. H., et al. Value of neonicotinoid insecticide seed treatments in Mid-South corn (Zea mays) production systems. Journal of Economic Entomology. 111 (1), 187-192 (2018).
- Simon-Delso, N., et al. Systemic insecticides (neonicotinoids and fipronil): Trends, uses, mode of action and metabolites. Environmental Science and Pollution Research. 22 (1), 5-34 (2015).
- Bass, C., Denholm, I., Williamson, M. S., Nauen, R. The global status of insect resistance to neonicotinoid insecticides. Pesticide Biochemistry and Physiology. 121, 78-87 (2015).
- Craddock, H. A., Huang, D., Turner, P. C., Quiros-Alcala, L., Payne-Sturges, D. C. Trends in neonicotinoid pesticide residues in food and water in the United States, 1999-2015. Environmental Health. 18 (1), 7(2019).
- Shao, X. S., Liu, Z. W., Xu, X. Y., Li, Z., Qian, X. H. Overall status of neonicotinoid insecticides in China: Production, application and innovation. Journal of Pesticide Science. 38 (1-2), 1-9 (2013).
- Zhao, Y., et al. Urinary neonicotinoid insecticides in children from South China: Concentrations, profiles and influencing factors. Chemosphere. 291, 132937(2022).
- Kurwadkar, S., Evans, A. Neonicotinoids: Systemic insecticides and systematic failure. Bulletin of Environmental Contamination and Toxicology. 97 (6), 745-748 (2016).
- Sadaria, A. M., et al. Passage of fiproles and imidacloprid from urban pest control uses through wastewater treatment plants in northern California, USA. Environmental Toxicology and Chemistry. 36 (6), 1473-1482 (2017).
- Damalas, C. A., Eleftherohorinos, I. G. Pesticide exposure, safety issues, and risk assessment indicators. International Journal of Environmental Research and Public Health. 8 (5), 1402-1419 (2011).
- Hayes, T. B., et al. Demasculinization and feminization of male gonads by atrazine: Consistent effects across vertebrate classes. Journal of Steroid Biochemistry and Molecular Biology. 127 (1-2), 64-73 (2011).
- Rani, L., et al. An extensive review on the consequences of chemical pesticides on human health and environment. Journal of Cleaner Production. 283, 124657(2021).
- Xu, Y. Q., et al. Ecotoxicity evaluation of azoxystrobin on Eisenia fetida in different soils. Environmental Research. 194, 110705(2021).
- Yavari, S., Malakahmad, A., Sapari, N. B. Biochar efficiency in pesticides sorption as a function of production variables-A review. Environmental Science and Pollution Research. 22 (18), 13824-13841 (2015).
- Delcour, I., Spanoghe, P., Uyttendaele, M. Literature review: Impact of climate change on pesticide use. Food Research International. 68, 7-15 (2015).
- Zhang, C. Y., et al. The application of the QuEChERS methodology in the determination of antibiotics in food: A review. TrAC-Trends in Analytical Chemistry. 118, 517-537 (2019).
- Wiilkowska, A., Biziuk, M. Determination of pesticide residues in food matrices using the QuEChERS methodology. Food Chemistry. 125 (3), 803-812 (2011).
- Ishii, Y., et al. HPLC determination of the new insecticide imidacloprid and its behavior in rice and cucumber. Journal of Agricultural and Food Chemistry. 42 (12), 2917-2921 (1994).
- Ko, A. Y., et al. Development of a simple extraction and oxidation procedure for the residue analysis of imidacloprid and its metabolites in lettuce using gas chromatography. Food Chemistry. 148, 402-409 (2014).
- Yuan, W. L., et al. Application of imidacloprid controlled-release granules to enhance the utilization rate and control wheat aphid on winter wheat. Journal of Integrative Agriculture. 19 (12), 3045-3053 (2020).
- Phugare, S. S., Kalyani, D. C., Gaikwad, Y. B., Jadhav, J. P. Microbial degradation of imidacloprid and toxicological analysis of its biodegradation metabolites in silkworm (Bombyx mori). Chemical Engineering Journal. 230, 27-35 (2013).
- Li, Y., et al. Uptake, translocation and accumulation of imidacloprid in six leafy vegetables at three growth stages. Ecotoxicology and Environmental Safety. 164, 690-695 (2018).
- Badawy, M. E. I., Ismail, A. M. E., Ibrahim, A. I. H. Quantitative analysis of acetamiprid and imidacloprid residues in tomato fruits under greenhouse conditions. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes. 54 (11), 898-905 (2019).
- Zhai, R. Q., et al. Residue, dissipation pattern, and dietary risk assessment of imidacloprid in Chinese chives. Frontiers in Nutrition. 9, 846333(2022).
- Aria, M. M., et al. Uptake and translocation monitoring of imidacloprid to chili and tomato plants by molecularly imprinting extraction - ion mobility spectrometry. Microchemical Journal. 144, 195-202 (2019).
- Chen, Y., et al. Translocation and metabolism of imidacloprid in cabbage: Application of C-14-labelling and LC-QTOF-MS. Chemosphere. 263, 127928(2021).
- Wild, S., Jones, K. Organic chemicals entering agricultural soils in sewage sludges: Screening for their potential to transfer to crop plants and livestock. Science of the Total Environment. 119, 85-119 (1992).
- Gong, W. W., et al. Uptake and dissipation of metalaxyl-M, fludioxonil, cyantraniliprole and thiamethoxam in greenhouse chrysanthemum. Environmental Pollution. 257, 113499(2020).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten