È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Determinazione dell'assorbimento, della traslocazione e della distribuzione dell'imidacloprid nel frumento
In questo articolo
Riepilogo
Qui è presentato un protocollo per la determinazione dell'assorbimento, della traslocazione e della distribuzione dell'imidacloprid nel grano in condizioni idroponiche utilizzando cromatografia liquida-spettrometria di massa tandem (LC-MS-MS). I risultati hanno mostrato che l'imidacloprid può essere assorbito dal grano e l'imidacloprid è stato rilevato sia nelle radici che nelle foglie del grano.
Abstract
I neonicotinoidi, una classe di insetticidi, sono ampiamente utilizzati a causa delle loro nuove modalità d'azione, dell'elevata attività insetticida e del forte assorbimento delle radici. L'imidacloprid, l'insetticida più utilizzato in tutto il mondo, è un neonicotinoide rappresentativo di prima generazione e viene utilizzato nel controllo dei parassiti per colture, verdure e alberi da frutto. Con un'applicazione così ampia di imidacloprid, il suo residuo nelle colture ha attirato un controllo crescente. Nel presente studio, 15 piantine di grano sono state poste in un terreno di coltura contenente 0,5 mg / L o 5 mg / L di imidacloprid per l'idrocoltura. Il contenuto di imidacloprid nelle radici e nelle foglie di grano è stato determinato dopo 1 giorno, 2 giorni e 3 giorni di idrocoltura per esplorare la migrazione e la distribuzione dell'imidacloprid nel grano. I risultati hanno mostrato che l'imidacloprid è stato rilevato sia nelle radici che nelle foglie della pianta di grano e il contenuto di imidacloprid nelle radici era superiore a quello nelle foglie. Inoltre, la concentrazione di imidacloprid nel grano aumentava con l'aumentare del tempo di esposizione. Dopo 3 giorni di esposizione, le radici e le foglie del frumento nel gruppo di trattamento 0,5 mg/L contenevano rispettivamente 4,55 mg/kg ± 1,45 mg/kg e 1,30 mg/kg ± 0,08 mg/kg di imidacloprid, mentre le radici e le foglie del gruppo di trattamento da 5 mg/L contenevano rispettivamente 42,5 mg/kg ± 0,62 mg/kg e 8,71 mg/kg ± 0,14 mg/kg di imidacloprid, rispettivamente. I risultati del presente studio consentono una migliore comprensione dei residui di pesticidi nelle colture e forniscono un riferimento per la valutazione del rischio ambientale dei pesticidi.
Introduzione
Nell'agronomia attuale, l'uso di pesticidi è essenziale per aumentare la resa delle colture. Gli insetticidi neonicotinoidi alterano l'equilibrio potenziale della membrana controllando i recettori nicotinici dell'acetilcolina nel sistema nervoso degli insetti, inibendo così la normale conduzione del sistema nervoso centrale degli insetti, portando alla paralisi e alla morte degli insetti1. Rispetto agli insetticidi tradizionali, i neonicotinoidi presentano vantaggi quali nuove modalità d'azione, elevata attività insetticida e forte assorbimento delle radici, che li rendono di grande successo nel mercato dei pesticidi 2,3. Il volume delle vendite di neonicotinoidi è stato segnalato per rappresentare il 27% del mercato mondiale dei pesticidi nel 2014. Il tasso di crescita medio annuo dei neonicotinoidi è stato dell'11,4% dal 2005 al 2010, di cui circa il 7% è stato registrato in Cina 4,5,6. Dalla fine del 2016 alla prima metà del 2017, le vendite di pesticidi in Cina hanno iniziato a rimbalzare dopo il calo e i prezzi dei pesticidi hanno continuato a salire, tra cui gli insetticidi neonicotinoidi hanno mostrato un significativo aumento dei prezzi7. Finora sono state sviluppate tre generazioni di insetticidi neonicotinoidi, ciascuno contenente gruppi di cloruro di piridina, tiazolile e tetraidrofurano di nicotina, rispettivamente8.
L'imidacloprid rappresenta la prima generazione di insetticidi neonicotinoidi, la cui formula molecolare è C9H10ClN5O2, ed è un cristallo incolore. L'imidacloprid è usato principalmente per controllare i parassiti, come afidi, cavallette, vermi della farina e tripidi9 e può essere applicato a colture come riso, grano, mais, cotone e verdure come patate e alberi da frutto. A causa dell'applicazione a lungo termine, sostanziale e continua dei pesticidi, sia gli insetti utili che i nemici naturali dei parassiti sono stati rapidamente ridotti e alcuni parassiti agricoli sono diventati resistenti ai pesticidi, con conseguente circolo vizioso di applicazione continua e crescente di quantità di pesticidi10. Inoltre, l'applicazione estensiva di pesticidi ha portato al deterioramento della qualità del suolo, residui persistenti di pesticidi nei prodotti agricoli e altri problemi ecologici, che non solo causano danni significativi all'ambiente ecologico agricolo11 , ma rappresentano anche una grave minaccia per la salute umana12. L'irrorazione di pesticidi influisce gravemente sulla crescita e sulla qualità dei microbi del suolo e degli animali del suolo13. L'uso irragionevole o eccessivo di pesticidi ha causato notevoli rischi per la sicurezza del suolo e dell'ambiente idrico, degli animali e delle piante e persino della vita umana14. Negli ultimi anni, il problema dell'eccessivo residuo di pesticidi nelle colture è diventato più grave con l'applicazione estensiva di pesticidi. Quando l'imidacloprid è stato utilizzato per aumentare la resa vegetale, il tasso di assorbimento di imidacloprid nelle verdure è aumentato con l'aumento della quantità e del residuo di imidacloprid15. Essendo una delle principali colture alimentari, sia la produzione che la sicurezza del grano sono fondamentali. Pertanto, è necessario chiarire le politiche di distribuzione e dei residui dei pesticidi utilizzati per il grano.
Negli ultimi anni, sono stati sviluppati molti metodi per estrarre residui di imidacloprid dall'acqua, dal suolo e dalle piante. Il metodo QuEChERS (rapido, facile, economico, efficace, robusto e sicuro) è un nuovo metodo che combina la tecnologia di microestrazione in fase solida e la tecnologia di estrazione in fase solida dispersa e prevede l'uso di acetonitrile come solvente di estrazione e la rimozione di impurità miste e acqua nel campione utilizzando rispettivamente NaCl eMgSO 4 anidro16. Il metodo QuEChERS richiede vetreria minima e ha semplici passaggi sperimentali, rendendolo uno dei metodi di estrazione dei pesticidi più popolari17. Per la rilevazione di imidacloprid, è stato raggiunto un limite di rilevazione di 1 × 10−9 g18 con la cromatografia liquida (LC) e 1 × 10−11 g 19 è stato raggiunto con la gascromatografia (GC). Grazie alla loro elevata risoluzione e sensibilità, LC-MS e GC-MS hanno mostrato limiti di rilevazione dell'imidacloprid ancora più bassi da 1 × 10-13 a 1 × 10-14 g 20,21; Queste tecniche sono quindi adatte per l'analisi di tracce di residui di imidacloprid.
Nel presente studio, l'imidacloprid è stato scelto come inquinante bersaglio e il grano è stato selezionato come coltura di prova per studiare la distribuzione dei residui di imidacloprid nel grano. Questo protocollo descrive un metodo per l'analisi completa dell'arricchimento e del trasferimento del pesticida imidacloprid nel frumento esplorando l'assorbimento e lo stoccaggio dell'imidacloprid in diverse parti delle piante di grano coltivate in condizioni idroponiche. Il presente studio mira a fornire una base teorica per la valutazione del rischio dei residui di pesticidi nel grano, guidare l'applicazione razionale dei pesticidi nelle attività di produzione agricola per ridurre i residui di pesticidi e migliorare la sicurezza della produzione agricola.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Germinazione dei semi di grano
- Seleziona 1.000 semi di grano (Jimai 20) con granuli completi, embrioni intatti e dimensioni uniformi (lunghezza: 6 mm ± 0,5 mm).
- Trasferire 333,3 mL di soluzione al 30% di H 2 O 2 in un matraccio tarato da 1 L e diluire con acqua deionizzata per preparare 1 L di soluzione al 10% di H 2 O2. Immergere i semi di grano in una soluzione di H2 O2 al 10% per 15 minuti per disinfettare la superficie del seme (Figura 1).
- Risciacquare i semi di grano 5 volte con acqua sterile corrente per 10 s ogni volta.
- Distribuire uniformemente i semi di grano con gli embrioni rivolti verso l'alto in una capsula di Petri di vetro contenente carta da filtro sterile umida (Figura 2). Posizionare la capsula di Petri in un incubatore climatico artificiale a 30 °C e 80% di umidità relativa. Coltiva i semi di grano al buio per 3 giorni fino a quando non germinano e mettono radici.

Figura 1: Disinfezione dei semi di grano. I semi di grano sono stati immersi in una soluzione di H 2O 2al 10% (in un becher) per 15 minuti per disinfettare la superficie del seme. Fare clic qui per visualizzare una versione ingrandita di questa figura.
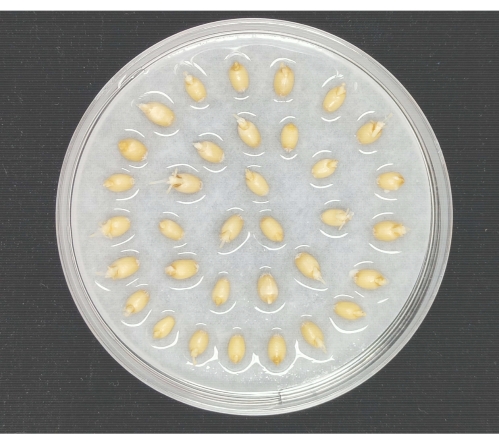
Figura 2: Germinazione dei semi di grano. I semi di grano sono stati distribuiti uniformemente in una capsula di Petri di vetro contenente carta da filtro sterile umida. La capsula di Petri è stata posta in un incubatore climatico artificiale per germinare i semi di grano. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Coltivazione di piantine di grano
- Sciogliere 551 mg della miscela di sali basali di Hoagland in 1 L di acqua deionizzata per preparare 1/2 soluzione nutritiva di Hoagland (contenente 0,75 mmol/L K2SO 4, 0,1 mmol/L KCl, 0,6 mmol/L MgSO 4, 4,0 × 10−2 mmol/L FeEDTA, 1,0 × 10−3 mmol/L H 3 BO3, 1,0 × 10−3 mmol/L MnSO4, 1,0 × 10−3 mmol/L ZnSO 4, 1,0 × 10−4 mmol/L CuSO 4 e 5,0 × 10−6 mmol/L Na2 MoO 4).
- Dopo che i semi di grano (fase 1.4) sono germinati, mettere 15 piantine di grano in attrezzature idroponiche (vedi Tabella dei materiali) contenenti 100 ml di 1/2 soluzione nutritiva Hoagland per l'idroponica (Figura 3). Porre l'intero apparato idroponico in un incubatore climatico artificiale (vedi Tabella dei materiali) e incubare per 7 giorni a 25 °C e 80% di umidità relativa con un fotoperiodo di 16 ore di luce/8 ore di buio.

Figura 3: Coltivazione idroponica delle piantine di grano. Le piantine di grano sono state coltivate idroponicamente per 0 giorni, 3 giorni e 7 giorni in 100 ml di 1/2 soluzione nutritiva Hoagland. Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Esperimento che espone le piante di grano alla soluzione di imidacloprid
- Dopo un periodo idroponico di 7 giorni, trapiantare le piante di grano in 1/2 soluzione nutritiva Hoagland contenente 0,5 mg/L o 5 mg/L di imidacloprid per condurre gli esperimenti di esposizione all'imidacloprid. Coltiva 15 piante di grano in ogni dispositivo idroponico. Impostare 15 dispositivi idroponici per ciascun gruppo di concentrazione di imidacloprid per garantire che durante il campionamento vengano prelevati campioni adeguati.
- Posizionare l'intera attrezzatura idroponica in un incubatore climatico artificiale per 3 giorni a 25 °C e 80% di umidità relativa con un fotoperiodo di 16 ore di luce/8 ore di buio.
- Durante tutto il periodo di esposizione, raccogliere quotidianamente le radici di grano (0,2 g per pianta di grano) e le foglie (0,5 g per pianta di grano). Integrare i campioni di grano di ogni quinto dispositivo idroponico come gruppo parallelo e determinare il contenuto di imidacloprid dei campioni.
4. Procedura per l'estrazione dell'imidacloprid dal frumento
- Estrazione di imidacloprid dalle radici di grano
- Per evitare errori sperimentali, lavare le radici di grano 4 volte con acqua sterile corrente per 10 s ogni volta per rimuovere l'imidacloprid adsorbito sulla superficie della radice.
- Tritare le radici di grano in pezzi di circa 1 cm con le forbici (Figura 4). Pesare 10,00 g delle radici di grano triturate e metterle in una provetta da centrifuga da 50 ml.
- Aggiungere 10 ml di acetonitrile al tubo della centrifuga e far vortice il tubo su un vortice per 1 minuto. Quindi, aggiungere 4 g diMgSO 4 anidro e 1,5 g di NaCl nel tubo della centrifuga e vortice immediatamente il tubo per 30 s. Centrifugare il tubo per 5 minuti a 6.000 x g.
- Aspirare il surnatante con una siringa monouso e passarlo attraverso un filtro a siringa (dimensione dei pori 0,22 μm) per ottenere il campione.
- Estrazione di imidacloprid dalle foglie di grano (Figura 5)
- Tritare le foglie di grano fresco in pezzi di circa 1 cm con le forbici (Figura 4). Pesare 10,00 g delle foglie di grano triturate e metterle in una provetta da centrifuga da 50 ml.
- Aggiungere 10 mL di acetonitrile al tubo della centrifuga e far vortice il tubo su un vortice per 1 minuto.
- Aggiungere 4 g diMgSO 4 anidro e 1,5 g di NaCl nel tubo della centrifuga e vorticare immediatamente il tubo per 30 s.
- Centrifugare il tubo per 5 minuti a 6.000 x g.
- Dopo la centrifugazione, aggiungere 2 mL di surnatante in una provetta da centrifuga da 5 mL contenente 50 mg di nerofumo grafitizzato (GCB) e 150 mg diMgSO 4 anidro (per rimuovere pigmento e umidità dal campione) e vortice la provetta della centrifuga per 30 s (Figura 6). Centrifugare il tubo per 5 minuti a 6.000 x g.
- Aspirare il surnatante con una siringa monouso e passarlo attraverso un filtro a siringa (dimensione dei pori 0,22 μm) per ottenere il campione.

Figura 4: Radici e foglie di grano triturate. Le radici e le foglie di grano fresco sono state triturate usando le forbici in pezzi di circa 1 cm. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Estrazione di imidacloprid nelle foglie di grano. L'imidacloprid nei campioni è stato estratto utilizzando il metodo QuEChERS (fasi 4.2.1-4.2.4 del protocollo). Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 6: Purificazione dell'imidacloprid nelle foglie di grano. Il decontaminante era 50 mg GCB + 150 mg MgSO4. Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Quantificazione dell'imidacloprid
- Quantificare l'imidacloprid nel campione utilizzando cromatografia liquida-spettrometria di massa tandem (LC-MS-MS), sulla base di una curva standard (y = 696,61x + 56,411, R=1) ottenuta da concentrazioni di imidacloprid di 0,2-250 μg/L. (Figura 7). Lo spettrometro di massa era dotato di una colonna C18 (100 mm x 2,1 mm, 3 μm) e di una sorgente di ionizzazione elettrospray (ESI+). Il programma di eluizione e i parametri della sorgente ionica sono mostrati nella Tabella 1.
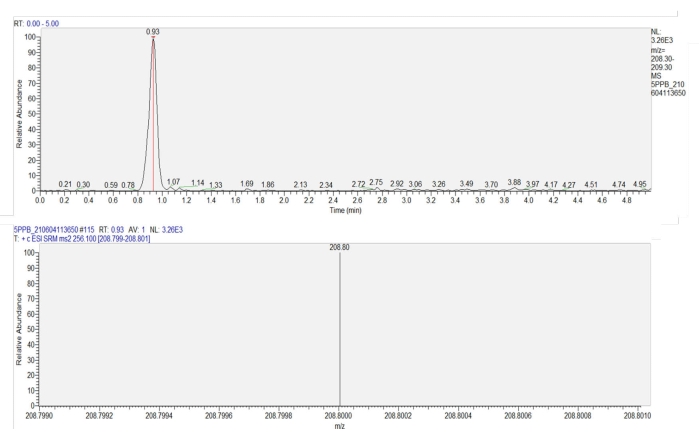
Figura 7: Cromatogramma e spettrogramma di massa dell'imidacloprid nelle foglie di grano. Il pannello superiore mostra un cromatogramma di imidacloprid (tempo di ritenzione = 0,93 min). Il pannello inferiore mostra lo spettrogramma di massa di imidacloprid a 0,93 min, mostrando l'intensità di risposta della produzione (m/z = 208,8) di imidacloprid. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Temperatura della colonna | 40 °C |
| Solvente A | 99,9% acqua/0,1% acido formico (v/v) |
| Solvente B | acetonitrile |
| Programma di eluizione | 0–0,5 min, A = 20% |
| 0,5–2 min, A = 20%–50% | |
| 2–3 min, A = 50% | |
| 3–3,1 min, A = 50%–20% | |
| 3,1–5 min, A=20% | |
| Portata (ml/min) | 0.3 |
| Volume di iniezione (μL) | 5 |
| Temperatura capillare (°C) | 330 |
| Temperatura vaporizzatore (°C) | 350 |
| Portata gas guaina (Arb) | 40 |
| Portata gas ausiliaria (Arb) | 20 |
| Tensione di spruzzo (V) | 3900 |
| Pressione del gas di collisione (mTorr) | 1.5 |
| Ione precursore | 256.1 |
| Prodotto ion/Energia di collisione (eV) | 208.8/16 |
Tabella 1: Programma di eluizione e parametri della sorgente ionica del metodo cromatografia-spettrometria di massa liquida.
Access restricted. Please log in or start a trial to view this content.
Risultati
Il limite strumentale di rilevazione (LOD) di imidacloprid era 5,76 × 10−14 g, e il LOD del metodo di imidacloprid nella radice o foglia di grano era di 0,01 μg/kg; Non è stato osservato alcun effetto matrice. Le rese recuperate di imidacloprid nel frumento sono indicate nella tabella 2. Le rese di recupero dell'imidacloprid dalle radici di frumento esposte a concentrazioni di imidacloprid di 0,5 mg/L e 5 mg/L sono state rispettivamente del 94,0%-97,6% e del 98,8%-99,2%; I coefficienti di...
Access restricted. Please log in or start a trial to view this content.
Discussione
Negli ultimi anni sono stati frequentemente riportati metodi per il pretrattamento e l'individuazione dei residui del pesticida imidacloprid. Badawy et al.23 hanno utilizzato la cromatografia liquida ad alte prestazioni per determinare il contenuto di imidacloprid nei frutti di pomodoro coltivati in condizioni di serra e hanno riportato una buona linearità per l'imidacloprid nell'intervallo 0,0125-0,15 μg / ml. Zhai et al.24 hanno usato LC-MS-MS per studiare il residuo di...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse. Tutti gli autori hanno letto e approvato il manoscritto. Questo lavoro non è stato pubblicato in precedenza, né è stato preso in considerazione da nessun'altra rivista peer-reviewed.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (n. 42277039).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | 01-06-1995 | Suitable for HPLC, gradient grade, >99.9% |
| Analytical balance | Sartorius Lab Instruments Co.Ltd. | GL124-1SCN | |
| Artificial climate incubator | Shanghai Badian Instrument Equipment Co. Ltd. | HK320 | |
| Centrifuge | Eppendorf China Co. Ltd. | Centrifuge5804 | |
| Disposable syringe | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Z116866 | Capacity 5 mL, graduated 0.2 mL, non-sterile |
| Formic acid | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Y0001970 | European pharmacopoeia reference standard |
| Graphitized carbon black (GCB) | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | V900058 | 45 μm |
| H2O2 | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | 31642 | 30% (w/w) |
| Hoagland’s Basal Salt Mixture | Shanghai Yu Bo Biotech Co. Ltd. | NS1011 | Anhydrous, reagent grade |
| Hydroponic equipment | Jiangsu Rongcheng Agricultural Science and Technology Development Co.Ltd. | SDZ04BD | |
| Hypersil BDS C18 column | Thermo Fisher Scientific (China) Co. Ltd. | 28103-102130 | |
| Imidacloprid | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Y0002028 | European pharmacopoeia reference standard |
| MgSO4 | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | 208094 | Anhydrous, reagent grade, >97% |
| NaCl | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | S9888 | Reagent grade, 99% |
| pH meter | Shanghai Thunder Magnetic Instrument Factory | PHSJ-3F | |
| Phytotron box | Harbin Donglian Electronic Technology Co. Ltd. | HPG-280B | |
| Pipettes | Eppendorf China Co. Ltd. | Research plus | |
| Syringe filter | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | SLGV033N | Nylon, 0.22 µm pore size, 33 mm, non-sterile |
| Ultra performance liquid chromatography tandem triple quadrupole mass spectrometry | Thermo Fisher Scientific (China) Co. Ltd. | UltiMate 3000 | |
| TSQ Quantum Access MAX | |||
| Vortex mixer | Shanghai Yetuo Technology Co. Ltd. | Vortex-2 | |
| Wheat seed | LuKe seed industry | Jimai 20 |
Riferimenti
- Lin, P. C., Lin, H. J., Liao, Y. Y., Guo, H. R., Chen, K. T. Acute poisoning with neonicotinoid insecticides: A case report and literature review. Basic & Clinical Pharmacology & Toxicology. 112 (4), 282-286 (2013).
- North, J. H., et al. Value of neonicotinoid insecticide seed treatments in Mid-South corn (Zea mays) production systems. Journal of Economic Entomology. 111 (1), 187-192 (2018).
- Simon-Delso, N., et al. Systemic insecticides (neonicotinoids and fipronil): Trends, uses, mode of action and metabolites. Environmental Science and Pollution Research. 22 (1), 5-34 (2015).
- Bass, C., Denholm, I., Williamson, M. S., Nauen, R. The global status of insect resistance to neonicotinoid insecticides. Pesticide Biochemistry and Physiology. 121, 78-87 (2015).
- Craddock, H. A., Huang, D., Turner, P. C., Quiros-Alcala, L., Payne-Sturges, D. C. Trends in neonicotinoid pesticide residues in food and water in the United States, 1999-2015. Environmental Health. 18 (1), 7(2019).
- Shao, X. S., Liu, Z. W., Xu, X. Y., Li, Z., Qian, X. H. Overall status of neonicotinoid insecticides in China: Production, application and innovation. Journal of Pesticide Science. 38 (1-2), 1-9 (2013).
- Zhao, Y., et al. Urinary neonicotinoid insecticides in children from South China: Concentrations, profiles and influencing factors. Chemosphere. 291, 132937(2022).
- Kurwadkar, S., Evans, A. Neonicotinoids: Systemic insecticides and systematic failure. Bulletin of Environmental Contamination and Toxicology. 97 (6), 745-748 (2016).
- Sadaria, A. M., et al. Passage of fiproles and imidacloprid from urban pest control uses through wastewater treatment plants in northern California, USA. Environmental Toxicology and Chemistry. 36 (6), 1473-1482 (2017).
- Damalas, C. A., Eleftherohorinos, I. G. Pesticide exposure, safety issues, and risk assessment indicators. International Journal of Environmental Research and Public Health. 8 (5), 1402-1419 (2011).
- Hayes, T. B., et al. Demasculinization and feminization of male gonads by atrazine: Consistent effects across vertebrate classes. Journal of Steroid Biochemistry and Molecular Biology. 127 (1-2), 64-73 (2011).
- Rani, L., et al. An extensive review on the consequences of chemical pesticides on human health and environment. Journal of Cleaner Production. 283, 124657(2021).
- Xu, Y. Q., et al. Ecotoxicity evaluation of azoxystrobin on Eisenia fetida in different soils. Environmental Research. 194, 110705(2021).
- Yavari, S., Malakahmad, A., Sapari, N. B. Biochar efficiency in pesticides sorption as a function of production variables-A review. Environmental Science and Pollution Research. 22 (18), 13824-13841 (2015).
- Delcour, I., Spanoghe, P., Uyttendaele, M. Literature review: Impact of climate change on pesticide use. Food Research International. 68, 7-15 (2015).
- Zhang, C. Y., et al. The application of the QuEChERS methodology in the determination of antibiotics in food: A review. TrAC-Trends in Analytical Chemistry. 118, 517-537 (2019).
- Wiilkowska, A., Biziuk, M. Determination of pesticide residues in food matrices using the QuEChERS methodology. Food Chemistry. 125 (3), 803-812 (2011).
- Ishii, Y., et al. HPLC determination of the new insecticide imidacloprid and its behavior in rice and cucumber. Journal of Agricultural and Food Chemistry. 42 (12), 2917-2921 (1994).
- Ko, A. Y., et al. Development of a simple extraction and oxidation procedure for the residue analysis of imidacloprid and its metabolites in lettuce using gas chromatography. Food Chemistry. 148, 402-409 (2014).
- Yuan, W. L., et al. Application of imidacloprid controlled-release granules to enhance the utilization rate and control wheat aphid on winter wheat. Journal of Integrative Agriculture. 19 (12), 3045-3053 (2020).
- Phugare, S. S., Kalyani, D. C., Gaikwad, Y. B., Jadhav, J. P. Microbial degradation of imidacloprid and toxicological analysis of its biodegradation metabolites in silkworm (Bombyx mori). Chemical Engineering Journal. 230, 27-35 (2013).
- Li, Y., et al. Uptake, translocation and accumulation of imidacloprid in six leafy vegetables at three growth stages. Ecotoxicology and Environmental Safety. 164, 690-695 (2018).
- Badawy, M. E. I., Ismail, A. M. E., Ibrahim, A. I. H. Quantitative analysis of acetamiprid and imidacloprid residues in tomato fruits under greenhouse conditions. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes. 54 (11), 898-905 (2019).
- Zhai, R. Q., et al. Residue, dissipation pattern, and dietary risk assessment of imidacloprid in Chinese chives. Frontiers in Nutrition. 9, 846333(2022).
- Aria, M. M., et al. Uptake and translocation monitoring of imidacloprid to chili and tomato plants by molecularly imprinting extraction - ion mobility spectrometry. Microchemical Journal. 144, 195-202 (2019).
- Chen, Y., et al. Translocation and metabolism of imidacloprid in cabbage: Application of C-14-labelling and LC-QTOF-MS. Chemosphere. 263, 127928(2021).
- Wild, S., Jones, K. Organic chemicals entering agricultural soils in sewage sludges: Screening for their potential to transfer to crop plants and livestock. Science of the Total Environment. 119, 85-119 (1992).
- Gong, W. W., et al. Uptake and dissipation of metalaxyl-M, fludioxonil, cyantraniliprole and thiamethoxam in greenhouse chrysanthemum. Environmental Pollution. 257, 113499(2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon