Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение абсорбции, транслокации и распределения имидаклоприда в пшенице
В этой статье
Резюме
Здесь представлен протокол определения абсорбции, транслокации и распределения имидаклоприда в пшенице в гидропонных условиях с использованием жидкостной хроматографии-тандемной масс-спектрометрии (ЖХ-МС-МС). Результаты показали, что имидаклоприд может поглощаться пшеницей, и имидаклоприд был обнаружен как в корнях, так и в листьях пшеницы.
Аннотация
Неоникотиноиды, класс инсектицидов, широко используются из-за их новых способов действия, высокой инсектицидной активности и сильного поглощения корней. Имидаклоприд, наиболее широко используемый инсектицид во всем мире, является репрезентативным неоникотиноидом первого поколения и используется для борьбы с вредителями сельскохозяйственных культур, овощей и фруктовых деревьев. При таком широком применении имидаклоприда его остатки в сельскохозяйственных культурах привлекают все большее внимание. В настоящем исследовании 15 проростков пшеницы помещали в питательную среду, содержащую 0,5 мг/л или 5 мг/л имидаклоприда для гидрокультуры. Содержание имидаклоприда в корнях и листьях пшеницы определяли через 1 день, 2 дня и 3 дня гидрокультуры для изучения миграции и распределения имидаклоприда в пшенице. Результаты показали, что имидаклоприд был обнаружен как в корнях, так и в листьях растения пшеницы, причем содержание имидаклоприда в корнях было выше, чем в листьях. Кроме того, концентрация имидаклоприда в пшенице увеличивалась с увеличением времени воздействия. После 3 дней воздействия корни и листья пшеницы в группе лечения 0,5 мг/л содержали 4,55 мг/кг ± 1,45 мг/кг и 1,30 мг/кг ± 0,08 мг/кг имидаклоприда, соответственно, в то время как корни и листья группы лечения 5 мг/л содержали 42,5 мг/кг ± 0,62 мг/кг и 8,71 мг/кг ± 0,14 мг/кг имидаклоприда, соответственно. Результаты настоящего исследования позволяют лучше понять остатки пестицидов в сельскохозяйственных культурах и служат справочными данными для оценки экологического риска, связанного с пестицидами.
Введение
В современной агрономии использование пестицидов имеет важное значение для повышения урожайности сельскохозяйственных культур. Неоникотиноидные инсектициды изменяют баланс мембранных потенциалов, контролируя никотиновые ацетилхолиновые рецепторы в нервной системе насекомых, тем самым ингибируя нормальную проводимость центральной нервной системы насекомого, что приводит к параличу и гибели насекомых1. По сравнению с традиционными инсектицидами неоникотиноиды обладают такими преимуществами, как новые способы действия, высокая инсектицидная активность и сильное поглощение корней, что делает их очень успешными на рынке пестицидов 2,3. Сообщается, что объем продаж неоникотиноидов составил 27% мирового рынка пестицидов в 2014 году. Среднегодовой темп роста неоникотиноидов составил 11,4% с 2005 по 2010 год, из которых около 7% было зарегистрировано в Китае 4,5,6%. С конца 2016 года по первое полугодие 2017 года продажи пестицидов в Китае начали восстанавливаться после падения, а цены на пестициды продолжали расти, среди которых значительный рост цен показали неоникотиноидные инсектициды7. К настоящему времени было разработано три поколения неоникотиноидных инсектицидов, каждое из которых содержит пиридинхлоридные, тиазолиловые и тетрагидрофурановые группы никотина, соответственно8.
Имидаклоприд представляет собой первое поколение неоникотиноидных инсектицидов, молекулярная формула которых C9H10ClN5O2 и представляет собой бесцветный кристалл. Имидаклоприд используется в основном для борьбы с вредителями, такими как тля, кузнечики, мучные черви и трипсы9 , и может применяться к таким культурам, как рис, пшеница, кукуруза, хлопок и овощи, такие как картофель, а также фруктовые деревья. Из-за долгосрочного, существенного и постоянного применения пестицидов количество как полезных насекомых, так и естественных врагов вредителей быстро сократилось, а некоторые сельскохозяйственные вредители стали устойчивыми к пестицидам, что привело к порочному кругу применения постоянных и растущих количеств пестицидов10. Кроме того, широкое применение пестицидов привело к ухудшению качества почвы, стойким остаткам пестицидов в сельскохозяйственной продукции и другим экологическим проблемам, которые не только наносят значительный ущерб сельскохозяйственной экологической среде11, но и представляют серьезную угрозу здоровью человека12. Распыление пестицидов серьезно влияет на рост и качество почвенных микробов и почвенных животных13. Необоснованное или чрезмерное использование пестицидов создало значительные риски для безопасности почвы и водной среды, животных и растений и даже жизни человека14. В последние годы проблема избыточных остатков пестицидов в сельскохозяйственных культурах стала более острой в связи с широким применением пестицидов. Когда имидаклоприд использовался для повышения урожайности овощей, скорость абсорбции имидаклоприда в овощах увеличивалась с увеличением количества и остатка имидаклоприда15. Поскольку пшеница является основной продовольственной культурой, ее производство и безопасность имеют решающее значение. Поэтому необходимо уточнить остатки и политику распределения пестицидов, используемых для пшеницы.
В последние годы было разработано множество методов извлечения остатков имидаклоприда из воды, почвы и растений. Метод QuEChERS (быстрый, простой, дешевый, эффективный, прочный и безопасный) представляет собой новый метод, который сочетает в себе технологию твердофазной микроэкстракции и технологию дисперсной твердофазной экстракции и включает использование ацетонитрила в качестве экстракционного растворителя и удаление смешанных примесей и воды в образце с использованием NaCl и безводного MgSO4 соответственно16. Метод QuEChERS требует минимального количества стеклянной посуды и имеет простые экспериментальные этапы, что делает его одним из самых популярных методов экстракции пестицидов17. Для обнаружения имидаклоприда предел обнаружения составляет всего 1 × 10−9 г18 был достигнут с помощью жидкостной хроматографии (ЖК), а 1 × 10−11 г 19 был достигнут с помощью газовой хроматографии (ГХ). Благодаря высокой разрешающей способности и чувствительности ЖК-МС и ГХ-МС показали еще более низкие пределы обнаружения имидаклоприда от 1 × 10-13 до 1 × 10-14 г 20,21; Таким образом, эти методы хорошо подходят для анализа следовых остатков имидаклоприда.
В настоящем исследовании имидаклоприд был выбран в качестве целевого загрязнителя, а пшеница была выбрана в качестве тестовой культуры для изучения распределения остатков имидаклоприда в пшенице. В этом протоколе подробно описывается метод всестороннего анализа обогащения и переноса пестицида имидаклоприда в пшенице путем изучения поглощения и хранения имидаклоприда в различных частях растений пшеницы, выращенных в условиях гидропоники. Настоящее исследование направлено на то, чтобы обеспечить теоретическую основу для оценки риска остатков пестицидов в пшенице, руководство по рациональному применению пестицидов в сельскохозяйственной производственной деятельности для сокращения остатков пестицидов и повышения безопасности растениеводства.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Проращивание семян пшеницы
- Выберите 1 000 семян пшеницы (Jimai 20) с полными гранулами, неповрежденными эмбрионами и однородным размером (длина: 6 мм ± 0,5 мм).
- 333,3 мл 30% раствора H 2 O 2 в мерную колбу объемом 1 л и разбавить деионизированной водой до приготовления 1 л 10% раствора H 2 O2. Погрузите семена пшеницы в 10% раствор H 2 O2на 15 минут для обеззараживания поверхности семян (рис. 1).
- Промойте семена пшеницы 5 раз проточной стерильной водой в течение 10 с каждый раз.
- Равномерно распределите семена пшеницы зародышами вверх в стеклянной чашке Петри, содержащей влажную стерильную фильтровальную бумагу (рис. 2). Поместите чашку Петри в инкубатор с искусственным климатом при температуре 30 °C и относительной влажности 80%. Культивируйте семена пшеницы в темноте в течение 3 дней, пока они не прорастут и не укоренятся.

Рисунок 1: Обеззараживание семян пшеницы. Семена пшеницы замачивали в 10% растворе H 2O2 (в стакане) на 15 мин для обеззараживания поверхности семян. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок 2: Проращивание семян пшеницы. Семена пшеницы равномерно распределяли в стеклянной чашке Петри, содержащей влажную стерильную фильтровальную бумагу. Чашка Петри была помещена в инкубатор с искусственным климатом для проращивания семян пшеницы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Выращивание проростков пшеницы
- Растворите 551 мг смеси базальных солей Хогланда в 1 л деионизированной воды для приготовления 1/2 питательного раствора Hoagland (содержащего 0,75 ммоль/л K2SO 4, 0,1 ммоль/л KCl, 0,6 ммоль/л MgSO 4,4,0 × 10−2 ммоль/л FeEDTA, 1,0 × 10−3 ммоль/л H3 BO3, 1,0 × 10−3ммоль/лMnSO4, 1,0 × 10−3 ммоль/л ZnSO4, 1,0 × 10−4 ммоль/лCuSO4 и 5,0 × 10−6 ммоль/л Na2 MoO4).
- После того, как семена пшеницы (шаг 1.4) прорастут, поместите 15 проростков пшеницы в гидропонное оборудование (см. Таблицу материалов), содержащее 100 мл 1/2 питательного раствора Hoagland для гидропоники (рис. 3). Поместите весь гидропонный аппарат в инкубатор с искусственным климатом (см. Таблицу материалов) и инкубируйте в течение 7 дней при температуре 25 ° C и относительной влажности 80% с 16-часовым светлым / 8-часовым темным фотопериодом.

Рисунок 3: Гидропонное выращивание проростков пшеницы. Проростки пшеницы выращивали на гидропонике в течение 0 дней, 3 дней и 7 дней в 100 мл 1/2 питательного раствора Hoagland. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Поэкспериментируйте, подвергая растения пшеницы воздействию раствора имидаклоприда
- После 7-дневного гидропонного периода пересадите растения пшеницы в 1/2 питательного раствора Hoagland, содержащего 0,5 мг / л или 5 мг / л имидаклоприда, для проведения экспериментов по воздействию имидаклоприда. Выращивайте 15 растений пшеницы в каждом гидропонном устройстве. Установите 15 гидропонных устройств для каждой группы концентрации имидаклоприда, чтобы обеспечить отбор адекватных проб во время отбора проб.
- Поместите все гидропонное оборудование в инкубатор с искусственным климатом на 3 дня при температуре 25 ° C и относительной влажности 80% с 16-часовым светлым / 8-часовым темным фотопериодом.
- В течение всего периода воздействия ежедневно собирайте корни пшеницы (0,2 г на растение пшеницы) и листья (0,5 г на растение пшеницы). Интегрируйте образцы пшеницы из каждого пятого гидропонного устройства в параллельную группу и определите содержание имидаклоприда в образцах.
4. Порядок извлечения имидаклоприда из пшеницы
- Извлечение имидаклоприда из корней пшеницы
- Чтобы избежать экспериментальных ошибок, промывайте корни пшеницы 4 раза проточной стерильной водой в течение 10 с каждый раз, чтобы удалить имидаклоприд, адсорбированный на поверхности корня.
- Измельчите корни пшеницы ножницами примерно на кусочки размером примерно 1 см (рис. 4). Взвесьте 10,00 г измельченных корней пшеницы и поместите в центрифужную пробирку объемом 50 мл.
- Добавьте 10 мл ацетонитрила в центрифужную пробирку и встряхните пробирку на вихре в течение 1 мин. Затем добавьте 4 г безводного MgSO4 и 1,5 г NaCl в центрифужную пробирку и сразу же встряхните пробирку в течение 30 с. Центрифугируйте пробирку в течение 5 мин при 6 000 x g.
- Аспирируйте надосадочную жидкость одноразовым шприцем и пропустите ее через шприцевой фильтр (размер пор 0,22 мкм) для получения образца.
- Извлечение имидаклоприда из листьев пшеницы (рис. 5)
- Измельчите свежие листья пшеницы ножницами примерно на кусочки размером примерно 1 см (рис. 4). Взвесьте 10,00 г измельченных листьев пшеницы и поместите в центрифужную пробирку объемом 50 мл.
- Добавьте 10 мл ацетонитрила в центрифужную пробирку и встряхните пробирку на вихре в течение 1 мин.
- Добавьте 4 г безводного MgSO4 и 1,5 г NaCl в центрифужную пробирку и немедленно встряхните пробирку в течение 30 с.
- Центрифугируйте пробирку в течение 5 мин при 6 000 x g.
- После центрифугирования добавьте 2 мл надосадочной жидкости в центрифужную пробирку объемом 5 мл, содержащую 50 мг графитированного технического углерода (GCB) и 150 мг безводного MgSO4 (для удаления пигмента и влаги из образца), и встряхните центрифужную пробирку в течение 30 с (рис. 6). Центрифугируйте пробирку в течение 5 мин при 6 000 x g.
- Аспирируйте надосадочную жидкость одноразовым шприцем и пропустите ее через шприцевой фильтр (размер пор 0,22 мкм) для получения образца.

Рисунок 4: Измельченные корни и листья пшеницы. Свежие корни и листья пшеницы измельчали ножницами примерно на кусочки размером примерно 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Экстракция имидаклоприда в листьях пшеницы. Имидаклоприд в образцах был выделен с помощью метода QuEChERS (этапы 4.2.1-4.2.4 протокола). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Очистка имидаклоприда в листьях пшеницы. Обеззараживающее вещество составляло 50 мг GCB + 150 мг MgSO4. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Количественная оценка имидаклоприда
- Количественно определите имидаклоприд в образце с помощью жидкостной хроматографии-тандемной масс-спектрометрии (ЖХ-МС-МС) на основе стандартной кривой (y = 696,61x + 56,411, R = 1), полученной из концентраций имидаклоприда 0,2-250 мкг/л. (Рисунок 7). Масс-спектрометр был оснащен колонкой C18 (100 мм x 2,1 мм, 3 мкм) и источником ионизации электрораспылением (ESI+). Программа элюирования и параметры источника ионов приведены в таблице 1.
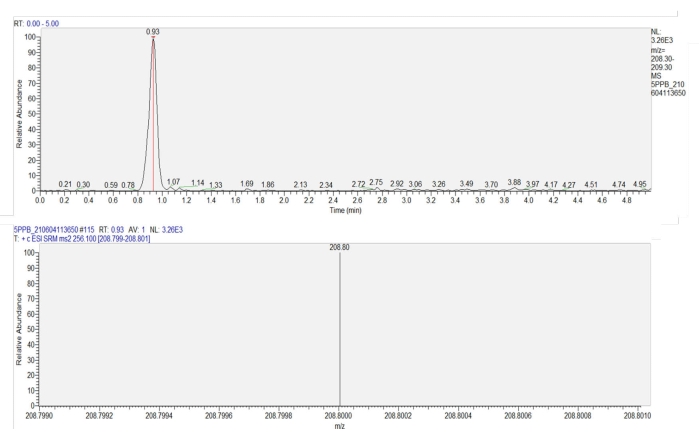
Рисунок 7: Хроматограмма и масс-спектрограмма имидаклоприда в листьях пшеницы. На верхней панели показана хроматограмма имидаклоприда (время удержания = 0,93 мин). На нижней панели показана масс-спектрограмма имидаклоприда через 0,93 мин, показывающая интенсивность отклика продукции (m/z = 208,8) имидаклоприда. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Температура колонны | 40 °С |
| Растворитель А | 99,9% воды/0,1% муравьиной кислоты (об./об.) |
| Растворитель Б | ацетонитрил |
| Программа элюции | 0–0,5 мин, А = 20% |
| 0,5–2 мин, А = 20–50% | |
| 2–3 мин, А = 50% | |
| 3–3,1 мин, А = 50–20% | |
| 3,1–5 мин, А=20% | |
| Расход (мл/мин) | 0.3 |
| Объем впрыска (мкл) | 5 |
| Температура капилляров (°C) | 330 |
| Температура испарителя (°C) | 350 |
| Расход газа в оболочке (Arb) | 40 |
| Расход вспомогательного газа (Arb) | 20 |
| Напряжение распыления (В) | 3900 |
| Давление ударного газа (мТорр) | 1.5 |
| Ион-предшественник | 256.1 |
| Ион продукта/энергия столкновения (эВ) | 208.8/16 |
Таблица 1: Программа элюирования и параметры источника ионов методом жидкостной хромато-масс-спектрометрии.
Access restricted. Please log in or start a trial to view this content.
Результаты
Инструментальный предел обнаружения (LOD) имидаклоприда составлял 5,76 × 10−14 г, а LOD имидаклоприда в корне или листе пшеницы составлял 0,01 мкг/кг; Матричного эффекта не наблюдалось. Восстановительные урожаи имидаклоприда в пшенице приведены в таблице 2. Выход имидаклоприда и?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В последние годы часто сообщалось о методах предварительной обработки и обнаружения остатков пестицида имидаклоприда. Badawy et al.23 использовали высокоэффективную жидкостную хроматографию для определения содержания имидаклоприда в плодах томатов, выращенных в тепличных ус...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов. Все авторы прочитали и одобрили рукопись. Эта работа не была опубликована ранее и не рассматривается каким-либо другим рецензируемым журналом.
Благодарности
Работа выполнена при поддержке Национального фонда естественных наук Китая (No 42277039).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | 01-06-1995 | Suitable for HPLC, gradient grade, >99.9% |
| Analytical balance | Sartorius Lab Instruments Co.Ltd. | GL124-1SCN | |
| Artificial climate incubator | Shanghai Badian Instrument Equipment Co. Ltd. | HK320 | |
| Centrifuge | Eppendorf China Co. Ltd. | Centrifuge5804 | |
| Disposable syringe | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Z116866 | Capacity 5 mL, graduated 0.2 mL, non-sterile |
| Formic acid | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Y0001970 | European pharmacopoeia reference standard |
| Graphitized carbon black (GCB) | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | V900058 | 45 μm |
| H2O2 | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | 31642 | 30% (w/w) |
| Hoagland’s Basal Salt Mixture | Shanghai Yu Bo Biotech Co. Ltd. | NS1011 | Anhydrous, reagent grade |
| Hydroponic equipment | Jiangsu Rongcheng Agricultural Science and Technology Development Co.Ltd. | SDZ04BD | |
| Hypersil BDS C18 column | Thermo Fisher Scientific (China) Co. Ltd. | 28103-102130 | |
| Imidacloprid | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Y0002028 | European pharmacopoeia reference standard |
| MgSO4 | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | 208094 | Anhydrous, reagent grade, >97% |
| NaCl | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | S9888 | Reagent grade, 99% |
| pH meter | Shanghai Thunder Magnetic Instrument Factory | PHSJ-3F | |
| Phytotron box | Harbin Donglian Electronic Technology Co. Ltd. | HPG-280B | |
| Pipettes | Eppendorf China Co. Ltd. | Research plus | |
| Syringe filter | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | SLGV033N | Nylon, 0.22 µm pore size, 33 mm, non-sterile |
| Ultra performance liquid chromatography tandem triple quadrupole mass spectrometry | Thermo Fisher Scientific (China) Co. Ltd. | UltiMate 3000 | |
| TSQ Quantum Access MAX | |||
| Vortex mixer | Shanghai Yetuo Technology Co. Ltd. | Vortex-2 | |
| Wheat seed | LuKe seed industry | Jimai 20 |
Ссылки
- Lin, P. C., Lin, H. J., Liao, Y. Y., Guo, H. R., Chen, K. T. Acute poisoning with neonicotinoid insecticides: A case report and literature review. Basic & Clinical Pharmacology & Toxicology. 112 (4), 282-286 (2013).
- North, J. H., et al. Value of neonicotinoid insecticide seed treatments in Mid-South corn (Zea mays) production systems. Journal of Economic Entomology. 111 (1), 187-192 (2018).
- Simon-Delso, N., et al. Systemic insecticides (neonicotinoids and fipronil): Trends, uses, mode of action and metabolites. Environmental Science and Pollution Research. 22 (1), 5-34 (2015).
- Bass, C., Denholm, I., Williamson, M. S., Nauen, R. The global status of insect resistance to neonicotinoid insecticides. Pesticide Biochemistry and Physiology. 121, 78-87 (2015).
- Craddock, H. A., Huang, D., Turner, P. C., Quiros-Alcala, L., Payne-Sturges, D. C. Trends in neonicotinoid pesticide residues in food and water in the United States, 1999-2015. Environmental Health. 18 (1), 7(2019).
- Shao, X. S., Liu, Z. W., Xu, X. Y., Li, Z., Qian, X. H. Overall status of neonicotinoid insecticides in China: Production, application and innovation. Journal of Pesticide Science. 38 (1-2), 1-9 (2013).
- Zhao, Y., et al. Urinary neonicotinoid insecticides in children from South China: Concentrations, profiles and influencing factors. Chemosphere. 291, 132937(2022).
- Kurwadkar, S., Evans, A. Neonicotinoids: Systemic insecticides and systematic failure. Bulletin of Environmental Contamination and Toxicology. 97 (6), 745-748 (2016).
- Sadaria, A. M., et al. Passage of fiproles and imidacloprid from urban pest control uses through wastewater treatment plants in northern California, USA. Environmental Toxicology and Chemistry. 36 (6), 1473-1482 (2017).
- Damalas, C. A., Eleftherohorinos, I. G. Pesticide exposure, safety issues, and risk assessment indicators. International Journal of Environmental Research and Public Health. 8 (5), 1402-1419 (2011).
- Hayes, T. B., et al. Demasculinization and feminization of male gonads by atrazine: Consistent effects across vertebrate classes. Journal of Steroid Biochemistry and Molecular Biology. 127 (1-2), 64-73 (2011).
- Rani, L., et al. An extensive review on the consequences of chemical pesticides on human health and environment. Journal of Cleaner Production. 283, 124657(2021).
- Xu, Y. Q., et al. Ecotoxicity evaluation of azoxystrobin on Eisenia fetida in different soils. Environmental Research. 194, 110705(2021).
- Yavari, S., Malakahmad, A., Sapari, N. B. Biochar efficiency in pesticides sorption as a function of production variables-A review. Environmental Science and Pollution Research. 22 (18), 13824-13841 (2015).
- Delcour, I., Spanoghe, P., Uyttendaele, M. Literature review: Impact of climate change on pesticide use. Food Research International. 68, 7-15 (2015).
- Zhang, C. Y., et al. The application of the QuEChERS methodology in the determination of antibiotics in food: A review. TrAC-Trends in Analytical Chemistry. 118, 517-537 (2019).
- Wiilkowska, A., Biziuk, M. Determination of pesticide residues in food matrices using the QuEChERS methodology. Food Chemistry. 125 (3), 803-812 (2011).
- Ishii, Y., et al. HPLC determination of the new insecticide imidacloprid and its behavior in rice and cucumber. Journal of Agricultural and Food Chemistry. 42 (12), 2917-2921 (1994).
- Ko, A. Y., et al. Development of a simple extraction and oxidation procedure for the residue analysis of imidacloprid and its metabolites in lettuce using gas chromatography. Food Chemistry. 148, 402-409 (2014).
- Yuan, W. L., et al. Application of imidacloprid controlled-release granules to enhance the utilization rate and control wheat aphid on winter wheat. Journal of Integrative Agriculture. 19 (12), 3045-3053 (2020).
- Phugare, S. S., Kalyani, D. C., Gaikwad, Y. B., Jadhav, J. P. Microbial degradation of imidacloprid and toxicological analysis of its biodegradation metabolites in silkworm (Bombyx mori). Chemical Engineering Journal. 230, 27-35 (2013).
- Li, Y., et al. Uptake, translocation and accumulation of imidacloprid in six leafy vegetables at three growth stages. Ecotoxicology and Environmental Safety. 164, 690-695 (2018).
- Badawy, M. E. I., Ismail, A. M. E., Ibrahim, A. I. H. Quantitative analysis of acetamiprid and imidacloprid residues in tomato fruits under greenhouse conditions. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes. 54 (11), 898-905 (2019).
- Zhai, R. Q., et al. Residue, dissipation pattern, and dietary risk assessment of imidacloprid in Chinese chives. Frontiers in Nutrition. 9, 846333(2022).
- Aria, M. M., et al. Uptake and translocation monitoring of imidacloprid to chili and tomato plants by molecularly imprinting extraction - ion mobility spectrometry. Microchemical Journal. 144, 195-202 (2019).
- Chen, Y., et al. Translocation and metabolism of imidacloprid in cabbage: Application of C-14-labelling and LC-QTOF-MS. Chemosphere. 263, 127928(2021).
- Wild, S., Jones, K. Organic chemicals entering agricultural soils in sewage sludges: Screening for their potential to transfer to crop plants and livestock. Science of the Total Environment. 119, 85-119 (1992).
- Gong, W. W., et al. Uptake and dissipation of metalaxyl-M, fludioxonil, cyantraniliprole and thiamethoxam in greenhouse chrysanthemum. Environmental Pollution. 257, 113499(2020).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены