JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
밀에서 imidacloprid의 흡수, 전위 및 분포 측정
요약
여기에 제시된 것은 액체 크로마토그래피-탠덤 질량 분석법(LC-MS-MS)을 사용하여 수경 조건 하에서 밀에서 이미다클로프리드의 흡수, 전위 및 분포를 측정하기 위한 프로토콜입니다. 결과는 이미다클로프리드가 밀에 흡수될 수 있고 이미다클로프리드가 밀 뿌리와 잎 모두에서 검출된다는 것을 보여주었습니다.
초록
살충제의 일종인 네오니코티노이드는 새로운 작용 방식, 높은 살충 활성 및 강력한 뿌리 흡수로 인해 널리 사용됩니다. 전 세계적으로 가장 널리 사용되는 살충제인 이미다클로프리드는 대표적인 1세대 네오니코티노이드로 작물, 채소, 과수나무의 해충 방제에 사용됩니다. 이미다클로프리드의 광범위한 적용으로 인해 작물의 잔류물에 대한 조사가 증가하고 있습니다. 본 연구에서는 수경 배양을 위해 15개의 밀 묘목을 0.5mg/L 또는 5mg/L 이미다클로프리드를 함유하는 배양 배지에 넣었습니다. 밀 뿌리와 잎의 이미다클로프리드 함량은 밀에서 이미다클로프리드의 이동과 분포를 탐색하기 위해 1일, 2일, 3일의 수경 배양 후에 결정되었습니다. 그 결과 이미다클로프리드는 밀 식물의 뿌리와 잎 모두에서 검출되었으며 뿌리의 이미다클로프리드 함량은 잎의 함량보다 높았다. 또한, 밀의 이미다클로프리드 농도는 노출 시간이 증가함에 따라 증가했습니다. 노출 3일 후, 0.5mg/L 처리군의 밀의 뿌리와 잎은 각각 4.55mg/kg ± 1.45mg/kg 및 1.30mg/kg ± 0.08mg/kg 이미다클로프리드를 함유한 반면, 5mg/L 처리군의 뿌리와 잎은 0.62mg/kg 및 8.71mg/kg ± 0.14mg/kg 이미다클로프리드± 각각 함유하고, 각각. 본 연구의 결과는 작물의 잔류 농약에 대한 더 나은 이해를 가능하게 하고 농약의 환경 위험 평가를 위한 데이터 참조를 제공합니다.
서문
오늘날의 농경학에서 농약의 사용은 작물 수확량을 증가시키는 데 필수적입니다. 네오니코티노이드 살충제는 곤충 신경계의 니코틴성 아세틸콜린 수용체를 조절하여 막 전위 균형을 변화시켜 곤충 중추신경계의 정상적인 전도를 억제하여 곤충의 마비와 죽음을 초래한다1. 전통적인 살충제와 비교할 때, 네오니코티노이드는 새로운 작용 방식, 높은 살충 활성, 강력한 뿌리 흡수와 같은 장점을 가지고 있어 살충제 시장에서 큰 성공을 거두었다 2,3. 네오니코티노이드의 판매량은 2014년 세계 살충제 시장의 27%를 차지하는 것으로 보고되었습니다. 네오니코티노이드의 연평균 성장률은 2005년부터 2010년까지 11.4%였으며 그 중 약 7%가 중국에 등록되었습니다 4,5,6. 2016 년 말부터 2017 년 상반기까지 중국의 살충제 판매는 하락 후 반등하기 시작했으며 살충제 가격은 계속 상승했으며 그 중 네오 니코 티 노이드 살충제는 상당한 가격 상승을 보였다7. 지금까지 3 세대의 네오 니코 티 노이드 살충제가 개발되었으며, 각각 피리딘 클로라이드, 티아 졸릴 및 테트라 히드로 푸란 그룹의 니코틴을 각각 함유하고 있습니다8.
이미다클로프리드는 분자식이 C9H10ClN5O2인 네오니코티노이드살충제의 1세대를 나타내며 무색의 결정이다. 이미다클로프리드는 주로 진딧물, 식물매, 거저리, 총채벌레등의 해충을 방제하는 데 사용되며9 쌀, 밀, 옥수수, 면화, 감자 등의 채소, 과수 등의 작물에 적용할 수 있다. 살충제의 장기적, 실질적, 지속적인 살포로 인해 유익한 곤충과 해충의 천적이 급격히 감소하고 일부 농업 해충이 살충제에 내성을 갖게 되어 살충제를 지속적으로 사용하는 악순환이 발생한다10. 또한, 농약의 광범위한 적용은 토양의 질 악화, 농산물의 잔류농약 잔류물 및 기타 생태학적 문제로 이어져 농업 생태환경11에 심각한 피해를 줄 뿐만 아니라 인간의 건강(12)에 심각한 위협이 된다. 살충제 살포는 토양 미생물과 토양 동물의 성장과 품질에 심각한 영향을 미친다13. 살충제의 불합리하거나 과도한 사용은 토양과 수질 환경, 동식물, 심지어 인간의 생명에 심각한 보안 위험을 초래했습니다14. 최근 몇 년 동안 농약의 광범위한 적용으로 작물의 과도한 농약 잔류 물 문제가 더욱 심각 해졌습니다. 채소 수확량을 증가시키기 위해 이미다클로프리드를 사용했을 때, 채소에서 이미다클로프리드의 흡수율은 이미다클로프리드의 양과 잔류물이 증가함에 따라 증가하였다15. 주요 식량 작물로서 밀의 생산과 안전은 모두 중요합니다. 따라서 밀에 사용되는 농약의 잔류 및 유통 정책을 명확히 할 필요가있다.
최근 몇 년 동안 물, 토양 및 식물에서 이미다클로프리드 잔류물을 추출하기 위한 많은 방법이 개발되었습니다. QuEChERS 분석법(빠르고, 쉽고, 저렴하고, 효과적이고, 견고하고, 안전함)은 고체상 미세 추출 기술과 분산 고체상 추출 기술을 결합한 새로운 분석법으로, 아세토니트릴을 추출 용매로 사용하고 각각 NaCl 및 무수MgSO4를 사용하여 시료에서 혼합 불순물과 물을 제거하는 방법을 포함한다16. QuEChERS 분석법은 최소한의 유리 제품을 필요로 하고 실험 단계가 간단하여 가장 인기 있는 농약 추출 방법중 하나입니다 17. 이미다클로프리드의 검출을 위해 액체 크로마토그래피(LC)로 1 × 10-9 g18의 낮은 검출 한계를 달성했으며, 가스 크로마토그래피(GC)를 사용하여 1 × 10-11 g 19의 검출 한계를 달성했습니다. 높은 분해능과 감도로 인해 LC-MS 및 GC-MS는 10-13× 10-14g × 1 훨씬 더 낮은 이미다클로프리드 검출 한계를 보여주었습니다 20,21; 따라서 이러한 기술은 미량의 이미다클로프리드 잔류물 분석에 매우 적합합니다.
본 연구에서는 이미다클로프리드를 대상 오염물질로 선택하고 밀의 이미다클로프리드 잔류물 분포를 연구하기 위해 시험 작물로 밀을 선택하였다. 이 프로토콜은 수경 재배 조건에서 재배된 밀 식물의 다른 부분에서 이미다클로프리드의 흡수 및 저장을 탐색하여 밀에서 살충제 이미다클로프리드의 농축 및 전달에 대한 포괄적인 분석을 위한 방법을 자세히 설명합니다. 본 연구는 밀의 잔류 농약의 위험성 평가를위한 이론적 근거를 제공하고, 농약 잔류 물을 줄이기 위해 농업 생산 활동에 농약을 합리적으로 적용하도록 안내하고, 작물 생산의 안전성을 향상시키는 것을 목표로한다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 밀 종자의 발아
- 완전한 과립, 온전한 배아 및 균일한 크기(길이: 6mm ± 0.5mm)의 밀 종자 1,000개(지마이 20)를 선택합니다.
- 333.3 mL의 30% H2O2 용액을 1 L 부피 플라스크에 옮기고, 탈이온수로 희석하여 1 L의 10%H2O2용액을 제조하였다. 밀 종자를 10%H2O2용액에 15분 동안 담가 종자 표면을 소독합니다(그림 1).
- 매번 10초 동안 흐르는 멸균수로 밀 씨앗을 5번 헹굽니다.
- 축축한 멸균 여과지가 들어 있는 유리 페트리 접시에 배아가 위를 향하도록 밀 씨앗을 고르게 펴십시오(그림 2). 페트리 접시를 30°C 및 80% 상대 습도의 인공 기후 인큐베이터에 넣습니다. 밀 씨앗이 발아하고 뿌리를 내릴 때까지 3 일 동안 어둠 속에서 배양하십시오.

그림 1 : 밀 종자의 소독. 밀 종자를 10%H2O2용액(비이커 중)에 15분 동안 담가 종자 표면을 소독하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
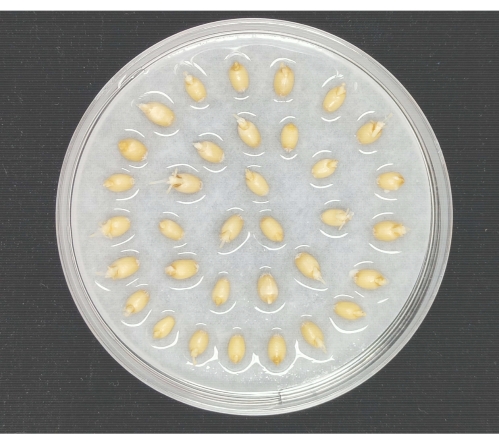
그림 2 : 밀 씨앗 발아. 밀 종자는 촉촉한 멸균 여과지가 들어있는 유리 페트리 접시에 고르게 퍼졌습니다. 페트리 접시는 밀 씨앗을 발아시키기 위해 인공 기후 인큐베이터에 넣었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 밀 묘목 재배
- Hoagland의 기초 염 혼합물 551 mg을 탈 이온수 1 L에 용해시켜 1/2 Hoagland 영양 용액 (0.75 mmol / L K 2 SO 4, 0.1 mmol / L KCl, 0.6 mmol / L MgSO 4, 4.0 × 10-2 mmol / L FeEDTA, 1.0 × 10-3 mmol / L H 3 BO 3, 1.0 × 10-3 mmol / L MnSO 4, 1.0 × 10-3 mmol / L ZnSO 4, 1.0 × 10-4 mmol / L CuSO 4 및 5.0 × 10-6 mmol / L Na2 MoO 4).
- 밀 종자 (1.4 단계)가 발아 한 후 수경 재배 용 1/100 Hoagland 영양 용액 100mL가 들어있는 수경 재배 장비 ( 재료 표 참조)에 2 개의 밀 묘목을 넣습니다 (그림 3). 전체 수경 재배 장치를 인공 기후 인큐베이터( 재료 표 참조)에 넣고 7시간 밝기/25시간 어두운 광주기로 80°C 및 80% 상대 습도에서 16일 동안 배양합니다.

그림 3: 밀 묘목의 수경재배. 밀 묘목을 1/2 Hoagland 영양 용액 100mL에서 0 일, 3 일 및 7 일 동안 수경 재배 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 밀 식물을 이미다클로프리드 용액에 노출시키는 실험
- 7일간의 수경재배 후 밀 식물을 0.5mg/L 또는 5mg/L 이미다클로프리드를 함유한 1/2 Hoagland 영양 용액에 이식하여 이미다클로프리드 노출 실험을 수행합니다. 각 수경 재배 장치에서 15 개의 밀 식물을 재배하십시오. 샘플링 중에 적절한 샘플을 채취할 수 있도록 각 imidacloprid 농도 그룹에 대해 15개의 수경 재배 장치를 설정합니다.
- 전체 수경 재배 장비를 인공 기후 인큐베이터에 3 ° C 및 25 % 상대 습도에서 80 일 동안 16 시간 밝기 / 8 시간 어두운 광주기로 놓습니다.
- 노출 기간 동안 매일 밀 뿌리 (밀 식물 당 0.2g)와 잎 (밀 식물 당 0.5g)을 수집하십시오. 매 5 번째 수경 재배 장치의 밀 샘플을 병렬 그룹으로 통합하고 샘플의 이미다 클로 프리드 함량을 결정합니다.
4. 밀에서 이미다클로프리드를 추출하는 절차
- 밀 뿌리에서 이미다클로프리드 추출
- 실험 오류를 피하기 위해 매번 10초 동안 흐르는 멸균수로 밀 뿌리를 4배 세척하여 뿌리 표면에 흡착된 이미다클로프리드를 제거합니다.
- 가위로 밀 뿌리를 약 1cm 크기로 잘게 썬다(그림 4). 잘게 썬 밀 뿌리 10.00g의 무게를 달아 50mL 원심분리기 튜브에 넣습니다.
- 원심분리기 튜브에 아세토니트릴 10mL를 넣고 튜브를 1분 동안 볼텍서에서 소용돌이칩니다. 그런 다음 무수 MgSO4 4g과 NaCl 1.5g을 원심분리기 튜브에 넣고 튜브를 즉시 30초 동안 와동시킵니다. 튜브를 6,000 x g에서 5분 동안 원심분리합니다.
- 일회용 주사기로 상층액을 흡인하고 주사기 필터(0.22μm 공극 크기)에 통과시켜 시료를 얻습니다.
- 밀 잎에서 이미다클로프리드 추출(그림 5)
- 신선한 밀 잎을 가위로 약 1cm 크기로 잘게 썬다(그림 4). 잘게 썬 밀 잎 10.00g의 무게를 달아 50mL 원심분리기 튜브에 넣습니다.
- 원심분리기 튜브에 아세토니트릴 10mL를 넣고 튜브를 볼텍서에서 1분 동안 소용돌이칩니다.
- 무수 MgSO4 4g과 NaCl 1.5g을 원심분리기 튜브에 넣고 튜브를 즉시 30초 동안 소용돌이칩니다.
- 튜브를 6,000 x g에서 5분 동안 원심분리합니다.
- 원심분리 후 50mg의 흑연화 카본 블랙(GCB)과 150mg의 무수MgSO4 (샘플에서 색소와 수분을 제거하기 위해)가 들어 있는 5mL 원심분리기 튜브에 상층액 2mL를 넣고 원심분리기 튜브를 30초 동안 와동시킵니다(그림 6). 튜브를 6,000 x g에서 5분 동안 원심분리합니다.
- 일회용 주사기로 상층액을 흡인하고 주사기 필터(0.22μm 공극 크기)에 통과시켜 시료를 얻습니다.

그림 4: 갈가리 찢긴 밀 뿌리와 잎. 신선한 밀 뿌리와 잎은 가위를 사용하여 약 1cm 조각으로 잘게 썬다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 밀 잎에서 이미다클로프리드의 추출. 샘플에서 이미다클로프리드는 QuEChERS 방법(프로토콜의 단계 4.2.1-4.2.4)을 사용하여 추출하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 밀 잎의 이미다클로프리드 정제. 오염제거제는 50 mg GCB + 150 mgMgSO4였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 이미다클로프리드의 정량화
- 0.2-250 μg/L 이미다클로프리드 농도에서 얻은 표준 곡선(y = 696.61x + 56.411, R=1)을 기반으로 액체 크로마토그래피-탠덤 질량 분석법(LC-MS-MS)을 사용하여 샘플의 이미다클로프리드를 정량합니다. (그림 7). 질량 분석기에는 C 18 컬럼(100mm x2.1mm , 3μm)과 전기분무 이온화 소스(ESI+)가 장착되었습니다. 용출 프로그램 및 이온 소스 파라미터는 표 1에 나와 있습니다.
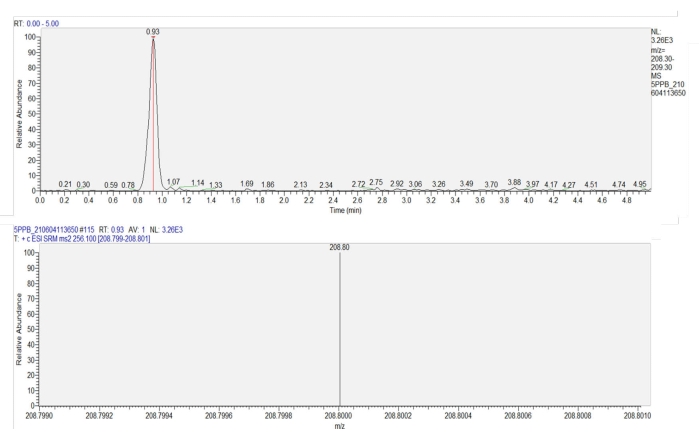
그림 7: 밀 잎에서 이미다클로프리드의 크로마토그램 및 질량 분석기. 상부 패널은 이미다클로프리드의 크로마토그램을 보여준다(머무름 시간 = 0.93분). 하단 패널은 0.93분에서 이미다클로프리드의 질량 분석기를 보여주며, 이미다클로프리드 생산의 반응 강도(m/z = 208.8)를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 컬럼 온도 | 섭씨 40도 |
| 용매 A | 99.9% 물/0.1% 포름산(v/v) |
| 솔벤트 B | 아세토니트릴 |
| 용출 프로그램 | 0–0.5분, A = 20% |
| 0.5–2분, A = 20%–50% | |
| 2-3분, A = 50% | |
| 3–3.1분, A = 50%–20% | |
| 3.1–5분, A=20% | |
| 유속(mL/min) | 0.3 |
| 주입량(μL) | 5 |
| 모세관 온도(°C) | 330 |
| 기화기 온도(°C) | 350 |
| 피복 가스 유량(Arb) | 40 |
| 보조 가스 유량(Arb) | 20 |
| 살포 전압 (V) | 3900 |
| 충돌 가스 압력(mTorr) | 1.5 |
| 전구체 이온 | 256.1 |
| 생성물 이온/충돌 에너지(eV) | 208.8/16 |
표 1: 액체 크로마토그래피-질량 분석법의 용리 프로그램 및 이온 소스 매개변수.
Access restricted. Please log in or start a trial to view this content.
결과
이미다클로프리드의 기기 검출 한계(LOD)는 5.76 × 10-14g 이었고, 방법의 밀 뿌리 또는 잎에서 이미다클로프리드의 LOD는 0.01μg/kg이었습니다. 매트릭스 효과는 관찰되지 않았다. 밀에서 이미다클로프리드의 회수율은 표 2에 나타내었다. 0.5mg/L 및 5mg/L의 이미다클로프리드 농도에 노출된 밀 뿌리에서 이미다클로프리드의 회수율은 각각 94.0%-97.6% 및 98.8%-99.2%였습니다. 변동 계수는 ?...
Access restricted. Please log in or start a trial to view this content.
토론
최근에는, 이미다클로프리드 농약의 잔류물을 전처리 및 검출하는 방법이 빈번히 보고되고 있다. Badawy et al.23은 고성능 액체 크로마토그래피를 사용하여 온실 조건에서 재배된 토마토 과일의 이미다클로프리드 함량을 측정했으며 0.0125-0.15μg/mL 범위에서 이미다클로프리드에 대한 우수한 선형성을 보고했습니다. Zhai et al.24는 LC-MS-MS를 사용하여 중국 골파에서 ?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 이해 상충이 없다고 선언합니다. 모든 저자는 원고를 읽고 승인했습니다. 이 작업은 이전에 출판되지 않았으며 다른 동료 심사 저널에서 고려하지도 않습니다.
감사의 말
이 연구는 중국 국립 자연 과학 재단 (No. 42277039)의 지원을 받았다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | 01-06-1995 | Suitable for HPLC, gradient grade, >99.9% |
| Analytical balance | Sartorius Lab Instruments Co.Ltd. | GL124-1SCN | |
| Artificial climate incubator | Shanghai Badian Instrument Equipment Co. Ltd. | HK320 | |
| Centrifuge | Eppendorf China Co. Ltd. | Centrifuge5804 | |
| Disposable syringe | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Z116866 | Capacity 5 mL, graduated 0.2 mL, non-sterile |
| Formic acid | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Y0001970 | European pharmacopoeia reference standard |
| Graphitized carbon black (GCB) | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | V900058 | 45 μm |
| H2O2 | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | 31642 | 30% (w/w) |
| Hoagland’s Basal Salt Mixture | Shanghai Yu Bo Biotech Co. Ltd. | NS1011 | Anhydrous, reagent grade |
| Hydroponic equipment | Jiangsu Rongcheng Agricultural Science and Technology Development Co.Ltd. | SDZ04BD | |
| Hypersil BDS C18 column | Thermo Fisher Scientific (China) Co. Ltd. | 28103-102130 | |
| Imidacloprid | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | Y0002028 | European pharmacopoeia reference standard |
| MgSO4 | Sigma-Aldrich (Shanghai) Trading Co. Ltd. | 208094 | Anhydrous, reagent grade, >97% |
| NaCl | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | S9888 | Reagent grade, 99% |
| pH meter | Shanghai Thunder Magnetic Instrument Factory | PHSJ-3F | |
| Phytotron box | Harbin Donglian Electronic Technology Co. Ltd. | HPG-280B | |
| Pipettes | Eppendorf China Co. Ltd. | Research plus | |
| Syringe filter | Sigma-Aldrich (Shanghai) Trading Co.Ltd. | SLGV033N | Nylon, 0.22 µm pore size, 33 mm, non-sterile |
| Ultra performance liquid chromatography tandem triple quadrupole mass spectrometry | Thermo Fisher Scientific (China) Co. Ltd. | UltiMate 3000 | |
| TSQ Quantum Access MAX | |||
| Vortex mixer | Shanghai Yetuo Technology Co. Ltd. | Vortex-2 | |
| Wheat seed | LuKe seed industry | Jimai 20 |
참고문헌
- Lin, P. C., Lin, H. J., Liao, Y. Y., Guo, H. R., Chen, K. T. Acute poisoning with neonicotinoid insecticides: A case report and literature review. Basic & Clinical Pharmacology & Toxicology. 112 (4), 282-286 (2013).
- North, J. H., et al. Value of neonicotinoid insecticide seed treatments in Mid-South corn (Zea mays) production systems. Journal of Economic Entomology. 111 (1), 187-192 (2018).
- Simon-Delso, N., et al. Systemic insecticides (neonicotinoids and fipronil): Trends, uses, mode of action and metabolites. Environmental Science and Pollution Research. 22 (1), 5-34 (2015).
- Bass, C., Denholm, I., Williamson, M. S., Nauen, R. The global status of insect resistance to neonicotinoid insecticides. Pesticide Biochemistry and Physiology. 121, 78-87 (2015).
- Craddock, H. A., Huang, D., Turner, P. C., Quiros-Alcala, L., Payne-Sturges, D. C. Trends in neonicotinoid pesticide residues in food and water in the United States, 1999-2015. Environmental Health. 18 (1), 7(2019).
- Shao, X. S., Liu, Z. W., Xu, X. Y., Li, Z., Qian, X. H. Overall status of neonicotinoid insecticides in China: Production, application and innovation. Journal of Pesticide Science. 38 (1-2), 1-9 (2013).
- Zhao, Y., et al. Urinary neonicotinoid insecticides in children from South China: Concentrations, profiles and influencing factors. Chemosphere. 291, 132937(2022).
- Kurwadkar, S., Evans, A. Neonicotinoids: Systemic insecticides and systematic failure. Bulletin of Environmental Contamination and Toxicology. 97 (6), 745-748 (2016).
- Sadaria, A. M., et al. Passage of fiproles and imidacloprid from urban pest control uses through wastewater treatment plants in northern California, USA. Environmental Toxicology and Chemistry. 36 (6), 1473-1482 (2017).
- Damalas, C. A., Eleftherohorinos, I. G. Pesticide exposure, safety issues, and risk assessment indicators. International Journal of Environmental Research and Public Health. 8 (5), 1402-1419 (2011).
- Hayes, T. B., et al. Demasculinization and feminization of male gonads by atrazine: Consistent effects across vertebrate classes. Journal of Steroid Biochemistry and Molecular Biology. 127 (1-2), 64-73 (2011).
- Rani, L., et al. An extensive review on the consequences of chemical pesticides on human health and environment. Journal of Cleaner Production. 283, 124657(2021).
- Xu, Y. Q., et al. Ecotoxicity evaluation of azoxystrobin on Eisenia fetida in different soils. Environmental Research. 194, 110705(2021).
- Yavari, S., Malakahmad, A., Sapari, N. B. Biochar efficiency in pesticides sorption as a function of production variables-A review. Environmental Science and Pollution Research. 22 (18), 13824-13841 (2015).
- Delcour, I., Spanoghe, P., Uyttendaele, M. Literature review: Impact of climate change on pesticide use. Food Research International. 68, 7-15 (2015).
- Zhang, C. Y., et al. The application of the QuEChERS methodology in the determination of antibiotics in food: A review. TrAC-Trends in Analytical Chemistry. 118, 517-537 (2019).
- Wiilkowska, A., Biziuk, M. Determination of pesticide residues in food matrices using the QuEChERS methodology. Food Chemistry. 125 (3), 803-812 (2011).
- Ishii, Y., et al. HPLC determination of the new insecticide imidacloprid and its behavior in rice and cucumber. Journal of Agricultural and Food Chemistry. 42 (12), 2917-2921 (1994).
- Ko, A. Y., et al. Development of a simple extraction and oxidation procedure for the residue analysis of imidacloprid and its metabolites in lettuce using gas chromatography. Food Chemistry. 148, 402-409 (2014).
- Yuan, W. L., et al. Application of imidacloprid controlled-release granules to enhance the utilization rate and control wheat aphid on winter wheat. Journal of Integrative Agriculture. 19 (12), 3045-3053 (2020).
- Phugare, S. S., Kalyani, D. C., Gaikwad, Y. B., Jadhav, J. P. Microbial degradation of imidacloprid and toxicological analysis of its biodegradation metabolites in silkworm (Bombyx mori). Chemical Engineering Journal. 230, 27-35 (2013).
- Li, Y., et al. Uptake, translocation and accumulation of imidacloprid in six leafy vegetables at three growth stages. Ecotoxicology and Environmental Safety. 164, 690-695 (2018).
- Badawy, M. E. I., Ismail, A. M. E., Ibrahim, A. I. H. Quantitative analysis of acetamiprid and imidacloprid residues in tomato fruits under greenhouse conditions. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes. 54 (11), 898-905 (2019).
- Zhai, R. Q., et al. Residue, dissipation pattern, and dietary risk assessment of imidacloprid in Chinese chives. Frontiers in Nutrition. 9, 846333(2022).
- Aria, M. M., et al. Uptake and translocation monitoring of imidacloprid to chili and tomato plants by molecularly imprinting extraction - ion mobility spectrometry. Microchemical Journal. 144, 195-202 (2019).
- Chen, Y., et al. Translocation and metabolism of imidacloprid in cabbage: Application of C-14-labelling and LC-QTOF-MS. Chemosphere. 263, 127928(2021).
- Wild, S., Jones, K. Organic chemicals entering agricultural soils in sewage sludges: Screening for their potential to transfer to crop plants and livestock. Science of the Total Environment. 119, 85-119 (1992).
- Gong, W. W., et al. Uptake and dissipation of metalaxyl-M, fludioxonil, cyantraniliprole and thiamethoxam in greenhouse chrysanthemum. Environmental Pollution. 257, 113499(2020).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유