Method Article
ثقافة أولية منخفضة الكثافة سهلة وقابلة للتكرار باستخدام مخزون مجمد من الخلايا العصبية الجنينية الحصين
In This Article
Summary
يعد المخزون المجمد الجاهز للاستخدام من الخلايا العصبية أداة قوية لتقييم الوظائف المشبكية. هنا ، نقدم استزراع أولي سهل منخفض الكثافة من المخزون المجمد باستخدام لوحة 96 بئر.
Abstract
الثقافة العصبية هي نظام قيم لتقييم الوظائف المشبكية وفحوصات الأدوية. على وجه الخصوص ، تسمح الثقافة منخفضة الكثافة للخلايا العصبية الحصينية الأولية بدراسة الخلايا العصبية الفردية أو المكونات تحت الخلوية. لقد أظهرنا توطين البروتين تحت الخلوي داخل الخلية العصبية عن طريق الكيمياء المناعية ، والقطبية العصبية ، والتشكل المشبكي ، وتغيره التنموي باستخدام ثقافة الحصين الأولية منخفضة الكثافة. في الآونة الأخيرة ، أصبحت المخزونات المجمدة الجاهزة للاستخدام من الخلايا العصبية متاحة تجاريا. هذه المخزونات المجمدة من الخلايا العصبية تقلل من الوقت اللازم لإعداد التجارب على الحيوانات وتساهم أيضا في تقليل عدد الحيوانات المستخدمة. هنا ، نقدم طريقة استزراع أولية منخفضة الكثافة قابلة للتكرار باستخدام لوحة 96 بئرا. استخدمنا مخزونا مجمدا متاحا تجاريا من الخلايا العصبية من الحصين الجنيني للفئران. يمكن استزراع الخلايا العصبية بشكل مستقر على المدى الطويل دون تغييرات في الوسائط عن طريق تقليل نمو الخلايا الدبقية في نقاط زمنية معينة. يسمح هذا الفحص عالي الإنتاجية باستخدام ثقافة منخفضة الكثافة بإجراء تقييمات قائمة على التصوير قابلة للتكرار للدونة المشبكية.
Introduction
من المهم تطوير نظام تجريبي في المختبر يمكنه تقييم الوظائف المشبكية المشاركة في التعلم والذاكرة. الثقافة العصبية هي نظام قيم لتقييم الوظائف المشبكية في المختبر. تم استخدام تقنية الثقافة العصبية لأول مرة في 1980s ، وفي 1990s ، تم تطوير ثقافة منخفضة الكثافة من الخلايا العصبية الحصين الأولية1،2،3 لدراسة الخلايا العصبية الفردية من حيث توطين تحت الخلايا لمكونات البروتين ، والاتجار بالبروتين ، وقطبية الخلايا العصبية ، ومورفولوجيا العمود الفقري ، وتطوير المشبك ، واللدونة4،5،6،7،8 . ومع ذلك ، هناك العديد من الخطوات التي تنطوي عليها هذه التقنية: تزاوج الحيوانات ، وتشريح الأجنة ، وإعداد أوعية الاستزراع ، وزراعة الخلايا لمدة 3 أسابيع مع تغييرات الوسائط مرة واحدة في الأسبوع. بالإضافة إلى ذلك ، فإنه يتطلب تقنيات متقدمة3.
لقد طورنا مخزونا مجمدا من الخلايا العصبية الحصين المنفصلة من أجنة الفئران 9,10. المخزونات المجمدة من الخلايا العصبية جاهزة للاستخدام ، ولا يلزم تقنيات متقدمة لزراعة الخلايا11,12. بمعنى آخر ، لا يعتمد زراعة الخلايا العصبية من المخزونات المجمدة على تقنية المجرب. إنه يلغي الحاجة إلى التجارب على الحيوانات (على سبيل المثال ، إذن التجارب على الحيوانات ، وترتيب الحيوانات الحامل الموقوتة ، وتشريح أجنة الفئران) ، وبالتالي تقليل عدد الحيوانات المستخدمة. في الآونة الأخيرة ، أصبحت مخزونات الخلايا العصبية المجمدة عالية الجودة والجاهزة للاستخدام متاحة تجاريا. هنا ، استخدمنا المخزونات المجمدة المتاحة تجاريا من اليوم الجنيني (E) 18 قرن آمونالفئران 13،14،15. لا يتطلب استزراع الخلايا العصبية من مخزون مجمد وسائط مكيفة مع الخلايا الدبقية أو زراعة مشتركة مع الخلايا الدبقية. يمكن استخدام وسائط الثقافة الأولية العادية بدون مصل إضافي لزراعة الخلايا. ومن ثم يمكننا الحصول على بيانات قابلة للتكرار. علاوة على ذلك ، ليست هناك حاجة لتبادل الوسائط لمدة 3 أسابيع بعد بذر الخلية حيث يتم تقليل نمو الخلايا الدبقية (الشكل 1).
العمود الفقري الشجيري هو المقصورة بعد المشبكية لمعظم نقاط الاشتباك العصبي المثيرة. أنها تحتوي على بروتينات مستقبلات ، وبروتينات سقالة ما بعد المشبكي ، وبروتينات الأكتين الخلوي الهيكلي. ركزنا على بروتين دريبرين المرتبط بالأكتين5،6،7،16،17،18. يتراكم Drebrin عند رأس العمود الفقري في الخلايا العصبية الناضجة19 ، وأبلغنا عن drebrin كعلامة للحالة المشبكية15،17،20،21،22،23. من خلال إجراء تحليل عالي المحتوى باستخدام drebrin كقراءات ، أبلغنا مؤخرا عن التأثيرات المثبطة لنظائر phencyclidine على مستقبلات الغلوتامات من نوع حمض N-methyl-D-aspartic (NMDARs)10 والتأثيرات المعتمدة على NMDAR للمركبات الطبيعية والأدوية الخام على الحالات المشبكية15.
هنا ، نوضح بالتفصيل كيفية زراعة المخزونات المجمدة من الخلايا العصبية بكثافة منخفضة. بالإضافة إلى ذلك ، نعرض تقييما قائما على التصوير drebrin للحالة المشبكية باستخدام 96 لوحة بئر.
Protocol
1. طلاء لوحة
- قم بتغطية صفيحة دقيقة ذات 96 بئرا ببولي-L-ليسين (1 مجم / مل ، مخفف في محلول بورات 0.1 M [الرقم الهيدروجيني: 8.5] ؛ 100 ميكرولتر / بئر) واحتضانه طوال الليل عند 37 درجة مئوية.
ملاحظة: قم فقط بتغطية الآبار التي يجب استخدامها. في التجارب التي أجريت هنا ، يتم استخدام 60 بئرا متوسطة. يتم تحضير المخزن المؤقت للبورات عن طريق خلط 50 mM حمض البوريك و 12 mM borate في الماء المعقم. - اغسل الطبق مرتين بالماء المعقم (250 ميكرولتر / بئر).
- اغسل الطبق مرة واحدة بوسط زراعة طازج بدون مكملات (250 ميكرولتر / بئر).
- جفف الطبق على مقعد نظيف لمدة 20 دقيقة.
- لف الطبق بورق الألمنيوم واحتفظ به عند 4 درجات مئوية حتى الاستخدام (صالح لمدة 1 شهر).
2. بذر الخلية
- أضف 50 ميكرولتر / بئر من وسط الاستزراع إلى اللوحة المطلية واحتفظ بها في حاضنة 37 درجة مئوية ، 5٪ CO2 لمدة 30 دقيقة إلى 1 ساعة. املأ الآبار الطرفية بالماء المعقم (200 ميكرولتر / بئر).
ملاحظة: يتم تحضير وسط الاستزراع بإضافة 50x B-27 و 400x Glutamax و 100 وحدة / مل من البنسلين / الستربتومايسين إلى الوسط العصبي القاعدي (راجع جدول المواد للحصول على التفاصيل). - قم بإزالة الخلايا العصبية المبردة من خزان النيتروجين السائل. كانت الخلايا العصبية المستخدمة هنا هي الخلايا العصبية المحفوظة بالتبريدDMSO 11.
- اغمر المبرد في كتلة حرارية 37 درجة مئوية لمدة تصل إلى 3 دقائق وقم بإذابة المحتويات جزئيا. لا تقم بتسخين cryovial لفترة طويلة. انقل المحتويات إلى أنبوب سعة 50 مل بمجرد إذابته.
- انقل محتويات الخلايا العصبية المبردة ببطء إلى أنبوب معقم سعة 50 مل (50 ميكرولتر / ثانية) باستخدام ماصة سعة 1 مل بطرف عريض المسام.
- شطف cryovial فارغة مع 1 مل من وسط الثقافة (درجة حرارة الغرفة ؛ RT). انقل هذا 1 مل من وسط المزرعة من قطرة التبريد (50 ميكرولتر / ثانية) إلى أنبوب 50 مل الذي يحتوي على تعليق الخلية.
- أضف 9 مل من وسط الاستزراع (RT) إلى أنبوب 50 مل (0.5 مل / ثانية) واجعل الحجم يصل إلى 11 مل. لا تكرر السحب ، ولكن امزج تعليق الخلية ببطء.
- عد رقم الخلية (استخدم عداد الخلايا أو مقياس الدم).
- انقل كل تعليق الخلية إلى خزان وقم بتوزيع تعليق الخلية على لوحة 96 بئرا باستخدام ماصة متعددة القنوات مع أطراف واسعة المسام (1.0 × 104 خلايا / بئر). لتقليل تبخر وسط الاستزراع ، املأ الآبار الطرفية بالماء المعقم (الخطوة 2.1).
ملاحظة: تؤكد هذه الدراسة أن التبخر المتوسط للاستزراع صغير بالنسبة للاستزراع لمدة 3 أسابيع بدون تبادل متوسط. معدل التخفيض للوسط هو 3.6٪ (ن = 120 بئر). وبالتالي ، فإن تغيير الأسمولية لن يكون جذريا خلال فترة الحضانة لمدة 3 أسابيع. - احتضان الخلايا العصبية لمدة 1-2 ساعة في حاضنة 37 درجة مئوية ، 5 ٪ CO2 .
- استبدل وسط الاستزراع ب 100 ميكرولتر من وسط الاستزراع المسخن مسبقا (37 درجة مئوية) لكل بئر وأعده إلى حاضنة 37 درجة مئوية ، 5٪ CO2 (لا يلزم تغيير الوسيط أثناء الاستزراع).
3. علاج Ara-C
- في 4 أيام في المختبر (DIV) ، أضف السيتوزين β-D-أرابينو-فورانوسيد (Ara-C) إلى تركيز نهائي قدره 0.2 ميكرومتر لكل بئر لتقليل نمو الخلايا الدبقية.
4. العلاجات الدوائية
- في 21 يوما في المختبر ، عالج الخلايا بالأدوية ذات الأهمية.
- حافظ على درجة حرارة اللوحة عند 37 درجة مئوية أثناء العلاج بالعقاقير.
- للتحكم الإيجابي ، عالج الخلايا ب 100 ميكرومتر من الغلوتامات (لكل بئر للتركيز النهائي) لمدة 10 دقائق قبل التثبيت.
5. التثبيت
- للتثبيت ، استخدم 4٪ بارافورمالدهيد في محلول فوسفات 0.1 م (100 ميكرولتر / بئر).
- بعد ~ 20 دقيقة من التثبيت ، اغسل الآبار بمحلول ملحي مخزن بالفوسفات (PBS ؛ 250 ميكرولتر / بئر) 2x لمدة 5 دقائق لكل منهما.
6. الكيمياء المناعية
- اغسل الخلايا باستخدام PBS (250 ميكرولتر / بئر) 1x لمدة 5 دقائق.
- تغلغل الخلايا بنسبة 0.1٪ Triton X-100 (100 ميكرولتر / بئر) في PBS لمدة 5 دقائق.
- اغسل الخلايا باستخدام PBS (250 ميكرولتر / بئر) 3x لمدة 5 دقائق لكل منها.
- للحجب ، استخدم 3٪ ألبومين مصل بقري في PBS (PBSA ؛ 100 ميكرولتر / بئر) لمدة 1 ساعة في RT.
- احتضان الخلايا بمضادات دريبرين (1: 1) والبروتين 2 المرتبط بالأنابيب الدقيقة (MAP2) (1: 000) أجسام مضادة (60 ميكرولتر / بئر) عند 4 درجات مئوية طوال الليل.
- اغسل الخلايا باستخدام PBS (250 ميكرولتر / بئر) 4x لمدة 5 دقائق لكل منها.
- احتضان الخلايا بأجسام مضادة ثانوية مناسبة و 4′،6-دياميدينو-2-فينيليندول ، ثنائي هيدروكلوريد (DAPI ؛ 1: 1000) في PBSA (60 ميكرولتر / بئر) لمدة 2 ساعة في RT.
- اغسل الخلايا باستخدام PBS (250 ميكرولتر / بئر) 4x لمدة 5 دقائق لكل منها.
- قم بتخزين الخلايا في PBS تحتوي على 0.1٪ أزيد الصوديوم (150 ميكرولتر / بئر).
7. الحصول على الصور وتحليلها
- للحصول على الصور ، استخدم مجهرا مناسبا.
- لتحديد أجسام الخلايا العصبية ، استخدم كلا من المناطق الإيجابية MAP2 وإيجابية DAPI.
- لتحديد الزوائد الشجيرية للخلايا العصبية ، استخدم إشارات إيجابية MAP2 بدون أجسام خلوية.
- لتحديد مجموعات drebrin ، استخدم إشارات إيجابية drebrin-على طول التشعبات الإيجابية MAP2.
النتائج
باتباع البروتوكول ، تم استزراع الخلايا العصبية في صفيحة 96 بئرا لمدة 21 يوما ، ثم عولجت بالغلوتامات (الشكل 1). تطورت الخلايا العصبية بشكل طبيعي دون تبادل وسط الاستزراع لمدة 3 أسابيع (الشكل 2). عالجنا الخلايا بعدة تركيزات من الغلوتامات (1 ميكرومتر ، 3 ميكرومتر ، 10 ميكرومتر ، 30 ميكرومتر ، و 100 ميكرومتر مخففة في ماء معقم) لمدة 10 دقائق وثبتناها. تم إجراء الكيمياء المناعية ، وتم الحصول على صور مضان للدريبرين و MAP2 باستخدام مجهر مضان آلي مع كاميرا sCMOS. كما هو موضح في الشكل 3 ، لوحظت أشواك تغصنية إيجابية الدريبرين بوضوح على طول الزوائد الشجيرية الإيجابية MAP2. لقد ثبت أن تحفيز الغلوتامات يثير تدفق Ca2+ من خلال NMDAR ، مما يسبب هجرة دريبرين من العمود الفقري المتغصن مما يؤدي إلى تقليل كثافة مجموعة دريبرين 5,17. وفقا لذلك ، لاحظنا الانخفاض المعتمد على الجرعة في كثافات مجموعة دريبرين ضد تحفيز الغلوتامات10 (الشكل 4). كما هو موضح في الشكل 5 ، هذه الطريقة قابلة للتكرار بشكل كبير إذا تم استخدام drebrin كعلامة للحالات المشبكية.
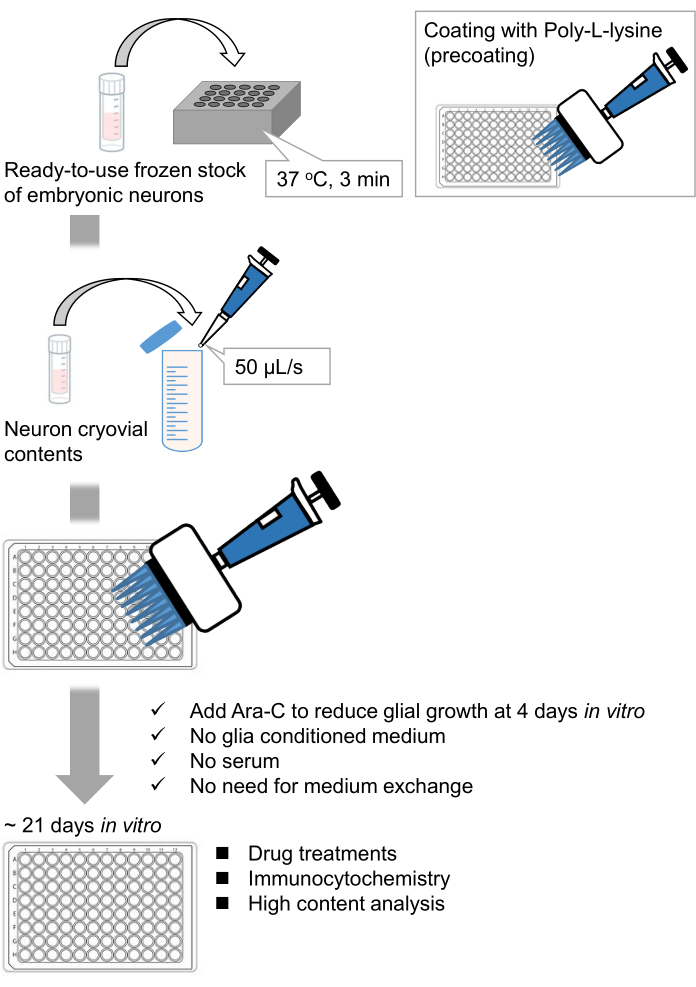
الشكل 1: مخطط الطريقة. تم استزراع الخلايا العصبية في صفيحة 96 بئرا لمدة 21 يوما ، ثم عولجت بالغلوتامات. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
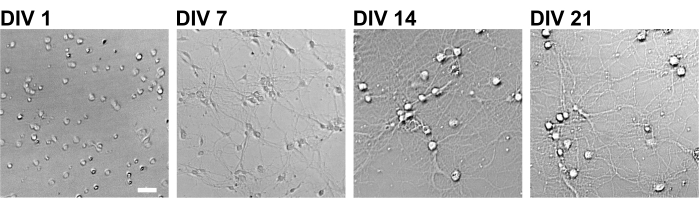
الشكل 2: صور المجال الساطع للخلايا العصبية المستزرعة باستخدام صفيحة مكونة من 96 بئرا. تم الحصول على صور تباين الطور من كل مرحلة من مراحل النمو (DIV 1 ، 7 ، 14 ، 21) باستخدام مقياس خلوي كمي للصورة متحد البؤر. شريط المقياس: 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
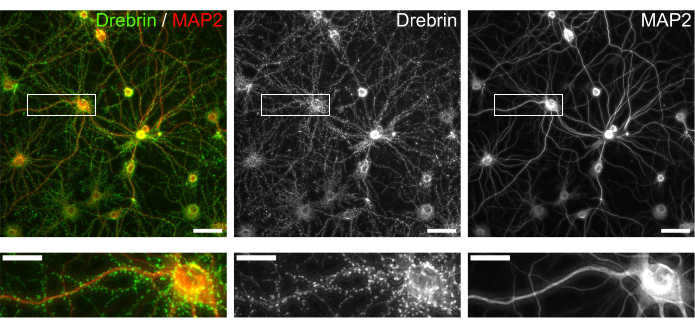
الشكل 3: صور تمثيلية للخلايا العصبية المستزرعة المناعية. (يسار) صور مضان مدمجة لدريبرين (أخضر) و MAP2 (أحمر). أظهرت كل صورة مضان ل drebrin و MAP2 في اللوحات الوسطى واليمنى ، على التوالي. تظهر المستطيلات البيضاء المساحة المكبرة أدناه. قضبان المقياس الألواح العلوية: 50 ميكرومتر ، الألواح السفلية: 20 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
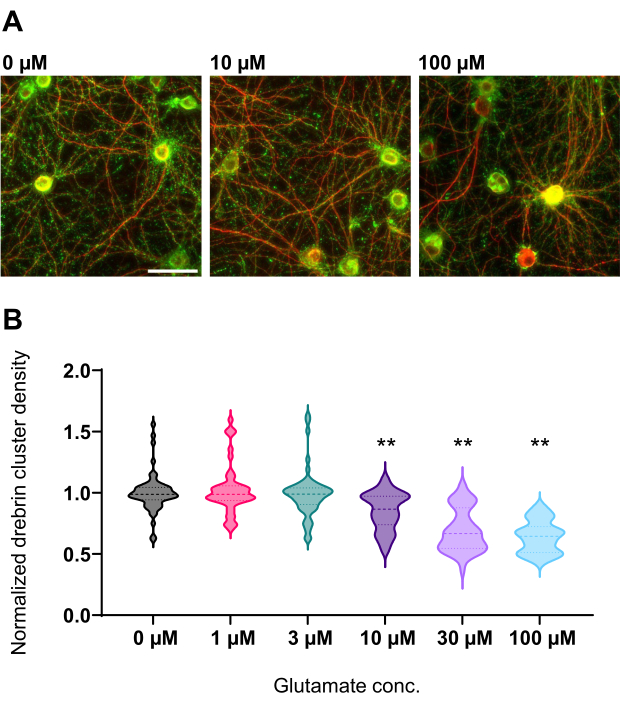
الشكل 4: تغيرات الجرعة والاستجابة المعتمدة على الغلوتامات في كثافة مجموعة دريبرين الطبيعية. (أ) صور مضان تمثيلية ملطخة بالمناعة باستخدام دريبرين (أخضر) و MAP2 (أحمر) من البئر المعالج ب 0 ميكرومتر و 10 ميكرومتر و 100 ميكرومتر غلوتامات (من اليسار إلى اليمين). شريط المقياس: 50 ميكرومتر. (ب) تم تطبيع كثافة مجموعة Drebrin بمتوسط التحكم (0 ميكرومتر). 0 ميكرومتر ، N = 58 بئرا ؛ 1 ميكرومتر ، ن = 46 ؛ 3 ميكرومتر ، N = 54 ؛ 10 ميكرومتر ، N = 45 ؛ 30 ميكرومتر ، N = 54 ؛ 100 ميكرومتر ، N = 55 ، من 13 تجربة باستخدام مجموعات مختلفة. ** P < 0.01 مقابل التحكم (0 ميكرومتر) من خلال اختبار المقارنات المتعددة لدونيت بعد ANOVA. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
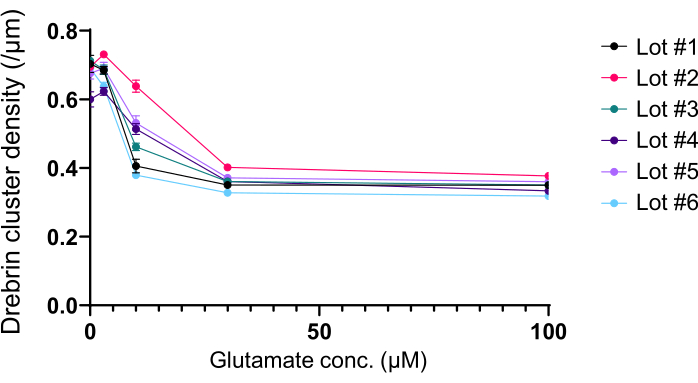
الشكل 5: تغيرات الجرعة والاستجابة المعتمدة على الغلوتامات في كثافة مجموعة دريبرين. البيانات الأولية من ست تجارب باستخدام دفعات مختلفة. N = 4 آبار لكل تركيز (0 ميكرومتر ، 3 ميكرومتر ، 10 ميكرومتر ، 30 ميكرومتر ، و 100 ميكرومتر). يتم التعبير عن القيم كمتوسط ± SEM. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 6: تطبيق المخزونات المجمدة من الخلايا العصبية على تجارب الفيزيولوجيا الكهربية. (أ) بروتوكول للتجارب الفيزيولوجية الكهربية باستخدام ألواح مصفوفة الأقطاب الكهربائية الدقيقة (MEA). الطلاء: قبل يوم واحد من طلاء الخلايا ، تم طلاء كل صفيحة MEA ذات 48 بئرا مسبقا بمحلول بولي إيثيلين (PEI: 0.1٪) وتم تحضينها لمدة ساعة واحدة عند 37 درجة مئوية. ثم تم غسل لوحة MEA 3x بالماء المعقم وتجفيفها لمدة 1 ساعة. بعد ذلك ، تم الاحتفاظ بلوحة MEA عند 4 درجات مئوية طوال الليل. مزرعة عالية الكثافة: تم طلاء 50000 خلية / بئر من الخلايا العصبية على 48 لوحة MEA بئر. تم تنفيذ خطوة بذر الخلية كما هو موضح في القسم 2 من البروتوكول الموصوف أعلاه. تم استخدام Laminin (20 μg / mL) وسط الاستزراع المضاف (إضافة 2 v / v٪ B-27 ، 2.5 mM Glutamax ، و 100 μg / mL من البنسلين / الستربتومايسين إلى الوسط العصبي القاعدي) للوحة الخلايا العصبية. بعد ذلك ، تم استزراع الخلايا العصبية عند 37 درجة مئوية ، 5٪ CO2 في وسط الثقافة. تم تبادل وسائل الإعلام بالكامل على DIV 1 مع وسيط الثقافة حتى DIV 3. تمت إضافة Ara-C في DIV 4 (النهائي 0.2 ميكرومتر). من DIV 5 فصاعدا و 2 مرات في الأسبوع ، تم تغيير 50٪ من وسائل الإعلام مع وسيط الثقافة. تم تسجيل نشاط الخلايا العصبية على كل بئر من لوحة MEA باستخدام نظام MEA. (ب) تم الحصول على نشاط عصبي عفوي عند 37 درجة مئوية تحت جو CO2 بنسبة 5٪ باستخدام نظام MEA بمعدل أخذ عينات يبلغ 12.5 كيلو هرتز / قناة عند DIV 21. يتم عرض تسجيلات من 4 قنوات من أصل 16 قناة داخل بئر. بالنسبة لجميع التسجيلات ، تم تطبيق مرشح تمرير النطاق Butterworth (200-3000 هرتز). تظهر رؤوس الأسهم توقيت إطلاق النار المتزاحم المتزامن. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
الخطوة الحاسمة في هذه الطريقة هي إذابة تعليق الخلية. نقل تعليق الخلية قبل أن يصبح دافئا جدا مهم جدا. لتجنب التغيير السريع للأسمولية ، لا تنقل تعليق الخلية إلى حجم كبير من الوسط مرة واحدة. تعد إضافة وسط الاستزراع أمرا بالغ الأهمية أيضا لتجنب التغيرات المفاجئة في الضغط التناضحي.
يمكن استزراع الخلايا العصبية في أوعية استزراع أخرى: 24 لوحة بئر ، أو غرف ذات 8 آبار ، أو أطباق 60 مم ، أو مجسات MED. ومع ذلك ، في هذه الحالات ، يجب تعديل التركيز النهائي وتوقيت إضافة Ara-C. بالإضافة إلى ذلك ، يجب تحسين كثافة الخلايا العصبية في أنواع مختلفة من التجارب. على سبيل المثال ، الثقافة عالية الكثافة مطلوبة لتجارب الفيزيولوجيا الكهربية ، وفي هذه الحالة ، هناك حاجة إلى تبادل الوسائط مرتين في الأسبوع (الشكل 6). وبالتالي ، تتطلب الثقافة منخفضة الكثافة خطوات أقل من الثقافة عالية الكثافة.
غالبا ما تتطلب الثقافة العصبية منخفضة الكثافة تقنيات متقدمة. ومع ذلك ، فإن استخدام المخزون المجمد الجاهز للاستخدام يحل هذه المشكلة. الطريقة الموصوفة لا تعتمد على مهارة المجرب. جودة المخزون المجمد مستقرة ويمكن استزراعه بثبات طالما يتم تخزينه في النيتروجين السائل وتجنب التغيرات في درجات الحرارة لمدة تصل إلى 4 سنوات.
يثير استزراع الخلايا لمدة 3 أسابيع دون تبادل متوسط السؤال حول ما إذا كانت هناك تغييرات كبيرة في الأسمولية أو تبخر وسائط الثقافة. ومع ذلك ، فقد أكدنا أن تبخر الوسائط الثقافية صغير (معدل تخفيض 3.6٪). توطين البروتينات المشبكية ومورفولوجيا الخلايا العصبية تبدو طبيعية بعد 3 أسابيع. لذلك ، لا تسبب الثقافة لمدة 3 أسابيع دون تبادل الوسائط تغيرات أسمولية كبيرة تؤثر على ظروف الخلايا العصبية المزروعة. يعد الاحتفاظ باللوحة في حاضنة بعد علاج Ara-C أيضا نقطة مهمة تقلل من التبخر.
لا توجد قيود فيما يتعلق باستخدام الخلايا العصبية المجمدة. ومع ذلك ، هناك بعض القيود على طريقة الاستزراع منخفض الكثافة. أكدنا أنه يمكن تطبيق الثقافة منخفضة الكثافة للمراقبة المورفولوجية للخلايا العصبية ، وتقييم الوظيفة المشبكية ، ونقل GFP. ومع ذلك ، لم نفحص تصوير الخلايا الحية. بالإضافة إلى ذلك ، كما ذكر أعلاه ، مطلوب ثقافة عالية الكثافة لأداء الفيزيولوجيا الكهربية.
عادة ما يستغرق نضوج المشبك العصبي 3 أسابيع7 ، ولا يمكننا تأكيد أن الخلايا العصبية المستزرعة لديها نقاط اشتباك عصبي مناسبة حتى النهاية. إذا لم يكن نضوج المشبك جيدا بعد 3 أسابيع ، فسيتعين علينا الثقافة مرة أخرى. من خلال معرفة جودة الخلايا العصبية قبل بدء التجارب ، يمكننا توفير هذه الأسابيع 3. لذلك ، لإجراء التجارب بكفاءة ، من الأفضل التحقق من جودة الخلايا العصبية مقدما. المخزونات المجمدة تجعل من الممكن التحقق من جودة الخلايا العصبية مسبقا. يتم إنشاء كل دفعة من المخزونات المجمدة من فضلات الفئران ، ويمكننا استخدام أحد المخزونات من كل دفعة لفحص الجودة. Drebrin هو علامة جيدة لفحص جودة الخلايا العصبية. كما هو موضح ، يتراكم drebrin في رأس العمود الفقري في الخلايا العصبية الناضجة ، ويتفاعل مع التحفيز المشبكي. وبالتالي ، يمكننا التحقق من جودة الخلايا العصبية في المخزونات المجمدة باستخدام drebrin كعلامة.
يمكن تطبيق هذه الطريقة لتقييم تأثير الأدوية على الحالة المشبكية. يحدث نزوح drebrin من العمود الفقري التغصني خلال المراحل الأولية من اللدونة المشبكية22. لذلك ، فإن الكشف عن الحد من مجموعة drebrin الناجم عن العلاج بالعقاقير يظهر أن الدواء يحفز المشبك ويسبب اللدونة المشبكية. علاوة على ذلك ، لتحديد ما إذا كان التخفيض يعتمد على NMDAR ، من المفيد إجراء تجربة باستخدام حمض 2-amino-5-phosphonovaleric (APV ، مضاد NMDAR). باستخدام drebrin كعلامة ، حتى تبعية NMDAR يتم تحديدها بوضوح10,15. الطريقة الموصوفة مفيدة في فحوصات الأدوية ، والدراسات الدوائية للسلامة ، وتقييم الوظيفة المشبكية.
Disclosures
تومواكي شيراو هو الرئيس التنفيذي لشركة AlzMed، Inc. تم تمويل الدراسة من قبل AlzMed، Inc. (500000 ين ياباني إلى NK لمشروع بعنوان "تحليل عالي الإنتاجية للوظيفة المشبكية").
Acknowledgements
نشكر كازومي كامياما ومانامي كاوادا على المساعدة في التجارب. تم دعم هذا العمل من قبل JSPS KAKENHI (رقم المنحة 19K08010 إلى N.K.) والوكالة اليابانية للبحث والتطوير الطبي (AMED) (رقم المنحة JP19bk0104077 و JP22bm0804024 إلى T.S.).
Materials
| Name | Company | Catalog Number | Comments |
| 96 well plate | Zeon Corporation | Gifted | |
| 96 well plate | greiner | 655986 | |
| Anti-drebrin antibody (M2F6) | MBL | D029-3 | Mouse monoclonal (dilution 1:1) |
| Anti-MAP2 antibody | Millipore | AB5622 | Rabbit (dilution 1:1000) |
| Anti-mouse Alexa Fluor 568 | Thermo Fisher Scientific | A11031 | Dilution 1: 500 |
| Anti-rabbit Alexa Fluor | Thermo Fisher Scientific | A11008 | Dilution 1: 500 |
| B-27 | Gibco | 17504-044 | 2 v/v% for MEA plates; 50x for normal plates |
| Borax | Sigma | B-9876 | Final concentration 12 mM |
| Boric acid | WAKO | 021-02195 | Final concentration 50 mM |
| Bovine serum albumin | Millipore | 12659-100G | Final concentration: 3% in PBS |
| Confocal quantitative image cytometer CellVoyager CQ1 | YOKOGAWA | Phase contrast images | |
| Cytosine β-D-arabino-furanoside (Ara-C) | Sigma | C-6645 | Diluted in dH2O (final concentration: 0.2 µM) |
| DAPI | FUJIFILM | 340-07971 | Dilution 1:1000 |
| GlutaMAX | Gibco | 35050-061 | 2.5 mM for MEA plates; 400x for normal plates |
| In Cell Analyzer 2200 | Cytiva | Fluorescence images | |
| Laminin | Sigma | 114956-81-9 | Final concentration: 20 µg/mL |
| Maestro | Axion Biosystems | MEA recordings | |
| MEA plate | Axion Biosystems | M768-tMEA-48W | |
| Neurobasal | Gibco | 21103-049 | |
| Paraformaldehyde | nacalai tesque | 26126-25 | Final concentration: 4% in PBS |
| Penicillin/Streptomycin | Gibco | 15140-122 | 100 U/mL for normal plates |
| Penicillin/Streptomycin | nacalai tesque | 26253-84 | 100 µg/mL for MEA plates |
| polyethyleimine | Sigma | 9002-98-6 | Final concentration: 0.1% |
| Poly-L-lysine | Sigma | P2636 | Diluted in the borate buffer (final concentration: 1 mg/mL) |
| SKY Neuron | AlzMed , Inc. | ARH001 | 1.0 x 106 cells/tube |
| Sodium azide | FUJIFILM | 195-11092 | 0.1% |
| SodiumL(+)-Glutamate monohydrate | WAKO | 194-02032 | Diluted in dH2O (final concentrations: 1 µM, 3 µM, 10 µM, 30 µM, 100 µM) |
References
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126 (3), 397-342 (1977).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Roppongi, R. T., Champagne-Jorgensen, K. P., Siddiqui, T. J. Low-density primary hippocampal neuron culture. Journal of Visualized Experiments. (122), e55000 (2017).
- Mizui, T., et al. Drebrin E is involved in the regulation of axonal growth through actin-myosin interactions. Journal of Neurochemistry. 109 (2), 611-622 (2009).
- Mizui, T., et al. Myosin II ATPase activity mediates the long-term potentiation-induced exodus of stable F-actin bound by drebrin A from dendritic spines. PLoS One. 9 (1), 85367 (2014).
- Takahashi, H., Mizui, T., Shirao, T. Down-regulation of drebrin A expression suppresses synaptic targeting of NMDA receptors in developing hippocampal neurons. Journal of Neurochemistry. 97, 110-115 (2006).
- Takahashi, H., et al. Drebrin-dependent actin clustering in dendritic filopodia governs synaptic targeting of postsynaptic density-95 and dendritic spine morphogenesis. The Journal of Neuroscience. 23 (16), 6586-6595 (2003).
- Yamazaki, H., Sasagawa, Y., Yamamoto, H., Bito, H., Shirao, T. CaMKIIbeta is localized in dendritic spines as both drebrin-dependent and drebrin-independent pools. Journal of Neurochemistry. 146 (2), 145-159 (2018).
- Hanamura, K., et al. High-content imaging analysis for detecting the loss of drebrin clusters along dendrites in cultured hippocampal neurons. Journal of Pharmacological and Toxicological Methods. 99, 106607 (2019).
- Mitsuoka, T., et al. Assessment of NMDA receptor inhibition of phencyclidine analogues using a high-throughput drebrin immunocytochemical assay. Journal of Pharmacological and Toxicological Methods. 99, 106583 (2019).
- Ishizuka, Y., Bramham, C. R. A simple DMSO-based method for cryopreservation of primary hippocampal and cortical neurons. Journal of Neuroscience Methods. 333, 108578 (2020).
- Pischedda, F., et al. Cryopreservation of primary mouse neurons: The benefit of neurostore cryoprotective medium. Frontiers in Cellular Neuroscience. 12, 81 (2018).
- Kobayashi, Y., et al. Impairment of ciliary dynamics in an APP knock-in mouse model of Alzheimer's disease. Biochemical and Biophysical Research Communications. 610, 85-91 (2022).
- Kobayashi, Y., et al. Properties of primary cilia in melanin-concentrating hormone receptor 1-bearing hippocampal neurons in vivo and in vitro. Neurochemistry International. 142, 104902 (2021).
- Koganezawa, N., et al. NMDA receptor-dependent and -independent effects of natural compounds and crude drugs on synaptic states as revealed by drebrin imaging analysis. The European Journal of Neuroscience. 53 (11), 3548-3560 (2021).
- Mizui, T., Takahashi, H., Sekino, Y., Shirao, T. Overexpression of drebrin A in immature neurons induces the accumulation of F-actin and PSD-95 into dendritic filopodia, and the formation of large abnormal protrusions. Molecular and Cellular Neurosciences. 30 (1), 149-157 (2005).
- Sekino, Y., et al. Activation of N-methyl-D-aspartate receptor induces a shift of drebrin distribution: disappearance from dendritic spines and appearance in dendritic shafts. Molecular and Cellular Neurosciences. 31 (3), 493-504 (2006).
- Takahashi, H., Yamazaki, H., Hanamura, K., Sekino, Y., Shirao, T. Activity of the AMPA receptor regulates drebrin stabilization in dendritic spine morphogenesis. Journal of Cell Science. 122, 1211-1219 (2009).
- Aoki, C., et al. Drebrin A is a postsynaptic protein that localizes in vivo to the submembranous surface of dendritic sites forming excitatory synapses. The Journal of Comparative Neurology. 483 (4), 383-402 (2005).
- Koganezawa, N., Hanamura, K., Sekino, Y., Shirao, T. The role of drebrin in dendritic spines. Molecular and Cellular Neurosciences. 84, 85-92 (2017).
- Shirao, T., et al. The role of drebrin in neurons. Journal of Neurochemistry. 141 (6), 819-834 (2017).
- Sekino, Y., Koganezawa, N., Mizui, T., Shirao, T. Role of drebrin in synaptic plasticity. Advances in Experimental Medicine and Biology. 1006, 183-201 (2017).
- Togo, K., et al. Postsynaptic structure formation of human iPS cell-derived neurons takes longer than presynaptic formation during neural differentiation in vitro. Molecular Brain. 14 (1), 149 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved