Method Article
Coltura primaria a bassa densità facile e riproducibile utilizzando stock congelati di neuroni ippocampali embrionali
In questo articolo
Riepilogo
Uno stock congelato di neuroni pronto all'uso è un potente strumento per valutare le funzioni sinaptiche. Qui, introduciamo una semplice coltura primaria a bassa densità da stock congelati utilizzando una piastra a 96 pozzetti.
Abstract
La coltura neuronale è un sistema prezioso per valutare le funzioni sinaptiche e gli screening farmacologici. In particolare, una coltura a bassa densità di neuroni ippocampali primari consente lo studio di singoli neuroni o componenti subcellulari. Abbiamo dimostrato la localizzazione della proteina subcellulare all'interno di un neurone mediante immunocitochimica, polarità neuronale, morfologia sinaptica e il suo cambiamento di sviluppo utilizzando una coltura ippocampale primaria a bassa densità. Recentemente, le scorte congelate di neuroni pronte all'uso sono diventate disponibili in commercio. Queste scorte congelate di neuroni riducono il tempo necessario per preparare gli esperimenti sugli animali e contribuiscono anche alla riduzione del numero di animali utilizzati. Qui, introduciamo un metodo di coltura primaria a bassa densità riproducibile utilizzando una piastra a 96 pozzetti. Abbiamo usato uno stock congelato di neuroni disponibile in commercio dall'ippocampo embrionale del ratto. I neuroni possono essere coltivati stabilmente a lungo termine senza cambiamenti dei media riducendo la crescita delle cellule gliali in particolari punti temporali. Questo test ad alta produttività che utilizza colture a bassa densità consente valutazioni riproducibili basate sull'imaging della plasticità sinaptica.
Introduzione
Lo sviluppo di un sistema sperimentale in vitro in grado di valutare le funzioni sinaptiche coinvolte nell'apprendimento e nella memoria è importante. La coltura neuronale è un sistema prezioso per valutare le funzioni sinaptiche in vitro. La tecnica di coltura neuronale è stata utilizzata per la prima volta nel 1980, e nel 1990, la coltura a bassa densità di neuroni ippocampali primari è stata sviluppata 1,2,3 per lo studio dei singoli neuroni in termini di localizzazione subcellulare di componenti proteici, traffico proteico, polarità neuronale, morfologia della colonna vertebrale, sviluppo sinapsi e plasticità 4,5,6,7,8 . Tuttavia, ci sono molti passaggi coinvolti in questa tecnica: accoppiamento di animali, sezionamento di embrioni, preparazione di vasi di coltura e coltura di cellule per 3 settimane con cambi di media una volta alla settimana. Inoltre, richiede tecniche avanzate3.
Abbiamo sviluppato scorte congelate di neuroni ippocampali dissociati da embrioni di ratto 9,10. Le scorte congelate di neuroni sono pronte all'uso e non sono necessarie tecniche avanzate per la coltura delle cellule11,12. In altre parole, la coltura dei neuroni da scorte congelate non dipende dalla tecnica di uno sperimentatore. Elimina la necessità di esperimenti sugli animali (ad esempio, il permesso per gli esperimenti sugli animali, l'organizzazione di animali gravidi a tempo e la dissezione di embrioni di ratto), riducendo così il numero di animali utilizzati. Recentemente, scorte congelate di neuroni di alta qualità e pronte all'uso sono diventate disponibili in commercio. Qui, abbiamo utilizzato scorte congelate disponibili in commercio dal giorno embrionale (E) 18 ippocampo di ratto13,14,15. La coltura dei neuroni da uno stock congelato non richiede terreni condizionati dalla glia o co-coltura con cellule gliali. I normali terreni di coltura primari senza siero aggiuntivo possono essere utilizzati per coltivare le cellule; quindi possiamo acquisire dati riproducibili. Inoltre, non vi è alcuna necessità di scambio di mezzi per 3 settimane dopo la semina cellulare poiché la crescita delle cellule gliali è ridotta (Figura 1).
Le spine dendritiche sono il compartimento postsinaptico della maggior parte delle sinapsi eccitatorie. Contengono proteine recettoriali, proteine dell'impalcatura postsinaptica e proteine citoscheletriche dell'actina. Ci siamo concentrati su una proteina legante l'actina drebrin 5,6,7,16,17,18. Il drebrin si accumula alla testa della colonna vertebrale nei neuroni maturi19 e abbiamo riportato drebrin come marker per lo stato sinaptico 15,17,20,21,22,23. Conducendo un'analisi ad alto contenuto utilizzando drebrin come lettura, abbiamo recentemente riportato gli effetti inibitori degli analoghi della fenciclidina sui recettori del glutammato di tipo acido N-metil-D-aspartico (NMDAR) 10 e gli effetti NMDAR-dipendenti di composti naturali e farmaci grezzi sugli stati sinaptici15.
Qui, descriviamo in dettaglio come coltivare scorte congelate di neuroni a bassa densità. Inoltre, mostriamo una valutazione basata sull'imaging drebrin dello stato sinaptico utilizzando piastre a 96 pozzetti.
Protocollo
1. Rivestimento della piastra
- Rivestire una micropiastra da 96 pozzetti con poli-L-lisina (1 mg/ml, diluita in tampone borato da 0,1 M [pH: 8,5]; 100 μL/pozzetto) e incubare per una notte a 37 °C.
NOTA: rivestire solo i pozzetti che devono essere utilizzati. Negli esperimenti eseguiti qui, vengono utilizzati i 60 pozzi centrali. Il tampone borato viene preparato mescolando 50 mM di acido borico e 12 mM di borato in acqua sterilizzata. - Lavare la piastra due volte con acqua sterilizzata (250 μL/pozzetto).
- Lavare la piastra una volta con terreno di coltura fresco senza integratori (250 μL/pozzetto).
- Asciugare il piatto su una panca pulita per 20 minuti.
- Avvolgere la piastra con un foglio di alluminio e tenerla a 4 °C fino all'uso (valido per 1 mese).
2. Semina cellulare
- Aggiungere 50 μL/pozzetto del terreno di coltura alla piastra rivestita e conservarla in un incubatore a 37 °C, 5% CO2 per 30 minuti a 1 ora. Riempire i pozzetti periferici con acqua sterilizzata (200 μL/pozzetto).
NOTA: Il terreno di coltura viene preparato aggiungendo 50x B-27, 400x Glutamax e 100 U / mL di penicillina / streptomicina al mezzo neurobasale (fare riferimento alla Tabella dei materiali per i dettagli). - Rimuovere il crioviale neuronale dal serbatoio di azoto liquido. I neuroni utilizzati qui erano neuroni DMSO-crioconservati11.
- Immergere il crioviale in un blocco termico a 37 °C per un massimo di 3 minuti e scongelare parzialmente il contenuto. Non riscaldare il crioviale troppo a lungo. Trasferire il contenuto in un tubo da 50 mL non appena viene scongelato.
- Trasferire lentamente il contenuto crioviale del neurone in un tubo sterile da 50 mL a goccia (50 μL/s) utilizzando una pipetta da 1 mL con punta a poro largo.
- Risciacquare il crioviale vuoto con 1 mL di terreno di coltura (temperatura ambiente; RT). Trasferire questo 1 mL del terreno di coltura dal crioviale a goccia (50 μL/s) al tubo da 50 mL contenente la sospensione cellulare.
- Aggiungere 9 mL del terreno di coltura (RT) al tubo da 50 mL in senso goccia (0,5 mL/s) e portare il volume a 11 mL. Non ripetere il pipettaggio, ma mescolare lentamente la sospensione cellulare.
- Contare il numero di cellule (utilizzare un contatore di cellule o un emocitometro).
- Trasferire tutta la sospensione della cella in un serbatoio ed erogare la sospensione della cella sulla piastra a 96 pozzetti utilizzando una pipetta multicanale con punte a pori larghi (1,0 x 104 celle/pozzetto). Per ridurre l'evaporazione del terreno di coltura, riempire i pozzetti periferici con acqua sterilizzata (fase 2.1).
NOTA: Questo studio conferma che l'evaporazione del terreno di coltura è piccola per una coltura di 3 settimane senza scambio di mezzo. Il tasso di riduzione del mezzo è del 3,6% (n = 120 pozzi). Pertanto, il cambiamento di osmolalità non sarà drastico durante il periodo di incubazione di 3 settimane. - Incubare i neuroni per 1-2 ore in un incubatore a 37 °C, 5% CO2 .
- Sostituire il terreno di coltura con 100 μL di terreno di coltura preriscaldato (37 °C) per pozzetto e rimetterlo in un incubatore a 37 °C, 5% di CO2 (non è necessario cambiare il terreno durante la coltura).
3. Trattamento Ara-C
- A 4 giorni in vitro (DIV), aggiungere citosina β-D-arabino-furanoside (Ara-C) a una concentrazione finale di 0,2 μM per pozzetto per ridurre la crescita delle cellule gliali.
4. Trattamenti farmacologici
- A 21 giorni in vitro, trattare le cellule con i farmaci di interesse.
- Mantenere la temperatura della piastra a 37 °C durante i trattamenti farmacologici.
- Per un controllo positivo, trattare le cellule con 100 μM di glutammato (per pozzetto per concentrazione finale) per 10 minuti prima della fissazione.
5. Fissazione
- Per la fissazione, utilizzare paraformaldeide al 4% in tampone fosfato 0,1 M (100 μL/pozzetto).
- Dopo ~ 20 minuti di fissazione, lavare i pozzetti con soluzione salina tamponata fosfato (PBS; 250 μL / pozzetto) 2x per 5 minuti ciascuno.
6. Immunocitochimica
- Lavare le celle con PBS (250 μL/pozzetto) 1x per 5 min.
- Permeabilizzare le cellule con Triton X-100 allo 0,1% (100 μL/pozzetto) in PBS per 5 minuti.
- Lavare le celle con PBS (250 μL/pozzetto) 3 volte per 5 minuti ciascuna.
- Per il blocco, utilizzare albumina sierica bovina al 3% in PBS (PBSA; 100 μL/pozzetto) per 1 ora a RT.
- Incubare le cellule con anticorpi anti-drebrin (1:1) e anti-Microtubule Associated Protein 2 (MAP2) (1:000) (60 μL/pozzetto) a 4 °C durante la notte.
- Lavare le celle con PBS (250 μL/pozzetto) 4x per 5 minuti ciascuna.
- Incubare le cellule con anticorpi secondari appropriati e 4′,6-diamidino-2-fenilindolo, dicloridrato (DAPI; 1:1000) in PBSA (60 μL/pozzetto) per 2 ore a RT.
- Lavare le celle con PBS (250 μL/pozzetto) 4x per 5 minuti ciascuna.
- Conservare le cellule in PBS contenente lo 0,1% di azoturo di sodio (150 μL/pozzetto).
7. Acquisizione e analisi delle immagini
- Per acquisire le immagini, utilizzare un microscopio appropriato.
- Per identificare i corpi cellulari dei neuroni, utilizzare entrambe le regioni MAP2-positive e DAPI-positive.
- Per identificare i dendriti dei neuroni, utilizzare segnali MAP2-positivi senza corpi cellulari.
- Per identificare i cluster di drebrin, utilizzare segnali positivi alla drebrina lungo i dendriti positivi MAP2.
Risultati
Seguendo il protocollo, i neuroni sono stati coltivati in una piastra a 96 pozzetti per 21 giorni e quindi trattati con glutammato (Figura 1). I neuroni si sono sviluppati normalmente senza uno scambio del terreno di coltura per 3 settimane (Figura 2). Abbiamo trattato le cellule con diverse concentrazioni di glutammato (1 μM, 3 μM, 10 μM, 30 μM e 100 μM diluite in acqua sterilizzata) per 10 minuti e le abbiamo fissate. È stata eseguita l'immunocitochimica e sono state acquisite immagini di fluorescenza di drebrin e MAP2 utilizzando un microscopio a fluorescenza automatizzato con una fotocamera sCMOS. Come mostrato nella Figura 3, le spine dendritiche drebrin-positive sono chiaramente osservate lungo i dendriti MAP2-positivi. È stato dimostrato che la stimolazione del glutammato provoca l'afflusso di Ca2+ attraverso NMDAR, che causa l'esodo di drebrin dalle spine dendritiche con conseguente riduzione della densità dei cluster di drebrina 5,17. Di conseguenza, abbiamo osservato la riduzione dose-dipendente delle densità dei cluster di drebrina rispetto alla stimolazione del glutammato10 (Figura 4). Come mostrato nella Figura 5, questo metodo è altamente riproducibile se il drebrin viene utilizzato come marcatore per gli stati sinaptici.
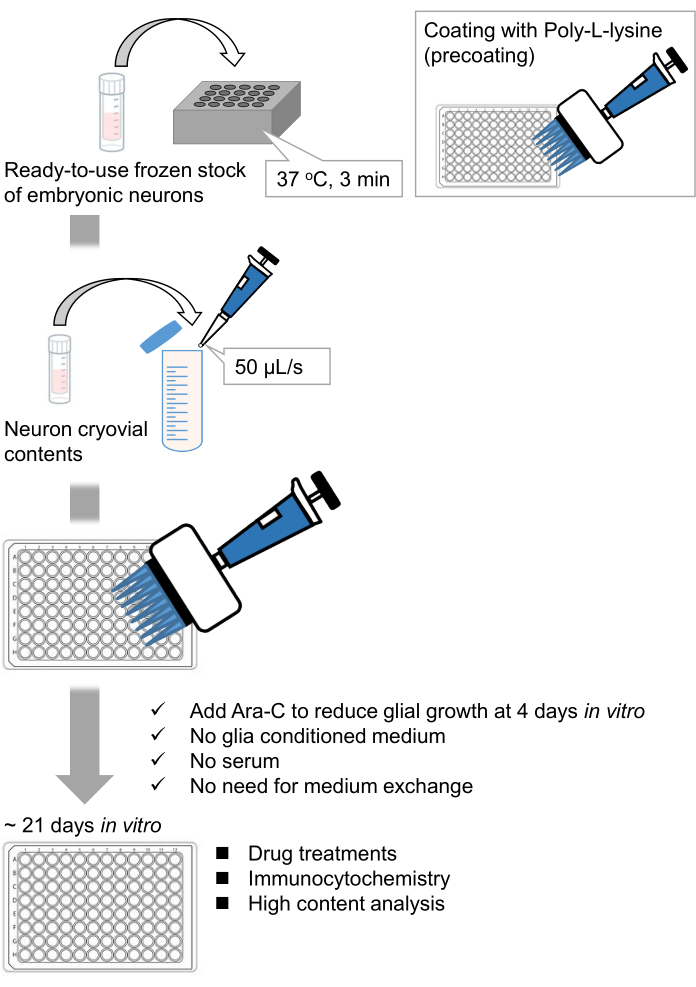
Figura 1: Schema del metodo. I neuroni sono stati coltivati in una piastra da 96 pozzetti per 21 giorni e poi trattati con glutammato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
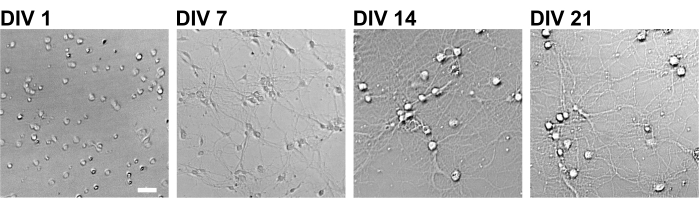
Figura 2: Immagini in campo chiaro di neuroni in coltura utilizzando una piastra a 96 pozzetti. Le immagini a contrasto di fase sono state ottenute da ogni stadio di sviluppo (DIV 1, 7, 14, 21) utilizzando un citometro a immagine quantitativa confocale. Barra scala: 50 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
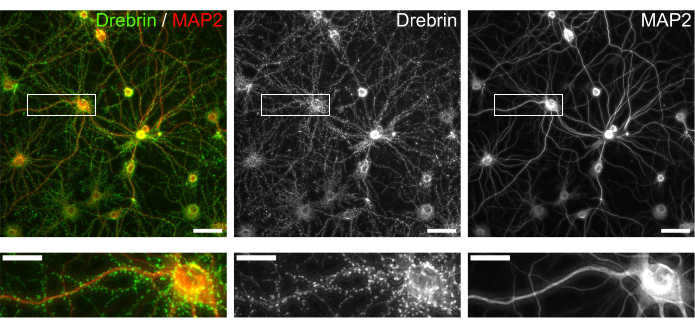
Figura 3: Immagini rappresentative di neuroni in coltura immunocolorati. (Sinistra) Immagini di fluorescenza unite di drebrin (verde) e MAP2 (rosso). Ogni immagine di fluorescenza di drebrin e MAP2 mostrata rispettivamente nei pannelli centrale e destro. I rettangoli bianchi mostrano l'area ingrandita sotto. Barre della scala; Pannelli superiori: 50 μm, Pannelli inferiori: 20 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
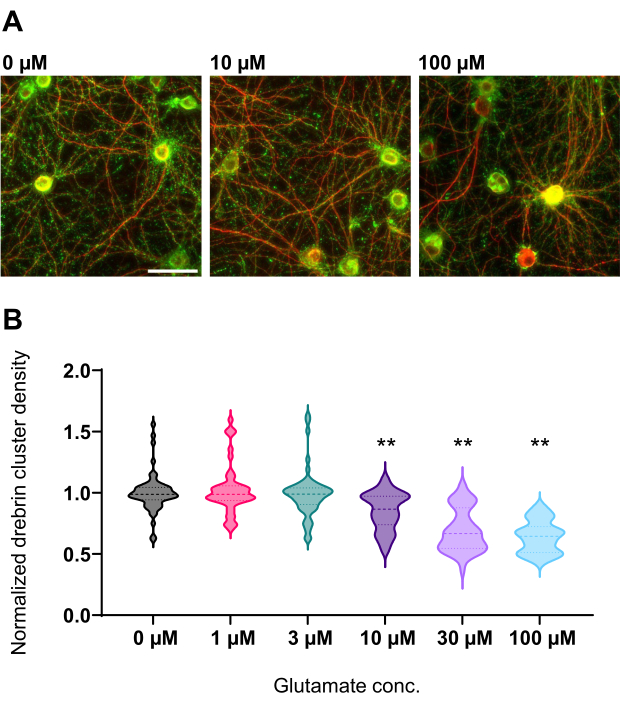
Figura 4: Variazioni dose-risposta glutammato-dipendenti nella densità normalizzata dei cluster di drebrina. (A) Immagini rappresentative di fluorescenza immunocolorate con drebrin (verde) e MAP2 (rosso) dal pozzetto trattato con glutammato 0 μM, 10 μM e 100 μM (da sinistra a destra). Barra di scala: 50 μm. (B) La densità dell'ammasso di drebrina è stata normalizzata dalla media del controllo (0 μM). 0 μM, N = 58 pozzetti; 1 μM, N = 46; 3 μM, N = 54; 10 μM, N = 45; 30 μM, N = 54; 100 μM, N = 55, da 13 esperimenti che utilizzano lotti diversi. ** P < 0,01 rispetto al controllo (0 μM) dal test di confronto multiplo di Dunnett dopo ANOVA. Fare clic qui per visualizzare una versione ingrandita di questa figura.
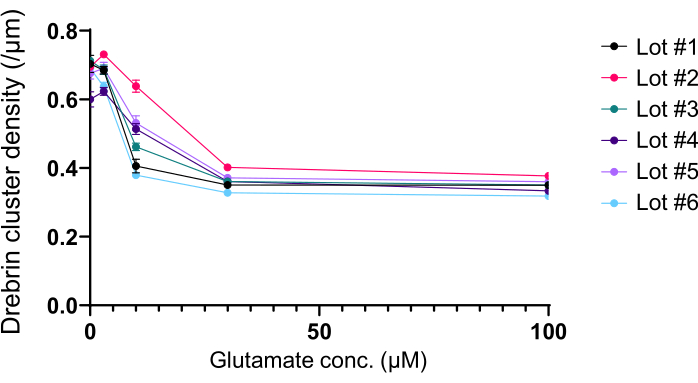
Figura 5: Variazioni dose-risposta glutammato-dipendenti nella densità dei cluster di drebrina. I dati grezzi di sei esperimenti che utilizzano lotti diversi. N = 4 pozzetti per ogni concentrazione (0 μM, 3 μM, 10 μM, 30 μM e 100 μM). I valori sono espressi come media ± SEM. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 6: Applicazione delle scorte congelate di neuroni agli esperimenti elettrofisiologici. (A) Un protocollo per esperimenti elettrofisiologici che utilizzano piastre MEA (microelectrode array). Rivestimento: Un giorno prima della placcatura delle celle, ogni piastra MEA a 48 pozzetti è stata pre-rivestita con una soluzione di polietilenimmina (PEI: 0,1%) e incubata per 1 ora a 37 °C. La piastra MEA è stata quindi lavata 3 volte con acqua sterilizzata e asciugata per 1 ora. Quindi, la piastra MEA è stata mantenuta a 4 ° C durante la notte. Coltura ad alta densità: 50.000 cellule / pozzetto dei neuroni sono stati placcati su piastre MEA a 48 pozzetti. La fase di semina cellulare è stata eseguita come descritto nella sezione 2 del protocollo sopra descritto. Laminina (20 μg / mL) aggiunto terreno di coltura (aggiungere 2 v / v% B-27, 2,5 mM Glutamax e 100 μg / mL di penicillina / streptomicina al mezzo neurobasale) è stata utilizzata per placcare i neuroni. Successivamente, i neuroni sono stati coltivati a 37 ° C, 5% CO2 nel terreno di coltura. I media sono stati completamente scambiati su DIV 1 con il terreno di coltura fino a DIV 3. Ara-C è stato aggiunto a DIV 4 (finale 0,2 μM). Da DIV 5 in poi e 2 volte a settimana, il 50% dei media è stato cambiato con il mezzo di coltura. L'attività dei neuroni su ciascun pozzetto della piastra MEA è stata registrata con un sistema MEA. (B) L'attività neuronale spontanea è stata acquisita a 37 °C in un'atmosfera di CO2 al 5% utilizzando un sistema MEA ad una frequenza di campionamento di 12,5 kHz/canale a DIV 21. Vengono mostrate le registrazioni da 4 canali dei 16 canali all'interno di un pozzo. Per tutte le registrazioni, è stato applicato un filtro passa-banda Butterworth (200-3.000 Hz). Le punte delle frecce mostrano i tempi di sparo a raffica sincronizzati. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Un passo fondamentale in questo metodo è quello di scongelare la sospensione cellulare. Il trasferimento della sospensione cellulare prima che diventi troppo caldo è molto importante. Per evitare il rapido cambiamento dell'osmolalità, tuttavia, non trasferire la sospensione cellulare su un grande volume del mezzo in una sola volta. Anche l'aggiunta a goccia del terreno di coltura è fondamentale per evitare improvvisi cambiamenti nella pressione osmotica.
I neuroni possono essere coltivati in altri vasi di coltura: piastre a 24 pozzetti, camere a 8 pozzetti, piatti da 60 mm o sonde MED. In questi casi, tuttavia, la concentrazione finale e i tempi dell'aggiunta di Ara-C devono essere adeguati. Inoltre, la densità dei neuroni deve essere ottimizzata in diversi tipi di esperimenti. Ad esempio, la coltura ad alta densità è necessaria per gli esperimenti elettrofisiologici e, in tal caso, lo scambio di media è necessario due volte alla settimana (Figura 6). Pertanto, una coltura a bassa densità richiede meno passaggi rispetto a una cultura ad alta densità.
La coltura neuronale a bassa densità richiede spesso tecniche avanzate; Tuttavia, l'utilizzo di scorte congelate pronte all'uso risolve questo problema. Il metodo descritto non dipende dall'abilità di uno sperimentatore. La qualità delle scorte congelate è stabile e può essere coltivata stabilmente purché siano conservate in azoto liquido ed evitino variazioni di temperatura fino a 4 anni.
La coltura delle cellule per 3 settimane senza scambio di mezzo solleva la questione se ci siano cambiamenti significativi dell'osmolalità o evaporazione dei terreni di coltura. Tuttavia, abbiamo confermato che l'evaporazione dei terreni di coltura è modesta (tasso di riduzione del 3,6%). La localizzazione delle proteine sinaptiche e la morfologia dei neuroni appaiono normali dopo 3 settimane. Pertanto, la coltura di 3 settimane senza scambio di media non causa grandi cambiamenti di osmolalità che influenzano le condizioni dei neuroni coltivati. Mantenere la piastra in un'incubatrice dopo il trattamento Ara-C è anche un punto importante che riduce al minimo l'evaporazione.
Non vi è alcuna limitazione per quanto riguarda l'uso dei neuroni congelati. Tuttavia, ci sono alcune limitazioni del metodo di coltura a bassa densità. Abbiamo confermato che la coltura a bassa densità potrebbe essere applicata per l'osservazione morfologica dei neuroni, la valutazione della funzione sinaptica e la trasfezione della GFP. Tuttavia, non abbiamo esaminato l'imaging delle cellule vive. Inoltre, come accennato in precedenza, è necessaria una coltura ad alta densità per eseguire l'elettrofisiologia.
La maturazione delle sinapsi richiede in genere 3 settimane7 e non possiamo confermare che i neuroni coltivati abbiano sinapsi adeguate fino alla fine. Se la maturazione delle sinapsi non è buona dopo 3 settimane, dovremmo coltivare di nuovo. Conoscendo la qualità dei neuroni prima di iniziare gli esperimenti, possiamo salvare queste 3 settimane. Pertanto, per eseguire esperimenti in modo efficiente, è meglio controllare in anticipo la qualità dei neuroni. Le scorte congelate consentono di controllare in anticipo la qualità dei neuroni. Ogni lotto di scorte congelate è generato da una cucciolata di ratti e possiamo utilizzare uno degli stock di ogni lotto per un controllo di qualità. Drebrin è un buon marcatore per il controllo di qualità dei neuroni. Come descritto, la drebrina si accumula nella testa della colonna vertebrale nei neuroni maturi e reagisce alla stimolazione sinaptica. Pertanto, possiamo controllare la qualità dei neuroni nelle scorte congelate usando drebrin come marcatore.
Questo metodo può essere applicato per valutare l'effetto dei farmaci sullo stato sinaptico. L'esodo di drebrin dalle spine dendritiche si verifica durante le fasi iniziali della plasticità sinaptica22. Pertanto, il rilevamento della riduzione del cluster di drebrin indotta dal trattamento farmacologico mostra che il farmaco stimola la sinapsi e causa plasticità sinaptica. Inoltre, per identificare se la riduzione è NMDAR dipendente, è utile un esperimento che utilizza acido 2-ammino-5-fosfonovalerico (APV, un antagonista NMDAR). Usando drebrin come marcatore, anche una dipendenza NMDAR è chiaramente determinata10,15. Il metodo descritto è utile negli screening farmacologici, negli studi farmacologici di sicurezza e nella valutazione della funzione sinaptica.
Divulgazioni
Tomoaki Shirao è il CEO di AlzMed, Inc. Lo studio è stato finanziato da AlzMed, Inc. (500.000 JPY a NK per il progetto intitolato "High-throughput analysis of synaptic function").
Riconoscimenti
Ringraziamo Kazumi Kamiyama e Manami Kawada per l'assistenza negli esperimenti. Questo lavoro è stato supportato da JSPS KAKENHI (numero di sovvenzione 19K08010 a N.K.) e dall'Agenzia giapponese per la ricerca e lo sviluppo medico (AMED) (numero di sovvenzione JP19bk0104077 e JP22bm0804024 a T.S.).
Materiali
| Name | Company | Catalog Number | Comments |
| 96 well plate | Zeon Corporation | Gifted | |
| 96 well plate | greiner | 655986 | |
| Anti-drebrin antibody (M2F6) | MBL | D029-3 | Mouse monoclonal (dilution 1:1) |
| Anti-MAP2 antibody | Millipore | AB5622 | Rabbit (dilution 1:1000) |
| Anti-mouse Alexa Fluor 568 | Thermo Fisher Scientific | A11031 | Dilution 1: 500 |
| Anti-rabbit Alexa Fluor | Thermo Fisher Scientific | A11008 | Dilution 1: 500 |
| B-27 | Gibco | 17504-044 | 2 v/v% for MEA plates; 50x for normal plates |
| Borax | Sigma | B-9876 | Final concentration 12 mM |
| Boric acid | WAKO | 021-02195 | Final concentration 50 mM |
| Bovine serum albumin | Millipore | 12659-100G | Final concentration: 3% in PBS |
| Confocal quantitative image cytometer CellVoyager CQ1 | YOKOGAWA | Phase contrast images | |
| Cytosine β-D-arabino-furanoside (Ara-C) | Sigma | C-6645 | Diluted in dH2O (final concentration: 0.2 µM) |
| DAPI | FUJIFILM | 340-07971 | Dilution 1:1000 |
| GlutaMAX | Gibco | 35050-061 | 2.5 mM for MEA plates; 400x for normal plates |
| In Cell Analyzer 2200 | Cytiva | Fluorescence images | |
| Laminin | Sigma | 114956-81-9 | Final concentration: 20 µg/mL |
| Maestro | Axion Biosystems | MEA recordings | |
| MEA plate | Axion Biosystems | M768-tMEA-48W | |
| Neurobasal | Gibco | 21103-049 | |
| Paraformaldehyde | nacalai tesque | 26126-25 | Final concentration: 4% in PBS |
| Penicillin/Streptomycin | Gibco | 15140-122 | 100 U/mL for normal plates |
| Penicillin/Streptomycin | nacalai tesque | 26253-84 | 100 µg/mL for MEA plates |
| polyethyleimine | Sigma | 9002-98-6 | Final concentration: 0.1% |
| Poly-L-lysine | Sigma | P2636 | Diluted in the borate buffer (final concentration: 1 mg/mL) |
| SKY Neuron | AlzMed , Inc. | ARH001 | 1.0 x 106 cells/tube |
| Sodium azide | FUJIFILM | 195-11092 | 0.1% |
| SodiumL(+)-Glutamate monohydrate | WAKO | 194-02032 | Diluted in dH2O (final concentrations: 1 µM, 3 µM, 10 µM, 30 µM, 100 µM) |
Riferimenti
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126 (3), 397-342 (1977).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Roppongi, R. T., Champagne-Jorgensen, K. P., Siddiqui, T. J. Low-density primary hippocampal neuron culture. Journal of Visualized Experiments. (122), e55000 (2017).
- Mizui, T., et al. Drebrin E is involved in the regulation of axonal growth through actin-myosin interactions. Journal of Neurochemistry. 109 (2), 611-622 (2009).
- Mizui, T., et al. Myosin II ATPase activity mediates the long-term potentiation-induced exodus of stable F-actin bound by drebrin A from dendritic spines. PLoS One. 9 (1), 85367 (2014).
- Takahashi, H., Mizui, T., Shirao, T. Down-regulation of drebrin A expression suppresses synaptic targeting of NMDA receptors in developing hippocampal neurons. Journal of Neurochemistry. 97, 110-115 (2006).
- Takahashi, H., et al. Drebrin-dependent actin clustering in dendritic filopodia governs synaptic targeting of postsynaptic density-95 and dendritic spine morphogenesis. The Journal of Neuroscience. 23 (16), 6586-6595 (2003).
- Yamazaki, H., Sasagawa, Y., Yamamoto, H., Bito, H., Shirao, T. CaMKIIbeta is localized in dendritic spines as both drebrin-dependent and drebrin-independent pools. Journal of Neurochemistry. 146 (2), 145-159 (2018).
- Hanamura, K., et al. High-content imaging analysis for detecting the loss of drebrin clusters along dendrites in cultured hippocampal neurons. Journal of Pharmacological and Toxicological Methods. 99, 106607 (2019).
- Mitsuoka, T., et al. Assessment of NMDA receptor inhibition of phencyclidine analogues using a high-throughput drebrin immunocytochemical assay. Journal of Pharmacological and Toxicological Methods. 99, 106583 (2019).
- Ishizuka, Y., Bramham, C. R. A simple DMSO-based method for cryopreservation of primary hippocampal and cortical neurons. Journal of Neuroscience Methods. 333, 108578 (2020).
- Pischedda, F., et al. Cryopreservation of primary mouse neurons: The benefit of neurostore cryoprotective medium. Frontiers in Cellular Neuroscience. 12, 81 (2018).
- Kobayashi, Y., et al. Impairment of ciliary dynamics in an APP knock-in mouse model of Alzheimer's disease. Biochemical and Biophysical Research Communications. 610, 85-91 (2022).
- Kobayashi, Y., et al. Properties of primary cilia in melanin-concentrating hormone receptor 1-bearing hippocampal neurons in vivo and in vitro. Neurochemistry International. 142, 104902 (2021).
- Koganezawa, N., et al. NMDA receptor-dependent and -independent effects of natural compounds and crude drugs on synaptic states as revealed by drebrin imaging analysis. The European Journal of Neuroscience. 53 (11), 3548-3560 (2021).
- Mizui, T., Takahashi, H., Sekino, Y., Shirao, T. Overexpression of drebrin A in immature neurons induces the accumulation of F-actin and PSD-95 into dendritic filopodia, and the formation of large abnormal protrusions. Molecular and Cellular Neurosciences. 30 (1), 149-157 (2005).
- Sekino, Y., et al. Activation of N-methyl-D-aspartate receptor induces a shift of drebrin distribution: disappearance from dendritic spines and appearance in dendritic shafts. Molecular and Cellular Neurosciences. 31 (3), 493-504 (2006).
- Takahashi, H., Yamazaki, H., Hanamura, K., Sekino, Y., Shirao, T. Activity of the AMPA receptor regulates drebrin stabilization in dendritic spine morphogenesis. Journal of Cell Science. 122, 1211-1219 (2009).
- Aoki, C., et al. Drebrin A is a postsynaptic protein that localizes in vivo to the submembranous surface of dendritic sites forming excitatory synapses. The Journal of Comparative Neurology. 483 (4), 383-402 (2005).
- Koganezawa, N., Hanamura, K., Sekino, Y., Shirao, T. The role of drebrin in dendritic spines. Molecular and Cellular Neurosciences. 84, 85-92 (2017).
- Shirao, T., et al. The role of drebrin in neurons. Journal of Neurochemistry. 141 (6), 819-834 (2017).
- Sekino, Y., Koganezawa, N., Mizui, T., Shirao, T. Role of drebrin in synaptic plasticity. Advances in Experimental Medicine and Biology. 1006, 183-201 (2017).
- Togo, K., et al. Postsynaptic structure formation of human iPS cell-derived neurons takes longer than presynaptic formation during neural differentiation in vitro. Molecular Brain. 14 (1), 149 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon