Method Article
Embriyonik Hipokampal Nöronların Dondurulmuş Stoğunu Kullanarak Kolay ve Tekrarlanabilir Düşük Yoğunluklu Birincil Kültür
Bu Makalede
Özet
Kullanıma hazır dondurulmuş bir nöron stoğu, sinaptik fonksiyonları değerlendirmek için güçlü bir araçtır. Burada, 96 delikli bir plaka kullanarak dondurulmuş stoktan kolay, düşük yoğunluklu bir birincil kültürü tanıtıyoruz.
Özet
Nöronal kültür, sinaptik fonksiyonların ve ilaç taramalarının değerlendirilmesinde değerli bir sistemdir. Özellikle, birincil hipokampal nöronların düşük yoğunluklu bir kültürü, bireysel nöronların veya hücre altı bileşenlerin incelenmesine izin verir. İmmünositokimya, nöronal polarite, sinaptik morfoloji ve düşük yoğunluklu primer hipokampal kültür kullanılarak gelişimsel değişimi ile bir nöron içindeki hücre altı protein lokalizasyonunu gösterdik. Son zamanlarda, kullanıma hazır dondurulmuş nöron stokları ticari olarak kullanılabilir hale gelmiştir. Bu dondurulmuş nöron stokları, hayvan deneylerini hazırlamak için gereken süreyi azaltır ve ayrıca kullanılan hayvan sayısının azaltılmasına katkıda bulunur. Burada, 96 delikli bir plaka kullanarak tekrarlanabilir düşük yoğunluklu bir birincil kültür yöntemini tanıtıyoruz. Sıçan embriyonik hipokampusundan ticari olarak temin edilebilen dondurulmuş bir nöron stoğu kullandık. Nöronlar, belirli zaman noktalarında glial hücrelerin büyümesini azaltarak medya değişiklikleri olmadan uzun vadede istikrarlı bir şekilde kültürlenebilir. Düşük yoğunluklu kültür kullanan bu yüksek verimli tahlil, sinaptik plastisitenin tekrarlanabilir görüntüleme tabanlı değerlendirmelerine izin verir.
Giriş
Öğrenme ve hafızada yer alan sinaptik fonksiyonları değerlendirebilen in vitro bir deneysel sistemin geliştirilmesi önemlidir. Nöronal kültür, in vitro sinaptik fonksiyonları değerlendirmek için değerli bir sistemdir. Nöronal kültür tekniği ilk olarak 1980'lerde kullanılmış ve 1990'larda, protein bileşenlerinin hücre altı lokalizasyonu, protein kaçakçılığı, nöronal polarite, omurga morfolojisi, sinaps gelişimi ve plastisite 4,5,6,7,8 açısından bireysel nöronların incelenmesi için birincil hipokampal nöronların düşük yoğunluklu kültürü 1,2,3 geliştirilmiştir. . Bununla birlikte, bu teknikte yer alan birçok adım vardır: hayvanları çiftleştirmek, embriyoları parçalara ayırmak, kültür damarlarını hazırlamak ve haftada bir kez medya değişiklikleri ile 3 hafta boyunca hücreleri kültürlemek. Ek olarak, ileri teknikler gerektirir3.
Sıçan embriyolarından ayrışmış hipokampal nöronların dondurulmuş stoklarını geliştirdik 9,10. Dondurulmuş nöron stokları kullanıma hazırdır ve hücrelerin kültürlenmesi için ileri tekniklere gerek yoktur11,12. Başka bir deyişle, nöronların donmuş stoklardan kültürlenmesi, bir deneycinin tekniğine bağlı değildir. Hayvan deneylerine olan ihtiyacı ortadan kaldırır (örneğin, hayvan deneyleri için izin, zamanlanmış hamile hayvanların düzenlenmesi ve sıçan embriyolarının diseke edilmesi), böylece kullanılan hayvan sayısını azaltır. Son zamanlarda, yüksek kaliteli, kullanıma hazır dondurulmuş nöron stokları ticari olarak kullanılabilir hale gelmiştir. Burada, embriyonik gün (E) 18 sıçan hipokampüsü 13,14,15'ten ticari olarak temin edilebilen dondurulmuş stokları kullandık. Nöronların dondurulmuş bir stoktan kültürlenmesi, glia şartlandırılmış ortam veya glial hücrelerle ortak kültür gerektirmez. Ek serum içermeyen sıradan birincil kültür ortamı, hücreleri kültürlemek için kullanılabilir; böylece tekrarlanabilir veriler elde edebiliriz. Ayrıca, glial hücrelerin büyümesi azaldığı için hücre tohumlamasından sonra 3 hafta boyunca ortam değişimine gerek yoktur (Şekil 1).
Dendritik dikenler, çoğu uyarıcı sinapsın postsinaptik bölmesidir. Reseptör proteinleri, postsinaptik iskele proteinleri ve aktin sitoiskelet proteinleri içerirler. Aktin bağlayıcı protein drebrin 5,6,7,16,17,18'e odaklandık. Drebrin olgun nöronlarda omurga başında birikir19 ve drebrini sinaptik durum 15,17,20,21,22,23 için bir belirteç olarak bildirdik. Okuma olarak drebrin'i kullanarak yüksek içerikli bir analiz yaparak, yakın zamanda fensiklidin analoglarının N-metil-D-aspartik asit tipi glutamat reseptörleri (NMDAR'lar) üzerindeki inhibitör etkilerini ve doğal bileşiklerin ve ham ilaçların sinaptik durumlar üzerindeki NMDAR'a bağımlı etkilerini15 bildirmiştir.
Burada, donmuş nöron stoklarının düşük yoğunlukta nasıl kültürleneceğini detaylandırıyoruz. Ek olarak, 96 delikli plakalar kullanarak sinaptik durumun drebrin görüntüleme tabanlı bir değerlendirmesini gösteriyoruz.
Protokol
1. Plaka kaplama
- 96 delikli bir mikro plakayı poli-L-lizin (1 mg / mL, 0.1 M borat tamponunda seyreltilmiş [pH: 8.5]; 100 μL / kuyu) ile kaplayın ve gece boyunca 37 ° C'de inkübe edin.
NOT: Sadece kullanılması gereken kuyuları kaplayın. Burada yapılan deneylerde ortadaki 60 kuyu kullanılmıştır. Borat tamponu, sterilize suda 50 mM borik asit ve 12 mM boratın karıştırılmasıyla hazırlanır. - Plakayı sterilize suyla (250 μL/kuyu) iki kez yıkayın.
- Tabağı takviyesiz taze kültür ortamı ile bir kez yıkayın (250 μL / kuyu).
- Tabağı temiz bir tezgahta 20 dakika kurulayın.
- Plakayı alüminyum folyo ile sarın ve kullanıma kadar 4 ° C'de tutun (1 ay boyunca geçerlidir).
2. Hücre tohumlama
- Kaplanmış plakaya kültür ortamının 50 μL/kuyucuğunu ekleyin ve 37 °C, %5 CO2 inkübatörde 30 dakika ila 1 saat arasında saklayın. Periferik kuyuları sterilize suyla doldurun (200 μL/kuyu).
NOT: Kültür ortamı, nörobazal ortama 50x B-27, 400x Glutamax ve 100 U / mL penisilin / streptomisin eklenerek hazırlanır (ayrıntılar için Malzeme Tablosuna bakın). - Nöron kriyovyalini sıvı azot tankından çıkarın. Burada kullanılan nöronlar DMSO-kriyo-korunmuş nöronlardı11.
- Kriyovyayı 37 °C'lik bir ısı bloğuna 3 dakikaya kadar batırın ve içindekileri kısmen çözün. Kriyovyayı çok uzun süre ısıtmayın. İçeriği çözülür çözülmez 50 mL'lik bir tüpe aktarın.
- Geniş gözenekli uçlu 1 mL'lik bir pipet kullanarak nöron kriyovyal içeriğini yavaşça steril 50 mL'lik bir tüpe damla yönünde (50 μL/s) aktarın.
- Boş kriyovyalı 1 mL kültür ortamı ile durulayın (oda sıcaklığında; RT). Kültür ortamının bu 1 mL'sini kriyoviyal damla bakımından (50 μL / s) hücre süspansiyonunu içeren 50 mL tüpe aktarın.
- 50 mL tüp damla yönünde (0,5 mL/s) 9 mL kültür ortamı (RT) ekleyin ve hacmi 11 mL'ye kadar yükseltin. Pipetlemeyi tekrarlamayın, ancak hücre süspansiyonunu yavaşça karıştırın.
- Hücre numarasını sayın (bir hücre sayacı veya hemositometre kullanın).
- Tüm hücre süspansiyonunu bir rezervuara aktarın ve geniş gözenek uçlu (1,0 x 104 hücre/kuyu) çok kanallı bir pipet kullanarak hücre süspansiyonunu 96 delikli plakaya dağıtın. Kültür ortamı buharlaşmasını azaltmak için, çevre kuyularını sterilize edilmiş suyla doldurun (adım 2.1).
NOT: Bu çalışma, orta değişim olmadan 3 haftalık bir kültür için kültür orta buharlaşmasının küçük olduğunu doğrulamaktadır. Ortamın küçülme oranı %3,6'dır (n=120 kuyu). Böylece, ozmolalite değişikliği 3 haftalık kuluçka döneminde şiddetli olmayacaktır. - Nöronları 37 ° C,% 5 CO 2 inkübatöründe1-2 saat boyunca inkübe edin.
- Kültür ortamını kuyucuk başına 100 μL önceden ısıtılmış kültür ortamı (37 ° C) ile değiştirin ve 37 ° C,% 5 CO2 inkübatöre geri koyun (kültür sırasında ortam değişikliği gerekmez).
3. Ara-C tedavisi
- 4 gün in vitro (DIV), glial hücrelerin büyümesini azaltmak için kuyucuk başına 0.2 μM'lik son konsantrasyona sitozin β-D-arabino-furanosid (Ara-C) ekleyin.
4. İlaç tedavileri
- In vitro 21 günde, hücreleri ilgilenilen ilaçlarla tedavi edin.
- İlaç tedavileri sırasında plakanın sıcaklığını 37 ° C'de tutun.
- Pozitif bir kontrol için, hücreleri fiksasyondan önce 10 dakika boyunca 100 μM glutamat (son konsantrasyon için kuyu başına) ile tedavi edin.
5. Fiksasyon
- Fiksasyon için, 0.1 M fosfat tamponunda (100 μL / kuyu) % 4 paraformaldehit kullanın.
- ~ 20 dakikalık fiksasyondan sonra, kuyucukları her biri 5 dakika boyunca fosfat tamponlu salin (PBS; 250 μL / kuyu) 2x ile yıkayın.
6. İmmünositokimya
- Hücreleri 5 dakika boyunca PBS (250 μL/kuyu) 1x ile yıkayın.
- PBS'de% 0.1 Triton X-100 (100 μL / kuyu) ile hücreleri 5 dakika boyunca geçirgenleştirin.
- Hücreleri PBS (250 μL/kuyu) ile her biri 5 dakika boyunca 3x yıkayın.
- Blokaj için, RT'de 1 saat boyunca PBS'de (PBSA; 100 μL / kuyu) % 3 sığır serum albümini kullanın.
- Hücreleri gece boyunca 4 ° C'de anti-drebrin (1: 1) ve anti-Mikrotübül İlişkili Protein 2 (MAP2) (1: 000) antikorları (60 μL / kuyu) ile inkübe edin.
- Hücreleri PBS (250 μL/kuyu) ile her biri 5 dakika boyunca 4x yıkayın.
- Hücreleri uygun sekonder antikorlar ve 4′,6-diamidino-2-fenilindol, dihidroklorür (DAPI; 1:1000) ile PBSA'da (60 μL / kuyu) RT'de 2 saat boyunca inkübe edin.
- Hücreleri PBS (250 μL/kuyu) ile her biri 5 dakika boyunca 4x yıkayın.
- Hücreleri% 0.1 sodyum azid (150 μL / kuyu) içeren PBS'de saklayın.
7. Görüntü toplama ve analizi
- Görüntüleri elde etmek için uygun bir mikroskop kullanın.
- Nöronların hücre gövdelerini tanımlamak için, hem MAP2-pozitif hem de DAPI-pozitif bölgeleri kullanın.
- Nöronların dendritlerini tanımlamak için, hücre gövdeleri olmadan MAP2-pozitif sinyaller kullanın.
- Drebrin kümelerini tanımlamak için, MAP2 pozitif dendritler boyunca drebrin-pozitif sinyaller kullanın.
Sonuçlar
Protokolü takiben, nöronlar 21 gün boyunca 96 kuyucuklu bir plakada kültürlendi ve daha sonra glutamat ile tedavi edildi (Şekil 1). Nöronlar, 3 hafta boyunca kültür ortamının değişimi olmadan normal olarak gelişti (Şekil 2). Hücreleri 10 dakika boyunca çeşitli konsantrasyonlarda glutamat (1 μM, 3 μM, 10 μM, 30 μM ve sterilize suda seyreltilmiş 100 μM) ile tedavi ettik ve sabitledik. İmmünositokimya yapıldı ve drebrin ve MAP2'nin floresan görüntüleri, sCMOS kameralı otomatik floresan mikroskop kullanılarak elde edildi. Şekil 3'te gösterildiği gibi, MAP2-pozitif dendritler boyunca drebrin-pozitif dendritik dikenler açıkça gözlenir. Glutamat stimülasyonunun NMDAR yoluyla Ca2 + akışını ortaya çıkardığı gösterilmiştir, bu da dendritik dikenlerden drebrin göçüne neden olur ve bu da drebrin kümesi yoğunluklarının azalmasına neden olur 5,17. Buna göre, glutamat stimülasyonuna karşı drebrin kümesi yoğunluklarının doza bağlı azalmasını gözlemledik10 (Şekil 4). Şekil 5'te gösterildiği gibi, drebrin sinaptik durumlar için bir belirteç olarak kullanılıyorsa, bu yöntem yüksek oranda tekrarlanabilir.
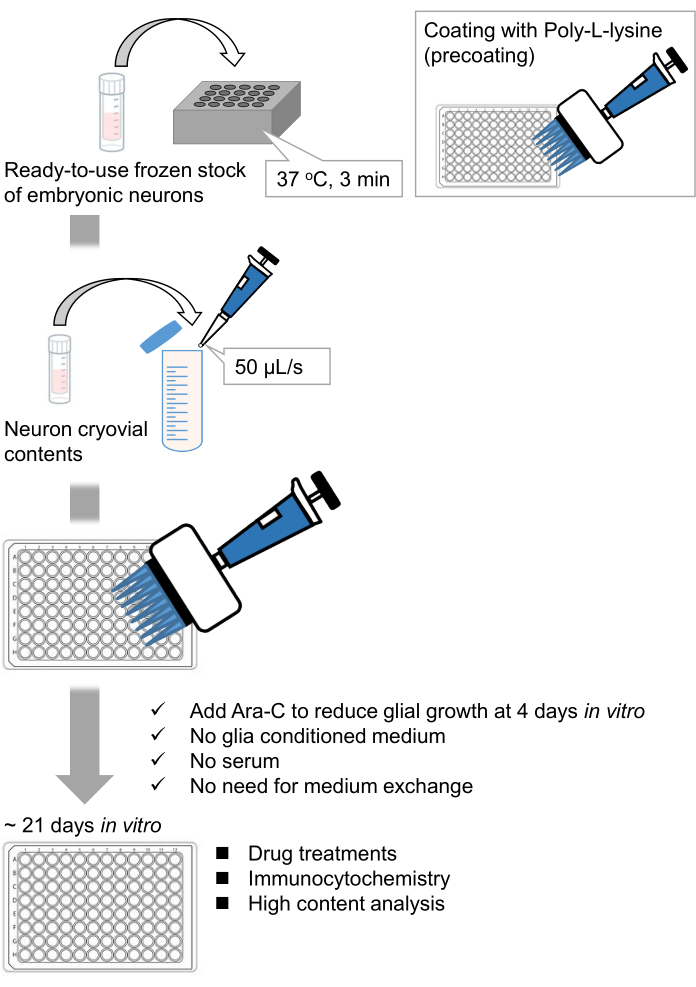
Şekil 1: Yöntemin şeması. Nöronlar 21 gün boyunca 96 kuyucuklu bir plakada kültürlendi ve daha sonra glutamat ile tedavi edildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
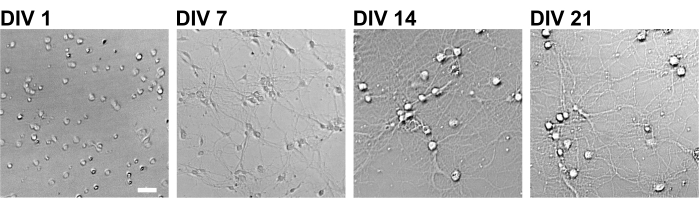
Şekil 2: 96 kuyucuklu bir plaka kullanan kültürlenmiş nöronların parlak alan görüntüleri. Faz kontrast görüntüleri her gelişimsel aşamadan (DIV 1, 7, 14, 21) konfokal kantitatif görüntü sitometresi kullanılarak elde edildi. Ölçek çubuğu: 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
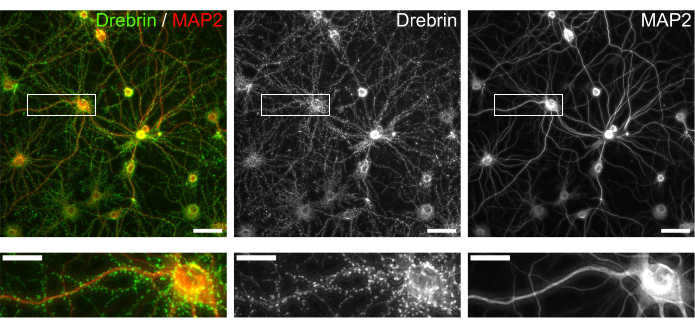
Şekil 3: İmmün boyalı kültürlü nöronların temsili görüntüleri. (Solda) Drebrin (yeşil) ve MAP2'nin (kırmızı) birleştirilmiş floresan görüntüleri. Drebrin ve MAP2'nin her floresan görüntüsü sırasıyla orta ve sağ panellerde gösterildi. Beyaz dikdörtgenler aşağıda büyütülmüş alanı gösterir. Ölçek çubukları; üst paneller: 50 μm, alt paneller: 20 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
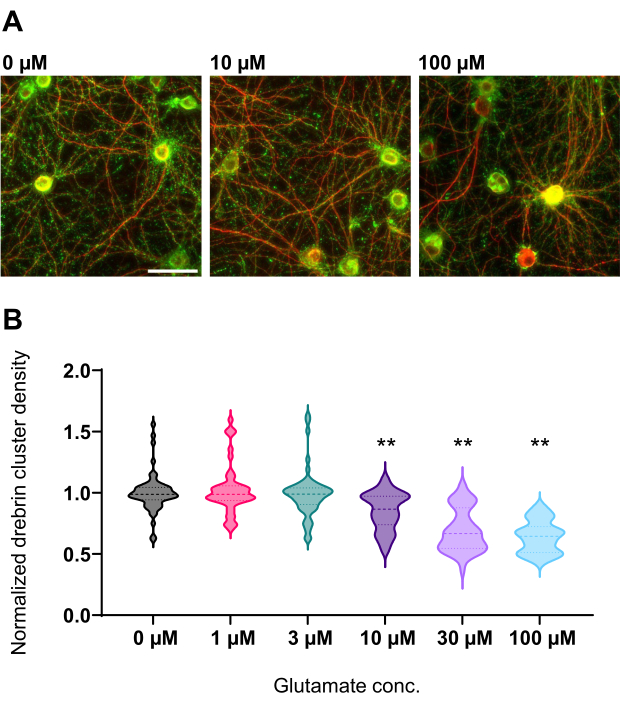
Şekil 4: Normalize drebrin kümesi yoğunluğunda glutamat bağımlı doz-yanıt değişiklikleri. (A) 0 μM, 10 μM ve 100 μM glutamat (soldan sağa) ile tedavi edilen kuyudan drebrin (yeşil) ve MAP2 (kırmızı) kullanılarak immünoboyalı temsili floresan görüntüleri. Ölçek çubuğu: 50 μm. (B) Drebrin kümesi yoğunluğu, kontrol ortalaması (0 μM) ile normalleştirildi. 0 μM, N = 58 kuyu; 1 μM, N = 46; 3 μM, N = 54; 10 μM, N = 45; 30 μM, N = 54; 100 μM, N = 55, farklı lotlar kullanan 13 deneyden. ** Dunnett'in ANOVA'yı takiben yaptığı çoklu karşılaştırma testi ile P < 0.01'e karşı kontrol (0 μM). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
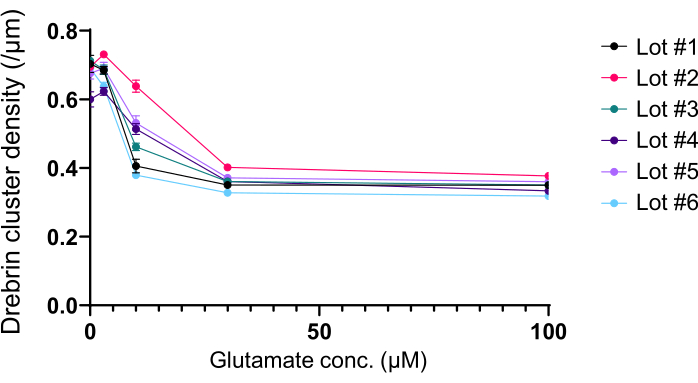
Şekil 5: Drebrin kümesi yoğunluğunda glutamat bağımlı doz-yanıt değişiklikleri. Farklı lotlar kullanan altı deneyden elde edilen ham veriler. N = her konsantrasyon için 4 kuyucuk (0 μM, 3 μM, 10 μM, 30 μM ve 100 μM). Değerler SEM ± ortalama olarak ifade edilir.

Şekil 6: Dondurulmuş nöron stoklarının elektrofizyolojik deneylere uygulanması . (A) Mikroelektrot dizisi (MEA) plakalarını kullanan elektrofizyolojik deneyler için bir protokol. Kaplama: Hücrelerin kaplanmasından bir gün önce, her 48 delikli MEA plakası bir polietilenimin (PEI: % 0.1) çözeltisi ile önceden kaplandı ve 37 ° C'de 1 saat boyunca inkübe edildi. MEA plakası daha sonra sterilize su ile 3x yıkandı ve 1 saat kurutuldu. Daha sonra, MEA plakası gece boyunca 4 ° C'de tutuldu. Yüksek yoğunluklu kültür: Nöronların 50.000 hücresi / kuyusu 48 kuyucuklu MEA plakalarına kaplandı. Hücre tohumlama adımı, yukarıda açıklanan protokolün 2. bölümünde açıklandığı gibi gerçekleştirilmiştir. Nöronları plakalamak için laminin (20 μg / mL) eklenen kültür ortamı (nörobazal ortama 2 v / v% B-27, 2.5 mM Glutamask ve 100 μg / mL penisilin / streptomisin ekleyin) kullanıldı. Bundan sonra, nöronlar kültür ortamında 37 ° C'de,% 5 CO2'de kültürlendi. Medya, DIV 1'de DIV 3'e kadar kültür ortamıyla tamamen değiştirildi. Ara-C, DIV 4'te (son 0,2 μM) eklendi. DIV 5'ten itibaren ve haftada 2 kez, medyanın% 50'si kültür ortamı ile değiştirildi. MEA plakasının her bir kuyucuğundaki nöronların aktivitesi bir MEA sistemi ile kaydedildi. (B) Spontan nöronal aktivite, DIV21'de 12.5 kHz/kanal örnekleme hızında bir MEA sistemi kullanılarak %5'lik bir CO 2 atmosferi altında 37 °C'de elde edilmiştir. Bir kuyu içindeki 16 kanaldan 4 kanaldan gelen kayıtlar gösterilir. Tüm kayıtlar için bir Butterworth band-pass filtresi (200-3.000 Hz) uygulandı. Ok uçları, senkronize patlama ateşlemesinin zamanlamasını gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu yöntemdeki kritik bir adım, hücre süspansiyonunu çözmektir. Hücre süspansiyonunun çok ısınmadan önce aktarılması çok önemlidir. Bununla birlikte, ozmolalitenin hızlı değişimini önlemek için, hücre süspansiyonunu bir kerede ortamın büyük bir hacmine aktarmayın. Kültür ortamının damla bazında eklenmesi, ozmotik basınçtaki ani değişiklikleri önlemek için de çok önemlidir.
Nöronlar diğer kültür damarlarında kültürlenebilir: 24 delikli plakalar, 8 delikli odalar, 60 mm'lik tabaklar veya MED probları. Bununla birlikte, bu gibi durumlarda, Ara-C'nin eklenmesinin nihai konsantrasyonu ve zamanlamasının ayarlanması gerekir. Ek olarak, nöronların yoğunluğunun farklı deney türlerinde optimize edilmesi gerekir. Örneğin, elektrofizyolojik deneyler için yüksek yoğunluklu kültür gereklidir ve bu durumda, haftada iki kez medya değişimine ihtiyaç duyulur (Şekil 6). Bu nedenle, düşük yoğunluklu bir kültür, yüksek yoğunluklu bir kültürden daha az adım gerektirir.
Düşük yoğunluklu nöronal kültür genellikle ileri teknikler gerektirir; ancak kullanıma hazır dondurulmuş stok kullanımı bu sorunu çözer. Açıklanan yöntem, bir deneycinin becerisine bağlı değildir. Dondurulmuş stokların kalitesi sabittir ve sıvı azotta depolandıkları ve 4 yıla kadar sıcaklık değişimlerinden kaçındıkları sürece istikrarlı bir şekilde kültürlenebilir.
Hücrelerin orta değişim olmadan 3 hafta boyunca kültürlenmesi, önemli ozmolalite değişiklikleri veya kültür ortamı buharlaşması olup olmadığı sorusunu gündeme getirmektedir. Bununla birlikte, kültür ortamı buharlaşmasının küçük olduğunu doğruladık (% 3.6'lık azalma oranı). Sinaptik proteinlerin lokalizasyonu ve nöronların morfolojisi 3 hafta sonra normal görünür. Bu nedenle, medya değişimi olmadan 3 haftalık kültür, kültürlenmiş nöronların koşullarını etkileyen büyük ozmolalite değişikliklerine neden olmaz. Ara-C işleminden sonra plakanın bir inkübatörde tutulması da buharlaşmayı en aza indiren önemli bir noktadır.
Dondurulmuş stok nöronlarının kullanımı ile ilgili herhangi bir sınırlama yoktur. Bununla birlikte, düşük yoğunluklu kültür yönteminin bazı sınırlamaları vardır. Düşük yoğunluklu kültürün nöronların morfolojik gözlemi, sinaptik fonksiyonun değerlendirilmesi ve GFP transfeksiyonu için uygulanabileceğini doğruladık. Bununla birlikte, canlı hücre görüntülemeyi incelemedik. Ek olarak, yukarıda belirtildiği gibi, elektrofizyolojiyi gerçekleştirmek için yüksek yoğunluklu kültür gereklidir.
Sinaps olgunlaşması tipik olarak 3 haftasürer 7 ve kültürlenmiş nöronların sonuna kadar uygun sinapslara sahip olduğunu doğrulayamayız. Sinaps olgunlaşması 3 hafta sonra iyi olmazsa, tekrar kültüre ihtiyacımız olur. Deneylere başlamadan önce nöronların kalitesini bilerek, bu 3 haftayı kurtarabiliriz. Bu nedenle, deneyleri verimli bir şekilde gerçekleştirmek için, nöronların kalitesini önceden kontrol etmek en iyisidir. Dondurulmuş stoklar, nöronların kalitesini önceden kontrol etmeyi mümkün kılar. Dondurulmuş stokların her bir partisi bir sıçan çöpünden üretilir ve kalite kontrolü için her partideki stoklardan birini kullanabiliriz. Drebrin, nöronların kalite kontrolü için iyi bir belirteçtir. Tarif edildiği gibi, drebrin olgun nöronlarda omurga kafasında birikir ve sinaptik stimülasyona tepki verir. Böylece, dondurulmuş stoklardaki nöronların kalitesini, drebrin'i bir belirteç olarak kullanarak kontrol edebiliriz.
Bu yöntem, ilaçların sinaptik durum üzerindeki etkisini değerlendirmek için uygulanabilir. Dendritik dikenlerden drebrin göçü, sinaptik plastisitenin ilk aşamalarında meydana gelir22. Bu nedenle, ilaç tedavisi ile ortaya çıkan drebrin kümesi azalmasının tespiti, ilacın sinapsı uyardığını ve sinaptik plastisiteye neden olduğunu göstermektedir. Ayrıca, indirgemenin NMDAR'a bağımlı olup olmadığını belirlemek için, 2-amino-5-fosfonovalerik asit (APV, bir NMDAR antagonisti) kullanan bir deney yararlıdır. Drebrin'i bir belirteç olarak kullanarak, bir NMDAR bağımlılığı bile açıkçabelirlenir 10,15. Açıklanan yöntem ilaç taramalarında, güvenlik farmakolojik çalışmalarında ve sinaptik fonksiyonun değerlendirilmesinde yararlıdır.
Açıklamalar
Tomoaki Shirao, AlzMed, Inc.'in CEO'sudur. Çalışma AlzMed, Inc. ("Sinaptik fonksiyonun yüksek verimli analizi" başlıklı proje için NK'ye 500.000 JPY) tarafından finanse edildi.
Teşekkürler
Kazumi Kamiyama ve Manami Kawada'ya deneylerdeki yardımları için teşekkür ederiz. Bu çalışma JSPS KAKENHI (Hibe Numarası 19K08010 - N.K.) ve Japonya Tıbbi Araştırma ve Geliştirme Ajansı (AMED) (Hibe Numarası JP19bk0104077 ve JP22bm0804024 - T.S.) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96 well plate | Zeon Corporation | Gifted | |
| 96 well plate | greiner | 655986 | |
| Anti-drebrin antibody (M2F6) | MBL | D029-3 | Mouse monoclonal (dilution 1:1) |
| Anti-MAP2 antibody | Millipore | AB5622 | Rabbit (dilution 1:1000) |
| Anti-mouse Alexa Fluor 568 | Thermo Fisher Scientific | A11031 | Dilution 1: 500 |
| Anti-rabbit Alexa Fluor | Thermo Fisher Scientific | A11008 | Dilution 1: 500 |
| B-27 | Gibco | 17504-044 | 2 v/v% for MEA plates; 50x for normal plates |
| Borax | Sigma | B-9876 | Final concentration 12 mM |
| Boric acid | WAKO | 021-02195 | Final concentration 50 mM |
| Bovine serum albumin | Millipore | 12659-100G | Final concentration: 3% in PBS |
| Confocal quantitative image cytometer CellVoyager CQ1 | YOKOGAWA | Phase contrast images | |
| Cytosine β-D-arabino-furanoside (Ara-C) | Sigma | C-6645 | Diluted in dH2O (final concentration: 0.2 µM) |
| DAPI | FUJIFILM | 340-07971 | Dilution 1:1000 |
| GlutaMAX | Gibco | 35050-061 | 2.5 mM for MEA plates; 400x for normal plates |
| In Cell Analyzer 2200 | Cytiva | Fluorescence images | |
| Laminin | Sigma | 114956-81-9 | Final concentration: 20 µg/mL |
| Maestro | Axion Biosystems | MEA recordings | |
| MEA plate | Axion Biosystems | M768-tMEA-48W | |
| Neurobasal | Gibco | 21103-049 | |
| Paraformaldehyde | nacalai tesque | 26126-25 | Final concentration: 4% in PBS |
| Penicillin/Streptomycin | Gibco | 15140-122 | 100 U/mL for normal plates |
| Penicillin/Streptomycin | nacalai tesque | 26253-84 | 100 µg/mL for MEA plates |
| polyethyleimine | Sigma | 9002-98-6 | Final concentration: 0.1% |
| Poly-L-lysine | Sigma | P2636 | Diluted in the borate buffer (final concentration: 1 mg/mL) |
| SKY Neuron | AlzMed , Inc. | ARH001 | 1.0 x 106 cells/tube |
| Sodium azide | FUJIFILM | 195-11092 | 0.1% |
| SodiumL(+)-Glutamate monohydrate | WAKO | 194-02032 | Diluted in dH2O (final concentrations: 1 µM, 3 µM, 10 µM, 30 µM, 100 µM) |
Referanslar
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126 (3), 397-342 (1977).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Roppongi, R. T., Champagne-Jorgensen, K. P., Siddiqui, T. J. Low-density primary hippocampal neuron culture. Journal of Visualized Experiments. (122), e55000 (2017).
- Mizui, T., et al. Drebrin E is involved in the regulation of axonal growth through actin-myosin interactions. Journal of Neurochemistry. 109 (2), 611-622 (2009).
- Mizui, T., et al. Myosin II ATPase activity mediates the long-term potentiation-induced exodus of stable F-actin bound by drebrin A from dendritic spines. PLoS One. 9 (1), 85367 (2014).
- Takahashi, H., Mizui, T., Shirao, T. Down-regulation of drebrin A expression suppresses synaptic targeting of NMDA receptors in developing hippocampal neurons. Journal of Neurochemistry. 97, 110-115 (2006).
- Takahashi, H., et al. Drebrin-dependent actin clustering in dendritic filopodia governs synaptic targeting of postsynaptic density-95 and dendritic spine morphogenesis. The Journal of Neuroscience. 23 (16), 6586-6595 (2003).
- Yamazaki, H., Sasagawa, Y., Yamamoto, H., Bito, H., Shirao, T. CaMKIIbeta is localized in dendritic spines as both drebrin-dependent and drebrin-independent pools. Journal of Neurochemistry. 146 (2), 145-159 (2018).
- Hanamura, K., et al. High-content imaging analysis for detecting the loss of drebrin clusters along dendrites in cultured hippocampal neurons. Journal of Pharmacological and Toxicological Methods. 99, 106607 (2019).
- Mitsuoka, T., et al. Assessment of NMDA receptor inhibition of phencyclidine analogues using a high-throughput drebrin immunocytochemical assay. Journal of Pharmacological and Toxicological Methods. 99, 106583 (2019).
- Ishizuka, Y., Bramham, C. R. A simple DMSO-based method for cryopreservation of primary hippocampal and cortical neurons. Journal of Neuroscience Methods. 333, 108578 (2020).
- Pischedda, F., et al. Cryopreservation of primary mouse neurons: The benefit of neurostore cryoprotective medium. Frontiers in Cellular Neuroscience. 12, 81 (2018).
- Kobayashi, Y., et al. Impairment of ciliary dynamics in an APP knock-in mouse model of Alzheimer's disease. Biochemical and Biophysical Research Communications. 610, 85-91 (2022).
- Kobayashi, Y., et al. Properties of primary cilia in melanin-concentrating hormone receptor 1-bearing hippocampal neurons in vivo and in vitro. Neurochemistry International. 142, 104902 (2021).
- Koganezawa, N., et al. NMDA receptor-dependent and -independent effects of natural compounds and crude drugs on synaptic states as revealed by drebrin imaging analysis. The European Journal of Neuroscience. 53 (11), 3548-3560 (2021).
- Mizui, T., Takahashi, H., Sekino, Y., Shirao, T. Overexpression of drebrin A in immature neurons induces the accumulation of F-actin and PSD-95 into dendritic filopodia, and the formation of large abnormal protrusions. Molecular and Cellular Neurosciences. 30 (1), 149-157 (2005).
- Sekino, Y., et al. Activation of N-methyl-D-aspartate receptor induces a shift of drebrin distribution: disappearance from dendritic spines and appearance in dendritic shafts. Molecular and Cellular Neurosciences. 31 (3), 493-504 (2006).
- Takahashi, H., Yamazaki, H., Hanamura, K., Sekino, Y., Shirao, T. Activity of the AMPA receptor regulates drebrin stabilization in dendritic spine morphogenesis. Journal of Cell Science. 122, 1211-1219 (2009).
- Aoki, C., et al. Drebrin A is a postsynaptic protein that localizes in vivo to the submembranous surface of dendritic sites forming excitatory synapses. The Journal of Comparative Neurology. 483 (4), 383-402 (2005).
- Koganezawa, N., Hanamura, K., Sekino, Y., Shirao, T. The role of drebrin in dendritic spines. Molecular and Cellular Neurosciences. 84, 85-92 (2017).
- Shirao, T., et al. The role of drebrin in neurons. Journal of Neurochemistry. 141 (6), 819-834 (2017).
- Sekino, Y., Koganezawa, N., Mizui, T., Shirao, T. Role of drebrin in synaptic plasticity. Advances in Experimental Medicine and Biology. 1006, 183-201 (2017).
- Togo, K., et al. Postsynaptic structure formation of human iPS cell-derived neurons takes longer than presynaptic formation during neural differentiation in vitro. Molecular Brain. 14 (1), 149 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır