Method Article
Cultura Primária de Baixa Densidade Fácil e Reprodutível usando Estoque Congelado de Neurônios Embrionários do Hipocampo
Neste Artigo
Resumo
Um estoque congelado pronto para uso de neurônios é uma ferramenta poderosa para avaliar as funções sinápticas. Aqui, apresentamos uma cultura primária fácil de baixa densidade a partir de estoque congelado usando uma placa de 96 poços.
Resumo
A cultura neuronal é um sistema valioso para avaliar as funções sinápticas e os exames de drogas. Em particular, uma cultura de baixa densidade de neurônios primários do hipocampo permite o estudo de neurônios individuais ou componentes subcelulares. Mostramos a localização de proteínas subcelulares dentro de um neurônio por imunocitoquímica, polaridade neuronal, morfologia sináptica e sua mudança de desenvolvimento usando uma cultura hipocampal primária de baixa densidade. Recentemente, estoques congelados prontos para uso de neurônios tornaram-se comercialmente disponíveis. Esses estoques congelados de neurônios reduzem o tempo necessário para preparar experimentos com animais e também contribuem para a redução do número de animais usados. Aqui, apresentamos um método de cultura primária de baixa densidade reprodutível usando uma placa de 96 poços. Usamos um estoque congelado comercialmente disponível de neurônios do hipocampo embrionário de ratos. Os neurônios podem ser cultivados de forma estável a longo prazo, sem alterações na mídia, reduzindo o crescimento de células gliais em determinados pontos de tempo. Este ensaio de alto rendimento usando cultura de baixa densidade permite avaliações reprodutíveis baseadas em imagens da plasticidade sináptica.
Introdução
O desenvolvimento de um sistema experimental in vitro que possa avaliar as funções sinápticas envolvidas na aprendizagem e na memória é importante. A cultura neuronal é um sistema valioso para avaliar as funções sinápticas in vitro. A técnica de cultura neuronal foi utilizada pela primeira vez na década de 1980 e, na década de 1990, desenvolveu-se a cultura de baixa densidade de neurônios primários do hipocampo 1,2,3 para o estudo de neurônios individuais em termos de localização subcelular de componentes proteicos, tráfico de proteínas, polaridade neuronal, morfologia da coluna, desenvolvimento de sinapses e plasticidade 4,5,6,7,8 . No entanto, existem muitas etapas envolvidas nesta técnica: acasalamento de animais, dissecação de embriões, preparação de vasos de cultura e cultura de células por 3 semanas com alterações de mídia uma vez por semana. Além disso, requer técnicas avançadas3.
Desenvolvemos estoques congelados de neurônios hipocampais dissociados de embriões de ratos 9,10. Os estoques congelados de neurônios estão prontos para uso, e não são necessárias técnicas avançadas para a cultura das células11,12. Em outras palavras, a cultura dos neurônios a partir de estoques congelados não depende da técnica de um experimentador. Ele elimina a necessidade de experimentos em animais (por exemplo, permissão para experimentos com animais, organização de animais prenhes cronometrados e dissecação de embriões de ratos), reduzindo assim o número de animais usados. Recentemente, estoques congelados de neurônios de alta qualidade e prontos para uso tornaram-se comercialmente disponíveis. Aqui, foram utilizados estoques congelados comercialmente disponíveis do hipocampo embrionário do dia (E) 18 de rato13,14,15. A cultura dos neurônios de um estoque congelado não requer meios condicionados pela glia ou co-cultura com células gliais. Meios de cultura primários comuns sem soro adicional podem ser usados para cultivar as células; portanto, podemos adquirir dados reprodutíveis. Além disso, não há necessidade de troca de meios por 3 semanas após a semeadura celular, pois o crescimento de células gliais é reduzido (Figura 1).
Os espinhos dendríticos são o compartimento pós-sináptico da maioria das sinapses excitatórias. Eles contêm proteínas receptoras, proteínas de andaime pós-sináptico e proteínas citoesqueléticas de actina. Focalizamos uma proteína dretrina ligadora de actina 5,6,7,16,17,18. A drebrina se acumula na cabeça da coluna vertebral em neurônios maduros19, e relatamos a drebrina como marcador do estado sináptico 15,17,20,21,22,23. Ao realizar uma análise de alto conteúdo usando dretrina como leitura, relatamos recentemente os efeitos inibitórios de análogos de fenciclidina em receptores de glutamato do tipo ácido N-metil-D-aspártico (NMDARs)10 e os efeitos dependentes de NMDAR de compostos naturais e drogas brutas em estados sinápticos15.
Aqui, detalhamos como cultivar estoques congelados de neurônios em baixa densidade. Além disso, mostramos uma avaliação baseada em imagens de drebrin do estado sináptico usando placas de 96 poços.
Protocolo
1. Revestimento da placa
- Revestir uma microplaca de 96 poços com poli-L-lisina (1 mg/mL, diluída em tampão de borato 0,1 M [pH: 8,5]; 100 μL/poço) e incubar durante a noite a 37 °C.
NOTA: Revestir apenas os poços que precisam ser usados. Nos experimentos aqui realizados, são utilizados os 60 poços médios. O tampão de borato é preparado misturando ácido bórico 50 mM e borato 12 mM em água esterilizada. - Lave a placa duas vezes com água esterilizada (250 μL/poço).
- Lave o prato uma vez com meio de cultura fresco sem suplementos (250 μL/poço).
- Seque o prato em uma bancada limpa por 20 min.
- Envolva o prato com papel alumínio e mantenha-o a 4 °C até o uso (válido por 1 mês).
2. Semeadura de células
- Adicionar 50 μL/poço do meio de cultura à placa revestida e mantê-lo em uma incubadora de 37 °C, 5% de CO2 por 30 min a 1 h. Encha os poços periféricos com água esterilizada (200 μL/poço).
NOTA: O meio de cultura é preparado adicionando 50x B-27, 400x Glutamax e 100 U/mL de penicilina/estreptomicina ao meio neurobasal (consulte a Tabela de Materiais para obter detalhes). - Remova o neurônio criovial do tanque de nitrogênio líquido. Os neurônios aqui utilizados foram neurônios criopreservados por DMSO11.
- Imergir o criovial num bloco de calor de 37 °C até 3 min e descongelar parcialmente o conteúdo. Não aqueça o criovial por muito tempo. Transfira o conteúdo para um tubo de 50 mL assim que for descongelado.
- Transfira lentamente o conteúdo criovial do neurônio para um tubo estéril de 50 mL em sentido gota (50 μL/s) usando uma pipeta de 1 mL com uma ponta de poros largos.
- Enxaguar o criovial vazio com 1 mL do meio de cultura (temperatura ambiente; RT). Transfira este 1 mL do meio de cultura do criovial drop-wise (50 μL/s) para o tubo de 50 mL contendo a suspensão celular.
- Adicionar 9 mL do meio de cultura (RT) ao tubo de 50 mL gota a gota (0,5 mL/s) e compor o volume até 11 mL. Não repita a pipetagem, mas misture a suspensão celular lentamente.
- Conte o número da célula (use um contador de células ou um hemocitômetro).
- Transfira toda a suspensão celular para um reservatório e dispense a suspensão celular para a placa de 96 poços usando uma pipeta multicanal com pontas de poros largos (1,0 x 104 células/poço). Para reduzir a evaporação do meio de cultura, encher os poços periféricos com água esterilizada (etapa 2.1).
NOTA: Este estudo confirma que a evaporação do meio de cultura é pequena para uma cultura de 3 semanas sem troca média. A taxa de redução do meio é de 3,6% (n = 120 poços). Assim, a alteração da osmolalidade não será drástica durante o período de incubação de 3 semanas. - Incubar os neurônios por 1-2 h em uma incubadora de 37 °C, 5% de CO2 .
- Substitua o meio de cultura por 100 μL de meio de cultura pré-aquecido (37 °C) por poço e coloque-o novamente em uma incubadora de 37 °C, 5% de CO2 (nenhuma mudança de meio é necessária durante a cultura).
3. Tratamento Ara-C
- Aos 4 dias in vitro (DIV), adicione citosina β-D-arabino-furanoside (Ara-C) a uma concentração final de 0,2 μM por poço para reduzir o crescimento de células gliais.
4. Tratamentos medicamentosos
- Aos 21 dias in vitro, trate as células com as drogas de interesse.
- Manter a temperatura da placa a 37 °C durante os tratamentos medicamentosos.
- Para um controle positivo, trate as células com glutamato de 100 μM (por poço para concentração final) por 10 min antes da fixação.
5. Fixação
- Para a fixação, utilizar paraformaldeído a 4% em tampão fosfato 0,1 M (100 μL/poço).
- Após ~20 min de fixação, lave os poços com solução salina tamponada com fosfato (PBS; 250 μL/poço) 2x por 5 min cada.
6. Imunocitoquímica
- Lave as células com PBS (250 μL/poço) 1x por 5 min.
- Permeabilizar as células com Triton X-100 a 0,1% (100 μL/poço) em PBS por 5 min.
- Lave as células com PBS (250 μL/poço) 3x por 5 min cada.
- Para o bloqueio, use albumina sérica bovina a 3% em PBS (PBSA; 100 μL/poço) por 1 h no TR.
- Incubar as células com anticorpos anti-drepina (1:1) e anti-Microtubule Associated Protein 2 (MAP2) (1:000) (60 μL/poço) a 4 °C durante a noite.
- Lave as células com PBS (250 μL/poço) 4x por 5 min cada.
- Incubar as células com anticorpos secundários apropriados e 4′,6-diamidino-2-fenilindol, dicloridrato (DAPI; 1:1000) em PBSA (60 μL/poço) por 2 h no RT.
- Lave as células com PBS (250 μL/poço) 4x por 5 min cada.
- Armazenar as células em PBS contendo 0,1% de azida de sódio (150 μL/poço).
7. Aquisição e análise de imagens
- Para adquirir as imagens, use um microscópio apropriado.
- Para identificar os corpos celulares dos neurônios, use as regiões MAP2-positivas e DAPI-positivas.
- Para identificar os dendritos dos neurônios, use sinais positivos para MAP2 sem corpos celulares.
- Para identificar aglomerados de dretrina, use sinais positivos de drebrina ao longo de dendritos positivos para MAP2.
Resultados
Seguindo o protocolo, os neurônios foram cultivados em uma placa de 96 poços por 21 dias e, em seguida, tratados com glutamato (Figura 1). Os neurônios se desenvolveram normalmente sem troca do meio de cultura por 3 semanas (Figura 2). Foram tratadas as células com várias concentrações de glutamato (1 μM, 3 μM, 10 μM, 30 μM e 100 μM diluídas em água esterilizada) por 10 min e fixadas nelas. A imunocitoquímica foi realizada e as imagens de fluorescência de dretrina e MAP2 foram adquiridas usando um microscópio de fluorescência automatizado com uma câmera sCMOS. Como mostrado na Figura 3, espinhos dendríticos positivos para drebrina são claramente observados ao longo dos dendritos positivos para MAP2. Demonstrou-se que a estimulação do glutamato provoca influxo de Ca2+ através do NMDAR, o que causa o êxodo de dretrina das espinhas dendríticas, resultando em uma redução das densidades do aglomerado de dretrina 5,17. Nesse sentido, observou-se a redução dose-dependente das densidades dos aglomerados de drepina frente à estimulação do glutamato10 (Figura 4). Como mostrado na Figura 5, esse método é altamente reprodutível se a drebrina for usada como marcador para estados sinápticos.
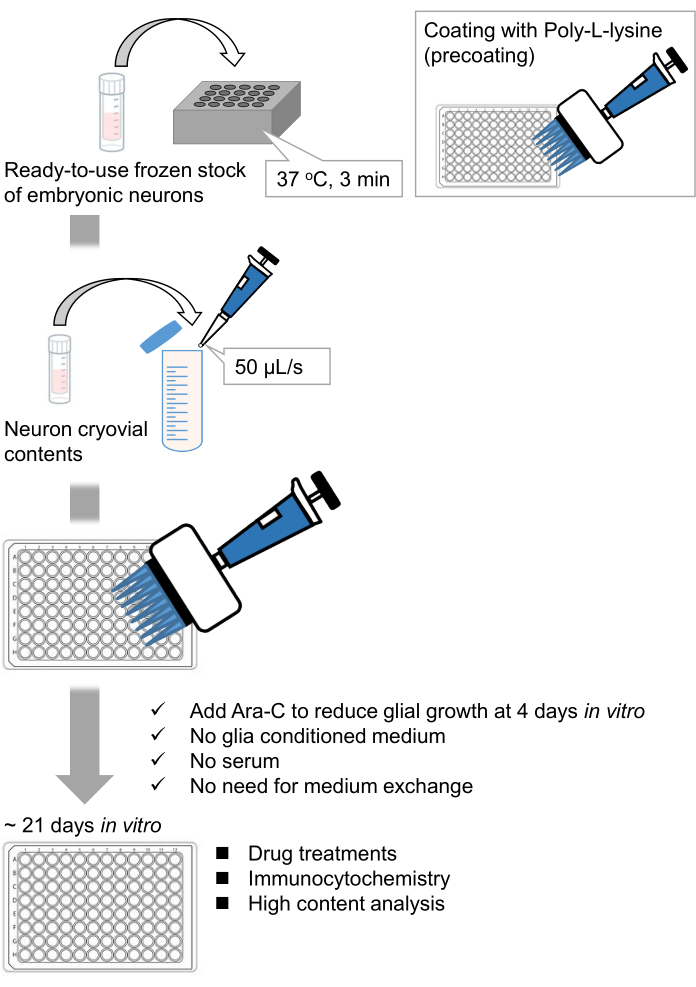
Figura 1: Esquema do método. Os neurônios foram cultivados em uma placa de 96 poços por 21 dias e, em seguida, tratados com glutamato. Por favor, clique aqui para ver uma versão maior desta figura.
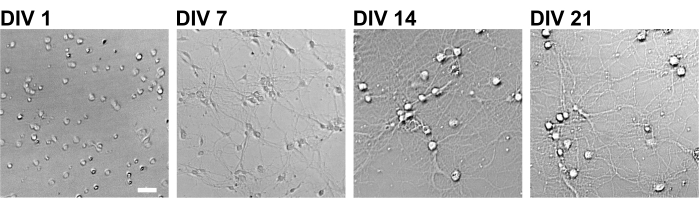
Figura 2: Imagens de campo brilhante de neurônios cultivados usando uma placa de 96 poços. As imagens de contraste de fase foram obtidas de cada estágio de desenvolvimento (DIV 1, 7, 14, 21) usando um citômetro de imagem quantitativo confocal. Barra de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
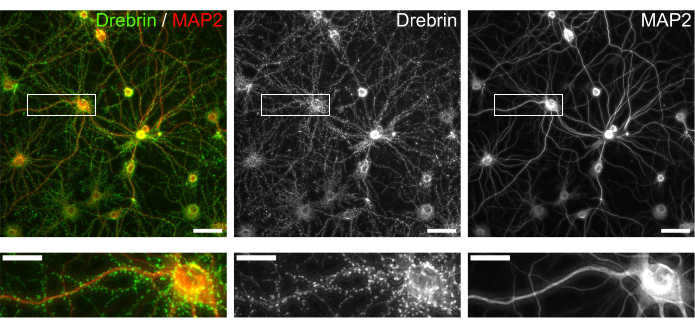
Figura 3: Imagens representativas de neurônios cultivados imunocorados. (Esquerda) Imagens de fluorescência mesclada de drebrin (verde) e MAP2 (vermelho). Cada imagem de fluorescência de drebrin e MAP2 foi apresentada nos painéis médio e direito, respectivamente. Retângulos brancos mostram a área ampliada abaixo. Barras de escala; painéis superiores: 50 μm, painéis inferiores: 20 μm. Clique aqui para ver uma versão maior desta figura.
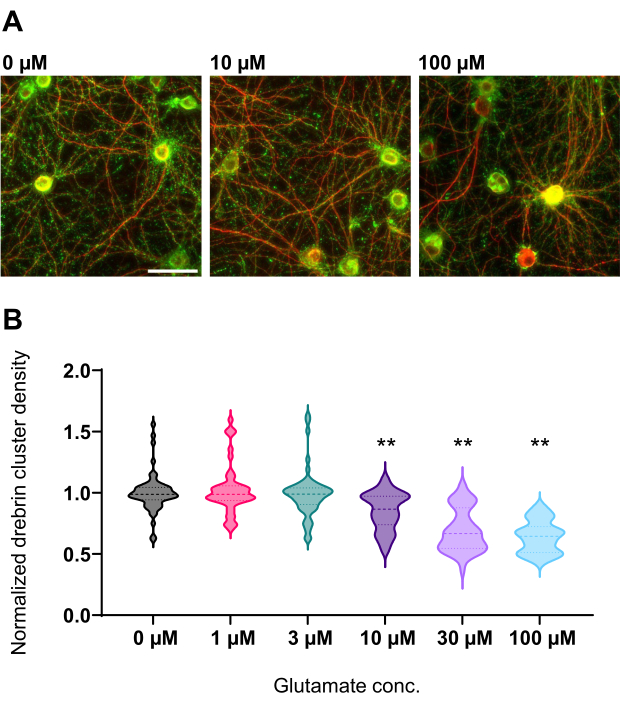
Figura 4: Alterações dose-resposta dependentes de glutamato na densidade normalizada do aglomerado de dretrina. (A) Imagens representativas de fluorescência imunocoradas usando dretrina (verde) e MAP2 (vermelho) do poço que é tratado com glutamato de 0 μM, 10 μM e 100 μM (da esquerda para a direita). Barra de escala: 50 μm. (B) A densidade do aglomerado de Drebrin foi normalizada pela média de controle (0 μM). 0 μM, N = 58 poços; 1 μM, N = 46; 3 μM, N = 54; 10 μM, N = 45; 30 μM, N = 54; 100 μM, N = 55, de 13 experimentos utilizando diferentes lotes. ** P < 0,01 versus controle (0 μM) pelo teste de comparações múltiplas de Dunnett após ANOVA. Por favor, clique aqui para ver uma versão maior desta figura.
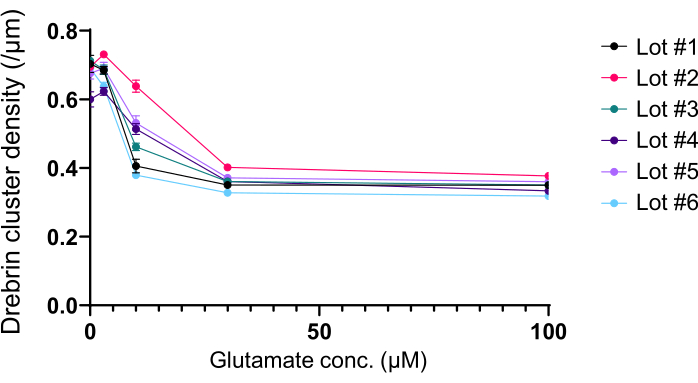
Figura 5: Alterações dose-resposta dependentes de glutamato na densidade do aglomerado de drepina. Os dados brutos de seis experimentos usando lotes diferentes. N = 4 poços para cada concentração (0 μM, 3 μM, 10 μM, 30 μM e 100 μM). Os valores são expressos como média ± SEM. Clique aqui para ver uma versão maior desta figura.

Figura 6: Aplicação dos estoques congelados de neurônios a experimentos eletrofisiológicos. (A) Um protocolo para experimentos eletrofisiológicos usando placas de matriz de microeletrodos (MEA). Revestimento: Um dia antes do revestimento das células, cada placa MEA de 48 poços foi pré-revestida com uma solução de polietilenoimina (PEI: 0,1%) e incubada por 1 h a 37 °C. A placa MEA foi então lavada 3x com água esterilizada e seca por 1 h. Em seguida, a placa MEA foi mantida a 4 °C durante a noite. Cultura de alta densidade: 50.000 células/poço dos neurônios foram banhados em placas MEA de 48 poços. A etapa de semeadura celular foi realizada conforme descrito na seção 2 do protocolo acima descrito. Laminina (20 μg/mL) adicionado meio de cultura (adicionar 2 v/v% B-27, 2,5 mM Glutamax e 100 μg/mL de penicilina/estreptomicina ao meio neurobasal) foi utilizado para plaquear os neurônios. Posteriormente, os neurônios foram cultivados a 37 °C, 5% de CO2 no meio de cultura. A mídia foi totalmente trocada na DIV 1 com o meio de cultura até a DIV 3. Ara-C foi adicionado na DIV 4 (0,2 μM final). Da DIV 5 em diante e 2 vezes por semana, 50% da mídia foi alterada com o meio de cultura. A atividade dos neurônios em cada poço da placa MEA foi registrada com um sistema MEA. (B) A atividade neuronal espontânea foi adquirida a 37 °C sob uma atmosfera de CO2 a 5% usando um sistema MEA a uma taxa de amostragem de 12,5 kHz/canal na DIV 21. Gravações de 4 canais dos 16 canais dentro de um poço são mostradas. Para todas as gravações, um filtro passa-banda Butterworth (200-3.000 Hz) foi aplicado. As pontas de seta mostram o tempo de disparo sincronizado da explosão. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Um passo crítico neste método é descongelar a suspensão celular. A transferência da suspensão celular antes que ela se torne muito quente é muito importante. Para evitar a rápida mudança da osmolalidade, no entanto, não transfira a suspensão celular para um grande volume do meio de uma só vez. A adição gota a gota do meio de cultura também é crucial para evitar mudanças bruscas na pressão osmótica.
Os neurônios podem ser cultivados em outros vasos de cultura: placas de 24 poços, câmaras de 8 poços, placas de 60 mm ou sondas MED. Nesses casos, no entanto, a concentração final e o momento da adição de Ara-C precisam ser ajustados. Além disso, a densidade dos neurônios precisa ser otimizada em diferentes tipos de experimentos. Por exemplo, a cultura de alta densidade é necessária para experimentos eletrofisiológicos e, nesse caso, a troca de meios é necessária duas vezes por semana (Figura 6). Assim, uma cultura de baixa densidade requer menos etapas do que uma cultura de alta densidade.
A cultura neuronal de baixa densidade geralmente requer técnicas avançadas; no entanto, o uso de estoque congelado pronto para uso resolve esse problema. O método descrito não depende da habilidade de um experimentador. A qualidade do estoque congelado é estável e pode ser cultivada de forma estável, desde que sejam armazenados em nitrogênio líquido e evitem mudanças de temperatura por até 4 anos.
A cultura das células por 3 semanas sem troca de meio levanta a questão sobre se há mudanças significativas na osmolalidade ou evaporação do meio de cultura. No entanto, confirmamos que a evaporação do meio de cultura é pequena (taxa de redução de 3,6%). A localização das proteínas sinápticas e a morfologia dos neurônios parecem normais após 3 semanas. Portanto, a cultura de 3 semanas sem troca de mídia não causa grandes alterações de osmolalidade que afetam as condições dos neurônios cultivados. Manter a placa em uma incubadora após o tratamento com Ara-C também é um ponto importante que minimiza a evaporação.
Não há limitação quanto ao uso dos neurônios congelados. No entanto, existem algumas limitações do método de cultura de baixa densidade. Confirmamos que a cultura de baixa densidade poderia ser aplicada para observação morfológica de neurônios, avaliação da função sináptica e transfecção de GFP. No entanto, não examinamos imagens de células vivas. Além disso, como mencionado acima, a cultura de alta densidade é necessária para realizar a eletrofisiologia.
A maturação da sinapse normalmente leva 3 semanas7, e não podemos confirmar que os neurônios cultivados têm sinapses adequadas até o final. Se a maturação da sinapse não for boa após 3 semanas, teríamos que cultivar novamente. Conhecendo a qualidade dos neurônios antes de iniciar os experimentos, podemos salvar essas 3 semanas. Portanto, para realizar experimentos de forma eficiente, é melhor verificar a qualidade dos neurônios com antecedência. Os estoques congelados permitem verificar a qualidade dos neurônios de antemão. Cada lote de estoques congelados é gerado a partir de uma ninhada de ratos, e podemos usar um dos estoques de cada lote para uma verificação de qualidade. Drebrin é um bom marcador para a verificação de qualidade dos neurônios. Como descrito, a dretrina se acumula na cabeça da coluna vertebral em neurônios maduros e reage à estimulação sináptica. Assim, podemos verificar a qualidade dos neurônios em estoques congelados usando drebrin como marcador.
Este método pode ser aplicado para avaliar o efeito de drogas sobre o estado sináptico. O êxodo de drebrin dos espinhos dendríticos ocorre durante os estágios iniciais da plasticidade sináptica22. Portanto, a detecção da redução do cluster de drebrin provocada pelo tratamento medicamentoso mostra que a droga estimula a sinapse e causa plasticidade sináptica. Além disso, para identificar se a redução é dependente do NMDAR, um experimento usando ácido 2-amino-5-fosfonovalérico (APV, um antagonista do NMDAR) é útil. Usando a dretrina como marcador, mesmo uma dependência NMDAR é claramente determinada10,15. O método descrito é útil em exames de medicamentos, estudos farmacológicos de segurança e avaliação da função sináptica.
Divulgações
Tomoaki Shirao é o CEO da AlzMed, Inc. O estudo foi financiado pela AlzMed, Inc. (500.000 JPY para NK para o projeto intitulado "Análise de alto rendimento da função sináptica").
Agradecimentos
Agradecemos a Kazumi Kamiyama e Manami Kawada pela assistência com os experimentos. Este trabalho foi apoiado pela JSPS KAKENHI (Grant Number 19K08010 to N.K.) e pela Japan Agency for Medical Research and Development (AMED) (Grant Number JP19bk0104077 e JP22bm0804024 to T.S.).
Materiais
| Name | Company | Catalog Number | Comments |
| 96 well plate | Zeon Corporation | Gifted | |
| 96 well plate | greiner | 655986 | |
| Anti-drebrin antibody (M2F6) | MBL | D029-3 | Mouse monoclonal (dilution 1:1) |
| Anti-MAP2 antibody | Millipore | AB5622 | Rabbit (dilution 1:1000) |
| Anti-mouse Alexa Fluor 568 | Thermo Fisher Scientific | A11031 | Dilution 1: 500 |
| Anti-rabbit Alexa Fluor | Thermo Fisher Scientific | A11008 | Dilution 1: 500 |
| B-27 | Gibco | 17504-044 | 2 v/v% for MEA plates; 50x for normal plates |
| Borax | Sigma | B-9876 | Final concentration 12 mM |
| Boric acid | WAKO | 021-02195 | Final concentration 50 mM |
| Bovine serum albumin | Millipore | 12659-100G | Final concentration: 3% in PBS |
| Confocal quantitative image cytometer CellVoyager CQ1 | YOKOGAWA | Phase contrast images | |
| Cytosine β-D-arabino-furanoside (Ara-C) | Sigma | C-6645 | Diluted in dH2O (final concentration: 0.2 µM) |
| DAPI | FUJIFILM | 340-07971 | Dilution 1:1000 |
| GlutaMAX | Gibco | 35050-061 | 2.5 mM for MEA plates; 400x for normal plates |
| In Cell Analyzer 2200 | Cytiva | Fluorescence images | |
| Laminin | Sigma | 114956-81-9 | Final concentration: 20 µg/mL |
| Maestro | Axion Biosystems | MEA recordings | |
| MEA plate | Axion Biosystems | M768-tMEA-48W | |
| Neurobasal | Gibco | 21103-049 | |
| Paraformaldehyde | nacalai tesque | 26126-25 | Final concentration: 4% in PBS |
| Penicillin/Streptomycin | Gibco | 15140-122 | 100 U/mL for normal plates |
| Penicillin/Streptomycin | nacalai tesque | 26253-84 | 100 µg/mL for MEA plates |
| polyethyleimine | Sigma | 9002-98-6 | Final concentration: 0.1% |
| Poly-L-lysine | Sigma | P2636 | Diluted in the borate buffer (final concentration: 1 mg/mL) |
| SKY Neuron | AlzMed , Inc. | ARH001 | 1.0 x 106 cells/tube |
| Sodium azide | FUJIFILM | 195-11092 | 0.1% |
| SodiumL(+)-Glutamate monohydrate | WAKO | 194-02032 | Diluted in dH2O (final concentrations: 1 µM, 3 µM, 10 µM, 30 µM, 100 µM) |
Referências
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126 (3), 397-342 (1977).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Roppongi, R. T., Champagne-Jorgensen, K. P., Siddiqui, T. J. Low-density primary hippocampal neuron culture. Journal of Visualized Experiments. (122), e55000(2017).
- Mizui, T., et al. Drebrin E is involved in the regulation of axonal growth through actin-myosin interactions. Journal of Neurochemistry. 109 (2), 611-622 (2009).
- Mizui, T., et al. Myosin II ATPase activity mediates the long-term potentiation-induced exodus of stable F-actin bound by drebrin A from dendritic spines. PLoS One. 9 (1), 85367(2014).
- Takahashi, H., Mizui, T., Shirao, T. Down-regulation of drebrin A expression suppresses synaptic targeting of NMDA receptors in developing hippocampal neurons. Journal of Neurochemistry. 97, 110-115 (2006).
- Takahashi, H., et al. Drebrin-dependent actin clustering in dendritic filopodia governs synaptic targeting of postsynaptic density-95 and dendritic spine morphogenesis. The Journal of Neuroscience. 23 (16), 6586-6595 (2003).
- Yamazaki, H., Sasagawa, Y., Yamamoto, H., Bito, H., Shirao, T. CaMKIIbeta is localized in dendritic spines as both drebrin-dependent and drebrin-independent pools. Journal of Neurochemistry. 146 (2), 145-159 (2018).
- Hanamura, K., et al. High-content imaging analysis for detecting the loss of drebrin clusters along dendrites in cultured hippocampal neurons. Journal of Pharmacological and Toxicological Methods. 99, 106607(2019).
- Mitsuoka, T., et al. Assessment of NMDA receptor inhibition of phencyclidine analogues using a high-throughput drebrin immunocytochemical assay. Journal of Pharmacological and Toxicological Methods. 99, 106583(2019).
- Ishizuka, Y., Bramham, C. R. A simple DMSO-based method for cryopreservation of primary hippocampal and cortical neurons. Journal of Neuroscience Methods. 333, 108578(2020).
- Pischedda, F., et al. Cryopreservation of primary mouse neurons: The benefit of neurostore cryoprotective medium. Frontiers in Cellular Neuroscience. 12, 81(2018).
- Kobayashi, Y., et al. Impairment of ciliary dynamics in an APP knock-in mouse model of Alzheimer's disease. Biochemical and Biophysical Research Communications. 610, 85-91 (2022).
- Kobayashi, Y., et al. Properties of primary cilia in melanin-concentrating hormone receptor 1-bearing hippocampal neurons in vivo and in vitro. Neurochemistry International. 142, 104902(2021).
- Koganezawa, N., et al. NMDA receptor-dependent and -independent effects of natural compounds and crude drugs on synaptic states as revealed by drebrin imaging analysis. The European Journal of Neuroscience. 53 (11), 3548-3560 (2021).
- Mizui, T., Takahashi, H., Sekino, Y., Shirao, T. Overexpression of drebrin A in immature neurons induces the accumulation of F-actin and PSD-95 into dendritic filopodia, and the formation of large abnormal protrusions. Molecular and Cellular Neurosciences. 30 (1), 149-157 (2005).
- Sekino, Y., et al. Activation of N-methyl-D-aspartate receptor induces a shift of drebrin distribution: disappearance from dendritic spines and appearance in dendritic shafts. Molecular and Cellular Neurosciences. 31 (3), 493-504 (2006).
- Takahashi, H., Yamazaki, H., Hanamura, K., Sekino, Y., Shirao, T. Activity of the AMPA receptor regulates drebrin stabilization in dendritic spine morphogenesis. Journal of Cell Science. 122, 1211-1219 (2009).
- Aoki, C., et al. Drebrin A is a postsynaptic protein that localizes in vivo to the submembranous surface of dendritic sites forming excitatory synapses. The Journal of Comparative Neurology. 483 (4), 383-402 (2005).
- Koganezawa, N., Hanamura, K., Sekino, Y., Shirao, T. The role of drebrin in dendritic spines. Molecular and Cellular Neurosciences. 84, 85-92 (2017).
- Shirao, T., et al. The role of drebrin in neurons. Journal of Neurochemistry. 141 (6), 819-834 (2017).
- Sekino, Y., Koganezawa, N., Mizui, T., Shirao, T. Role of drebrin in synaptic plasticity. Advances in Experimental Medicine and Biology. 1006, 183-201 (2017).
- Togo, K., et al. Postsynaptic structure formation of human iPS cell-derived neurons takes longer than presynaptic formation during neural differentiation in vitro. Molecular Brain. 14 (1), 149(2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados