Method Article
تحليل كمي محسن للبروتينات المرتبطة بالحمض النووي الريبي باستخدام الحمض النووي الريبي القصير البيوتينيل
In This Article
Summary
هنا ، نقدم طريقة محسنة في المختبر للكشف عن تفاعلات البروتين وتحديدها والتحقق من صحتها لتسلسلات الحمض النووي الريبي المحددة ، باستخدام مستخلص البروتين الكلي من الخلايا البشرية ، وحبات الستربتافيدين المغلفة بالحمض النووي الريبي البيوتينيل ، وتحليل قياس الطيف الكتلي.
Abstract
تنظم تفاعلات البروتين والحمض النووي الريبي التعبير الجيني والوظائف الخلوية على مستويات النسخ وما بعد النسخ. لهذا السبب ، يظل تحديد الشركاء الملزمين للحمض النووي الريبي محل الاهتمام ذا أهمية كبيرة للكشف عن الآليات الكامنة وراء العديد من العمليات الخلوية. ومع ذلك ، قد تتفاعل جزيئات الحمض النووي الريبي بشكل عابر وديناميكي مع بعض البروتينات المرتبطة بالحمض النووي الريبي (RBPs) ، خاصة مع البروتينات غير المتعارف عليها. ومن ثم، هناك حاجة ماسة إلى أساليب محسنة لعزل وتحديد هذه الممارسات التجارية التقييدية.
لتحديد شركاء البروتين لتسلسل الحمض النووي الريبي المعروف بكفاءة وكمية ، قمنا بتطوير طريقة تعتمد على سحب وتوصيف جميع البروتينات المتفاعلة ، بدءا من مستخلص البروتين الكلي الخلوي. قمنا بتحسين سحب البروتين باستخدام الحمض النووي الريبي البيوتينيل المحمل مسبقا على حبات مغلفة بالستربتافيدين. كدليل على المفهوم ، استخدمنا تسلسل RNA قصيرا معروفا بربط البروتين المرتبط بالتنكس العصبي TDP-43 والتحكم السلبي في تكوين نيوكليوتيدات مختلفة ولكن بنفس الطول. بعد سد الخرزات باستخدام الحمض النووي الريبي الخميرة ، قمنا بتحميل تسلسل الحمض النووي الريبي البيوتينيلاتي على حبات الستربتافيدين واحتضنها بمستخلص البروتين الكلي من خلايا HEK 293T. بعد الحضانة والعديد من خطوات الغسيل لإزالة المجلدات غير المحددة ، قمنا باستخلاص البروتينات المتفاعلة بمحلول عالي الملح ، متوافق مع كواشف القياس الكمي للبروتين الأكثر استخداما ومع تحضير العينة لقياس الطيف الكتلي. قمنا بقياس تخصيب TDP-43 في القائمة المنسدلة التي تم إجراؤها باستخدام رابط الحمض النووي الريبي المعروف مقارنة بالتحكم السلبي بواسطة مطياف الكتلة. استخدمنا نفس التقنية للتحقق من التفاعلات الانتقائية للبروتينات الأخرى التي تم التنبؤ حسابيا بأنها روابط فريدة للحمض النووي الريبي الذي يهمنا أو عنصر التحكم. أخيرا ، تحققنا من صحة البروتوكول عن طريق اللطخة الغربية من خلال الكشف عن TDP-43 بجسم مضاد مناسب.
سيسمح هذا البروتوكول بدراسة شركاء البروتين في الحمض النووي الريبي ذي الأهمية في الظروف القريبة من الفسيولوجية ، مما يساعد على الكشف عن تفاعلات البروتين والحمض النووي الريبي الفريدة وغير المتوقعة.
Introduction
برزت البروتينات المرتبطة بالحمض النووي الريبي (RBPs) كلاعبين حاسمين في تنظيم الجينات النسخية وما بعد النسخ ، لأنها تشارك في عمليات مثل الربط mRNA ، وتوطين خلايا الحمض النووي الريبي ، والترجمة ، والتعديل ، والتدهور1،2،3. هذه التفاعلات بين الجزيئين الكبيرين منسقة للغاية ومتوازنة بدقة وضرورية لتشكيل محاور وظيفية ومعالجة. الاختلافات أو عدم التنظيم داخل هذه المحاور لديها القدرة على تعطيل شبكات البروتين والحمض النووي الريبي المنظمة بدقة وترتبط بشكل متزايد بمجموعة متنوعة من الأمراض البشرية ، بما في ذلك السرطان 4,5 والاضطرابات التنكسية العصبية6،7،8. يمكن أن تكون التفاعلات بين جزيئات الحمض النووي الريبي وشركائها في الارتباط بالبروتين إما مستقرة وسهلة التحقق من صحتها تجريبيا ، أو ديناميكية للغاية وعابرة وأكثر صعوبة في توصيفها.
في السنوات الأخيرة ، بذلت جهود مكثفة لفهم هذه التفاعلات. من بين أكثر الطرق رسوخا ، من المحتمل أن تكون فحوصات سحب البروتين (PDs) هي الأساليب الأكثر تقديرا وشائعة الاستخدام لكشف اللاعبين الرئيسيين الذين يشكلون مجمعات البروتين النووي الريبي (RNP) وشبكات تفاعل البروتين والحمض النووي الريبي الأخرى3،9،10. تشمل PDs مظلة واسعة من التقنيات الإعلامية ، مثل الترسيب المناعي إما للحمض النووي الريبي (RIP) 11,12 أو البروتين (CLIP) 13,14 محل الاهتمام. تستخدم بعض بروتوكولات RNA-PD هذه الحمض النووي الريبي المعروف كطعم للبروتينات15 ، في أغلب الأحيان من خلال الاستفادة من علامات التقارب العالية مثل البيوتين. في هذه الحالة ، يمكن الكشف عن شركاء التفاعل للحمض النووي الريبي البيوتينيل عن طريق تثبيت الحمض النووي الريبي على حبات مغلفة بالستربتافيدين ، مما يتيح العزل الفعال ل RNPs. عادة ما تكون القيود الرئيسية لهذه الأساليب هي تصميم مجسات البيوتينيلات واختبار قدرتها على ربط البروتينات المستهدفة. لهذا الغرض ، قد يكون من المفيد الاعتماد على بيانات CLIP المنشورة للبروتين محل الاهتمام ، إذا كانت متوفرة ، لأنها تكشف ، بدقة عالية ، عن مناطق الحمض النووي الريبي القصيرة التي تتوافق مع قمم التفاعلات مع البروتين المستهدف13,16. يمكن استخدام هذه المناطق نفسها لتطوير مجسات ل PD. قد تكون الطريقة البديلة لتصميم طعوم الحمض النووي الريبي هذه هي التطور المنهجي للروابط عن طريق التخصيب الأسي (SELEX)17 ، والتي تمكن من تصميم الأبتامير من خلال الاختيار في المختبر ، بدءا من مكتبة عشوائية شاملة وعبر سلسلة من دورات التحسين المدفوعة بتفاعل البوليميراز المتسلسل. ومع ذلك ، فإن SELEX معقدة وتستغرق وقتا طويلا ، وتعتمد النتائج النهائية بشكل كبير على المكتبة الأولية. لتحديد طعم الحمض النووي الريبي لاستخدامه في البروتوكول المقدم هنا ، تم استغلال نهج آخر ، يتكون من استخدام طعم الحمض النووي الريبي المصمم من جديد عن طريق القوة الحسابية لخوارزمية القطالسريع ، والذي يتنبأ بالارتباط التفضيلي لبروتين معين تجاه تسلسلات معينة من الحمض النووي الريبي18،19،20.
البروتوكول المقدم هنا هو نسخة من RNA-PD محسنة لاستئصال شركاء بروتين معينين في ظروف قريبة من الفسيولوجية ، دون استخدام المنظفات أو عوامل تغيير الطبيعة أو درجات الحرارة المرتفعة. يعتمد على حبات نانو فائقة المغناطيسية مغلفة تساهميا بستربتافيدين عالي النقاء واستخدام الحمض النووي الريبي البيوتينيلي المصمم في السيليكو كطعم. يوفر هذا البروتوكول طريقة سريعة وفعالة لعزل شركاء الربط لجزيئات الحمض النووي الريبي البيوتينيل في الظروف الأصلية ، مما يوفر إمكانية لمجموعة واسعة من التطبيقات النهائية. لاختبار هذا البروتوكول ، تم استخدام تسلسل أبتامير الحمض النووي الريبي المفرد المكون من 10 نيوكليوتيد ، والذي تم تصميمه سابقا لربط البروتين 43 المرتبط بالحمض النووي TAR (TDP-43) مع تقارب وخصوصية عالية ،20. بدءا من محللات الخلايا التائية HEK 293T ، تم تحديد تفاعلات أبتامير الحمض النووي الريبي البيوتينيل عن طريق تحليل قياس الطيف الكتلي الذي تم إجراؤه على عينات منفصلة عن طعم الحمض النووي الريبي باستخدام مخزن مؤقت مفرط التوتر. أكد هذا التحليل التحديد الناجح والقياس الكمي ل TDP-43 باعتباره الموثق المفضل.
يتيح هذا البروتوكول التعرف الناجح على تفاعلات البروتين باستخدام قليل قليل النوكليوتيد RNA قصير في المختبر. علاوة على ذلك ، فإن استخدام أبتامير الحمض النووي الريبي المصمم في السيليكو كمجسات PD21,22 يضمن خصوصية الأهداف بتكاليف منخفضة بشكل كبير.
Protocol
1. الأساليب والمواد العامة
- تحضير الوسط المناسب لزراعة خلايا الثدييات المختارة وتسخينه مسبقا على حرارة 37 درجة مئوية لمدة 20 دقيقة قبل الاستخدام.
- قم بإعداد المواد المطلوبة مسبقا ، كما هو موضح في جدول المواد. الأواني الزجاجية الأوتوكلاف والأواني البلاستيكية والمخزون العازل.
- قم بإعداد المخازن المؤقتة كما هو موضح في الجدول 1. اضبط الأس الهيدروجيني لمحاليل المخزون باستخدام حمض الهيدروكلوريك المركز أو هيدروكسيد الصوديوم قبل تخفيف المكونات إلى أحجامها النهائية.
2. إعداد خط خلايا الثدييات
- تنمو خلايا HEK 293T في وسط النسر المعدل (DMEM) من Dulbecco المكمل بمصل بقري جنيني بنسبة 10٪ (FBS) ومحلول 100 ميكروغرام / مل من البنسلين / الستربتومايسين. احتضانها عند 37 درجة مئوية في حاضنة مرطبة مزودة بنسبة 5٪ CO2. تقسيم الخلايا بشكل روتيني.
- قبل الانفصال ، اشطف الخلايا بمحلول ملحي مخزن بالفوسفات (PBS) لتغطية السطح المتنامي.
- قم بإزالة PBS وإضافة طبقة رقيقة جدا من محلول التربسين-EDTA.
- احتضان الخلايا عند 37 درجة مئوية في حاضنة مرطبة مزودة ب 5٪ CO2 لمدة 5 دقائق ، أو حتى يتم فصل الخلايا (يجب أن تبدو مشتتة تحت الملاحظة المجهرية).
- قم بتخفيف محلول التربسين-EDTA عشرة أضعاف عن طريق إضافة DMEM كامل لتعطيله وعد الخلايا.
- لوحة 1.5 × 105 خلايا / مل في ألواح 6 آبار ، مع مراعاة بئرين / حالة للاختبار.
- احتضان الخلايا عند 37 درجة مئوية لمدة 48 ساعة في حاضنة مرطبة مع 5٪ CO2.
ملاحظة: تحقق من تعليمات الشركة المصنعة لمعرفة نوع الوسيط والملحق المناسب لخط الخلية. أيضا ، تعتمد كمية ووقت حضانة التربسين-EDTA على خط الخلية. تنمو بعض أنواع الخلايا بشكل أسرع / أبطأ مما تم الإبلاغ عنه في هذا البروتوكول ؛ وبالتالي ، يجب اختبار تركيز البذر مسبقا.
3. إجمالي حصاد البروتين
- إزالة الوسط من الآبار حيث تنمو الخلايا.
- اغسل كل بئر من الألواح المكونة من 6 آبار مع 1 مل من PBS.
- تجاهل برنامج تلفزيوني.
- حرك الألواح على الثلج وتابع الخطوة 3.5 أو قم بتجميد الألواح الجافة عند -80 درجة مئوية لتسهيل التحلل.
- أضف 200 ميكرولتر من محلول التحلل إلى كل بئر.
- استخدم مكشطة الخلايا لفصل الخلايا وكسرها.
- انقل مستخلص الخلية المشتق من بئرين إلى نفس الأنبوب سعة 1.5 مل.
- ضع الأنبوب الذي يحتوي على مستخلص البروتين على الثلج لمدة 30 دقيقة.
- أجهزة الطرد المركزي تتحلل الخلية عند 17000 × جم لمدة 15 دقيقة عند 4 درجات مئوية.
- نقل كل طاف في أنبوب مبرد مسبقا.
ملاحظة: يوصى بما مجموعه 106-10 7 خلايا لكل حالة PD. يجب إجراء تحلل الخلايا وحصاد البروتين باستخدام مخازن الجليد الباردة. يجب إضافة مثبطات الأنزيم البروتيني إلى محلول التحلل لمنع تدهور البروتين.
4. تحديد تركيز البروتين
- تحضير كاشف برادفورد ، كما أشار المنتج ، عن طريق تخفيفه خمسة أضعاف في dH2O.
- وزع 1 مل من الكاشف في كوفيت طوله 1 سم ، وأضف 1 ميكرولتر من العينة ، واخلطها بالانقلاب.
- احتضان في الظلام في درجة حرارة الغرفة لمدة 5-10 دقائق.
- اقرأ الامتصاص عند 595 نانومتر.
- احسب حجم مستخلص البروتين المقابل ل 1.5 مجم من البروتينات وجلب جميع العينات إلى الحجم النهائي البالغ 600 ميكرولتر باستخدام محلول التحلل.
- احتفظ بالعينات على الثلج حتى الاستخدام.
ملاحظة: يمكن استخدام أي طريقة أخرى لتحديد تركيز البروتين ، باتباع توصيات توافق المخزن المؤقت. في أي حال ، يجب استخدام المخزن المؤقت للتحلل كفراغ. العديد من الكواشف غير متوافقة مع ديثيوثريتول (DTT). يوصى بإضافة DTT أو عوامل اختزال أخرى فقط بعد القياس الكمي للبروتين (DTT إلى تركيز نهائي قدره 1 مللي مول).
5. إعداد حبة
- امزج الخرزات في المخزن المؤقت للتخزين عن طريق تحريك الأنبوب.
- احسب 100 ميكرولتر من وسط الطين / العينة وضع الحجم في رف مغناطيسي.
- غسل حبة
- قم بإزالة محلول التخزين واغسل الخرز بإضافة 1 مل من المخزن المؤقت / الأنبوب وقلبه يدويا.
- قم بإزالة المخزن المؤقت باستخدام الحامل المغناطيسي.
- كرر خطوة الغسيل.
- أضف حجما من محلول التحلل يساوي الحجم الأولي لوسط الملاط ، واخلطه عن طريق تحريك الأنبوب ، ووزع الوسط بشكل موحد في أكبر عدد ممكن من الأنابيب سعة 1.5 مل كما توجد عينات.
- حبة حجب
- قم بإزالة المخزن المؤقت باستخدام الرف المغناطيسي وأضف 600 ميكرولتر من محلول 0.25 مجم / مل من الحمض النووي الريبي الخميري المحضر في محلول التحلل.
- احتضان لمدة 1 ساعة في درجة حرارة الغرفة على عجلة دوارة.
- قم بإزالة محلول tRNA باستخدام الحامل المغناطيسي.
- أضف 600 ميكرولتر من محلول التحلل واغسله بالخلط يدويا.
- كرر خطوة الغسيل وتخلص من المخزن المؤقت.
6. حبة التحميل
- تحضير 200 ميكروغرام من قليل النوكليوتيد RNA في 600 ميكرولتر من محلول التحلل لكل أنبوب يحتوي على وسط ملاط أولي 100 ميكرولتر (حبات مسدودة الآن).
- أضف oligo إلى الخرز واحتضانه لمدة 1 ساعة في درجة حرارة الغرفة أثناء الدوران.
- قم بإزالة المحلول ، وأضف 600 ميكرولتر من محلول التحلل ، واغسل الخرز مرتين عن طريق تدوير الأنابيب لمدة 5 دقائق في درجة حرارة الغرفة.
- تجاهل المخزن المؤقت.
ملاحظة: لا تقم أبدا بدوامة الخرز ، ولكن نفض الغبار بدلا من ذلك. قلل من عدد خطوات سحب العينات، إلا إذا لزم الأمر. عندما يكون ذلك ممكنا ، استخدم قطع ، 1 مل من الأطراف. تعتمد كمية وسط / عينة ملاط الخرز على قدرة ربط الخرز وكمية البدء من البروتينات الكلية. إذا كان من المتوقع أن يكون ل RNA oligo كمية كبيرة من البنية الثانوية ، فإننا نوصي أولا بتشويهه عند 80 درجة مئوية لمدة 10 دقائق ثم تبريده ببطء في درجة حرارة الغرفة أو إعادة تشكيله عن طريق احتضانه عند 30 درجة مئوية لمدة 1 ساعة. يقترح استعادة oligo الحمض النووي الريبي بعد تحميل حبة وتحديد التركيز المتبقي ، من أجل تحسين الكمية المطلوبة للتحميل وتقييم إمكانية إعادة استخدام الحمض النووي الريبي.
7. ربط البروتين على الخرز
ملاحظة: من الآن فصاعدا ، عندما يكون ذلك ممكنا ، قم بتنفيذ الخطوات عند 4 درجات مئوية.
- خذ حجما بنسبة 5٪ من محلول البروتين 600 ميكرولتر واحتفظ به كمدخلات (IN) لمزيد من التحليل (يتم إذابة 1.5 مجم من البروتينات في 600 ميكرولتر ، لذلك 5٪ يتوافق مع 30 ميكرولتر و 75 ميكروغرام من البروتينات).
- أضف مزيج البروتين المتبقي إلى كل أنبوب من الخرز المحمل واتركه يدور ببطء طوال الليل عند 4 درجات مئوية.
8. غسل المجلدات غير المحددة
- قم بإزالة الجزء غير المنضم باستخدام الرف المغناطيسي. وفر 5٪ من الحجم وقم بتسميته ك FLOWTHROUGH (FT) (الحجم غير المنضم هو حوالي 600 ميكرولتر ، لذا احتفظ مرة أخرى ب 30 ميكرولتر لمزيد من التحليل).
- أضف 1 مل من محلول الغسيل 1 إلى الخرزات واتركه يدور لمدة 5 دقائق عند 4 درجات مئوية.
- تجاهل المخزن المؤقت.
- كرر الخطوتين 8.2 و 8.3.
- أضف 1 مل من محلول الغسيل 2 إلى الحبيبات واتركه يدور لمدة 5 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية.
9. شطف المجلدات المحددة
- أضف 100 ميكرولتر من محلول الشطف 1 أو محلول الشطف 2 إلى الخرز.
- تخلط يدويا عن طريق النقر والاحتضان لمدة 5 دقائق في درجة حرارة الغرفة.
- ضع الأنابيب في خلاط حراري ورجها بقوة لمدة 5 دقائق عند 95 درجة مئوية.
- ضع الأنبوب في الرف المغناطيسي واجمع الجزء المضغوط في أنبوب نظيف.
- قم بتدوير الخرز بسرعة باستخدام جهاز طرد مركزي على مقاعد البدلاء لتحقيق أقصى قدر من استعادة الشطب.
- وفر 5٪ من إجمالي حجم ELUATE (EL) لمزيد من التحليلات (الحجم الإجمالي هو 100 ميكرولتر ، لذا افصل 5 ميكرولتر في أنبوب آخر).
- إذا لزم الأمر ، يمكن تحديد تركيز البروتين كما في القسم 4 ، باستخدام المخزن المؤقت للشطف كفراغ.
ملاحظة: يوصى بالامتناع عن إضافة DTT إلى محلول الشطف حتى يتم تحديد تركيز البروتين. إذا لم يكن القياس الكمي للبروتين مطلوبا ، أو في حالة توفر مجموعات قياس كمية البروتين المتوافقة مع العامل ، يمكن إضافة 1 mM DTT إلى المخزن المؤقت للشطف من البداية. في هذا البروتوكول ، تم اختبار كل من المخزن المؤقت للشطف 1 (يحتوي على 1 M NaCl) ومخزن الشطف 2 (مع 2 M NaCl). لم يلاحظ أي اختلاف في كفاءة الشطف للبروتين المستهدف مع زيادة القوة الأيونية ، ولكن يوصى باختبار كلا الشرطين قبل إنشاء المخزن المؤقت الأنسب. إذا كان الوجود العالي للملح في المخزن المؤقت للشطف يمثل قيدا لمزيد من التحليل ، فإن الكمية المنخفضة جدا من المنظفات في محلول الشطف تسمح بتبادل المخزن المؤقت. كبديل ، يمكن تخفيف الشطف للوصول إلى تركيز الملح المطلوب.
10. تحديد روابط البروتين بواسطة قياس الطيف الكتلي
- الأسيتون هطول الأمطار
- ركز البروتينات المستخلصة عن طريق تخفيفها أربعة أضعاف في الأسيتون البارد (-20 درجة مئوية).
- دوامة واحتضان الأنبوب عند -20 درجة مئوية طوال الليل.
- تدور عند 17000 × جم لمدة 30 دقيقة عند 4 درجات مئوية.
- قم بإزالة المادة الطافية برفق واترك الأسيتون يتبخر حتى تجف الحبيبات تماما.
- هضم البروتين في المحلول
- قم بإذابة حبيبات البروتين بإضافة 50 ميكرولتر من محلول تمسخ.
- أضف DTT إلى تركيز نهائي يبلغ 5 مللي مول ، مما يسمح بتقليل البروتين لمدة 30 دقيقة عند 55 درجة مئوية.
- قم بتبريد العينات في درجة حرارة الغرفة واستمر في تفاعل ألكلة البروتين ، مع إضافة يودواسيتاميد (IAA) بتركيز 10 مللي متر لمدة 15 دقيقة.
- هضم البروتينات باستخدام إنزيم مناسب (التربسين ، LysC) واحتضان العينات طوال الليل عند 37 درجة مئوية.
- أوقف عملية الهضم بإضافة 1 ميكرولتر من حمض ثلاثي فلورو أسيتيك 10٪ (TFA).
- قم بتنظيف وتركيز الببتيدات على عمود صغير C18 معكوس مخصص للمرحلة ، كما هو موضح سابقا19.
- الببتيدات Elute من طرف C18 مع العازلة B.
- قم بإزالة المكون العضوي باستخدام جهاز طرد مركزي مفرغ وأعد تعليق الببتيدات في 5 ميكرولتر من حمض الفورميك 0.1٪ لمزيد من التحليل.
ملاحظة: بدلا من ذلك ، يمكن إجراء هضم البروتين "على الخرز" مباشرة بعد غسل المجلدات غير المحددة (الخطوات 8.1-8.6) ، مما يجعل البروتوكول أسرع. ومع ذلك ، فمن المستحسن اختبار كفاءة الإنزيم الذي يعمل "على الخرزات" البروتينات المجمدة مقارنة بالمعيار في هضم المحلول ، من أجل ضمان التغطية المثلى لتسلسل البروتين التجريبي.
- الكروماتوغرافيا السائلة - قياس الطيف الكتلي الترادفي (LC-MS / MS)
- قم بتوصيل العمود التحليلي (المرحلة الثابتة C18) واحتفظ به عند 45 درجة مئوية خلال وقت التشغيل.
- قم بتوصيل العمود بمخرج صمام دوار بستة منافذ لمضخة LC من خلال تركيب شعري محكم الإصبع (20 ميكرومتر × 550 مم) في تكوين عمود واحد.
- اضبط إعدادات LC كما يلي:
- قم بتحميل الببتيدات تحت ضغط متحكم فيه (980 بار) في المخزن المؤقت أ.
- قم بتطبيق تدرج 5٪ -20٪ Buffer B عند 300 nL / min خلال 59 دقيقة ، متبوعا بتدرج Buffer B بنسبة 20٪ -30٪ على مدار 15 دقيقة وتدرج Buffer B بنسبة 30٪ -65٪ على مدى 5 دقائق.
- أضف خطوة غسيل عن طريق زيادة تركيز المخزن المؤقت B حتى 95٪ خلال 5 دقائق بالإضافة إلى خطوة متساوية لمدة 5 دقائق عند 95٪ Buffer B.
- قم بتشغيل مطياف الكتلة في وضع الاستحواذ المعتمد على البيانات (DDA) للتبديل تلقائيا بين أحداث MS و MSMS.
- حدد عدد الحلقات الذي يساوي 15 باستخدام القيمة المستهدفة للتحكم التلقائي في الكسب (AGC) 3 × 106 و 1 × 105 لأحداث MS و MSMS ، على التوالي.
- اضبط الحد الأقصى المسموح به لوقت تراكم الأيونات على 20 مللي ثانية ل MS بدقة 60 K ، و 100 مللي ثانية ل MSMS بدقة 15 K.
- قم بإجراء تجربة تجزئة تفكك الاصطدام العالية (HCD) باستخدام طاقة تصادم طبيعية تبلغ 28٪ ، مع وقت استبعاد ديناميكي يبلغ 20 ثانية.
- قم بتشغيل معلمات المصدر كما يلي:
رذاذ الجهد: 1.7 كيلو فولت
الجهد الشعري: 275 °C
لا غمد ولا غاز مساعد المستخدمة
ملاحظة: في هذا البروتوكول ، تم إجراء تحليل مطياف الكتلة (MS) للكروماتوغرافيا السائلة فائقة الأداء (UHPLC) على وجه التحديد باستخدام إعداد عمود واحد LC ، مقترنا بأداة orbitrap رباعية ثلاثية الأقطاب هجينة (جدول المواد). يمكن استخدام أنظمة LCMS الأخرى ، ولكن يوصى بتكييف المعلمات.
- تحليل البيانات
- استخدم الزر تحميل لاستيراد الملفات الأولية.
- حدد أسماء التجارب بالنقر فوق الزر تعيين التجربة .
- أدخل قسم المعلمات الخاصة بالمجموعة لتحديد جميع المعلمات المتعلقة بالتعريف:
الإنزيم المستخدم للهضم: التربسين / P
الانقسامات الفائتة: ما يصل إلى ثلاثة
تعديل ثابت: كارباميدوميثيليشن
التعديل المتغير: N-acetyl (بروتين) ، أكسدة (M) - قم بتحميل ملف FASTA محدث ، متوفر من قواعد البيانات العامة مثل UniprotKB.
- حدد قواعد التحليل الصحيحة وفقا لمصدر قاعدة البيانات المختارة.
- حدد قيمة معدل الاكتشاف الخاطئ للنسب (FDR) = 1 لكل من البروتينات والببتيدات.
- أضف خيار القياس الكمي المجاني للتسمية (LFQ) في علامة التبويب القياس الكمي المجاني للتسمية.
- حافظ على الحد الأدنى لعدد نسبة LFQ عند اثنين.
ملاحظة: هنا ، نصف تحليل البيانات باستخدام برنامج MaxQuant24 و Perseus25 لإجراء القياس الكمي للبروتين والتحليل الإحصائي اللاحق ، على التوالي. ومع ذلك ، يمكن إجراء تحليل البيانات باستخدام أي معلوماتية حيوية أخرى متاحة تجاريا أو مجانية. يتم تقدير FDR باستخدام نهج قائم على قاعدة بيانات شرك الهدف26. الببتيد والبروتين FDR يساوي 0.01 يعني أنه من المتوقع أن تحتوي الببتيدات والبروتينات المحددة على 1٪ من الإيجابيات الكاذبة.
- التحليل الإحصائي
- قم بتحميل ملف مجموعات البروتين.txt لإجراء تحليل إحصائي على مستوى البروتين.
- حدد قيم LFQ كأعمدة رئيسية.
- قم بإزالة "العكس" و "الملوثات" عن طريق تصفية الصفوف بناء على العمود الفئوي.
- استخدم صفوف التعليقات التوضيحية الفئوية لتجميع الظروف التجريبية المختلفة.
- تقليل مصفوفة البيانات ، وتحديد عدد القيم الصالحة في كل مجموعة من المجموعات المحددة مسبقا.
- حدد الاختبار الإحصائي الذي يناسب الظروف التجريبية بشكل أفضل (أي اختبار t ، اختبار عينات متعددة ANOVA).
- حدد الحد الأقصى للتلميحات المهمة باستخدام حساب قائم على FDR. عادة ، يتم قبول كل من 0.01 و 0.05 كعتبات لقيمة p المعدلة.
- تصور نتائج التحليلات التفاضلية بناء على إحصائيات اختبار t باستخدام تمثيل مخطط البركان.
- تصدير المصفوفة النهائية بتنسيق .txt لمزيد من التحرير لجدول النتائج النهائية.
ملاحظة: يحتوي مجلد التكوين على ملف FASTA مع بروتينات مثل الكيراتين التي تعتبر ملوثات شائعة في التجارب البروتينية العالمية ، والتي تم وضع علامة عليها بعلامة + في جدول الإخراج. في الدراسة الحالية ، مع وجود شرطين للعينة ، يتم استخدام اختبار t للتحليل الإحصائي.
11. التحقق من صحة النتائج بواسطة اللطخة الغربية
- إعداد العينة
- أضف الحجم المناسب من المخزن المؤقت لتحميل العينة 4x إلى كل حصة من IN و FT و EL.
- تغلي العينات لمدة 5 دقائق عند 95 درجة مئوية.
- تدور بسرعة لاستعادة العينة المتبخرة من أعلى الأنابيب.
- SDS-PAGE ونقل هلام
- قم بتحميل العينات على جل بولي أكريلاميد 4٪ -12٪ الذي يمسخ.
- قم بتشغيل الجل باستخدام مخزن مؤقت لتشغيل MES SDS لمدة 1.5 ساعة عند 120 فولت.
- انقل الجل على غشاء نيتروسليلوز باستخدام كاسيت نقل شبه جاف ، باتباع تعليمات الشركة المصنعة. نوصي بنقل 10 دقائق عند 15 فولت.
- الكشف المناعي
- سد الغشاء مع 10٪ ألبومين مصل البقر (BSA) لمدة 1 ساعة في درجة حرارة الغرفة أثناء التقليب بلطف.
- أضف الجسم المضاد الأساسي المحضر في 5٪ BSA في TBST ، وفقا لتعليمات الشركة المصنعة. اتركيه طوال الليل عند 4 درجات مئوية أو لمدة 1 ساعة في درجة حرارة الغرفة تحت التحريك اللطيف.
- اغسل الغشاء ثلاث مرات باستخدام TBST ، في كل مرة لمدة 5 دقائق.
- أضف الجسم المضاد الثانوي المحضر في TBST لمدة 1 ساعة في درجة حرارة الغرفة تحت الإثارة.
- اغسل الغشاء ثلاث مرات باستخدام TBST ، في كل مرة لمدة 5 دقائق.
- تصور النتائج باستخدام جهاز تصوير وصمة عار.
ملاحظة: للكشف عن TDP-43 ، وهو رابط معروف للحمض النووي الريبي الخاص بنا ، تم استخدام الجسم المضاد أحادي النسيلة للأرانب المؤتلف وترك مع الغشاء طوال الليل عند 4 درجات مئوية. كجسم مضاد ثانوي ، تم استخدام بيروكسيديز الفجل IgG المضاد للأرانب (HRP) ، ولكن الجسم المضاد الثانوي الفلوري سيعمل أيضا. لتصور الأجسام المضادة على الغشاء ، تم تحضين الغشاء بركيزة Clarity Western ECL لمدة 1 دقيقة ، قبل التصوير باستخدام نظام التصوير ChemiDoc.
النتائج
للتحقق من صحة البروتوكول المقترح ، تم إجراء تجارب PD المقدمة هنا باستخدام أبتامير الحمض النووي الريبي الحيوي المصمم في السيليكو لربط TDP-4320 على وجه التحديد. يربط هذا الحمض النووي الريبي هدفه البروتيني بتقارب ارتباط عالي (Kd = 90 نانومتر) 20. هنا ، يشار إلى هذا الحمض النووي الريبي ، من التسلسل 5'-CGGUGUUGCU-3 '، باسم "+ RNA". كعنصر تحكم سلبي ، تم استخدام التسلسل المكمل العكسي ل + RNA ، والذي يسمى هنا "-RNA". تسلسلها هو 5'-AGCAACACCG-3'. - يظهر الحمض النووي الريبي تقاربا أقل بكثير تجاه TDP-43 (Kd = 1.5 μM)19. لغرض البروتوكول الموصوف هنا ، تم شراء قليل النيوكليوتيدات RNA هذه مترافقة مع جزيء البيوتين ، للسماح بالارتباط بخرز الستربتافيدين . + تم شراء الحمض النووي الريبي مع البيوتين-TEG في نهايته 3 '، والتي تشمل فاصل ثلاثي إيثيلين جلايكول 15 ذرة بين البيوتين ومجموعة الفوسفات من الحمض النووي. - بدلا من ذلك ، كان الحمض النووي الريبي يحتوي على بيوتين في نهايته 5 بوصات ، مترافق مع الحمض النووي عبر رابط amino-C6. ومع ذلك ، إذا كان تصميم طعم الحمض النووي الريبي قويا ، وطالما لا يوجد تداخل هيكلي أو كيميائي بين الرابط والحمض النووي الريبي ، فيمكن استخدام مواضع أخرى لاقتران البيوتين وأطوال الروابط الأخرى.
إن معرفة هوية البروتين الرئيسي الذي يمكن العثور عليه مرتبطا بمسبار + الحمض النووي الريبي بعد أن مكن PD من التحقق من صحة البروتوكول عن طريق تحديد TDP-43 في الشطف ، باستخدام كل من قياس الطيف الكتلي (MS) واللطخة الغربية (WB) (الشكل 1).
تم إجراء تحليل MS على أربعة مكررات PD تم إجراؤها إما باستخدام + RNA أو -RNA (الشكل 2). إن تحديد تفاعلات + RNA و -RNA خارج نطاق هذا البروتوكول ، ولكن يتم الإبلاغ عن بعض النتائج التي تتحقق من دقة البروتوكول. وتجدر الإشارة إلى أن رسم البروتينات المخصبة بشكل كبير في مخطط بركان كشف أن إجمالي محتوى البروتين والبروتينات المخصبة المستخلصة من + الحمض النووي الريبي كانت أعلى بكثير مما تم استرداده من -RNA (الشكل 2). هذا يعني أنه على الرغم من وجود نفس الطول والمحتوى الهيكلي (الخطي) ، يمكن ل + RNA إنشاء عدد أكبر من التفاعلات المحددة ، والتي يتم الاحتفاظ بها حتى خطوة الشطف بملح عالي. من المحتمل أن -RNA بدلا من ذلك ينشئ عددا أكبر من جهات الاتصال غير المحددة التي تتعطل أثناء خطوات الغسيل. كما هو متوقع ، تم تحديد TDP-43 كتفاعل فريد ل + RNA20 ؛ متوسط القياس الكمي الخالي من الملصقات (LFQ) لتكرارات PD الأربعة التي يتم إجراؤها باستخدام + RNA هو 31.96 ± 0.56 ، بينما لم يتم تحديد البروتين بين تفاعلات -RNA. بالإضافة إلى ذلك ، من بين جميع التفاعلات الفريدة ل + RNA ، وجد أن TDP-43 هو البروتين الأكثر إثراء.
لمزيد من التحقق من صحة البروتوكول ، تم استخدام الخوارزمية الداخلية catRAPID18,19 للتنبؤ الحسابي بالبروتينات الأخرى التي سترتبط على وجه التحديد إما + RNA أو -RNA. على وجه الخصوص ، تم حساب درجات التفاعل ل + RNA و -RNA مع البروتينات التي تشكل البروتين البشري باستخدام ميزة "ميل التفاعل" catRAPID ، على النحو المحدد في عملناالسابق 27. من بين البروتينات التي تم تسجيلها بثقة عالية ، كان من المتوقع أن يرتبط HNRNPH3 بشكل انتقائي + RNA (+ درجة تفاعل الحمض النووي الريبي = 1.01 ؛ -درجة تفاعل الحمض النووي الريبي = 0.21) و PCBP2 للتفاعل على وجه التحديد مع -RNA (+ درجة تفاعل الحمض النووي الريبي = -0.5 ؛ -درجة تفاعل الحمض النووي الريبي = 0.31) (الشكل 3 أ). بالإضافة إلى ذلك ، كان من المتوقع أن يكون البروتين RBM41 منحلا لكل من قليل النيوكليوتيدات RNA (+ درجة تفاعل الحمض النووي الريبي = 0.4 ؛ -درجة تفاعل الحمض النووي الريبي = 0.39) (الشكل 3 أ). أكد تحليل MS بالفعل وجود HNRNPH3 و PCBP2 في PD ل + RNA و -RNA على التوالي ، بينما تم العثور على RBM41 يتفاعل مع كليهما (الشكل 3B).
تم استخدام WB للكشف عن وجود TDP-43 لمزيد من تأكيد النتائج وأثناء تحسين البروتوكول (الشكل 4). في الإجراء الموصوف هنا ، تم جمع عينات مختلفة في مراحل مختلفة. تألفت عينة الإدخال (IN) من إجمالي البروتينات المخففة في محلول التحلل. تم الحصول على التدفق (FT) بعد حضانة ليلية للبروتينات الكلية مع حبات الستربتافيدين المغلفة مسبقا بالحمض النووي الريبي البيوتينيل ، وهو ما يمثل جزء البروتينات التي لم تربط الحمض النووي الريبي. أخيرا ، احتوى الشطف (EL) على جميع البروتينات التي تعرفت على وجه التحديد على الحمض النووي الريبي قيد التحقيق ، حيث أنه بين خطوات FT و EL ، كان من المفترض أن تزيل ثلاث خطوات غسيل بملح 150 مللي متر و 0.1٪ triton-X أضعف التفاعلات.
لكل نسخة متماثلة ، تم تشغيل نفس الكمية (5٪ v / v) من IN و FT و EL بالتوازي على SDS-PAGE وملطخة بجسم مضاد ل TDP-43 (الشكل 4). في حالة + RNA ، لوحظ شريط TDP-43 في IN وفي EL ، مما يشير إلى أن البروتين ، الموجود منذ البداية في مستخلص البروتين الكلي ، يتم الاحتفاظ به بواسطة + RNA أثناء خطوات الغسيل ويتم استخلاصه فقط في النهاية بمحلول ملح عالي. كان TDP-43 موجودا أيضا في IN ل -RNA ، ولكن النطاق المقابل للبروتين مرئي أيضا في FT ، مما يشير إلى أن هذا الحمض النووي الريبي لا يربط TDP-43. يؤكد غياب النطاق TDP-43 في EL هذه النتيجة.
أثناء تحسين البروتوكول ، تم فحص شطف البروتينات المرتبطة على وجه التحديد بتسلسل الحمض النووي الريبي باستخدام مخزن مؤقت للشطف يحتوي على 1 M NaCl (EB1) ومع مخزن مؤقت للشطف كامل مع 2 M NaCl (EB2) (الشكل 4). تمت مقارنة الشطف الذي تم الحصول عليه مع أي من EB على SDS-PAGE ومسحه بالجسم المضاد ل TDP-43. ثم تم تحليل الصور التي تم الحصول عليها باستخدام ImageJ28 لتحديد أي اختلاف في كمية TDP-43 المستخلصة من المخازن المؤقتة. بشكل عام ، لم يلاحظ أي فرق كبير ، وخلصنا إلى أنه ضمن هذه المقايسات ، يكفي 1 M من الملح لتعطيل حتى أقوى تفاعلات البروتين والحمض النووي الريبي.
بشكل عام ، تظهر النتائج التي تم الإبلاغ عنها هنا ل MS و WBs أن هذا البروتوكول فعال في التقاط تفاعلات البروتين في RNA معين بطريقة محددة ، وأنه يتيح الشطف في المخازن المؤقتة المتوافقة مع تحليل المصب.
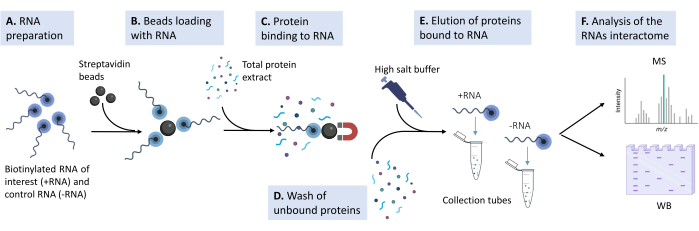
الشكل 1: رسم تخطيطي لخط الأنابيب التجريبي المستخدم في البروتوكول المقترح . (أ) يحضر قليل النوكليوتيد الريبي المبوتنيل في محلول التحلل بالتركيز المناسب. (ب) تغسل حبات الستربتافيدين المغناطيسية، وتسد بالحمض النووي الريبوزي الناقل (tRNA) الخميري، وتحمل بالحمض النووي الريبوزي الريبوزي البيوتينيل. (ج) يضاف مستخلص البروتين الكلي المشتق من خطوط خلايا الثدييات المستزرعة إلى خليط الخرز والحمض النووي الريبوزي (RNA). (د) تجرى غسلات متعددة لإزالة التفاعلات غير المتخصصة. (ه) تنفصل متفاعلات البروتين المحددة عن الحمض النووي الريبوزي (RNA) بمحلول مفرط التوتر. (F) يتم الكشف عن هوية المتفاعلات بواسطة قياس الطيف الكتلي ، ويتم التحقق من صحة حالات محددة بواسطة اللطخة الغربية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
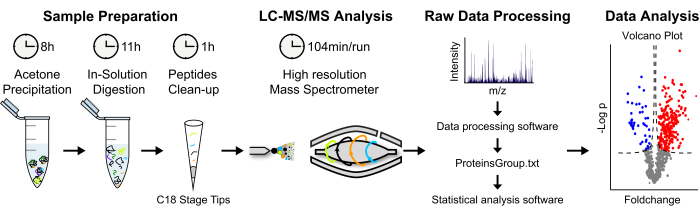
الشكل 2: استراتيجية تحليلية لقياس كمية البروتين القائم على مرض التصلب العصبي المتعدد الخالي من التسمية . (أ) تترسب البروتينات الملطخة في الأسيتون البارد طوال الليل. ثم يتم تغيير طبيعة البروتينات ، ويتم إجراء عملية هضم في المحلول. تتركز الببتيدات المحللة للبروتين وتحلية. (ب) يتم تحليل الببتيدات عبر LC-MS / MS باستخدام "نهج البندقية". (ج) تتم معالجة البيانات الخام وتحليلها باستخدام برنامج MaxQuant و Perseus ، على التوالي. (د) تعرض البروتينات المخصبة ذات الدلالة الإحصائية في مخطط بركان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
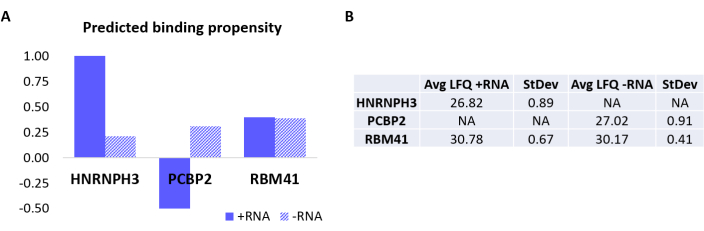
الشكل 3: العلاقة بين ميول التفاعل المتوقعة والتفاعلات المحددة تجريبيا ل + RNA و -RNA. (A) درجات تفاعل القطالسريع بالنسبة إلى HNRNPH3 و PCBP2 و RBM41 ، مما يشير إلى الارتباط التفضيلي ل HNRNPH3 ل + RNA و PCBP2 ل -RNA ، بينما من المتوقع أن يربط RBM41 تسلسل الحمض النووي الريبي بشكل عشوائي. (ب) متوسطات القياس الكمي الخالية من الملصقات التي يحددها تحليل قياس الطيف الكتلي من القوائم المنسدلة التي يتم إجراؤها باستخدام + RNA و -RNA. يؤكد التحليل أن HNRNPH3 يربط فقط + RNA ، و PCBP2 يربط فقط -RNA ، و RBM41 يربط كلاهما بالتساوي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
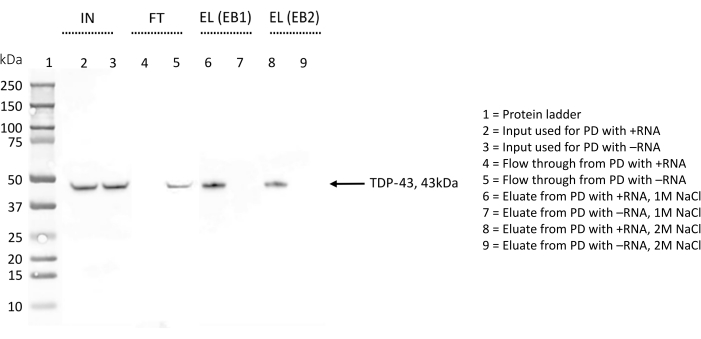
الشكل 4: التحقق من صحة اللطخة الغربية لوجود / عدم وجود TDP-43 بين التفاعلات لتسلسلات الحمض النووي الريبي المختارة. تمت معالجة غشاء WB بجسم مضاد ل TDP-43. IN = الإدخال ؛ FT = التدفق من خلال ؛ EL (EB1) = الشطف مع المخزن المؤقت للشطف 1 ؛ EL (EB2) = الشطف مع المخزن المؤقت للشطف 2 ؛ تشير العلامة "+" إلى العينات المشتقة من القائمة المنسدلة التي يتم إجراؤها باستخدام + RNA ؛ تشير العلامة "-" إلى العينات المشتقة من القائمة المنسدلة التي يتم إجراؤها باستخدام -RNA ؛ يحتوي الممر 1 على سلم بروتيني. يشار إلى TDP-43 بسهم. يشير WB إلى أن TDP-43 موجود بين + تفاعلات الحمض النووي الريبي ولكن ليس بين تفاعلات -RNA. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم المخزن المؤقت | تكوين | |||||
| 10x المخزن المؤقت ترانفر | 250 مللي متر تريس ، 1.92 م جليكاين ، 1٪ SDS ، 20٪ ميثانول. تمييع 10 أضعاف قبل الاستخدام | شرطه | ||||
| 20X MES SDS تشغيل المخزن المؤقت | 1 م MES ، 1 م تريس ، 2٪ SDS ، 20 مللي متر EDTA. اضبط الرقم الهيدروجيني على 7.3. تمييع 20 مرة قبل الاستخدام | |||||
| 4x عينة تحميل المخزن المؤقت | 0.25 م قاعدة تريس، 0.28 م SDS، 40٪ جلسرين، 20٪ 2-ميركابتو إيثانول، 4 ملغ/مل برومفينول أزرق | |||||
| العازلة للشطف 1 | 20 mM فوسفات درجة الحموضة 7.5 ، 1 M كلوريد الصوديوم ، 0.5 mM EDTA ، 0.1 ٪ Triton X-100 ، 1 mM DTT (تضاف بعد الكمية) | |||||
| العازلة للشطف 2 | 20 mM فوسفات درجة الحموضة 7.5 ، 2 M كلوريد الصوديوم ، 0.5 mM EDTA ، 0.1 ٪ Triton X-100 ، 1 mM DTT (يضاف بعد القياس الكمي) | |||||
| التحلل العازلة | 10 ملليمتر Tris-HCl pH 7.4 ، 150 mM NaCl ، 0.5 mM EDTA ، 0.1٪ Triton X-100 ، 1 mM DTT ومثبطات الأنزيم البروتيني | |||||
| محلول ملحي مخزن تريس مع توين -20 | 1 م Tris-HCl pH 7.4 ، 3 M كلوريد الصوديوم ، 2.0٪ توين -20 | |||||
| اغسل العازلة 1 | 10 ملليمتر Tris-HCl pH 7.4 ، 150 mM NaCl ، 0.5 mM EDTA ، 0.1٪ Triton TM X-100 ، 1 mM DTT ومثبطات الأنزيم البروتيني | |||||
| غسل العازلة 2 | 25 مللي متر Hepes pH 8 ، 150 mM NaCl ، 0.5 mM EDTA ، 0.1٪ Triton X-100 ، 1 mM DTT ومثبطات الأنزيم البروتيني | |||||
| المخزن المؤقت أ | 0.1٪ حمض الفورميك | مللي ثانية | ||||
| المخزن المؤقت ب | 60٪ أسيتونيتريل ، 0.1٪ حمض الفورميك | |||||
| العازلة تمسخ | 8 ميجا يوريا ، 50 مللي متر تريس حمض الهيدروكلوريك | |||||
الجدول 1: المخازن المؤقتة PD و MS. أسماء وتكوين المخازن المؤقتة المستخدمة إما للتجارب المنسدلة (PD) أو لتحليل قياس الطيف الكتلي (MS).
Discussion
يشير هذا العمل إلى تحسين بروتوكول PD الذي يتم إجراؤه باستخدام قليل النيوكليوتيدات الحمضية للحمض النووي الريبي البيوتينيلوت لالتقاط تفاعلات البروتين الخاصة بهم. البروتوكول الموصوف هنا سهل التنفيذ ، ويتطلب القليل من المواد ، وينتج نتائج موثوقة للغاية. الأهم من ذلك ، أن الجوانب الأكثر حداثة لهذا البروتوكول تتكون من استخدام طعم الحمض النووي الريبي المصمم بالكامل في السيليكو والمحدد لهدف البروتين ، وشطف جميع البروتينات المرتبطة بطعم الحمض النووي الريبي عن طريق تعطيل تفاعلاتها مباشرة مع محلول عالي الملح ، بدلا من فصل الستربتافيدين عن البيوتين مع المنظفات والمعالجة بدرجة حرارة عالية.
يستفيد هذا البروتوكول من قوة الرابطة بين البيوتين والستربتافيدين29,30. وفقا لحبيبات الستربتافيدين المختارة ، يجب اختبار تحميل الحمض النووي الريبي البيوتينيل وقياسه قبل المتابعة. أيضا ، قد يؤثر طي الحمض النووي الريبي ثلاثي الأبعاد على كفاءة التحميل على الخرز ، لأنه قد يحد من تعرض البيوتين للستربتافيدين. يؤدي منع الخرزات باستخدام الحمض النووي الريبي غير البيوتينلي إلى تحسين نظافة النتائج عن طريق الحد من التفاعلات غير المحددة مع الخرزات. يجب اختيار مخزن التحميل المؤقت والمخزن المؤقت للشطف اعتمادا على تطبيقات المصب. هنا ، تم اقتراح ظروف معتدلة للغاية ، مناسبة لغالبية التطبيقات وتم تطويرها للحفاظ على مجمعات البروتين المحتملة. ومع ذلك ، فإن هذه الطريقة قابلة للتكيف بدرجة كبيرة. يمكن للمستخدم اختيار أي خط خلية وأي حجم للحمض النووي الريبي ، ويمكن أن يقرر تكرار البروتوكول بعد طي / فتح الحمض النووي الريبي لتحديد تأثير الهيكل على خصائص الربط.
جانب أصلي آخر من هذا البروتوكول هو استخدام أدوات التنبؤ بالسيليكو لضمان صحة النتائج20. إن معرفة البروتينات التي يجب تحديدها مسبقا على أنها متفاعلات للحمض النووي الريبي محل الاهتمام يعطي ميزة غير مسبوقة تتمثل في التحقق من صحة الجوانب التقنية للبروتوكول. على سبيل المثال ، باستخدام تحليل بسيط للبنك الدولي ، من الممكن التحقق من وجود هدف بروتين معروف في العينات المشتقة من الخطوات المختلفة للبروتوكول قبل الشروع في تحليل MS ، والذي يتطلب أجهزة متخصصة وأكثر تكلفة. بالإضافة إلى ذلك ، تم الإبلاغ مؤخرا عن طريقة لاستخدام catRAPID20 ، وهي خوارزمية تنبؤ داخلية للبروتين والحمض النووي الريبي ، لتصميم دي نوفو RNA خاص بالبروتين المستهدف. حتى وقت قريب ، كان خط الأنابيب الوحيد المتاح لتصميم أبتامير الحمض النووي / الحمض النووي الريبي للبروتين المستهدف هو نهج SELEX (التطور المنهجي للروابط عن طريق التخصيب الأسي)31. تتيح طريقة السيليكو تصميما أسرع بكثير وفعالا من حيث التكلفة لأتامرز الحمض النووي الريبي.
ترتبط القيود الرئيسية لهذه الطريقة بالحاجة إلى العمل في المخازن المؤقتة والأدوات الخالية من النيوكلياز. علاوة على ذلك ، إذا اعتبر من الضروري التأكد في المختبر من الارتباط بين الحمض النووي الريبي المصمم من جديد والبروتين المستهدف السابق ل PD ، فيجب إنتاج البروتين وتنقيته وتحديد الارتباط بنهج فيزيائية حيوية. هذا هو القيد الذي يتم مشاركته مع إنتاج الأجسام المضادة وحيدة النسيلة.
على الرغم من هذه القضايا البسيطة ، فإن الطرق الموثوقة لرسم خريطة تفاعلات بروتين الحمض النووي الريبي ، مثل تلك المعروضة هنا ، يمكن أن تقرب العلماء من الكشف عن شبكات الجزيئات الكبيرة والجهات الفاعلة الرئيسية المعقدة للعديد من الآليات الفسيولوجية والمرضية ، مثل تلك المشاركة في السرطان ، واعتلال عضلة القلب ، والسكري ، والالتهابات الميكروبية ، والاضطرابات الوراثية والتنكسية العصبية.
Disclosures
ليس للمؤلفين مصالح مالية متنافسة أو تضارب مصالح آخر.
Acknowledgements
يود المؤلفون أن يشكروا مجموعة أبحاث البروفيسور تارتاليا والدكتور كومو على الدعم المقدم. تلقت EZ تمويلا من زمالة MINDED لبرنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي بموجب اتفاقية منحة Marie Sklodowska-Curie رقم 754490.
Materials
| Name | Company | Catalog Number | Comments |
| 6-well tissue culture plates | VWR | 10861-554 | CELLS |
| Cell scrapers | BIOSIGMA | 10153 | CELLS |
| Dulbecco′s Modified Eagle′s Medium (DMEM) | Thermo Fisher Scientfic | 11995065 | CELLS |
| Fetal Bovine Serum, qualified, heat inactivated, Brazil | Thermo Fisher Scientfic | 10500064 | CELLS |
| Phosphate Buffer Saline (PBS, Waltham, MA) | Thermo Fisher Scientfic | 14190169 | CELLS |
| Trypsin (0.25%), phenol red | Thermo Fisher Scientfic | 15050065 | CELLS |
| Anti-rabbit IgG horseradish peroxidase (HRP) | Cellsignal | 7070 | PD |
| Biotinylated RNA | Eurofins | Custom RNA oligonucleotides | PD |
| Bovine serum albumin | Sigma-Aldrich | A9418 | PD |
| Clarity Western ECL Substrate, 500 ml | Biorad | 1705061 | PD |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Merck - Sigma Aldrich | 5056489001 | PD |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm, Mini Protein Gel, 10-well | Invitrogen | NP0321BOX | PD |
| Recombinant anti-TDP43 antibody | Abcam | ab109535 | PD |
| Ribonucleic acid, transfer from baker's yeast (S. cerevisiae) | Merck - Sigma Aldrich | R5636-1ML | PD |
| Streptavidin Mag Sepharose | Merck - Sigma Aldrich | GE28-9857-99 | PD |
| Trans-Blot Turbo RTA Mini 0.2 µm PVDF Transfer Kit | Biorad | 1704272 | PD |
| Acetone | Thermo Fisher Scientfic | 022928.K2 | MS |
| C18 cartridge | Thermo Fisher Scientfic | 13-110-018 | MS |
| Dithiothreitol (DTT) | Thermo Fisher Scientfic | 20290 | MS |
| EASY-Spray HPLC Columns | Thermo Scientific | ES902 | MS |
| iodoacetamide (IAA) | Sigma Aldrich S.r.l. | I6125 | MS |
| Lys-C/Trypsin | Promega | V5073 | MS |
| Trifluoroacetic acid (TFA) | Thermo Fisher Scientfic | 28904 | MS |
| Urea | Thermo Fisher Scientfic | J75826.A7 | MS |
| Equipment | |||
| ChemiDoc imaging system | Bio-Rad | CELLS | |
| Dyna Mag -2 , Magnetic rack | Invitrogen | CELLS | |
| Forma Series 3 water jacketed C02 incubator | Thermo Scientific | PD | |
| PROTEAN II xi cell , power supply for PAGE applications | Bio-Rad | PD | |
| Rotating wheel, rotator SB3 | Stuart | PD | |
| Water bath set at 37 °C | VWR | PD | |
| XCell SureLock Mini-Cell electrophoresis system | ThermoFisher Scientific | MS | |
| Easy-nLC 1200 UHPLC | Thermo Scientific | MS | |
| Q exactive Mass Spectrometer | Thermo Scientific | MS | |
| Software | Version | ||
| MaxQuant | 2.0.3.0 | MS | |
| Perseus | 1.6.14.0 | MS |
References
- Gebauer, F., Schwarzl, T., Valcárcel, J., Hentze, M. W. RNA-binding proteins in human genetic disease. Nature Reviews Genetics. 22 (3), 185-198 (2021).
- Hentze, M. W., Castello, A., Schwarzl, T., Preiss, T. A brave new world of RNA-binding proteins. Nature Reviews Molecular Cell Biology. 19 (5), 327-341 (2018).
- Castello, A., et al. Insights into RNA biology from an atlas of mammalian mRNA-binding proteins. Cell. 149 (6), 1393-1406 (2012).
- Cooper, T. A., Wan, L., Dreyfuss, G. RNA and disease. Cell. 136 (4), 777-793 (2009).
- Qin, H., et al. RNA-binding proteins in tumor progression. Journal of Hematology & Oncology. 13 (1), 90 (2020).
- Nussbacher, J. K., Tabet, R., Yeo, G. W., Lagier-Tourenne, C. Disruption of RNA metabolism in neurological diseases and emerging therapeutic interventions. Neuron. 102 (2), 294-320 (2019).
- Duan, R., Sharma, S., Xia, Q., Garber, K., Jin, P. Towards understanding RNA-mediated neurological disorders. Journal of Genetics and Genomics. 41 (9), 473-484 (2014).
- Maziuk, B., Ballance, H. I., Wolozin, B. Dysregulation of RNA binding protein aggregation in neurodegenerative disorders. Frontiers in Molecular Neuroscience. 10, 89 (2017).
- Zielinski, J., et al. In vivo identification of ribonucleoprotein-RNA interactions. Proceedings of the National Academy of Sciences. 103 (5), 1557-1562 (2006).
- Armaos, A., Zacco, E., Sanchez de Groot, N., Tartaglia, G. G. RNA-protein interactions: Central players in coordination of regulatory networks. BioEssays. 43 (2), 2000118 (2021).
- Weidmann, C. A., Mustoe, A. M., Jariwala, P. B., Calabrese, J. M., Weeks, K. M. Analysis of RNA-protein networks with RNP-MaP defines functional hubs on RNA. Nature Biotechnology. 39 (3), 347-356 (2021).
- Graindorge, A., et al. In-cell identification and measurement of RNA-protein interactions. Nature Communications. 10 (1), 5317 (2019).
- Ule, J., Hwang, H. W., Darnell, R. B. The future of cross-linking and immunoprecipitation (CLIP). Cold Spring Harbor Perspectives in Biology. 10 (8), 032243 (2018).
- Ascano, M., Hafner, M., Cekan, P., Gerstberger, S., Tuschl, T. Identification of RNA-protein interaction networks using PAR-CLIP. Wiley Interdisciplinary Reviews. RNA. 3 (2), 159-177 (2012).
- McHugh, C. A., Russell, P., Guttman, M. Methods for comprehensive experimental identification of RNA-protein interactions. Genome Biology. 15 (1), 203 (2014).
- Sugimoto, Y., et al. Analysis of CLIP and iCLIP methods for nucleotide-resolution studies of protein-RNA interactions. Genome Biology. 13 (8), (2012).
- Bayat, P., et al. SELEX methods on the road to protein targeting with nucleic acid aptamers. Biochimie. 154, 132-155 (2018).
- Armaos, A., Colantoni, A., Proietti, G., Rupert, J., Tartaglia, G. G. CatRAPID omics v2.0: Going deeper and wider in the prediction of protein-RNA interactions. Nucleic Acids Research. 49, 72-79 (2021).
- Agostini, F., et al. CatRAPID omics: A web server for large-scale prediction of protein-RNA interactions. Bioinformatics. 29 (22), 2928-2930 (2013).
- Zacco, E., et al. Probing TDP-43 condensation using an in silico designed aptamer. Nature Communications. 13 (1), 3306 (2022).
- Leppek, K., Stoecklin, G. An optimized streptavidin-binding RNA aptamer for purification of ribonucleoprotein complexes identifies novel ARE-binding proteins. Nucleic Acids Research. 42 (2), 13 (2014).
- Zhang, Y., Lai, B. S., Juhas, M. Recent advances in aptamer discovery and applications. Molecules. 24 (5), 941 (2019).
- UniProt Consortium. UniProt: the Universal Protein Knowledgebase in 2023. Nucleic Acids Research. 51, 523-531 (2023).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Tyanova, S., et al. The Perseus computational platform for comprehensive analysis of (prote)omics data. Nature Methods. 13 (9), 731-740 (2016).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nature Protocols. 2 (8), 1896-1906 (2007).
- Bellucci, M., Agostini, F., Masin, M., Tartaglia, G. G. Predicting protein associations with long noncoding RNAs. Nature Methods. 8 (6), 444-445 (2011).
- Gallo-Oller, G., Ordoñez, R., Dotor, J. A new background subtraction method for Western blot densitometry band quantification through image analysis software. Journal of Immunological Methods. 457, 1-5 (2018).
- Weissinger, R., Heinold, L., Akram, S., Jansen, R. P., Hermesh, O. RNA proximity labeling: A new detection tool for RNA-protein interactions. Molecules. 26 (8), 2270 (2021).
- Hirsch, J. D., et al. Easily reversible desthiobiotin binding to streptavidin, avidin, and other biotin-binding proteins: Uses for protein labeling, detection, and isolation. Analytical Biochemistry. 308 (2), 343-357 (2002).
- Sefah, K., Shangguan, D., Xiong, X., O'Donoghue, M. B., Tan, W. Development of DNA aptamers using cell-SELEX. Nature Protocols. 5 (6), 1169-1185 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved