Method Article
توطين البنية التحتية ل LC3 الداخلي بواسطة المجهر الإلكتروني الضوئي المترابط في المقطع
In This Article
Summary
هنا ، نقدم بروتوكولا للفحص المجهري الإلكتروني الضوئي المترابط على المقطع بناء على الملصقات الفلورية الداخلية كأداة للتحقيق في توطين البروتينات النادرة فيما يتعلق بالبنية الخلوية الفائقة. تتجلى قوة هذا النهج من خلال توطين البنية التحتية ل LC3 الداخلي في الخلايا الجائعة دون علاج بافيلوميسين.
Abstract
يعد تصور عضيات الالتهام الذاتي على مستوى البنية التحتية بواسطة المجهر الإلكتروني (EM) أمرا ضروريا لتحديد هويتها والكشف عن التفاصيل المهمة لفهم عملية الالتهام الذاتي. ومع ذلك ، غالبا ما تفتقر طرق EM إلى المعلومات الجزيئية ، مما يعيق ارتباط المعلومات الهيكلية الفائقة التي تحصل عليها EM بالتوطين القائم على الفحص المجهري الفلوري لبروتينات الالتهام الذاتي المحددة. علاوة على ذلك ، فإن ندرة البلعمة الذاتية في الظروف الخلوية غير المتغيرة تعيق التحقيق بواسطة EM ، الأمر الذي يتطلب تكبيرا عاليا ، وبالتالي يوفر مجال رؤية محدودا.
ردا على كلا التحديين ، تم تطبيق طريقة المجهر الإلكتروني الضوئي المترابط (CLEM) على المقطع بناء على وضع العلامات الفلورية لربط علامة البلعمة الذاتية الشائعة ، LC3 ، بالبنية الفائقة EM. تم استخدام الطريقة لفحص الخلايا بسرعة في الفحص المجهري الفلوري لوضع العلامات LC3 بالاشتراك مع العلامات الأخرى ذات الصلة. بعد ذلك ، تم تحديد السمات الهيكلية الأساسية للبقع المختارة التي تحمل علامة LC3 بواسطة CLEM. تم تطبيق الطريقة على الخلايا الجائعة دون إضافة مثبطات التحمض الليزوزومي.
في هذه الظروف ، تم العثور على LC3 في الغالب على البلعمة الذاتية ونادرا في autolysosomes ، حيث يتحلل LC3 بسرعة. تظهر هذه البيانات جدوى وحساسية هذا النهج ، مما يدل على أنه يمكن استخدام CLEM لتوفير رؤى هيكلية فائقة حول الالتهام الذاتي بوساطة LC3 في الظروف المحلية - بدون علاجات دوائية أو تعديلات جينية. بشكل عام ، تقدم هذه الطريقة أداة قيمة لدراسات توطين البنية التحتية لبروتينات الالتهام الذاتي والمستضدات النادرة الأخرى عن طريق ربط الفحص المجهري الضوئي ببيانات EM.
Introduction
الالتهام الذاتي هو عملية رئيسية لإزالة وإعادة تدوير البروتينات والعضيات السيتوبلازمية. تتضمن عملية الالتهام الذاتي الكلي (المشار إليها فيما يلي باسم الالتهام الذاتي) تكوين عضيات مزدوجة الغشاء ، البلعمة الذاتية ، والتي تسمح للخلايا بإحاطة الجزيئات السيتوبلازمية والعضيات لتدهور الليزوزومات. يحدث الالتهام الذاتي على المستوى القاعدي في معظم الخلايا ويتم تنظيمه استجابة للظروف الخلوية ، مثل الجوع أو الإجهاد الخلوي. يحدث الالتهام الذاتي إما بطريقة خاصة بالركيزة ، ويستهدف هياكل أو بروتينات محددة للتحلل ، أو كعملية سائبة غير انتقائية تشمل أجزاء من العصارة الخلوية. في الالتهام الذاتي الانتقائي ، تتشكل البلعمة الذاتية عن طريق اقتران بروتينات عائلة Atg8 (البروتينات المرتبطة بالأنابيب الدقيقة 1A / B سلسلة الضوء 3A / B / C [LC3] و GABARAPs) إلى الأغشية المشتقة من إعادة تدوير الإندوسومات ، و / أو جولجي ، و / أو الشبكة الإندوبلازمية (ER) 1. يتعرف LC3 على حمولة الالتهام الذاتي في السيتوسول مباشرة أو عبر محولات الالتهام الذاتي الانتقائية مثل P62 / SQSTM. يمكن بعد ذلك اقتران أغشية الالتهام الذاتي الجديدة ب LC3 ، وتوسيعها ، ودمجها لتشكيل غشاء مزدوج مكتمل يحيط بالشحنة يسمى البلعمة الذاتية. ينضج البلعمة الذاتية ويندمج في النهاية مع الإندوسوم أو الليزوزوم ، حيث تتحلل بعد ذلك البضائع والمحولات ذاتيةالالتهام 2.
غالبا ما تستخدم الدراسات حول تكوين البلعمة الذاتية والنضج والاندماج تقنيات الفحص المجهري الضوئي. يستخدم الفحص المجهري الفلوري ل LC3 بشكل عام لتقييم عدد البلعمة الذاتية وتوطينها الخلوي في ظل ظروف مختلفة. علاوة على ذلك ، من خلال اقتران LC3 ب GFP الحساس للأس الهيدروجيني و RFP المستقر للأس الهيدروجيني في ما يسمى بالمسبار الترادفي ، يمكن قياس التدفق الكلي للالتهام الذاتي في الخلايا الحية كدالة لفقدان مضان GFP3. هذه الأساليب هي أدوات قيمة للباحثين لفهم دور وآلية الالتهام الذاتي في ظل ظروف مختلفة. أداة أخرى لا تقدر بثمن هي المجهر الإلكتروني (EM) ، الذي يكشف عن البنية التحتية لعضيات الالتهام الذاتي في مراحل مختلفة من الالتهام الذاتي4،5،6،7،8. حتى الآن ، لا يزال EM هو الطريقة المفضلة لتحديد المراحل الدقيقة لتكوين البلعمة الذاتية عن طريق التمييز بين أغشية الالتهام الذاتي المختلفة عن طريق التشكل: البلعمة (غشاء مزدوج غير مغلق بالكامل) ، البلعمة الذاتية (غشاء مزدوج مغلق حول البضائع الخلوية) ، والتحلل الذاتي (فقدان [جزئي] للغشاء الذاتي الداخلي). ومع ذلك ، يمكن أن يكون التشكل بدون معلومات جزيئية عرضة للخطأ في التعرف أو الغموض. Immuno-EM هي الطريقة الأكثر شمولا للتوصيف الجزيئي المتزامن والتصنيف المورفولوجي لعضيات الالتهام الذاتي. على سبيل المثال ، يسمح وضع العلامات المناعية ل LC3 على عمليات التجميد المذابة بالتوطين الفائق ل LC3 والتحديد الدقيق للعضيات التي تحمل علامة LC39.
عيب EM هو مجال الرؤية الصغير الذي يأتي مع التكبير العالي المطلوب لمراقبة البنية التحتية الدقيقة للأغشية ذاتية الالتهام ، وفي حالة immuno-EM ، لتحديد الملصق الذي يميز البروتين محل الاهتمام. نظرا لندرتها وانخفاض مستويات البروتين ، فإن هذا يعيق بشكل عام التحليل الكمي EM للجسيمات الذاتية. لزيادة عدد البلعمة الذاتية ، غالبا ما يتم تجويع الخلايا ومعالجتها باستخدام Bafilomycin A1 (BafA1) ، وهو مثبط للتحمض الليزوزومي وتدهوره. بدون علاج BafA1 ، فإن البحث عن البلعمة الذاتية بواسطة EM يستغرق وقتا طويلا ، بسبب ندرة هذه العضيات. تعالج الطريقة المعروضة في هذه المخطوطة هذه المشكلة من خلال وضع العلامات الفلورية وتصوير LC3 الداخلي على عمليات التجميد المذابة في مجهر مضان قبل مزيد من التحضير ل EM. ثم توجه الصور الفلورية البحث عن الهياكل ذات العلامات LC3 في EM. بعد التجميع ، ترتبط صور EM بالصور الفلورية لإضافة معلومات جزيئية - وجود LC3 - إلى البنية التحتية للخلية. تزيد طريقة "CLEM المقطعية" هذه بشكل كبير من القدرة على العثور على الهياكل التي تحمل علامة LC3 ، خاصة في الحالات غير المعالجة ، لتحديد وتصنيف لاحقين بواسطة EM.
تم تطبيق هذه الطريقة على خلايا HEPG210 المشتقة من الورم الأرومي الكبدي الجائعة للعثور على البلعمة الذاتية في ظروف غير متغيرة (أي لم يتم استخدام BafA1). تم العثور على عدد قليل نسبيا من النقاط الفلورية (أقل من واحد لكل ملف تعريف خلية في قسم 90 نانومتر) ، وهو ما يتفق مع ارتفاع معدل دوران LC311. أكد هذا التباين في LC3-puncta على قيمة CLEM. من خلال اختيار المناطق التي تحتوي على العديد من النقاط الفلورية للتصوير في EM ، تم العثور على عضيات إيجابية LC3 وتميزت بطريقة أكثر فعالية بكثير من خلال EM المناعي التقليدي. كشف هذا أن غالبية العضيات الإيجابية ل LC3 كانت عبارة عن جسيمات بلعمية ذاتية ، كما هو محدد من خلال مورفولوجيتها ، وهو ما يتناقض مع النتائج التي تم الحصول عليها في الخلايا المعالجة ب BafA1 ، حيث تكون الليزوزومات الذاتية أكثر شيوعا9. تظهر هذه البيانات أنه مع CLEM على المقطع ، يمكن دراسة الالتهام الذاتي على مستوى البنية التحتية دون الحاجة إلى تثبيط تدفق الالتهام الذاتي.
Protocol
1. إعداد الأدوات والكواشف
ملاحظة: للحصول على الكواشف والمخازن المؤقتة والحلول المطلوبة، راجع الملف التكميلي 1 أو 12 لمزيد من المعلومات. للحصول على تفاصيل تتعلق بجميع المواد والكواشف والمعدات والبرامج المستخدمة في هذا البروتوكول ، راجع جدول المواد.
- المثبتات
- قم بإعداد محلول فوسفات 0.2 متر (PB) أو 0.2 متر ، HEPES ، EGTA ، MgSO4 (PHEM) ، كما هو موضح في الملف التكميلي 1 ، لاستخدامه كقاعدة للحلول المثبتة.
ملاحظة: يتم تخزين المثبتات بشكل روتيني في محلول 0.1 M PB أو PHEM للتخزين المؤقت ضد التحمض الناجم عن تفاعل الألدهيد مع المادة البيولوجية. - نظرا لأن جودة البارافورمالدهايد (PFA) هي مفتاح التثبيت الموثوق للبنية التحتية للعينات ، استخدم PFA من الدرجة EM. لاتباع هذا البروتوكول ، استخدم حلول مخزون بنسبة 16٪ ، محضرة من عبوات PFA عالية الجودة (انظر الملف التكميلي 1).
تنبيه: بارافورمالدهيد مادة كيميائية خطرة (بيانات الخطر H228 ، H301 ، H302 ، H311 ، H314 ، H315 ، H317 ، H318 ، H331 ، H332 ، H335 ، H341 ، H350). عند العمل مع PFA ، ارتد معدات واقية (قفازات ومعطف مختبر ونظارات واقية) واعمل في غطاء كيميائي. يجب جمع النفايات التي تحتوي على PFA والتخلص منها وفقا لإرشادات ولوائح المعاهد. - اجمع بين 10 مل من 0.2 M PB ، و 5 مل من 16٪ PFA (في الماء منزوع المعادن [dH 2 O])، و 5 مل من dH2O لإعداد محلول مثبت من 4٪ PFA.
- اختياري: تؤدي إضافة 0.02٪ -0.5٪ جلوتارالدهيد (GA) إلى المحلول المثبت من الخطوة 1.1.3 إلى تحسين الحفاظ على البنية التحتية ، ولكنه يقلل من مستضدية العينة تجاه العديد من الأجسام المضادة.
ملاحظة: عندما يكون تثبيت GA مطلوبا ، استخدم GA من الدرجة EM من مورد مناسب.
تنبيه: الجلوتارالدهيد مادة كيميائية خطرة (بيانات الخطر H301 ، H302 ، H314 ، H317 ، H330 ، H332 ، H334 ، H335 ، H400 ، H411). العمل في غطاء كيميائي وارتداء معدات واقية (قفازات ومعطف مختبر ونظارات واقية) عند التعامل مع GA. يجب جمع النفايات التي تحتوي على GA والتخلص منها وفقا لإرشادات ولوائح المعاهد.
- قم بإعداد محلول فوسفات 0.2 متر (PB) أو 0.2 متر ، HEPES ، EGTA ، MgSO4 (PHEM) ، كما هو موضح في الملف التكميلي 1 ، لاستخدامه كقاعدة للحلول المثبتة.
- الأدوات والمواد
- خدش سطح دبابيس حامل عينة الألومنيوم وصوتنة لهم في الإيثانول 3 × 10 دقائق لإزالة بقايا المعادن وضمان الالتصاق الأمثل عند تركيب كتل الخلايا المضمنة في الجيلاتين على المسامير.
- استخدم علبة تخزين مناسبة لتخزين دبابيس حامل عينة الألومنيوم مع عيناتها في النيتروجين السائل (LN2).
- اصنع مناورا عن طريق لصق شعرة واحدة أو رمش في نهاية سيخ خشبي باستخدام طلاء الأظافر.
- اصنع حلقة بيك اب. ثني سلك من الفولاذ المقاوم للصدأ بسمك 0.3 مم حول قضيب دائري قطره 3 مم وقم بلف الأطراف معا ، لتشكيل حلقة في أحد طرفيها. أدخل الأطراف الملتوية في طرف ماصة. أدخل سيخا خشبيا من الطرف الآخر وألصقه بالغراء أو الراتنج.
ملاحظة: تتوفر أيضا حلقة التقاط تجاريا (انظر جدول المواد). - لتحضير حلقات تجفيف الشبكة ، اتبع نفس الخطوات لعمل حلقات الالتقاط: قم بتشكيل سلك من الفولاذ المقاوم للصدأ في حلقة 4 مم وتثبيته على طرف ماصة كبير بالغراء أو الراتنج.
- قم بتغطية الشبكات باستخدام فيلم داعم رقيق مثل formvar (البروتوكول في الملف التكميلي 1). قبل الاستخدام ، قم بتغطية الشبكات بطبقة رقيقة من الكربون.
ملاحظة: الشبكات الجاهزة للاستخدام متوفرة تجاريا (انظر جدول المواد). يمكن تخزين الشبكات المطلية ب Formvar إلى أجل غير مسمى في درجة حرارة الغرفة (RT) ؛ يمكن تخزين الشبكات المطلية بالكربون لعدة أشهر في RT. - قم بإعداد شرائح زجاجية نظيفة وأغطية كبيرة (24 مم × 24 مم مثالية مع شرائح زجاجية بعرض 25 مم) ، كما هو الحال في 13.
2. التثبيت وإعداد العينة
- تثبيت
- استخدم المثبت المحضر في الخطوة 1.1.3 (4٪ PFA في 0.1 M PB). بالنسبة لخطوط الخلايا الملتصقة ، ثقافة 1-5 × 10 6 خلايا في أطباق6 سم. أضف المثبت إلى وسط الاستزراع بنسبة 1: 1 واحتضن العينة لمدة 5 دقائق في RT. ثم استبدل الخليط المتوسط المثبت بالمثبت فقط واحتضانه لمدة 2 ساعة في RT.
ملاحظة: قد يختلف عدد الخلايا الدقيق والالتقاء وظروف المزرعة وفقا لنظام النموذج المستخدم. - قم بتخزين العينات طوال الليل أو لمدة تصل إلى 3-4 أسابيع في 0.5٪ PFA في 0.1 M PB عند 4 درجات مئوية.
ملاحظة: يمكن إضافة GA إلى التثبيت (انظر الخطوة 1.1.4) ويمكن تغيير طول التثبيت لإيجاد توازن مثالي بين الحفاظ على التشكل والمستضدات ، والذي يختلف حسب العينة ووضع العلامات. لمزيد من المعلومات، راجع14.
- استخدم المثبت المحضر في الخطوة 1.1.3 (4٪ PFA في 0.1 M PB). بالنسبة لخطوط الخلايا الملتصقة ، ثقافة 1-5 × 10 6 خلايا في أطباق6 سم. أضف المثبت إلى وسط الاستزراع بنسبة 1: 1 واحتضن العينة لمدة 5 دقائق في RT. ثم استبدل الخليط المتوسط المثبت بالمثبت فقط واحتضانه لمدة 2 ساعة في RT.
- تضمين العينة
- اغسل الطبق بخلايا ثابتة 3x مع PBS في RT. ثم استبدله ب PBS الذي يحتوي على 0.15٪ جليكاين واحتضانه لمدة 10 دقائق في RT.
- استبدل PBS الذي يحتوي على 0.15٪ جليكاين ب 1٪ جيلاتين في PBS مسخن مسبقا إلى 37 درجة مئوية ، وكشط ونقل الخلايا في 1٪ جيلاتين إلى أنبوب طرد مركزي دقيق. بيليه الخلايا في 6000 × غرام لمدة 1 دقيقة في RT في جهاز طرد مركزي صغير. ثم ، قم بإزالة الجيلاتين 1٪ دون إزعاج الحبيبات وأضف 12٪ جيلاتين دافئ إلى 37 درجة مئوية. أعد تعليق حبيبات الخلية عن طريق سحب الحبيبات برفق لأعلى ولأسفل باستخدام أطراف الماصة أو ماصات باستور الزجاجية المسخنة مسبقا إلى 37 درجة مئوية.
- احتضان في 37 درجة مئوية لمدة 10 دقائق ؛ ثم, بيليه الخلايا في 6,000 × غرام لمدة 1 دقيقة. تصلب الجيلاتين على الجليد لمدة 30 دقيقة.
- لإزالة الخلايا المضمنة بالجيلاتين من الأنبوب ، اقطع طرف الأنبوب الذي يحتوي على الحبيبات من بقية الأنبوب بشفرة حلاقة. ثم ، عموديا على القطع الأول ، قم بقطع نهاية الأنبوب بحبيبات الخلية إلى النصف.
- احتضان نصفي نهاية الأنبوب المحتويين على حبيبات الخلايا المدمجة بالجيلاتين في سكروز 2.3 متر لمدة 10 دقائق عند 4 درجات مئوية. يؤدي هذا إلى تقلص نصفي حبيبات الخلايا المضمنة في الجيلاتين قليلا وإزاحتها من الأنبوب البلاستيكي.
ملاحظة: يجب حفظ كريات الخلايا المضمنة في الجيلاتين عند 4 درجات مئوية أو باردة قدر الإمكان لتجنب أن يصبح السكروز 2.3 متر لزجا جدا والجيلاتين ناعما جدا. أثناء معالجة كريات الخلايا المضمنة بالجيلاتين في الخطوات التالية ، اعمل مع عينة واحدة فقط في كل مرة واحتفظ بالعينات الأخرى على الجليد ، أو اعمل في غرفة باردة (~ 4 درجة مئوية). تجنب ارتفاع درجة حرارة الكريات الخلوية المضمنة بالجيلاتين بواسطة أشعة الشمس, مصابيح المجهر الساخنة, أو مصادر الحرارة الأخرى. - قم بإزالة نصفي الأنبوب باستخدام حبيبات الخلية المضمنة في الجيلاتين من السكروز 2.3 متر. بعد ذلك ، قم بإزالة نصفي حبيبات الخلية المضمنة بالجيلاتين من نصفي الأنبوب البلاستيكي بالملاقط. قطع الحبيبات يدويا إلى كتل ذات حجم مناسب (~ 1 مم3) بشفرة حلاقة. استخدم مجهر تشريح ستيريو لتكبير الهدف أثناء القطع.
- قم ببث كتل الخلايا المضمنة بالجيلاتين مع 2.3 M سكروز لمدة 3-16 ساعة ، مع التقليب من طرف إلى طرف في دوار عند 4 درجات مئوية.
- ضع كتلة خلية مدمجة بالجيلاتين على دبوس حامل عينة من الألومنيوم (انظر الخطوة 1.2.1). اترك ما يكفي من السكروز 2.3 متر حول حواف الكتلة بحيث تشكل "طوقا" رفيعا بين الكتلة والدبوس. تجنب الكثير من السكروز 2.3 متر الذي يغطي الجزء العلوي من الكتلة. قم بتجميدها وتخزينها في LN2.
3. التقسيم
- التشذيب (انظر أيضا12)
- خذ دبوسا به كتلة من الخلايا المضمنة في الجيلاتين من تخزين LN2 وضعه داخل microtome cryomicrotome مضبوطا على -80 درجة مئوية.
- تقليم الجزء الأمامي من الكتلة لتسطيح سطحها والحصول على أقسام ~ 250 نانومتر. اغمس الحلقة 3 مم في محلول الالتقاط (1: 1 2.3 م سكروز و 2٪ ميثيل سلولوز) ، وأدخل الحلقة في غرفة التبريد في الميكروتوم ، وانتظر حتى يبدأ الجليد في التكون في القطرة (عادة 5-7 ثوان). بعد ذلك ، التقط القسم على الفور عن طريق الضغط بسرعة ولكن برفق على القطرة ضدهم. قم بإزالة الحلقة من غرفة التبريد ، وانتظر حتى تذوب القطرة تماما ، واضغط على القطرة على شريحة زجاجية.
- تحقق من اتجاه الخلية عن طريق تلطيخ التولويدين الأزرق للأقسام.
- ضع قطرة من محلول التولويدين الأزرق (انظر الملف التكميلي 1) أعلى الأقسام على شريحة زجاجية وجففها على لوحة تسخين 80 درجة مئوية حتى تجف حواف القطرة.
- قم بإزالة الشريحة الزجاجية من لوحة التسخين وشطف التولويدين الأزرق برفق بعيدا باستخدام dH2O ، واجمعها في حاوية نفايات مناسبة.
- جفف الشريحة الزجاجية وتحقق من اتجاه الخلية في الأقسام من خلال مجهر ضوئي بسيط على الطاولة.
- قم بقص جوانب الكتلة عن طريق تقسيم 50-100 ميكرومتر في جانب وجه كتلة العينة باستخدام زاوية السكين. قم بقص أربعة جوانب من وجه كتلة العينة عن طريق تدوير حامل العينة 90 درجة بعد تقليم كل جانب لإنشاء مستطيل بارز ~ 250 ميكرومتر × 375 ميكرومتر. حدد المنطقة البارزة بناء على اتجاه الخلية المحدد في الخطوة السابقة.
- التقسيم والاستلام
- قم بتبريد الميكروتوم المبرد إلى -100 درجة مئوية. قسم شريط من المستطيل البارز ، يبلغ سمك المقاطع 70-90 نانومتر ولمعان ذهبي فضي. قم بتوجيه الأقسام بعيدا عن حافة السكين الماسي بشعر على عصا (انظر القسم 1.2.3) لإنشاء شريط طويل (2-5 مم).
- بمجرد تكوين شريط مناسب ، توقف عن التقسيم لالتقاط الشريط. اغمس حلقة الالتقاط 3 مم في 2.3 متر سكروز و 2٪ ميثيل سلولوز مختلط 1: 1 ، وأدخل الحلقة في غرفة التبريد في الميكروتوم ، وانتظر حتى تبدأ القطرة في التجمد (عادة 5-7 ثوان). ثم ، التقط الأقسام على الفور عن طريق الضغط بسرعة ولكن برفق على القطرة ضدها. قم بإزالة الحلقة من غرفة التبريد ، وانتظر حتى تذوب القطرة تماما ، واضغط على القطرة على شبكة معدة (الخطوة 1.2.6).
ملاحظة: يمكن تخزين الشبكات ذات المقاطع عند 4 درجات مئوية لعدة أشهر.
4. وضع العلامات والمجهر الضوئي
- وصفها
- ضع الشبكات مع أقسام (الشكل 1 أ) جانب القسم لأسفل على ~ 1 مل من PBS في طبق صغير أو طبق متعدد الآبار. احتضان على حرارة 37 درجة مئوية لمدة 30 دقيقة.
ملاحظة: هذه الخطوة تزيل الجيلاتين الموجود بين الخلايا; ليست هناك حاجة إلى الجيلاتين بعد التقسيم ويتداخل مع البروتوكول المتبقي. - قم بمعالجة جانب قسم الشبكات لأسفل على ~ 75 ميكرولتر قطرات على parafilm (انظر الشكل 1B). ابدأ ب PBS + 0.15٪ غسول جليكاين (3 × 2 دقيقة) في RT. بعد ذلك ، احتضن الشبكات بنسبة 0.1٪ من ألبومين مصل الأبقار (BSA) -c + 0.5٪ جيلاتين جلد السمك (FSG) في برنامج تلفزيوني لمدة 10 دقائق في RT كخطوة مانعة. تمييع الأجسام المضادة الأولية في 0.1٪ BSA-c + 0.5٪ FSG في PBS واحتضان الشبكات على ~ 10 قطرات ميكرولتر من هذا الحل لمدة 1 ساعة في RT (الشكل 1C).
- اغسل الشبكات بنسبة 0.1٪ من مساحة سطح القمر في PBS 5x في RT. بعد ذلك ، قم بتخفيف الأجسام المضادة الثانوية و 4 '، 6-diamidino-2-phenylindole (DAPI ؛ 10 ميكروغرام / مل) في 0.1٪ BSA-c + 0.5٪ FSG في PBS واحتضان الشبكات على ~ 10 قطرات ميكرولتر من هذا المحلول لمدة 30+ دقيقة في RT (الشكل 1C). اغسل الشبكات في PBS 5x في RT.
ملاحظة: اختياريا ، يمكن تسمية الجسم المضاد الثانوي بجزيئات الذهب الغروية 5 أو 10 أو 15 أو 20 نانومتر مترافقة مع البروتين A (PAG) لتوطين البروتين محل الاهتمام في EM. إذا كان ذلك مطلوبا ، فقم باحتضان الشبكات باستخدام PAG لمدة 20 دقيقة في RT بعد الخطوة 4.1.3. ثم اغسل 5 مرات باستخدام PBS في RT. تجنب الاستخدام المتزامن للأجسام المضادة الأولية المتعددة ولاحظ تفاعل PAG مع IgGs للأنواع المختلفة لمنع التفاعلات المتقاطعة غير المرغوب فيها. لمزيد من المعلومات، راجع12.
- ضع الشبكات مع أقسام (الشكل 1 أ) جانب القسم لأسفل على ~ 1 مل من PBS في طبق صغير أو طبق متعدد الآبار. احتضان على حرارة 37 درجة مئوية لمدة 30 دقيقة.
- تركيب عينات للفحص المجهري الضوئي
- اغمر الشبكات في 50٪ جلسرين في dH 2 O2× 5 دقائق في RT. قم بشطيرة الشبكات بين شريحة زجاجية وغطاء في 50٪ جلسرين ، شبكة واحدة لكل غطاء ، مع أقسام تواجه غطاء الغطاء (الشكل 1 د).
ملاحظة: يمكن أن تتدهور جودة الملصقات عندما يتم الاحتفاظ بالشبكات مثبتة في 50٪ من الجلسرين لأكثر من 30 دقيقة. لذلك يوصى بتركيب وتصوير شبكتين أو ثلاث شبكات في وقت واحد وترك الشبكات الأخرى على حل الملصقات الثانوي.
- اغمر الشبكات في 50٪ جلسرين في dH 2 O2× 5 دقائق في RT. قم بشطيرة الشبكات بين شريحة زجاجية وغطاء في 50٪ جلسرين ، شبكة واحدة لكل غطاء ، مع أقسام تواجه غطاء الغطاء (الشكل 1 د).
- المجهر الضوئي
- خذ شريحة زجاجية مع شبكات محصورة إلى مجهر واسع المجال مع مرحلة آلية. حدد هدفا زيتيا عالي التكبير (63x أو 100x). قم بإنشاء مجموعة تجانب صورة من (جزء من) شريط الأقسام (الشكل 1E).
ملاحظة: يمكن لبعض الأجسام المضادة الثانوية تكوين مجاميع فلورية على الشبكات ، خاصة حول الطيات أو التمزقات في الأقسام. بالإضافة إلى ذلك ، تحتوي بعض أنواع الخلايا والأنسجة على هياكل ذاتية الفلورسنت. إذا كانت مثل هذه المشكلات متوقعة ، ينصح بتضمين شبكة تحكم سلبية غير محتضنة بجسم مضاد أولي.
- خذ شريحة زجاجية مع شبكات محصورة إلى مجهر واسع المجال مع مرحلة آلية. حدد هدفا زيتيا عالي التكبير (63x أو 100x). قم بإنشاء مجموعة تجانب صورة من (جزء من) شريط الأقسام (الشكل 1E).
- فك و EM التباين
- أضف 10 ميكرولتر من dH2O إلى جانب شطيرة غطاء الشريحة الزجاجية وانتظر العمل الشعري لملء واجهة شطيرة الغطاء الزجاجي. قم بإزالة الغطاء بعناية دون خلط زيت الغمر في الجلسرين. استرجع الشبكات بملاقط واغمرها في dH2O 3x في RT لغسل 50٪ من الجلسرين.
ملاحظة: يمكن أن يتداخل الزيت مع تلطيخ اليورانيل ويؤدي إلى تدهور تباين EM. - جفف الجزء الخلفي من الشبكة بعناية باستخدام مناديل ورقية خالية من النسالة.
ملاحظة: إذا تم تمييز العينة أيضا بجزيئات الذهب الغروية ، فقم بتنفيذ الخطوات التالية: ضع الشبكة مع أقسام جانب القسم لأسفل على قطرات PBS واغسل 2x في RT. Postfix في 1٪ GA لمدة 5 دقائق في RT (انظر ملاحظة التحذير تحت 1.1.4). اغسل في PBS 2x في RT. - ضع جانب قسم الشبكات لأسفل على قطرات dH2O واغسل 8x في RT.
- لتلطيخ أقسام التباين في EM ، احتضان مع خلات اليورانيل (UA) ، درجة الحموضة 7 ، لمدة 5 دقائق في RT (الشكل 1F).
- قبل وضع الشبكات ، قم بتبريد UA: methylcellulose ، الرقم الهيدروجيني 4 ، عن طريق وضع قطرات على parafilm على لوحة معدنية على الجليد. بعد ذلك ، اغسل الشبكات باستخدام UA البارد المثلج: ميثيل سلولوز ، درجة الحموضة 4 ، 2x واحتضانها باستخدام UA البارد المثلج: ميثيل سلولوز ، درجة الحموضة 4 ، لمدة 10 دقائق (الشكل 1F).
تنبيه: أسيتات اليورانيل مادة كيميائية خطرة (بيانات الخطر H300 ، H330 ، H373 ، H411). في الخطوات التي تتطلب UA ، اعمل في غطاء كيميائي وارتد معدات واقية (معطف المختبر والقفازات والنظارات الواقية). جمع والتخلص من النفايات التي تحتوي على UA وفقا لإرشادات ولوائح المعاهد. - قم بإخراج الشبكات عن طريق إدخال حلقة تجفيف الشبكة في UA: قطرة ميثيل سلولوز أسفل الشبكة وارفعها برفق حتى يتم سحب الشبكة من القطرة12. امسح UA: methylcellulose الزائد بعيدا عن طريق لمس الحلقة بزاوية ~ 60 درجة (الأقسام متجهة لأسفل) على ورق ترشيح خال من النسالة (انظر جدول المواد) واسحبه ببطء على طول الورق حتى لا يتم امتصاص المزيد من UA: methylcellulose . بعد ذلك ، ضع الحلقة مع الشبكة في رف مناسب واتركها تجف لمدة >10 دقائق في RT (الشكل 1G).
- أضف 10 ميكرولتر من dH2O إلى جانب شطيرة غطاء الشريحة الزجاجية وانتظر العمل الشعري لملء واجهة شطيرة الغطاء الزجاجي. قم بإزالة الغطاء بعناية دون خلط زيت الغمر في الجلسرين. استرجع الشبكات بملاقط واغمرها في dH2O 3x في RT لغسل 50٪ من الجلسرين.
5. م
- استخدم النظرة العامة التي تم الحصول عليها بواسطة المجهر الضوئي لتحديد منطقة الاهتمام (ROI) للتصوير في المجهر الإلكتروني النافذ (TEM; الشكل 1H). أضف تعليقا توضيحيا على عائد الاستثمار على مجموعة بيانات الفحص المجهري الضوئي. بمجرد تحديد منطقة، احصل على مجموعة تجانب للصورة عند تكبير 20,000x-50,000x في TEM. أعد إنشاء مجموعة تجانب الصور في برنامج ما بعد المعالجة15,16.
6. الارتباط والتحليل
- قم بتحميل المجهر الضوئي ومجموعة بيانات EM في برنامج معالجة الصور المناسب ، مثل ImageJ / Fiji17 ، أو المكون الإضافي ec-CLEM في Icy18 ، أو Photoshop. قم بقص مجموعة بيانات الفحص المجهري الضوئي وتدويرها لمطابقة مجموعة تجانب EM.
- قم بإجراء الارتباط بناء على إشارة DAPI في التألق والخطوط العريضة النووية في EM (الشكل 1I). قم بتحويل الصور لتراكبها بدقة وقم بإجراء الارتباط اليدوي بدقة. لجعل النهج أكثر دقة ، قم بتطبيق الارتباط المستند إلى المعالم من خلال ، على سبيل المثال ، المكون الإضافي ec-CLEM في Icy أو المكون الإضافي BigWarp في ImageJ ، لربط الصور من خلال التحديد اليدوي للنقاط المقابلة. يتوفر بروتوكول مفصل خطوة بخطوة للارتباط مع ec-CLEM19.
ملاحظة: يعمل هذا النهج أيضا بشكل جيد مع استخدام المجسات الائتمانية ثنائية النمط20,21.
- قم بإجراء الارتباط بناء على إشارة DAPI في التألق والخطوط العريضة النووية في EM (الشكل 1I). قم بتحويل الصور لتراكبها بدقة وقم بإجراء الارتباط اليدوي بدقة. لجعل النهج أكثر دقة ، قم بتطبيق الارتباط المستند إلى المعالم من خلال ، على سبيل المثال ، المكون الإضافي ec-CLEM في Icy أو المكون الإضافي BigWarp في ImageJ ، لربط الصور من خلال التحديد اليدوي للنقاط المقابلة. يتوفر بروتوكول مفصل خطوة بخطوة للارتباط مع ec-CLEM19.
- قم بتحليل الصور المرتبطة عن طريق تحديد عائد الاستثمار بناء على إشارة الفلورسنت في برنامج مناسب (على سبيل المثال ، ImageJ). للتحليل الكمي ، قم بإنشاء مجموعة من عائد الاستثمار لجميع العضيات المصنفة. بعد ذلك ، افحص البنية التحتية المقابلة لعائد الاستثمار الفردي وصنفها بناء على العناصر المورفولوجية.
النتائج
تم مؤخرا نشر بروتوكول EM المناعي الأمثل لوضع العلامات المناعية الذهبية ل LC3 على عمليات التجميد فائقة النحافة بواسطة De Maziere et al.9. تضمنت هذه الدراسة حالات الجوع بدون BafA1 ، حيث كان LC3 موجودا ولكنه نادر نسبيا ويصعب العثور عليه بواسطة EM. تم تقديم طريقة CLEM في المقطع في دراسة منفصلة ، والتي تستخدم حساسية وضع العلامات الفلورية لتصور البروتينات الداخلية النادرة نسبيا والمنخفضة التعبير عنها وربط ذلك بالبنية التحتية EM14. هنا ، يتم الجمع بين هذين النهجين من خلال استخدام بروتوكول وضع العلامات LC3 المحسن كجزء من نهج CLEM.
تم تجويع خلايا HEPG2 ، وهي خلايا مشتقة من الكبد ذات مستويات عالية نسبيا من الالتهام الذاتيالقاعدي 22 ، في الحد الأدنى من الوسط (محلول ملح إيرل المتوازن [EBSS]) لمدة 2 ساعة قبل التثبيت في 4٪ PFA. تبع ذلك تحضير العينة بطريقة توكوياسو للتقسيم بالتبريد فائق النحافة (الأقسام 1-3 ؛ انظر الفتحة و Geuze12) ، والتي تتوافق بشكل كبير مع CLEM14،23 في المقطع. تم تصنيف عمليات التجميد المذابة بشكل فلوري (قسم البروتوكول 4 والشكل 1) باستخدام الجسم المضاد الأساسي للفأرLC3 9. بالإضافة إلى ذلك ، تم استخدام الأرنب المضاد ل LAMP1 للإشارة إلى الجسيمات الداخلية ، تليها الأجسام المضادة المضادة للفأر AlexaFluor488 والأجسام المضادة الثانوية المضادة للأرانب AlexaFluor568. كانت الشبكات محصورة بين غطاء وشريحة زجاجية وتم تصويرها في RT على مجهر واسع المجال (هدف زيت 100x 1.47 NA ، كاميرا sCMOS).
تتمثل ميزة وضع العلامات الفلورية للأقسام الرقيقة على IF التقليدية للخلية الكاملة في الدقة المتزايدة في Z ، نظرا لأن السماكة الفيزيائية للقسم هي 60-90 نانومتر. مع دقة Z المحسنة هذه ، يكشف وضع العلامات الفلورية ل LC3 و LAMP1 على المقاطع الرقيقة عن القليل جدا من التمركز المشترك (الشكل 2A). في الخلايا المعالجة بمثبطات الليزوزومات ، مثل BafA1 ، يحدث تمركز مشترك مرتفع ، حيث يظل LC3 المغلق بالليزوزوم غير متحلل9. في الخلايا غير المعالجة ، يتحلل LC3 بسرعة عند ملامسته للجسيمات الحالة النشطة إنزيميا والإيجابية LAMP1 ، وبالتالي فإن التوطين المشترك نادر في هذه الحالات. بشكل عام ، لوحظ أقل من نقطة LC3 واحدة لكل ملف تعريف خلية. يشير هذا إلى أنه حتى في ظروف الجوع ، يكون معدل دوران البلعمة الذاتية سريعا ، مما يحافظ على انخفاض أعداد البلعمة الذاتية. كما يسلط الضوء على أهمية استخدام CLEM للعثور على الهياكل النادرة التي تحمل علامة LC3 ، باستخدام مجال الرؤية الكبير الذي يوفره الفحص المجهري الضوئي. علاوة على ذلك ، فإن الحساسية العالية لوضع العلامات الفلورية مقارنة بوضع العلامات الذهبية تمكن من تحديد عضيات إيجابية LC3 أكثر من العضيات المناعية التقليدية ، مما يساعد على توصيفها.
بعد الحصول على مجموعة مربعات كاملة من شريط الأقسام ، تم استرداد الشبكات من المجهر وملطخة بعد EM باستخدام UA وطريقة الحلقة (خطوات البروتوكول 4.4-4.6 ؛ الشكل 1F ، G). تضمن طريقة "الحلقة الخروجية" هذه بقاء طبقة رقيقة من UA: methylcellulose على الشبكة ، مما يخلق التباين المطلوب في EM. يعتمد سمك الطبقة على السرعة والزاوية التي يتم بها مسح UA: methylcellulose على ورق الترشيح. يمكن أن يؤدي سحب الحلقة بسرعة كبيرة إلى ترك الكثير من UA: methylcellulose على الشبكة وتغميق مظهر الأقسام في EM. يمكن أن يؤدي السحب ببطء شديد إلى سحب الكثير من UA: methylcellulose بعيدا ، مما يؤدي إلى القليل جدا من التلوين وضعف التشكل ، ويخاطر بسقوط الشبكة خارج الحلقة. يشير تلوين "بقعة الزيت" (الشكل 1 ج) على الشبكات الجافة إلى سمك طبقة UA: ميثيل سلولوز مناسب.
بعد الخروج والتجفيف ، تم تصوير الشبكات في TEM عند عائد الاستثمار المحدد بواسطة التألق. تم ربط مجموعات بيانات IF و EM عن طريق تراكب إشارة DAPI على الخطوط العريضة للنوى المرئية في EM ، مما أدى إلى إنشاء صورة متكاملة تحتوي على معلومات عن كلتا الطريقتين.
قد يكون العثور على نفس المنطقة في EM كما هو محدد في IF أمرا صعبا. لذلك يوصى بالاحتفاظ بصورة عامة لمجموعة تجانب IF في متناول اليد أثناء البحث في EM. يجب على المستخدمين البحث عن ميزات يمكن التعرف عليها في كلتا الطريقتين ، مثل الطيات أو التمزقات في الأقسام أو أشرطة الشبكة أو ترتيب النوى. من المهم أيضا أن تضع في اعتبارك أن العينة يمكن أن تظهر دوارة ومعكوسة في EM. يمكن استخدام "شبكات الباحث" ذات الميزات المحددة لتحديد المناطق لتسهيل الارتباط (انظر جدول المواد).
كشف ارتباط العضيات الإيجابية LC3 بالبنية التحتية EM أن النقاط المختلفة تمثل مراحل متميزة من الالتهام الذاتي (الشكل 2B). على الرغم من أن الحفاظ على البنية التحتية البلعمية الذاتية يمثل تحديا في عمليات التجميد ، فقد لوحظ بشكل متكرر عضيات ذات محتوى سيتوبلازمي وأغشية مزدوجة (الشكل 2C ، الأسهم في العضيات 1-5 ؛ الشكل 2C ، الأسهم في العضيات 1-5 ؛ الشكل 2C ، السهام في العضيات 1-5 ؛ الشكل 2C ، السهام في العضيات 1-5 ؛ الشكل 2C ، السهام في العضيات 1-5 ؛ الشكل 2C ، السهام في العضيات 1-5 ؛ الشكل 2C ، السهام في العضيات 1-5 ؛ الشكل 2C ، السهام في العضيات 1-5 ؛ الشكل 2C ، الشكل التكميلي S1) ، والتي تحدد السمات المورفولوجية للجسيمات الذاتية. ومن المثير للاهتمام ، تم تحديد بقع الفلورسنت الضعيفة إلى حد ما بواسطة EM على أنها جسيمات ذاتية إيجابية LC3 (الشكل 2C ، عضية 6 ؛ يتم تمييز محتوى الالتهام الذاتي *) ، والتي تتميز بمحتوى كثيف وحويصلات داخل اللمعة. أظهر هذا أن كميات صغيرة جدا من LC3 مرئية في IF من عمليات التجميد فائقة النحافة ، وأشار إلى أنه على الرغم من الوسط المتحلل ، يمكن اكتشاف بعض LC3 في التحلل الذاتي في الحالة المستقرة. ومع ذلك ، فإن غالبية النقاط الموجبة ل LC3 تمثل البلعمة الذاتية ، في حين أن التحلل الذاتي كان نادرا جدا. هذا على النقيض من الخلايا المعالجة ب BafA1 ، والتي تتراكم بشكل أساسي التحلل الذاتي وليس البلعمةالذاتية 9.
باختصار ، يصف هذا البروتوكول طريقة CLEM في المقطع لربط المعلومات الجزيئية التي تم الحصول عليها عن طريق الفحص المجهري الفلوري بالبنية التحتية ل EM. تزيد هذه الطريقة من حساسية EM-EM المناعية ، حيث يتم استخدام الفلوروفورات فقط لوضع العلامات وهذه تعطي عموما إشارة أكثر من مجسات EM. هذه الطريقة مناسبة بشكل خاص لاستخدام عمليات التجميد فائقة النحافة ، حيث يمكن الحصول على مستويات عالية من التألق النوعي على تلطيخ الخلفية المهمل. باستخدام التألق لفحص الهياكل أو الأحداث النادرة وربط عائد الاستثمار المحدد ب EM ، يمكن تقليل وقت تشغيل EM والتكاليف المرتبطة به بشكل كبير. تتجلى حساسية وجدوى الطريقة من خلال تصور LC3 في الخلايا الجائعة غير المعالجة ، مما يدل على أن LC3 يرتبط في الغالب بالبلعمة الذاتية في هذه الظروف ، مع وجود مستويات منخفضة جدا مرئية في التحلل الذاتي.
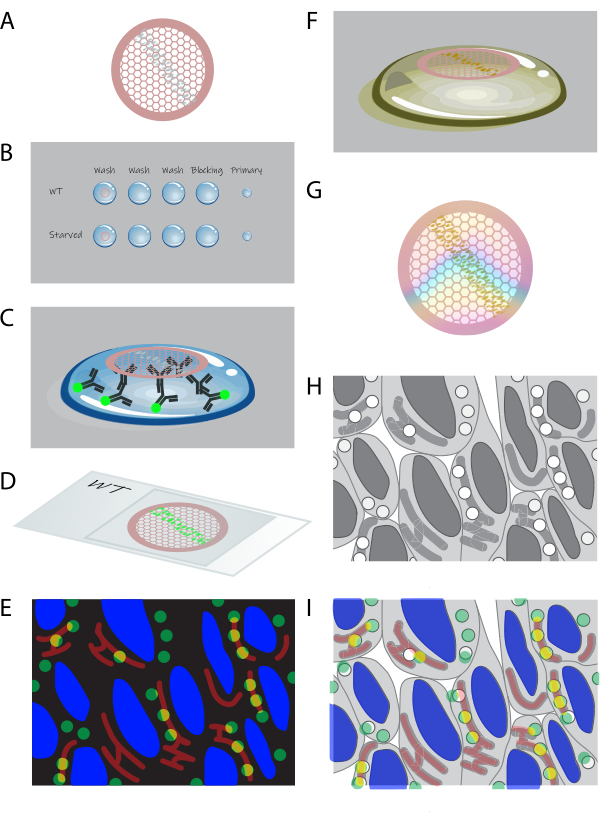
الشكل 1: نظرة عامة تخطيطية على CLEM في المقطع . (أ) تجمع عمليات الاستئصال بالتبريد من الخلايا المدمجة في الجيلاتين على شبكة نحاسية مغلفة بالشكلفار. (ب) تتم معالجة الشبكات من قسم لأسفل على قطرات من المحاليل المناسبة. (ج) تلصق على الشبكات بأجسام مضادة أولية وفلورية ثانوية. (د) تقع الشبكات بين غطاء منزلق وشريحة زجاجية في 50٪ من الجلسرين. ه: تجمع الصور الفلورية في مجهر واسع المجال. (F) يتم استرداد الشبكات من الشريحة الزجاجية ومعالجتها بشكل أكبر عن طريق تلطيخ اليورانيل ل EM. (ز) بعد التجفيف ، يمكن تصوير الشبكات بواسطة TEM. (H) يتم الحصول على مجموعة تجانب صور TEM عالية التكبير من منطقة مختارة من بيانات التألق. (I) الصور من المجهر الفلوري و EM مترابطة ومتراكبة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
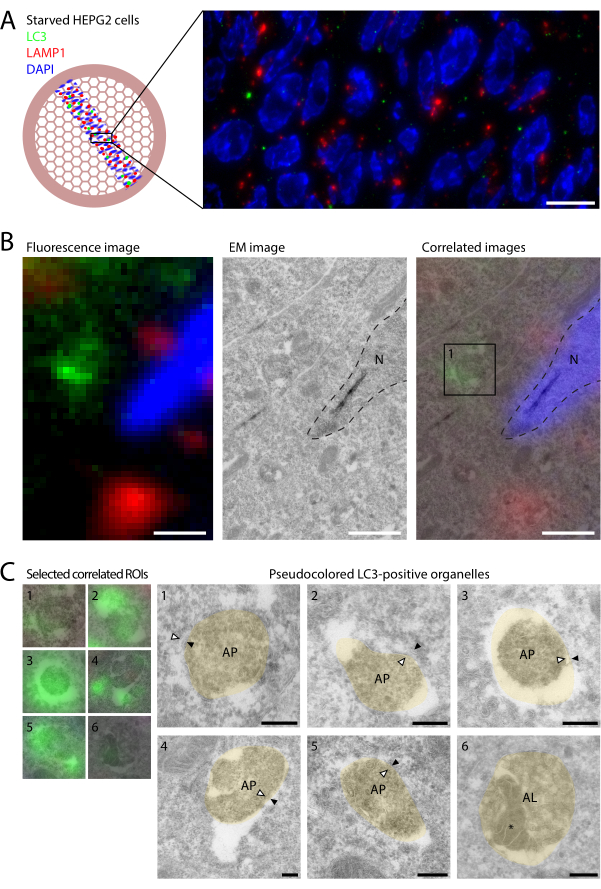
الشكل 2: CLEM من LC3 و LAMP1 في خلايا HEPG2 الجائعة. تم تجويع خلايا HEPG2 لمدة ساعتين في EBSS قبل التثبيت بنسبة 4٪ PFA لمدة ساعتين. (A) يكشف تصوير IF ل LC3 (أخضر) و LAMP1 (أحمر) على المقاطع عن عدد قليل نسبيا من نقاط LC3 والقليل من التمركز المشترك مع LAMP1. (ب) ربط المعلومات الجزيئية من IF (اللوحة اليسرى) بالمعلومات الهيكلية الفائقة التي تم الحصول عليها في EM (اللوحة الوسطى) عن طريق تراكب طريقتي التصوير على أساس DAPI والخطوط العريضة النووية (الخطوط المتقطعة ، اللوحة اليمنى). تظهر البنية التحتية للمقصورات الفردية التي تحمل علامة LC3 ، كما يتضح من المربع 1 (اللوحة اليمنى) ، في C. (ج) البنية التحتية للمقصورات الموجبة LC3. يتم عرض صور CLEM على اليسار وصور EM شبه الملونة (البيج) على اليمين (تظهر صور EM غير الملونة في الشكل التكميلي S1). يشار إلى الأغشية البلعمية الذاتية الداخلية والخارجية بواسطة رؤوس الأسهم البيضاء والسوداء ، على التوالي. يشار إلى محتوى الالتهام الذاتي داخل التحلل الذاتي في المثال 6 ب *. قضبان المقياس = 10 ميكرومتر (أ) ، 1 ميكرومتر (ب) ، 200 نانومتر (ج). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي S1: صور EM غير ملونة للعضيات الإيجابية LC3. (أ-و) صور EM غير ملونة للأمثلة الزائفة الملونة 1-6 الموضحة في الشكل 2C. تم اختيار العضيات بواسطة مضان LC3 ، كما هو موضح في الشكل 2. يشار إلى الأغشية البلعمية الذاتية الداخلية والخارجية بواسطة رؤوس الأسهم البيضاء والسوداء ، على التوالي. يشار إلى محتوى الالتهام الذاتي داخل التحلل الذاتي في المثال 6 ب *. أشرطة المقياس = 200 نانومتر. الاختصارات: AL = التحلل الذاتي. AP = البلعمة الذاتية. م = الميتوكوندريا. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 1: المخازن المؤقتة والحلول المستخدمة في هذه الدراسة. يحتوي هذا الملف التكميلي على الوصفات والبروتوكولات اللازمة لعمل المخازن المؤقتة والحلول المستخدمة في هذه الدراسة. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
تستفيد الطريقة المعروضة هنا من التطورات الحديثة في CLEM القائم على المقطع بالتبريد - الحساسية العالية لوضع العلامات IF والارتباط الدقيق (<خطأ 100 نانومتر) بين FM و EM14,24. ينتج عن هذا طريقة ذات حساسية لتسمية البروتينات النادرة والداخلية الفلورية والقدرة على تراكب ذلك بدقة عالية مع البنية التحتية EM. وبالتالي ، فإن هذه الطريقة تتجنب الحاجة إلى (إفراط) التعبير عن البروتينات الموسومة خارجيا واستخدام ملصقات EM أقل حساسية. تظهر جدوى الطريقة من خلال أمثلة CLEM على LC3 الداخلي في الخلايا الجائعة ، دون استخدام مثبطات الليزوزومات.
تعتبر عمليات التجميد المذابة التي تم الحصول عليها باستخدام طريقة Tokuyasu عينات مثالية للمناعة EM ، على عكس أقسام الراتنج ، فهي قابلة للاختراق للأجسام المضادة. إلى جانب التثبيت المعتدل والإجراءات المتناقضة ، ينتج عن هذا بشكل عام كفاءة رائعة في وضع العلامات على الطرق الأخرى دون المساس بالبنية التحتية التفصيلية ، ويصور الأغشية الخلوية بشكل ممتاز12،25،26. علاوة على ذلك ، فإن عمليات التقطيع بالتبريد متوافقة للغاية مع الفحص المجهري الفلوري ، مما يجعلها ركائز قيمة ل CLEM. قدم كل من وضع العلامات المناعية الكلاسيكية و CLEM على عمليات التجميد رؤى أساسية في فهم التنظيم تحت الخلوي14،27،28،29،30.
في الوقت الحالي ، أصبحت تطبيقات CLEM على عمليات التجميد المذابة أكثر انتشارا ، نتيجة للتطورات والتحسينات المستمرة 14،20،24،31،32،33،34 التي حسنت جودة النهج وقابليته للتطبيق ودقته. الآن ، من خلال الارتباط الدقيق لمجموعات تجانب الصور الكبيرة IF و EM ، تسهل التقنية فحص البنية التحتية للمكونات الخلوية الداخلية ذات العلامات الفلورية14،32،33. هذه ميزة على EM المناعي الكلاسيكي ، حيث يتطلب البحث عن الهياكل ذات العلامات الذهبية عادة تكبيرا عاليا ، وبالتالي فهو أكثر شاقة ويستغرق وقتا طويلا. ولهذا السبب ، فإن توطين LC3 إلى البنية التحتية يستفيد بشكل كبير من CLEM. العضيات الإيجابية LC3 شائعة عندما يتم حظر إزالة الالتهام الذاتي (أي عندما يتم التعامل مع الخلايا ب BafA1 أو عوامل رفع الأس الهيدروجيني) ، في حين يتم إزالة عضيات الالتهام الذاتي بسرعة في الخلايا غير المتغيرة أو الجائعة ، مما يؤدي إلى مستويات منخفضة جدا من الحالة المستقرة. في مثل هذه الظروف ، قد يكون العثور على عضيات تحمل علامة LC3 باستخدام EM المناعي الكلاسيكي أمرا صعبا ، ويوفر CLEM ميزة واضحة.
في السابق ، تم تطبيق CLEM على أقسام الراتنج في الدراسات باستخدام التعبير خارج الرحم ل LC3-GFP أو مسبار ترادفي LC3-GFP-RFP35،36،37،38،39. في هذه الدراسات ، تم إجراء التصوير الفلوري قبل التضمين أو مباشرة في أقسام راتنج الأكريليك40 ، وتم فحص العينات لاحقا بواسطة EM. هناك العديد من المزايا لتضمين الراتنج. يتم الحفاظ على البنية التحتية البلعمية الذاتية بشكل جيد بشكل عام ، خاصة إذا كانت المادة مجمدة بضغط عال40. علاوة على ذلك ، فإن تباين المواد المدمجة في الراتنج الملطخة بالمعادن الثقيلة يكون بشكل عام أكثر وضوحا من تباين عمليات التجميد الملطخة باليورانيل. تتوافق المقاطع المضمنة بالراتنج مع طرق EM الحجمية ، مثل التصوير المقطعي للصفيف أو FIB-SEM أو SEM التسلسلي blockface ، في حين أن عمليات التقطيع بالتبريد ليست كذلك. في الأساليب التي تقوم بالتصوير قبل التضمين ، يعد تصوير الخلايا الحية خيارا41 غير متوفر في CLEM في عمليات الاستئصال بالتبريد. الميزة الرئيسية ل CLEM على عمليات التجميد على هذه البدائل هي إشارة IF العالية ، مما يسمح بالتوطين المناعي للبروتينات النادرة دون الحاجة إلى نفاذية الغشاء أو الإفراط في التعبير. هذا يتجنب استخراج الغشاء المحتمل ، والإفراط في التعبير عن المصنوعات اليدوية42 والتعديل الوراثي للموضوع ، والذي ، جنبا إلى جنب مع إمكانية ربط مساحات كبيرة في IF و EM ، يجعله أداة ممتازة لدراسة LC3 والالتهام الذاتي.
هنا ، كشف تطبيق CLEM على المقطع على خلايا HEPG2 الجائعة أن LC3 موضعي في الغالب إلى الهياكل التي تم تحديدها على أنها البلعمة الذاتية. بالإضافة إلى ذلك ، تم العثور على عدد قليل من البقع الفلورية الضعيفة في التحلل الذاتي. هذا يتناقض بشكل مباشر مع الخلايا المعالجة ب BafA19 ويعكس التدهور السريع للبروتينات البلعمية الذاتية بمجرد اندماج البلعمة الذاتية مع الجسيمات الحالة. بشكل عام ، أظهرت البيانات أن CLEM للتشريح المذاب يمكن أن يوفر رؤى حول الالتهام الذاتي بوساطة LC3 في الظروف الأصلية. تسلط البيانات الضوء أيضا على حساسية التكنولوجيا ، حيث تم اكتشاف LC3 حتى في التحلل الذاتي الذي يحتوي فقط على مستويات منخفضة من حوائط LC3 السليمة. سيؤدي التطبيق الإضافي لهذه التقنية عن طريق تصوير LC3 في نماذج وظروف مختلفة إلى تحسين فهمنا للالتهام الذاتي والعمليات البيولوجية الأخرى بوساطة LC3 ، مثل البلعمة المرتبطة ب LC3 أو اقتران ATG8 بالأغشية المفردة.
بالإضافة إلى الالتهام الذاتي ، يمكن تطبيق CLEM على الأحداث أو الهياكل النادرة الأخرى ، مثل انقسام الخلايا ، أو العدوى ، أو أنواع الخلايا النادرة في الأنسجة ، أو الحركية ، أو الأهداب الأولية ، أو العضيات الخاصة بنوع الخلية. يمكن للفحص الفعال للموضوع محل الاهتمام من قبل IF أن يسهل إلى حد كبير دراسة البنية التحتية لهذه النوادر. علاوة على ذلك ، تبين14 أنه يمكن استخدام هذه التقنية لتوطين البروتينات بطريقة أكثر حساسية من المناعة الكهرومغناطيسية الكلاسيكية. يمكن أن يؤدي ضبط طول التثبيت إلى زيادة هذه الحساسية ، مما يسمح بتوطين البنية التحتية للبروتينات منخفضة الوفرة جدا أو المستضدات الضعيفة. أخيرا ، تسهل طريقة CLEM المقطعية الاختيار السريع لعدد كمي من العضيات ، مما يسهل إجراء تحليل أكثر قوة للتوزيع الفائق البنية لبروتين معين.
يتطلب CLEM على عمليات الاستئصال بالتبريد المعدات والخبرة اللازمة للتشريح بالتبريد. في المجموعات التي لديها إمكانية الوصول إلى هذه الأدوات (على سبيل المثال ، cryomicrotomes) ، يكون تنفيذ CLEM في المقطع أمرا بسيطا ولا يتطلب سوى توفر مجهر آلي واسع المجال ، وهو إعداد يمكن لمعظم المختبرات الوصول إليه. علاوة على ذلك ، فإن الطريقة متاحة في مرافق EM في جميع أنحاء العالم. نظرا لأن CLEM في المقطع يجمع بين تطبيق طرق IF و EM المعمول بها ، يمكن تكييف الطريقة بسهولة ويمكن دمجها ، على سبيل المثال ، التصوير المقطعي20،33،43 ، أو حجم المقطع التسلسلي EM لعدد محدود من الأقسام 44 ، أو الفحص المجهري فائق الدقة 45. يدعم هذا التنوع في الطريقة التطبيقات على مجموعة واسعة من الأسئلة البيولوجية.
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح.
Acknowledgements
نشكر زملائنا في مركز الطب الجزيئي التابع للمركز الطبي الجامعي في أوتريخت على المناقشات والتعليقات المثمرة. نشكر الزملاء السابقين والحاليين في مختبر Klumperman لإجراء تحسينات مستمرة في تقنيات الفحص المجهري لدينا. البنية التحتية EM المستخدمة لهذا العمل هي جزء من برنامج البحث خارطة الطريق الوطنية للبنية التحتية للبحوث واسعة النطاق (NEMI) بتمويل من مجلس البحوث الهولندي (NWO) ، رقم المشروع 184.034.014 إلى JK.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals and reagents | |||
| Antibody donkey anti-mouse Alexa Fluor 488 | Life Technologies | #A21202 | use 1:250 |
| Antibody donkey anti-rabbit Alexa Fluor 568 | Life Technologies | A#10042 | use 1:250 |
| Antibody mouse anti-LC3 | Cosmo Bio | CTB-LC3-2-IC | use 1:100 |
| Antibody rabbit anti-LAMP1 | Cell Signaling | 9091 | use 1:250 |
| Bovine serum Albumin, fraction V | Sigma-Aldrich | A-9647 | |
| BSA-c | Aurion | 900.099 | |
| BSA-conjugated gold | Cell Microscopy Core, UMC Utrecht | BSAG 5 nm | |
| Water-free Chloroform | Merck | 1.02447.0500 | |
| DAPI | Invitrogen | 10184322 | Use at end concentration of 10 µg/ml |
| EGTA | Sigma-Aldrich | E4378 | |
| Fish-skin Gelatin | Sigma-Aldrich | G7765 | |
| Food-grade gelatin | Merck | G1890 | |
| Formvar, Vinylec E | SPI | 02492-RA | |
| Gluteraldehyde | Serva | 23115.01 | See CAUTION note |
| Glycerol | Boom | MBAK 7044.1000 | |
| Glycine | Merck | 1042010250 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Methylcellulose, 25 centipoises | Sigma-Aldrich | M-6385 | |
| MgSO4 | Riedel-de Haen | 12142 | |
| Na2HPO4 (PB component A) | Merck | 106580-0500 | |
| NaBH4 | Merck | 806373 | |
| NaH2PO4 (PB component B) | Merck | 106346 | |
| NH4OH | Sigma-Aldrich | 221228-0025 | |
| Oxalic acid | Merck | 100495 | |
| Paraformaldehyde prills | Sigma-Aldrich | 441244 | See CAUTION note |
| PIPES | Merck | 110220 | |
| Protein-A conjugated gold | Cell Microscopy Core, UMC Utrecht | PAG 5, 10, 15 or 20 nm | |
| Sucrose D(+) | VWR | 27483294 | |
| Uranyl acetate | SPI | 020624-AB | See CAUTION note |
| Tools and consumables | |||
| Pick-up loop | Electron Microscopy Sciences | 70944 | |
| Filter paper, qualitative, medium-fast | LLG | 6.242 668 | |
| Finder grids | Ted Pella | G100F1 | |
| Grids | Cell Microscopy Core, UMC Utrecht | CU 100 mesh | |
| Microscopes | |||
| Leica Thunder widefield microscope | Leica | Components: 100x, 1.47 NA TIRF objective; Photometrics prime 95B sCMOS camera; LAS X software; | |
| Leica UC7 ultracryomicrotome | Leica | ||
| Tecnai T12 | FEI | Components: Veleta VEL-FEI-TEC12-TEM camera; SerialEM software | |
| Software | |||
| ec-CLEM in icy | open source | Paul-Gilloteaux et al., 2017 | |
| Fiji | open source | Schindelin et al., 2012 | |
| IMOD | open source | Mastronarde et al., 2017 | |
| Photoshop | Adobe | ||
| SerialEM | open source | Mastronarde et al., 2018 |
References
- Hu, Y., Reggiori, F. Molecular regulation of autophagosome formation. Biochemical Society Transactions. 50 (1), 55-69 (2022).
- Reggiori, F., Ungermann, C. Autophagosome maturation and fusion. Journal of Molecular Biology. 429 (4), 486-496 (2017).
- Kimura, S., Noda, T., Yoshimori, T. Dissection of the autophagosome maturation process by a novel reporter protein, tandem fluorescent-tagged LC3. Autophagy. 3 (5), 452-460 (2007).
- Baba, M., Takeshige, K., Baba, N., Ohsumi, Y. Ultrastructural analysis of the autophagic process in yeast: detection of autophagosomes and their characterization. The Journal of Cell Biology. 124 (6), 903-913 (1994).
- Takeshige, K., Baba, M., Tsuboi, S., Noda, T., Ohsumi, Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. The Journal of Cell Biology. 119 (2), 301-311 (1992).
- De Duve, C., Wattiaux, R. Functions of lysosomes. Annual Review of Physiology. 28, 435-492 (1966).
- Arstila, A. U., Trump, B. F. Studies on cellular autophagocytosis. The formation of autophagic vacuoles in the liver after glucagon administration. The American Journal of Pathology. 53 (5), 687-733 (1968).
- Eskelinen, E. L., Reggiori, F., Baba, M., Kovács, A. L., Seglen, P. O. Seeing is believing: The impact of electron microscopy on autophagy research. Autophagy. 7 (9), 935-956 (2011).
- De Mazière, A., et al. An optimized protocol for immuno-electron microscopy of endogenous LC3. Autophagy. 18 (12), 3004-3022 (2022).
- López-Terrada, D., Cheung, S. W., Finegold, M. J., Knowles, B. B. Hep G2 is a hepatoblastoma-derived cell line. Human Pathology. 40 (10), 1512-1515 (2009).
- Tanida, I., Minematsu-Ikeguchi, N., Ueno, T., Kominami, E. Lysosomal turnover, but not a cellular level, of endogenous LC3 is a marker for autophagy. Autophagy. 1 (2), 84-91 (2005).
- Slot, J. W., Geuze, H. J. Cryosectioning and immunolabeling. Nature Protocols. 2 (10), 2480-2491 (2007).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Current Protocols in Cell Biology. 13 (1), (2001).
- vander Beek, J., de Heus, C., Liv, N., Klumperman, J. Quantitative correlative microscopy reveals the ultrastructural distribution of endogenous endosomal proteins. The Journal of Cell Biology. 221 (1), e202106044(2022).
- Mastronarde, D. N. Advanced data acquisition from electron microscopes with SerialEM. Microscopy and Microanalysis. 24, 864-865 (2018).
- Mastronarde, D. N., Held, S. R. Automated tilt series alignment and tomographic reconstruction in IMOD. Journal of Structural Biology. 197 (2), 102-113 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Paul-Gilloteaux, P., et al. EC-CLEM: Flexible multidimensional registration software for correlative microscopies. Nature Methods. 14 (2), 102-103 (2017).
- Heiligenstein, X., Paul-Gilloteaux, P., Raposo, G., Salamero, J. eC-CLEM: A multidimension, multimodel software to correlate intermodal images with a focus on light and electron microscopy. Methods in Cell Biology. 140, 335-352 (2017).
- Fermie, J., et al. Bimodal endocytic probe for three-dimensional correlative light and electron microscopy. Cell Reports Methods. 2 (5), 100220(2022).
- Fokkema, J., et al. Fluorescently labelled silica coated gold nanoparticles as fiducial markers for correlative light and electron microscopy. Scientific Reports. 8 (1), 13625(2018).
- Czaja, M. J., et al. Functions of autophagy in normal and diseased liver. Autophagy. 9 (8), 1131(2013).
- Robinson, J. M., Takizawa, T., Pombo, A., Cook, P. R. Correlative fluorescence and electron microscopy on ultrathin cryosections: Bridging the resolution gap. Journal of Histochemistry and Cytochemistry. 49 (7), 803-808 (2001).
- Mohammadian, S., et al. High accuracy, fiducial marker-based image registration of correlative microscopy images. Scientific Reports. 9 (1), 3211(2019).
- Tokuyasu, K. T. A study of positive staining of ultrathin frozen sections. Journal of Ultrasructure Research. 63 (3), 287-307 (1978).
- Slot, J. W., Geuze, H. J. A new method of preparing gold probes for multiple-labeling cytochemistry. European Journal of Cell Biology. 38 (1), 87-93 (1985).
- Klumperman, J., Raposo, G. The complex ultrastructure of the endolysosomal system. Cold Spring Harbor Perspectives in Biology. 6 (10), a016857(2014).
- Geuze, H. J., Slot, J. W., Strous, G. J., Lodish, H. F., Schwartz, A. L. Intracellular site of asialoglycoprotein receptor-ligand uncoupling: Double-label immunoelectron microscopy during receptor-mediated endocytosis. Cell. 32 (1), 277-287 (1983).
- Biazik, J., Ylä-Anttila, P., Vihinen, H., Jokitalo, E., Eskelinen, E. L. Ultrastructural relationship of the phagophore with surrounding organelles. Autophagy. 11 (3), 439-451 (2015).
- Fahimi, H. D., Reich, D., Völkl, A., Baumgart, E. Contributions of the immunogold technique to investigation of the biology of peroxisomes. Histochemistry and Cell Biology. 106 (1), 105-114 (1996).
- Vicidomini, G., et al. A novel approach for correlative light electron microscopy analysis. Microscopy Research and Technique. 73 (3), 215-224 (2010).
- Vicidomini, G., et al. High data output and automated 3D correlative light-electron microscopy method. Traffic. 9 (11), 1828-1838 (2008).
- Cortese, K., et al. 3D HDO-CLEM: cellular compartment analysis by correlative light-electron microscopy on cryosection. Methods in Cell Biology. 111, 95-115 (2012).
- van Rijnsoever, C., Oorschot, V., Klumperman, J. Correlative light-electron microscopy (CLEM) combining live-cell imaging and immunolabeling of ultrathin cryosections. Nature Methods. 5 (11), 973-980 (2008).
- Razi, M., Chan, E. Y. W., Tooze, S. A. Early endosomes and endosomal coatomer are required for autophagy. The Journal of Cell Biology. 185 (2), 305-321 (2009).
- Ligeon, L. A., Barois, N., Werkmeister, E., Bongiovanni, A., Lafont, F. Structured illumination microscopy and correlative microscopy to study autophagy. Methods. 75, 61-68 (2015).
- Biazik, J., Vihinen, H., Anwar, T., Jokitalo, E., Eskelinen, E. L. The versatile electron microscope: An ultrastructural overview of autophagy. Methods. 75, 44-53 (2015).
- Gudmundsson, S., Kahlhofer, J., Baylac, N., Kallio, K., Eskelinen, E. L. Correlative light and electron microscopy of autophagosomes. Methods in Molecular Biology. 1880, 199-209 (2019).
- Kriel, J., et al. Correlative light and electron microscopy (CLEM): bringing together the best of both worlds to study neuronal autophagy. Imaging and Quantifying Neuronal Autophagy. 171, 135-147 (2022).
- Largeau, C., Legouis, R. Correlative light and electron microscopy to analyze LC3 proteins in Caenorhabditis elegans embryo. Methods in Molecular Biology. 1880, 281-293 (2019).
- Fermie, J., et al. Single organelle dynamics linked to 3D structure by correlative live-cell imaging and 3D electron microscopy. Traffic. 19 (5), 354-369 (2018).
- Kuma, A., Matsui, M., Mizushima, N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy: Caution in the interpretation of LC3 localization. Autophagy. 3 (4), 323-328 (2007).
- Ladinsky, M. S., Howell, K. E. Electron tomography of immunolabeled cryosections. Methods in Cell Biology. 79, 543-558 (2007).
- Oorschot, V., Lindsey, B. W., Kaslin, J., Ramm, G. TEM, SEM, and STEM-based immuno-CLEM workflows offer complementary advantages. Scientific Reports. 11 (1), 899(2021).
- Franke, C., et al. Correlative single-molecule localization microscopy and electron tomography reveals endosome nanoscale domains. Traffic. 20 (8), 601-617 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved