Method Article
On-Section Correlative Light-Electron Microscopy를 통한 내인성 LC3의 초구조적 국소화
요약
여기서는 세포 초미세 구조와 관련된 희귀 단백질의 국소화를 조사하기 위한 도구로서 내인성 형광 표지를 기반으로 하는 최적화된 절편 상관 광전자 현미경을 위한 프로토콜을 제시합니다. 이 접근법의 힘은 바필로마이신 처리 없이 굶주린 세포에서 내인성 LC3의 초구조적 국소화에 의해 입증되었습니다.
초록
전자 현미경(EM)을 통해 초미세 구조 수준에서 자가포식 소기관의 시각화는 자가포식 과정을 이해하는 데 중요한 세부 사항을 밝히고 정체성을 확립하는 데 필수적입니다. 그러나 EM 분석법은 분자 정보가 부족한 경우가 많아 EM으로 얻은 초미구조 정보와 특정 자가포식 단백질의 형광 현미경 기반 국소화 간의 상관관계를 방해합니다. 또한, 변경되지 않은 세포 조건에서 자가포식체의 희귀성은 고배율이 필요한 EM에 의한 조사를 방해하므로 제한된 시야를 제공합니다.
이 두 가지 문제에 대한 해답으로, 형광 표지를 기반으로 하는 절편 상관 광전자 현미경(CLEM) 방법을 적용하여 일반적인 자가포식 마커인 LC3를 EM 초미세 구조와 연관시켰습니다. 이 방법은 다른 관련 마커와 함께 LC3 라벨링을 위해 형광 현미경 검사에서 세포를 신속하게 스크리닝하는 데 사용되었습니다. 그 후, 선택된 LC3 표지 스폿의 근본적인 초구조적 특징을 CLEM에 의해 식별했습니다. 이 방법은 리소좀 산성화 억제제를 첨가하지 않고 굶주린 세포에 적용되었습니다.
이러한 조건에서 LC3는 주로 자가포식체에서 발견되었으며 LC3가 급격히 분해되는 자가리소좀에서는 드물게 발견되었습니다. 이러한 데이터는 이 접근법의 타당성과 민감도를 모두 보여주며, CLEM이 약물 치료나 유전적 변형 없이 자연 조건에서 LC3 매개 자가포식에 대한 초구조적 통찰력을 제공하는 데 사용될 수 있음을 보여줍니다. 전반적으로, 이 방법은 광학 현미경을 EM 데이터에 연결하여 자가포식 단백질 및 기타 희소 항원의 초구조적 국소화 연구에 유용한 도구를 제공합니다.
서문
자가포식은 세포질 단백질과 세포소기관의 청소와 재활용을 위한 핵심 과정입니다. 거대 자가포식(이하 자가포식)의 과정은 세포가 리소좀 분해를 위해 세포질 분자와 세포소기관을 둘러쌀 수 있도록 하는 이중막 소기관인 자가포식소체의 형성을 포함합니다. 자가포식은 대부분의 세포에서 기초 수준에서 발생하며 기아 또는 세포 스트레스와 같은 세포 상태에 반응하여 상향 조절됩니다. 자가포식은 분해를 위해 특정 구조나 단백질을 표적으로 하는 기질 특이적 방식으로 발생하거나 세포질의 일부를 포함하는 비선택적 벌크 과정으로 발생합니다. 선택적 자가포식에서 자가포식체는 Atg8 계열 단백질(미세소관 관련 단백질 1A/B 경쇄 3A/B/C [LC3] 및 GABARAP)을 재활용 엔도솜, 골지체 및/또는 소포체(ER)1에서 유래한 막에 접합하여 형성됩니다. LC3는 세포질의 자가포식 화물을 직접 인식하거나 P62/SQSTM과 같은 선택적 자가포식 어댑터를 통해 인식합니다. 그런 다음 새로운 자가포식막을 LC3에 접합하고, 확장 및 융합하여 자가포식체라고 하는 화물을 둘러싸는 완성된 이중막을 형성할 수 있습니다. 자가포식체는 성숙하고 결국 엔도솜 또는 리소좀과 융합하며, 그 후 자가포식 화물과 어댑터가 분해된다2.
자가포식 형성, 성숙 및 융합에 대한 연구는 종종 광학 현미경 기술을 사용합니다. LC3의 형광 현미경은 일반적으로 다양한 조건에서 자가포식체의 수와 세포 국소화를 평가하는 데 사용됩니다. 또한, LC3를 소위 탠덤 프로브에서 pH 민감성 GFP 및 pH 안정 RFP에 결합함으로써 GFP 형광 손실3의 함수로 살아있는 세포에서 자가포식의 전체 플럭스를 측정할 수 있습니다. 이러한 접근법은 연구자들이 다양한 조건에서 자가포식의 역할과 메커니즘을 이해하는 데 유용한 도구입니다. 또 다른 귀중한 도구는 전자 현미경(EM)으로, 자가포식 4,5,6,7,8의 여러 단계에서 자가포식 소기관의 미세 구조를 보여줍니다. 현재까지 EM은 형태학에 따라 다양한 자가포식 막을 구별하여 자가포식 형성의 정확한 단계를 식별하기 위해 선택되는 방법입니다: phagophore(완전히 닫히지 않은 이중막), autophagosome(세포질 화물 주위의 닫힌 이중막) 및 autolysosome(내부 자가포식 막의 [부분] 손실). 그러나 분자 정보가 없는 형태학은 오인이나 모호성이 발생하기 쉽습니다. Immuno-EM은 자가포식 세포소기관의 동시 분자 특성 분석 및 형태학적 분류를 위한 가장 포괄적인 방법입니다. 예를 들어, 해동된 극저온 절편에서 LC3의 immunogold 표지를 통해 LC3의 초구조적 국소화와 LC3 표시 소기관을 정밀하게 식별할 수 있습니다9.
EM의 단점은 자가포식막의 미세한 미세구조를 관찰하고 immuno-EM의 경우 관심 단백질을 표시하는 라벨을 찾는 데 필요한 고배율과 함께 제공되는 작은 시야입니다. 단백질이 부족하고 단백질 수준이 낮기 때문에 일반적으로 자가포식체의 정량적 EM 분석이 방해가 됩니다. 자가포식체의 수를 늘리기 위해 세포를 굶주리고 리소좀 산성화 및 분해 억제제인 바필로마이신 A1(BafA1)으로 처리합니다. BafA1 치료가 없으면 이러한 세포 소기관이 부족하기 때문에 EM에 의한 자가포식체 검색은 시간이 많이 걸립니다. 이 원고에 제시된 방법은 EM을 추가로 준비하기 전에 형광 현미경에서 해동된 극저온 절편에 대한 내인성 LC3의 형광 표지 및 이미징을 통해 이 문제를 해결합니다. 그런 다음 형광 이미지는 EM에서 LC3 표지 구조를 찾는 데 도움이 됩니다. 수집 후 EM 이미지는 형광 이미지와 상관 관계가 있어 세포의 초미세 구조에 분자 정보(LC3의 존재)를 추가합니다. 이 '절편 내 CLEM' 분석법은 특히 처리되지 않은 조건에서 EM에 의한 후속 식별 및 분류를 위해 LC3 표지 구조를 찾는 능력을 크게 향상시킵니다.
이 방법은 굶주린 간모세포종 유래 HEPG210 세포에 적용되어 변경되지 않은(즉, BafA1이 사용되지 않은) 조건에서 자가포식체를 찾았습니다. 상대적으로 적은 수의 형광 반점(90nm 절편에서 세포 프로파일당 1개 미만)이 발견되었으며, 이는 LC311의 높은 회전율과 일치합니다. LC3-puncta의 이러한 희소성은 CLEM의 가치를 강조했습니다. EM에서 이미징을 위해 여러 형광 반점이 있는 영역을 선택함으로써 LC3 양성 소기관을 발견하고 기존 immuno-EM보다 훨씬 더 효과적인 방식으로 특성화했습니다. 그 결과, LC3 양성 세포소기관의 대다수가 형태학에 의해 정의된 자가포식체(autophagosome)라는 사실이 밝혀졌는데, 이는 자가리소좀이 더 흔한 BafA1 처리 세포에서 얻은 결과와 대조된다9. 이러한 데이터는 절편 CLEM을 사용하면 자가포식 흐름을 억제할 필요 없이 초구조적 수준에서 자가포식을 연구할 수 있음을 보여줍니다.
프로토콜
1. 도구 및 시약의 준비
참고: 필요한 시약, 완충액 및 용액에 대한 자세한 내용은 보충 파일 1 또는 12 를 참조하십시오. 이 프로토콜에 사용된 모든 재료, 시약, 장비 및 소프트웨어와 관련된 자세한 내용은 재료 표를 참조하십시오.
- 고정액
- 보충 파일 1에 설명된 대로 0.2M 인산염 완충액(PB) 또는 0.2M 파이프, HEPES, EGTA, MgSO4(PHEM) 완충액을 준비하여 정착액의 기초로 사용합니다.
참고: 고정제는 생물학적 물질과의 알데히드 반응으로 인한 산성화를 방지하기 위해 0.1M PB 또는 PHEM 완충액에서 일상적으로 완충됩니다. - 파라포름알데히드(PFA)의 품질은 시료의 미세구조를 안정적으로 고정하는 데 중요하므로 EM 등급 PFA를 사용하십시오. 이 프로토콜을 따르려면 고품질 PFA 프릴로 준비된 16% 원액을 사용하십시오( 보충 파일 1 참조).
주의 : 파라 포름 알데히드는 유해 화학 물질입니다 (위험 문구 H228, H301, H302, H311, H314, H315, H317, H318, H331, H332, H335, H341, H350). PFA로 작업할 때는 보호 장비(장갑, 실험복 및 보호 안경)를 착용하고 화학 후드에서 작업하십시오. PFA가 포함된 폐기물은 기관의 지침 및 규정에 따라 수거 및 처리해야 합니다. - 0.2M PB 10mL, 16% PFA 5mL(탈염수[dH2O]) 및 dH2O5mL를 결합하여 4% PFA의 정착액을 준비합니다.
- 선택 사항: 1.1.3단계의 고정 용액에 0.02%-0.5% 글루타르알데히드(GA)를 추가하면 미세구조의 보존이 향상되지만 많은 항체에 대한 샘플의 항원성이 감소합니다.
알림: GA 고정이 필요한 경우 적절한 공급업체의 EM 등급 GA를 사용하십시오.
주의: 글루타르알데히드는 유해 화학 물질입니다(위험 문구 H301, H302, H314, H317, H330, H332, H334, H335, H400, H411). GA를 조작할 때 화학 후드에서 작업하고 보호 장비(장갑, 실험실 가운 및 보호 안경)를 착용하십시오. GA가 포함된 폐기물은 기관의 지침 및 규정에 따라 수거 및 처리해야 합니다.
- 보충 파일 1에 설명된 대로 0.2M 인산염 완충액(PB) 또는 0.2M 파이프, HEPES, EGTA, MgSO4(PHEM) 완충액을 준비하여 정착액의 기초로 사용합니다.
- 도구 및 재료
- 알루미늄 샘플 홀더 핀의 표면을 긁고 에탄올로 초음파 처리 3 x 10 분 동안 금속 잔여물을 제거하고 젤라틴이 내장된 셀 블록을 핀에 장착할 때 최적의 접착력을 보장합니다.
- 알루미늄을 보관하는 데 적합한 보관 캐니스터를 사용하십시오.ample와 함께 홀더 핀amp액체 질소(LN2)에 있습니다.
- 매니큐어를 사용하여 나무 꼬치 끝에 머리카락이나 속눈썹 하나를 부착하여 매니퓰레이터를 만듭니다.
- 픽업 루프를 만드십시오. 직경 3mm의 둥근 막대 주위에 0.3mm 두께의 스테인리스 스틸 와이어를 구부리고 끝을 함께 비틀어 한쪽 끝에 고리를 만듭니다. 꼬인 끝을 피펫 팁에 삽입합니다. 반대쪽 끝에서 나무 꼬챙이를 꽂고 접착제나 수지를 붙입니다.
알림: 픽업 루프도 상업적으로 이용 가능합니다( 재료 표 참조). - 그리드 건조 루프를 준비하려면 픽업 루프를 만드는 것과 동일한 단계를 따르십시오: 4mm 루프에 스테인리스 스틸 와이어를 형성하고 접착제 또는 수지로 큰 피펫 팁에 부착합니다.
- formvar( 보충 파일 1의 프로토콜)와 같은 얇은 지지 필름을 사용하여 그리드를 코팅합니다. 사용하기 전에 그리드를 얇은 탄소 층으로 코팅하십시오.
알림: 바로 사용할 수 있는 그리드는 상업적으로 이용 가능합니다( 재료 표 참조). Formvar 코팅 그리드는 실온(RT)에서 무기한 보관할 수 있습니다. 탄소 코팅 그리드는 RT에서 몇 달 동안 보관할 수 있습니다. - 13에서와 같이 깨끗한 유리 슬라이드와 큰 커버슬립(24mm x 24mm는 25mm 너비의 유리 슬라이드에 이상적임)을 준비합니다.
2. 고정 및 시료 준비
- 고정
- 1.1.3 단계에서 준비한 정착제를 사용하십시오 (0.1M PB에서 4 % PFA). 부착 세포주의 경우 6cm 접시에 1-5 × 106 세포를 배양합니다. 정착액을 배양 배지에 1:1 비율로 첨가하고 샘플을 RT에서 5분 동안 배양합니다. 그런 다음 중간 고정제 혼합물을 고정제로만 교체하고 상온에서 2시간 동안 배양합니다.
참고: 정확한 세포 수, 합류 및 배양 조건은 사용된 모델 시스템에 따라 다를 수 있습니다. - 샘플을 하룻밤 동안 또는 4°C에서 0.1M PB의 0.5% PFA로 최대 3-4주 동안 보관합니다.
참고: GA를 고정에 추가할 수 있으며(1.1.4단계 참조) 고정 길이를 변경하여 형태 보존과 항원성 사이의 최적 균형을 찾을 수 있으며, 이는 표본 및 라벨링에 따라 다릅니다. 더 알아보려면14쪽을 참조한다.
- 1.1.3 단계에서 준비한 정착제를 사용하십시오 (0.1M PB에서 4 % PFA). 부착 세포주의 경우 6cm 접시에 1-5 × 106 세포를 배양합니다. 정착액을 배양 배지에 1:1 비율로 첨가하고 샘플을 RT에서 5분 동안 배양합니다. 그런 다음 중간 고정제 혼합물을 고정제로만 교체하고 상온에서 2시간 동안 배양합니다.
- 샘플 임베딩
- RT에서 PBS로 고정 셀로 접시를 3번 씻습니다. 그런 다음 0.15% 글리신을 함유한 PBS로 교체하고 RT에서 10분 동안 배양합니다.
- 37°C로 예열된 PBS에서 0.15% 글리신이 함유된 PBS를 1% 젤라틴으로 교체하고 1% 젤라틴의 세포를 긁어내어 마이크로 원심분리 튜브로 옮깁니다. 세포를 6,000× g 에서 마이크로 원심분리기에서 RT에서 1분 동안 펠렛합니다. 그런 다음 펠릿을 방해하지 않고 1% 젤라틴을 제거하고 37°C로 예열한 12% 젤라틴을 추가합니다. 37°C로 예열된 피펫 팁 또는 유리 파스퇴르 피펫을 사용하여 위아래로 부드럽게 피펫팅하여 세포 펠릿을 재현탁합니다.
- 37°C에서 10분 동안 배양합니다. 그런 다음 세포를 6,000× g 에서 1분 동안 펠렛합니다. 젤라틴을 얼음 위에서 30분 동안 굳힙니다.
- 튜브에서 젤라틴이 박힌 세포를 제거하려면 면도날로 튜브의 나머지 부분에서 펠릿이 들어 있는 튜브 끝을 잘라냅니다. 그런 다음 첫 번째 절단에 수직으로 셀 펠릿이 있는 튜브 끝을 반으로 자릅니다.
- 젤라틴이 포매된 세포 펠릿을 포함하는 두 개의 튜브 말단 반쪽을 2.3M 자당에 4°C에서 10분 동안 배양합니다. 이로 인해 젤라틴이 포함된 세포 펠릿 반쪽이 약간 줄어들고 플라스틱 튜브에서 떨어져 나갑니다.
알림: 젤라틴이 포함된 세포 펠릿은 2.3M 자당이 너무 점성이 있고 젤라틴이 너무 부드러워지는 것을 방지하기 위해 가능한 한 4°C 또는 얼음처럼 차갑게 보관해야 합니다. 다음 단계에서 젤라틴에 포매된 세포 펠릿을 조작하는 동안 한 번에 하나의 샘플로만 작업하고 나머지는 얼음 위에 두거나 차가운(~4°C) 방에서 작업합니다. 젤라틴이 내장된 세포 펠릿이 햇빛, 뜨거운 현미경 램프 또는 기타 열원에 의해 과열되지 않도록 하십시오. - 2.3M 자당에서 젤라틴이 포함된 세포 펠릿으로 튜브 반쪽을 제거합니다. 그런 다음 핀셋으로 플라스틱 튜브 반쪽에서 젤라틴이 박힌 세포 펠릿 반쪽을 제거합니다. 면도날로 펠릿을 적절한 크기(~1mm3)의 블록으로 수동으로 자릅니다. 절단하는 동안 입체 해부 현미경을 사용하여 피사체를 확대합니다.
- 젤라틴이 포매된 셀 블록에 2.3M 자당을 3-16시간 동안 주입하고 4°C의 로터에서 끝까지 돌립니다.
- 젤라틴이 박힌 셀 블록을 알루미늄 샘플 홀더 핀에 놓습니다(1.2.1단계 참조). 블록과 핀 사이에 얇은 '칼라'를 형성하도록 블록 가장자리 주위에 2.3M 자당을 충분히 남겨 둡니다. 블록의 상단을 덮고 있는 2.3M 자당을 너무 많이 피하십시오. 스냅 냉동 및 LN2에 보관하십시오.
3. 단면
- 트리밍(12 참조)
- LN2 저장소에서 젤라틴이 내장된 세포 블록이 있는 핀을 꺼내 -80°C로 설정된 cryomicrotome 안에 넣습니다.
- 블록의 전면을 잘라 표면을 평평하게 만들고 ~250nm 섹션을 얻습니다. 3mm 루프를 픽업 용액(1:1 2.3M 자당 및 2% 메틸셀룰로오스)에 담그고 루프를 마이크로톰의 크라이오 챔버에 삽입하고 방울에 얼음이 형성되기 시작할 때까지 기다립니다(일반적으로 5-7초). 그런 다음 물방울을 빠르고 부드럽게 눌러 섹션을 즉시 집어 올립니다. 냉동 챔버에서 루프를 제거하고 물방울이 완전히 해동될 때까지 기다렸다가 유리 슬라이드에 물방울을 누릅니다.
- 절편의 톨루이딘 블루 염색으로 세포 방향을 확인합니다.
- 톨루이딘 블루 용액 한 방울( 보충 파일 1 참조)을 유리 슬라이드의 섹션 위에 놓고 방울의 가장자리가 마를 때까지 80°C 가열판에서 건조합니다.
- 가열판에서 유리 슬라이드를 제거하고 톨루이딘 블루를 dH2O로 부드럽게 헹구어 적절한 폐기물 용기에 모읍니다.
- 유리 슬라이드를 건조시키고 간단한 탁상형 광학 현미경을 통해 섹션의 세포 방향을 확인합니다.
- 칼 모서리로 샘플 블록 면의 측면에 50-100 μm를 절단하여 블록의 측면을 자릅니다. 각 면을 트리밍한 후 샘플 홀더를 90° 회전하여 샘플 블록 면의 4면을 트리밍하여 돌출된 ~250μm x 375μm 직사각형을 만듭니다. 이전 단계에서 결정한 셀 방향을 기준으로 돌출 영역을 선택합니다.
- 구획화 및 픽업
- cryomicrotome을 -100°C로 식힙니다. 돌출된 직사각형에서 리본을 절편하고 단면은 두께가 70-90nm이고 은빛 황금색 광택이 있습니다. 막대기에 머리카락이 있는 다이아몬드 나이프의 가장자리에서 섹션을 멀리 안내하여(섹션 1.2.3 참조) 긴(2-5mm) 리본을 만듭니다.
- 적절한 리본이 형성되면 단면을 중지하고 리본을 집어 듭니다. 3mm 픽업 루프를 2.3M 자당과 2% 메틸셀룰로오스를 1:1로 혼합한 혼합물에 담그고 루프를 마이크로톰의 크라이오 챔버에 삽입한 다음 액적이 얼기 시작할 때까지(일반적으로 5-7초) 기다립니다. 그런 다음 물방울을 빠르고 부드럽게 눌러 섹션을 즉시 집어 올립니다. 극저온 챔버에서 루프를 제거하고 물방울이 완전히 해동될 때까지 기다린 다음 준비된 그리드에서 물방울을 누릅니다(1.2.6단계).
알림: 단면이 있는 그리드는 4°C에서 몇 달 동안 보관할 수 있습니다.
4. 라벨링 및 광학 현미경 검사
- 라벨
- 섹션(그림 1A)이 있는 그리드를 작은 접시 또는 멀티웰 플레이트의 ~1mL의 PBS에 섹션 면이 아래로 향하게 놓습니다. 37°C에서 30분 동안 배양합니다.
참고: 이 단계는 세포 사이에 있는 젤라틴을 제거합니다. 젤라틴은 절편 후 필요하지 않으며 나머지 프로토콜을 방해합니다. - 파라필름의 ~75μL 액적에서 그리드 섹션을 아래로 향하게 하여 처리합니다( 그림 1B 참조). RT에서 PBS + 0.15% 글리신 세척(3 x 2분)으로 시작합니다. 그런 다음 PBS에서 0.1% 소 혈청 알부민(BSA)-c + 0.5% 생선 피부 젤라틴(FSG)을 차단 단계로 RT에서 10분 동안 배양합니다. PBS의 0.1% BSA-c + 0.5% FSG에 1차 항체를 희석하고 RT에서 1시간 동안 이 용액의 ~10μL 액적에 그리드를 배양합니다(그림 1C).
- RT에서 PBS 5x의 0.1% BSA로 그리드를 세척합니다. 그런 다음 PBS의 0.1% BSA-c + 0.5% FSG에 2차 항체와 4',6-diamidino-2-phenylindole(DAPI, 10μg/mL)을 희석하고 RT에서 30+분 동안 이 용액의 ~10μL 방울에 그리드를 배양합니다(그림 1C). RT에서 PBS 5x의 그리드를 세척합니다.
참고: 선택적으로, EM에서 관심 단백질의 국소화를 위해 단백질 A(PAG)에 접합된 5, 10, 15 또는 20nm 콜로이드 금 입자로 2차 항체를 표지할 수 있습니다. 이것이 원하는 경우, 4.1.3단계 후 RT에서 20분 동안 PAG로 그리드를 배양합니다. 그런 다음 RT에서 PBS로 5회 세척합니다. 여러 1차 항체의 동시 사용을 피하고 원치 않는 교차 반응을 방지하기 위해 다른 종의 IgG에 대한 PAG의 반응성에 유의하십시오. 더 알아보려면12쪽을 참조한다.
- 섹션(그림 1A)이 있는 그리드를 작은 접시 또는 멀티웰 플레이트의 ~1mL의 PBS에 섹션 면이 아래로 향하게 놓습니다. 37°C에서 30분 동안 배양합니다.
- 광학 현미경 검사용 샘플 장착
- RT에서 dH 2 O2x 5 분 동안 50 % 글리세롤에 그리드를 담그고 유리 슬라이드와 커버 슬립 사이에 그리드를 50 % 글리세롤로 끼우고 커버 슬립 당 하나의 그리드를 커버 슬립 당 하나의 그리드로 덮습니다 (그림 1D).
알림: 그리드를 50% 글리세롤에 30분 이상 장착하면 라벨링 품질이 저하될 수 있습니다. 따라서 한 번에 2개 또는 3개의 그리드를 장착하고 이미지를 생성하고 나머지는 2차 라벨링 솔루션에 남겨 두는 것이 좋습니다.
- RT에서 dH 2 O2x 5 분 동안 50 % 글리세롤에 그리드를 담그고 유리 슬라이드와 커버 슬립 사이에 그리드를 50 % 글리세롤로 끼우고 커버 슬립 당 하나의 그리드를 커버 슬립 당 하나의 그리드로 덮습니다 (그림 1D).
- 광학 현미경
- 격자가 끼워진 유리 슬라이드를 자동 스테이지가 있는 광시야 현미경으로 가져갑니다. 고배율(63x 또는 100x) 오일 대물렌즈를 선택하십시오. 섹션 리본(일부)의 이미지 타일셋을 만듭니다(그림 1E).
참고: 일부 2차 항체는 그리드, 특히 절편의 접힘 또는 찢어진 부분에 형광 응집체를 형성할 수 있습니다. 또한 일부 세포 유형 및 조직에는 자가형광 구조가 포함되어 있습니다. 이러한 문제가 예상되는 경우 1차 항체로 배양되지 않은 음성 대조군을 포함하는 것이 좋습니다.
- 격자가 끼워진 유리 슬라이드를 자동 스테이지가 있는 광시야 현미경으로 가져갑니다. 고배율(63x 또는 100x) 오일 대물렌즈를 선택하십시오. 섹션 리본(일부)의 이미지 타일셋을 만듭니다(그림 1E).
- 마운트 해제 및 EM 대비(DECONTRASTING)
- 유리 슬라이드-커버슬립 샌드위치 측면에 10μL의 dH2O를 추가하고 모세관 작용이 유리-커버슬립 샌드위치 인터페이스를 채울 때까지 기다립니다. 글리세롤에 침지 오일을 섞지 않고 커버슬립을 조심스럽게 제거합니다. 핀셋으로 그리드를 검색하고 RT에서 dH2O 3x에 담가 50% 글리세롤을 씻어냅니다.
알림: 오일은 우라닐 염색을 방해하고 EM 대비를 악화시킬 수 있습니다. - 보푸라기가 없는 티슈 페이퍼로 그리드 뒷면을 조심스럽게 말립니다.
참고: 샘플이 콜로이드 금 입자로도 라벨링된 경우 다음 단계를 수행합니다. 단면이 아래로 향하게 하여 그리드를 PBS 액적에 놓고 RT에서 2회 세척합니다. RT에서 5분 동안 1% GA에 접미사를 넣습니다(1.1.4의 주의 사항 참조). RT에서 PBS 2x로 세척하십시오. - 격자 부분을 아래로 향하게 하여 dH2O 물방울에 놓고 RT에서 8번 세척합니다.
- EM에서 조영제를 위해 절편을 염색하려면 RT에서 5분 동안 pH 7의 우라닐 아세테이트(UA)로 배양합니다(그림 1F).
- 그리드를 배치하기 전에 얼음 위의 금속판에 파라필름에 물방울을 놓아 UA:메틸셀룰로오스(pH 4)를 식힙니다. 그런 다음 얼음처럼 차가운 UA:메틸셀룰로오스, pH 4, 2배로 그리드를 세척하고 얼음처럼 차가운 UA:메틸셀룰로오스, pH 4로 10분 동안 배양합니다(그림 1F).
주의 : 우라닐 아세테이트는 유해 화학 물질입니다(위험 문구 H300, H330, H373, H411). UA가 필요한 단계에서는 화학 후드에서 작업하고 보호 장비(실험실 가운, 장갑 및 보호 안경)를 착용하십시오. UA가 포함된 폐기물은 기관의 지침 및 규정에 따라 수거하여 처리한다. - 격자 아래의 UA:메틸셀룰로오스 방울에 격자 건조 루프를 삽입하고 격자가 액적12에서 당겨질 때까지 부드럽게 들어 올려 격자를 고리로 만듭니다. 보푸라기가 없는 여과지( 재료 표 참조)에 ~60° 각도(섹션이 아래를 향함)로 루프를 터치하고 UA:메틸셀룰로오스가 더 이상 흡수되지 않을 때까지 종이를 따라 천천히 드래그하여 여분의 UA:메틸셀룰로오스를 닦아냅니다. 그런 다음 그리드가 있는 루프를 적절한 랙에 놓고 RT에서 >10분 동안 건조시킵니다(그림 1G).
- 유리 슬라이드-커버슬립 샌드위치 측면에 10μL의 dH2O를 추가하고 모세관 작용이 유리-커버슬립 샌드위치 인터페이스를 채울 때까지 기다립니다. 글리세롤에 침지 오일을 섞지 않고 커버슬립을 조심스럽게 제거합니다. 핀셋으로 그리드를 검색하고 RT에서 dH2O 3x에 담가 50% 글리세롤을 씻어냅니다.
5. EM
- 광학 현미경으로 얻은 개요를 사용하여 투과 전자 현미경(TEM)에서 이미징을 위한 관심 영역(ROI)을 찾습니다. 그림 1H). 광학 현미경 데이터 세트의 ROI에 주석을 달 수 있습니다. 영역이 선택되면 TEM에서 20,000x-50,000x 배율의 이미지 타일셋을 얻습니다. 후처리 소프트웨어15,16에서 이미지 타일셋을 재구성한다.
6. 상관관계 및 분석
- ImageJ/Fiji17, Icy18의 ec-CLEM 플러그인 또는 Photoshop과 같은 적절한 이미지 처리 소프트웨어에서 광학 현미경 및 EM 데이터 세트를 불러옵니다. 광학 현미경 데이터셋을 자르고 회전하여 EM 타일셋과 일치시킵니다.
- 형광의 DAPI 신호와 EM의 핵 윤곽을 기반으로 상관 관계를 수행합니다(그림 1I). 이미지를 이동하여 정확하게 오버레이하고 수동 상관 관계를 정확하게 수행합니다. 접근 방식을 보다 정확하게 하려면 예를 들어 Icy의 ec-CLEM 플러그인 또는 ImageJ의 BigWarp 플러그인을 통해 랜드마크 기반 상관 관계를 적용하여 해당 지점을 수동으로 선택하여 이미지를 상호 연관시킵니다. ec-CLEM과의 상관관계를 위한 상세한 단계별 프로토콜이 이용 가능하다19.
참고: 이 접근법은 바이모달 기준 프로브(20,21)의 사용에서도 잘 작동한다.
- 형광의 DAPI 신호와 EM의 핵 윤곽을 기반으로 상관 관계를 수행합니다(그림 1I). 이미지를 이동하여 정확하게 오버레이하고 수동 상관 관계를 정확하게 수행합니다. 접근 방식을 보다 정확하게 하려면 예를 들어 Icy의 ec-CLEM 플러그인 또는 ImageJ의 BigWarp 플러그인을 통해 랜드마크 기반 상관 관계를 적용하여 해당 지점을 수동으로 선택하여 이미지를 상호 연관시킵니다. ec-CLEM과의 상관관계를 위한 상세한 단계별 프로토콜이 이용 가능하다19.
- 적합한 프로그램(예: ImageJ)에서 형광 신호를 기반으로 ROI를 선택하여 상관 영상을 분석합니다. 정량 분석의 경우, 라벨링된 모든 세포 기관에 대한 ROI 모음을 만듭니다. 그런 다음, 개별 ROI의 대응되는 초미구조를 검사하고 형태학적 요소를 기반으로 분류합니다.
결과
초박형 극저온 절편에서 LC3의 면역 금 표지를 위한 최적화된 면역-EM 프로토콜이 최근 De Maziere et al.9에 의해 발표되었습니다. 이 연구에는 LC3가 존재하지만 상대적으로 드물고 EM에서 찾기 어려운 BafA1이 없는 굶주린 조건이 포함되었습니다. 형광 표지의 감도를 사용하여 상대적으로 희귀하고 발현이 적은 내인성 단백질을 시각화하고 이를 EM 초미세구조14와 연관시키는 절편 CLEM 분석법이 별도의 연구에서 소개되었습니다. 여기서 이 두 가지 접근 방식은 CLEM 접근 방식의 일부로 최적화된 LC3 라벨링 프로토콜을 사용하여 결합됩니다.
상대적으로 높은 수준의 기저 자가포식22를 가진 간 유래 세포인 HEPG2 세포를 4% PFA에 고정하기 전에 최소 배지(Earle's balanced salt solution [EBSS])에서 2시간 동안 굶주렸습니다. 그 다음에는 초박형 극저온 절제술의 Tokuyasu 방법(섹션 1-3, Slot 및 Geuze12 참조)에 의한 샘플 준비가 이어졌으며, 이는 절편 CLEM 14,23과 호환성이 매우 높습니다. 해동된 극저온 절편은 마우스 항-LC3 1차 항체9를 사용하여 형광 표지(프로토콜 섹션 4 및 그림 1)했습니다. 또한 토끼 항-LAMP1을 사용하여 엔도-리소좀을 표시하고, 항-마우스 AlexaFluor488 및 항-토끼 AlexaFluor568 2차 항체를 사용했습니다. 그리드를 커버슬립과 유리 슬라이드 사이에 끼우고 광시야 현미경(100x 1.47 NA 오일 대물렌즈, sCMOS 카메라)에서 RT로 이미징했습니다.
기존의 전체 셀 IF에 비해 얇은 절편의 형광 표지의 장점은 절편의 물리적 두께가 60-90nm이기 때문에 Z의 분해능이 증가한다는 것입니다. 이렇게 Z 분해능이 개선되면 얇은 절편에서 LC3 및 LAMP1의 형광 표지는 공동 국소화가 거의 나타나지 않습니다(그림 2A). BafA1과 같은 리소좀 억제제로 처리된 세포에서는 리소좀 밀폐 LC3가 분해되지 않은 상태로 유지되기 때문에 높은 공동 국소화가 발생한다9. 처리되지 않은 세포에서 LC3는 효소 활성, LAMP1 양성 리소좀과 접촉하면 빠르게 분해되므로 이러한 조건에서는 공동 국소화가 드뭅니다. 일반적으로, 세포 프로파일당 1개 미만의 LC3 푼크툼이 관찰되었다. 이는 굶주린 상태에서도 자가포식소체의 회전율이 빨라 자가포식체 수가 낮게 유지된다는 것을 나타냅니다. 또한 광학 현미경이 제공하는 넓은 시야를 사용하여 희귀한 LC3 표지 구조를 찾기 위해 CLEM을 사용하는 것의 중요성을 강조합니다. 또한, 금 라벨링에 비해 형광 라벨링의 감도가 높기 때문에 기존 immuno-EM보다 더 많은 LC3 양성 소기관을 식별할 수 있어 특성 분석에 더욱 도움이 됩니다.
단면 리본의 전체 타일셋을 획득한 후, 현미경에서 그리드를 회수하고 UA 및 루프 아웃 방법(프로토콜 단계 4.4-4.6; 그림 1F,G). 이 '루프 아웃(loop-out)' 방법은 UA:메틸셀룰로오스의 얇은 층이 그리드에 남아 EM에서 원하는 대비를 생성하도록 합니다. 층의 두께는 UA:메틸셀룰로오스가 여과지에 지워지는 속도와 각도에 따라 다릅니다. 루프를 너무 빨리 드래그하면 그리드에 UA:메틸셀룰로오스가 너무 많이 남고 EM에서 섹션의 모양이 어두워질 수 있습니다. 너무 느리게 드래그하면 UA:methylcellulose가 너무 많이 당겨져 얼룩이 너무 적고 형태가 좋지 않으며 그리드가 루프에서 빠질 위험이 있습니다. 건식 그리드의 '유막' 착색(그림 1G)은 적절한 UA:메틸셀룰로오스 층 두께를 나타냅니다.
루프 아웃 및 건조 후, 그리드는 형광에 의해 선택된 ROI의 TEM에서 이미지화되었습니다. IF 및 EM 데이터 세트는 DAPI 신호를 EM에서 볼 수 있는 핵의 윤곽에 오버레이하여 두 양식의 정보를 포함하는 통합 이미지를 생성함으로써 상관 관계를 분석했습니다.
IF에서 선택한 것과 동일한 영역을 EM에서 찾는 것은 어려울 수 있습니다. 따라서 EM에서 검색하는 동안 IF 타일셋의 개요 이미지를 가까이에 두는 것이 좋습니다. 사용자는 단면의 접힘이나 찢어짐, 격자 막대 또는 핵 배열과 같은 두 가지 방식에서 인식 가능한 특징을 찾아야 합니다. 또한 샘플이 EM에서 회전하고 미러링된 것처럼 보일 수 있다는 점을 명심하는 것이 중요합니다. 영역을 식별하기 위한 특정 기능이 있는 '파인더 그리드'를 사용하여 상관 관계를 쉽게 할 수 있습니다(재료 표 참조).
LC3 양성 소기관과 EM 초미세구조의 상관관계는 서로 다른 반점이 뚜렷한 자가포식 단계를 나타낸다는 것을 보여주었습니다(그림 2B). 냉동 절편에서 자가포식 초세구조의 보존은 어렵지만, 세포질 함량과 이중막을 가진 세포소기관이 자주 관찰되었다(그림 2C, 세포소기관의 화살표 1-5; 보충 그림 S1)은 자가포식체의 형태학적 특징을 정의합니다. 흥미롭게도, 다소 약한 형광 반점은 EM에 의해 LC3 양성 자가리소좀(그림 2C, 세포 기관 6, 자가포식 함량은 *로 표시됨)으로 식별되었으며, 이는 밀도가 높은 함량과 내강 내 소포를 특징으로 합니다. 이는 극박형 극저온 절편의 IF에서 매우 적은 양의 LC3를 볼 수 있음을 보여주었으며, 분해 환경에도 불구하고 일부 LC3는 정상 상태 상가시소체에서 검출될 수 있음을 나타냅니다. 그러나 LC3 양성 반점의 대부분은 자가포식체를 나타내는 반면 자가리소좀은 매우 드물었습니다. 이는 BafA1 처리된 세포가 주로 자가포식체가 아닌 자가리소좀을 축적하는 것과는 대조적이다9.
요약하면, 이 프로토콜은 형광 현미경으로 얻은 분자 정보를 EM의 미세 구조에 연결하기 위한 절편 CLEM 방법을 설명합니다. 이 방법은 형광단만 표지에 사용되며 일반적으로 EM 프로브보다 더 많은 신호를 생성하기 때문에 immuno-EM의 감도를 높입니다. 이 방법은 특히 초박형 극저온 절편을 사용하는 데 적합하며, 무시할 수 있는 배경 염색에 비해 높은 수준의 특정 형광을 얻을 수 있습니다. 형광을 사용하여 희귀 구조 또는 이벤트를 스크리닝하고 선택한 ROI를 EM과 연관시킴으로써 EM 작동 시간 및 관련 비용을 크게 줄일 수 있습니다. 이 방법의 민감도와 타당성은 처리되지 않고 굶주린 세포에서 LC3의 시각화를 통해 입증되었으며, LC3는 이러한 조건에서 주로 자가포식체와 연관되며 자가리소좀에서 매우 낮은 수준을 볼 수 있음을 보여줍니다.
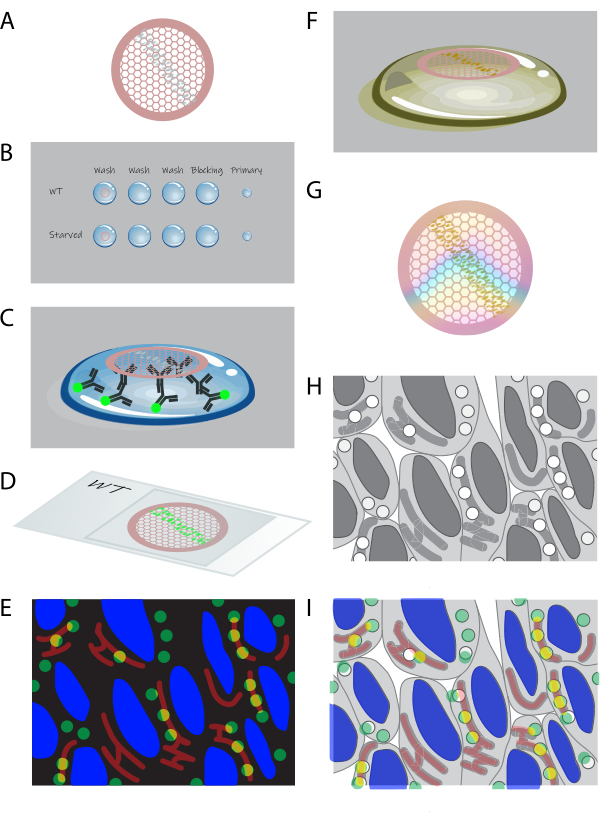
그림 1: on-section CLEM의 개략도 . (A) 젤라틴이 포집된 세포의 극저온 절편은 formvar 코팅된 구리 그리드에서 수집됩니다. (B) 그리드는 적절한 용액의 액적에서 섹션 다운으로 처리됩니다. (C) 그리드는 1차 및 형광 2차 항체로 표지됩니다. (D) 그리드는 50% 글리세롤의 커버슬립과 유리 슬라이드 사이에 끼워져 있습니다. (E) 형광 이미지는 광시야 현미경으로 수집됩니다. (F) 그리드는 유리 슬라이드에서 회수되고 EM에 대한 우라닐 염색으로 추가 처리됩니다. (G) 건조 후 그리드는 TEM으로 이미지화할 수 있습니다. (H) 고배율 TEM 이미지 타일셋은 형광 데이터에서 선택된 영역에서 획득됩니다. (I) 형광 현미경 검사와 EM의 이미지는 상관 관계가 있고 중첩되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
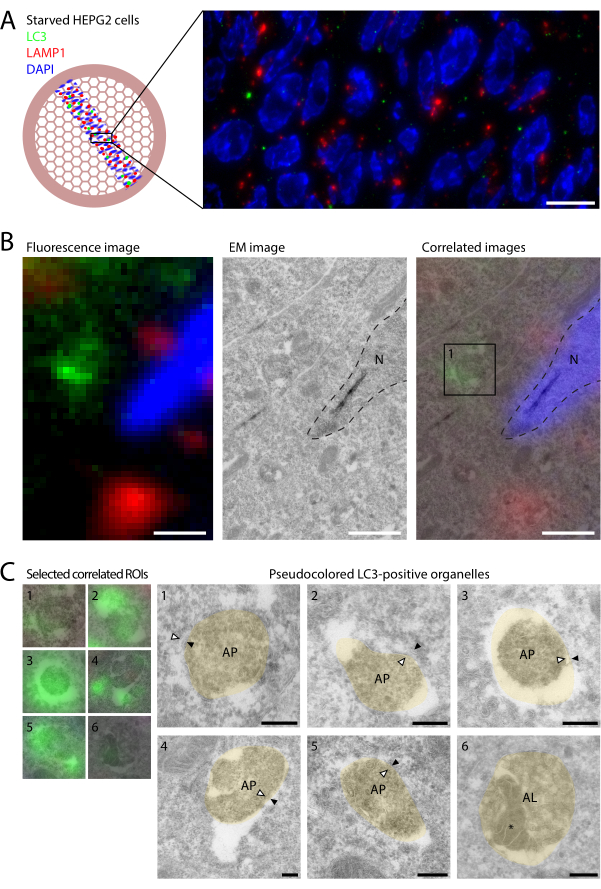
그림 2: 결핍된 HEPG2 세포에서 LC3 및 LAMP1의 CLEM입니다. HEPG2 세포는 2시간 동안 4% PFA로 고정하기 전에 EBSS에서 2시간 동안 굶주렸습니다. (A) 절편에서 LC3(녹색) 및 LAMP1(빨간색)의 IF 이미징은 상대적으로 적은 LC3 반점과 LAMP1과의 공동 국소화가 거의 없음을 보여줍니다. (B) DAPI 및 핵 윤곽선(점선, 오른쪽 패널)을 기반으로 하는 두 가지 이미징 양식을 오버레이하여 IF(왼쪽 패널)의 분자 정보를 EM(중간 패널)에서 얻은 초미구조 정보와 연결합니다. 상자 1(오른쪽 패널)에 예시된 바와 같이 개별 LC3 라벨링 구획의 미세 구조는 C에 나와 있습니다. (C) LC3 양성 구획의 초미세 구조. CLEM 이미지는 왼쪽에, 유사 색상(베이지색) EM 이미지는 오른쪽에 표시됩니다(무색 EM 이미지는 보충 그림 S1에 표시됨). 내부 및 외부 자가포식체 막은 각각 흰색과 검은색 화살촉으로 표시됩니다. 실시예 6에서 자가포식 함량은 *로 표시된다. 스케일 바 = 10μm(A), 1μm(B), 200nm(C). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 S1: LC3 양성 소기관의 무색 EM 이미지. (A-F) 도 2C에 도시된 유사 채색된 예 1-6의 무색 EM 이미지. 세포소기관은 도 2에 기술된 바와 같이 LC3 형광에 의해 선택되었다. 내부 및 외부 자가포식체 막은 각각 흰색과 검은색 화살촉으로 표시됩니다. 실시예 6에서 자가포식 함량은 *로 표시된다. 스케일 바 = 200nm. 약어: AL = autolysosome; AP = 자가포식체; M = 미토콘드리아. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 이 연구에 사용된 버퍼 및 솔루션. 이 보충 파일에는 이 연구에 사용된 완충액과 용액을 만드는 데 필요한 레시피와 프로토콜이 포함되어 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에 제시된 방법은 극저온 절편 기반 절편 CLEM의 최근 발전, 즉 IF 라벨링의 고감도 및 FM과 EM 14,24 간의 정확한(<100nm 오류) 상관 관계를 활용합니다. 그 결과 형광 표지가 희소한 내인성 단백질에 대한 민감도와 이를 EM 초미세 구조에 높은 정밀도로 오버레이할 수 있는 능력을 갖춘 분석법이 탄생했습니다. 따라서, 이 방법은 외인성 표지 단백질의 (과잉)발현과 덜 민감한 EM 표지의 사용을 피할 수 있습니다. 이 방법의 타당성은 리소좀 억제제를 사용하지 않고 굶주린 세포에서 내인성 LC3에 대한 CLEM의 예에 의해 표시됩니다.
Tokuyasu 방법으로 얻은 해동 동결 절편은 수지 절편과 달리 항체에 대한 투과성이 있기 때문에 immuno-EM에 이상적인 샘플입니다. 온화한 고정 및 대조 절차와 결합하여, 이는 일반적으로 상세한 미세 구조를 손상시키지 않으면서 다른 방법에 비해 탁월한 표지 효율을 산출하고, 세포막을 훌륭하게 시각화한다 12,25,26. 또한 cryosection은 형광 현미경과 호환성이 높기 때문에 CLEM에 유용한 기질이 됩니다. 동결절편에 대한 고전적인 immunogold 표지와 CLEM은 모두 세포 내 조직을 이해하는 데 중요한 통찰력을 제공했습니다 14,27,28,29,30.
현재, 해동된 극저온 절편에 대한 CLEM의 적용은 접근법의 품질, 적용 가능성 및 정확성을 개선한 지속적인 개발및 최적화(14,20,24,31,32,33,34)의 결과로 더욱 보편화되고 있습니다. 이제, 대형 IF 및 EM 이미지 타일셋의 정확한 상관 관계를 통해, 이 기술은 형광 표지된 내인성 세포 성분 14,32,33의 미세구조에 대한 스크리닝을 용이하게 합니다. 이는 금 표지 구조를 검색하는 데 일반적으로 고배율이 필요하고 따라서 더 힘들고 시간이 많이 걸리는 기존 immuno-EM에 비해 장점이 있습니다. 이러한 이유로 LC3를 초미세 구조로 국소화하면 CLEM의 이점을 크게 누릴 수 있습니다. LC3 양성 소기관은 자가포식 청소가 차단될 때(즉, 세포가 BafA1 또는 pH 상승제로 처리될 때) 흔한 반면, 자가포식 소기관은 변경되지 않거나 결핍된 세포에서 빠르게 제거되어 정상 상태 수준이 매우 낮습니다. 이러한 조건에서 기존 immuno-EM을 사용하여 LC3 표지 소기관을 찾는 것은 어려울 수 있으며 CLEM은 분명한 이점을 제공합니다.
이전에는 LC3-GFP 또는 LC3-GFP-RFP 탠덤 프로브 35,36,37,38,39의 이소성 발현을 사용하는 연구에서 수지 절편상의 CLEM을 적용했습니다. 이러한 연구에서, 형광 이미징은 아크릴 수지 섹션(40)에 매립하기 전에 또는 직접 수행되었으며, 샘플은 이후에 EM에 의해 스크리닝되었습니다. 수지 임베딩에는 몇 가지 장점이 있습니다. 자가포식 미세구조는 일반적으로 잘 보존되어 있으며, 특히 물질이 고압-동결(40)인 경우에 더욱 그러하다. 더욱이, 중금속 염색 수지 포매 재료의 대비는 일반적으로 우라닐 염색 극저온 절편보다 더 뚜렷합니다. 수지 포매 절편은 어레이 단층 촬영, FIB-SEM 또는 연속 블록페이스 SEM과 같은 체적 EM 방법과 호환되지만 극저온 절편은 그렇지 않습니다. 임베딩 전에 이미징을 수행하는 접근법에서 살아있는 세포 이미징은 극저온 절편의 CLEM에서 사용할 수 없는 옵션41입니다. 이러한 대안에 비해 극저온 절편에서 CLEM의 주요 이점은 높은 IF 신호로, 막 투과화 또는 과발현 없이 희귀 단백질의 면역 국소화가 가능합니다. 이는 잠재적인 막 추출, 과발현 인공물42 및 피험자의 유전자 변형을 방지하며, 이는 IF와 EM의 넓은 영역을 상호 연관시킬 수 있는 가능성과 결합되어 LC3 및 자가포식을 연구하는 데 탁월한 도구가 됩니다.
여기에서 굶주린 HEPG2 세포에 절편 CLEM을 적용한 결과 LC3가 주로 자가포식체로 식별된 구조에 국한된 것으로 나타났습니다. 또한, 몇 개의 약한 형광 반점이 autolysosome에서 발견되었습니다. 이는 BafA19 로 처리된 세포와 정반대이며, 자가포식체가 리소좀과 융합되면 자가포식 단백질이 급격히 분해되는 것을 반영합니다. 전반적으로, 데이터는 해동된 극저온 절편의 CLEM이 네이티브 조건에서 LC3 매개 자가포식에 대한 통찰력을 제공할 수 있음을 보여주었습니다. 이 데이터는 또한 낮은 수준의 온전한 LC3 에피토프만 포함하는 오토리소좀에서도 LC3가 검출되었기 때문에 기술의 민감도를 강조합니다. 다양한 모델과 조건에서 LC3를 이미징하여 이 기술을 추가로 적용하면 LC3 관련 식균작용 또는 ATG8을 단일 막에 접합하는 것과 같은 자가포식 및 기타 LC3 매개 생물학적 과정에 대한 이해가 향상될 것입니다.
자가포식 외에도 절편 CLEM은 세포 분열, 감염, 조직의 희귀 세포 유형, 운동세포, 원발성 섬모 또는 세포 유형 특이적 소기관과 같은 다른 희귀 사건 또는 구조에 적용할 수 있습니다. IF에 의한 관심 주제에 대한 효과적인 스크리닝은 이러한 희귀성에 대한 초구조적 연구를 크게 촉진할 수 있습니다. 또한, 이 기술은 기존의 immuno-EM보다 더 민감한 방식으로 단백질을 국소화하는 데 사용될 수 있음이14 에 밝혀졌습니다. 고정 길이를 조정하면 이러한 감도를 더욱 확장하여 매우 풍부하지 않거나 항원이 부족한 단백질의 초구조적 국소화를 가능하게 할 수 있습니다. 마지막으로, 절편 CLEM 분석법은 정량적 수의 소기관을 신속하게 선택할 수 있도록 하여 주어진 단백질의 초구조적 분포에 대한 보다 강력한 분석을 용이하게 합니다.
극저온 절편에 대한 CLEM은 극저온 절편을 위한 장비와 전문 지식이 필요합니다. 이러한 도구(예: cryomicrotomes)에 액세스할 수 있는 그룹에서 절편 CLEM의 구현은 간단하며 대부분의 실험실에서 액세스할 수 있는 설정인 자동화된 광시야 현미경만 있으면 됩니다. 또한 이 방법은 전 세계 EM 시설에서 사용할 수 있습니다. 온-단면 CLEM은 확립된 IF 및 EM 방법의 응용을 결합하기 때문에, 이 방법은 쉽게 적응할 수 있으며, 예를 들어, 단 층 촬영(20,33,43), 제한된 수의 섹션(44)의 연속 단면 부피 EM, 또는 초고해상도 현미경(45)과 결합될 수 있다. 이 방법의 다양성은 광범위한 생물학적 질문에 대한 응용을 지원합니다.
공개
저자는 이해 상충이 없다고 선언합니다.
감사의 말
유익한 토론과 피드백을 주신 위트레흐트 대학 의료 센터 분자 의학 센터의 동료들에게 감사드립니다. 현미경 기술을 지속적으로 개선해 주신 Klumperman 연구실의 전현직 동료들에게 감사드립니다. 이 작업에 사용된 EM 인프라는 네덜란드 연구 위원회(NWO)가 자금을 지원하는 연구 프로그램인 NEMI(National Roadmap for Large-Scale Research Infrastructure)의 일부입니다(프로젝트 번호 184.034.014).
자료
| Name | Company | Catalog Number | Comments |
| Chemicals and reagents | |||
| Antibody donkey anti-mouse Alexa Fluor 488 | Life Technologies | #A21202 | use 1:250 |
| Antibody donkey anti-rabbit Alexa Fluor 568 | Life Technologies | A#10042 | use 1:250 |
| Antibody mouse anti-LC3 | Cosmo Bio | CTB-LC3-2-IC | use 1:100 |
| Antibody rabbit anti-LAMP1 | Cell Signaling | 9091 | use 1:250 |
| Bovine serum Albumin, fraction V | Sigma-Aldrich | A-9647 | |
| BSA-c | Aurion | 900.099 | |
| BSA-conjugated gold | Cell Microscopy Core, UMC Utrecht | BSAG 5 nm | |
| Water-free Chloroform | Merck | 1.02447.0500 | |
| DAPI | Invitrogen | 10184322 | Use at end concentration of 10 µg/ml |
| EGTA | Sigma-Aldrich | E4378 | |
| Fish-skin Gelatin | Sigma-Aldrich | G7765 | |
| Food-grade gelatin | Merck | G1890 | |
| Formvar, Vinylec E | SPI | 02492-RA | |
| Gluteraldehyde | Serva | 23115.01 | See CAUTION note |
| Glycerol | Boom | MBAK 7044.1000 | |
| Glycine | Merck | 1042010250 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Methylcellulose, 25 centipoises | Sigma-Aldrich | M-6385 | |
| MgSO4 | Riedel-de Haen | 12142 | |
| Na2HPO4 (PB component A) | Merck | 106580-0500 | |
| NaBH4 | Merck | 806373 | |
| NaH2PO4 (PB component B) | Merck | 106346 | |
| NH4OH | Sigma-Aldrich | 221228-0025 | |
| Oxalic acid | Merck | 100495 | |
| Paraformaldehyde prills | Sigma-Aldrich | 441244 | See CAUTION note |
| PIPES | Merck | 110220 | |
| Protein-A conjugated gold | Cell Microscopy Core, UMC Utrecht | PAG 5, 10, 15 or 20 nm | |
| Sucrose D(+) | VWR | 27483294 | |
| Uranyl acetate | SPI | 020624-AB | See CAUTION note |
| Tools and consumables | |||
| Pick-up loop | Electron Microscopy Sciences | 70944 | |
| Filter paper, qualitative, medium-fast | LLG | 6.242 668 | |
| Finder grids | Ted Pella | G100F1 | |
| Grids | Cell Microscopy Core, UMC Utrecht | CU 100 mesh | |
| Microscopes | |||
| Leica Thunder widefield microscope | Leica | Components: 100x, 1.47 NA TIRF objective; Photometrics prime 95B sCMOS camera; LAS X software; | |
| Leica UC7 ultracryomicrotome | Leica | ||
| Tecnai T12 | FEI | Components: Veleta VEL-FEI-TEC12-TEM camera; SerialEM software | |
| Software | |||
| ec-CLEM in icy | open source | Paul-Gilloteaux et al., 2017 | |
| Fiji | open source | Schindelin et al., 2012 | |
| IMOD | open source | Mastronarde et al., 2017 | |
| Photoshop | Adobe | ||
| SerialEM | open source | Mastronarde et al., 2018 |
참고문헌
- Hu, Y., Reggiori, F. Molecular regulation of autophagosome formation. Biochemical Society Transactions. 50 (1), 55-69 (2022).
- Reggiori, F., Ungermann, C. Autophagosome maturation and fusion. Journal of Molecular Biology. 429 (4), 486-496 (2017).
- Kimura, S., Noda, T., Yoshimori, T. Dissection of the autophagosome maturation process by a novel reporter protein, tandem fluorescent-tagged LC3. Autophagy. 3 (5), 452-460 (2007).
- Baba, M., Takeshige, K., Baba, N., Ohsumi, Y. Ultrastructural analysis of the autophagic process in yeast: detection of autophagosomes and their characterization. The Journal of Cell Biology. 124 (6), 903-913 (1994).
- Takeshige, K., Baba, M., Tsuboi, S., Noda, T., Ohsumi, Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. The Journal of Cell Biology. 119 (2), 301-311 (1992).
- De Duve, C., Wattiaux, R. Functions of lysosomes. Annual Review of Physiology. 28, 435-492 (1966).
- Arstila, A. U., Trump, B. F. Studies on cellular autophagocytosis. The formation of autophagic vacuoles in the liver after glucagon administration. The American Journal of Pathology. 53 (5), 687-733 (1968).
- Eskelinen, E. L., Reggiori, F., Baba, M., Kovács, A. L., Seglen, P. O. Seeing is believing: The impact of electron microscopy on autophagy research. Autophagy. 7 (9), 935-956 (2011).
- De Mazière, A., et al. An optimized protocol for immuno-electron microscopy of endogenous LC3. Autophagy. 18 (12), 3004-3022 (2022).
- López-Terrada, D., Cheung, S. W., Finegold, M. J., Knowles, B. B. Hep G2 is a hepatoblastoma-derived cell line. Human Pathology. 40 (10), 1512-1515 (2009).
- Tanida, I., Minematsu-Ikeguchi, N., Ueno, T., Kominami, E. Lysosomal turnover, but not a cellular level, of endogenous LC3 is a marker for autophagy. Autophagy. 1 (2), 84-91 (2005).
- Slot, J. W., Geuze, H. J. Cryosectioning and immunolabeling. Nature Protocols. 2 (10), 2480-2491 (2007).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Current Protocols in Cell Biology. 13 (1), (2001).
- vander Beek, J., de Heus, C., Liv, N., Klumperman, J. Quantitative correlative microscopy reveals the ultrastructural distribution of endogenous endosomal proteins. The Journal of Cell Biology. 221 (1), e202106044(2022).
- Mastronarde, D. N. Advanced data acquisition from electron microscopes with SerialEM. Microscopy and Microanalysis. 24, 864-865 (2018).
- Mastronarde, D. N., Held, S. R. Automated tilt series alignment and tomographic reconstruction in IMOD. Journal of Structural Biology. 197 (2), 102-113 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Paul-Gilloteaux, P., et al. EC-CLEM: Flexible multidimensional registration software for correlative microscopies. Nature Methods. 14 (2), 102-103 (2017).
- Heiligenstein, X., Paul-Gilloteaux, P., Raposo, G., Salamero, J. eC-CLEM: A multidimension, multimodel software to correlate intermodal images with a focus on light and electron microscopy. Methods in Cell Biology. 140, 335-352 (2017).
- Fermie, J., et al. Bimodal endocytic probe for three-dimensional correlative light and electron microscopy. Cell Reports Methods. 2 (5), 100220(2022).
- Fokkema, J., et al. Fluorescently labelled silica coated gold nanoparticles as fiducial markers for correlative light and electron microscopy. Scientific Reports. 8 (1), 13625(2018).
- Czaja, M. J., et al. Functions of autophagy in normal and diseased liver. Autophagy. 9 (8), 1131(2013).
- Robinson, J. M., Takizawa, T., Pombo, A., Cook, P. R. Correlative fluorescence and electron microscopy on ultrathin cryosections: Bridging the resolution gap. Journal of Histochemistry and Cytochemistry. 49 (7), 803-808 (2001).
- Mohammadian, S., et al. High accuracy, fiducial marker-based image registration of correlative microscopy images. Scientific Reports. 9 (1), 3211(2019).
- Tokuyasu, K. T. A study of positive staining of ultrathin frozen sections. Journal of Ultrasructure Research. 63 (3), 287-307 (1978).
- Slot, J. W., Geuze, H. J. A new method of preparing gold probes for multiple-labeling cytochemistry. European Journal of Cell Biology. 38 (1), 87-93 (1985).
- Klumperman, J., Raposo, G. The complex ultrastructure of the endolysosomal system. Cold Spring Harbor Perspectives in Biology. 6 (10), a016857(2014).
- Geuze, H. J., Slot, J. W., Strous, G. J., Lodish, H. F., Schwartz, A. L. Intracellular site of asialoglycoprotein receptor-ligand uncoupling: Double-label immunoelectron microscopy during receptor-mediated endocytosis. Cell. 32 (1), 277-287 (1983).
- Biazik, J., Ylä-Anttila, P., Vihinen, H., Jokitalo, E., Eskelinen, E. L. Ultrastructural relationship of the phagophore with surrounding organelles. Autophagy. 11 (3), 439-451 (2015).
- Fahimi, H. D., Reich, D., Völkl, A., Baumgart, E. Contributions of the immunogold technique to investigation of the biology of peroxisomes. Histochemistry and Cell Biology. 106 (1), 105-114 (1996).
- Vicidomini, G., et al. A novel approach for correlative light electron microscopy analysis. Microscopy Research and Technique. 73 (3), 215-224 (2010).
- Vicidomini, G., et al. High data output and automated 3D correlative light-electron microscopy method. Traffic. 9 (11), 1828-1838 (2008).
- Cortese, K., et al. 3D HDO-CLEM: cellular compartment analysis by correlative light-electron microscopy on cryosection. Methods in Cell Biology. 111, 95-115 (2012).
- van Rijnsoever, C., Oorschot, V., Klumperman, J. Correlative light-electron microscopy (CLEM) combining live-cell imaging and immunolabeling of ultrathin cryosections. Nature Methods. 5 (11), 973-980 (2008).
- Razi, M., Chan, E. Y. W., Tooze, S. A. Early endosomes and endosomal coatomer are required for autophagy. The Journal of Cell Biology. 185 (2), 305-321 (2009).
- Ligeon, L. A., Barois, N., Werkmeister, E., Bongiovanni, A., Lafont, F. Structured illumination microscopy and correlative microscopy to study autophagy. Methods. 75, 61-68 (2015).
- Biazik, J., Vihinen, H., Anwar, T., Jokitalo, E., Eskelinen, E. L. The versatile electron microscope: An ultrastructural overview of autophagy. Methods. 75, 44-53 (2015).
- Gudmundsson, S., Kahlhofer, J., Baylac, N., Kallio, K., Eskelinen, E. L. Correlative light and electron microscopy of autophagosomes. Methods in Molecular Biology. 1880, 199-209 (2019).
- Kriel, J., et al. Correlative light and electron microscopy (CLEM): bringing together the best of both worlds to study neuronal autophagy. Imaging and Quantifying Neuronal Autophagy. 171, 135-147 (2022).
- Largeau, C., Legouis, R. Correlative light and electron microscopy to analyze LC3 proteins in Caenorhabditis elegans embryo. Methods in Molecular Biology. 1880, 281-293 (2019).
- Fermie, J., et al. Single organelle dynamics linked to 3D structure by correlative live-cell imaging and 3D electron microscopy. Traffic. 19 (5), 354-369 (2018).
- Kuma, A., Matsui, M., Mizushima, N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy: Caution in the interpretation of LC3 localization. Autophagy. 3 (4), 323-328 (2007).
- Ladinsky, M. S., Howell, K. E. Electron tomography of immunolabeled cryosections. Methods in Cell Biology. 79, 543-558 (2007).
- Oorschot, V., Lindsey, B. W., Kaslin, J., Ramm, G. TEM, SEM, and STEM-based immuno-CLEM workflows offer complementary advantages. Scientific Reports. 11 (1), 899(2021).
- Franke, C., et al. Correlative single-molecule localization microscopy and electron tomography reveals endosome nanoscale domains. Traffic. 20 (8), 601-617 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유