Method Article
לוקליזציה אולטרה-מבנית של LC3 אנדוגני על ידי מיקרוסקופ אור-אלקטרונים קורלטיבי בחתך
In This Article
Summary
כאן, אנו מציגים פרוטוקול למיקרוסקופ אור-אלקטרונים מתאמי אופטימלי על חתך המבוסס על תיוג אנדוגני פלואורסצנטי ככלי לחקר לוקליזציה של חלבונים נדירים ביחס לאולטרה-מבנה תאי. כוחה של גישה זו מודגם על ידי לוקליזציה אולטרה-מבנית של LC3 אנדוגני בתאים מורעבים ללא טיפול Bafilomycin.
Abstract
הדמיה של אברונים אוטופגיים ברמה האולטרה-מבנית על ידי מיקרוסקופ אלקטרונים (EM) חיונית כדי לקבוע את זהותם ולחשוף פרטים החשובים להבנת התהליך האוטופגי. עם זאת, שיטות EM חסרות לעתים קרובות מידע מולקולרי, מה שחוסם את המתאם של מידע אולטרה-מבני המתקבל על ידי EM ללוקליזציה מבוססת מיקרוסקופיה פלואורסצנטית של חלבוני אוטופגיה ספציפיים. יתר על כן, הנדירות של אוטופגוזומים בתנאים תאיים שלא השתנו מעכבת את חקירת הקרינה האלקטרומגנטית, הדורשת הגדלה גבוהה, ולכן מספקת שדה ראייה מוגבל.
בתשובה לשני האתגרים, יושמה שיטת מיקרוסקופ אור-אלקטרונים מתאמי (CLEM) המבוססת על תיוג פלואורסצנטי כדי להתאים סמן אוטופגוזומלי נפוץ, LC3, לאולטרה-מבנה EM. השיטה שימשה לסינון מהיר של תאים במיקרוסקופ פלואורסצנטי לתיוג LC3 בשילוב עם סמנים רלוונטיים אחרים. לאחר מכן, התכונות האולטרה-סטרוקטורליות הבסיסיות של כתמים נבחרים המסומנים בתווית LC3 זוהו על ידי CLEM. השיטה יושמה על תאים מורעבים מבלי להוסיף מעכבי החמצה ליזוזומלית.
בתנאים אלה, LC3 נמצא בעיקר על אוטופגוזומים ולעתים רחוקות באוטוליזוזומים, שבהם LC3 מתפרק במהירות. נתונים אלה מראים הן את ההיתכנות והן את הרגישות של גישה זו, ומוכיחים כי CLEM יכול לשמש כדי לספק תובנות אולטרה-מבניות על אוטופגיה בתיווך LC3 בתנאים מקומיים - ללא טיפולים תרופתיים או שינויים גנטיים. בסך הכל, שיטה זו מציגה כלי רב ערך למחקרי לוקליזציה אולטרה-סטרוקטורליים של חלבוני אוטופגיה ואנטיגנים נדירים אחרים על ידי גישור מיקרוסקופ אור לנתוני EM.
Introduction
אוטופגיה היא תהליך מפתח לפינוי ומיחזור של חלבונים ואברונים ציטופלזמיים. תהליך המאקרו-אוטופגיה (להלן אוטופגיה) כרוך בהיווצרות אברונים דו-קרומיים, אוטופגוזומים, המאפשרים לתאים להקיף מולקולות ציטופלזמיות ואברונים לצורך פירוק ליזוזומלי. אוטופגיה מתרחשת ברמה בסיסית ברוב התאים והיא מווסתת בתגובה לתנאים תאיים, כגון רעב או לחץ תאי. אוטופגיה מתרחשת באופן ספציפי למצע, המכוון למבנים או חלבונים ספציפיים לצורך פירוק, או כתהליך תפזורת לא סלקטיבי המקיף חלקים של הציטוזול. באוטופגיה סלקטיבית, אוטופגוזומים נוצרים על ידי צימוד חלבונים ממשפחת Atg8 (חלבונים הקשורים למיקרוטובולים 1A/B שרשרת אור 3A/B/C [LC3] ו-GABARAPs) לממברנות שמקורן באנדוזומים ממוחזרים, גולג'י ו/או רשתית אנדופלסמית (ER)1. LC3 מזהה מטען אוטופגי בציטוזול ישירות או באמצעות מתאמי אוטופגיה סלקטיביים כגון P62/SQSTM. לאחר מכן ניתן להצמיד קרומים אוטופגיים חדשים ל-LC3, להתרחב ולהתיך כדי ליצור קרום כפול שלם התוחם את המטען הנקרא אוטופגוזום. האוטופגוזום מבשיל ובסופו של דבר מתמזג עם אנדוזום או ליזוזום, ולאחר מכן המטען האוטופגי והמתאמים מתפרקים2.
מחקרים על היווצרות, הבשלה ואיחוי אוטופגוזום עושים לעתים קרובות שימוש בטכנולוגיות של מיקרוסקופ אור. מיקרוסקופ פלואורסצנטי של LC3 משמש בדרך כלל להערכת מספר לוקליזציה תאית של אוטופגוזומים בתנאים שונים. יתר על כן, על ידי צימוד LC3 ל- GFP רגיש ל- pH ו- RFP יציב ל- pH במה שמכונה בדיקת טנדם, ניתן למדוד את השטף הכולל של אוטופגיה בתאים חיים כפונקציה של אובדן פלואורסצנטיות GFP3. גישות אלה הן כלים רבי ערך עבור חוקרים להבין את התפקיד והמנגנון של אוטופגיה בתנאים שונים. כלי רב ערך נוסף הוא מיקרוסקופ אלקטרונים (EM), אשר חושף את מבנה העל של אברונים אוטופגיים בשלבים שונים של אוטופגיה 4,5,6,7,8. נכון להיום, EM היא עדיין השיטה המועדפת לזהות את השלבים המדויקים של היווצרות אוטופגוזום על ידי הבחנה בין קרומים אוטופגיים שונים לפי מורפולוגיה: פגופור (קרום כפול שאינו סגור במלואו), אוטופגוזום (קרום כפול סגור סביב מטען ציטוסולי), ואוטוליזוזום (אובדן [חלקי] של הממברנה האוטופגית הפנימית). מורפולוגיה ללא מידע מולקולרי, לעומת זאת, עלולה להיות מועדת לזיהוי שגוי או לעמימות. Immuno-EM היא השיטה המקיפה ביותר לאפיון מולקולרי סימולטני וסיווג מורפולוגי של אברונים אוטופגיים. לדוגמה, תיוג אימונוגולד של LC3 על קריוסקציות מופשרות מאפשר לוקליזציה אולטרה-מבנית של LC3 וזיהוי מדויק של אברונים מסומנים LC39.
החיסרון של EM הוא שדה הראייה הקטן שמגיע עם ההגדלה הגבוהה הנדרשת כדי לצפות באולטרה-מבנה העדין של ממברנות אוטופגיות, ובמקרה של immuno-EM, לאתר את התווית המסמנת את החלבון המעניין. בשל המחסור שלהם ורמות חלבון נמוכות, זה בדרך כלל מעכב את ניתוח EM כמותי של אוטופגוזומים. כדי להגדיל את מספר האוטופגוזומים, לעתים קרובות מורעבים תאים ומטופלים ב-Bafilomycin A1 (BafA1), מעכב החמצה ליזוזומלית והתפרקות. ללא טיפול BafA1, החיפוש אחר אוטופגוזומים על ידי EM הוא גוזל זמן, בשל המחסור של אברונים אלה. השיטה המוצגת בכתב יד זה מטפלת בבעיה זו באמצעות תיוג פלואורסצנטי והדמיה של LC3 אנדוגני על קריוסקציות מופשרות במיקרוסקופ פלואורסצנטי לפני הכנה נוספת ל- EM. התמונות הפלואורסצנטיות מנחות את החיפוש אחר מבנים המסומנים ב-LC3 ב-EM. לאחר האיסוף, תמונות EM מתואמות עם תמונות פלואורסצנטיות כדי להוסיף מידע מולקולרי - נוכחות LC3 - למבנה העל של התא. שיטת 'על חתך CLEM' זו מגדילה מאוד את היכולת למצוא מבנים המסומנים LC3, במיוחד בתנאים לא מטופלים, לזיהוי וסיווג לאחר מכן על ידי EM.
שיטה זו יושמה על תאי HEPG210 שמקורם בהפטובלסטומה מורעבים כדי למצוא אוטופגוזומים בתנאים ללא שינוי (כלומר, לא נעשה שימוש ב- BafA1). נמצאו יחסית מעט פונקטה פלואורסצנטית (פחות מאחד לכל פרופיל תא בחתך של 90 ננומטר), מה שתואם את התחלופה הגבוהה של LC311. דלילות זו של LC3-puncta הדגישה את הערך של CLEM; על ידי בחירת אזורים עם מספר פונקטה פלואורסצנטית להדמיה ב- EM, נמצאו אברונים חיוביים LC3 ואופיינו בצורה הרבה יותר יעילה מאשר באמצעות EM חיסוני קונבנציונאלי. זה גילה שרוב האברונים החיוביים ל-LC3 היו אוטופגוזומים, כפי שהוגדרו על ידי המורפולוגיה שלהם, בניגוד לתוצאות שהתקבלו בתאים שטופלו ב-BafA1, שם אוטוליזוזומים נפוצים יותר9. נתונים אלה מראים כי עם CLEM על חתך, אוטופגיה ניתן לחקור ברמה ultrastructural ללא צורך לעכב זרימה אוטופגית.
Protocol
1. הכנת כלים וריאגנטים
הערה: לקבלת ריאגנטים, מאגרים ופתרונות נדרשים, ראה קובץ משלים 1 או 12 לקבלת מידע נוסף. לפרטים הקשורים לכל החומרים, הריאגנטים, הציוד והתוכנות המשמשים בפרוטוקול זה, עיין בטבלת החומרים.
- קיבוע
- הכן חיץ פוספט 0.2 M (PB) או 0.2 M צינורות, hepes, egta, מאגר MgSO4 (PHEM), כמתואר בקובץ משלים 1, לשימוש כבסיס לפתרונות קיבוע.
הערה: קיבועים נאגרים באופן שגרתי במאגר 0.1 M PB או PHEM כדי לחצוץ מפני החמצה הנגרמת על ידי תגובת אלדהיד עם החומר הביולוגי. - מכיוון שאיכות הפרפורמאלדהיד (PFA) היא המפתח לקיבוע אמין של מבנה העל של הדגימות, השתמש ב- PFA ברמת EM. כדי לעקוב אחר פרוטוקול זה, השתמש בפתרונות מלאי של 16%, שהוכנו מסלסולי PFA באיכות גבוהה (ראה קובץ משלים 1).
התראה: פרפורמאלדהיד הוא כימיקל מסוכן (הצהרות סיכון H228, H301, H302, H311, H314, H315, H317, H318, H331, H332, H335, H341, H350). בעת עבודה עם PFA, ללבוש ציוד מגן (כפפות, מעיל מעבדה, משקפי מגן) ולעבוד עם מכסה מנוע כימי. פסולת המכילה PFA יש לאסוף ולסלק בהתאם להנחיות ולתקנות המכונים. - ערבבו 10 מ"ל של 0.2 M PB, 5 מ"ל של 16% PFA (במים נטולי מינרלים [dH 2 O]), ו-5 מ"ל של dH2O להכנת תמיסה קבועה של 4% PFA.
- אופציונלי: הוספת 0.02%-0.5% גלוטראלדהיד (GA) לתמיסה המקובעת משלב 1.1.3 משפרת את שימור מבנה העל, אך מפחיתה את האנטיגניות של הדגימה כלפי נוגדנים רבים.
הערה: כאשר יש צורך בקיבוע GA, השתמש ב- GA ברמת EM מספק מתאים.
התראה: גלוטראלדהיד הוא כימיקל מסוכן (הצהרות סיכון H301, H302, H314, H317, H330, H332, H334, H335, H400, H411). יש לעבוד במכסה מנוע כימי וללבוש ציוד מגן (כפפות, מעיל מעבדה ומשקפי מגן) בעת מניפולציה GA. פסולת המכילה GA יש לאסוף ולהשליך בהתאם להנחיות ולתקנות המכונים.
- הכן חיץ פוספט 0.2 M (PB) או 0.2 M צינורות, hepes, egta, מאגר MgSO4 (PHEM), כמתואר בקובץ משלים 1, לשימוש כבסיס לפתרונות קיבוע.
- כלים וחומרים
- גרדו את פני השטח של פינים של מחזיק דגימות אלומיניום והסוניק אותם באתנול 3 x 10 דקות כדי להסיר שאריות מתכת ולהבטיח היצמדות אופטימלית כאשר גושי תאים משובצים ג'לטין מותקנים על הפינים.
- השתמש במיכל אחסון המתאים לאחסון סיכות מחזיק דגימות האלומיניום עם הדגימות שלהם בחנקן נוזלי (LN2).
- עשו מניפולטור על ידי הצמדת שערה או ריס בודדים לקצה שיפוד עץ באמצעות לק.
- הכינו לולאת איסוף. כופפו חוט נירוסטה בעובי 0.3 מ"מ סביב מוט עגול בקוטר 3 מ"מ וסובבו את הקצוות יחד, ויצרו לולאה בקצה אחד. הכניסו את הקצוות המעוותים לקצה פיפטה. מכניסים שיפוד עץ מהקצה השני ומדביקים עם דבק או שרף.
הערה: לולאת איסוף זמינה גם באופן מסחרי (ראה טבלת חומרים). - כדי להכין את לולאות ייבוש הרשת, בצע את אותם השלבים להכנת לולאות איסוף: צור חוט נירוסטה בלולאה של 4 מ"מ והצמיד על קצה פיפטה גדול עם דבק או שרף.
- צפו את הרשתות בסרט תומך דק כגון formvar (פרוטוקול בקובץ משלים 1). לפני השימוש, מצפים את הרשתות בשכבה דקה של פחמן.
הערה: רשתות מוכנות לשימוש זמינות באופן מסחרי (ראה טבלת חומרים). רשתות מצופות Formvar ניתן לאחסן ללא הגבלת זמן בטמפרטורת החדר (RT); רשתות מצופות פחמן ניתן לאחסן במשך מספר חודשים ב RT. - הכינו מגלשות זכוכית נקיות וכיסויים גדולים (24 מ"מ x 24 מ"מ הוא אידיאלי עם שקופיות זכוכית ברוחב 25 מ"מ), כמו ב-13.
2. קיבוע והכנת מדגם
- קיבוע
- השתמש בקיבוע שהוכן בשלב 1.1.3 (4% PFA ב- 0.1 M PB). עבור קווי תאים דבקים, תרבית 1-5 × 10 6 תאים בכלים6 ס"מ. הוסף את הקיבוע למדיום התרבית ביחס של 1:1 ודגר על הדגימה במשך 5 דקות ב- RT. לאחר מכן, החלף את התערובת המקובעת בינונית בקיבוע בלבד ודגר במשך שעתיים ב- RT.
הערה: ספירת התאים המדויקת, המפגש ותנאי התרבית עשויים להשתנות בהתאם למערכת המודל שבה נעשה שימוש. - אחסן את הדגימות למשך הלילה או עד 3-4 שבועות ב- PFA של 0.5% ב- 0.1 M PB ב- 4 ° C.
הערה: ניתן להוסיף GA לקיבוע (ראה שלב 1.1.4) ולשנות את אורך הקיבוע כדי למצוא איזון אופטימלי בין שימור המורפולוגיה והאנטיגניות, המשתנה לפי דגימה ותיוג. לקבלת מידע נוסף, ראה14.
- השתמש בקיבוע שהוכן בשלב 1.1.3 (4% PFA ב- 0.1 M PB). עבור קווי תאים דבקים, תרבית 1-5 × 10 6 תאים בכלים6 ס"מ. הוסף את הקיבוע למדיום התרבית ביחס של 1:1 ודגר על הדגימה במשך 5 דקות ב- RT. לאחר מכן, החלף את התערובת המקובעת בינונית בקיבוע בלבד ודגר במשך שעתיים ב- RT.
- הטבעה לדוגמה
- לשטוף את הכלים עם תאים קבועים 3x עם PBS ב RT. לאחר מכן, החלף ב- PBS המכיל 0.15% גליצין ודגור במשך 10 דקות ב- RT.
- החליפו את PBS המכיל 0.15% גליצין בג'לטין 1% ב-PBS שחומם מראש ל-37°C, וגרדו והעבירו את התאים בג'לטין 1% לצינור מיקרוצנטריפוגה. גלולה את התאים ב 6,000 × גרם במשך 1 דקות ב RT במיקרוצנטריפוגה. לאחר מכן, להסיר את 1% ג'לטין מבלי להפריע את הגלולה ולהוסיף 12% ג'לטין מחומם ל 37 ° C. השהה מחדש את גלולת התא על ידי פיפטוף עדין למעלה ולמטה עם קצות פיפטה או פיפטות פסטר זכוכית שחוממו מראש ל 37 מעלות צלזיוס.
- לדגור ב 37 ° C במשך 10 דקות; לאחר מכן, גלולה את התאים ב 6,000 × גרם במשך 1 דקה. ממצקים את הג'לטין על קרח למשך 30 דקות.
- כדי להסיר את התאים המשובצים בג'לטין מהצינור, חתכו את קצה הצינור המכיל את הגלולה משאר הצינור בעזרת סכין גילוח. לאחר מכן, בניצב לחתך הראשון, חותכים את קצה הצינור עם גלולת התא לשניים.
- דגרו על שני חצאי קצה הצינור המכילים את גלולת התא המשובצת בג'לטין בסוכרוז 2.3 מ 'למשך 10 דקות ב -4 מעלות צלזיוס. זה גורם לחצאי כדורי התא המשובצים בג'לטין להתכווץ מעט ולהתנתק מצינור הפלסטיק.
הערה: כדורי התא המשובצים בג'לטין צריכים להישמר בטמפרטורה של 4°C או קרים כקרח ככל האפשר, כדי למנוע מהסוכרוז באורך 2.3 M להפוך צמיג מדי והג'לטין רך מדי. במהלך מניפולציה של כדורי התא המשובצים בג'לטין בשלבים הבאים, עבוד עם דגימה אחת בלבד בכל פעם ושמור את האחרות על קרח, או עבוד בחדר קר (~ 4 ° C). הימנע מהתחממות יתר של כדורי התא המשובצים בג'לטין על ידי אור השמש, מנורות מיקרוסקופ חם או מקורות חום אחרים. - הסר את חצאי הצינור עם גלולת התא המשובצת בג'לטין מהסוכרוז באורך 2.3 מטר. לאחר מכן, הסר את חצאי גלולות התא המשובצות בג'לטין מחצאי צינור הפלסטיק באמצעות פינצטה. חותכים ידנית את הגלולה לגושים בגודל מתאים (~ 1 מ"מ3) עם סכין גילוח. השתמש במיקרוסקופ מנתח סטריאו כדי להגדיל את הנושא במהלך החיתוך.
- להחדיר את בלוקים התא משובץ ג'לטין עם 2.3 M סוכרוז במשך 3-16 שעות, להפוך מקצה לקצה ברוטור ב 4 ° C.
- הניחו בלוק תא מוטבע בג'לטין על פין מחזיק דגימת אלומיניום (ראה שלב 1.2.1). השאירו מספיק סוכרוז 2.3 מ' סביב קצוות הבלוק כך שהוא יוצר 'צווארון' דק בין הבלוק לסיכה. הימנע יותר מדי 2.3 מ 'סוכרוז מכסה את החלק העליון של הבלוק. יש להקפיא בהצמדה ולאחסן ב-LN2.
3. חלוקת חתכים
- חיתוך (ראו גם12)
- קח סיכה עם בלוק של תאים משובצים ג'לטין מתוך אחסון LN2 והנח אותו בתוך cryomicrotome להגדיר על -80 ° C.
- חתוך את חזית הבלוק כדי לשטח את פני השטח שלו ולקבל חתכים ~ 250 ננומטר. טבלו את הלולאה בקוטר 3 מ"מ בתמיסת איסוף (1:1, 2.3 מ' סוכרוז ו-2% מתילצלולוז), הכניסו את הלולאה לתא ההקפאה של המיקרוטום והמתינו עד שיתחיל להיווצר קרח בטיפה (בדרך כלל 5-7 שניות). לאחר מכן, מיד להרים את החלק על ידי לחיצה מהירה אך עדינה על הטיפה נגדם. הסר את הלולאה מתא ההקפאה, המתן עד שהטיפה תפשיר לחלוטין, ולחץ על הטיפה על מגלשת זכוכית.
- בדוק את כיוון התא על ידי צביעה כחולה toluidine של הסעיפים.
- מניחים טיפה של תמיסה כחולה טולוידין (ראה קובץ משלים 1) על גבי החלקים על מגלשת זכוכית ומייבשים על פלטת חימום של 80 מעלות צלזיוס עד ששולי הטיפה יבשים.
- הסר את מגלשת הזכוכית מצלחת החימום ושטוף בעדינות את כחול הטולוידין עם dH2O, תוך איסוף במיכל פסולת מתאים.
- יבשו את מגלשת הזכוכית ובדקו את כיוון התא במקטעים באמצעות מיקרוסקופ אור פשוט.
- חותכים את דפנות הבלוק על ידי חתך 50-100 מיקרומטר לצד פני הבלוק לדוגמה עם פינת הסכין. חתוך ארבעה צדדים של פני גוש הדגימה על ידי סיבוב מחזיק הדגימה ב- 90° לאחר חיתוך כל צד ליצירת מלבן בולט ~ 250 מיקרומטר x 375 מיקרומטר. בחר באזור הבולט בהתבסס על כיוון התא שנקבע בשלב הקודם.
- חלוקה ואיסוף
- מצננים את הקריומיקרוטום לטמפרטורה של -100°C. חתך סרט מהמלבן הבולט, הקטעים בעובי 70-90 ננומטר ועם ברק כסוף-זהוב. יש להרחיק את הקטעים מקצה סכין היהלום בעזרת שערה על מקל (ראה סעיף 1.2.3) ליצירת סרט ארוך (2-5 מ"מ).
- לאחר יצירת רצועת כלים מתאימה, הפסק את המקטעים כדי להרים את רצועת הכלים. טובלים את לולאת האיסוף בקוטר 3 מ"מ בסוכרוז בקוטר 2.3 מ' ותערובת של 2% מתילצלולוז ביחס של 1:1, מכניסים את הלולאה לתא ההקפאה של המיקרוטום, וממתינים עד שהטיפה מתחילה לקפוא (בדרך כלל 5-7 שניות). לאחר מכן, מיד להרים את החלקים על ידי לחיצה מהירה אך עדינה על הטיפה נגדם. הסר את הלולאה מתא ההקפאה, המתן עד שהטיפה תפשיר לחלוטין, ולחץ על הטיפה על רשת מוכנה (שלב 1.2.6).
הערה: רשתות עם מקטעים ניתן לאחסן ב 4 ° C במשך מספר חודשים.
4. תיוג ומיקרוסקופ אור
- תיוג
- הניחו את הרשתות עם מקטעים (איור 1A) בצד החתך כלפי מטה על ~1 מ"ל של PBS בצלחת קטנה או צלחת מרובת בארות. יש לדגור בטמפרטורה של 37°C למשך 30 דקות.
הערה: שלב זה מסיר את הג'לטין שנמצא בין התאים; ג'לטין אינו נחוץ לאחר החתך ומפריע לפרוטוקול הנותר. - עבד את הרשתות בצד החתך כלפי מטה על ~ 75 μL טיפות על פרפילם (ראה איור 1B). יש להתחיל עם PBS + שטיפות גליצין 0.15% (3 x 2 דקות) ב-RT. לאחר מכן, דגרו על הרשתות עם 0.1% אלבומין בסרום בקר (BSA)-c + 0.5% ג'לטין מעור דגים (FSG) ב-PBS למשך 10 דקות ב-RT כשלב החסימה. דללו נוגדנים ראשוניים ב-0.1% BSA-c + 0.5% FSG ב-PBS ודגרו על הרשתות על ~10 μL טיפות של תמיסה זו למשך שעה אחת ב-RT (איור 1C).
- שטפו את הרשתות ב-0.1% BSA ב-PBS 5x ב-RT. לאחר מכן, דללו נוגדנים משניים ו-4',6-diamidino-2-phenylindole (DAPI; 10 מיקרוגרם/מ"ל) ב-0.1% BSA-c + 0.5% FSG ב-PBS ודגרו על הרשתות על ~10 μL טיפות של תמיסה זו למשך 30+ דקות ב-RT (איור 1C). שטפו את הרשתות ב-PBS 5x ב-RT.
הערה: לחלופין, נוגדן משני יכול להיות מסומן עם חלקיקי זהב קולואידים 5, 10, 15 או 20 ננומטר מצומדים לחלבון A (PAG) עבור לוקליזציה של החלבון המעניין EM. אם זה רצוי, לדגור על הרשתות עם PAG במשך 20 דקות ב- RT לאחר שלב 4.1.3. לאחר מכן, שטפו 5x עם PBS ב- RT. הימנעו משימוש בו זמנית במספר נוגדנים ראשוניים ושימו לב לתגובתיות של PAG ל- IgGs של מינים שונים כדי למנוע תגובות צולבות לא רצויות. לקבלת מידע נוסף, ראה12.
- הניחו את הרשתות עם מקטעים (איור 1A) בצד החתך כלפי מטה על ~1 מ"ל של PBS בצלחת קטנה או צלחת מרובת בארות. יש לדגור בטמפרטורה של 37°C למשך 30 דקות.
- הרכבה של דגימות למיקרוסקופ אור
- השקיעו את הרשתות ב-50% גליצרול ב-dH 2 O2x 5 דקות ב-RT. דחפו את הרשתות בין מגלשת זכוכית ל-coverslip ב-50% גליצרול, רשת אחת לכל כיסוי, עם מקטעים הפונים למכסה (איור 1D).
הערה: איכות ההתוויה עלולה להידרדר כאשר הרשתות מותקנות ב-50% גליצרול למשך יותר מ-30 דקות. לכן מומלץ להרכיב ולצלם שתיים או שלוש רשתות בכל פעם ולהשאיר את האחרות על פתרון התיוג המשני.
- השקיעו את הרשתות ב-50% גליצרול ב-dH 2 O2x 5 דקות ב-RT. דחפו את הרשתות בין מגלשת זכוכית ל-coverslip ב-50% גליצרול, רשת אחת לכל כיסוי, עם מקטעים הפונים למכסה (איור 1D).
- מיקרוסקופ אור
- קח מגלשת זכוכית עם רשתות דחוקות למיקרוסקופ שדה רחב עם שלב אוטומטי. בחר מטרת שמן בהגדלה גבוהה (63x או 100x). צור ערכת אריחים של תמונה (חלק מ) רצועת המקטעים (איור 1E).
הערה: נוגדנים משניים מסוימים יכולים ליצור אגרגטים פלואורסצנטיים על רשתות, במיוחד סביב קפלים או קרעים בקטעים. בנוסף, סוגים מסוימים של תאים ורקמות מכילים מבנים אוטופלואורסצנטיים. אם צפויות בעיות כאלה, מומלץ לכלול רשת בקרה שלילית שאינה מודגרת עם נוגדן ראשוני.
- קח מגלשת זכוכית עם רשתות דחוקות למיקרוסקופ שדה רחב עם שלב אוטומטי. בחר מטרת שמן בהגדלה גבוהה (63x או 100x). צור ערכת אריחים של תמונה (חלק מ) רצועת המקטעים (איור 1E).
- ביטול הרכבה וניגוד EM
- הוסף 10 μL של dH2O לצד כריך כיסוי הזכוכית והמתן לפעולה נימית כדי למלא את ממשק הכריך מכסה הזכוכית. יש להסיר בזהירות את הכיסוי מבלי לערבב שמן טבילה בגליצרול. אחזר את הרשתות עם פינצטה ושקע ב- dH2O 3x ב- RT כדי לשטוף את 50% גליצרול.
הערה: שמן יכול להפריע לצביעת אורניל ולדרדר את ניגודיות ה- EM. - יבש בזהירות את גב הרשת עם נייר טישו ללא סיבים.
הערה: אם הדגימה סומנה גם בחלקיקי זהב קולואידיים, בצע את השלבים הבאים: מקם את הרשת עם מקטעים בצד המקטע כלפי מטה על טיפות PBS ושטוף 2x ב- RT. Postfix ב- 1% GA למשך 5 דקות ב- RT (ראה הערת אזהרה תחת 1.1.4). שטפו ב-PBS 2x ב-RT. - הניחו את הרשתות בצד כלפי מטה על טיפות dH2O וכבסו 8x ב-RT.
- כדי להכתים את חלקי הניגוד ב-EM, יש לדגור עם אורניל אצטט (UA), pH 7, למשך 5 דקות ב-RT (איור 1F).
- לפני הנחת הרשתות, לקרר את UA:methylcellulose, pH 4, על ידי הנחת טיפות על parafilm על צלחת מתכת על קרח. לאחר מכן, שטפו את הרשתות עם UA קר כקרח:מתילצלולוז, pH 4, 2x ודגרו עם UA:methylcellulose קר כקרח, pH 4, למשך 10 דקות (איור 1F).
זהירות: אורניל אצטט הוא כימיקל מסוכן (הצהרות סיכון H300, H330, H373, H411). בשלבים הדורשים UA, יש לעבוד במכסה מנוע כימי וללבוש ציוד מגן (מעיל מעבדה, כפפות ומשקפי מגן). איסוף וסילוק פסולת המכילה UA בהתאם להנחיות ולתקנות המכונים. - יש להוציא את הרשתות בלולאה על ידי הכנסת לולאת ייבוש רשת לטיפת UA:methylcellulose מתחת לרשת ולהרים אותה בעדינות עד למשיכת הרשת מהטיפה12. הרחיקו את עודפי UA:methylcellulose על ידי נגיעה בלולאה בזווית ~60° (קטעים הפונים כלפי מטה) על נייר סינון ללא סיבים (ראה טבלת חומרים) וגרירתו באיטיות לאורך הנייר עד שלא נספג יותר UA:methylcellulose. לאחר מכן, הניחו את הלולאה עם הרשת במדף מתאים והניחו לה להתייבש במשך >10 דקות ב-RT (איור 1G).
- הוסף 10 μL של dH2O לצד כריך כיסוי הזכוכית והמתן לפעולה נימית כדי למלא את ממשק הכריך מכסה הזכוכית. יש להסיר בזהירות את הכיסוי מבלי לערבב שמן טבילה בגליצרול. אחזר את הרשתות עם פינצטה ושקע ב- dH2O 3x ב- RT כדי לשטוף את 50% גליצרול.
5. EM
- השתמש בסקירה המתקבלת במיקרוסקופ אור כדי לאתר אזור עניין (ROI) לדימות במיקרוסקופ אלקטרונים תמסורת (TEM; איור 1H). הוסף הערות להחזר ההשקעה בערכת הנתונים של מיקרוסקופ האור. לאחר בחירת אזור, קבל ערכת אריחים של תמונה בהגדלה של 20,000x-50,000x ב- TEM. בנה מחדש את ערכת אריחי התמונה בתוכנת עיבוד15,16.
6. מתאם וניתוח
- טען את מיקרוסקופ האור ואת ערכת הנתונים EM בתוכנות עיבוד תמונה מתאימות, כגון ImageJ/Fiji17, תוסף ec-CLEM ב- Icy18 או Photoshop. חתוך וסובב את ערכת הנתונים של מיקרוסקופ האור כך שיתאים לערכת האריחים של EM.
- בצעו את המתאם בהתבסס על אות DAPI בפלואורסצנטיות וקווי מתאר גרעיניים בקרינה אלקטרומגנטית (איור 1I). הזיזו את התמונות כדי לכסות אותן במדויק ובצעו את ההתאמה הידנית במדויק. כדי להפוך את הגישה למדויקת יותר, החל מתאם מבוסס ציון דרך באמצעות, לדוגמה, תוסף ec-CLEM ב- Icy או תוסף BigWarp ב- ImageJ, כדי להתאים את התמונות באמצעות בחירה ידנית של נקודות מתאימות. פרוטוקול מפורט שלב אחר שלב למתאם עם ec-CLEM זמין19.
הערה: גישה זו פועלת היטב גם עם השימוש בבדיקות פידוקיאליות בימודאליות20,21.
- בצעו את המתאם בהתבסס על אות DAPI בפלואורסצנטיות וקווי מתאר גרעיניים בקרינה אלקטרומגנטית (איור 1I). הזיזו את התמונות כדי לכסות אותן במדויק ובצעו את ההתאמה הידנית במדויק. כדי להפוך את הגישה למדויקת יותר, החל מתאם מבוסס ציון דרך באמצעות, לדוגמה, תוסף ec-CLEM ב- Icy או תוסף BigWarp ב- ImageJ, כדי להתאים את התמונות באמצעות בחירה ידנית של נקודות מתאימות. פרוטוקול מפורט שלב אחר שלב למתאם עם ec-CLEM זמין19.
- נתח את התמונות המתואמות על ידי בחירת החזר השקעה בהתבסס על אות פלואורסצנטי בתוכנית מתאימה (למשל, ImageJ). לניתוח כמותי, צור אוסף של ROI עבור כל האברונים המסומנים. לאחר מכן, בדוק את מבנה העל המתאים של החזר ההשקעה הבודד וסווג אותם בהתבסס על אלמנטים מורפולוגיים.
תוצאות
פרוטוקול immuno-EM אופטימלי לסימון אימונו-זהב של LC3 על קריוסקציות אולטרה-דקות פורסם לאחרונה על ידי De Maziere et al.9. מחקר זה כלל תנאי רעב ללא BafA1, בהם LC3 היה נוכח אך נדיר יחסית וקשה למצוא אותו על ידי EM. שיטת CLEM הוצגה במחקר נפרד, המשתמשת ברגישות של תיוג פלואורסצנטי כדי לדמיין חלבונים אנדוגניים נדירים יחסית ובעלי ביטוי נמוך ולקשר זאת לאולטרה-מבנהEM 14. כאן, שתי גישות אלה משולבות על ידי השימוש בפרוטוקול התוויה LC3 הממוטב כחלק מגישה LEM.
תאי HEPG2, תאים שמקורם בכבד עם רמות גבוהות יחסית של אוטופגיה בסיסית22, הורעבו בתווך מינימלי (תמיסת המלח המאוזנת של ארל [EBSS]) במשך שעתיים לפני הקיבוע ב-4% PFA. לאחר מכן נעשתה הכנת דגימה בשיטת טוקויאסו של קריוסקציה אולטרה-דקה (סעיפים 1-3; ראו חריץ וגוזה12), התואמת מאוד ל-CLEM 14,23 בחתך. קריוסקציות מופשרות סומנו באופן פלואורסצנטי (פרוטוקול סעיף 4 ואיור 1) באמצעות נוגדן ראשוני9 נגד LC3 של עכבר. בנוסף, ארנב נגד LAMP1 שימש כדי לציין אנדו-ליזוזומים, ואחריו נוגדנים משניים נגד עכבר AlexaFluor488 ונוגדנים משניים נגד ארנב AlexaFluor568. הרשתות נדחקו בין שקופית כיסוי למגלשת זכוכית וצולמו ב-RT במיקרוסקופ רחב שדה (100x 1.47 NA oil objective, מצלמת sCMOS).
יתרון של תיוג פלואורסצנטי של מקטעים דקים על פני IF קונבנציונלי של תא שלם הוא הרזולוציה המוגברת ב-Z, שכן העובי הפיזי של הקטע הוא 60-90 ננומטר. עם רזולוציית Z משופרת זו, התיוג הפלואורסצנטי של LC3 ו-LAMP1 על מקטעים דקים חושף מעט מאוד קולוקליזציה (איור 2A). בתאים המטופלים במעכבי ליזוזומליים, כגון BafA1, מתרחשת קולוקליזציה גבוהה, שכן LC3 סגור ליזוזומלי נשאר ללא פירוק9. בתאים שאינם מטופלים, LC3 מתפרק במהירות במגע עם ליזוזומים פעילים אנזימטית, חיוביים ל-LAMP1, ולכן קו-לוקליזציה נדירה בתנאים אלה. באופן כללי, פחות מניקוב LC3 אחד לכל פרופיל תא נצפתה. זה מצביע על כך שגם בתנאי רעב, התחלופה של אוטופגוזומים היא מהירה, מה ששומר על מספרים אוטופגוזומים נמוכים. זה גם מדגיש את החשיבות של השימוש ב- CLEM כדי למצוא את המבנים הנדירים המסומנים בתווית LC3, באמצעות שדה הראייה הגדול המסופק על ידי מיקרוסקופ אור. יתר על כן, הרגישות הגבוהה יותר של תיוג פלואורסצנטי בהשוואה לתיוג זהב מאפשרת זיהוי של יותר אברונים חיוביים LC3 מאשר במערכת החיסון הקונבנציונלית, מה שמסייע עוד יותר לאפיונם.
לאחר רכישת ערכת אריחים מלאה של רצועת המקטעים, הרשתות נלקחו מהמיקרוסקופ והוכתמו לאחר מכן עבור EM באמצעות UA ושיטת הלולאה החוצה (שלבי פרוטוקול 4.4-4.6; איור 1F,G). שיטת 'לולאה החוצה' זו מבטיחה ששכבה דקה של UA:methylcellulose תישאר על הרשת, מה שיוצר את הניגודיות הרצויה ב- EM. עובי השכבה תלוי במהירות ובזווית שבה UA:methylcellulose הוא נמחק על נייר המסנן. גרירת הלולאה מהר מדי יכולה להשאיר יותר מדי UA:methylcellulose על הרשת ולהכהות את המראה של החלקים ב- EM. גרירה איטית מדי עלולה למשוך יותר מדי UA:methylcellulose משם, וכתוצאה מכך מעט מדי כתמים ומורפולוגיה ירודה, ומסתכן בנפילת הרשת מהלולאה. צביעה 'חלקלקת שמן' (איור 1G) על רשתות יבשות מצביעה על עובי שכבת UA:methylcellulose מתאים.
לאחר לולאה וייבוש, הרשתות צולמו ב-TEM בהחזר השקעה שנבחר על ידי פלואורסצנטיות. מערכי הנתונים IF ו- EM היו מתואמים על ידי כיסוי אות DAPI לקווי המתאר של גרעינים הנראים ב- EM, ויצרו תמונה משולבת המכילה מידע משני האופנים.
מציאת אותו אזור ב- EM כפי שנבחר ב- IF יכולה להיות מאתגרת. לכן מומלץ לשמור תמונת סקירה כללית של ערכת האריחים IF בהישג יד בעת חיפוש ב- EM. משתמשים צריכים לחפש תכונות הניתנות לזיהוי בשני האופנים, כגון קפלים או קרעים במקטעים, פסי רשת או סידור גרעינים. חשוב גם לזכור כי הדגימה יכולה להיראות מסובבת ומשוקפת ב- EM. ניתן להשתמש ב'רשתות איתור' עם תכונות ספציפיות לזיהוי אזורים כדי להקל על המתאם (ראה טבלת חומרים).
הקורלציה בין אברונים חיוביים LC3 לאולטרה-מבנה EM גילתה שהפונקטה השונים ייצגו שלבים נפרדים של אוטופגיה (איור 2B). אף על פי שהשימור של אולטרה-מבנה אוטופגוזומלי מאתגר בהקפאה, אברונים עם תוכן ציטופלזמי וקרומים כפולים נצפו לעתים קרובות (איור 2C, חצים באברונים 1-5; איור משלים S1), המגדירים תכונות מורפולוגיות של אוטופגוזומים. באופן מעניין, כתמים פלואורסצנטיים חלשים למדי זוהו על-ידי EM כאוטוליזוזומים חיוביים ל-LC3 (איור 2C, אברון 6; התוכן האוטופגי מסומן*), המאופיינים בתכולה צפופה ובשלפוחיות תוך לומינליות. זה הראה כי כמויות קטנות מאוד של LC3 נראות ב- IF של קריוזקציות דקות במיוחד, והצביע על כך שלמרות הסביבה המתכלה, חלק מ- LC3 ניתן לזיהוי באוטוליזוזומים במצב יציב. עם זאת, רוב הפונקטים החיוביים ל-LC3 ייצגו אוטופגוזומים, בעוד שאוטוליזוזומים היו נדירים מאוד. זאת בניגוד לתאים שטופלו ב-BafA1, שצוברים בעיקר אוטוליזוזומים ולא אוטופגוזומים9.
לסיכום, פרוטוקול זה מתאר שיטת CLEM חתך לקישור מידע מולקולרי המתקבל במיקרוסקופ פלואורסצנטי לאולטרה-מבנה של EM. שיטה זו מגבירה את הרגישות של immuno-EM, שכן רק fluorophores משמשים תיוג אלה בדרך כלל להניב יותר אות מאשר בדיקות EM. השיטה מתאימה במיוחד לשימוש בקריוסקציות דקות במיוחד, בהן ניתן לקבל רמות גבוהות של פלואורסצנטיות ספציפית על פני צביעת רקע זניחה. על ידי שימוש בפלואורסצנטיות כדי לסנן מבנים או אירועים נדירים ומתאם החזר השקעה נבחר ל- EM, זמן הפעולה של EM והעלויות הנלוות יכולים להיות מופחתים במידה ניכרת. הרגישות וההיתכנות של השיטה מודגמות על ידי הדמיה של LC3 בתאים לא מטופלים ומורעבים, מה שמראה כי LC3 מתקשר בעיקר לאוטופגוזומים בתנאים אלה, עם רמות נמוכות מאוד הנראות באוטוליזוזומים.
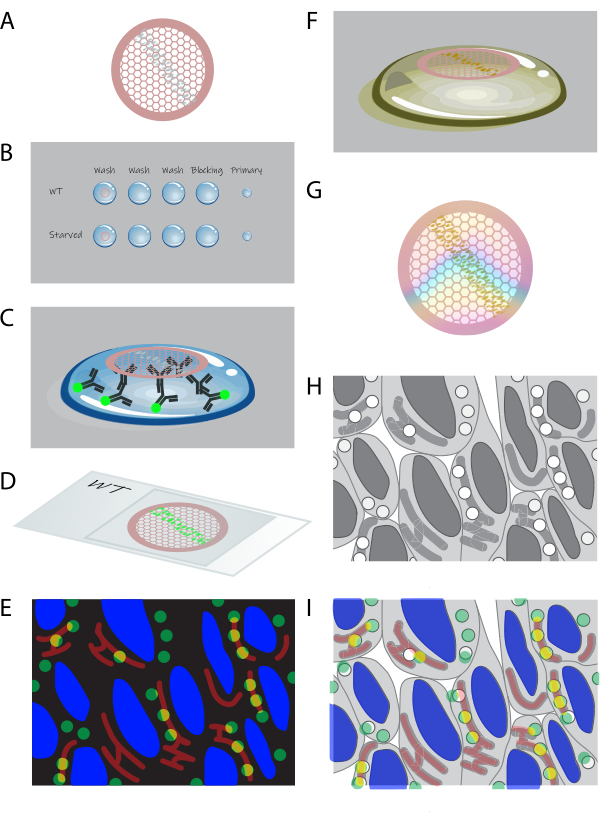
איור 1: סקירה סכמטית של CLEM בחתך . (A) קריוקטעים מתאים משובצי ג'לטין נאספים ברשת נחושת מצופה טופסבר. (B) רשתות מעובדות על טיפות של הפתרונות המתאימים. (C) רשתות מסומנות בנוגדנים ראשוניים ומשניים פלואורסצנטיים. (D) הרשתות דחוקות בין החלקה למגלשת זכוכית ב-50% גליצרול. (E) תמונות פלואורסצנטיות נאספות במיקרוסקופ שדה רחב. (F) רשתות מאוחזרות משקופית הזכוכית ומעובדות עוד יותר על ידי צביעת אורניל עבור EM. (G) לאחר הייבוש, ניתן לצלם את הרשתות על ידי TEM. (H) ערכת אריחי תמונה TEM בהגדלה גבוהה מתקבלת מאזור שנבחר מנתוני פלואורסצנטיות. (I) תמונות ממיקרוסקופ פלואורסצנטי ומקרינה אלקטרומגנטית מתואמות ומונחות בשכבות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
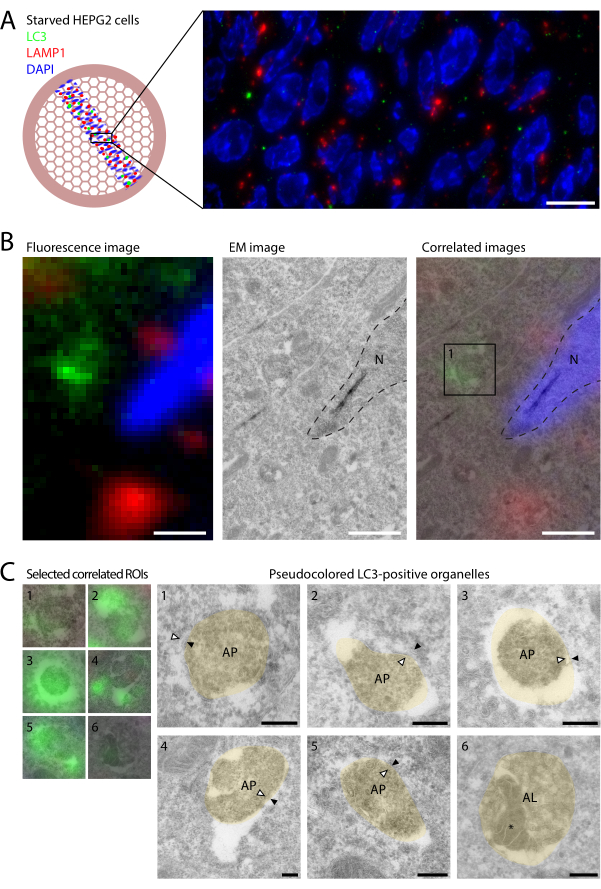
איור 2: CLEM של LC3 ו-LAMP1 בתאי HEPG2 מורעבים. תאי HEPG2 הורעבו במשך שעתיים ב- EBSS לפני הקיבוע עם 4% PFA למשך שעתיים. (A) הדמיה של LC3 (ירוק) ו- LAMP1 (אדום) על מקטעים מגלה יחסית מעט LC3 puncta ומעט לוקליזציה עם LAMP1. (B) קישור מידע מולקולרי מ-IF (פאנל שמאלי) למידע העל-מבני המתקבל ב-EM (פאנל אמצעי) על-ידי כיסוי שני אופני הדימות המבוססים על DAPI וקווי מתאר גרעיניים (קווים מקווקוים, פאנל ימני). מבנה העל של התאים הבודדים המסומנים בתווית LC3, כפי שמודגם בתיבה 1 (לוח ימני), מוצג ב- C. (C) מבנה אולטרה של תאים חיוביים LC3. תמונות CLEM מוצגות משמאל ותמונות EM פסאודו-צבעוניות (בז') מימין (תמונות EM לא צבעוניות מוצגות באיור משלים S1). קרומים אוטופגוזומליים פנימיים וחיצוניים מסומנים על ידי ראשי חץ לבנים ושחורים, בהתאמה. התוכן האוטופגי בתוך האוטוליזוזום בדוגמה 6 מצוין על ידי *. מוטות קנה מידה = 10 מיקרומטר (A), 1 מיקרומטר (B), 200 ננומטר (C). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים S1: תמונות EM לא צבעוניות של אברונים חיוביים ל-LC3. (א-ו) תמונות EM לא צבעוניות של דוגמאות פסאודו-צבעוניות 1-6 מוצגות באיור 2C. האברונים נבחרו על-ידי פלואורסצנטיות LC3, כפי שמתואר באיור 2. קרומים אוטופגוזומליים פנימיים וחיצוניים מסומנים על ידי ראשי חץ לבנים ושחורים, בהתאמה. התוכן האוטופגי בתוך האוטוליזוזום בדוגמה 6 מצוין על ידי *. פסי קנה מידה = 200 ננומטר. קיצורים: AL = autolysosome; AP = אוטופגוזום; M = מיטוכונדריה. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 1: מאגרים ופתרונות ששימשו במחקר זה. קובץ משלים זה מכיל את המתכונים והפרוטוקולים הדרושים ליצירת המאגרים והפתרונות המשמשים במחקר זה. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
השיטה המוצגת כאן מנצלת את ההתקדמות האחרונה ב- CLEM מבוסס קריוזקציה - הרגישות הגבוהה של תיוג IF ומתאם מדויק (שגיאה של <100 ננומטר) בין FM ו- EM14,24. התוצאה היא שיטה עם רגישות לסימון פלואורסצנטי של חלבונים נדירים ואנדוגניים והיכולת לכסות זאת בדיוק גבוה לאולטרה-מבנה EM. לפיכך, שיטה זו מונעת את הצורך בביטוי (יתר) של חלבונים מתויגים אקסוגנית ושימוש בתוויות EM פחות רגישות. היתכנות השיטה מוצגת על ידי דוגמאות של CLEM על LC3 אנדוגני בתאים מורעבים, ללא שימוש במעכבי ליזוזומליים.
קריוסקציות מופשרות המתקבלות בשיטת טוקויאסו הן דגימות אידיאליות עבור immuno-EM, שכן בניגוד לקטעי שרף, הם חדירים לנוגדנים. בשילוב עם קיבוע קל ופרוצדורות מנוגדות, זה בדרך כלל מניב יעילות תיוג מעולה על פני שיטות אחרות מבלי להתפשר על מבנה העל המפורט, וממחיש בצורה מצוינת את קרומי התאים 12,25,26. יתר על כן, קריוסקציות תואמות מאוד למיקרוסקופ פלואורסצנטי, מה שהופך אותן למצעים יקרי ערך עבור CLEM. הן תיוג אימונוגולד קלאסי והן CLEM על קריוסקציות סיפקו תובנות ראשוניות בהבנת הארגון התת-תאי 14,27,28,29,30.
כיום, יישומים של CLEM על קריוסטים מופשרים הופכים נפוצים יותר, כתוצאה מהתפתחויות מתמשכות ואופטימיזציות 14,20,24,31,32,33,34 ששיפרו את האיכות, הישימות והדיוק של הגישה. כעת, על ידי התאמה מדויקת של אריחי תמונה גדולים של IF ו- EM, הטכניקה מאפשרת סינון עבור אולטרה-מבנה של רכיבים תאיים אנדוגנייםבעלי תווית פלואורסצנטית 14,32,33. זהו יתרון על פני immuno-EM קלאסי, שבו החיפוש אחר מבנים המסומנים בזהב דורש בדרך כלל הגדלה גבוהה ולכן הוא מייגע יותר וגוזל זמן. מסיבה זו לוקליזציה של LC3 לאולטרה-מבנה נהנית מאוד מ-CLEM. אברונים חיוביים ל-LC3 נפוצים כאשר פינוי אוטופגי נחסם (כלומר, כאשר תאים מטופלים ב-BafA1 או בחומרים מעלים pH), בעוד אברונים אוטופגיים מנוקים במהירות בתאים ללא שינוי או מורעבים, וכתוצאה מכך רמות מצב יציב נמוכות מאוד. בתנאים כאלה, מציאת אברונים המסומנים ב- LC3 באמצעות immuno-EM קלאסי יכולה להיות מאתגרת, ו- CLEM מציע יתרון ברור.
בעבר, CLEM על קטעי שרף יושם במחקרים באמצעות ביטוי חוץ רחמי של LC3-GFP או LC3-GFP-RFP טנדםבדיקה 35,36,37,38,39. במחקרים אלה בוצעה הדמיה פלואורסצנטית לפני ההטבעה או ישירות בחתכי שרף אקרילי40, ולאחר מכן הדגימות נבדקו על ידי EM. ישנם מספר יתרונות של הטבעה שרף; מבנה האולטרה האוטופגוזומלי נשמר בדרך כלל היטב, במיוחד אם החומר קפואבלחץ גבוה 40. יתר על כן, הניגודיות של חומר משובץ שרף מוכתם במתכת כבדה היא בדרך כלל בולטת יותר מזו של קריוסקציות מוכתמות באורניל. מקטעים משובצי שרף תואמים לשיטות EM נפחיות, כגון טומוגרפיית מערך, FIB-SEM או SEM חסום טורי, בעוד שהקפאה איננה. בגישות המבצעות הדמיה לפני הטבעה, דימות תאים חיים הוא אפשרות41 שאינה זמינה ב- CLEM בהקפאה. היתרון העיקרי של CLEM בקריוסקציות על פני חלופות אלה הוא אות IF גבוה, המאפשר לוקליזציה חיסונית של חלבונים נדירים ללא צורך בחדירות ממברנה או ביטוי יתר. זה מונע מיצוי ממברנה פוטנציאלית, ביטוי יתר חפצים42 ושינוי גנטי של הנושא, אשר, בשילוב עם האפשרות לתאם שטחים גדולים IF ו EM, עושה את זה כלי מצוין ללמוד LC3 ו אוטופגיה.
כאן, היישום של CLEM בחתך על תאי HEPG2 מורעבים גילה כי LC3 מקומי בעיקר למבנים שזוהו כאוטופגוזומים. בנוסף, נמצאו כמה כתמים פלואורסצנטיים חלשים באוטוליזוזומים. זאת בניגוד ישיר לתאים שטופלו ב-BafA19 ומשקף את הפירוק המהיר של חלבונים אוטופגוזומליים ברגע שהאוטופגוזום מתמזג עם ליזוזומים. בסך הכל, הנתונים הראו כי CLEM של קריוקציות מופשרות יכול לספק תובנות על אוטופגיה בתיווך LC3 בתנאים מקומיים. הנתונים גם מדגישים את הרגישות של הטכנולוגיה, שכן LC3 זוהה אפילו באוטוליזוזומים המכילים רק רמות נמוכות של אפיטופים LC3 שלמים. יישום נוסף של טכניקה זו על ידי הדמיה LC3 במודלים ותנאים שונים ישפר את הבנתנו של אוטופגיה ותהליכים ביולוגיים אחרים בתיווך LC3, כגון פגוציטוזה הקשורה ל- LC3 או הצמדה של ATG8 לממברנות בודדות.
מעבר לאוטופגיה, CLEM בחתך יכול להיות מיושם על אירועים או מבנים נדירים אחרים, כגון חלוקת תאים, זיהום, סוגי תאים נדירים ברקמות, קינטוכורים, ריסונים ראשוניים או אברונים ספציפיים לסוג התא. סינון יעיל לנושא העניין על ידי IF יכול מאוד להקל על המחקר ultrastructural של נדירים אלה. יתר על כן, הוכח14 כי ניתן להשתמש בטכניקה כדי למקם חלבונים באופן רגיש יותר מאשר immuno-EM קלאסי. התאמת אורך הקיבוע יכולה להרחיב עוד יותר רגישות זו, ולאפשר לוקליזציה אולטרה-מבנית של חלבונים בעלי שפע נמוך מאוד או אנטיגניים גרועים. לבסוף, שיטת CLEM מקלה על בחירה מהירה של מספר כמותי של אברונים, ומאפשרת ניתוח חזק יותר של ההתפלגות האולטרה-מבנית של חלבון נתון.
CLEM על cryosections דורש את הציוד ואת המומחיות עבור cryosectioning. בקבוצות עם גישה לכלים אלה (למשל, קריומיקרוטומים), היישום של CLEM על חתך הוא פשוט ודורש רק את הזמינות של מיקרוסקופ שדה רחב אוטומטי, הגדרה שלרוב המעבדות יש גישה אליה. יתר על כן, השיטה זמינה במתקני EM ברחבי העולם. מכיוון ש- CLEM בחתך משלב את היישום של שיטות IF ו- EM מבוססות, השיטה מותאמת בקלות וניתן לשלב אותה עם, למשל, טומוגרפיה 20,33,43, נפח חתך טורי EM של מספר מוגבל של סעיפים 44, או מיקרוסקופיה ברזולוציה סופר 45. רבגוניות זו של השיטה תומכת ביישומים למגוון רחב של שאלות ביולוגיות.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
אנו מודים לעמיתינו במרכז לרפואה מולקולרית של המרכז הרפואי האוניברסיטאי אוטרכט על דיונים ומשוב פוריים. אנו מודים לעמיתי מעבדת קלומפרמן בעבר ובהווה על ביצוע שיפורים מתמשכים בטכנולוגיות המיקרוסקופיה שלנו. תשתית EM המשמשת לעבודה זו היא חלק מתוכנית המחקר מפת הדרכים הלאומית לתשתיות מחקר בקנה מידה גדול (NEMI) הממומנת על ידי מועצת המחקר ההולנדית (NWO), פרויקט מספר 184.034.014 ל- JK.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals and reagents | |||
| Antibody donkey anti-mouse Alexa Fluor 488 | Life Technologies | #A21202 | use 1:250 |
| Antibody donkey anti-rabbit Alexa Fluor 568 | Life Technologies | A#10042 | use 1:250 |
| Antibody mouse anti-LC3 | Cosmo Bio | CTB-LC3-2-IC | use 1:100 |
| Antibody rabbit anti-LAMP1 | Cell Signaling | 9091 | use 1:250 |
| Bovine serum Albumin, fraction V | Sigma-Aldrich | A-9647 | |
| BSA-c | Aurion | 900.099 | |
| BSA-conjugated gold | Cell Microscopy Core, UMC Utrecht | BSAG 5 nm | |
| Water-free Chloroform | Merck | 1.02447.0500 | |
| DAPI | Invitrogen | 10184322 | Use at end concentration of 10 µg/ml |
| EGTA | Sigma-Aldrich | E4378 | |
| Fish-skin Gelatin | Sigma-Aldrich | G7765 | |
| Food-grade gelatin | Merck | G1890 | |
| Formvar, Vinylec E | SPI | 02492-RA | |
| Gluteraldehyde | Serva | 23115.01 | See CAUTION note |
| Glycerol | Boom | MBAK 7044.1000 | |
| Glycine | Merck | 1042010250 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Methylcellulose, 25 centipoises | Sigma-Aldrich | M-6385 | |
| MgSO4 | Riedel-de Haen | 12142 | |
| Na2HPO4 (PB component A) | Merck | 106580-0500 | |
| NaBH4 | Merck | 806373 | |
| NaH2PO4 (PB component B) | Merck | 106346 | |
| NH4OH | Sigma-Aldrich | 221228-0025 | |
| Oxalic acid | Merck | 100495 | |
| Paraformaldehyde prills | Sigma-Aldrich | 441244 | See CAUTION note |
| PIPES | Merck | 110220 | |
| Protein-A conjugated gold | Cell Microscopy Core, UMC Utrecht | PAG 5, 10, 15 or 20 nm | |
| Sucrose D(+) | VWR | 27483294 | |
| Uranyl acetate | SPI | 020624-AB | See CAUTION note |
| Tools and consumables | |||
| Pick-up loop | Electron Microscopy Sciences | 70944 | |
| Filter paper, qualitative, medium-fast | LLG | 6.242 668 | |
| Finder grids | Ted Pella | G100F1 | |
| Grids | Cell Microscopy Core, UMC Utrecht | CU 100 mesh | |
| Microscopes | |||
| Leica Thunder widefield microscope | Leica | Components: 100x, 1.47 NA TIRF objective; Photometrics prime 95B sCMOS camera; LAS X software; | |
| Leica UC7 ultracryomicrotome | Leica | ||
| Tecnai T12 | FEI | Components: Veleta VEL-FEI-TEC12-TEM camera; SerialEM software | |
| Software | |||
| ec-CLEM in icy | open source | Paul-Gilloteaux et al., 2017 | |
| Fiji | open source | Schindelin et al., 2012 | |
| IMOD | open source | Mastronarde et al., 2017 | |
| Photoshop | Adobe | ||
| SerialEM | open source | Mastronarde et al., 2018 |
References
- Hu, Y., Reggiori, F. Molecular regulation of autophagosome formation. Biochemical Society Transactions. 50 (1), 55-69 (2022).
- Reggiori, F., Ungermann, C. Autophagosome maturation and fusion. Journal of Molecular Biology. 429 (4), 486-496 (2017).
- Kimura, S., Noda, T., Yoshimori, T. Dissection of the autophagosome maturation process by a novel reporter protein, tandem fluorescent-tagged LC3. Autophagy. 3 (5), 452-460 (2007).
- Baba, M., Takeshige, K., Baba, N., Ohsumi, Y. Ultrastructural analysis of the autophagic process in yeast: detection of autophagosomes and their characterization. The Journal of Cell Biology. 124 (6), 903-913 (1994).
- Takeshige, K., Baba, M., Tsuboi, S., Noda, T., Ohsumi, Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. The Journal of Cell Biology. 119 (2), 301-311 (1992).
- De Duve, C., Wattiaux, R. Functions of lysosomes. Annual Review of Physiology. 28, 435-492 (1966).
- Arstila, A. U., Trump, B. F. Studies on cellular autophagocytosis. The formation of autophagic vacuoles in the liver after glucagon administration. The American Journal of Pathology. 53 (5), 687-733 (1968).
- Eskelinen, E. L., Reggiori, F., Baba, M., Kovács, A. L., Seglen, P. O. Seeing is believing: The impact of electron microscopy on autophagy research. Autophagy. 7 (9), 935-956 (2011).
- De Mazière, A., et al. An optimized protocol for immuno-electron microscopy of endogenous LC3. Autophagy. 18 (12), 3004-3022 (2022).
- López-Terrada, D., Cheung, S. W., Finegold, M. J., Knowles, B. B. Hep G2 is a hepatoblastoma-derived cell line. Human Pathology. 40 (10), 1512-1515 (2009).
- Tanida, I., Minematsu-Ikeguchi, N., Ueno, T., Kominami, E. Lysosomal turnover, but not a cellular level, of endogenous LC3 is a marker for autophagy. Autophagy. 1 (2), 84-91 (2005).
- Slot, J. W., Geuze, H. J. Cryosectioning and immunolabeling. Nature Protocols. 2 (10), 2480-2491 (2007).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Current Protocols in Cell Biology. 13 (1), (2001).
- vander Beek, J., de Heus, C., Liv, N., Klumperman, J. Quantitative correlative microscopy reveals the ultrastructural distribution of endogenous endosomal proteins. The Journal of Cell Biology. 221 (1), e202106044(2022).
- Mastronarde, D. N. Advanced data acquisition from electron microscopes with SerialEM. Microscopy and Microanalysis. 24, 864-865 (2018).
- Mastronarde, D. N., Held, S. R. Automated tilt series alignment and tomographic reconstruction in IMOD. Journal of Structural Biology. 197 (2), 102-113 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Paul-Gilloteaux, P., et al. EC-CLEM: Flexible multidimensional registration software for correlative microscopies. Nature Methods. 14 (2), 102-103 (2017).
- Heiligenstein, X., Paul-Gilloteaux, P., Raposo, G., Salamero, J. eC-CLEM: A multidimension, multimodel software to correlate intermodal images with a focus on light and electron microscopy. Methods in Cell Biology. 140, 335-352 (2017).
- Fermie, J., et al. Bimodal endocytic probe for three-dimensional correlative light and electron microscopy. Cell Reports Methods. 2 (5), 100220(2022).
- Fokkema, J., et al. Fluorescently labelled silica coated gold nanoparticles as fiducial markers for correlative light and electron microscopy. Scientific Reports. 8 (1), 13625(2018).
- Czaja, M. J., et al. Functions of autophagy in normal and diseased liver. Autophagy. 9 (8), 1131(2013).
- Robinson, J. M., Takizawa, T., Pombo, A., Cook, P. R. Correlative fluorescence and electron microscopy on ultrathin cryosections: Bridging the resolution gap. Journal of Histochemistry and Cytochemistry. 49 (7), 803-808 (2001).
- Mohammadian, S., et al. High accuracy, fiducial marker-based image registration of correlative microscopy images. Scientific Reports. 9 (1), 3211(2019).
- Tokuyasu, K. T. A study of positive staining of ultrathin frozen sections. Journal of Ultrasructure Research. 63 (3), 287-307 (1978).
- Slot, J. W., Geuze, H. J. A new method of preparing gold probes for multiple-labeling cytochemistry. European Journal of Cell Biology. 38 (1), 87-93 (1985).
- Klumperman, J., Raposo, G. The complex ultrastructure of the endolysosomal system. Cold Spring Harbor Perspectives in Biology. 6 (10), a016857(2014).
- Geuze, H. J., Slot, J. W., Strous, G. J., Lodish, H. F., Schwartz, A. L. Intracellular site of asialoglycoprotein receptor-ligand uncoupling: Double-label immunoelectron microscopy during receptor-mediated endocytosis. Cell. 32 (1), 277-287 (1983).
- Biazik, J., Ylä-Anttila, P., Vihinen, H., Jokitalo, E., Eskelinen, E. L. Ultrastructural relationship of the phagophore with surrounding organelles. Autophagy. 11 (3), 439-451 (2015).
- Fahimi, H. D., Reich, D., Völkl, A., Baumgart, E. Contributions of the immunogold technique to investigation of the biology of peroxisomes. Histochemistry and Cell Biology. 106 (1), 105-114 (1996).
- Vicidomini, G., et al. A novel approach for correlative light electron microscopy analysis. Microscopy Research and Technique. 73 (3), 215-224 (2010).
- Vicidomini, G., et al. High data output and automated 3D correlative light-electron microscopy method. Traffic. 9 (11), 1828-1838 (2008).
- Cortese, K., et al. 3D HDO-CLEM: cellular compartment analysis by correlative light-electron microscopy on cryosection. Methods in Cell Biology. 111, 95-115 (2012).
- van Rijnsoever, C., Oorschot, V., Klumperman, J. Correlative light-electron microscopy (CLEM) combining live-cell imaging and immunolabeling of ultrathin cryosections. Nature Methods. 5 (11), 973-980 (2008).
- Razi, M., Chan, E. Y. W., Tooze, S. A. Early endosomes and endosomal coatomer are required for autophagy. The Journal of Cell Biology. 185 (2), 305-321 (2009).
- Ligeon, L. A., Barois, N., Werkmeister, E., Bongiovanni, A., Lafont, F. Structured illumination microscopy and correlative microscopy to study autophagy. Methods. 75, 61-68 (2015).
- Biazik, J., Vihinen, H., Anwar, T., Jokitalo, E., Eskelinen, E. L. The versatile electron microscope: An ultrastructural overview of autophagy. Methods. 75, 44-53 (2015).
- Gudmundsson, S., Kahlhofer, J., Baylac, N., Kallio, K., Eskelinen, E. L. Correlative light and electron microscopy of autophagosomes. Methods in Molecular Biology. 1880, 199-209 (2019).
- Kriel, J., et al. Correlative light and electron microscopy (CLEM): bringing together the best of both worlds to study neuronal autophagy. Imaging and Quantifying Neuronal Autophagy. 171, 135-147 (2022).
- Largeau, C., Legouis, R. Correlative light and electron microscopy to analyze LC3 proteins in Caenorhabditis elegans embryo. Methods in Molecular Biology. 1880, 281-293 (2019).
- Fermie, J., et al. Single organelle dynamics linked to 3D structure by correlative live-cell imaging and 3D electron microscopy. Traffic. 19 (5), 354-369 (2018).
- Kuma, A., Matsui, M., Mizushima, N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy: Caution in the interpretation of LC3 localization. Autophagy. 3 (4), 323-328 (2007).
- Ladinsky, M. S., Howell, K. E. Electron tomography of immunolabeled cryosections. Methods in Cell Biology. 79, 543-558 (2007).
- Oorschot, V., Lindsey, B. W., Kaslin, J., Ramm, G. TEM, SEM, and STEM-based immuno-CLEM workflows offer complementary advantages. Scientific Reports. 11 (1), 899(2021).
- Franke, C., et al. Correlative single-molecule localization microscopy and electron tomography reveals endosome nanoscale domains. Traffic. 20 (8), 601-617 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved