Method Article
عزل الخلايا الظهارية القصبية من أنسجة الرئة المقطوعة للبنوك الحيوية وإنشاء مزارع واجهة الهواء والسائل جيدة التمايز
In This Article
Summary
تظهر هنا طريقة قابلة للتكرار وبأسعار معقولة وقوية لعزل وتوسيع الخلايا الظهارية القصبية الأولية للبنوك الحيوية طويلة الأجل وتوليد الخلايا الظهارية المتمايزة عن طريق الثقافة في واجهة الهواء والسائل.
Abstract
تشكل طبقة الخلايا الظهارية في مجرى الهواء الحاجز الأول بين أنسجة الرئة والبيئة الخارجية ، وبالتالي تتعرض باستمرار للمواد المستنشقة ، بما في ذلك العوامل المعدية وملوثات الهواء. تلعب الطبقة الظهارية في مجرى الهواء دورا مركزيا في مجموعة كبيرة ومتنوعة من أمراض الرئة الحادة والمزمنة ، ويتم إعطاء العلاجات المختلفة التي تستهدف هذه الظهارة عن طريق الاستنشاق. يتطلب فهم دور الظهارة في التسبب في المرض وكيف يمكن استهدافه للعلاج نماذج قوية وتمثيلية. يتم استخدام نماذج الثقافة الظهارية في المختبر بشكل متزايد وتوفر ميزة إجراء التجارب في بيئة خاضعة للرقابة ، مما يعرض الخلايا لأنواع مختلفة من المحفزات أو المواد السامة أو العوامل المعدية. يتميز استخدام الخلايا الأولية بدلا من خطوط الخلايا الخالدة أو السرطانية بأن هذه الخلايا تتمايز في الثقافة إلى طبقة الخلايا الظهارية المستقطبة الزائفة مع تمثيل أفضل للظهارة مقارنة بخطوط الخلايا.
يظهر هنا بروتوكول قوي ، تم تحسينه على مدار العقود الماضية ، لعزل وزراعة الخلايا الظهارية في مجرى الهواء من أنسجة الرئة. يسمح هذا الإجراء بالعزل الناجح والتوسع والثقافة والتمايز المخاطي الهدبي للخلايا الظهارية القصبية الأولية (PBECs) عن طريق الزراعة في واجهة الهواء والسائل (ALI) ويتضمن بروتوكولا للبنوك الحيوية. علاوة على ذلك ، يتم وصف توصيف هذه الثقافات باستخدام جينات علامة خاصة بالخلية. يمكن استخدام مزارع ALI-PBEC هذه لمجموعة من التطبيقات ، بما في ذلك التعرض لدخان السجائر الكامل أو الوسطاء الالتهابيين ، والمزارع المشتركة / العدوى بالفيروسات أو البكتيريا.
من المتوقع أن يوفر البروتوكول المقدم في هذه المخطوطة ، والذي يوضح الإجراء بطريقة تدريجية ، أساسا و / أو مرجعا للمهتمين بتنفيذ أو تكييف أنظمة الاستزراع هذه في مختبراتهم.
Introduction
تم وصف دور ظهارة مجرى الهواء في مجموعة متنوعة من أمراض الرئة الحادة والمزمنة في مراجعات مختلفة1،2،3،4،5،6،7. تعد الثقافات المتمايزة جيدا للخلايا الظهارية في مجرى الهواء أداة مهمة لكشف دور ظهارة مجرى الهواء. يتم تطبيق ثقافة الخلايا الظهارية في مجرى الهواء والسائل (ALI) على نطاق واسع لتعزيز تمايز الخلايا الظهارية القاعدية في مجرى الهواء وبالتالي دراسة ظهارة مجرى الهواء بشكل موثوق في المختبر 8,9. في السنوات الماضية ، زاد استخدام هذه النماذج بشكل أكبر نتيجة للمبادرات البحثية الجديدة المتعلقة بجائحة COVID-19 والانتقال العالمي إلى البحوث الخالية من الحيوانات. لذلك ، فإن الاستخدام المتزايد لخط الخلايا النموذجي هذا يؤكد الحاجة إلى تبادل الإجراءات والخبرات للحصول على نتائج قوية. سيسمح هذا أيضا بمقارنة النتائج بين مجموعات البحث. متانة الإجراء هي السمة الرئيسية وبالتالي يجب أن تخضع لمراقبة الجودة. استثمرت العديد من المختبرات في تطوير بروتوكولات لزراعة الخلايا الظهارية في مجرى الهواء الأولي في ALI. يمكن تقليل الوقت والجهد والميزانية المطلوبة عند مشاركة هذه الإجراءات بالتفصيل. تتضمن هذه التفاصيل ، على سبيل المثال ، اختيار البلاستيك والوسائط المزروعة بالخلايا التي توفرها مختلف الشركات المصنعة ، حيث وجد أن هذا يؤثر على خصائص الثقافات التي تم الحصول عليها10،11،12. وهذا يؤكد على أهمية تبادل الخبرات وتفاصيل إجراءات الثقافة، لأنه في غياب مثل هذه الرؤى، قد تتأثر النتائج و / أو قد تعرقل جهود التحقق عبر مختلف المختبرات.
تتكون ظهارة الرئة البشرية من أنواع مختلفة من الخلايا ، بما في ذلك الأنواع الرئيسية مثل الخلايا القاعدية والخلايا المهدبة والخلايا الكأسية وخلايا النادي. من أجل محاكاة طبقة الخلايا الظهارية في الشعب الهوائية بشكل موثوق في المختبر ، يجب تمثيل أنواع الخلايا هذه في نماذج الثقافة ، والحفاظ على استقطابها ووظيفتها13،14،15،16. إن إدراك أن خصائص المانحين (بما في ذلك حالة المرض) والأصل التشريحي للخلايا (أي الأنف والقصبة الهوائية والممرات الهوائية الكبيرة والصغيرة) قد تؤثر على التركيب الخلوي والاستجابات الوظيفية لثقافة الخلية أمر مهم بنفس القدر. تعد الخبرة والممارسة ذات الصلة شرطا أساسيا لاستزراع الخلايا الظهارية الأولية في مجرى الهواء بنجاح وتقييم جودة الثقافة بشكل حدسي (عن طريق الفحص البصري أثناء الثقافة) وبشكل كمي. الهدف من هذه المساهمة هو توفير طريقة فعالة من حيث التكلفة والوقت لعزل وزراعة الخلايا الظهارية القصبية البشرية الأولية (PBECs) التي يمكن تطبيقها أيضا على زراعة الخلايا الظهارية القصبة الهوائية والهوائية الصغيرة. بالإضافة إلى وصف طريقة لعزل هذه الخلايا من أنسجة الرئة المقطوعة ، يتم تقديم ومناقشة طريقة للتوسع والبنوك الحيوية ، وأخيرا لإنشاء وتوصيف ثقافة ALI متمايزة جيدا ضمن تكلفة معقولة وفترة زمنية.
Protocol
تم عزل الخلايا من أنسجة الرئة الطبيعية المجهرية التي تم الحصول عليها من المرضى الذين يخضعون لجراحة استئصال سرطان الرئة في المركز الطبي بجامعة ليدن ، هولندا. تم تسجيل المرضى الذين تم اشتقاق أنسجة الرئة منهم في البنك الحيوي عبر نظام عدم ممانعة للاستخدام الإضافي المجهول المشفر لمثل هذه الأنسجة (www.coreon.org). ومع ذلك ، منذ 01-09-2022 ، تم تسجيل المرضى في البنك الحيوي باستخدام الموافقة المستنيرة النشطة وفقا للوائح المحلية من البنك الحيوي LUMC بموافقة لجنة الأخلاقيات الطبية المؤسسية (B20.042 / Ab / ab و B20.042 / Kb / kb).
ملاحظة: يتم تنفيذ جميع الإجراءات في خزانة السلامة البيولوجية ، وفقا لقواعد السلامة البيولوجية المحلية ، وتحت ظروف عمل معقمة أثناء ارتداء القفازات الجراحية ومعطف المختبر ، ما لم ينص على خلاف ذلك. للاطلاع على جميع الوسائط والكواشف والحلول الأخرى المستخدمة في البروتوكول، يرجى الاطلاع على جدول المواد والجدول التكميلي 1. يرجى الاطلاع على الشكل 1 للحصول على خطوات البروتوكول التفصيلية
1. عزل الخلايا الظهارية الشعب الهوائية من أنسجة الرئة البشرية
ملاحظة: للحصول على معدل نجاح مثالي لعزل الخلايا الظهارية القصبية ، يجب أن تبقى حلقة الشعب الهوائية المستأصلة مغمورة عند 4 درجات مئوية لمدة أقصاها 24 ساعة في محلول ملحي مخزن بالفوسفات (PBS) مع إضافة Primocin.
- الاستعدادات قبل بدء الإجراء
- قم بإعداد محلول طلاء في PBS ، كما هو موضح في الجدول التكميلي 1 ، وقم بتغطية عدد مناسب من ألواح 6 آبار ب 1.5 مل من محلول الطلاء لكل بئر. احتضان لمدة ساعتين في حاضنة زراعة الخلايا عند 37 درجة مئوية و 5٪ CO2.
ملاحظة: يعتمد عدد الآبار المراد طلاءها على حجم الأنسجة المستأصلة. كمبدأ توجيهي تقريبي ، يتم طلاء أربع ألواح من 6 آبار عندما يكون قطر حلقة الشعب الهوائية المستأصلة 10 مم وعرضها 4 مم. - تحضير وسط كامل خال من مصل الخلايا الكيراتينية (c-KSFM) ، كما هو موضح في الجدول التكميلي 1 ؛ استخدم 2 مل من الوسط لكل بئر من لوحة 6 آبار.
ملاحظة: يمكن تخزين c-KSFM في 4 درجات مئوية لمدة 7 أيام. c-KSFM هو وسيط منخفض الكالسيوم يستخدم لتوسيع الخلايا الظهارية في مجرى الهواء مع تثبيط نمو الخلايا الليفية الملوثة.
- قم بإعداد محلول طلاء في PBS ، كما هو موضح في الجدول التكميلي 1 ، وقم بتغطية عدد مناسب من ألواح 6 آبار ب 1.5 مل من محلول الطلاء لكل بئر. احتضان لمدة ساعتين في حاضنة زراعة الخلايا عند 37 درجة مئوية و 5٪ CO2.
- نظف حلقة الشعب الهوائية عن طريق شطف الحلقة برفق في 10 مل من برنامج تلفزيوني معقم في طبق بتري 10 سم. استخدم الملقط لتثبيت الحلقة بعناية (المس الخارج فقط) ، ومقص صغير لإزالة أي نسيج ضام زائد وبقايا دم. لمزيد من المعالجة ، اقطع الحلقة إلى قسمين.
ملاحظة: يجب تعقيم جميع الأدوات المستخدمة في العملية قبل الاستخدام. - اغمر نصفي الحلقة القصبية في 10 مل من محلول بروتياز الرابع عشر (1.8 مجم / مل) في محلول ملح هانك المتوازن (HBSS) ، بما في ذلك Primocin في حاوية معقمة مغلقة ، واحتضانها لمدة 2 ساعة بالضبط عند 37 درجة مئوية في حاضنة زراعة الخلايا.
ملاحظة: يستخدم HBSS كمخفف للبروتياز الرابع عشر لفصل الخلايا عن الأنسجة خلال فترة حضانة 2 ساعة. HBSS هو حل متساوي التوتر متوازن يتيح الحفاظ على صلاحية الخلية أثناء الحضانة قصيرة الأجل. - بعد الحضانة ، انقل قطع الأنسجة إلى طبق بتري مع 10 مل من برنامج تلفزيوني دافئ وكشط الجزء الداخلي من الحلقة باستخدام ملاقط منحنية للحصول على محلول خلوي.
ملاحظة: يبدو النسيج أكثر ليونة وتوسعا إلى حد ما. - تخلص من الحلقة ، وانقل محلول الخلية إلى أنبوب سعة 50 مل ، وأضف برنامج تلفزيوني دافئ للحصول على حجم نهائي قدره 50 مل. جهاز طرد مركزي لمدة 7 دقائق عند 230 × جم وفي درجة حرارة الغرفة (RT).
- نضح الطافع وأعد تعليق الحبيبات في 10 مل من برنامج تلفزيوني دافئ. علاوة على ذلك ، قم بتكوين حجم يصل إلى 50 مل باستخدام برنامج تلفزيوني دافئ. أجهزة طرد مركزي لمدة 7 دقائق عند 230 × جم في RT.
- نضح المادة الطافية وإعادة تعليق حبيبات الخلية في كمية مناسبة من c-KSFM الدافئ الذي يحتوي على بريموسين.
ملاحظة: يستخدم Primocin لمدة لا تقل عن 7 أيام للقضاء على أي بكتيريا أو فطريات أو (بشكل مهم) الميكوبلازما التي قد تكون موجودة في الأنسجة. بعد 7 أيام ، يكفي إضافة البنسلين / الستربتومايسين فقط إلى الوسط. - نضح محلول الطلاء من الألواح ذات 6 آبار وأضف 2 مل من تعليق الخلية لكل بئر.
- اسمح للخلايا بالنمو حتى يتم الوصول إلى التقاء 80٪ إلى 90٪ وقم بتغيير الوسط ثلاث مرات في الأسبوع (على سبيل المثال ، كل يوم اثنين وأربعاء وجمعة). عادة ما يتم الوصول إلى درجة الالتقاء المطلوبة بين 7 و 14 يوما ؛ إذا تجاوز الوقت اللازم للوصول إلى نقطة الالتقاء المطلوبة 14 يوما ، فتجاهل الخلايا.
ملاحظة: في الأيام القليلة الأولى ، يبدأ عدد قليل فقط من الخلايا في التكاثر. مجموعات من الخلايا ملحوظة بعد بضعة أيام.
2. الحفظ بالتبريد للخلايا الظهارية القصبية الأولية البشرية (PBECs)
ملاحظة: عند العمل مع درجات حرارة -80 درجة مئوية و -196 درجة مئوية ، يتم استخدام قفازات التبريد للحماية ، وتستخدم الملقط لنقل القوارير المجمدة. عند العمل مع النيتروجين السائل ، يتم استخدام قفازات التبريد ودرع الوجه للحماية الشخصية.
- نضح الوسط واغسل الآبار مرة واحدة باستخدام 2 مل من برنامج تلفزيوني دافئ لكل بئر.
- التربسين الخلايا بإضافة 0.5 مل من التربسين الطري لكل بئر (انظر الجدول التكميلي 1 لتكوين محلول التربسين اللين). احتضان الخلايا لمدة 5 إلى 10 دقائق كحد أقصى عند 37 درجة مئوية. قم بتدوير محلول التربسين في اللوحة وحرر الخلايا عن طريق النقر برفق على اللوحة.
- نقل الخلايا المنفصلة إلى أنبوب طرد مركزي سعة 50 مل يحتوي على مثبط التربسين لفول الصويا 1.1 مجم / مل (SBTI ؛ لمنع نشاط التربسين) المذاب في KSFM مع البنسلين / الستربتومايسين. ويجب أن يكون حجم التربسين ضعف الحجم الكلي للتربسين الطري (أي 1 مل لكل بئر).
ملاحظة: لا تقم بإضافة SBTI مباشرة إلى الآبار ، حيث سيتم إعادة توصيل الخلايا في غضون دقائق. - جهاز طرد مركزي الأنبوب لمدة 7 دقائق عند 230 × جم في RT.
- تخلص من المادة الطافية وأعد تعليق الخلايا الحبيبية في 10 مل من RT KSFM تحتوي على البنسلين / الستربتومايسين ولكن بدون إضافات أخرى. عد الخلايا باستخدام مقياس الدم أو عداد الخلايا الآلي. قم بإجراء عدد الخلايا الحية / الميتة عن طريق إضافة التريبان الأزرق بنسبة 1: 1 ، أو استخدم إجراء بديل لحساب الخلايا الحية / الميتة.
- حفظ الخلايا بالتبريد بتركيز 400000 خلية لكل وسط تجميد مل (راجع الجدول التكميلي 1 للتكوين) وإضافة 1 مل من هذا المعلق لكل كريوفيال. انقل الكريوفيالات إلى حاوية خلية تبريد وضعها في درجة حرارة -80 درجة مئوية. بعد 24 ساعة ، انقل القوارير إلى -196 درجة مئوية من النيتروجين السائل للتخزين طويل الأجل.
ملاحظة: هناك خياران ممكنان لنقل الخلايا إلى وسط التجميد ، وكلاهما يعمل بشكل جيد: 1) بيليه الخلايا مرة أخرى عن طريق الطرد المركزي وإعادة التعليق في وسط التجميد البارد عند تركيز الخلية المطلوب ؛ أو 2) إضافة وسط تجميد بارد وضبط تركيز المبرد (ثنائي ميثيل سلفوكسيد [DMSO]) بناء على حجم KSFM الذي توجد فيه الخلايا.
3. إذابة PBECs المحفوظة بالتبريد وتنميتها للثقافة على الإدخالات
- قم بتغطية قارورة زراعة الخلايا T75 طوال الليل ب 10 مل من محلول الطلاء في PBS مع إغلاق الأغطية بإحكام. احتضان القارورة في حاضنة زراعة الخلايا عند 37 درجة مئوية و 5٪ CO2.
- قبل إذابة PBECs المحفوظة بالتبريد ، قم بإزالة محلول الطلاء من القارورة واملأه ب 10 مل من c-KSFM. اتركه دافئا إلى 37 درجة مئوية في حاضنة زراعة الخلايا ، مع أغطية مفتوحة قليلا للسماح لهواء الحاضنة بالدخول.
- قم بإذابة الخلايا بسرعة في حمام ماء أو خرز بدرجة حرارة 37 درجة مئوية.
ملاحظة: يفضل حمام الخرز على حمام الماء بسبب انخفاض خطر التلوث وانخفاض استهلاك الطاقة. - أضف المحتوى الكامل للكريوفيال إلى قارورة T75 التي تم تسخينها مسبقا بوسط (الخطوة 3.2) وقم بتوزيع الخلايا بالتساوي.
ملاحظة: لا تقم بالطرد المركزي للخلايا في هذه المرحلة ، لأنها لن تنجو من خطوة الطرد المركزي. - بعد حوالي 4 ساعات ، تأكد من أن الخلايا متصلة بشكل كاف. استبدل الوسط ب 10 مل من c-KSFM الطازج والدافئ.
ملاحظة: بهذه الطريقة ، تتم إزالة DMSO من وسط التجميد. يجب أن تتم هذه الخطوة بين 4 ساعات و 24 ساعة بعد بذر الخلايا في القارورة. - تنمو الخلايا حتى يتم الوصول إلى التقاء 80٪ إلى 90٪ ، وتغيير الوسط كل يوم اثنين وأربعاء وجمعة.
4. إنشاء ثقافة واجهة الهواء السائل مع الخلايا الظهارية القصبية الأولية (ALI-PBEC)
ملاحظة: الإجراء التالي مخصص لاستزراع PBECs على إدخالات القطر الداخلي 11.9 مم.
- قم بتغطية عدد مناسب من إدخالات زراعة الخلايا ب 0.4 مل من محلول الطلاء لكل إدراج. احتضان بين عشية وضحاها في 37 درجة مئوية في حاضنة زراعة الخلايا.
- إعداد وسيط BD الكامل (cBD medium) ، كما هو موضح في الجدول التكميلي 1.
ملاحظة: وسط cBD هو وسط مركب (انظر الجدول التكميلي 1) تمت صياغته لدعم نمو الخلايا الظهارية القصبية لفترات أطول من الوقت ، مع السماح بتمايزها بعد زيادة تركيز وثقافة حمض الريتينويك (RA) (أو نظير RA كما هو مستخدم في هذا البروتوكول) في ALI ، كما هو موضح في الخطوة 4.10. - التربسين PBECs في قارورة T75 ، باستخدام 2 مل من التربسين الطري لكل قارورة. احتضان الخلايا لمدة 5 إلى 10 دقائق للسماح للخلايا بالانفصال (بناء على الفحص البصري). بعد 5 دقائق من الحضانة ، قم بتسهيل انفصال الخلايا عن طريق تدوير التربسين في القارورة والنقر برفق على القارورة (كرر إذا لزم الأمر).
- أضف 4 مل من SBTI إلى القارورة وانقل تعليق الخلية مباشرة إلى أنبوب طرد مركزي سعة 25 مل.
ملاحظة: الخلايا إعادة الالتصاق في غضون دقائق. لذلك ، عند العمل مع أكثر من قارورة واحدة ، يجب نقل تعليق الخلية الذي تم الحصول عليه في الخطوة 4.4 مباشرة إلى أنبوب طرد مركزي قبل إضافة SBTI إلى دورق ثان. في الإجراء ، تتم معالجة خمس قوارير كحد أقصى في وقت واحد. - أجهزة الطرد المركزي الأنابيب لمدة 7 دقائق في 230 × غرام في RT.
- أعد تعليق الخلايا في 6 مل من وسط cBD وعد الخلايا باستخدام مقياس الدم أو عداد الخلايا الآلي. قم بإجراء عدد الخلايا الحية / الميتة عن طريق ، على سبيل المثال ، إضافة تريبان أزرق بنسبة 1: 1 ، أو باستخدام إجراء آخر لحساب الخلايا الحية / الميتة.
- قم بإزالة محلول الطلاء من إدخالات زراعة الخلية.
- قم بتخفيف تعليق الخلية ، الذي تم إنشاؤه في الخطوة 4.6 ، مع وسط cBD المكمل ب 1 نانومتر EC 23 إلى تركيز 80000 خلية لكل مل ، وأضف 0.5 مل إلى الجزء العلوي من الغشاء في الإدخال. أضف 1.5 مل من وسط cBD المكمل ب 1 نانومتر EC 23 إلى البئر الموجود أسفل الملحق.
- قم بتغيير الوسط باستخدام وسط cBD المكمل ب 1 نانومتر EC 23 ثلاث مرات في الأسبوع حتى تصبح الثقافات جاهزة للتعرض للهواء (أي بعد يومين من الوصول إلى التقاء 100٪). في كل مرة ، تتم إضافة 0.5 مل من الوسط داخل الملحق (على الخلايا) ويضاف 1.5 مل إلى المقصورة السفلية (البئر).
ملاحظة: بشكل عام ، تصل طبقة الخلية إلى التقاء 100٪ بعد حوالي 5 أيام من بذر PBECs على الإدراجات. بناء على الفحص البصري لالتقاء الخلايا ، يتم اتخاذ القرار بنقل الخلايا إلى مرحلة ALI بعد 2 أيام. - عندما تكون الخلايا جاهزة للنقل إلى ALI (أي بعد يومين من الوصول إلى التقاء 100٪) ، قم بإزالة الوسط من الإدخالات والبئر ، ولا تضيف وسيطا جديدا داخل الإدخال ، وأضف وسيطا جديدا (1 مل من وسط cBD المكمل ب 50 نانومتر EC 23) فقط إلى البئر. تغيير الوسط في الآبار ثلاث مرات في الأسبوع.
- لإزالة المخاط الزائد والحطام الخلوي ، أضف برفق 200 ميكرولتر من PBS الدافئ على الجانب القمي لطبقة الخلية داخل الملحق (يفضل أن يكون ذلك عبر جانب الملحق وليس عن طريق السحب المباشر على الخلايا) واحتضانه لمدة 10 دقائق في حاضنة زراعة الخلايا عند 37 درجة مئوية. ثم ، استنشاق برنامج تلفزيوني لإزالة المخاط الزائد والحطام الخلوي.
ملاحظة: من هذه النقطة فصاعدا (بداية ثقافة ALI) ، قبل تغيير وسط الجزء السفلي ، اغسل الجانب القمي من الخلايا باستخدام PBS في كل مرة. - استزراع الخلايا في ALI لمدة لا تقل عن 2 أسابيع للتأكد من تمثيل جميع أنواع الخلايا الرئيسية.
5. إنشاء ثقافة ALI-PBEC من مجموعة مختلطة من المانحين
- استخدم خلايا ما يصل إلى خمسة متبرعين فرديين لبدء ثقافات PBEC من مجموعة سكانية مختلطة.
- امزج عددا متساويا من الخلايا لكل متبرع باستخدام الخلايا التي تم إنشاؤها في الخطوة 4.7 للوصول إلى إجمالي 150,000 خلية لكل إدراج (أي 30,000 خلية لكل متبرع عند استخدام خمسة متبرعين). سيضمن ذلك الحفاظ على الانتشار في الإدخال إلى الحد الأدنى ووجود أعداد متساوية من الخلايا من المتبرعين الأفراد في الثقافة.
- تابع ثقافة ALI-PBEC كما هو موضح في الخطوات 4.9-4.12.
6. مراقبة جودة ثقافة ALI-PBEC
- مراقبة المقاومة الكهربائية الظهارية العابرة (TEER) أثناء زراعة الخلايا
ملاحظة: يمكن إجراء قياس المقاومة الكهربائية ، بناء على استخدام مقياس الفولتوم ، في أي وقت أثناء ثقافة ALI-PBEC ويتم إجراؤه في كل مرة وفقا لنفس البروتوكول في ظل نفس الظروف ، حيث يتأثر قياس المقاومة الكهربائية بمتغيرات مختلفة ، بما في ذلك موضع القطب ودرجة الحرارة والوسط والمناولة. يمكن حساب TEER باستخدام المقاومة الكهربائية المقاسة من خلال تطبيق الصيغة التالية بناء على قانون أوم: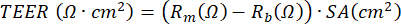 ، حيث Rm هي المقاومة الكهربائية المقاسة ، Rb هي المقاومة الكهربائية الأساسية لإدراج بدون طلاء وخلايا ، و SA هي مساحة سطح غشاء الملحق17.
، حيث Rm هي المقاومة الكهربائية المقاسة ، Rb هي المقاومة الكهربائية الأساسية لإدراج بدون طلاء وخلايا ، و SA هي مساحة سطح غشاء الملحق17.- أضف برفق 200 ميكرولتر من برنامج تلفزيوني دافئ إلى الجانب القمي لطبقة الخلية لإزالة المخاط والحطام على الخلايا. احتضن الملحق لمدة 10 دقائق في حاضنة زراعة الخلايا عند 37 درجة مئوية وقم بإزالة برنامج تلفزيوني مرة أخرى.
- أضف برفق 700 ميكرولتر من PBS الدافئ إلى الجانب القمي لطبقة الخلية واحتضن الملحق لمدة 10 دقائق في RT للسماح بتثبيت درجة الحرارة للقياسات.
- قم بمعايرة مقياس الفولتوم باستخدام مقاوم الاختبار 1000 Ω ، واضبط مقياس الفولتوم لقياس أوم ، واستخدم مفك براغي لضبط برغي المعايرة "R ADJ" حتى يتم ضبطه على 1000 Ω.
- شطف القطب عن طريق تحريكه لأعلى ولأسفل عدة مرات في الماء المعقم (RT) ثم في PBS المعقم (RT).
- قياس المقاومة الكهربائية لطبقة الخلية في الإدراجات. تحقيقا لهذه الغاية ، ضع القطب في وضع عمودي في البئر مع لمس الذراع الطويل للقطب الجزء السفلي من اللوحة. بهذه الطريقة ، يكون الذراع القصير فوق طبقة الخلية داخل الإدخال. اقرأ القيمة المعروضة على الفولتومتر.
ملاحظة: القيمة المعروضة لن تستقر تماما; اقرأ القيمة في اللحظة التي تكون فيها القيمة متقطعة. - بين القياسات ، قم بتنظيف القطب عن طريق تحريكه لأعلى ولأسفل عدة مرات في برنامج تلفزيوني معقم (RT).
- قم بتنظيف القطب عند الانتهاء من القياسات عن طريق تحريكه لأعلى ولأسفل عدة مرات في الماء المعقم (RT) ، و PBS المعقم (RT) ، و 70٪ إيثانول (RT). قم بتخزين القطب جافا.
- قم بإجراء قياس أساسي للملحق (بدون طلاء) والخلايا عن طريق إضافة 700 ميكرولتر من PBS الدافئ داخل الملحق و 1 مل من PBS الدافئ إلى البئر وقياس المقاومة الكهربائية جنبا إلى جنب مع الإدخالات الأخرى.
- تقييم التركيب الخلوي لثقافة ALI-PBEC
- خلال مرحلة ALI ، تحقق من التمايز عن طريق التقييم البصري لأهداب الضرب. يمكن ملاحظة ذلك عن طريق الفحص المجهري القياسي برايت فيلد في وقت مبكر بعد 9 أيام من التعرض للهواء على الجانب القمي من الخلايا.
ملاحظة: من الأفضل رؤية أهداب الضرب مباشرة بعد غسل السطح القمي. تنتج الخلايا الكأسية مخاطا ، وبالتالي فإن وجود المخاط ، كما لوحظ أثناء غسل السطح القمي ، هو علامة على تكوين الخلايا الكأسية. ومع ذلك ، فإن مستوى الخلايا الكأسية وكمية المخاط المنتجة تعتمد بشكل كبير على المتبرعين. يمكن رؤية وجود المخاط عند استنشاق برنامج تلفزيوني بعد غسل السطح القمي لطبقة الخلية في الإدراج ؛ في هذه الحالة ، يكون PBS المستنشق أكثر لزوجة ، ويمكن ملاحظة خيوط المخاط أثناء الشفط. - يوفر تقييم التركيب الخلوي باستخدام التلوين المناعي والفحص المجهري الفلوري أو فرز الخلايا المنشطة بالفلورة (FACS) ، أو تحليل التعبير الجيني عن طريق تفاعل البلمرة المتسلسل الكمي في الوقت الفعلي (RT-qPCR) معلومات مهمة عن حالة التمايز للثقافة ، ولكن وصفها خارج نطاق هذه المساهمة.
- خلال مرحلة ALI ، تحقق من التمايز عن طريق التقييم البصري لأهداب الضرب. يمكن ملاحظة ذلك عن طريق الفحص المجهري القياسي برايت فيلد في وقت مبكر بعد 9 أيام من التعرض للهواء على الجانب القمي من الخلايا.
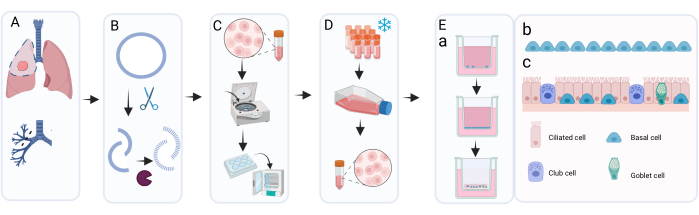
الشكل 1: نظرة عامة تخطيطية على إجراءات عزل الخلايا الطلائية القصبية الأولية وتمددها وزراعتها . (أ) يتم الحصول على أنسجة الرئة أثناء جراحة استئصال السرطان ويقوم أخصائي علم الأمراض باستئصال أنسجة حلقة الشعب الهوائية الطبيعية مجهريا وخالية من الورم. (ب) تنظف حلقة الشعب الهوائية وتخضع للعلاج الأنزيمي لفصل الطبقة الخلوية وفصلها. (ج) يغسل معلق الخلية المسترجعة وتوزع الخلايا في آبار صفيحة من 6 آبار للتمدد. (د) عند التوسع الكافي للخلايا المعزولة في c-KSFM مع بريموسين ، يتم فصل طبقات الخلايا عن طريق التربسين ويتم إعادة تعليق الخلايا في وسط التجمد للحفظ بالتبريد. عند الحاجة ، يتم إذابة الخلايا المحفوظة بالتبريد وتوسيعها مرة أخرى باستخدام c-KSFM مع البنسلين / الستربتومايسين في قوارير زراعة الخلايا. بعد التوسع ، يتم بذرها في وسط cBD على إدراج زراعة الخلايا. (هاء) تتم زراعة ALI-PBEC على مرحلتين رئيسيتين: المرحلة المغمورة في وسط cBD المكمل ب 1 نانومتر EC 23 حتى تصل الخلايا إلى الالتقاء الكامل ، تليها إزالة الوسط القمي والمزرعة في ALI للسماح بالتمايز. في مرحلة ALI هذه ، يتم استزراع الخلايا في وسط cBD مع استكمال 50 نانومتر EC 23. (إب) تمثيل رسومي للخلايا القاعدية التي تغطي الإدراج أثناء الاستزراع المغمور. (ه) تمثيل رسومي لطبقة الخلايا الظهارية المتمايزة التي تم الحصول عليها بعد الثقافة في ALI في وجود تركيزات متزايدة من EC 23. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
التوسع باستخدام الثقافة المغمورة
باستخدام الطريقة المعروضة هنا ، يمكن الحصول على ما معدله ثمانية كريوفيالات تحتوي على 400000 خلية / كريوفيال من صفيحة واحدة ذات 6 آبار للتخزين طويل الأجل في النيتروجين السائل (الشكل 2 أ). لتحقيق ذلك ، يتم استزراع PBECs المعزولة في ألواح من 6 آبار لمدة لا تقل عن 7 أيام وبحد أقصى 14 يوما (الشكل 2 ب) في وجود Primocin لاستبعاد التلوث الميكروبي (خاصة الميكوبلازما). يقدم الشكل 2 أ ، ب نظرة ثاقبة على أعداد الخلايا التي تم الحصول عليها ووقت المزرعة المطلوب بين عزلات مختلفة من مختلف المتبرعين. قبل حصاد الخلايا عن طريق التربسين للتخزين في النيتروجين السائل ، يجب أن يكون التقاء أكثر من 80 ٪. إذا لم يتحقق ذلك في غضون 14 يوما ، فلا ينبغي حفظ الخلايا بالتبريد. الأهم من ذلك ، عند الحصاد للتخزين والمرور ، يجب ألا يتجاوز التقاء طبقة الخلية ~ 95٪ (الشكل 2C). بعد التخزين في النيتروجين السائل ، يمكن إذابة الخلايا واستزراعها للتوسع حتى يتم الحصول على أعداد خلايا كافية لمزارع ALI. الوسط المستخدم لتوسيع الخلايا في هذه المرحلة هو c-KSFM ، على غرار ما حدث أثناء الاستزراع الأولي بعد الحصاد من حلقة الشعب الهوائية18. ومع ذلك ، ليست هناك حاجة إلى Primocin في هذه المرحلة ، لأن خطر التلوث الميكروبي الإضافي الناشئ عن أنسجة الرئة غائب ، وبالتالي يمكن تغيير Primocin للبنسلين / الستربتومايسين. تفضل هذه الوسيلة الخلايا الظهارية على الخلايا الليفية ، وبالتالي تمنع النمو الزائد المحتمل للثقافة عن طريق تكاثر الخلايا الليفيةبشكل أسرع 19،20،21. باستخدام وسط c-KSFM ، تنتشر الخلايا في القارورة ولا تتصل ببعضها البعض ، وهو ما يختلف بشكل ملحوظ عن مورفولوجيا الخلايا المستزرعة المغمورة في هذه المرحلة في وسط cBD (الشكل 2D ، E). بعد 5 أو 6 أيام من زراعة الخلايا المذابة في قارورة T75 ، يجب أن تكون طبقة الخلية متقاربة بنسبة 80٪ -95٪ ، وهو ما يترجم إلى ما يقرب من 3 × 106 خلايا في المجموع (الشكل 2F). من هذا ، يمكن إنشاء ما يقرب من 75 إدراج (حجم لوحة 12 بئرا) لثقافة ALI.
يمكن أيضا تكييف طريقة العزلة والثقافة الموصوفة في هذه المساهمة لاستخدامها مع خزعات الشعب الهوائية أو فرش الشعب الهوائية كمواد أولية.
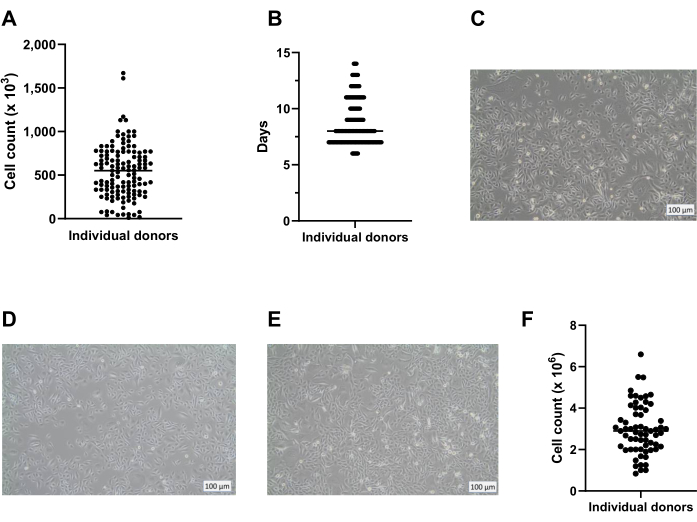
الشكل 2: تمدد الخلايا القاعدية قبل الحفظ بالتبريد. تم عزل الخلايا وفقا للبروتوكول الموصوف واستزراعها باستخدام c-KSFM. تم رصد عدد الخلايا المتولدة لكل متبرع ، وتم إجراء عدد الخلايا الحية باستخدام عداد الخلايا الآلي (A) عند حصاد خلايا المرور 0 (P0) من ألواح الآبار ال 6 (الخطوة 2 من البروتوكول) ، n = 123 مانحا ، تم تقديم عدد الخلايا على أنه عدد الخلايا التي تم حصادها لكل بئر ؛ تمثل كل نقطة متبرعا واحدا ويشار إلى الوسيط بشريط أفقي. (ب) كجزء من مراقبة الجودة ، تم رصد الوقت المطلوب لخلايا P0 للوصول إلى التقاء 80٪ إلى 90٪ في ألواح 6 آبار وعرضها كأيام بعد بدء الثقافة المغمورة في c-KSFM (ن = 127 مانحا مختلفا). يشار إلى كل متبرع فردي بنقطة ، وجميع النقاط التي تنتمي إلى 1 يوم تندمج في خط ؛ كلما اتسع الخط كلما زاد عدد المانحين الذين يمثلهم ؛ يشار إلى متوسط عدد الأيام التي تكون فيها الخلايا في الثقافة بشريط أفقي أرق. (ج) صورة برايت فيلد تمثيلية لخلايا P0 المزروعة في c-KSFM في اللحظة التي تم فيها حصاد الخلايا للحفظ بالتبريد على المدى الطويل. (د) صورة برايت فيلد تمثيلية لخلايا P1 المزروعة في c-KSFM في اللحظة التي تم فيها حصاد الخلايا ونقلها إلى إدخالات و (ه) خلايا P1 المزروعة في وسط cBD. (و) تم رصد عدد الخلايا الحية المتولدة لكل متبرع باستخدام عداد خلايا آلي عند حصاد خلايا P1 من دورق T75 (القسم 4 من البروتوكول) ، ن = 63 متبرعا مختلفا ؛ يتم تقديم عدد الخلايا كعدد الخلايا لكل قارورة T75 ، ويشار إلى كل متبرع بنقطة ، ويشار إلى متوسط عدد الخلايا بشريط أفقي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ثقافة واجهة الهواء السائل (ALI)
في 7 أيام بعد بدء زراعة ALI ، يتم قياس المقاومة الكهربائية لطبقة الخلية ويجب أن تكون أكثر من 300 Ω (الشكل 3 أ) ؛ إذا لم يتحقق ذلك ، تعتبر الثقافة فاشلة بسبب احتمال عدم وجود تشكيل تقاطع ضيق. يوصى باستبعاد إمكانية الحصول على قيم TEER منخفضة ناتجة عن تلف الطبقة الظهارية في الإدخالات الفردية الناتجة ، على سبيل المثال ، عن تلف طبقة الخلية أثناء الغسيل والشفط. يمكن التحقق من ذلك عن طريق الفحص المجهري البصري لإدخالات الثقافة. في تجربتنا ، يمكن أن يكون التباين بين المانحين في المقاومة الكهربائية كبيرا (الشكل 3 ب) ، والذي تم الإبلاغ عنه أيضا في الأدبيات14 ، وكما لوحظ يتأثر أيضا بشكل ملحوظ بأصل وسيط النسر المعدل (DMEM) المستخدم في Dulbecco (الشكل 3C).
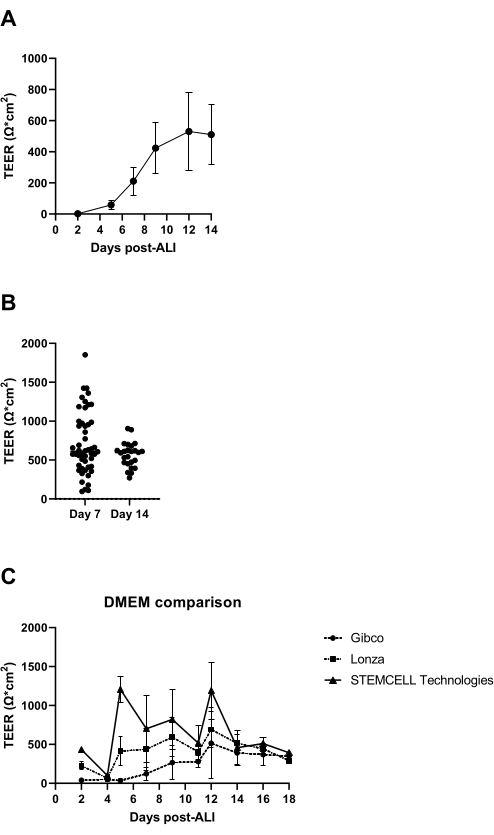
الشكل 3: المقاومة الكهربائية عبر الظهارة كمراقبة جودة لثقافات ALI-PBEC. تم عزل PBECs وتوسيعها ، وتم إنشاء ثقافات ALI-PBEC متباينة جيدا. في عدة نقاط زمنية أثناء الاستزراع ، تم قياس المقاومة الكهربائية ، وبعد ذلك تم حساب TEER (Ω · سم2). (أ) تم قياس المقاومة الكهربية على مدار 14 يوما بعد ALI. ن = 4 متبرعين مختلفين. يتم تصوير البيانات على أنها القيمة المتوسطة ± الانحراف المعياري (SD). (ب) كجزء من مراقبة جودة زراعة الخلايا ALI-PBEC ، تم قياس المقاومة الكهربائية في اليوم 7 (ن = 50) واليوم 14 بعد ALI (ن = 25) ؛ تمثل كل نقطة جهة مانحة واحدة ويشار إلى متوسط TEER (Ω · سم2) بشريط أفقي. تم اختبار البيانات للتأكد من أهميتها باستخدام اختبار مان ويتني غير المعلمية ، ولم يتم العثور على فرق كبير. (ج) تم اختبار وسائط من ثلاثة موردين مختلفين لإدارة نظم إدارة الوجهات السياحية لتقييم التأثير على تشكيل نظام التدريب والنقل البري الدولي. ن = 4 مانحين مختلفين ؛ يتم تصوير القيم المتوسطة ± SD. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
أثناء إنشاء ثقافة ALI-PBEC متباينة جيدا ، منذ بداية التعرض للهواء ، يزيد تركيز التهاب المفاصل الروماتويدي22. بهذه الطريقة ، تتحول الخلايا من الانتشار إلى التمايز المخاطي الهدبي ، والذي يكون مرئيا في وقت مبكر من 9 أيام (يعتمد على المتبرع) بعد التعرض للهواء باستخدام مجهر برايتفيلد. تكون حركة الأهداب الأولى مرئية في هذه المرحلة ، ومبكرة إلى حد ما عندما تستند إلى التعبير الجيني لعلامات الخلايا اللمعية المتمايزة23 (الشكل 4).
كما هو موضح في البروتوكول ، يمكن أيضا ملاحظة إنتاج المخاط عند شطف السطح القمي أثناء التغيير المتوسط. التهاب المفاصل الروماتويدي حساس للغاية للضوء ، مما يؤدي إلى نشاط متغير للغاية عند نفس تركيز المخزون. لهذا السبب ، يتم استبدال RA بنظير RA الاصطناعي EC 23 ويستخدم في نفس التركيز ، مع نتائج مماثلة كما هو محدد تجريبيا. لهذا السبب ولتجنب تغيير الإجراء ، تم الاحتفاظ بتركيز EC 23 المحدد مساويا لتركيز RA (أي 50 نانومتر) المستخدم سابقا24,25 (الشكل 5). ويبين الشكل 5 ألف قيم TEER التي تحققت عند استخدام تركيزات مختلفة من EC 23، ويبين الحد الأقصى ل TEER عند 50 نانومتر ضمن هذا النطاق من التركيزات المختبرة. تؤكد النتائج الموضحة في الشكل 5B أن التعبير الجيني لعلامات الخلايا المهدبة والكأس متشابه عند استخدام 50 نانومتر EC 23 أو RA. EC 23 مطلوب أيضا أثناء الاستزراع في المرحلة المغمورة (وإن كان بتركيز أقل بكثير) ، لأن حذفه في هذه المرحلة المغمورة وإضافته فقط في مرحلة ALI ينتج عنه ثقافة لا تصل أبدا إلى الالتقاء الكامل. الوقت اللازم لتوليد ثقافة ALI-PBEC متمايزة جيدا مع نشاط ضرب هدبي مرئي وإنتاج مخاط هو حوالي 14 يوما ، وبالتالي تبدأ معظم التجارب بين 14-21 يوما من مزارع ALI (الشكل 4). تتم ملاحظة جميع أنواع الخلايا الرئيسية المختلفة (الخلايا القاعدية ، المهدبة ، الكأسية ، وخلايا النادي) بعد 14 يوما من ثقافة ALI ، على الرغم من أن مستويات التعبير تعتمد بشكل كبير على المانحين. يتضح ذلك من خلال تقييم التعبير الجيني ل TP63 و FOXJ1 و MUC5AC و SCGB1A1 بواسطة RT-qPCR ، أو التعبير البروتيني باستخدام الأجسام المضادة الموجهة ضد p63 و α-tubulin و Muc5AC و CC-16 عن طريق تلطيخ التألق المناعي (IF) ، للكشف عن علامات الخلايا القاعدية والمهدبة والكأس والنادي ، على التوالي25,26. ومع ذلك ، في حين يمكن اعتبار 14-21 يوما كقاعدة عامة لمعظم التجارب ، بالنسبة للتجارب المختارة ، يمكن النظر في مدة تمايز أطول ، كما هو الحال بالنسبة لعملية التمثيل الغذائي للأجانب ، وعدوى SARS-CoV-2 ، وتقييم إزالة الغشاء المخاطي الهدبي27،28،29.
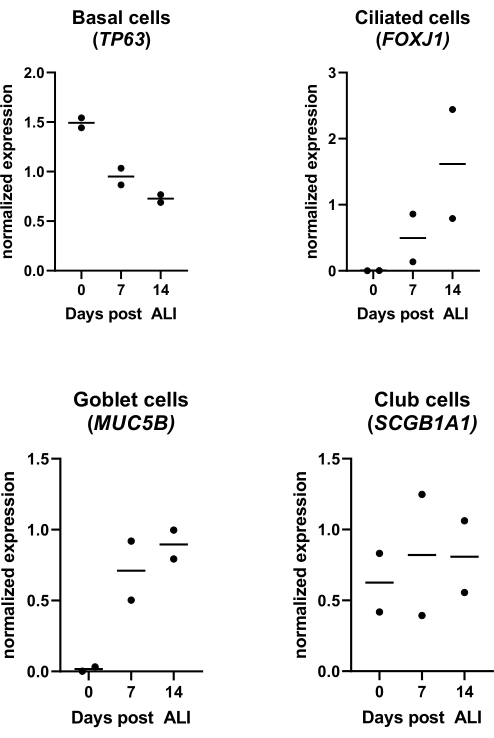
الشكل 4: ثقافة واجهة الهواء والسائل (ALI). تم عزل PBECs وتوسيعها ، وتم إنشاء ثقافات ALI-PBEC متباينة جيدا. تمت مراقبة ثقافات ALI-PBEC على مدار 14 يوما بعد ALI. تم تحليل مزارع الخلايا لعزل الحمض النووي الريبي في الأيام 0 و 7 و 14 بعد ALI. يتم عرض البيانات من متبرعين مختلفين ، وتمثل كل نقطة متبرعا فرديا واحدا يتم مراقبته بمرور الوقت ، ويشار إلى الوسيط بشريط أفقي. تم قياس التعبير الجيني لعلامات الخلايا القاعدية والمهدبة والكأس والنادي (TP63 و FOXJ1 و MUC5B و SCGB1A1 على التوالي) بواسطة qPCR وتطبيعها للتعبير الجيني RPL13A و ATP5B (انظر المرجع 23 للحصول على التفاصيل). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
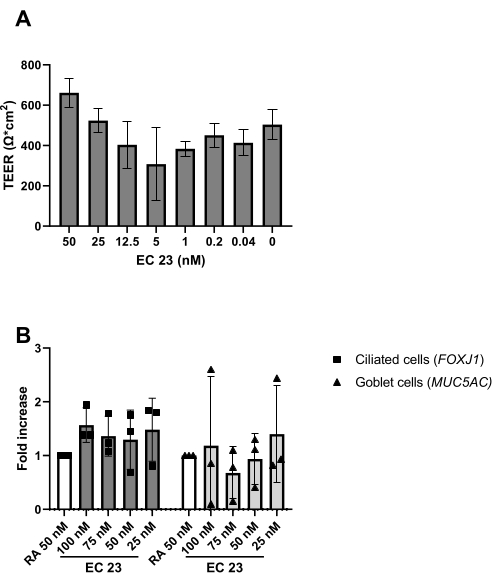
الشكل 5: مقارنة بين حمض الريتينويك (RA) ونظيره الاصطناعي EC 23. تم عزل PBECs وتوسيعها ، وتم إنشاء ثقافات ALI-PBEC متباينة جيدا. عند بدء التعرض للهواء لمزارع PBEC ، تم استبدال RA (50 نانومتر) بتركيزات مختلفة من EC 23. (أ ) تم قياس المقاومة الكهربائية في اليوم 14 بعد ALI وبعد ذلك تم حساب TEER (Ω · سم 2) ، n =2 مانحين ، تصور القضبان القيمة المتوسطة ± SD. ( ب) في اليوم 14 بعد ALI ، تم تحليل مزارع الخلايا لعزل الحمض النووي الريبي وتحليل التعبير الجيني اللاحق لعلامات الخلايا للخلايا المهدبة والكأس على التوالي (FOXJ1 ، MUC5AC) باستخدام qPCR ، وتطبيع ل RPL13A (ن = 3 مانحين). تم إظهار زيادة أضعاف مقابل ALI-PBEC المستزرع ب 50 نانومتر RA وموضح على أنه القيمة المتوسطة ± SD. (انظر المرجع 23 للحصول على التفاصيل) يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
على مدى السنوات الماضية ، تم فحص أداء المنتجات البديلة في نظام الثقافة ، مثل وسائل الإعلام والبلاستيك الثقافي. كانت هناك أسباب مختلفة لمثل هذه التقييمات ، بما في ذلك التغييرات في التكوين المتوسط من قبل الشركات المصنعة ، ووسائل الإعلام الجديدة التي تم إدخالها ، فضلا عن نقص المنتجات خلال جائحة COVID-19 (2020-2022). وقد لوحظ أن المنتجات المماثلة من موردين مختلفين تؤدي إلى مزارع خلايا ظهارية متباينة بناء على تقييم علامات أنواع الخلايا الظهارية، على الرغم من أن التركيب الخلوي النهائي قد يختلف اختلافا كبيرا (الشكل 6 أ)، في حين أن الاختلافات في TEER كانت أقل وضوحا (الشكل 6 ب). من ناحية أخرى ، أدى الوسيط من موردين مختلفين إلى اختلافات كبيرة في التركيب الخلوي. عند استخدام إدخالات من علامات تجارية مختلفة ، كانت هذه الاختلافات محدودة (الشكل 6C). على وجه الخصوص ، عند استخدام وسط زراعة الخلايا الظهارية في مجرى الهواء PneumaCult من STEMCELL Technologies ، لوحظ مورفولوجيا مختلفة وتشكيل أسرع للنشاط الهدبي المرئي. إلى جانب هذه الملاحظات ، لوحظ أيضا اختلاف في قيم TEER واختلاف في التركيب الخلوي ل ALI-PBEC مقارنة بوسط cBD (الشكل 6D).
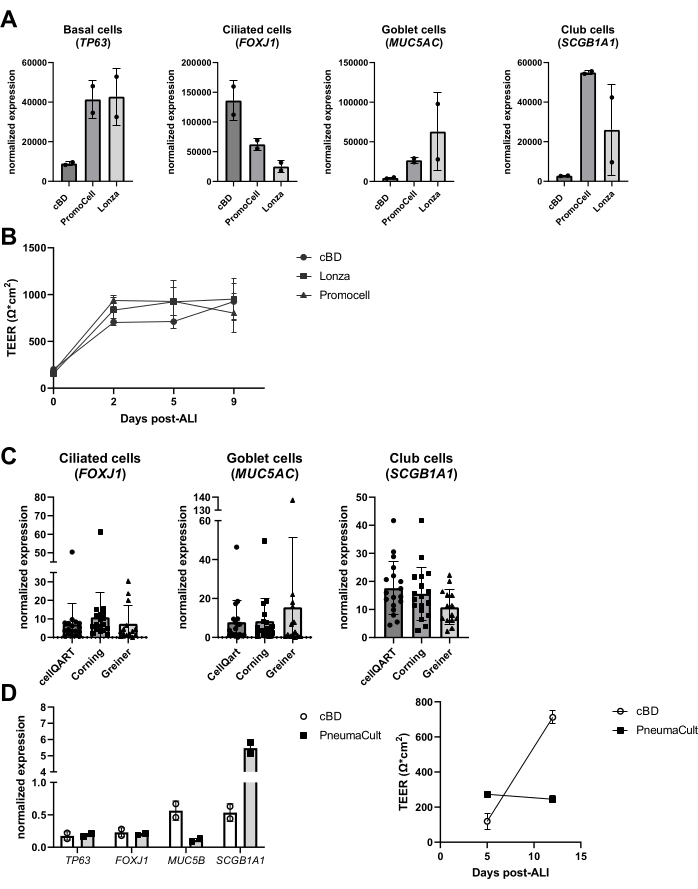
الشكل 6: مقارنة الموردين المختلفين لوسط الخلية الظهارية وإدراج زراعة الخلايا. تم عزل PBEC وتوسيعها وتم إنشاء ثقافات ALI-PBEC بشكل جيد. (أ) تم استزراع ALI-PBECs لمدة 14 يوما ، ثم تم تحليل طبقات الخلايا لعزل الحمض النووي الريبي. تم قياس التعبير الجيني لعلامات الخلايا القاعدية والهدبية والكأس والنادي (TP63 و FOXJ1 و MUC5AC و SCGB1A1 على التوالي) بواسطة qPCR وتطبيعها ل RPL13A و ATP5B. ن = 2 مانحين ؛ توضح الأشرطة القيمة المتوسطة ± SD. (B) على مدار 9 أيام بعد ALI ، تم قياس المقاومة الكهربائية وبعد ذلك تم حساب TEER (Ω · سم2). ن = 3 مانحين مختلفين ؛ (ج) تم استزراع ALI-PBECs لمدة 14 يوما باستخدام إدخالات زراعة الخلايا المشتراة من ثلاثة موردين مختلفين ، ثم تم تحليل طبقات الخلايا لعزل الحمض النووي الريبي.± تم قياس التعبير الجيني لعلامات الخلايا المهدبة والكأس والنادي (FOXJ1 و MUC5AC و SCGB1A1 على التوالي) بواسطة qPCR وتطبيعها ل RPL13A. n = 18 مانحا مختلفا ، تصور الأشرطة القيمة المتوسطة ± SD. تم اختبار البيانات للتأكد من أهميتها باستخدام اختبار ANOVA غير المعلمية أحادي الاتجاه Kruskal-Wallis ولم يتم العثور على فرق كبير. (د) تم استزراع ALI-PBECs إما في وسط cBD أو وسط PneumaCult (تقنيات STEMMCELL) لمدة 14 يوما بعد ALI ، ثم تم تحليل طبقات الخلايا لعزل الحمض النووي الريبي. تم قياس التعبير الجيني لعلامات الخلايا القاعدية والهدبية والكأس والنادي (TP63 و FOXJ1 و MUC5B و SCGB1A1 على التوالي) بواسطة qPCR وتطبيعها ل RPL13A (تصور القضبان القيمة المتوسطة ± SD) ، وتم قياس المقاومة الكهربائية في اليومين 5 و 12 بعد ALI واستخدمت لحساب TEER (Ω · سم2). ن = 2 ؛ يتم تصوير القيمة المتوسطة ± SD (انظر المرجع 23 للحصول على التفاصيل). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي 1: تكوين المحاليل والوسائط المستخدمة في البروتوكول. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يصف البروتوكول المقدم هنا عزل الخلايا الظهارية القصبية البشرية من أنسجة الرئة المقطوعة ، وطريقة للتوسع الأمثل للخلايا دون فقدان إمكانات التمايز ، وإجراء الحفظ بالتبريد ، وإجراء لتوليد ثقافات ALI-PBEC متمايزة جيدا. علاوة على ذلك ، يتم تقديم وصف لمراقبة الجودة ، بالإضافة إلى تعليمات لرصد وتقييم ALI-PBECs المتباينة.
يبدأ البروتوكول الموصوف بحلقة قصبية طبيعية مجهرية وخالية من الورم يتم استئصالها من فص الرئة من المرضى الذين يخضعون لعملية جراحية تتعلق بتشخيص سرطان الرئة. لذلك يجب ملاحظة أن هذه الحلقات لا يمكن اعتبارها نسيجا سليما ، مما قد يؤثر بالتالي على خصائص زراعة الخلايا. تشمل المصادر البديلة للحصول على الخلايا الظهارية للشعب الهوائية استخدام خزعات الشعب الهوائية أو تنظيف الشعب الهوائية أو الأنسجة من رئتي متبرع أو متلقي. بغض النظر عن المصدر ، عند استخدام أنسجة الرئة ، ينبغي النظر في خطر التلوث الميكروبي ، وبالتالي يتم استخدام المضادات الحيوية في وسائط الثقافة المختلفة لتقليل مخاطر التلوث الميكروبي لثقافة الخلية. على وجه الخصوص ، الميكوبلازما هي خطر كبير وشائع في زراعة الخلايا ، بسبب مجموعة واسعة من الآثار على ثقافة الخلايا ، ومقاومة المضادات الحيوية التي يشيع استخدامها في زراعة الخلايا ، وحقيقة أن تلوث الميكوبلازما لا يمكن تأكيده إلا من خلال فحوصات الكشف عن الميكوبلازما. لذلك ، في المرحلة الأولى من زراعة الخلايا بعد عزل الخلايا عن أنسجة الرئة ، يتم استخدام تركيبة مضادات الميكروبات واسعة الطيف Primocin ، وخلال عملية الاستزراع ، يتم اختبار العينات المختارة عشوائيا لوجود الميكوبلازما.
يوفر إجراء العزل الذي يبدأ بحلقة الشعب الهوائية مادة أولية كافية للسماح بدرجة توسع هذه الخلايا الأولية اللازمة لبدء المزارع في ALI دون المساس بقدرة التمايز. ومع ذلك ، فإن البدء في توسيع الخلايا الظهارية المعزولة بعدد محدود من الخلايا قد يطرح مشكلات في الحصول على عدد كاف من الإدخالات مع خلايا كافية يمكن بذرها لثقافة ALI. قد تؤدي الثقافة الممتدة والمرور المتكرر للخلايا الأولية إلى الشيخوخة المتماثلة. تم اقتراح حلول مختلفة للتغلب على هذا القيد. أظهر Horani et al. أن مثبط Rho kinase (ROCK) Y-27632 زاد من تكاثر الخلايا القاعدية30 ، واستخدم Mou et al. تثبيط Smad المزدوج لتوسيع الخلايا الجذعية القاعدية مع الحفاظ على خصائص طبقة الخلايا الظهارية المتمايزة 31 ، وطور Sachs et al. نظاما عضويا في مجرى الهواء يمكن استخدامه لتوسيع الخلايا الظهارية في مجرى الهواء والحفاظ على إمكانية تمايزها على مدار ممرات متعددة32. تم استخدام الطريقة الأخيرة أيضا لتوسيع الخلايا من مصادر ذات أعداد خلايا منخفضة للغاية ، مثل شفاطات القصبة الهوائية (TAs) من الخدج (< أسبوع من عمر الحمل) وسائل غسل القصبات الهوائية (BAL) ، قبل نقلها إلى ثقافة ALI كما هو موضح هنا33. وجد أن الخلايا المعزولة من BAL و TAs أظهرت قدرة تمايز مماثلة للخلايا المتولدة من أنسجة الشعب الهوائية ، على الرغم من ملاحظة الاختلافات عندما كان التمايز يميل نحو المزيد من الثقافات المحتوية على خلايا كأسية أو أكثر باستخدام تثبيط إشارات Notch أو Th2 cytokine IL-1333. لذلك يوصى بأنه إذا تم استزراع ALI-PBECs من مادة أولية ذات أعداد خلايا ظهارية منخفضة باستخدام طرق مماثلة ، للتحقق دائما من الثقافات لمعايير الجودة الأساسية ، كما تمت مناقشته في القسم 6 من البروتوكول. الأهم من ذلك ، أن استخدام الخلايا المغذية قد يساعد أيضا في الحصول على أعداد أكبر من الخلايا ، وهو أمر ضروري في إعداد هندسة السقالة القابلة للزرع حيث يكون الوقت ورقم الخلية ضروريين. يتضح ذلك من خلال دراسة تم فيها زراعة الخلايا الظهارية الذاتية من الخزعات المشتقة من مريض مصاب بمرض القصبة الهوائية وتم توسيع الخلايا بسرعة في وجود طبقة تغذية جنينية للفئران (الخلايا الليفية 3T3-J2 المعطلة انقساميا) والمثبط المذكور أعلاه لمسار Rho / ROCK (Y-27632) 34. تم العثور على ثقافة الخلايا الناتجة لتكون مفيدة لإعادة توطين سقالات القصبة الهوائية ، وبالتالي يمكن اعتبار هذا بروتوكولا مناسبا لنموذج الزرع.
عند استخدام البروتوكول الموضح في هذه المساهمة ، ولكن أيضا عند استخدام بروتوكولات الثقافة الأخرى ، يتم حتما تقديم تحيز في الاختيار. من المهم أن ندرك أن الاختلافات في تفاصيل البروتوكول ، مثل أصل الخلايا المستخدمة لبدء الثقافات ، والتكوين المتوسط ، وتفاصيل البروتوكول الأخرى ، يمكن أن تؤدي إلى تغييرات في التركيب الخلوي للثقافات وبالتالي تغييرات في استجابة ثقافة ALI33,35. بالإضافة إلى ذلك ، لوحظت أيضا اختلافات في خصائص الخلية عند مقارنة الوسائط المختلفة للتمييز بين خلايا مجرى الهواء10,11. عند مقارنة PneumaCult ووسط cBD ، لوحظت اختلافات في علامات mRNA للخلية الكأسية وخلية النادي ، وقيم TEER ، وسمك طبقة الخلية. بناء على هذه الملاحظات ، على الرغم من عدم وجود أساس إحصائي ، نظرا لانخفاض عدد المتبرعين المستخدمين ، فإن التركيب المتوسط غير معروف للعملاء ، وارتفاع تكاليف وسط PneumaCult ، تم اتخاذ القرار في مختبرنا لاستخدام وسط cBD.
كما تمت مناقشته ، يمكن توسيع الخلايا في البداية باستخدام ثقافة عضوي ثم نقلها لاحقا إلى نظام إدراج 2D ALI. هذا أمر مهم ، لأن الكائنات العضوية الظهارية في مجرى الهواء ليست مناسبة للتعرض للمواد المحمولة جوا ، في حين أن استخدام نظام ALI 2D يسمح بتقييم تأثير المواد المحمولة جوا مثل دخان السجائر23,36 على الخلايا الظهارية في مجرى الهواء المستزرع. هناك نهج مختلف لإنشاء مزارع الخلايا الظهارية في مجرى الهواء ALI وهو توليد خلايا ظهارية في مجرى الهواء عن طريق تمايز الخلايا الجذعية البشرية متعددة القدرات (hiPSCs)37. في مثل هذه البروتوكولات ، في المرحلة النهائية من بروتوكول التمايز بعد التمايز إلى أسلاف مجرى الهواء القريب ، يمكن تمييز الخلايا عن طريق الثقافة إلى ALI باستخدام إجراءات مماثلة لتلك الموصوفة هنا.
في البروتوكول الحالي ، يتم استخدام وسيط cBD للثقافة في ALI. وسط cBD هو وسيط خال من المصل يتم تحضيره عن طريق إضافة مزيج من المكملات الغذائية المختلفة ، مستوحاة من Fulcher et al.38 بالإضافة إلى دراسات أخرى. يحتوي المحلول المكمل على 52 ميكروغرام / مل من مستخلص الغدة النخامية البقري (BPE) ، و 0.5 ميكروغرام / مل هيدروكورتيزون ، و 0.5 نانوغرام / مل من EGF البشري ، و 0.5 ميكروغرام / مل من الإبينفرين ، و 10 ميكروغرام / مل من الترانسفيرين ، و 5 ميكروغرام / مل من الأنسولين ، و 6.5 نانوغرام / مل ثلاثي يودوثيرونين ، و 0.1 نانوغرام / مل RA39. نظرا لأن BPE عبارة عن مستخلص أنسجة ويخضع لتنوع دفعي حكيم ، فلا يمكن اعتبار الوسط وسيطا محددا بالكامل ، كما أنه ليس خاليا من الحيوانات. يفضل وسط زراعة الخلايا المحدد بالكامل لتقليل الاختلافات بين الدفعات والدفعات. وبالنظر إلى الانتقال إلى البحوث الخالية من الحيوانات، من المهم بذل الجهود لإنتاج وسائط محددة لا تحتوي على منتجات حيوانية وتكون ميسورة التكلفة بالنسبة للمجتمع العلمي.
يمكن استخدام إعدادات تجريبية مختلفة بناء على نموذج ALI ، اعتمادا على سؤال البحث. على سبيل المثال ، للتحقيق في تأثير المركبات التي قد تؤثر على عملية التمايز ، يمكن معالجة ذلك عن طريق إضافة المركبات إلى الثقافة خلال المراحل المختلفة للثقافة المغمورة ، أو أثناء التمايز ، أو في مرحلة التمايز الجيد. يمكن أن يتأثر التركيب الخلوي لثقافة ALI-PBEC بإضافة مركبات محددة. على سبيل المثال ، يؤدي التمييز بين ALI-PBECs في وجود IL-13 إلى توليد ثقافة تحتوي على المزيد من الخلايا الكأسية وعدد أقل من الخلايا المهدبة ، في حين أن العلاج بمثبط γ-secretase DAPT (المستخدم لمنع إشارات الشق) أثناء التمايز يؤدي إلى ثقافة بها خلايا مهدبة أكثر على حساب الخلايا الكأسية23،40،41،42.
علاوة على ذلك ، يمكن تطبيق عوامل لتحفيز الخلايا أو منع عمليات معينة إما على المقصورة القاعدية أو (بحجم صغير جدا) على المقصورة القمية للثقافة. يمكن أيضا أن تتعرض الخلايا للمواد المحمولة جوا من الجانب القمي. تم استخدام تصميمات التعرض هذه لدراسة تأثير عادم الديزل أو دخان السجائر الكامل على PBECs23،43،44. يمكن حصاد الوسط في كل مرة يتم فيها تغيير الوسط لمراقبة البروتينات المفرزة في الجانب القاعدي. الأمر نفسه ينطبق على الجانب القمي للخلايا التي يتم غسلها باستخدام PBS أثناء تحديث الوسط القاعدي. يتم حصاد ما يسمى بالغسيل القمي وإضافة ديثيوريثريتول اختياري (DTE) لفصل المخاط الذي تنتجه الخلايا الكأسية بشكل أكثر كفاءة. يمكن الحصول على محللات الخلايا لعزل البروتين الكلي والحمض النووي الريبي والحمض النووي للكروموسومات والميتوكوندريا. يمكن دراسة الخلايا بشكل أكبر باستخدام الأجسام المضادة لعلامات محددة ، عن طريق قطع غشاء البولي إيثيلين تيريفثاليت (PET) من الإدراج البلاستيكي وقطع هذا الغشاء إلى قطع أصغر للتلطيخ المناعي المتعدد45. علاوة على ذلك ، يمكن أيضا استخدام قياس التدفق الخلوي أو FACS بعد التربسين للخلايا في الإدراجات. خلال مرحلة ALI ، يمكن مراقبة تطور الحاجز الخلوي عن طريق قياس المقاومة الكهربائية ومن ثم حساب TEER ، حيث تتناسب المقاومة الكهربائية عكسيا مع مساحة سطح إدخال الغشاء. يعتمد الحساب على قانون أوم باستخدام الصيغة التالية: 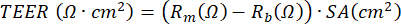 ، حيث Rm هي المقاومة الكهربائية المقاسة ، Rb هي المقاومة الكهربائية الأساسية للإدراج بدون طلاء وخلايا ، و SA هي مساحة سطح غشاء الإدخال. يعد قياس المقاومة الكهربائية باستخدام أقطاب EVOM2 و STX / عيدان تناول الطعام أمرا بسيطا ولكنه يعتمد بشكل كبير على إجراءات المناولة عند إدخاله في البئر. أيضا ، تم اقتراح شكل القطب للتأثير على قياس وظيفة الحاجز لمساحة السطح الكبيرة نسبيا17.
، حيث Rm هي المقاومة الكهربائية المقاسة ، Rb هي المقاومة الكهربائية الأساسية للإدراج بدون طلاء وخلايا ، و SA هي مساحة سطح غشاء الإدخال. يعد قياس المقاومة الكهربائية باستخدام أقطاب EVOM2 و STX / عيدان تناول الطعام أمرا بسيطا ولكنه يعتمد بشكل كبير على إجراءات المناولة عند إدخاله في البئر. أيضا ، تم اقتراح شكل القطب للتأثير على قياس وظيفة الحاجز لمساحة السطح الكبيرة نسبيا17.
مزيد من التحسين في نظام زراعة الخلايا ALI ، الذي يهدف إلى زيادة التمثيل الدقيق للأنسجة ، يشمل الزراعة المشتركة لنوع إضافي من الخلايا ، مثل الكريات البيض أو الخلايا الليفية أو الخلايا البطانية46،47،48. وقد لوحظ أن الاستزراع المشترك ل ALI-PBEC مع عامل تحفيز مستعمرة الخلايا المحببة والبلاعم (GM-CSF) أو الضامة المتمايزة M-CSF يؤثر بشكل ملحوظ على الاستجابات الظهارية الفطرية والإصلاح48. من المهم ملاحظة أنه في نماذج الزراعة المشتركة هذه ، يمكن أن يكون التوافق المتوسط مشكلة. نظرا لأن الوسط المستخدم في زراعة الخلايا الظهارية في مجرى الهواء تم تطويره خصيصا ل PBECs وقد لا يكون مناسبا بشكل مثالي لأنواع الخلايا الأخرى ، فإن التحسين ضروري. نوع آخر من التقدم الذي شوهد في مجال بيولوجيا مجرى الهواء والذي يمكن استخدام PBECs المعزولة له هو استخدام تقنية Organ-on-Chips (OoC)49,50. باستخدام هذه التقنية ، يمكن دراسة تأثير القوى الميكانيكية للتنفس وتدفق الدم ، مثل التمدد والهواء والتدفق المتوسط ، 29.
يمكن أن يكون التباين بين المانحين كبيرا عند استخدام PBECs من مختلف الجهات المانحة ، وبالتالي من المهم التفكير في استخدام خلايا من عدة مانحين لحساب هذا التباين في دراسات زراعة الخلايا الظهارية. نظرا لأن ثقافة ALI-PBECs تستغرق وقتا طويلا وترتبط بتكاليف كبيرة ، يتم فحص خيار إنشاء ثقافات ALI-PBEC عن طريق خلط الخلايا من جهات مانحة مختلفة في إدراج مزرعة خلية واحدة. بهذه الطريقة ، يمكن إجراء التجارب التجريبية بسهولة باستخدام الخلايا الأولية ، قبل تحليل استجابات الثقافات المستمدة من مختلف الجهات المانحة الفردية . بالإضافة إلى ذلك ، يمكن تجميع الجهات المانحة ذات الخصائص المختلفة (على سبيل المثال ، فئة عمرية أو جنس مختلف) للدراسات الاستكشافية. عند استخدام مزيج المانحين ، من المهم التأكد من وجود أعداد متساوية من الخلايا لمختلف المانحين ، لمنع احتمال هيمنة أحد المانحين على النتائج نتيجة لارتفاع معدل الانتشار. لذلك ، يتم توسيع الخلايا من المتبرعين الفرديين بشكل منفصل وبذرها بكثافة أعلى في الإدراج مقارنة بخلايا البذر من متبرع فردي ، لتقليل الانتشار في الإدراج قبل الانتقال إلى ALI. تمت مقارنة استجابات مزيج المانحين والمتبرعين الأفراد المناظرين من خلال دراسة حركية العدوى ل SARS-CoV-2. وباستخدام تفاعل البوليميراز المتسلسل بالاستنساخ العكسي (RT-qPCR) والتلوين المناعي، لوحظ أن مزيج المتبرعين قدم تمثيلا جيدا لمختلف المتبرعين الأفراد، من خلال إظهار أعداد مماثلة من جزيئات الفيروس المنتجة وأعداد مماثلة من الخلايا المصابة28.
لتصبح بديلا مقبولا للنماذج الحيوانية ، يجب أن يكون تحرير الجينات للخلايا الظهارية القصبية المستزرعة ممكنا51. يتم فحص تقنية تداخل الحمض النووي الريبي باستخدام الحمض النووي الريبي الصغير المتداخل (siRNAs) في ALI-PBECs ، ولكن نظرا لأن الخلايا تحتاج إلى نقلها باستخدام siRNA خلال المرحلة المغمورة من المزرعة ، لا يتم الحفاظ على ضربة قاضية بشكل كاف أثناء زراعة ALI بسبب مدة المزرعة الطويلة ، ما لم يتكرر نقل siRNA بشكل متكرر أثناء الثقافة52. ومع ذلك ، يمكن استخدام siRNAs بنجاح لتعديل التعبير الجيني في الخلايا القاعدية المغمورة. استخدم آخرون بنجاح تقنية CRISPR / Cas9 لتحقيق تحرير الجينات في مزارع الخلايا الظهارية الأولية في مجرى الهواء ALI مع توصيل البروتين النووي الريبي (RNP) 53. عند استخدام هذه التقنيات ، من الضروري أن تحافظ الخلايا على قدرتها الكاملة على التمايز. نظرا لأنه لا يمكن تمرير مزارع خلايا مجرى الهواء الأولية إلى أجل غير مسمى ، فإن التوسع النسيلي للخلايا المحررة جينيا ليس بالأمر السهل وإضافة وسيط لاختيار الخلايا المنقولة أمر مرهق. لذلك ، من الصعب تحقيق ضربة قاضية مرغوبة في جميع الخلايا المستزرعة. بديل لتوليد استنساخ بالضربة القاضية هو استخدام استراتيجيات خروج المغلوب في hiPSCs54 واستخدام هذه الخلايا لتوليد الخلايا الظهارية في مجرى الهواء. بديل آخر ، وإن كان دون المستوى الأمثل ، هو إنشاء خط PBEC خالد من أجل توسيع الخلايا المحررة جينيا55.
البروتوكول المقدم هنا هو إحدى الطرق لتوليد ALI-PBEC شبه متباينة جيدا ، ولكن تم العثور أيضا على بروتوكولات أخرى لتأسيس مثل هذه الثقافة ، مع اختلافات أصغر وأكبر مقارنة بالبروتوكول المقدم. في رأينا ، عبر التحقق المختبري من طرق الاستزراع ومراقبة الجودة الصارمة ضرورية لنظام ALI-PBEC وأنظمة الاستزراع المماثلة للخلايا الظهارية في مجرى الهواء ، لتصبح بديلا صالحا للتجارب على الحيوانات.
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم تضارب في المصالح ذات صلة.
Acknowledgements
تم دعم الدراسات التي تستخدم النموذج الموصوف في هذه المساهمة من قبل مجموعة متنوعة من منظمات التمويل ، بما في ذلك مؤسسة الرئة الهولندية ، والمنظمة الهولندية للبحث والتطوير الصحي (ZonMw ، منحة COVID-19 MKMD) ، والجمعية الهولندية لاستبدال التجارب على الحيوانات (Stichting Proefdiervrij ، grant #114025007) ، بالإضافة إلى منح بحثية من شركات مثل Boehringer Ingelheim و Galapagos. تم إنشاء الشكل 1 باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 1,000 ohm test resistor | World Precision Instruments | N/A | Used to calibrate the EVOM2 Epithelial Voltohmmeter |
| 4-[2-(5,6,7,8-Tetrahydro-5,5,8,8-tetramethyl-2-naphthalenyl)ethynyl)-benzoic acid (EC 23) | Tocris | 4011 | Used in cBD medium |
| 6-well Clear TC-treated Multiple Well Plates | Corning | 3506 | Used in the first step to grow the cells isolated form the bronchial ring |
| Airway Epithelial Cell Growth Medium Kit | PromoCell | C-21160 | Used to compare to cBD medium |
| Bead Bath 20 Liter | Lab Armor | 74220-720 | Used to pre-warm cell culture solutions |
| BEGM Bronchial Epithelial Cell Growth Medium BulletKit | LONZA | CC-3170 | Used to compare to cBD medium |
| Bovine albumin fraction V (BSA) | Thermo Fisher Scientific | 15260037 | Used in coating solution |
| Bovine pituitary extract (BPE) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Bronchial epithelial cell growth supplement (BEpiCGS) | ScienCell Research Laboratories | 3262 | Used in cBD medium |
| Bronchial epithelial cell medium-basal (BEpiCM-b) | ScienCell Research Laboratories | SCC3211-b | Used in cBD medium |
| Cell culture inserts; 12 mm Transwell with 0.4 µm pore polyester membrane insert | Corning | 3460 | Cell culture inserts used in the protocol |
| Cell culture inserts; 12-well inserts, 0.4 µm PET clear | CellQART made by SABEU | 9310412 | Cell culture inserts used to compare with Corning cell culture inserts |
| Cell culture inserts; 12-well ThinCert Tissue culture Inserts | Greiner Bio-One | 82050-032 | Cell culture inserts used to compare with Corning cell culture inserts |
| CELLSTAR flask, TC, PS, 250 ml, 75 cm2 | Greiner Bio-One | 658170 | Used to expand the number cells |
| CFX Maestro 1.0 | Bio-Rad | N/A | Software program for analyzing qPCR data generated with the CFX384 System |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad | 1855484 | qPCR detection system |
| Chopstick electrode set | World Precision Instruments | STX2 | Used to measure electrical resistance in ALI-PBEC |
| CO2-Incubator | PHCbi | MCO-170AICUV-PE | Cell culture incubator used for mycplasma free cell cultures |
| CO2-Incubator | Hereaus | Heracell 150 | Cell culture incubator used for possibly mycplasma infected cell cultures |
| Coolcell Container | Corning | 432006 | Used to cryopreserve cells at -80 °C before transfer to liquid N2 |
| Countess 3 Automated cell counter | Thermo Fisher Scientific | AMQAX2000 | Used to count cells and determine the cell concentration |
| Cryovials | Nalgene | 479-3224 | Used to cryopreserve cells in |
| D-Glucose | Avantor VWR BDH CHEMICALS | 101174Y | Used in soft trypsin |
| Dimethyl sulfoxide (DMSO) | Avantor VWR | 0231 | Used in cell freeze medium |
| dNTP (10 mM) | Promega | U1515 | Used in the synthesis of cDNA |
| Dulbecco's Modified Eagle's Medium (DMEM) + 4500 mg/l D-Glucose | STEMCELL Technologies | 36250 | Used in cBD medium |
| Dulbecco's Modified Eagle's Medium (DMEM) 4.5 g/l glucose with l-glutamine | LONZA | LOBE12-604F | Used in cBD medium to compare with DMEM from other manufacturers |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, pyruvate | Thermo Fisher Scientific | 41966029 | Used in cBD medium to compare with DMEM from other manufacturers |
| Epidermal growth factor (EGF) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Ethylenediaminetetraacetic acid (EDTA) | Avantor VWR BDH CHEMICALS | 443885J | Used in soft trypsin |
| EVOM2 Epithelial Voltohmmeter | World Precision Instruments | 91799 | Used with the chopstick electrode set to measure electrical resistance in ALI-PBEC |
| Fibronectin solution, Human | PromoCell | C-43060 | Used in coating solution |
| Glutamax | Thermo Fisher Scientific | 35050038 | Used in cBD medium |
| Hanks balanced salt solution (HBSS) | ScienCell Research Laboratories | SCC0313 | Used to dissolve protease XIV |
| IQ SYBR Green Super mix | Bio-Rad | 170887 | qPCR reagent |
| Isoproterenol hydrochloride, (-)- | Sigma-Aldrich | I-6504 | Used in c-KSFM |
| Keratinocyte-SFM (KSFM) | Thermo Fisher Scientific | 17005-034 | Used in c-KSFM |
| Maxwell RSC Instrument | Promega | AS4500 | Automated RNA isolation system |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | Used to isolate total RNA with the Maxwell RSC Instrument |
| M-MLV Reverse transcriptase | Promega | M5301 | Used in the synthesis of cDNA |
| M-MLV Reverse transcriptase 5X reaction buffer | Promega | M531A | Used in the synthesis of cDNA |
| MycoStrip | InvivoGen | rep-mys-10 | Used to detect the presence of mycoplasma in cell culture samples |
| N-2-hydroxyethylpiperazine-N-2-ethane sulfonic acid (HEPES) | Thermo Fisher Scientific | 15630056 | Used in cBD medium |
| Oligo(dT)15 | Qiagen | 79237 | Used in the synthesis of cDNA |
| Penicillin/Streptomycin solution (Pen/Strep) | ScienCell Research Laboratories | SCC0513 | Used as antibiotic in c-KSFM and cBD medium |
| Phosphate buffered saline (PBS) | LUMC pharmacy | N/A | Used in different steps of the protocol |
| Pneumacult-ALI Medium | STEMCELL Technologies | 05002 | Used to grow cells in the differentiation stage to compare to cBD medium |
| Pneumacult-Ex Plus Medium | STEMCELL Technologies | 05040 | Used to grow cells in the submerged stage to compare to cBD medium |
| Primer, ATP5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: TCACCCAGGCTGGTTCAGA |
| Primer, ATP5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGTGGCCAGGGTAGGCTGAT |
| Primer, FOXJ1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGAGGGGACGTAAATCCCTA |
| Primer, FOXJ1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TTGGTCCCAGTAGTTCCAGC |
| Primer, MUC5AC, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCTTCGACGGACAGAGCTAC |
| Primer, MUC5AC, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCTCGGTGACAACACGAAAG |
| Primer, MUC5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGGCTTTGACAAGAGAGT |
| Primer, MUC5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGGATGGTCGTGTTGATGCG |
| Primer, RPL13A, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: AAGGTGGTGGTCGTACGCTGTG |
| Primer, RPL13A, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: CGGGAAGGGTTGGTGTTCATCC |
| Primer, SCGB1A1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: ACATGAGGGAGGCAGGGGCTC |
| Primer, SCGB1A1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: ACTCAAAGCATGGCAGCGGCA |
| Primer, TP63, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCACCTGGACGTATTCCACTG |
| Primer, TP63, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCGAATCAAATGACTAGGAGGGG |
| Primocin | InvivoGen | ant-pm-2 | Used as antimicrobial agent against bacteria, mycoplasma, and fungi in c-KSFM medium |
| Protease XIV | Sigma-Aldrich | P5147 | Used for the enzymatic treatment of the bronchial ring |
| RNAsin Recombinant Ribonuclease inhibitor | Promega | N2515 | Used in the synthesis of cDNA |
| Soybean trypsin inhibitor (SBTI) | Sigma-Aldrich | T9128 | Used to inhibit the action of soft trypsin |
| T100 Thermal Cycler | Bio-Rad | 1861096 | Used in the synthesis of cDNA |
| TissueSAFE plus | MILESTONE MEDICAL | N/A | Vacuum transfer system for biological specimens |
| Trypan blue solution | Thermo Fisher Scientific | 15250061 | Used to count live- and dead cells |
| Trypsin 1:250 | Thermo Fisher Scientific | 27250-018 | Used in soft trypsin |
| Type I collagen solution (PureCol) | Advanced BioMatrix | 5005-B | Used in coating solution |
| Universal container, PP, with PE screw cap | Avantor VWR | 216-2053 | Used in the protocol for the Protease XIV treatment of the bronchial ring |
References
- Aghapour, M., et al. Role of air pollutants in airway epithelial barrier dysfunction in asthma and COPD. European Respiratory Review. 31 (163), 210112 (2022).
- de Waal, A. M., Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Duchesne, M., Okoye, I., Lacy, P. Epithelial cell alarmin cytokines: Frontline mediators of the asthma inflammatory response. Frontiers in Immunology. 13, 975914 (2022).
- Hewitt, R. J., Lloyd, C. M. Regulation of immune responses by the airway epithelial cell landscape. Nature Reviews Immunology. 21 (6), 347-362 (2021).
- Ruysseveldt, E., Martens, K., Steelant, B. Airway basal cells, protectors of epithelial walls in health and respiratory diseases. Frontiers in Allergy. 2, 787128 (2021).
- Alysandratos, K. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Hammad, H., Lambrecht, B. N. Barrier epithelial cells and the control of type 2 immunity. Immunity. 43 (1), 29-40 (2015).
- Hynds, R. E., Bonfanti, P., Janes, S. M. Regenerating human epithelia with cultured stem cells: feeder cells, organoids and beyond. EMBO Molecular Medicine. 10 (2), 139-150 (2018).
- Hiemstra, P. S., Tetley, T. D., Janes, S. M. Airway and alveolar epithelial cells in culture. The European Respiratory Journal. 54 (5), 1900742 (2019).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), 2137 (2020).
- Leung, C., Wadsworth, S. J., Yang, S. J., Dorscheid, D. R. Structural and functional variations in human bronchial epithelial cells cultured in air-liquid interface using different growth media. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1063-L1073 (2020).
- Morgan, R., et al. A medium composition containing normal resting glucose that supports differentiation of primary human airway cells. Scientific Reports. 12 (1), 1540 (2022).
- Ghosh, B., et al. Strong correlation between air-liquid interface cultures and in vivo transcriptomics of nasal brush biopsy. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1056-L1062 (2020).
- Pezzulo, A. A., et al. The air-liquid interface and use of primary cell cultures are important to recapitulate the transcriptional profile of in vivo airway epithelia. American Journal of Physiology. Lung Cellular and Molecular Physiology. 300 (1), L25-L31 (2011).
- Dvorak, A., Tilley, A. E., Shaykhiev, R., Wang, R., Crystal, R. G. Do airway epithelium air-liquid cultures represent the in vivo airway epithelium transcriptome. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 465-473 (2011).
- Legebeke, J., et al. Temporal whole-transcriptomic analysis of characterized in vitro and ex vivo primary nasal epithelia. Frontiers in Cell and Developmental Biology. 10, 907511 (2022).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- van Wetering, S., et al. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. Journal of Investigative Medicine. 48 (5), 359-366 (2000).
- Balk, S. D. Calcium as a regulator of the proliferation of normal, but not of transformed, chicken fibroblasts in a plasma-containing medium. Proceedings of the National Academy of Sciences. 68 (2), 271-275 (1971).
- Gail, M. H., Boone, C. W., Thompson, C. S. A calcium requirement for fibroblast motility and prolifertion. Experimental Cell Research. 79 (2), 386-390 (1973).
- Dulbecco, R., Elkington, J. Induction of growth in resting fibroblastic cell cultures by Ca. Proceedings of the National Academy of Sciences. 72 (4), 1584-1588 (1975).
- van Wetering, S., et al. Epithelial differentiation is a determinant in the production of eotaxin-2 and -3 by bronchial epithelial cells in response to IL-4 and IL-13. Molecular Immunology. 44 (5), 803-811 (2007).
- Amatngalim, G. D., et al. Aberrant epithelial differentiation by cigarette smoke dysregulates respiratory host defence. The European Respiratory Journal. 51 (4), 1701009 (2018).
- Christie, V. B., et al. Retinoid supplementation of differentiating human neural progenitors and embryonic stem cells leads to enhanced neurogenesis in vitro. Journal of Neuroscience Methods. 193 (2), 239-245 (2010).
- Schrumpf, J. A., Ninaber, D. K., vander Does, A. M., Hiemstra, P. S. TGF-β1 impairs vitamin D-induced and constitutive airway epithelial host defense mechanisms. Journal of Innate Immunity. 12 (1), 74-89 (2020).
- Schrumpf, J. A., et al. Proinflammatory cytokines impair vitamin D-induced host defense in cultured airway epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (6), 749-761 (2017).
- Boei, J. J. W. A., et al. Xenobiotic metabolism in differentiated human bronchial epithelial cells. Archives of Toxicology. 91 (5), 2093-2105 (2017).
- Wang, Y., et al. Impact of human airway epithelial cellular composition on SARS-CoV-2 infection biology. bioRxiv. , (2021).
- Nawroth, J. C., et al. Breathing on Chip: Dynamic flow and stretch tune cellular composition and accelerate mucociliary maturation of airway epithelium in vitro. bioRxiv. , (2022).
- Horani, A., Nath, A., Wasserman, M. G., Huang, T., Brody, S. L. Rho-associated protein kinase inhibition enhances airway epithelial Basal-cell proliferation and lentivirus transduction. American Journal of Respiratory Cell and Molecular Biology. 49 (3), 341-347 (2013).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Eenjes, E., et al. Disease modeling following organoid-based expansion of airway epithelial cells. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (4), L775-L786 (2021).
- Butler, C. R., et al. Rapid expansion of human epithelial stem cells suitable for airway tissue engineering. American Journal of Respiratory and Critical Care Medicine. 194 (2), 156-168 (2016).
- Amatngalim, G. D., et al. Antibacterial defense of human airway epithelial cells from chronic obstructive pulmonary disease patients induced by acute exposure to nontypeable Haemophilus influenzae: modulation by cigarette smoke. Journal of Innate Immunity. 9 (4), 359-374 (2017).
- Plebani, R., et al. 3D lung tissue models for studies on SARS-CoV-2 pathophysiology and therapeutics. International Journal of Molecular Sciences. 23 (17), 10071 (2022).
- Wong, A. P., et al. Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein. Nature Biotechnology. 30 (9), 876-882 (2012).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Biology. 107, 183-206 (2005).
- Cao, J., Wong, C. K., Yin, Y., Lam, C. W. K. Activation of human bronchial epithelial cells by inflammatory cytokines IL-27 and TNF-alpha: implications for immunopathophysiology of airway inflammation. The Journal of Cellular Physiology. 223 (3), 788-797 (2010).
- Tsao, P. N., et al. Notch signaling controls the balance of ciliated and secretory cell fates in developing airways. Development. 136 (13), 2297-2307 (2009).
- Laoukili, J., et al. IL-13 alters mucociliary differentiation and ciliary beating of human respiratory epithelial cells. The Journal of Clinical Investigation. 108 (12), 1817-1824 (2001).
- Mertens, T. C. J., et al. Cigarette smoke differentially affects IL-13-induced gene expression in human airway epithelial cells. Physiological Reports. 5 (13), e13347 (2017).
- Zarcone, M. C., et al. Effect of diesel exhaust generated by a city bus engine on stress responses and innate immunity in primary bronchial epithelial cell cultures. Toxicology in Vitro. 48, 221-231 (2018).
- vander Does, A. M., et al. Early transcriptional responses of bronchial epithelial cells to whole cigarette smoke mirror those of in-vivo exposed human bronchial mucosa. Respiratory Research. 23 (1), 227 (2022).
- Wang, Y., Ninaber, D. K., van Schadewijk, A., Hiemstra, P. S. Tiotropium and fluticasone inhibit rhinovirus-induced mucin production via multiple mechanisms in differentiated airway epithelial cells. Frontiers in Cellular and Infection Microbiology. 10, 278 (2020).
- Ronaghan, N. J., et al. M1-like, but not M0- or M2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), 0276013 (2022).
- Gindele, J. A., et al. Opposing effects of in vitro differentiated macrophages sub-type on epithelial wound healing. PLoS One. 12 (9), e0184386 (2017).
- van Riet, S., et al. Modulation of airway epithelial innate immunity and wound repair by M(GM-CSF) and M(M-CSF) macrophages. Journal of Innate Immunity. 12 (5), 410-421 (2020).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Stucki, A. O., et al. A lung-on-a-chip array with an integrated bio-inspired respiration mechanism. Lab on a Chip. 15 (5), 1302-1310 (2015).
- Peters-Hall, J. R., et al. Long-term culture and cloning of primary human bronchial basal cells that maintain multipotent differentiation capacity and CFTR channel function. American Journal of Physiology. Lung Cellular and Molecular Physiology. 315 (2), L313-L327 (2018).
- Bartman, C. M., Stelzig, K. E., Linden, D. R., Prakash, Y. S., Chiarella, S. E. Passive siRNA transfection method for gene knockdown in air-liquid interface airway epithelial cell cultures. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), L280-L286 (2021).
- Koh, K. D., et al. Efficient RNP-directed human gene targeting reveals SPDEF is required for IL-13-induced mucostasis. American Journal of Respiratory Cell and Molecular Biology. 62 (3), 373-381 (2020).
- Bhargava, N., et al. Development of an efficient single-cell cloning and expansion strategy for genome edited induced pluripotent stem cells. Molecular Biology Reports. 49 (8), 7887-7898 (2022).
- Angelopoulou, A., Papaspyropoulos, A., Papantonis, A., Gorgoulis, V. G. CRISPR-Cas9-mediated induction of large chromosomal inversions in human bronchial epithelial cells. STAR Protocols. 3 (2), 101257 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved