Method Article
Isolierung von Bronchialepithelzellen aus reseziertem Lungengewebe für Biobanken und Etablierung gut differenzierter Luft-Flüssigkeits-Grenzflächenkulturen
In diesem Artikel
Zusammenfassung
In dieser Arbeit wird eine reproduzierbare, kostengünstige und robuste Methode zur Isolierung und Expansion von primären Bronchialepithelzellen für das langfristige Biobanking und die Erzeugung differenzierter Epithelzellen durch Kultur an der Luft-Flüssigkeits-Grenzfläche vorgestellt.
Zusammenfassung
Die Epithelzellschicht der Atemwege bildet die erste Barriere zwischen Lungengewebe und der äußeren Umgebung und ist dadurch ständig eingeatmeten Substanzen, einschließlich Infektionserregern und Luftschadstoffen, ausgesetzt. Die Epithelschicht der Atemwege spielt eine zentrale Rolle bei einer Vielzahl von akuten und chronischen Lungenerkrankungen, und verschiedene Behandlungen, die auf dieses Epithel abzielen, werden durch Inhalation verabreicht. Um die Rolle des Epithels in der Pathogenese zu verstehen und zu verstehen, wie es gezielt für die Therapie eingesetzt werden kann, sind robuste und repräsentative Modelle erforderlich. In-vitro-Epithelkulturmodelle werden zunehmend eingesetzt und bieten den Vorteil, Experimente in einer kontrollierten Umgebung durchzuführen, bei denen die Zellen verschiedenen Arten von Reizen, Giftstoffen oder Infektionserregern ausgesetzt werden. Die Verwendung von Primärzellen anstelle von immortalisierten oder Tumorzelllinien hat den Vorteil, dass sich diese Zellen in Kultur zu einer pseudostratifizierten polarisierten Epithelzellschicht differenzieren, die im Vergleich zu Zelllinien eine bessere Repräsentation des Epithels aufweist.
Hier wird ein robustes Protokoll vorgestellt, das in den letzten Jahrzehnten für die Isolierung und Kultivierung von Atemwegsepithelzellen aus Lungengewebe optimiert wurde. Dieses Verfahren ermöglicht die erfolgreiche Isolierung, Expansion, Kultivierung und mukoziliäre Differenzierung von primären Bronchialepithelzellen (PBECs) durch Kultivierung an der Luft-Flüssigkeits-Grenzfläche (ALI) und beinhaltet ein Protokoll für das Biobanking. Des Weiteren wird die Charakterisierung dieser Kulturen anhand zellspezifischer Markergene beschrieben. Diese ALI-PBEC-Kulturen können für eine Reihe von Anwendungen verwendet werden, einschließlich der Exposition gegenüber ganzem Zigarettenrauch oder Entzündungsmediatoren und Co-Kultur/Infektion mit Viren oder Bakterien.
Das in diesem Manuskript enthaltene Protokoll, das das Verfahren Schritt für Schritt veranschaulicht, soll eine Grundlage und/oder Referenz für diejenigen bieten, die an der Implementierung oder Anpassung solcher Kultursysteme in ihrem Labor interessiert sind.
Einleitung
Die Rolle des Atemwegsepithels bei einer Vielzahl von akuten und chronischen Lungenerkrankungen wurde in verschiedenen Übersichtsarbeiten beschrieben 1,2,3,4,5,6,7. Gut differenzierte Kulturen von Atemwegsepithelzellen sind ein wichtiges Werkzeug, um die Rolle des Atemwegsepithels zu entschlüsseln. Die Air-Liquid Interface (ALI) Atemwegsepithelzellkultur wird breit eingesetzt, um die Differenzierung von Atemwegsepithelzellen zu fördern und dadurch das Atemwegsepithel zuverlässig in vitro zu untersuchen 8,9. In den letzten Jahren hat die Verwendung solcher Modelle aufgrund neuer Forschungsinitiativen im Zusammenhang mit der COVID-19-Pandemie und eines weltweiten Übergangs zur tierversuchsfreien Forschung noch weiter zugenommen. Daher unterstreicht die verstärkte Verwendung dieser Modellzelllinie die Notwendigkeit des Austauschs von Verfahren und Erfahrungen, um robuste Ergebnisse zu erzielen. Dies ermöglicht auch den Vergleich der Ergebnisse zwischen Forschungsgruppen. Die Robustheit des Verfahrens ist das Hauptmerkmal und muss daher einer Qualitätskontrolle unterzogen werden. Mehrere Labore haben in die Entwicklung von Protokollen für die Kultivierung von Epithelzellen der primären Atemwege am ALI investiert. Der Zeit-, Arbeits- und Budgetaufwand kann reduziert werden, wenn diese Verfahren im Detail geteilt werden. Zu diesen Details gehört beispielsweise die Auswahl von Zellkulturkunststoffen und -medien, die von verschiedenen Herstellern zur Verfügung gestellt werden, da festgestellt wurde, dass diese die Eigenschaften der erhaltenen Kulturenbeeinflussen 10,11,12. Dies unterstreicht die Bedeutung des Austauschs von Erfahrungen und Details über Kulturverfahren, da ohne solche Erkenntnisse die Ergebnisse beeinträchtigt und/oder die Validierungsbemühungen in verschiedenen Laboratorien behindert werden können.
Das menschliche Lungenepithel besteht aus verschiedenen Zelltypen, darunter Haupttypen wie Basalzellen, Flimmerzellen, Becherzellen und Keulenzellen. Um die Epithelzellschicht in den Atemwegen in vitro zuverlässig nachahmen zu können, müssen diese Zelltypen in den Kulturmodellen abgebildet und ihre Polarisation und Funktion aufrechterhalten werden13,14,15,16. Ebenso wichtig ist die Erkenntnis, dass die Eigenschaften des Spenders (einschließlich des Krankheitszustands) und der anatomische Ursprung der Zellen (d. h. nasale, tracheale, große und kleine Atemwege) die zelluläre Zusammensetzung und die funktionellen Reaktionen der Zellkultur beeinflussen können. Einschlägiges Fachwissen und Praxis sind Voraussetzung, um primäre Atemwegsepithelzellen erfolgreich zu kultivieren und die Qualität der Kultur sowohl intuitiv (durch visuelle Inspektion während der Kultur) als auch quantifizierbar zu beurteilen. Ziel dieses Beitrags ist es, eine kosten- und zeiteffiziente Methode zur Isolierung und Kultivierung von primären humanen Bronchialepithelzellen (PBECs) bereitzustellen, die auch auf die Kultur von trachealen und kleinen Atemwegsepithelzellen angewendet werden kann. Neben der Beschreibung eines Verfahrens zur Isolierung solcher Zellen aus reseziertem Lungengewebe wird ein Verfahren zur Expansion und zum Biobanking sowie schließlich zur Etablierung und Charakterisierung einer gut differenzierten ALI-Kultur innerhalb eines vertretbaren Kosten- und Zeitrahmens vorgestellt und diskutiert.
Protokoll
Die Zellen wurden aus makroskopisch normalem Lungengewebe isoliert, das von Patienten stammte, die sich am Leiden University Medical Center in den Niederlanden einer Resektionsoperation wegen Lungenkrebs unterzogen hatten. Patienten, von denen dieses Lungengewebe stammte, wurden über ein Unbedenklichkeitssystem in die Biobank aufgenommen, um eine kodierte anonyme Weiterverwendung dieses Gewebes zu ermöglichen (www.coreon.org). Seit dem 01.09.2022 werden Patientinnen und Patienten jedoch mit aktiver Einwilligungserklärung gemäß den lokalen Vorschriften der LUMC-Biobank mit Genehmigung der institutionellen medizinischen Ethikkommission (B20.042/Ab/ab und B20.042/Kb/kb) in die Biobank aufgenommen.
HINWEIS: Alle Verfahren werden in einer biologischen Sicherheitswerkbank gemäß den örtlichen biologischen Sicherheitsvorschriften und unter sterilen Arbeitsbedingungen mit OP-Handschuhen und einem Laborkittel durchgeführt, sofern nicht anders angegeben. Alle im Protokoll verwendeten Medien, Reagenzien und anderen Lösungen finden Sie in der Materialtabelle und in der ergänzenden Tabelle 1. In Abbildung 1 finden Sie detaillierte Protokollschritte
1. Isolierung von Bronchialepithelzellen aus menschlichem Lungengewebe
HINWEIS: Um eine optimale Erfolgsrate bei der Isolierung von Bronchialepithelzellen zu erzielen, sollte der exzidierte Bronchialring maximal 24 h lang bei 4 °C in phosphatgepufferter Kochsalzlösung (PBS) unter Zugabe von Primocin gehalten werden.
- Vorbereitungen vor Beginn des Eingriffs
- Bereiten Sie eine Beschichtungslösung in PBS vor, wie in der ergänzenden Tabelle 1 beschrieben, und beschichten Sie eine geeignete Anzahl von 6-Well-Platten mit 1,5 ml Beschichtungslösung pro Well. 2 h in einem Zellkultur-Inkubator bei 37 °C und 5 % CO2 inkubieren.
HINWEIS: Die Anzahl der zu beschichtenden Vertiefungen hängt von der Größe des herausgeschnittenen Gewebes ab. Als grober Richtwert gilt, dass vier 6-Well-Platten beschichtet werden, wenn der exzidierte Bronchialring einen Durchmesser von 10 mm und eine Breite von 4 mm hat. - Bereiten Sie ein vollständiges keratinozyten-serumfreies Medium (c-KSFM) vor, wie in der ergänzenden Tabelle 1 beschrieben; Verwenden Sie 2 ml des Mediums pro Vertiefung einer 6-Well-Platte.
HINWEIS: Dieses c-KSFM kann 7 Tage bei 4 °C gelagert werden. c-KSFM ist ein kalziumarmes Medium, das zur Expansion von Epithelzellen der Atemwege verwendet wird und gleichzeitig das Wachstum kontaminierender Fibroblasten hemmt.
- Bereiten Sie eine Beschichtungslösung in PBS vor, wie in der ergänzenden Tabelle 1 beschrieben, und beschichten Sie eine geeignete Anzahl von 6-Well-Platten mit 1,5 ml Beschichtungslösung pro Well. 2 h in einem Zellkultur-Inkubator bei 37 °C und 5 % CO2 inkubieren.
- Reinigen Sie den Bronchialring, indem Sie den Ring vorsichtig mit 10 ml sterilem PBS in einer 10-cm-Petrischale spülen. Verwenden Sie eine Pinzette, um den Ring vorsichtig zu halten (nur außen berühren), und eine kleine Schere, um überschüssiges Bindegewebe und Blutreste zu entfernen. Schneiden Sie den Ring zur Weiterverarbeitung in zwei Hälften.
Anmerkungen: Alle Werkzeuge, die in diesem Prozess verwendet werden, sollten vor dem Gebrauch sterilisiert werden. - Tauchen Sie die beiden Hälften des Bronchialrings in 10 ml einer vorgewärmten Lösung der Protease XIV (1,8 mg/ml) in Hanks balancierte Salzlösung (HBSS), einschließlich Primocin, in einem geschlossenen sterilen Behälter und inkubieren Sie sie für genau 2 h bei 37 °C in einem Zellkultur-Inkubator.
HINWEIS: HBSS wird als Verdünnungsmittel für die Protease XIV verwendet, um die Zellen während einer Inkubationszeit von 2 Stunden vom Gewebe zu lösen. HBSS ist eine ausgewogene isotonische Lösung, die die Aufrechterhaltung der Zellviabilität während kurzfristiger Inkubationen ermöglicht. - Nach der Inkubation geben Sie die Gewebestücke in eine Petrischale mit 10 ml warmem PBS und kratzen das Innere des Rings mit einer gebogenen Pinzette ab, um eine Zelllösung zu erhalten.
HINWEIS: Das Gewebe erscheint weicher und etwas gedehnt. - Verwerfen Sie den Ring, übertragen Sie die Zelllösung in ein 50-ml-Röhrchen und fügen Sie warmes PBS hinzu, um ein endgültiges Volumen von 50 ml zu erhalten. 7 min bei 230 x g und Raumtemperatur (RT) zentrifugieren.
- Aspirieren Sie den Überstand und resuspendieren Sie das Pellet in 10 ml warmem PBS. Füllen Sie das Volumen außerdem mit warmem PBS auf bis zu 50 ml aus. 7 min bei 230 x g RT zentrifugieren.
- Saugen Sie den Überstand ab und resuspendieren Sie das Zellpellet in einer angemessenen Menge warmem c-KSFM, das Primocin enthält.
HINWEIS: Das Primocin wird mindestens 7 Tage lang verwendet, um Bakterien, Pilze oder (wichtig) Mykoplasmen zu beseitigen, die möglicherweise im Gewebe vorhanden waren. Nach 7 Tagen ist die Zugabe von nur Penicillin/Streptomycin zum Medium ausreichend. - Aspirieren Sie die Beschichtungslösung von den 6-Well-Platten und fügen Sie 2 ml Zellsuspension pro Well hinzu.
- Lassen Sie die Zellen wachsen, bis eine Konfluenz von 80 % bis 90 % erreicht ist, und wechseln Sie das Medium dreimal pro Woche (z. B. jeden Montag, Mittwoch und Freitag). Der gewünschte Grad der Konfluenz wird in der Regel zwischen 7 und 14 Tagen erreicht; Wenn die Zeit, die zum Erreichen der gewünschten Konfluenz benötigt wird, länger als 14 Tage dauert, verwerfen Sie die Zellen.
HINWEIS: In den ersten Tagen beginnt sich nur eine kleine Anzahl von Zellen zu vermehren. Zellgruppen machen sich nach einigen Tagen bemerkbar.
2. Kryokonservierung von humanen primären Bronchialepithelzellen (PBECs)
Anmerkungen: Bei Temperaturen von -80 °C und -196 °C werden Kryohandschuhe zum Schutz und Pinzetten zum Umfüllen von gefrorenen Fläschchen verwendet. Bei der Arbeit mit flüssigem Stickstoff werden Kryo-Handschuhe und ein Gesichtsschutz zum persönlichen Schutz verwendet.
- Saugen Sie das Medium ab und waschen Sie die Vertiefungen einmal mit 2 ml warmem PBS pro Vertiefung.
- Trypsinisieren Sie die Zellen durch Zugabe von 0,5 ml weichem Trypsin pro Vertiefung (siehe ergänzende Tabelle 1 für die Zusammensetzung der weichen Trypsinlösung). Inkubieren Sie die Zellen für 5 bis maximal 10 min bei 37 °C. Schwenken Sie die Trypsinlösung in der Platte und lösen Sie die Zellen, indem Sie vorsichtig auf die Platte klopfen.
- Die abgetrennten Zellen werden in ein 50-ml-Zentrifugenröhrchen überführt, das 1,1 mg/ml Sojabohnen-Trypsin-Inhibitor (SBTI; zur Hemmung der Trypsin-Aktivität) enthält, der in KSFM mit Penicillin/Streptomycin gelöst ist. Das Volumen von SBTI muss doppelt so groß sein wie das Gesamtvolumen von weichem Trypsin (d. h. 1 ml pro Well).
Anmerkungen: Geben Sie SBTI nicht direkt in die Vertiefungen, da sich die Zellen innerhalb von Minuten wieder anheften. - Zentrifugieren Sie das Röhrchen 7 min lang bei 230 x g RT.
- Verwerfen Sie den Überstand und resuspendieren Sie die pelletierten Zellen in 10 ml RT KSFM, das Penicillin/Streptomycin, aber keine anderen Zusatzstoffe enthält. Zählen Sie die Zellen mit einem Hämozytometer oder einem automatischen Zellzähler. Führen Sie eine Zählung lebender/toter Zellen durch, indem Sie Trypanblau im Verhältnis 1:1 hinzufügen, oder verwenden Sie ein alternatives Verfahren zur Zählung lebender/toter Zellen.
- Kryokonservieren Sie die Zellen bei einer Konzentration von 400.000 Zellen pro ml Gefriermedium (siehe ergänzende Tabelle 1 für die Zusammensetzung) und fügen Sie 1 ml dieser Suspension pro Kryo hinzu. Überführen Sie die Kryogefäße in einen Kühlzellenbehälter und stellen Sie ihn bei -80 °C auf. Nach 24 h werden die Durchstechflaschen zur Langzeitlagerung auf -196 °C flüssigen Stickstoff umgefüllt.
Anmerkungen: Für den Transfer der Zellen in das Gefriermedium sind zwei Optionen möglich, die beide gut funktionieren: 1) Pelletieren Sie die Zellen erneut durch Zentrifugation und resuspendieren Sie sie in kaltem Gefriermedium mit der erforderlichen Zellkonzentration; oder 2) Fügen Sie kaltes Gefriermedium hinzu und passen Sie die Konzentration des Kryokonservierungsmittels (Dimethylsulfoxid [DMSO]) basierend auf dem Volumen des KSFM an, in dem sich die Zellen befinden.
3. Auftauen von kryokonservierten PBECs und Züchten für die Kultur auf Inserts
- Beschichten Sie einen T75-Zellkulturkolben über Nacht mit 10 ml Beschichtungslösung in PBS bei fest verschlossenen Deckeln. Inkubieren Sie den Kolben in einem Zellkultur-Inkubator bei 37 °C und 5 %CO 2.
- Entfernen Sie vor dem Auftauen der kryokonservierten PBECs die Beschichtungslösung aus dem Kolben und füllen Sie ihn mit 10 ml c-KSFM. In einem Zellkultur-Inkubator mit leicht geöffneten Deckeln auf 37 °C erwärmen, damit die Inkubatorluft eindringen kann.
- Tauen Sie die Zellen schnell in einem 37 °C warmen Wasser- oder Perlenbad auf.
Anmerkungen: Ein Perlenbad wird einem Wasserbad vorgezogen, da das Kontaminationsrisiko geringer ist und der Energieverbrauch geringer ist. - Geben Sie den kompletten Inhalt des Kryos in den vorgewärmten T75-Kolben mit Medium (Schritt 3.2) und verteilen Sie die Zellen gleichmäßig.
Anmerkungen: Zentrifugieren Sie die Zellen in diesem Stadium nicht, da sie den Zentrifugationsschritt nicht überleben. - Achten Sie nach ca. 4 h darauf, dass die Zellen ausreichend anhaften. Ersetzen Sie das Medium durch 10 ml frisches, warmes c-KSFM.
Anmerkungen: Auf diese Weise wird das DMSO aus dem Gefriermedium entfernt. Dieser Schritt sollte zwischen 4 h und 24 h nach der Aussaat der Zellen in den Kolben erfolgen. - Züchten Sie die Zellen, bis eine Konfluenz von 80 % bis 90 % erreicht ist, und wechseln Sie das Medium jeden Montag, Mittwoch und Freitag.
4. Etablierung einer Luft-Flüssigkeits-Grenzflächenkultur mit primären Bronchialepithelzellen (ALI-PBEC)
HINWEIS: Das folgende Verfahren gilt für die Kultur von PBECs auf Wendeschneidplatten mit einem Innendurchmesser von 11,9 mm.
- Beschichten Sie eine angemessene Anzahl von Zellkultureinsätzen mit 0,4 ml Beschichtungslösung pro Einsatz. Über Nacht bei 37 °C in einem Zellkultur-Inkubator inkubieren.
- Bereiten Sie ein vollständiges BD-Medium (cBD-Medium) vor, wie in der ergänzenden Tabelle 1 beschrieben.
ANMERKUNG: cBD-Medium ist ein zusammengesetztes Medium (siehe ergänzende Tabelle 1), das formuliert wurde, um das Wachstum von Bronchialepithelzellen über längere Zeiträume zu unterstützen und gleichzeitig ihre Differenzierung nach einem Anstieg der Retinsäurekonzentration (RA) (oder eines Analogons von RA, wie es in diesem Protokoll verwendet wird) am ALI zu ermöglichen, wie in Schritt 4.10 beschrieben. - Trypsinisieren Sie die PBECs im T75-Kolben mit 2 ml weichem Trypsin pro Kolben. Inkubieren Sie die Zellen 5 bis 10 Minuten lang, damit sich die Zellen lösen können (basierend auf visueller Inspektion). Erleichtern Sie nach 5 Minuten Inkubationszeit die Ablösung der Zellen, indem Sie das Trypsin im Kolben schwenken und vorsichtig auf den Kolben klopfen (wiederholen Sie dies bei Bedarf).
- Geben Sie 4 ml SBTI in den Kolben und geben Sie die Zellsuspension direkt in ein 25-ml-Zentrifugenröhrchen.
HINWEIS: Die Zellen werden innerhalb von Minuten wieder angebracht. Wenn daher mit mehr als einem Kolben gearbeitet wird, muss die in Schritt 4.4 erhaltene Zellsuspension direkt in ein Zentrifugenröhrchen überführt werden, bevor SBTI in einen zweiten Kolben gegeben wird. Dabei werden maximal fünf Kolben gleichzeitig verarbeitet. - Die Röhrchen 7 min bei 230 x g RT zentrifugieren.
- Resuspendieren Sie die Zellen in 6 ml cBD-Medium und zählen Sie die Zellen mit einem Hämozytometer oder einem automatischen Zellzähler. Führen Sie eine Zählung lebender/toter Zellen durch, indem Sie z. B. Trypanblau im Verhältnis 1:1 hinzufügen oder ein anderes Verfahren zur Zählung lebender/toter Zellen verwenden.
- Entfernen Sie die Beschichtungslösung aus den Zellkultureinsätzen.
- Die in Schritt 4.6 erzeugte Zellsuspension wird mit cBD-Medium, das mit 1 nM EC 23 angereichert ist, auf eine Konzentration von 80.000 Zellen pro ml verdünnt und 0,5 ml auf die Oberseite der Membran im Einsatz gegeben. Geben Sie 1,5 ml cBD-Medium, ergänzt mit 1 nM EC 23, in die Vertiefung unter dem Einsatz.
- Wechseln Sie das Medium dreimal pro Woche mit cBD-Medium, das mit 1 nM EC 23 ergänzt wird, bis die Kulturen für die Luftexposition bereit sind (d. h. 2 Tage nach Erreichen der 100%igen Konfluenz). Jedes Mal werden 0,5 ml des Mediums in den Einsatz (auf die Zellen) und 1,5 ml in das untere Fach (die Vertiefung) gegeben.
HINWEIS: Im Allgemeinen erreicht die Zellschicht etwa 5 Tage nach der Aussaat der PBECs auf den Inserts eine 100%ige Konfluenz. Basierend auf der visuellen Inspektion der Konfluenz der Zellen wird die Entscheidung getroffen, die Zellen 2 Tage später in die ALI-Phase zu überführen. - Wenn die Zellen für den Transfer in das ALI bereit sind (d. h. 2 Tage nach Erreichen der 100%igen Konfluenz), entfernen Sie das Medium aus den Einsätzen und der Vertiefung, fügen Sie kein neues Medium in den Einsatz hinzu und geben Sie neues Medium (1 ml cBD-Medium, ergänzt mit 50 nM EC 23) nur in die Vertiefung. Wechseln Sie das Medium in den Vertiefungen dreimal pro Woche.
- Um überschüssigen Schleim und Zelltrümmer zu entfernen, fügen Sie vorsichtig 200 μl warmes PBS auf der apikalen Seite der Zellschicht im Inneren des Einsatzes hinzu (vorzugsweise über die Seite des Einsatzes und nicht durch direktes Pipettieren auf den Zellen) und inkubieren Sie 10 Minuten lang in einem Zellkultur-Inkubator bei 37 °C. Aspirieren Sie dann das PBS, um überschüssigen Schleim und Zelltrümmer zu entfernen.
HINWEIS: Waschen Sie ab diesem Zeitpunkt (Beginn der ALI-Kultur) vor dem Wechsel des Mediums des unteren Kompartiments jedes Mal die apikale Seite der Zellen mit PBS. - Kultur der Zellen am ALI für mindestens 2 Wochen, um sicherzustellen, dass alle wichtigen Zelltypen vertreten sind.
5. Etablierung einer ALI-PBEC-Kultur aus einer gemischten Spenderpopulation
- Verwenden Sie Zellen von bis zu fünf einzelnen Spendern, um PBEC-Kulturen aus einer gemischten Population zu starten.
- Mischen Sie die gleiche Anzahl von Zellen pro Spender mit den in Schritt 4.7 erzeugten Zellen, um insgesamt 150.000 Zellen pro Einsatz zu erhalten (d. h. 30.000 Zellen pro Spender bei Verwendung von fünf Spendern). Dadurch wird sichergestellt, dass die Proliferation im Insert auf ein Minimum reduziert wird und die gleiche Anzahl von Zellen der einzelnen Spender in der Kultur vorhanden ist.
- Setzen Sie die ALI-PBEC-Kultur wie in den Schritten 4.9-4.12 beschrieben fort.
6. Qualitätskontrolle der ALI-PBEC-Kultur
- Überwachung des transepithelialen elektrischen Widerstands (TEER) während der Zellkultur
HINWEIS: Die Messung des elektrischen Widerstands, basierend auf der Verwendung eines Voltohmmeters, kann jederzeit während der ALI-PBEC-Kultur durchgeführt werden und wird jedes Mal nach demselben Protokoll unter den gleichen Bedingungen durchgeführt, da die Messung des elektrischen Widerstands von verschiedenen Variablen beeinflusst wird, einschließlich der Elektrodenposition, der Temperatur, des Mediums und der Handhabung. TEER kann unter Verwendung des gemessenen elektrischen Widerstands berechnet werden, indem die folgende Formel auf der Grundlage des Ohmschen Gesetzes angewendet wird: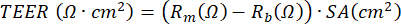 , wobei Rm der gemessene elektrische Widerstand, Rb der elektrische Grundwiderstand eines Einsatzes ohne Beschichtung und Zellen und SA die Oberfläche der Membran des Einsatzes17 ist.
, wobei Rm der gemessene elektrische Widerstand, Rb der elektrische Grundwiderstand eines Einsatzes ohne Beschichtung und Zellen und SA die Oberfläche der Membran des Einsatzes17 ist.- Fügen Sie vorsichtig 200 μl warmes PBS auf die apikale Seite der Zellschicht hinzu, um den Schleim und die Ablagerungen auf den Zellen zu entfernen. Inkubieren Sie den Einsatz für 10 min in einem Zellkultur-Inkubator bei 37 °C und entfernen Sie das PBS wieder.
- Geben Sie vorsichtig 700 μl warmes PBS auf die apikale Seite der Zellschicht und inkubieren Sie den Einsatz für 10 Minuten bei RT, um die Temperatur für Messungen zu stabilisieren.
- Kalibrieren Sie das Voltohmmeter mit dem 1.000-Ω-Prüfwiderstand, stellen Sie das Voltohmmeter auf die Messung von Ohm ein und stellen Sie die Kalibrierschraube "R ADJ" mit einem Schraubendreher ein, bis sie auf 1.000 Ω eingestellt ist.
- Spülen Sie die Elektrode, indem Sie sie einige Male in sterilem Wasser (RT) und dann in sterilem PBS (RT) auf und ab bewegen.
- Messen Sie den elektrischen Widerstand der Zellschicht in den Einsätzen. Platzieren Sie dazu die Elektrode in einer vertikalen Position in der Vertiefung, wobei der lange Arm der Elektrode den Boden der Platte berührt. Auf diese Weise befindet sich der kurze Arm über der Zellschicht im Inneren des Einsatzes. Lesen Sie den auf dem Voltohmmeter angezeigten Wert ab.
Anmerkungen: Der angezeigte Wert wird nicht vollständig stabilisiert. Lesen Sie den Wert in dem Moment, in dem der Wert intermittierend ist. - Reinigen Sie die Elektrode zwischen den Messungen, indem Sie sie einige Male in sterilem PBS (RT) auf und ab bewegen.
- Reinigen Sie die Elektrode nach Abschluss der Messungen, indem Sie sie einige Male in sterilem Wasser (RT), sterilem PBS (RT) und 70%igem Ethanol (RT) auf und ab bewegen. Lagern Sie die Elektrode trocken.
- Führen Sie eine Basismessung eines Einsatzes (ohne Beschichtung) und der Zellen durch, indem Sie 700 μl warmes PBS in den Einsatz und 1 ml warmes PBS in die Vertiefung geben und den elektrischen Widerstand zusammen mit den anderen Einsätzen messen.
- Evaluierung der zellulären Zusammensetzung der ALI-PBEC-Kultur
- Überprüfen Sie während der ALI-Phase die Differenzierung, indem Sie schlagende Flimmerhärchen visuell beurteilen. Diese können mittels Standard-Hellfeldmikroskopie bereits 9 Tage nach Luftexposition auf der apikalen Seite der Zellen beobachtet werden.
HINWEIS: Schlagende Flimmerhärchen sind am besten direkt nach dem Waschen der apikalen Oberfläche sichtbar. Becherzellen produzieren Schleim, und daher ist das Vorhandensein von Schleim, wie er beim Waschen der apikalen Oberfläche beobachtet wird, ein Zeichen dafür, dass Becherzellen gebildet werden. Die Menge der Becherzellen und die Menge des produzierten Schleims sind jedoch stark von den Spendern abhängig. Das Vorhandensein von Schleim ist beim Absaugen des PBS nach dem Waschen der apikalen Oberfläche der Zellschicht im Einsatz zu sehen. In diesem Fall ist das abgesaugte PBS viskoser, und beim Absaugen können Schleimfäden beobachtet werden. - Die Bewertung der zellulären Zusammensetzung mittels Immunfärbung und Fluoreszenzmikroskopie oder fluoreszenzaktivierter Zellsortierung (FACS) oder die Genexpressionsanalyse mittels quantitativer Polymerase-Kettenreaktion (RT-qPCR) liefert wichtige Informationen über den Differenzierungsstand der Kultur, deren Beschreibung jedoch den Rahmen dieses Beitrags sprengen würde.
- Überprüfen Sie während der ALI-Phase die Differenzierung, indem Sie schlagende Flimmerhärchen visuell beurteilen. Diese können mittels Standard-Hellfeldmikroskopie bereits 9 Tage nach Luftexposition auf der apikalen Seite der Zellen beobachtet werden.
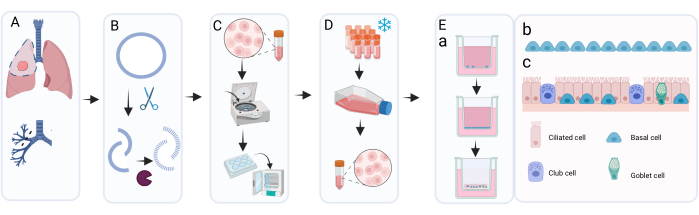
Abbildung 1: Schematische Darstellung des Isolations-, Expansions- und Kulturverfahrens von primären Bronchialepithelzellen . (A) Bei einer Krebsresektionsoperation wird Lungengewebe entnommen und der Pathologe entfernt makroskopisch normales und tumorfreies Bronchialringgewebe. (B) Der Bronchialring wird gereinigt und einer enzymatischen Behandlung ausgesetzt, um die Zellschicht abzulösen und zu dissoziieren. (C) Die entnommene Zellsuspension wird gewaschen und die Zellen werden zur Expansion in Vertiefungen einer 6-Well-Platte verteilt. (D) Nach ausreichender Expansion der isolierten Zellen in c-KSFM mit Primocin werden die Zellschichten durch Trypsinisierung dissoziiert und die Zellen werden zur Kryokonservierung in Gefriermedium resuspendiert. Bei Bedarf werden kryokonservierte Zellen aufgetaut und mit c-KSFM mit Penicillin/Streptomycin in Zellkulturflaschen wieder expandiert. Nach der Expansion werden sie in cBD-Medium auf Zellkultureinsätzen ausgesät; (EA) Die ALI-PBEC-Kultur erfolgt in zwei Hauptphasen: das getauchte Stadium in cBD-Medium, das mit 1 nM EC 23 ergänzt wird, bis die Zellen den vollständigen Zusammenfluss erreichen, gefolgt von der Entfernung des apikalen Mediums und der Kultur am ALI, um eine Differenzierung zu ermöglichen; In dieser ALI-Phase werden die Zellen in cBD-Medium kultiviert, das mit 50 nM EC 23 angereichert ist. (Eb) Grafische Darstellung der Basalzellen, die den Einsatz während der submersen Kultur bedecken. (EG) Grafische Darstellung der differenzierten Epithelzellschicht, die nach der Kultivierung am ALI in Gegenwart erhöhter Konzentrationen von EC 23 erhalten wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Expansion durch versunkene Kultur
Mit der hier vorgestellten Methode können aus einer 6-Well-Platte durchschnittlich acht Kryogefäße mit 400.000 Zellen/Kryo für die Langzeitlagerung in flüssigem Stickstoff gewonnen werden (Abbildung 2A). Um dies zu erreichen, werden isolierte PBECs in 6-Well-Platten für mindestens 7 Tage und maximal 14 Tage (Abbildung 2B) in Gegenwart von Primocin kultiviert, um eine mikrobielle Kontamination (insbesondere Mykoplasmen) auszuschließen. Abbildung 2A,B gibt Aufschluss über die erhaltene Zellzahl und die benötigte Kulturzeit zwischen verschiedenen Isolierungen von verschiedenen Spendern. Vor der Ernte der Zellen durch Trypsinisierung zur Speicherung in flüssigem Stickstoff muss die Konfluenz über 80% liegen. Gelingt dies nicht innerhalb von 14 Tagen, sollten die Zellen nicht kryokonserviert werden. Wichtig ist, dass bei der Ernte zur Lagerung und Durchreichung die Konfluenz der Zellschicht ~95% nicht überschreiten sollte (Abbildung 2C). Nach der Lagerung in flüssigem Stickstoff können die Zellen aufgetaut und für die Expansion kultiviert werden, bis eine ausreichende Anzahl von Zellen für ALI-Kulturen erreicht ist. Das Medium, das für die Expansion der Zellen in diesem Stadium verwendet wird, ist c-KSFM, ähnlich wie bei der ersten Kultur nach der Entnahme aus dem Bronchialring18. In diesem Stadium besteht jedoch kein Bedarf an Primocin, da das Risiko einer zusätzlichen mikrobiellen Kontamination durch das Lungengewebe nicht besteht und Primocin daher gegen Penicillin/Streptomycin ausgetauscht werden kann. Dieses Medium bevorzugt Epithelzellen gegenüber Fibroblasten und verhindert daher ein mögliches Überwachsen der Kultur durch schneller proliferierende Fibroblasten 19,20,21. Bei Verwendung des c-KSFM-Mediums sind die Zellen im Kolben verteilt und verbinden sich nicht miteinander, was sich deutlich von der Morphologie der kultivierten Zellen unterscheidet, die in diesem Stadium in cBD-Medium eingetaucht sind (Abbildung 2D,E). Nach 5 oder 6 Tagen der Kultivierung der aufgetauten Zellen in einem T75-Kolben sollte die Zellschicht zu 80 % bis 95 % konfluent sein, was insgesamt etwa 3 x 106 Zellen entspricht (Abbildung 2F). Daraus können ca. 75 Inserts (12-Well-Plattengröße) für die ALI-Kultur generiert werden.
Die in diesem Beitrag beschriebene Methode zur Isolierung und Kultur kann auch für den Einsatz mit Bronchialbiopsien oder Bronchialbürsten als Ausgangsmaterial adaptiert werden.
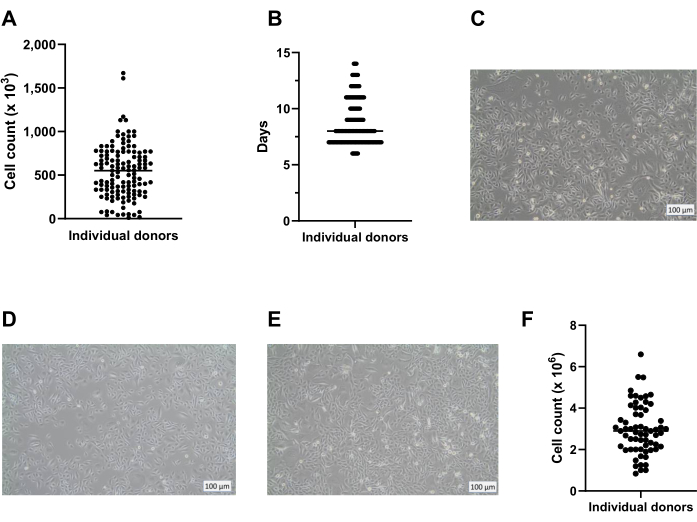
Abbildung 2: Basalzellexpansion vor und nach der Kryokonservierung. Die Zellen wurden nach dem beschriebenen Protokoll isoliert und mittels c-KSFM kultiviert. Die Anzahl der pro Spender erzeugten Zellen wurde überwacht, die Anzahl der lebenden Zellen wurde mit einem automatisierten Zellzähler (A) durchgeführt, wenn die Zellen der Passage 0 (P0) aus den 6-Well-Platten entnommen wurden (Schritt 2 des Protokolls), n = 123 Spender, die Zellzahl wurde als Anzahl der pro Well geernteten Zellen dargestellt; Jeder Punkt steht für einen Spender und der Median wird durch einen horizontalen Balken angezeigt. (B) Im Rahmen der Qualitätskontrolle wurde die Zeit, die die P0-Zellen benötigten, um eine Konfluenz von 80 % bis 90 % in den 6-Well-Platten zu erreichen, überwacht und als Tage nach Beginn der submersen Kultur in c-KSFM angezeigt (n = 127 verschiedene Spender). Jeder einzelne Spender wird durch einen Punkt gekennzeichnet, alle Punkte, die zu 1 Tag gehören, verschmelzen zu einer Linie; Je breiter die Linie, desto mehr Spender steht sie; Die mittlere Anzahl der Tage, an denen sich die Zellen in Kultur befinden, wird durch einen dünneren horizontalen Balken angezeigt. (C) Repräsentatives Hellfeldbild von P0-Zellen, die in c-KSFM gezüchtet wurden, als die Zellen für die Langzeit-Kryokonservierung geerntet wurden. (D) Repräsentatives Hellfeldbild von P1-Zellen, die in c-KSFM gezüchtet wurden, als die Zellen geerntet und auf Inserts übertragen wurden, und (E) P1-Zellen, die in cBD-Medium gezüchtet wurden. (F) Die Anzahl der pro Spender erzeugten lebenden Zellen wurde bei der Entnahme von P1-Zellen aus dem T75-Kolben (Abschnitt 4 des Protokolls) mit einem automatisierten Zellzähler überwacht, n = 63 verschiedene Spender; Die Zellzahl wird als Anzahl der Zellen pro T75-Flasche angegeben, jeder Spender wird durch einen Punkt und die mittlere Zellzahl durch einen horizontalen Balken angegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Luft-Flüssigkeits-Grenzfläche (ALI)-Kultur
7 Tage nach Beginn der ALI-Kultur wird der elektrische Widerstand der Zellschicht gemessen und sollte mehr als 300 Ω betragen (Abbildung 3A); Gelingt dies nicht, gilt die Kultur als gescheitert, da möglicherweise keine Tight Junction gebildet wird. Es wird empfohlen, niedrige TEER-Werte auszuschließen, die durch eine Schädigung der Epithelschicht in einzelnen Einsätzen verursacht werden, die z. B. durch eine Schädigung der Zellschicht während des Waschens und der Aspiration verursacht wird. Dies kann durch eine visuelle mikroskopische Inspektion der Kultureinsätze überprüft werden. Unserer Erfahrung nach kann die Variabilität des elektrischen Widerstands zwischen den Spendern signifikant sein (Abbildung 3B), was auch in der Literaturberichtet wird 14, und wie beobachtet, auch deutlich von der Herkunft des verwendeten modifizierten Adlermediums (DMEM) von Dulbecco beeinflusst wird (Abbildung 3C).
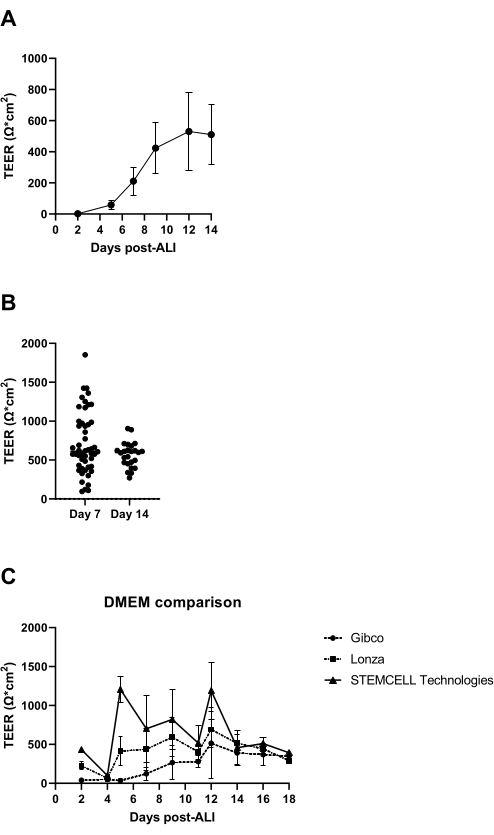
Abbildung 3: Transepithelialer elektrischer Widerstand als Qualitätskontrolle von ALI-PBEC-Kulturen. PBECs wurden isoliert und expandiert, und es wurden gut differenzierte ALI-PBEC-Kulturen etabliert. Zu mehreren Zeitpunkten während der Kultur wurde der elektrische Widerstand gemessen und anschließend der TEER berechnet (Ω·cm2). (A) Der elektrische Widerstand wurde über einen Zeitraum von 14 Tagen nach ALI gemessen. n = 4 verschiedene Spender. Die Daten werden als Mittelwert ± Standardabweichung (SD) dargestellt. (B) Im Rahmen der Qualitätskontrolle der ALI-PBEC-Zellkultur wurde der elektrische Widerstand an Tag 7 (n = 50) und Tag 14 nach ALI (n = 25) gemessen; Jeder Punkt steht für einen Spender und der mittlere TEER (Ω·cm2) wird durch einen horizontalen Balken angezeigt. Die Daten wurden mit einem nichtparametrischen Mann-Whitney-Test auf Signifikanz getestet, und es wurde kein signifikanter Unterschied gefunden. (C) Medien von drei verschiedenen DMEM-Lieferanten wurden getestet, um den Einfluss auf die TEER-Bildung zu bewerten. n = 4 verschiedene Spender; Die Mittelwerte sind ± SD dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Bei der Etablierung einer gut differenzierten ALI-PBEC-Kultur steigt die Konzentration von RA ab Beginn der Luftexposition an22. Auf diese Weise wechseln die Zellen von der Proliferation zur mukoziliären Differenzierung, die bereits 9 Tage (spenderabhängig) nach Luftexposition mittels Hellfeldmikroskopie sichtbar wird. Die Bewegung der ersten Zilien ist an dieser Stelle sichtbar, und etwas früher, wenn sie auf der Genexpression von Markern differenzierter luminaler Zellenberuht 23 (Abbildung 4).
Wie im Protokoll beschrieben, kann die Schleimproduktion auch beim Spülen der apikalen Oberfläche während des Mediumwechsels beobachtet werden. RA ist sehr lichtempfindlich, was zu einer sehr schwankenden Aktivität bei gleicher Stammkonzentration führt. Aus diesem Grund wird RA durch das synthetische RA-Analogon EC 23 ersetzt und in gleicher Konzentration eingesetzt, mit ähnlichen Ergebnissen wie experimentell. Aus diesem Grund und um eine Änderung des Verfahrens zu vermeiden, wurde die gewählte EC23-Konzentration auf die zuvor verwendete RA-Konzentration (d. h. 50 nM) 24,25 gehalten (Abbildung 5). Abbildung 5A zeigt die TEER-Werte, die bei Verwendung verschiedener Konzentrationen von EC 23 erreicht wurden, und zeigt einen maximalen TEER bei 50 nM innerhalb dieses getesteten Konzentrationsbereichs. Die in Abbildung 5B gezeigten Ergebnisse bestätigen, dass die Genexpression von Markern für Flimmer- und Becherzellen bei Verwendung von 50 nM EC 23 oder RA ähnlich ist. EC 23 wird auch während der Kultur im submersen Stadium benötigt (wenn auch in einer viel niedrigeren Konzentration), da das Weglassen in diesem submersen Stadium und die Zugabe erst im ALI-Stadium zu einer Kultur führt, die nie die vollständige Konfluenz erreicht. Die Zeit, die benötigt wird, um eine gut differenzierte ALI-PBEC-Kultur mit sichtbarer ziliarer Schlagaktivität und Schleimproduktion zu erzeugen, beträgt etwa 14 Tage, und die meisten Experimente werden daher zwischen 14-21 Tagen ALI-Kulturen begonnen (Abbildung 4). Alle wichtigen verschiedenen Zelltypen (Basal-, Flimmer-, Kelch- und Keulenzellen) werden nach 14 Tagen ALI-Kultur beobachtet, obwohl die Expressionsniveaus stark vom Spender abhängig sind. Dies wird durch die Bestimmung der Genexpression von TP63, FOXJ1, MUC5AC und SCGB1A1 mittels RT-qPCR oder der Proteinexpression mit Antikörpern, die gegen p63, α-Tubulin, Muc5AC und CC-16 gerichtet sind, durch Immunfluoreszenzfärbung (IF) demonstriert, um Marker für basale, Flimmer-, Kelch- bzw. Keulenzellen zu erkennen25,26. Während jedoch 14-21 Tage als Faustregel für die meisten Experimente angesehen werden können, kann für ausgewählte Experimente eine längere Differenzierungsdauer in Betracht gezogen werden, wie sie für den xenobiotischen Stoffwechsel, die SARS-CoV-2-Infektion und die Beurteilung der mukoziliären Clearance gefunden wurde27,28,29.
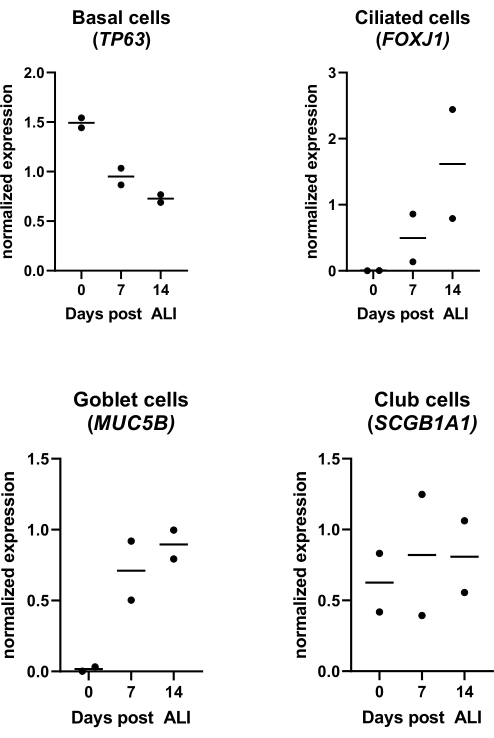
Abbildung 4: Luft-Flüssigkeits-Grenzfläche (ALI)-Kultur. PBECs wurden isoliert und expandiert, und es wurden gut differenzierte ALI-PBEC-Kulturen etabliert. Die ALI-PBEC-Kulturen wurden über einen Zeitraum von 14 Tagen nach ALI überwacht. Zellkulturen wurden für die Isolierung der RNA an den Tagen 0, 7 und 14 nach ALI lysiert. Es werden Daten von zwei verschiedenen Spendern angezeigt, jeder Punkt steht für einen einzelnen Spender, der im Laufe der Zeit überwacht wurde, und der Median wird durch einen horizontalen Balken angezeigt. Die Genexpression von basalen, Flimmer-, Kelch- und Keulenzellmarkern (TP63, FOXJ1, MUC5B bzw. SCGB1A1) wurde mittels qPCR gemessen und für die RPL13A- und ATP5B-Genexpression normalisiert (siehe Referenz 23 für Details). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
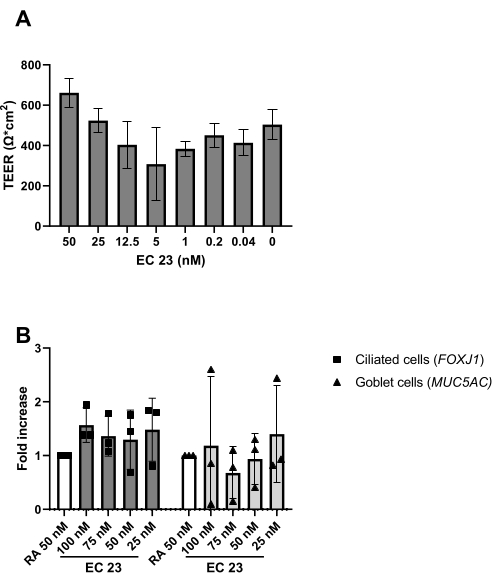
Abbildung 5: Vergleich von Retinsäure (RA) und ihrem synthetischen Analogon EC 23. PBECs wurden isoliert und expandiert, und es wurden gut differenzierte ALI-PBEC-Kulturen etabliert. Zu Beginn der Luftexposition der PBEC-Kulturen wurde RA (50 nM) durch verschiedene Konzentrationen von EC 23 ersetzt. (A) Der elektrische Widerstand wurde an Tag 14 post-ALI gemessen und anschließend der TEER berechnet (Ω·cm 2), n =2 Donoren, die Balken stellen den Mittelwert ± SD dar. (B) Am Tag 14 post-ALI wurden Zellkulturen für die RNA-Isolierung und anschließende Genexpressionsanalyse von Zellmarkern für Flimmer- bzw. Becherzellen (FOXJ1, MUC5AC) mittels qPCR lysiert, und normiert für RPL13A (n = 3 Donoren). Eine Faltenzunahme wird gegenüber ALI-PBEC gezeigt, die mit 50 nM RA kultiviert und als Mittelwert ± SD dargestellt wird. (Siehe Referenz 23 für Details) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
In den letzten Jahren wurde die Leistungsfähigkeit alternativer Produkte im Kultursystem untersucht, wie z. B. Medien und Kulturkunststoffe. Für solche Bewertungen gab es verschiedene Gründe, darunter Änderungen in der Medienzusammensetzung durch die Hersteller, die Einführung neuer Medien sowie eine Verknappung von Produkten während der COVID-19-Pandemie (2020-2022). Es wurde beobachtet, dass ähnliche Produkte von verschiedenen Anbietern zu differenzierten Epithelzellkulturen führen, basierend auf der Bewertung von Markern von Epithelzelltypen, obwohl die endgültige zelluläre Zusammensetzung erheblich variieren kann (Abbildung 6A), während Unterschiede in TEER weniger ausgeprägt waren (Abbildung 6B). Auf der anderen Seite führten Medien von verschiedenen Anbietern zu erheblichen Unterschieden in der zellulären Zusammensetzung; Bei der Verwendung von Wendeschneidplatten verschiedener Marken hielten sich diese Unterschiede in Grenzen (Abbildung 6C). Insbesondere bei der Verwendung des Atemwegsepithelzellkulturmediums PneumaCult von STEMCELL Technologies wurde eine andere Morphologie und eine schnellere Ausbildung der sichtbaren Ziliaraktivität beobachtet. Neben diesen Beobachtungen wurde auch ein Unterschied in den TEER-Werten und ein Unterschied in der zellulären Zusammensetzung des ALI-PBEC im Vergleich zum cBD-Medium festgestellt (Abbildung 6D).
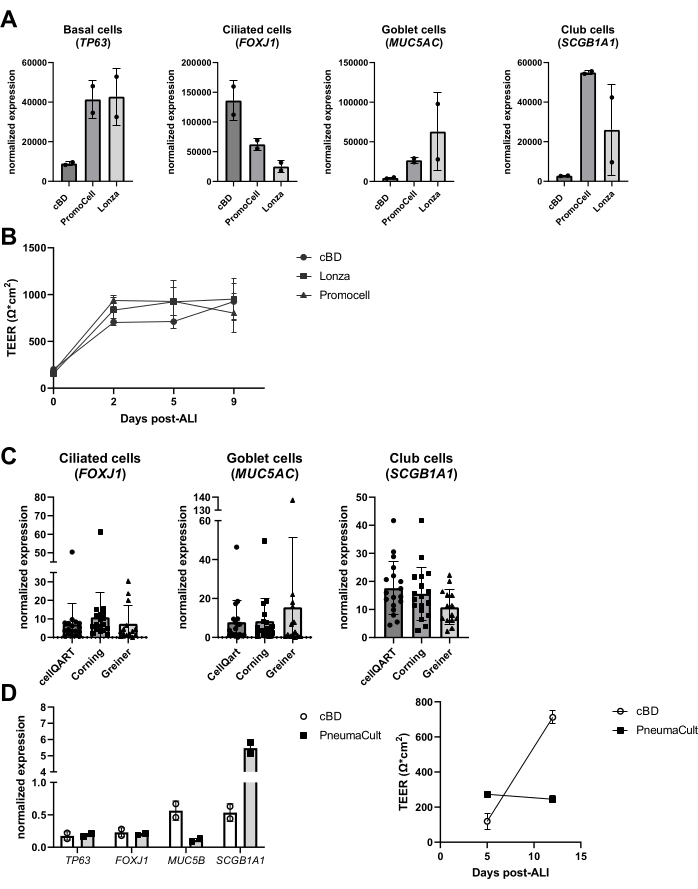
Abbildung 6: Vergleich verschiedener Anbieter von Epithelzellmedium und Zellkultureinsätzen. PBEC wurden isoliert, expandiert und gut differenzierte ALI-PBEC-Kulturen etabliert. (A) ALI-PBECs wurden 14 Tage lang kultiviert und dann wurden die Zellschichten für die RNA-Isolierung lysiert. Die Genexpression von Basal-, Flimmer-, Kelch- und Keulenzellmarkern (TP63, FOXJ1, MUC5AC bzw. SCGB1A1) wurde mittels qPCR gemessen und für RPL13A und ATP5B normalisiert. n = 2 Spender; Die Balken stellen den Mittelwert ± SD dar. (B) Im Laufe von 9 Tagen nach ALI wurde der elektrische Widerstand gemessen und anschließend der TEER berechnet (Ω·cm2). n = 3 verschiedene Spender; Die Mittelwerte sind ± SD dargestellt. (C) ALI-PBECs wurden 14 Tage lang mit Zellkultureinsätzen kultiviert, die von drei verschiedenen Lieferanten bezogen wurden, und dann wurden die Zellschichten für die RNA-Isolierung lysiert. Die Genexpression von Flimmer-, Kelch- und Keulenzellmarkern (FOXJ1, MUC5AC bzw. SCGB1A1) wurde mittels qPCR gemessen und für RPL13A normalisiert. n = 18 verschiedene Donoren, die Balken stellen den Mittelwert ± SD dar. Die Daten wurden mit einem unidirektionalen ANOVA-nichtparametrischen Kruskal-Wallis-Test auf Signifikanz getestet und es wurde kein signifikanter Unterschied gefunden. (D) ALI-PBECs wurden entweder in cBD-Medium oder PneumaCult-Medium (STEMMCELL-Technologien) für 14 Tage nach ALI kultiviert, und dann wurden die Zellschichten für die RNA-Isolierung lysiert. Die Genexpression von Basal-, Flimmer-, Kelch- und Keulenzellmarkern (TP63, FOXJ1, MUC5B bzw. SCGB1A1) wurde mittels qPCR gemessen und für RPL13A normalisiert (die Balken stellen den Mittelwert ± SD dar), und der elektrische Widerstand wurde an den Tagen 5 und 12 nach ALI gemessen und zur Berechnung des TEER (Ω·cm2) verwendet. n = 2; der Mittelwert ist ± SD dargestellt (Details siehe Referenz 23). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Tabelle 1: Zusammensetzung der im Protokoll verwendeten Lösungen und Medien. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das hier vorgestellte Protokoll beschreibt die Isolierung von humanen Bronchialepithelzellen aus reseziertem Lungengewebe, eine Methode zur optimalen Expansion von Zellen ohne Verlust des Differenzierungspotentials, ein Kryokonservierungsverfahren und ein Verfahren zur Erzeugung gut differenzierter ALI-PBEC-Kulturen. Des Weiteren wird eine Beschreibung der Qualitätskontrolle sowie eine Anleitung zur Überwachung und Bewertung der differenzierten ALI-PBECs gegeben.
Das beschriebene Protokoll beginnt mit einem makroskopisch normalen, tumorfreien Bronchialring, der aus einem Lungenlappen von Patienten reseziert wird, die sich im Zusammenhang mit ihrer Lungenkrebsdiagnose einer Operation unterziehen. Es ist daher zu beachten, dass diese Ringe streng genommen nicht als gesundes Gewebe angesehen werden können, was daher die Eigenschaften der Zellkultur beeinträchtigen kann. Alternative Quellen zur Gewinnung von Bronchialepithelzellen sind die Verwendung von Bronchialepithelzellen, Bronchialbürsten oder Gewebe aus der Lunge eines transplantierten Spenders oder Empfängers. Unabhängig von der Quelle sollte bei der Verwendung von Lungengewebe das Risiko einer mikrobiellen Kontamination berücksichtigt werden, und daher werden Antibiotika in den verschiedenen Nährmedien verwendet, um das Risiko einer mikrobiellen Kontamination der Zellkultur zu verringern. Insbesondere Mykoplasmen stellen ein hohes und häufiges Risiko in Zellkulturen dar, da sie eine Vielzahl von Auswirkungen auf die Zellkultur haben, Resistenzen gegen Antibiotika, die üblicherweise in Zellkulturen verwendet werden, und die Tatsache, dass eine Mykoplasmenkontamination nur durch Mykoplasmennachweisassays bestätigt werden kann. Daher wird in der Anfangsphase der Zellkultur nach der Isolierung von Zellen aus Lungengewebe die antimikrobielle Breitbandformulierung Primocin verwendet, und während des Kulturprozesses werden zufällig ausgewählte Proben auf das Vorhandensein von Mykoplasmen getestet.
Das Isolationsverfahren, das mit einem Bronchialring beginnt, liefert ausreichend Ausgangsmaterial, um den Expansionsgrad dieser Primärzellen zu ermöglichen, der für den Start von Kulturen am ALI erforderlich ist, ohne die Differenzierungsfähigkeit zu beeinträchtigen. Der Beginn der Expansion der isolierten Epithelzellen mit einer begrenzten Anzahl von Zellen kann jedoch Probleme bei der Gewinnung einer ausreichenden Anzahl von Inserts mit genügend Zellen verursachen, die für die ALI-Kultur ausgesät werden können. Eine ausgedehnte Kultur und wiederholte Passage von Primärzellen kann zu einer replikativen Seneszenz führen. Es wurden verschiedene Lösungen vorgeschlagen, um diese Einschränkung zu überwinden. Horani et al. zeigten, dass der Rho-Kinase-Inhibitor (ROCK) Y-27632 die Proliferation von Basalzellen erhöhte30, Mou et al. nutzten die duale Smad-Hemmung, um basale Stammzellen zu vermehren und gleichzeitig die Eigenschaften der differenzierten Epithelzellschicht31 beizubehalten, und Sachs et al. haben ein Atemwegsorganoidsystem entwickelt, das verwendet werden kann, um Atemwegsepithelzellen zu erweitern und ihr Differenzierungspotenzial im Laufe mehrerer Passagen aufrechtzuerhalten32. Die letztgenannte Methode wurde auch verwendet, um Zellen aus Quellen mit sehr geringer Zellzahl, wie z. B. Trachealaspiate (TAs) von Frühgeborenen (<28. Schwangerschaftswoche) und bronchoalveoläre Lavageflüssigkeit (BAL), zu expandieren, bevor sie in die ALI-Kultur übertragen wurden, wie hier beschrieben33. Es zeigte sich, dass Zellen, die aus BAL und TAs isoliert wurden, eine ähnliche Differenzierungsfähigkeit aufwiesen wie Zellen, die aus Bronchialgewebe generiert wurden, obwohl Unterschiede beobachtet wurden, wenn die Differenzierung in Richtung eher bewimperter oder kelchzellhaltiger Kulturen unter Verwendung der Notch-Signalinhibition oder des Th2-Zytokins IL-1333 verzerrt wurde. Es wird daher empfohlen, bei der Kultivierung von ALI-PBECs aus einem Ausgangsmaterial mit geringer Epithelzellzahl unter Verwendung ähnlicher Ansätze die Kulturen immer auf die grundlegenden Qualitätskriterien zu überprüfen, wie in Abschnitt 6 des Protokolls erörtert. Wichtig ist, dass die Verwendung von Feeder-Zellen auch dazu beitragen kann, größere Zellzahlen zu erhalten, was in einer Umgebung für die Entwicklung von transplantierbaren Gerüsten, in der Zeit und Zellzahl entscheidend sind, unerlässlich ist. Dies wird durch eine Studie veranschaulicht, in der autologe Epithelzellen aus Biopsien eines Patienten mit Trachealerkrankung kultiviert und Zellen in Gegenwart einer murinen embryonalen Feederschicht (mitotisch inaktivierte 3T3-J2-Fibroblasten) und des oben erwähnten Inhibitors des Rho/ROCK-Signalwegs (Y-27632)34 schnell vermehrt wurden. Die resultierende Zellkultur erwies sich als nützlich für die Wiederbesiedlung von Trachealgerüsten und könnte daher als geeignetes Protokoll für ein Transplantationsmodell angesehen werden.
Bei der Verwendung des in diesem Beitrag beschriebenen Protokolls, aber auch bei der Verwendung anderer Kulturprotokolle, wird zwangsläufig ein Selektionsbias eingeführt. Es ist wichtig zu wissen, dass Unterschiede in den Protokolldetails, wie z. B. die Herkunft der Zellen, die zur Initiierung von Kulturen verwendet werden, die Zusammensetzung des Mediums und andere Protokolldetails zu Veränderungen in der zellulären Zusammensetzung der Kulturen und damit zu Veränderungen in der Reaktion der ALI-Kultur führen können33,35. Darüber hinaus wurden auch Unterschiede in den Zelleigenschaften beobachtet, wenn verschiedene Medien zur Differenzierung der Atemwegszellen verglichenwurden 10,11. Beim Vergleich von PneumaCult und cBD-Medium wurden Unterschiede in den mRNA-Markern für Becherzellen und Keulenzellen, den TEER-Werten und der Zellschichtdicke beobachtet. Aufgrund dieser Beobachtungen wurde trotz fehlender statistischer Untermauerung, aufgrund der geringen Anzahl der verwendeten Spender, der den Kunden unbekannten Zusammensetzung des Mediums und der höheren Kosten des PneumaCult-Mediums, in unserem Labor die Entscheidung getroffen, cBD-Medium zu verwenden.
Wie bereits erwähnt, können Zellen zunächst mit Hilfe von Organoidkulturen expandiert und anschließend in das 2D-ALI-Insert-System überführt werden. Dies ist wichtig, da Atemwegsepithelorganoide nicht für die Exposition gegenüber luftgetragenen Substanzen geeignet sind, während die Verwendung des ALI 2D-Systems die Bewertung der Auswirkungen von luftgetragenen Substanzen wie Zigarettenrauch23,36 auf kultivierte Atemwegsepithelzellen ermöglicht. Ein anderer Ansatz zur Etablierung von ALI-Atemwegsepithelzellkulturen besteht darin, Atemwegsepithelzellen durch die Differenzierung menschlicher pluripotenter Stammzellen (hiPS-Zellen) zu erzeugen37. In solchen Protokollen können in der letzten Phase des Differenzierungsprotokolls nach der Differenzierung zu proximalen Atemwegsvorläuferzellen Zellen durch Kultur zum ALI differenziert werden, wobei ähnliche Verfahren wie die hier beschriebenen verwendet werden.
Im aktuellen Protokoll wird cBD-Medium für die Kultur am ALI verwendet. cBD-Medium ist ein serumfreies Medium, das durch Zugabe einer Mischung aus verschiedenen Nahrungsergänzungsmitteln hergestellt wird, inspiriert von Fulcher et al.38 sowie anderen Studien. Die Ergänzungslösung enthält 52 μg/ml Rinderhypophysenextrakt (BPE), 0,5 μg/ml Hydrocortison, 0,5 ng/ml humanes EGF, 0,5 μg/ml Epinephrin, 10 μg/ml Transferrin, 5 μg/ml Insulin, 6,5 ng/ml Trijodthyronin und 0,1 ng/ml RA39. Da es sich bei BPE um einen Gewebeextrakt handelt, der chargenweise Schwankungen unterliegt, kann das Medium nicht als vollständig definiertes Medium betrachtet werden und ist auch nicht tierversuchsfrei. Ein vollständig definiertes Zellkulturmedium wird bevorzugt, um Unterschiede von Charge zu Charge zu minimieren. Im Hinblick auf den Übergang zur tierversuchsfreien Forschung ist es wichtig, dass Anstrengungen unternommen werden, um definierte Medien zu produzieren, die keine tierischen Produkte enthalten und für die Wissenschaft erschwinglich sind.
Je nach Fragestellung können verschiedene Versuchsaufbauten auf Basis des ALI-Modells eingesetzt werden. Um beispielsweise die Auswirkungen von Verbindungen zu untersuchen, die den Differenzierungsprozess beeinflussen können, kann dies durch Zugabe der Verbindungen zur Kultur während der verschiedenen Stadien der submersen Kultur, während der Differenzierung oder in der gut differenzierten Phase behoben werden. Die zelluläre Zusammensetzung der ALI-PBEC-Kultur kann durch die Zugabe spezifischer Verbindungen beeinflusst werden; So führt beispielsweise die Differenzierung von ALI-PBECs in Gegenwart von IL-13 zu einer Kultur mit mehr Becherzellen und weniger Flimmerzellen, während die Behandlung mit dem γ-Sekretase-Inhibitor DAPT (der zur Blockierung des Notch-Signalwegs verwendet wird) während der Differenzierung zu einer Kultur mit mehr Flimmerzellen auf Kosten der Becherzellen führt 23,40,41,42.
Darüber hinaus können Wirkstoffe, die Zellen stimulieren oder bestimmte Prozesse blockieren, entweder auf das basale Kompartiment oder (in sehr kleinem Volumen) auf das apikale Kompartiment der Kultur appliziert werden. Zellen können auch von der apikalen Seite luftgetragenen Substanzen ausgesetzt werden. Solche Expositionsdesigns wurden verwendet, um die Wirkung von Dieselabgasen oder ganzem Zigarettenrauch auf PBECszu untersuchen 23,43,44. Das Medium kann jedes Mal geerntet werden, wenn das Medium gewechselt wird, um die sezernierten Proteine auf der Basalseite zu überwachen. Gleiches gilt für die apikale Seite der Zellen, die mit PBS gewaschen wird, während das Basalmedium aufgefrischt wird. Der sogenannte apikale Wash wird geerntet und optional Dithioerythrit (DTE) hinzugefügt, um den Schleim, der von den Becherzellen produziert wird, effizienter zu dissoziieren. Zelllysate können für die Isolierung von Gesamtprotein, RNA sowie chromosomaler und mitochondrialer DNA gewonnen werden. Die Zellen können unter Verwendung von Antikörpern für spezifische Marker weiter untersucht werden, indem die Polyethylenterephthalat (PET)-Membran aus dem Kunststoffeinsatz geschnitten und diese Membran für mehrere Immunfluoreszenzfärbungen weiter in kleinere Stücke geschnitten wird45. Darüber hinaus kann die Durchflusszytometrie oder FACS auch nach Trypsinisierung der Zellen in den Inserts eingesetzt werden. Während der ALI-Phase kann die Entwicklung der zellulären Barriere durch Messung des elektrischen Widerstands und anschließende Berechnung des TEER überwacht werden, wobei der elektrische Widerstand umgekehrt proportional zur Oberfläche des Membraneinsatzes ist. Die Berechnung basiert auf dem Ohmschen Gesetz unter Verwendung der folgenden Formel: 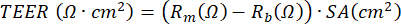 , wobei Rm der gemessene elektrische Widerstand, Rb der elektrische Grundwiderstand eines Einsatzes ohne Beschichtung und Zellen und SA die Oberfläche der Membran des Einsatzes ist. Die Messung des elektrischen Widerstands mit EVOM2- und STX/Essstäbchen-Elektroden ist unkompliziert, hängt aber stark von den Handhabungsverfahren beim Einführen in das Bohrloch ab. Auch wurde vorgeschlagen, dass die Form der Elektrode die Messung der Barrierefunktion der relativ großen Oberfläche17 beeinflusst.
, wobei Rm der gemessene elektrische Widerstand, Rb der elektrische Grundwiderstand eines Einsatzes ohne Beschichtung und Zellen und SA die Oberfläche der Membran des Einsatzes ist. Die Messung des elektrischen Widerstands mit EVOM2- und STX/Essstäbchen-Elektroden ist unkompliziert, hängt aber stark von den Handhabungsverfahren beim Einführen in das Bohrloch ab. Auch wurde vorgeschlagen, dass die Form der Elektrode die Messung der Barrierefunktion der relativ großen Oberfläche17 beeinflusst.
Eine weitere Verbesserung des ALI-Zellkultursystems, die darauf abzielt, die genaue Geweberepräsentation zu erhöhen, umfasst die Kokultur zusätzlicher Zelltypen wie Leukozyten, Fibroblasten oder Endothelzellen46,47,48. Es wurde beobachtet, dass die Kokultur von ALI-PBEC mit dem Granulozyten-Makrophagen-Kolonie-stimulierenden Faktor (GM-CSF) oder M-CSF-differenzierten Makrophagen die angeborenen Epithelreaktionen und -reparaturen deutlich beeinflusst48. Es ist wichtig zu beachten, dass in solchen Kokulturmodellen die Medienkompatibilität ein Problem darstellen kann. Da das für die Atemwegsepithelzellkultur verwendete Medium speziell für PBECs entwickelt wurde und für andere Zelltypen möglicherweise nicht optimal geeignet ist, ist eine Optimierung erforderlich. Eine weitere Art von Fortschritt auf dem Gebiet der Atemwegsbiologie, für die isolierte PBECs verwendet werden können, ist die Verwendung der Organs-on-Chips (OoC)-Technologie49,50. Mit dieser Technologie kann der Einfluss der mechanischen Kräfte der Atmung und des Blutflusses, wie z. B. Dehnung, Luft und mittlerer Durchfluss, untersucht werden 29.
Die Variabilität zwischen den Spendern kann bei der Verwendung von PBECs von verschiedenen Spendern signifikant sein, und daher ist es wichtig, die Verwendung von Zellen von mehreren Spendern in Betracht zu ziehen, um diese Variabilität in Epithelzellkulturstudien zu berücksichtigen. Da die Kultivierung von ALI-PBECs zeitaufwändig und mit erheblichen Kosten verbunden ist, wird die Möglichkeit geprüft, ALI-PBEC-Kulturen durch Mischen von Zellen verschiedener Spender in einem Zellkultureinsatz zu etablieren. Auf diese Weise können Pilotexperimente mit Primärzellen durchgeführt werden, bevor die Reaktionen von Kulturen analysiert werden, die von verschiedenen Einzelspendern stammen. Darüber hinaus können Spender mit unterschiedlichen Merkmalen (z.B. unterschiedliche Alterskategorie oder Geschlecht) für explorative Studien gruppiert werden. Bei der Verwendung von Spendermischungen ist es wichtig, darauf zu achten, dass die gleiche Zellzahl verschiedener Spender vorhanden ist, um zu verhindern, dass ein Spender aufgrund einer höheren Proliferationsrate die Ergebnisse dominiert. Daher werden Zellen von einzelnen Spendern separat expandiert und mit einer höheren Dichte im Einsatz ausgesät als bei der Aussaat von Zellen eines einzelnen Spenders, um die Proliferation im Insert vor dem Übergang zum ALI zu minimieren. Das Ansprechen von Spendermischungen und entsprechenden Einzelspendern wurde durch Untersuchung der Infektionskinetik von SARS-CoV-2 verglichen. Mit Hilfe von RT-qPCR und Immunfluoreszenzfärbung wurde beobachtet, dass die Spendermischung eine gute Repräsentation der verschiedenen einzelnen Spender lieferte, indem sie eine ähnliche Anzahl von produzierten Viruspartikeln und eine ähnliche Anzahl infizierter Zellen aufwies28.
Um eine akzeptable Alternative für Tiermodelle zu werden, sollte die Genom-Editierung von kultivierten Bronchialepithelzellen durchführbar sein51. Die RNA-Interferenztechnologie unter Verwendung kleiner interferierender RNAs (siRNAs) in ALI-PBECs wird untersucht, da die Zellen jedoch während der submersen Phase der Kultur mit siRNA transfiziert werden müssen, wird der Knockdown während der ALI-Kultur aufgrund der langen Kulturdauer nicht ausreichend aufrechterhalten, es sei denn, die siRNA-Transfektion wird während der Kultur häufig wiederholt52. Nichtsdestotrotz können siRNAs erfolgreich zur Modifikation der Genexpression in submersen Basalzellen eingesetzt werden. Andere haben die CRISPR/Cas9-Technologie erfolgreich eingesetzt, um Genom-Editierung in primären ALI-Epithelzellkulturen der Atemwege mit Ribonukleoprotein (RNP)-Abgabe zu erreichen 53. Bei der Anwendung solcher Techniken ist es wichtig, dass die Zellen ihre volle Differenzierungsfähigkeit behalten. Da primäre Atemwegszellkulturen nicht unbegrenzt passieren können, ist die klonale Expansion der geneditierten Zellen nicht einfach und die Zugabe von Medium zur Auswahl der transfizierten Zellen ist umständlich. Daher ist es schwierig, den gewünschten Knockdown in allen kultivierten Zellen zu erreichen. Eine Alternative zur Erzeugung von Knockout-Klonen ist die Verwendung von Knock-out-Strategien in hiPS-Zellen54 und die Verwendung dieser Zellen zur Erzeugung von Atemwegsepithelzellen. Eine weitere, wenn auch suboptimale Alternative ist die Etablierung einer immortalisierten PBEC-Linie, um geneditierte Zellen klonal zu vermehren55.
Das hier vorgestellte Protokoll ist eine Möglichkeit, ein gut differenziertes pseudostratifiziertes ALI-PBEC zu erzeugen, aber es wurden auch andere Protokolle gefunden, die eine solche Kultur etablieren, mit kleineren und größeren Unterschieden im Vergleich zum vorgestellten Protokoll. Unserer Meinung nach sind die laborübergreifende Validierung von Kulturmethoden und eine strenge Qualitätskontrolle unerlässlich, damit das ALI-PBEC-System und ähnliche Kultursysteme von Atemwegsepithelzellen eine valide Alternative für Tierversuche darstellen können.
Offenlegungen
Die Autoren erklären, dass keine relevanten Interessenkonflikte bestehen.
Danksagungen
Die Studien, die das in diesem Beitrag beschriebene Modell verwenden, wurden von einer Vielzahl von Förderorganisationen unterstützt, darunter die Lungenstiftung Niederlande, die Niederländische Organisation für Gesundheitsforschung und -entwicklung (ZonMw, COVID-19 MKMD-Zuschuss), die Niederländische Gesellschaft für den Ersatz von Tierversuchen (Stichting Proefdiervrij, Zuschuss #114025007) sowie Forschungsstipendien von Unternehmen wie Boehringer Ingelheim und Galapagos. Abbildung 1 wurde mit BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1,000 ohm test resistor | World Precision Instruments | N/A | Used to calibrate the EVOM2 Epithelial Voltohmmeter |
| 4-[2-(5,6,7,8-Tetrahydro-5,5,8,8-tetramethyl-2-naphthalenyl)ethynyl)-benzoic acid (EC 23) | Tocris | 4011 | Used in cBD medium |
| 6-well Clear TC-treated Multiple Well Plates | Corning | 3506 | Used in the first step to grow the cells isolated form the bronchial ring |
| Airway Epithelial Cell Growth Medium Kit | PromoCell | C-21160 | Used to compare to cBD medium |
| Bead Bath 20 Liter | Lab Armor | 74220-720 | Used to pre-warm cell culture solutions |
| BEGM Bronchial Epithelial Cell Growth Medium BulletKit | LONZA | CC-3170 | Used to compare to cBD medium |
| Bovine albumin fraction V (BSA) | Thermo Fisher Scientific | 15260037 | Used in coating solution |
| Bovine pituitary extract (BPE) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Bronchial epithelial cell growth supplement (BEpiCGS) | ScienCell Research Laboratories | 3262 | Used in cBD medium |
| Bronchial epithelial cell medium-basal (BEpiCM-b) | ScienCell Research Laboratories | SCC3211-b | Used in cBD medium |
| Cell culture inserts; 12 mm Transwell with 0.4 µm pore polyester membrane insert | Corning | 3460 | Cell culture inserts used in the protocol |
| Cell culture inserts; 12-well inserts, 0.4 µm PET clear | CellQART made by SABEU | 9310412 | Cell culture inserts used to compare with Corning cell culture inserts |
| Cell culture inserts; 12-well ThinCert Tissue culture Inserts | Greiner Bio-One | 82050-032 | Cell culture inserts used to compare with Corning cell culture inserts |
| CELLSTAR flask, TC, PS, 250 ml, 75 cm2 | Greiner Bio-One | 658170 | Used to expand the number cells |
| CFX Maestro 1.0 | Bio-Rad | N/A | Software program for analyzing qPCR data generated with the CFX384 System |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad | 1855484 | qPCR detection system |
| Chopstick electrode set | World Precision Instruments | STX2 | Used to measure electrical resistance in ALI-PBEC |
| CO2-Incubator | PHCbi | MCO-170AICUV-PE | Cell culture incubator used for mycplasma free cell cultures |
| CO2-Incubator | Hereaus | Heracell 150 | Cell culture incubator used for possibly mycplasma infected cell cultures |
| Coolcell Container | Corning | 432006 | Used to cryopreserve cells at -80 °C before transfer to liquid N2 |
| Countess 3 Automated cell counter | Thermo Fisher Scientific | AMQAX2000 | Used to count cells and determine the cell concentration |
| Cryovials | Nalgene | 479-3224 | Used to cryopreserve cells in |
| D-Glucose | Avantor VWR BDH CHEMICALS | 101174Y | Used in soft trypsin |
| Dimethyl sulfoxide (DMSO) | Avantor VWR | 0231 | Used in cell freeze medium |
| dNTP (10 mM) | Promega | U1515 | Used in the synthesis of cDNA |
| Dulbecco's Modified Eagle's Medium (DMEM) + 4500 mg/l D-Glucose | STEMCELL Technologies | 36250 | Used in cBD medium |
| Dulbecco's Modified Eagle's Medium (DMEM) 4.5 g/l glucose with l-glutamine | LONZA | LOBE12-604F | Used in cBD medium to compare with DMEM from other manufacturers |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, pyruvate | Thermo Fisher Scientific | 41966029 | Used in cBD medium to compare with DMEM from other manufacturers |
| Epidermal growth factor (EGF) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Ethylenediaminetetraacetic acid (EDTA) | Avantor VWR BDH CHEMICALS | 443885J | Used in soft trypsin |
| EVOM2 Epithelial Voltohmmeter | World Precision Instruments | 91799 | Used with the chopstick electrode set to measure electrical resistance in ALI-PBEC |
| Fibronectin solution, Human | PromoCell | C-43060 | Used in coating solution |
| Glutamax | Thermo Fisher Scientific | 35050038 | Used in cBD medium |
| Hanks balanced salt solution (HBSS) | ScienCell Research Laboratories | SCC0313 | Used to dissolve protease XIV |
| IQ SYBR Green Super mix | Bio-Rad | 170887 | qPCR reagent |
| Isoproterenol hydrochloride, (-)- | Sigma-Aldrich | I-6504 | Used in c-KSFM |
| Keratinocyte-SFM (KSFM) | Thermo Fisher Scientific | 17005-034 | Used in c-KSFM |
| Maxwell RSC Instrument | Promega | AS4500 | Automated RNA isolation system |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | Used to isolate total RNA with the Maxwell RSC Instrument |
| M-MLV Reverse transcriptase | Promega | M5301 | Used in the synthesis of cDNA |
| M-MLV Reverse transcriptase 5X reaction buffer | Promega | M531A | Used in the synthesis of cDNA |
| MycoStrip | InvivoGen | rep-mys-10 | Used to detect the presence of mycoplasma in cell culture samples |
| N-2-hydroxyethylpiperazine-N-2-ethane sulfonic acid (HEPES) | Thermo Fisher Scientific | 15630056 | Used in cBD medium |
| Oligo(dT)15 | Qiagen | 79237 | Used in the synthesis of cDNA |
| Penicillin/Streptomycin solution (Pen/Strep) | ScienCell Research Laboratories | SCC0513 | Used as antibiotic in c-KSFM and cBD medium |
| Phosphate buffered saline (PBS) | LUMC pharmacy | N/A | Used in different steps of the protocol |
| Pneumacult-ALI Medium | STEMCELL Technologies | 05002 | Used to grow cells in the differentiation stage to compare to cBD medium |
| Pneumacult-Ex Plus Medium | STEMCELL Technologies | 05040 | Used to grow cells in the submerged stage to compare to cBD medium |
| Primer, ATP5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: TCACCCAGGCTGGTTCAGA |
| Primer, ATP5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGTGGCCAGGGTAGGCTGAT |
| Primer, FOXJ1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGAGGGGACGTAAATCCCTA |
| Primer, FOXJ1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TTGGTCCCAGTAGTTCCAGC |
| Primer, MUC5AC, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCTTCGACGGACAGAGCTAC |
| Primer, MUC5AC, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCTCGGTGACAACACGAAAG |
| Primer, MUC5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGGCTTTGACAAGAGAGT |
| Primer, MUC5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGGATGGTCGTGTTGATGCG |
| Primer, RPL13A, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: AAGGTGGTGGTCGTACGCTGTG |
| Primer, RPL13A, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: CGGGAAGGGTTGGTGTTCATCC |
| Primer, SCGB1A1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: ACATGAGGGAGGCAGGGGCTC |
| Primer, SCGB1A1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: ACTCAAAGCATGGCAGCGGCA |
| Primer, TP63, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCACCTGGACGTATTCCACTG |
| Primer, TP63, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCGAATCAAATGACTAGGAGGGG |
| Primocin | InvivoGen | ant-pm-2 | Used as antimicrobial agent against bacteria, mycoplasma, and fungi in c-KSFM medium |
| Protease XIV | Sigma-Aldrich | P5147 | Used for the enzymatic treatment of the bronchial ring |
| RNAsin Recombinant Ribonuclease inhibitor | Promega | N2515 | Used in the synthesis of cDNA |
| Soybean trypsin inhibitor (SBTI) | Sigma-Aldrich | T9128 | Used to inhibit the action of soft trypsin |
| T100 Thermal Cycler | Bio-Rad | 1861096 | Used in the synthesis of cDNA |
| TissueSAFE plus | MILESTONE MEDICAL | N/A | Vacuum transfer system for biological specimens |
| Trypan blue solution | Thermo Fisher Scientific | 15250061 | Used to count live- and dead cells |
| Trypsin 1:250 | Thermo Fisher Scientific | 27250-018 | Used in soft trypsin |
| Type I collagen solution (PureCol) | Advanced BioMatrix | 5005-B | Used in coating solution |
| Universal container, PP, with PE screw cap | Avantor VWR | 216-2053 | Used in the protocol for the Protease XIV treatment of the bronchial ring |
Referenzen
- Aghapour, M., et al. Role of air pollutants in airway epithelial barrier dysfunction in asthma and COPD. European Respiratory Review. 31 (163), 210112 (2022).
- de Waal, A. M., Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Duchesne, M., Okoye, I., Lacy, P. Epithelial cell alarmin cytokines: Frontline mediators of the asthma inflammatory response. Frontiers in Immunology. 13, 975914 (2022).
- Hewitt, R. J., Lloyd, C. M. Regulation of immune responses by the airway epithelial cell landscape. Nature Reviews Immunology. 21 (6), 347-362 (2021).
- Ruysseveldt, E., Martens, K., Steelant, B. Airway basal cells, protectors of epithelial walls in health and respiratory diseases. Frontiers in Allergy. 2, 787128 (2021).
- Alysandratos, K. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Hammad, H., Lambrecht, B. N. Barrier epithelial cells and the control of type 2 immunity. Immunity. 43 (1), 29-40 (2015).
- Hynds, R. E., Bonfanti, P., Janes, S. M. Regenerating human epithelia with cultured stem cells: feeder cells, organoids and beyond. EMBO Molecular Medicine. 10 (2), 139-150 (2018).
- Hiemstra, P. S., Tetley, T. D., Janes, S. M. Airway and alveolar epithelial cells in culture. The European Respiratory Journal. 54 (5), 1900742 (2019).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), 2137 (2020).
- Leung, C., Wadsworth, S. J., Yang, S. J., Dorscheid, D. R. Structural and functional variations in human bronchial epithelial cells cultured in air-liquid interface using different growth media. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1063-L1073 (2020).
- Morgan, R., et al. A medium composition containing normal resting glucose that supports differentiation of primary human airway cells. Scientific Reports. 12 (1), 1540 (2022).
- Ghosh, B., et al. Strong correlation between air-liquid interface cultures and in vivo transcriptomics of nasal brush biopsy. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1056-L1062 (2020).
- Pezzulo, A. A., et al. The air-liquid interface and use of primary cell cultures are important to recapitulate the transcriptional profile of in vivo airway epithelia. American Journal of Physiology. Lung Cellular and Molecular Physiology. 300 (1), L25-L31 (2011).
- Dvorak, A., Tilley, A. E., Shaykhiev, R., Wang, R., Crystal, R. G. Do airway epithelium air-liquid cultures represent the in vivo airway epithelium transcriptome. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 465-473 (2011).
- Legebeke, J., et al. Temporal whole-transcriptomic analysis of characterized in vitro and ex vivo primary nasal epithelia. Frontiers in Cell and Developmental Biology. 10, 907511 (2022).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- van Wetering, S., et al. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. Journal of Investigative Medicine. 48 (5), 359-366 (2000).
- Balk, S. D. Calcium as a regulator of the proliferation of normal, but not of transformed, chicken fibroblasts in a plasma-containing medium. Proceedings of the National Academy of Sciences. 68 (2), 271-275 (1971).
- Gail, M. H., Boone, C. W., Thompson, C. S. A calcium requirement for fibroblast motility and prolifertion. Experimental Cell Research. 79 (2), 386-390 (1973).
- Dulbecco, R., Elkington, J. Induction of growth in resting fibroblastic cell cultures by Ca. Proceedings of the National Academy of Sciences. 72 (4), 1584-1588 (1975).
- van Wetering, S., et al. Epithelial differentiation is a determinant in the production of eotaxin-2 and -3 by bronchial epithelial cells in response to IL-4 and IL-13. Molecular Immunology. 44 (5), 803-811 (2007).
- Amatngalim, G. D., et al. Aberrant epithelial differentiation by cigarette smoke dysregulates respiratory host defence. The European Respiratory Journal. 51 (4), 1701009 (2018).
- Christie, V. B., et al. Retinoid supplementation of differentiating human neural progenitors and embryonic stem cells leads to enhanced neurogenesis in vitro. Journal of Neuroscience Methods. 193 (2), 239-245 (2010).
- Schrumpf, J. A., Ninaber, D. K., vander Does, A. M., Hiemstra, P. S. TGF-β1 impairs vitamin D-induced and constitutive airway epithelial host defense mechanisms. Journal of Innate Immunity. 12 (1), 74-89 (2020).
- Schrumpf, J. A., et al. Proinflammatory cytokines impair vitamin D-induced host defense in cultured airway epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (6), 749-761 (2017).
- Boei, J. J. W. A., et al. Xenobiotic metabolism in differentiated human bronchial epithelial cells. Archives of Toxicology. 91 (5), 2093-2105 (2017).
- Wang, Y., et al. Impact of human airway epithelial cellular composition on SARS-CoV-2 infection biology. bioRxiv. , (2021).
- Nawroth, J. C., et al. Breathing on Chip: Dynamic flow and stretch tune cellular composition and accelerate mucociliary maturation of airway epithelium in vitro. bioRxiv. , (2022).
- Horani, A., Nath, A., Wasserman, M. G., Huang, T., Brody, S. L. Rho-associated protein kinase inhibition enhances airway epithelial Basal-cell proliferation and lentivirus transduction. American Journal of Respiratory Cell and Molecular Biology. 49 (3), 341-347 (2013).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Eenjes, E., et al. Disease modeling following organoid-based expansion of airway epithelial cells. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (4), L775-L786 (2021).
- Butler, C. R., et al. Rapid expansion of human epithelial stem cells suitable for airway tissue engineering. American Journal of Respiratory and Critical Care Medicine. 194 (2), 156-168 (2016).
- Amatngalim, G. D., et al. Antibacterial defense of human airway epithelial cells from chronic obstructive pulmonary disease patients induced by acute exposure to nontypeable Haemophilus influenzae: modulation by cigarette smoke. Journal of Innate Immunity. 9 (4), 359-374 (2017).
- Plebani, R., et al. 3D lung tissue models for studies on SARS-CoV-2 pathophysiology and therapeutics. International Journal of Molecular Sciences. 23 (17), 10071 (2022).
- Wong, A. P., et al. Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein. Nature Biotechnology. 30 (9), 876-882 (2012).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Biology. 107, 183-206 (2005).
- Cao, J., Wong, C. K., Yin, Y., Lam, C. W. K. Activation of human bronchial epithelial cells by inflammatory cytokines IL-27 and TNF-alpha: implications for immunopathophysiology of airway inflammation. The Journal of Cellular Physiology. 223 (3), 788-797 (2010).
- Tsao, P. N., et al. Notch signaling controls the balance of ciliated and secretory cell fates in developing airways. Development. 136 (13), 2297-2307 (2009).
- Laoukili, J., et al. IL-13 alters mucociliary differentiation and ciliary beating of human respiratory epithelial cells. The Journal of Clinical Investigation. 108 (12), 1817-1824 (2001).
- Mertens, T. C. J., et al. Cigarette smoke differentially affects IL-13-induced gene expression in human airway epithelial cells. Physiological Reports. 5 (13), e13347 (2017).
- Zarcone, M. C., et al. Effect of diesel exhaust generated by a city bus engine on stress responses and innate immunity in primary bronchial epithelial cell cultures. Toxicology in Vitro. 48, 221-231 (2018).
- vander Does, A. M., et al. Early transcriptional responses of bronchial epithelial cells to whole cigarette smoke mirror those of in-vivo exposed human bronchial mucosa. Respiratory Research. 23 (1), 227 (2022).
- Wang, Y., Ninaber, D. K., van Schadewijk, A., Hiemstra, P. S. Tiotropium and fluticasone inhibit rhinovirus-induced mucin production via multiple mechanisms in differentiated airway epithelial cells. Frontiers in Cellular and Infection Microbiology. 10, 278 (2020).
- Ronaghan, N. J., et al. M1-like, but not M0- or M2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), 0276013 (2022).
- Gindele, J. A., et al. Opposing effects of in vitro differentiated macrophages sub-type on epithelial wound healing. PLoS One. 12 (9), e0184386 (2017).
- van Riet, S., et al. Modulation of airway epithelial innate immunity and wound repair by M(GM-CSF) and M(M-CSF) macrophages. Journal of Innate Immunity. 12 (5), 410-421 (2020).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Stucki, A. O., et al. A lung-on-a-chip array with an integrated bio-inspired respiration mechanism. Lab on a Chip. 15 (5), 1302-1310 (2015).
- Peters-Hall, J. R., et al. Long-term culture and cloning of primary human bronchial basal cells that maintain multipotent differentiation capacity and CFTR channel function. American Journal of Physiology. Lung Cellular and Molecular Physiology. 315 (2), L313-L327 (2018).
- Bartman, C. M., Stelzig, K. E., Linden, D. R., Prakash, Y. S., Chiarella, S. E. Passive siRNA transfection method for gene knockdown in air-liquid interface airway epithelial cell cultures. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), L280-L286 (2021).
- Koh, K. D., et al. Efficient RNP-directed human gene targeting reveals SPDEF is required for IL-13-induced mucostasis. American Journal of Respiratory Cell and Molecular Biology. 62 (3), 373-381 (2020).
- Bhargava, N., et al. Development of an efficient single-cell cloning and expansion strategy for genome edited induced pluripotent stem cells. Molecular Biology Reports. 49 (8), 7887-7898 (2022).
- Angelopoulou, A., Papaspyropoulos, A., Papantonis, A., Gorgoulis, V. G. CRISPR-Cas9-mediated induction of large chromosomal inversions in human bronchial epithelial cells. STAR Protocols. 3 (2), 101257 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten