Method Article
Isoler les cellules épithéliales bronchiques du tissu pulmonaire réséqué pour les biobanques et établir des cultures d’interface air-liquide bien différenciées
Dans cet article
Résumé
Présenté ici est une méthode reproductible, abordable et robuste pour l’isolement et l’expansion des cellules épithéliales bronchiques primaires pour la biobanque à long terme et la génération de cellules épithéliales différenciées par culture à l’interface air-liquide.
Résumé
La couche cellulaire épithéliale des voies respiratoires forme la première barrière entre le tissu pulmonaire et l’environnement extérieur et est donc constamment exposée aux substances inhalées, y compris les agents infectieux et les polluants atmosphériques. La couche épithéliale des voies respiratoires joue un rôle central dans une grande variété de maladies pulmonaires aiguës et chroniques, et divers traitements ciblant cet épithélium sont administrés par inhalation. Comprendre le rôle de l’épithélium dans la pathogenèse et comment il peut être ciblé pour la thérapie nécessite des modèles robustes et représentatifs. Les modèles de culture épithéliale in vitro sont de plus en plus utilisés et offrent l’avantage de réaliser des expériences dans un environnement contrôlé, exposant les cellules à différents types de stimuli, de toxiques ou d’agents infectieux. L’utilisation de cellules primaires au lieu de lignées cellulaires immortalisées ou tumorales présente l’avantage que ces cellules se différencient en culture d’une couche cellulaire épithéliale polarisée pseudostratifiée avec une meilleure représentation de l’épithélium par rapport aux lignées cellulaires.
Un protocole robuste, optimisé au cours des dernières décennies, est présenté ici pour l’isolement et la culture de cellules épithéliales des voies respiratoires à partir de tissus pulmonaires. Cette procédure permet d’isoler, d’étendre, de cultiver et de différencier mucociliaire avec succès les cellules épithéliales bronchiques primaires (PBEC) par culture à l’interface air-liquide (ALI) et comprend un protocole de biobanque. De plus, la caractérisation de ces cultures à l’aide de gènes marqueurs spécifiques aux cellules est décrite. Ces cultures ALI-PBEC peuvent être utilisées pour une gamme d’applications, y compris l’exposition à la fumée de cigarette entière ou aux médiateurs inflammatoires, et la co-culture / infection par des virus ou des bactéries.
Le protocole fourni dans ce manuscrit, illustrant la procédure étape par étape, devrait fournir une base et/ou une référence pour ceux qui s’intéressent à la mise en œuvre ou à l’adaptation de tels systèmes de culture dans leur laboratoire.
Introduction
Le rôle de l’épithélium des voies respiratoires dans une variété de maladies pulmonaires aiguës et chroniques a été décrit dans diverses revues 1,2,3,4,5,6,7. Des cultures bien différenciées de cellules épithéliales des voies respiratoires sont un outil important pour démêler le rôle de l’épithélium des voies respiratoires. La culture de cellules épithéliales des voies respiratoires de l’interface air-liquide (ALI) est largement appliquée pour favoriser la différenciation des cellules épithéliales basales des voies respiratoires et ainsi étudier l’épithélium des voies respiratoires de manière fiable in vitro 8,9. Au cours des dernières années, l’utilisation de tels modèles a encore augmenté en raison de nouvelles initiatives de recherche liées à la pandémie de COVID-19 et d’une transition mondiale vers une recherche sans animaux. Par conséquent, l’utilisation accrue de cette lignée cellulaire modèle souligne la nécessité de partager les procédures et les expériences pour obtenir des résultats solides. Cela permettra également de comparer les résultats entre les groupes de recherche. La robustesse de la procédure est la caractéristique clé et doit donc être soumise à un contrôle de qualité. Plusieurs laboratoires ont investi dans l’élaboration de protocoles pour la culture de cellules épithéliales primaires des voies respiratoires à l’ALI. Le temps, les efforts et le budget requis peuvent être réduits lorsque ces procédures sont partagées en détail. Ces détails incluent, par exemple, le choix des plastiques et des milieux de culture cellulaire fournis par divers fabricants, car il a été constaté que cela influençait les caractéristiques des cultures obtenues10,11,12. Cela souligne l’importance de partager les expériences et les détails des procédures de culture, car en l’absence de telles informations, les résultats peuvent être affectés et / ou les efforts de validation dans divers laboratoires peuvent être entravés.
L’épithélium pulmonaire humain comprend divers types de cellules, y compris des types majeurs tels que les cellules basales, les cellules ciliées, les cellules caliciformes et les cellules de club. Afin d’imiter de manière fiable la couche de cellules épithéliales dans les voies respiratoires in vitro, ces types de cellules doivent être représentés dans les modèles de culture, et leur polarisation et leur fonction maintenues13,14,15,16. Il est tout aussi important de réaliser que les caractéristiques du donneur (y compris l’état pathologique) et l’origine anatomique des cellules (c.-à-d. nasale, trachéale, grande et petite voie respiratoire) peuvent influer sur la composition cellulaire et les réponses fonctionnelles de la culture cellulaire. Une expertise et une pratique pertinentes sont une condition préalable à la culture réussie de cellules épithéliales primaires des voies respiratoires et à l’évaluation de la qualité de la culture à la fois intuitivement (par inspection visuelle pendant la culture) et quantifiable. L’objectif de cette contribution est de fournir une méthode rentable et rapide pour l’isolement et la culture de cellules épithéliales bronchiques humaines primaires (PBEC) qui peut également être appliquée à la culture de cellules épithéliales trachéales et de petites voies respiratoires. En plus de décrire une méthode pour isoler de telles cellules à partir de tissu pulmonaire réséqué, une méthode d’expansion et de biobanque, et enfin pour l’établissement et la caractérisation d’une culture d’ALI bien différenciée dans un coût et une période de temps raisonnables est présentée et discutée.
Protocole
Les cellules ont été isolées à partir de tissu pulmonaire macroscopiquement normal obtenu à partir de patients subissant une chirurgie de résection pour un cancer du poumon au Centre médical universitaire de Leiden, aux Pays-Bas. Les patients à partir desquels ce tissu pulmonaire a été dérivé ont été inscrits dans la biobanque via un système de non-objection pour l’utilisation anonyme codée de ces tissus (www.coreon.org). Cependant, depuis le 01-09-2022, les patients ont été inscrits à la biobanque en utilisant le consentement éclairé actif conformément aux réglementations locales de la biobanque LUMC avec l’approbation du comité d’éthique médicale de l’institution (B20.042 / Ab / ab et B20.042 / Kb / kb).
REMARQUE: Toutes les procédures sont effectuées dans une armoire de sécurité biologique, conformément aux règles locales de sécurité biologique et dans des conditions de travail stériles tout en portant des gants chirurgicaux et une blouse de laboratoire, sauf indication contraire. Pour tous les milieux, réactifs et autres solutions utilisés dans le protocole, veuillez consulter le tableau des matériaux et le tableau supplémentaire 1. Veuillez consulter la figure 1 pour connaître les étapes détaillées du protocole.
1. Isolement de cellules épithéliales bronchiques à partir de tissus pulmonaires humains
REMARQUE: Pour obtenir un taux de réussite optimal pour l’isolement des cellules épithéliales bronchiques, l’anneau bronchique excisé doit être maintenu immergé à 4 ° C pendant un maximum de 24 heures dans une solution saline tamponnée au phosphate (PBS) avec Primocin ajouté.
- Préparatifs avant le début de la procédure
- Préparer une solution de revêtement dans du PBS, tel que décrit dans le tableau supplémentaire 1, et enduire un nombre approprié de plaques à 6 puits de 1,5 mL de solution de revêtement par puits. Incuber pendant 2 h dans un incubateur de culture cellulaire à 37 °C et 5% de CO2.
NOTE: Le nombre de puits à revêtir dépend de la taille du tissu excisé. À titre indicatif, quatre plaques à 6 puits sont recouvertes lorsque l’anneau bronchique excisé mesure 10 mm de diamètre et 4 mm de largeur. - Préparer un milieu complet sans sérum kératinocytaire (c-KSFM), tel que décrit dans le tableau supplémentaire 1; utiliser 2 mL du milieu par puits d’une plaque de 6 puits.
REMARQUE: Ce c-KSFM peut être conservé à 4 ° C pendant 7 jours. c-KSFM est un milieu pauvre en calcium utilisé pour l’expansion des cellules épithéliales des voies respiratoires tout en inhibant la croissance des fibroblastes contaminants.
- Préparer une solution de revêtement dans du PBS, tel que décrit dans le tableau supplémentaire 1, et enduire un nombre approprié de plaques à 6 puits de 1,5 mL de solution de revêtement par puits. Incuber pendant 2 h dans un incubateur de culture cellulaire à 37 °C et 5% de CO2.
- Nettoyez l’anneau bronchique en rinçant doucement l’anneau dans 10 ml de PBS stérile dans une boîte de Petri de 10 cm. Utilisez une pince à épiler pour tenir soigneusement l’anneau (ne touchez que l’extérieur) et de petits ciseaux pour enlever tout excès de tissu conjonctif et de restes de sang. Pour un traitement ultérieur, coupez l’anneau en deux.
REMARQUE: Tous les outils utilisés dans le processus doivent être stérilisés avant utilisation. - Immerger les deux moitiés de l’anneau bronchique dans 10 mL d’une solution préchauffée de protéase XIV (1,8 mg/mL) dans la solution saline équilibrée de Hank (HBSS), y compris Primocin dans un récipient stérile fermé, et incuber pendant exactement 2 h à 37 °C dans un incubateur de culture cellulaire.
NOTE: HBSS est utilisé comme diluant pour la protéase XIV pour détacher les cellules du tissu pendant une période d’incubation de 2 heures. HBSS est une solution isotonique équilibrée qui permet le maintien de la viabilité cellulaire pendant les incubations à court terme. - Après l’incubation, transférer les morceaux de tissu dans une boîte de Petri avec 10 ml de PBS chaud et gratter l’intérieur de l’anneau à l’aide d’une pince à épiler pliée pour obtenir une solution cellulaire.
REMARQUE: Le tissu semble plus mou et quelque peu élargi. - Jeter l’anneau, transférer la solution cellulaire dans un tube de 50 mL et ajouter du PBS chaud pour obtenir un volume final de 50 mL. Centrifuger pendant 7 min à 230 x g et à température ambiante (RT).
- Aspirer le surnageant et remettre en suspension la pastille dans 10 ml de PBS chaud. De plus, compléter le volume jusqu’à 50 ml avec du PBS chaud. Centrifuger pendant 7 min à 230 x g à TA.
- Aspirer le surnageant et remettre en suspension la pastille de cellule dans une quantité appropriée de c-KSFM chaud contenant Primocin.
REMARQUE: La Primocine est utilisée pendant au moins 7 jours pour éliminer toute bactérie, champignon ou (surtout) mycoplasme qui pourrait avoir été présent dans le tissu; Après 7 jours, l’ajout de pénicilline/streptomycine au milieu est suffisant. - Aspirer la solution de revêtement des plaques à 6 puits et ajouter 2 mL de suspension cellulaire par puits.
- Laisser les cellules croître jusqu’à ce que la confluence de 80% à 90% soit atteinte et changer le milieu trois fois par semaine (par exemple, tous les lundis, mercredis et vendredis). Le degré de confluence souhaité est généralement atteint entre 7 et 14 jours; Si le temps nécessaire pour atteindre la confluence souhaitée dépasse 14 jours, jetez les cellules.
REMARQUE: Dans les premiers jours, seul un petit nombre de cellules commencent à proliférer; Des groupes de cellules sont perceptibles après quelques jours.
2. Cryoconservation des cellules épithéliales bronchiques primaires humaines (CSP)
REMARQUE: Lorsque vous travaillez avec des températures de -80 ° C et -196 ° C, des gants cryogéniques sont utilisés pour la protection et des pinces à épiler sont utilisées pour transférer les flacons congelés. Lorsque vous travaillez avec de l’azote liquide, des gants cryogéniques et un écran facial sont utilisés pour la protection personnelle.
- Aspirer le milieu et laver les puits une fois avec 2 mL de PBS chaud par puits.
- Trypsiniser les cellules en ajoutant 0,5 mL de trypsine molle par puits (voir le tableau supplémentaire 1 pour la composition de la solution de trypsine molle). Incuber les cellules pendant 5 à 10 minutes maximum à 37 °C. Faire tourbillonner la solution de trypsine dans la plaque et libérer les cellules en tapotant doucement la plaque.
- Transférer les cellules détachées dans un tube à centrifuger de 50 mL contenant 1,1 mg/mL d’inhibiteur de la trypsine de soja (SBTI; pour inhiber l’activité de la trypsine) dissous dans KSFM avec de la pénicilline/streptomycine. Le volume de SBTI doit être le double du volume total de trypsine molle (c.-à-d. 1 mL par puits).
REMARQUE: N’ajoutez pas SBTI directement aux puits, car les cellules se rattacheront en quelques minutes. - Centrifuger le tube pendant 7 min à 230 x g à TA.
- Jeter le surnageant et remettre en suspension les cellules granulées dans 10 mL de RT KSFM contenant de la pénicilline / streptomycine mais aucun autre additif. Comptez les cellules à l’aide d’un hémocytomètre ou d’un compteur de cellules automatisé. Effectuez un comptage de cellules vivantes / mortes en ajoutant du bleu de trypan dans un rapport de 1: 1, ou utilisez une procédure alternative de comptage de cellules vivantes / mortes.
- Cryoconserver les cellules à une concentration de 400 000 cellules par mL de milieu de congélation (voir le tableau supplémentaire 1 pour la composition) et ajouter 1 mL de cette suspension par cryoviale. Transférer les cryoviales dans un récipient à cellules froides et le placer à -80 °C. Après 24 h, transférer les flacons à -196 °C d’azote liquide pour un stockage à long terme.
NOTE: Deux options sont possibles pour transférer les cellules dans un milieu de congélation, qui fonctionnent bien: 1) Enduire à nouveau les cellules par centrifugation et les remettre en suspension dans un milieu de congélation à froid à la concentration de cellule requise; ou 2) ajouter un milieu de congélation à froid et ajuster la concentration du cryoconservateur (diméthylsulfoxyde [DMSO]) en fonction du volume de KSFM dans lequel les cellules sont présentes.
3. Décongeler des PBEC cryoconservés et les cultiver pour la culture sur des inserts
- Enduire une fiole de culture cellulaire T75 pendant la nuit de 10 mL de solution d’enrobage dans du PBS avec les couvercles bien fermés. Incuber la fiole dans un incubateur de culture cellulaire à 37 °C et 5 % de CO2.
- Avant de décongeler les PBEC cryoconservés, retirer la solution d’enrobage du ballon et la remplir de 10 ml de c-KSFM. Laisser chauffer à 37 °C dans un incubateur de culture cellulaire, avec des couvercles légèrement ouverts pour laisser entrer l’air de l’incubateur.
- Décongeler rapidement les cellules dans un bain d’eau ou de perles à 37 °C.
REMARQUE: Un bain de perles est préférable à un bain-marie en raison du risque de contamination plus faible et de la consommation d’énergie plus faible. - Ajouter le contenu complet du cryovial dans la fiole T75 préchauffée avec milieu (étape 3.2) et répartir uniformément les cellules.
REMARQUE: Ne centrifugez pas les cellules à ce stade, car elles ne survivront pas à l’étape de centrifugation. - Après environ 4 h, assurez-vous que les cellules sont suffisamment attachées. Remplacer le milieu par 10 ml de c-KSFM frais et chaud.
REMARQUE: De cette façon, le DMSO du milieu de congélation est retiré. Cette étape doit avoir lieu entre 4 h et 24 h après l’ensemencement des cellules dans la fiole. - Cultivez les cellules jusqu’à ce que la confluence soit atteinte de 80% à 90%, en changeant le milieu tous les lundis, mercredis et vendredis.
4. Mise en place d’une culture d’interface air-liquide avec les cellules épithéliales bronchiques primaires (ALI-PBEC)
NOTA : La procédure suivante s’applique à la culture de PEPE sur des inserts de diamètre intérieur de 11,9 mm.
- Enduire un nombre approprié d’inserts de culture cellulaire de 0,4 mL de solution d’enrobage par insert. Incuber pendant une nuit à 37 °C dans un incubateur de culture cellulaire.
- Préparer un milieu BD complet (milieu cBD), tel que décrit dans le tableau supplémentaire 1.
REMARQUE : Le milieu cBD est un milieu composite (voir le tableau supplémentaire 1) formulé pour soutenir la croissance des cellules épithéliales bronchiques pendant de plus longues périodes, tout en permettant leur différenciation après une augmentation de la concentration et de la culture d’acide rétinoïque (PR) (ou un analogue de la PR telle qu’utilisée dans le présent protocole) à l’ALI, comme indiqué à l’étape 4.10. - Trypsiniser les PEPE dans la fiole T75 en utilisant 2 mL de trypsine molle par fiole. Incuber les cellules pendant 5 à 10 minutes pour permettre aux cellules de se détacher (basé sur l’inspection visuelle). Après 5 min d’incubation, faciliter le détachement des cellules en faisant tourbillonner la trypsine dans la fiole et en tapotant doucement la fiole (répéter si nécessaire).
- Ajouter 4 mL de SBTI dans le ballon et transférer directement la suspension cellulaire dans un tube à centrifuger de 25 mL.
REMARQUE: Les cellules se rattachent en quelques minutes. Par conséquent, lors de l’utilisation de plusieurs fioles, la suspension cellulaire obtenue à l’étape 4.4 doit être directement transférée dans un tube à centrifuger avant d’être ajoutée au SBTI dans une deuxième fiole. Dans la procédure, un maximum de cinq flacons sont traités simultanément. - Centrifuger les tubes pendant 7 min à 230 x g à TA.
- Remettez les cellules en suspension dans 6 mL de milieu cBD et comptez les cellules à l’aide d’un hémocytomètre ou d’un compteur cellulaire automatisé. Effectuez un comptage de cellules vivantes / mortes, par exemple, en ajoutant du bleu de trypan dans un rapport de 1: 1, ou en utilisant une autre procédure de comptage de cellules vivantes / mortes.
- Retirez la solution d’enrobage des inserts de culture cellulaire.
- Diluer la suspension cellulaire, générée à l’étape 4.6, avec un milieu cBD complété par 1 nM EC 23 à une concentration de 80 000 cellules par mL, et ajouter 0,5 mL sur le dessus de la membrane dans l’insert. Ajouter 1,5 mL de milieu cBD complété par 1 nM EC 23 dans le puits situé sous l’insert.
- Changez le milieu avec un milieu cBD complété par 1 nM EC 23 trois fois par semaine jusqu’à ce que les cultures soient prêtes pour l’exposition à l’air (c.-à-d. 2 jours après que 100% de confluence est atteinte). Chaque fois, 0,5 mL du milieu est ajouté à l’intérieur de l’insert (sur les cellules) et 1,5 mL est ajouté au compartiment inférieur (le puits).
REMARQUE: En général, la couche cellulaire atteint 100% de confluence environ 5 jours après l’ensemencement des PBEC sur les inserts. Sur la base de l’inspection visuelle de la confluence des cellules, la décision est prise de transférer les cellules au stade ALI 2 jours plus tard. - Lorsque les cellules sont prêtes à être transférées dans l’ILA (c.-à-d. 2 jours après avoir atteint 100 % de confluence), retirez le milieu des inserts et du puits, n’ajoutez pas de nouveau milieu à l’intérieur de l’insert et ajoutez un nouveau milieu (1 mL de milieu cBD complété par 50 nM EC 23) uniquement dans le puits. Changez le milieu dans les puits trois fois par semaine.
- Pour éliminer l’excès de mucus et de débris cellulaires, ajouter doucement 200 μL de PBS chaud sur la face apicale de la couche cellulaire à l’intérieur de l’insert (de préférence par le côté de l’insert et non en pipetant directement sur les cellules) et incuber pendant 10 min dans un incubateur de culture cellulaire à 37 °C. Ensuite, aspirez le PBS pour éliminer l’excès de mucus et de débris cellulaires.
REMARQUE: À partir de ce moment (début de la culture ALI), avant de changer le milieu du compartiment inférieur, laver la face apicale des cellules avec du PBS à chaque fois. - Culture des cellules à l’ALI pendant au moins 2 semaines pour s’assurer que tous les principaux types de cellules sont représentés.
5. Établir une culture ALI-PBEC à partir d’une population de donneurs mixtes
- Utilisez des cellules provenant d’un maximum de cinq donneurs individuels pour commencer des cultures PBEC à partir d’une population mixte.
- Mélanger un nombre égal de cellules par donneur en utilisant les cellules générées à l’étape 4.7 pour atteindre un total de 150 000 cellules par insert (c.-à-d. 30 000 cellules par donneur lorsque vous utilisez cinq donneurs). Cela permettra de s’assurer que la prolifération dans l’insert est réduite au minimum et qu’un nombre égal de cellules provenant des donneurs individuels sont présentes dans la culture.
- Poursuivre la culture ALI-PBEC telle que décrite aux étapes 4.9-4.12.
6. Contrôle de la qualité de la culture ALI-PBEC
- Surveillance de la résistance électrique transépithéliale (TEER) pendant la culture cellulaire
REMARQUE: La mesure de la résistance électrique, basée sur l’utilisation d’un voltohmmètre, peut être effectuée à tout moment pendant la culture ALI-PBEC et est effectuée à chaque fois selon le même protocole dans les mêmes conditions, car la mesure de la résistance électrique est influencée par diverses variables, y compris la position de l’électrode, la température, le milieu et la manipulation. TEER peut être calculé en utilisant la résistance électrique mesurée en appliquant la formule suivante basée sur la loi d’Ohm: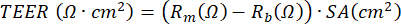 , dans laquelle Rm est la résistance électrique mesurée, Rb est la résistance électrique de base d’un insert sans revêtement ni cellules, et SA est la surface de la membrane de l’insert17.
, dans laquelle Rm est la résistance électrique mesurée, Rb est la résistance électrique de base d’un insert sans revêtement ni cellules, et SA est la surface de la membrane de l’insert17.- Ajouter doucement 200 μL de PBS chaud sur le côté apical de la couche cellulaire pour éliminer le mucus et les débris sur les cellules. Incuber l’insert pendant 10 min dans un incubateur de culture cellulaire à 37 °C et retirer à nouveau le PBS.
- Ajouter doucement 700 μL de PBS chaud sur la face apicale de la couche cellulaire et incuber l’insert pendant 10 min à TA pour permettre la stabilisation de la température pour les mesures.
- Calibrez le voltohmmètre à l’aide de la résistance de test de 1 000 Ω, réglez le voltohmmètre pour mesurer les Ohms et utilisez un tournevis pour régler la vis d’étalonnage « R ADJ » jusqu’à ce qu’elle soit réglée sur 1 000 Ω.
- Rincez l’électrode en la déplaçant de haut en bas plusieurs fois dans de l’eau stérile (RT), puis dans du PBS stérile (RT).
- Mesurer la résistance électrique de la couche cellulaire dans les inserts. À cette fin, placez l’électrode en position verticale dans le puits, le long bras de l’électrode touchant le fond de la plaque. De cette façon, le bras court est au-dessus de la couche de cellule à l’intérieur de l’insert. Lisez la valeur affichée sur le voltohmmètre.
Remarque : La valeur affichée ne se stabilisera pas complètement ; Lire la valeur au moment où la valeur est intermittente. - Entre les mesures, nettoyez l’électrode en la déplaçant de haut en bas plusieurs fois dans du PBS (RT) stérile.
- Nettoyez l’électrode lorsque les mesures sont terminées en la déplaçant de haut en bas plusieurs fois dans de l’eau stérile (RT), du PBS stérile (RT) et de l’éthanol à 70% (RT). Conservez l’électrode au sec.
- Effectuer une mesure de base d’un insert (sans revêtement) et de cellules en ajoutant 700 μL de PBS chaud à l’intérieur de l’insert et 1 mL de PBS chaud au puits et en mesurant la résistance électrique à côté des autres inserts.
- Evaluer la composition cellulaire de la culture ALI-PBEC
- Au cours de l’étape ALI, vérifiez la différenciation en évaluant visuellement les cils battants. Ceux-ci peuvent être observés par microscopie à fond clair standard dès 9 jours après l’exposition à l’air du côté apical des cellules.
REMARQUE: Les cils battus sont mieux visibles directement après le lavage de la surface apicale. Les cellules caliciformes produisent du mucus et, par conséquent, la présence de mucus, observée lors du lavage de la surface apicale, est un signe que des cellules caliciformes se forment. Cependant, le niveau de cellules caliciformes et la quantité de mucus produite dépendent fortement du donneur. La présence de mucus peut être observée lors de l’aspiration du PBS après avoir lavé la surface apicale de la couche cellulaire dans l’insert; dans ce cas, le PBS aspiré est plus visqueux et des fils de mucus peuvent être observés lors de l’aspiration. - L’évaluation de la composition cellulaire à l’aide d’immunocolorations et de microscopie fluorescente ou de tri cellulaire activé par fluorescence (FACS), ou d’analyse de l’expression génique par réaction en chaîne de la polymérase quantitative en temps réel (RT-qPCR) fournit des informations importantes sur l’état de différenciation de la culture, mais sa description dépasse le cadre de cette contribution.
- Au cours de l’étape ALI, vérifiez la différenciation en évaluant visuellement les cils battants. Ceux-ci peuvent être observés par microscopie à fond clair standard dès 9 jours après l’exposition à l’air du côté apical des cellules.
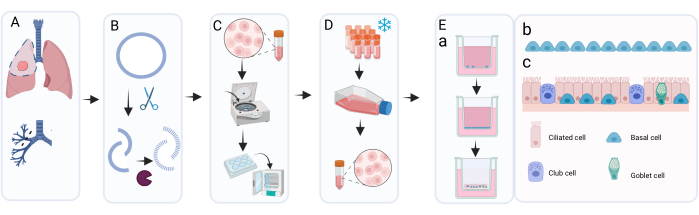
Figure 1 : Vue d’ensemble schématique de la procédure d’isolement, d’expansion et de culture des cellules épithéliales bronchiques primaires. (A) Le tissu pulmonaire est obtenu lors de la chirurgie de résection du cancer et le pathologiste excise le tissu de l’anneau bronchique qui est macroscopiquement normal et exempt de tumeur. (B) L’anneau bronchique est nettoyé et exposé à un traitement enzymatique pour détacher et dissocier la couche cellulaire. (C) La suspension de cellules récupérées est lavée et les cellules sont réparties dans des puits d’une plaque de 6 puits pour l’expansion. (D) Lors d’une expansion suffisante des cellules isolées dans le c-KSFM avec Primocin, les couches cellulaires sont dissociées par trypsinisation et les cellules sont remises en suspension dans un milieu de congélation pour la cryoconservation. Au besoin, les cellules cryoconservées sont décongelées et à nouveau expansées à l’aide de c-KSFM avec de la pénicilline / streptomycine dans des flacons de culture cellulaire. Après expansion, ils sont ensemencés en milieu cBD sur des inserts de culture cellulaire; (e bis) La culture ALI-PBEC se déroule en deux étapes principales: le stade immergé en milieu cBD complété par 1 nM EC 23 jusqu’à ce que les cellules atteignent la confluence complète, suivi de l’élimination du milieu apical et de la culture à l’ALI pour permettre la différenciation; dans cette phase ALI, les cellules sont cultivées en milieu cBD supplémenté en 50 nM EC 23. (eb) Représentation graphique des cellules basales qui recouvrent l’insert pendant la culture immergée. (e quater) Représentation graphique de la couche cellulaire épithéliale différenciée obtenue après culture à l’ALI en présence de concentrations accrues de EC 23. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Expansion utilisant la culture immergée
En utilisant la méthode présentée ici, une moyenne de huit cryovials avec 400 000 cellules/cryovial peut être obtenue à partir d’une plaque de 6 puits pour un stockage à long terme dans l’azote liquide (Figure 2A). Pour ce faire, des PBEC isolés sont cultivés en plaques à 6 puits pendant un minimum de 7 jours et un maximum de 14 jours (Figure 2B) en présence de Primocin pour exclure toute contamination microbienne (en particulier mycoplasmique). La figure 2A,B donne un aperçu du nombre de cellules obtenues et du temps de culture requis parmi différents isolements de divers donneurs. Avant de récolter les cellules par trypsinisation pour les stocker dans de l’azote liquide, la confluence doit être supérieure à 80%. Si cela n’est pas réalisé dans les 14 jours, les cellules ne doivent pas être cryoconservées. Il est important de noter que lors de la récolte pour le stockage et le passage, la confluence de la couche cellulaire ne doit pas dépasser ~95% (Figure 2C). Après stockage dans de l’azote liquide, les cellules peuvent être décongelées et cultivées pour l’expansion jusqu’à ce qu’un nombre suffisant de cellules soit obtenu pour les cultures ALI. Le milieu utilisé pour l’expansion des cellules à ce stade est c-KSFM, similaire à la culture initiale suivant la récolte de l’anneau bronchique18. Primocin n’est cependant pas nécessaire à ce stade, car le risque de contamination microbienne supplémentaire provenant du tissu pulmonaire est absent, et donc Primocin peut être changé pour la pénicilline / streptomycine. Ce milieu favorise les cellules épithéliales par rapport aux fibroblastes et empêche donc une éventuelle prolifération de la culture par prolifération plus rapide des fibroblastes 19,20,21. En utilisant le milieu c-KSFM, les cellules sont réparties dans le flacon et ne se connectent pas les unes aux autres, ce qui est nettement différent de la morphologie des cellules en culture immergées à ce stade dans le milieu cBD (Figure 2D,E). Après 5 ou 6 jours de culture des cellules décongelées dans un flacon T75, la couche cellulaire doit être confluente à 80 % à 95 %, ce qui se traduit par environ 3 x 106 cellules au total (figure 2F). À partir de là, environ 75 inserts (taille de plaque de 12 puits) peuvent être générés pour la culture ALI.
La méthode d’isolement et de culture décrite dans cette contribution peut également être adaptée pour être utilisée avec des biopsies bronchiques ou des brosses bronchiques comme matière première.
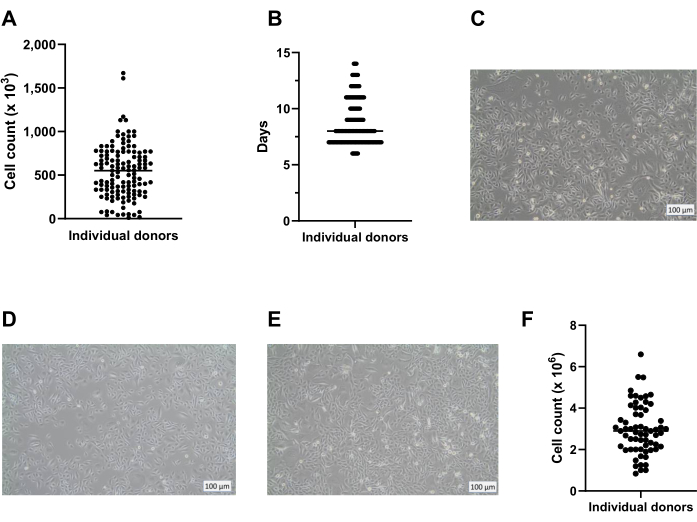
Figure 2 : Expansion des cellules basales avant et après cryoconservation. Les cellules ont été isolées selon le protocole décrit et cultivées à l’aide de c-KSFM. Le nombre de cellules générées par donneur a été surveillé, le comptage des cellules vivantes a été effectué à l’aide d’un compteur de cellules automatisé (A) lors de la récolte des cellules de passage 0 (P0) des plaques à 6 puits (étape 2 du protocole), n = 123 donneurs, le nombre de cellules a été présenté comme le nombre de cellules récoltées par puits; Chaque point représente un donneur et la médiane est indiquée par une barre horizontale. (B) Dans le cadre du contrôle de la qualité, le temps nécessaire aux cellules P0 pour atteindre une confluence de 80 % à 90 % dans les plaques à 6 puits a été surveillé et indiqué en jours après le début de la culture immergée dans c-KSFM (n = 127 donneurs différents). Chaque donateur individuel est indiqué par un point, tous les points appartenant à 1 jour fusionnent en une ligne; plus la ligne de démarcation est large, plus il représente de donateurs; Le nombre médian de jours pendant lesquels les cellules sont en culture est indiqué par une barre horizontale plus fine. (C) Image représentative en fond clair de cellules P0 cultivées immergées dans c-KSFM au moment où les cellules ont été récoltées pour la cryoconservation à long terme. (D) Image représentative en fond clair des cellules P1 cultivées immergées dans c-KSFM au moment où les cellules ont été récoltées et transférées dans des inserts et (E) cellules P1 cultivées immergées dans un milieu cBD. F) Le nombre de cellules vivantes produites par donneur a été surveillé à l’aide d’un compteur de cellules automatisé lors du prélèvement de cellules P1 dans le ballon T75 (section 4 du protocole), n = 63 donneurs différents; le nombre de cellules est présenté comme le nombre de cellules par fiole T75, chaque donneur est indiqué par un point et le nombre médian de cellules est indiqué par une barre horizontale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Culture d’interface air-liquide (ALI)
7 jours après le début de la culture ALI, la résistance électrique de la couche cellulaire est mesurée et doit être supérieure à 300 Ω (Figure 3A); Si cela n’est pas réalisé, la culture est considérée comme un échec en raison d’un éventuel manque de formation de jonctions serrées. Il est recommandé d’exclure la possibilité d’obtenir de faibles valeurs TEER causées par des dommages à la couche épithéliale dans des inserts individuels résultant, par exemple, d’endommagements de la couche cellulaire pendant le lavage et l’aspiration. Cela peut être vérifié par une inspection microscopique visuelle des inserts de culture. D’après notre expérience, la variabilité inter-donneurs de la résistance électrique peut être significative (Figure 3B), qui est également rapportée dans la littérature14, et comme observé est également nettement influencée par l’origine du milieu aigle modifié (DMEM) de Dulbecco utilisé (Figure 3C).
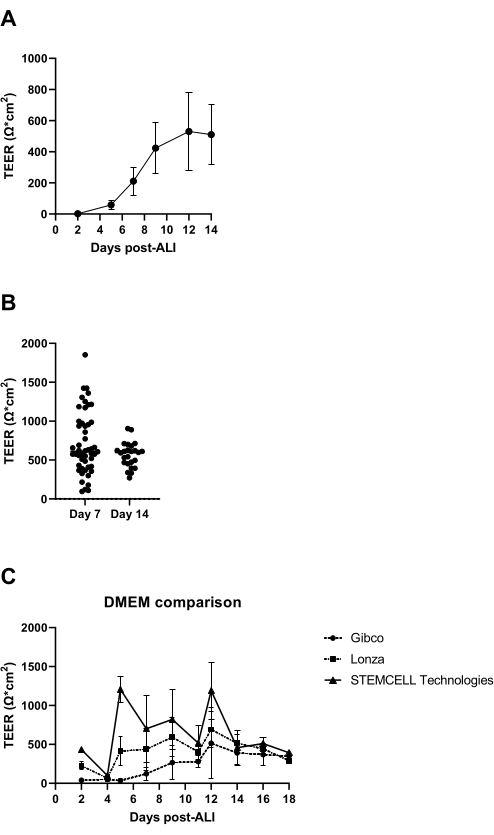
Figure 3 : Résistance électrique transépithéliale comme contrôle de qualité des cultures ALI-PBEC. Les PEPE ont été isolées et élargies, et des cultures ALI-PBEC bien différenciées ont été établies. À plusieurs moments de la culture, la résistance électrique a été mesurée, puis le TEER a été calculé (Ω·cm2). (A) La résistance électrique a été mesurée au cours des 14 jours suivant l’ALI. n = 4 donneurs différents. Les données sont représentées comme la valeur moyenne ±écart type (ET). (B) Dans le cadre du contrôle de la qualité de la culture cellulaire ALI-PBEC, la résistance électrique a été mesurée au jour 7 (n = 50) et au jour 14 après l’ALI (n = 25); chaque point représente un donneur et le TEER médian (Ω·cm2) est indiqué par une barre horizontale. La signification des données a été testée à l’aide d’un test de Mann-Whitney non paramétrique, et aucune différence significative n’a été trouvée. (C) Les milieux de trois fournisseurs différents de DMEM ont été testés pour évaluer l’influence sur la formation de TEER. n = 4 donneurs différents; Les valeurs moyennes sont représentées ± écart-type. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tout en établissant une culture ALI-PBEC bien différenciée, dès le début de l’exposition à l’air, la concentration de PR augmente22. De cette façon, les cellules passent de la prolifération à la différenciation mucociliaire, qui est visible dès 9 jours (dépendante du donneur) après l’exposition à l’air à l’aide de la microscopie à fond clair. Le mouvement des premiers cils est visible à ce stade, et un peu plus tôt lorsqu’il est basé sur l’expression génique de marqueurs de cellules luminales différenciées23 (Figure 4).
Comme décrit dans le protocole, la production de mucus peut également être observée lors du rinçage de la surface apicale pendant le changement de milieu. La PR est très sensible à la lumière, ce qui entraîne une activité très variable à la même concentration de stock. Pour cette raison, la PR est remplacée par l’analogue synthétique de la PR EC 23 et utilisée à la même concentration, avec des résultats similaires à ceux déterminés expérimentalement. Pour cette raison et pour éviter de modifier la procédure, la concentration EC 23 sélectionnée a été maintenue égale à la concentration RA (c’est-à-dire 50 nM) précédemment utilisée24,25 (figure 5). La figure 5A illustre les valeurs TEER obtenues en utilisant différentes concentrations de EC 23, montrant une TEER maximale à 50 nM dans cette plage de concentrations testées. Les résultats présentés à la figure 5B confirment que l’expression génique des marqueurs des cellules ciliées et caliciformes est similaire lors de l’utilisation de 50 nM EC 23 ou RA. EC 23 est également nécessaire pendant la culture au stade immergé (bien qu’à une concentration beaucoup plus faible), car l’omettre à ce stade submergé et ne l’ajouter qu’au stade ALI donne une culture qui n’atteint jamais sa pleine confluence. Le temps nécessaire pour générer une culture ALI-PBEC bien différenciée avec une activité visible de battement ciliaire et une production de mucus est d’environ 14 jours, et la plupart des expériences sont donc initiées entre 14 et 21 jours de cultures ALI (Figure 4). Tous les principaux types de cellules (cellules basales, ciliées, gobelets et massues) sont observés après 14 jours de culture ALI, bien que les niveaux d’expression dépendent fortement du donneur. Ceci est démontré en évaluant l’expression génique de TP63, FOXJ1, MUC5AC et SCGB1A1 par RT-qPCR, ou l’expression des protéines à l’aide d’anticorps dirigés contre p63, α-tubuline, Muc5AC et CC-16 par coloration par fluorescence immunitaire (IF), afin de détecter des marqueurs pour les cellules basales, ciliées, gobelet et massues, respectivement25,26. Cependant, alors que 14 à 21 jours peuvent être considérés comme une règle empirique pour la plupart des expériences, pour certaines expériences, une durée de différenciation plus longue peut être envisagée, comme on l’a constaté pour le métabolisme xénobiotique, l’infection par le SRAS-CoV-2 et l’évaluation de la clairance mucociliaire27,28,29.
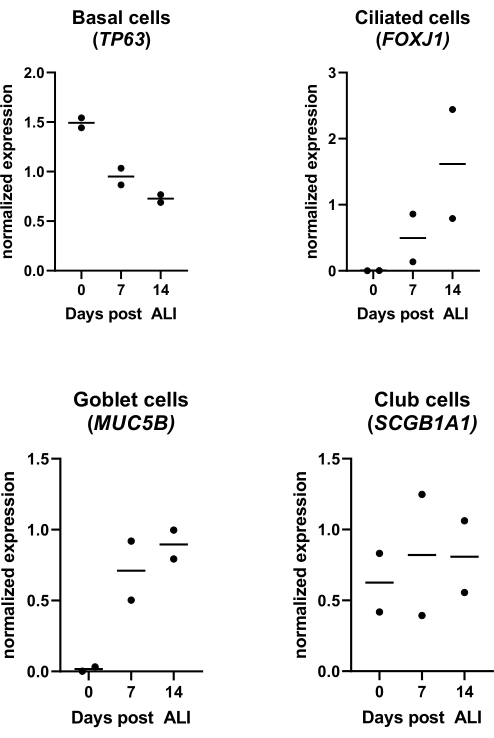
Figure 4 : Culture de l’interface air-liquide (ALI). Les PEPE ont été isolées et élargies, et des cultures ALI-PBEC bien différenciées ont été établies. Les cultures de l’ALI-PBEC ont été surveillées au cours des 14 jours suivant l’ALI. Des cultures cellulaires ont été lysées pour l’isolement de l’ARN aux jours 0, 7 et 14 post-ALI. Les données de deux donneurs différents sont affichées, chaque point représente un donneur individuel surveillé au fil du temps et la médiane est indiquée par une barre horizontale. L’expression génique des marqueurs basaux, ciliés, gobelets et de cellules de club (TP63, FOXJ1, MUC5B et SCGB1A1, respectivement) a été mesurée par qPCR et normalisée pour l’expression des gènes RPL13A et ATP5B (voir référence 23 pour plus de détails). Veuillez cliquer ici pour voir une version agrandie de cette figure.
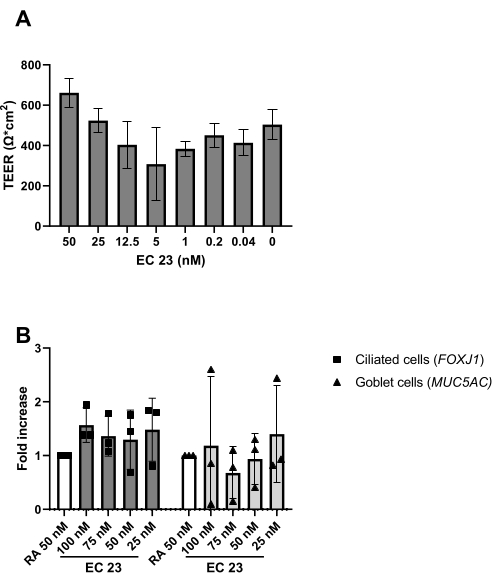
Figure 5: Comparaison de l’acide rétinoïque (RA) et de son analogue synthétique EC 23. Les PEPE ont été isolées et élargies, et des cultures ALI-PBEC bien différenciées ont été établies. Au début de l’exposition à l’air des cultures PBEC, le PR (50 nM) a été remplacé par diverses concentrations de EC 23. (A ) La résistance électrique a été mesurée au jour 14 après l’ALI, puis le TEER a été calculé (Ω·cm 2), n =2 donneurs, les barres représentent la valeur moyenne ± écart-type. ( B ) Au jour 14 post-ALI, des cultures cellulaires ont été lysées pour l’isolement de l’ARN et l’analyse ultérieure de l’expression génique des marqueurs cellulaires pour les cellules ciliées et caliciformes respectivement (FOXJ1, MUC5AC) en utilisant qPCR, et normalisé pour la RPL13A (n = 3 donneurs). Une augmentation de pli est montrée par rapport à ALI-PBEC cultivé avec 50 nM RA et représenté comme la valeur moyenne ± écart-type. (Voir référence 23 pour plus de détails) Veuillez cliquer ici pour voir une version agrandie de cette figure.
Au cours des dernières années, la performance des produits alternatifs dans le système de culture a été examinée, tels que les milieux et les plastiques de culture. Diverses raisons justifiaient ces évaluations, notamment les changements dans la composition des milieux par les fabricants, l’introduction de nouveaux médias, ainsi qu’une pénurie de produits pendant la pandémie de COVID-19 (2020-2022). On a observé que des produits similaires provenant de différents fournisseurs donnent lieu à des cultures de cellules épithéliales différenciées sur la base de l’évaluation des marqueurs des types de cellules épithéliales, bien que la composition cellulaire finale puisse varier considérablement (figure 6A), alors que les différences dans le TEER étaient moins prononcées (figure 6B). D’autre part, le milieu de différents fournisseurs a entraîné des différences substantielles dans la composition cellulaire; lors de l’utilisation d’inserts de différentes marques, ces différences étaient limitées (figure 6C). En particulier, lors de l’utilisation du milieu de culture de cellules épithéliales des voies respiratoires PneumaCult de STEMCELL Technologies, une morphologie différente et une formation plus rapide de l’activité ciliaire visible ont été observées. Outre ces observations, une différence dans les valeurs TEER et une différence dans la composition cellulaire de l’ALI-PBEC par rapport au milieu cBD ont également été notées (Figure 6D).
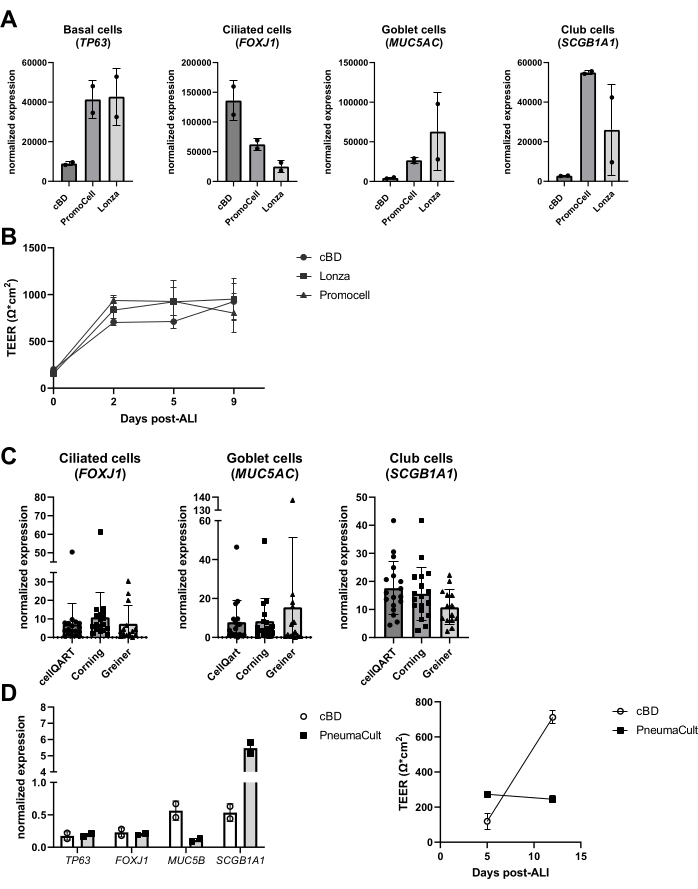
Figure 6 : Comparaison de différents fournisseurs de milieu cellulaire épithélial et d’inserts de culture cellulaire. Les CEPP ont été isolées, élargies et des cultures ALI-PBEC bien différenciées ont été établies. (A) Les ALI-PBEC ont été cultivés pendant 14 jours, puis les couches cellulaires ont été lysées pour l’isolement de l’ARN. L’expression génique des marqueurs basaux, ciliés, gobelet et de cellules bots (TP63, FOXJ1, MUC5AC et SCGB1A1, respectivement) a été mesurée par qPCR et normalisée pour RPL13A et ATP5B. n = 2 donateurs; les barres représentent la valeur moyenne ± écart-type. (B) Au cours des 9 jours suivant l’ALI, la résistance électrique a été mesurée et le TEER a ensuite été calculé (Ω·cm2). n = 3 donneurs différents; Les valeurs moyennes sont représentées ± écart-type. (C) Les ALI-PBEC ont été cultivés pendant 14 jours à l’aide d’inserts de culture cellulaire achetés auprès de trois fournisseurs différents, puis les couches cellulaires ont été lysées pour l’isolement de l’ARN. L’expression génique des marqueurs ciliés, gobelets et de cellules de club (FOXJ1, MUC5AC et SCGB1A1, respectivement) a été mesurée par qPCR et normalisée pour RPL13A. n = 18 donneurs différents, les barres représentent la valeur moyenne ± écart-type. Les données ont été testées pour la signification à l’aide d’un test de Kruskal-Wallis non paramétrique ANOVA unidirectionnel et aucune différence significative n’a été trouvée. (D) Les ALI-PBEC ont été cultivés soit en milieu cBD, soit en milieu PneumaCult (technologies STEMMCELL) pendant 14 jours après l’ALI, puis les couches cellulaires ont été lysées pour l’isolement de l’ARN. L’expression génique des marqueurs basaux, ciliés, gobelet et de cellules de club (TP63, FOXJ1, MUC5B et SCGB1A1, respectivement) a été mesurée par qPCR et normalisée pour RPL13A (les barres représentent la valeur moyenne ± écart-type), et la résistance électrique a été mesurée aux jours 5 et 12 post-ALI et utilisée pour calculer le TEER (Ω·cm2). n = 2; la valeur moyenne est représentée ± ET (voir la référence 23 pour plus de détails). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau supplémentaire 1 : Composition des solutions et des milieux utilisés dans le protocole. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le protocole présenté ici décrit l’isolement de cellules épithéliales bronchiques humaines à partir de tissu pulmonaire réséqué, une méthode pour l’expansion optimale des cellules sans perte de potentiel de différenciation, une procédure de cryoconservation et une procédure pour générer des cultures ALI-PBEC bien différenciées. En outre, une description du contrôle de la qualité est fournie, ainsi que des instructions pour le suivi et l’évaluation des ALI-PBEC différenciées.
Le protocole décrit commence par un anneau bronchique macroscopiquement normal, exempt de tumeur, qui est réséqué à partir d’un lobe pulmonaire de patients subissant une intervention chirurgicale liée à leur diagnostic de cancer du poumon. Il convient donc de noter que ces anneaux ne peuvent strictement pas être considérés comme des tissus sains, ce qui peut donc affecter les caractéristiques de la culture cellulaire. Les sources alternatives pour obtenir des cellules épithéliales bronchiques comprennent l’utilisation de biopsies bronchiques, de brossages bronchiques ou de tissus provenant de poumons de donneurs ou de receveurs de greffe. Quelle que soit la source, lors de l’utilisation de tissu pulmonaire, un risque de contamination microbienne doit être pris en compte et, par conséquent, des antibiotiques sont utilisés dans les différents milieux de culture pour réduire le risque de contamination microbienne de la culture cellulaire. En particulier, les mycoplasmes présentent un risque élevé et courant en culture cellulaire, en raison de sa grande variété d’effets sur la culture cellulaire, de sa résistance aux antibiotiques couramment utilisés en culture cellulaire et du fait que la contamination par les mycoplasmes ne peut être confirmée que par des tests de détection des mycoplasmes. Par conséquent, au stade initial de la culture cellulaire après l’isolement des cellules du tissu pulmonaire, la formulation antimicrobienne à large spectre Primocin est utilisée et, au cours du processus de culture, des échantillons sélectionnés au hasard sont testés pour détecter la présence de mycoplasmes.
La procédure d’isolement commençant par un anneau bronchique fournit suffisamment de matériel de départ pour permettre le degré d’expansion de ces cellules primaires nécessaire pour démarrer les cultures à l’ALI sans compromettre la capacité de différenciation. Cependant, le démarrage de l’expansion des cellules épithéliales isolées avec un nombre limité de cellules peut poser des problèmes pour obtenir un nombre suffisant d’inserts avec suffisamment de cellules pouvant être ensemencées pour la culture ALI. Une culture prolongée et le passage répété de cellules primaires peuvent entraîner une sénescence réplicative. Diverses solutions ont été proposées pour surmonter cette limitation. Horani et al. ont montré que l’inhibiteur de la Rhokinase (ROCK) Y-27632 augmentait la prolifération des cellules basales30, Mou et al. ont utilisé une double inhibition de Smad pour développer les cellules souches basales tout en maintenant les caractéristiques de la couche de cellules épithéliales différenciées 31, et Sachs et al. ont développé un système organoïde des voies respiratoires qui peut être utilisé pour dilater les cellules épithéliales des voies respiratoires et maintenir leur potentiel de différenciation au cours de multiples passages32. Cette dernière méthode a également été utilisée pour développer les cellules à partir de sources à très faible nombre de cellules, telles que les aspirations trachéales (AT) de nouveau-nés prématurés (âge de gestation <28 semaines) et le liquide de lavage broncho-alvéolaire (BAL), avant transfert vers la culture ALI comme décrit ici33. Il a été constaté que les cellules isolées de BAL et TA présentaient une capacité de différenciation similaire aux cellules générées à partir du tissu bronchique, bien que des différences aient été observées lorsque la différenciation était biaisée vers des cultures contenant plus de cellules calicinées ou plus caliciformes utilisant l’inhibition de la signalisation Notch ou la cytokine Th2 IL-1333. Il est donc recommandé, si les ALI-PBEC sont cultivés à partir d’une matière première avec un faible nombre de cellules épithéliales en utilisant des approches similaires, de toujours vérifier les cultures pour les critères de qualité de base, comme indiqué à la section 6 du protocole. Il est important de noter que l’utilisation de cellules nourricières peut également aider à obtenir un plus grand nombre de cellules, ce qui est essentiel dans un contexte d’ingénierie d’échafaudage transplantable où le temps et le nombre de cellules sont essentiels. Ceci est illustré par une étude dans laquelle des cellules épithéliales autologues ont été cultivées à partir de biopsies dérivées d’un patient atteint d’une maladie trachéale et les cellules ont été rapidement dilatées en présence d’une couche nourricière embryonnaire murine (fibroblastes 3T3-J2 inactivés mitotiquement) et de l’inhibiteur susmentionné de la voie Rho/ROCK (Y-27632)34. La culture cellulaire résultante s’est avérée utile pour le repeuplement des échafaudages trachéaux, et cela pourrait donc être considéré comme un protocole approprié pour un modèle de transplantation.
Lors de l’utilisation du protocole décrit dans cette contribution, mais aussi lors de l’utilisation d’autres protocoles de culture, inévitablement un biais de sélection est introduit. Il est important de réaliser que les différences dans les détails du protocole, tels que l’origine des cellules utilisées pour initier les cultures, la composition du milieu et d’autres détails du protocole, peuvent entraîner des changements dans la composition cellulaire des cultures et, par conséquent, des changements dans la réponse de la culture ALI33,35. En outre, des différences dans les propriétés cellulaires ont également été observées lors de la comparaison de différents milieux pour différencier les cellules des voies respiratoires10,11. En comparant PneumaCult et le milieu cBD, des différences ont été observées dans les marqueurs d’ARNm des cellules caliciformes et des cellules club, les valeurs TEER et l’épaisseur de la couche cellulaire. Sur la base de ces observations, malgré l’absence de fondement statistique, en raison du faible nombre de donneurs utilisés, de la composition du milieu est inconnue des clients et des coûts plus élevés du milieu PneumaCult, la décision a été prise dans notre laboratoire d’utiliser le milieu cBD.
Comme nous l’avons vu, les cellules peuvent être initialement étendues à l’aide d’une culture organoïde, puis transférées dans le système d’insertion ALI 2D. Ceci est important, car les organoïdes épithéliaux des voies respiratoires ne conviennent pas à l’exposition à des substances en suspension dans l’air, alors que l’utilisation du système ALI 2D permet d’évaluer l’impact de substances en suspension dans l’air telles que la fumée de cigarette23,36 sur les cellules épithéliales des voies respiratoires en culture. Une approche différente pour établir des cultures de cellules épithéliales des voies respiratoires ALI consiste à générer des cellules épithéliales des voies respiratoires par la différenciation des cellules souches pluripotentes humaines (CSPhi)37. Dans de tels protocoles, au stade final du protocole de différenciation après différenciation en progéniteurs proximaux des voies respiratoires, les cellules peuvent être différenciées par culture à l’ALI en utilisant des procédures similaires à celles décrites ici.
Dans le protocole actuel, le milieu cBD est utilisé pour la culture à l’ALI. Le milieu cBD est un milieu sans sérum qui est préparé en ajoutant un mélange de différents suppléments, inspiré de Fulcher et al.38 ainsi que d’autres études. La solution de supplément contient 52 μg/mL d’extrait hypophysaire bovin (BPE), 0,5 μg/mL d’hydrocortisone, 0,5 ng/mL d’EGF humain, 0,5 μg/mL d’épinéphrine, 10 μg/mL de transferrine, 5 μg/mL d’insuline, 6,5 ng/mL de triiodothyronine et 0,1 ng/mL d’AR39. Étant donné que le BPE est un extrait de tissu et qu’il est soumis à des variations par lots, le milieu ne peut pas être considéré comme un milieu entièrement défini, ni exempt d’animaux. Un milieu de culture cellulaire entièrement défini est préférable pour minimiser les différences entre les lots. Compte tenu de la transition vers une recherche sans animaux, il est important que des efforts soient faits pour produire des milieux définis qui ne contiennent pas de produits animaux et qui sont abordables pour la communauté scientifique.
Diverses configurations expérimentales peuvent être utilisées sur la base du modèle ALI, en fonction de la question de recherche. Par exemple, pour étudier l’impact des composés qui peuvent influencer le processus de différenciation, cela peut être abordé en ajoutant les composés à la culture pendant les différentes étapes de la culture immergée, pendant la différenciation ou au stade bien différencié. La composition cellulaire de la culture ALI-PBEC peut être influencée par l’ajout de composés spécifiques; par exemple, la différenciation des ALI-PBEC en présence d’IL-13 génère une culture avec plus de cellules caliciformes et moins de cellules ciliées, tandis que le traitement avec l’inhibiteur de la γ-sécrétase DAPT (utilisé pour bloquer la signalisation Notch) pendant la différenciation aboutit à une culture avec plus de cellules ciliées au détriment des cellules caliciformes 23,40,41,42.
De plus, les agents pour stimuler les cellules ou bloquer certains processus peuvent être appliqués soit sur le compartiment basal, soit (dans un très petit volume) sur le compartiment apical de la culture. Les cellules peuvent également être exposées à des substances en suspension dans l’air du côté apical. De tels modèles d’exposition ont été utilisés pour étudier l’effet des gaz d’échappement des moteurs diesel ou de la fumée de cigarette entière sur les CSPE23,43,44. Le milieu peut être récolté chaque fois qu’il est modifié pour surveiller les protéines sécrétées du côté basal; il en va de même pour la face apicale des cellules qui est lavée avec du PBS tout en rafraîchissant le milieu basal. Le soi-disant lavage apical est récolté et le dithioérythritol facultatif (DTE) est ajouté pour dissocier plus efficacement le mucus produit par les cellules caliciformes. Les lysats cellulaires peuvent être obtenus pour isoler la protéine totale, l’ARN et l’ADN chromosomique et mitochondrial. Les cellules peuvent être étudiées plus avant à l’aide d’anticorps pour marqueurs spécifiques, en coupant la membrane de polyéthylène téréphtalate (PET) de l’insert en plastique et en coupant davantage cette membrane en morceaux plus petits pour de multiples colorations par immunofluorescence45. En outre, la cytométrie de flux ou FACS peut également être utilisée après trypsinisation des cellules dans les inserts. Au cours de la phase ALI, le développement de la barrière cellulaire peut être surveillé en mesurant la résistance électrique et en calculant ensuite le TEER, où la résistance électrique est inversement proportionnelle à la surface de l’insert membranaire. Le calcul est basé sur la loi d’Ohm en utilisant la formule suivante: 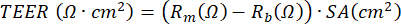 , dans laquelle Rm est la résistance électrique mesurée, Rb est la résistance électrique de base d’un insert sans revêtement ni cellules, et SA est la surface de la membrane de l’insert. La mesure de la résistance électrique à l’aide d’électrodes EVOM2 et STX/baguettes est simple, mais dépend fortement des procédures de manipulation lors de son introduction dans le puits. En outre, il a été suggéré que la forme de l’électrode affecte la mesure de la fonction barrière de la surface relativement grande17.
, dans laquelle Rm est la résistance électrique mesurée, Rb est la résistance électrique de base d’un insert sans revêtement ni cellules, et SA est la surface de la membrane de l’insert. La mesure de la résistance électrique à l’aide d’électrodes EVOM2 et STX/baguettes est simple, mais dépend fortement des procédures de manipulation lors de son introduction dans le puits. En outre, il a été suggéré que la forme de l’électrode affecte la mesure de la fonction barrière de la surface relativement grande17.
L’amélioration du système de culture cellulaire ALI, visant à accroître la représentation précise des tissus, comprend la coculture de types cellulaires supplémentaires tels que les leucocytes, les fibroblastes ou les cellules endothéliales46,47,48. Il a été observé que la co-culture d’ALI-PBEC avec le facteur de stimulation des colonies de granulocytes-macrophages (GM-CSF) ou les macrophages différenciés M-CSF affecte nettement les réponses épithéliales innées et la réparation48. Il est important de noter que dans de tels modèles de coculture, la compatibilité des supports peut être un problème. Étant donné que le milieu utilisé pour la culture de cellules épithéliales des voies respiratoires est développé spécifiquement pour les CSPE et peut ne pas être adapté de manière optimale à d’autres types de cellules, une optimisation est nécessaire. Un autre type de progrès observé dans le domaine de la biologie des voies respiratoires pour lequel des PBEC isolés peuvent être utilisés est l’utilisation de la technologie des organes sur puce (OoC) 49,50. En utilisant cette technologie, l’influence des forces mécaniques de la respiration et du flux sanguin, telles que l’étirement, l’air et le débit moyen, peut être étudiée 29.
La variabilité entre donneurs peut être importante lors de l’utilisation de CSPE de divers donneurs, et il est donc important d’envisager l’utilisation de cellules de plusieurs donneurs pour tenir compte de cette variabilité dans les études de culture de cellules épithéliales. Étant donné que la culture des ALI-PBEC prend beaucoup de temps et entraîne des coûts considérables, la possibilité d’établir des cultures ALI-PBEC en mélangeant des cellules de différents donneurs dans un seul encart de culture cellulaire est examinée. De cette façon, des expériences pilotes peuvent être facilement réalisées à l’aide de cellules primaires, avant d’analyser les réponses de cultures dérivées de divers donneurs individuels. De plus, les donneurs ayant des caractéristiques différentes (p. ex. catégorie d’âge ou sexe différent) peuvent être regroupés pour des études exploratoires. Lors de l’utilisation de mélanges de donneurs, il est important de s’assurer qu’un nombre égal de cellules de donneurs différents est présent, afin d’éviter la possibilité qu’un donneur domine les résultats en raison d’un taux de prolifération plus élevé. Par conséquent, les cellules provenant de donneurs individuels sont développées séparément et ensemencées à une densité plus élevée dans l’insert par rapport aux cellules d’ensemencement d’un donneur individuel, afin de minimiser la prolifération dans l’insert avant la transition vers la LAI. Les réponses des mélanges de donneurs et des donneurs individuels correspondants ont été comparées en étudiant la cinétique d’infection du SRAS-CoV-2. En utilisant la RT-qPCR et la coloration par immunofluorescence, il a été observé que le mélange de donneurs fournissait une bonne représentation des différents donneurs individuels, en montrant un nombre similaire de particules virales produites et un nombre similaire de cellules infectées28.
Pour devenir une alternative acceptable pour les modèles animaux, l’édition de gènes de cellules épithéliales bronchiques en culture devrait être réalisable51. La technologie d’interférence ARN par l’utilisation de petits ARN interférents (siRNA) dans les ALI-PBEC est examinée, mais comme les cellules doivent être transfectées avec siRNA pendant la phase immergée de la culture, le knockdown n’est pas suffisamment maintenu pendant la culture ALI en raison de la longue durée de culture, à moins que la transfection siRNA ne soit fréquemment répétée pendant la culture52. Néanmoins, les siRNA peuvent être utilisés avec succès pour modifier l’expression des gènes dans les cellules basales submergées. D’autres ont utilisé avec succès la technologie CRISPR/Cas9 pour réaliser l’édition de gènes dans des cultures de cellules épithéliales primaires des voies respiratoires ALI avec administration de ribonucléoprotéine (RNP) 53. Lors de l’utilisation de telles techniques, il est essentiel que les cellules conservent leur pleine capacité de différenciation. Parce que les cultures de cellules des voies respiratoires primaires ne peuvent pas être transmises indéfiniment, l’expansion clonale des cellules génétiquement modifiées n’est pas facile et l’ajout de milieu pour sélectionner les cellules transfectées est fastidieux. Par conséquent, il est difficile d’obtenir le knockdown souhaitable dans toutes les cellules en culture. Une alternative pour générer des clones knockout est l’utilisation de stratégies knock-out dans lesCSPhi 54 et l’utilisation de ces cellules pour générer des cellules épithéliales des voies respiratoires. Une autre alternative, bien que sous-optimale, consiste à établir une lignée PBEC immortalisée afin d’étendre clonalement les cellules génétiquement modifiées55.
Le protocole présenté ici est un moyen de générer un ALI-PBEC pseudostratifié bien différencié, mais d’autres protocoles ont également été trouvés pour établir une telle culture, avec des différences de plus en plus grandes par rapport au protocole présenté. À notre avis, la validation en laboratoire des méthodes de culture et un contrôle de qualité rigoureux sont essentiels pour que le système ALI-PBEC et les systèmes de culture similaires de cellules épithéliales des voies respiratoires deviennent une alternative valable pour les expériences sur les animaux.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas de conflits d’intérêts pertinents.
Remerciements
Les études utilisant le modèle décrit dans cette contribution ont été soutenues par divers organismes de financement, notamment la Lung Foundation Netherlands, l’Organisation néerlandaise pour la recherche et le développement en santé (ZonMw, subvention COVID-19 MKMD), la Société néerlandaise pour le remplacement des tests sur les animaux (Stichting Proefdiervrij, subvention #114025007), ainsi que des subventions de recherche d’entreprises comme Boehringer Ingelheim et Galapagos. La figure 1 a été créée avec BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 1,000 ohm test resistor | World Precision Instruments | N/A | Used to calibrate the EVOM2 Epithelial Voltohmmeter |
| 4-[2-(5,6,7,8-Tetrahydro-5,5,8,8-tetramethyl-2-naphthalenyl)ethynyl)-benzoic acid (EC 23) | Tocris | 4011 | Used in cBD medium |
| 6-well Clear TC-treated Multiple Well Plates | Corning | 3506 | Used in the first step to grow the cells isolated form the bronchial ring |
| Airway Epithelial Cell Growth Medium Kit | PromoCell | C-21160 | Used to compare to cBD medium |
| Bead Bath 20 Liter | Lab Armor | 74220-720 | Used to pre-warm cell culture solutions |
| BEGM Bronchial Epithelial Cell Growth Medium BulletKit | LONZA | CC-3170 | Used to compare to cBD medium |
| Bovine albumin fraction V (BSA) | Thermo Fisher Scientific | 15260037 | Used in coating solution |
| Bovine pituitary extract (BPE) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Bronchial epithelial cell growth supplement (BEpiCGS) | ScienCell Research Laboratories | 3262 | Used in cBD medium |
| Bronchial epithelial cell medium-basal (BEpiCM-b) | ScienCell Research Laboratories | SCC3211-b | Used in cBD medium |
| Cell culture inserts; 12 mm Transwell with 0.4 µm pore polyester membrane insert | Corning | 3460 | Cell culture inserts used in the protocol |
| Cell culture inserts; 12-well inserts, 0.4 µm PET clear | CellQART made by SABEU | 9310412 | Cell culture inserts used to compare with Corning cell culture inserts |
| Cell culture inserts; 12-well ThinCert Tissue culture Inserts | Greiner Bio-One | 82050-032 | Cell culture inserts used to compare with Corning cell culture inserts |
| CELLSTAR flask, TC, PS, 250 ml, 75 cm2 | Greiner Bio-One | 658170 | Used to expand the number cells |
| CFX Maestro 1.0 | Bio-Rad | N/A | Software program for analyzing qPCR data generated with the CFX384 System |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad | 1855484 | qPCR detection system |
| Chopstick electrode set | World Precision Instruments | STX2 | Used to measure electrical resistance in ALI-PBEC |
| CO2-Incubator | PHCbi | MCO-170AICUV-PE | Cell culture incubator used for mycplasma free cell cultures |
| CO2-Incubator | Hereaus | Heracell 150 | Cell culture incubator used for possibly mycplasma infected cell cultures |
| Coolcell Container | Corning | 432006 | Used to cryopreserve cells at -80 °C before transfer to liquid N2 |
| Countess 3 Automated cell counter | Thermo Fisher Scientific | AMQAX2000 | Used to count cells and determine the cell concentration |
| Cryovials | Nalgene | 479-3224 | Used to cryopreserve cells in |
| D-Glucose | Avantor VWR BDH CHEMICALS | 101174Y | Used in soft trypsin |
| Dimethyl sulfoxide (DMSO) | Avantor VWR | 0231 | Used in cell freeze medium |
| dNTP (10 mM) | Promega | U1515 | Used in the synthesis of cDNA |
| Dulbecco's Modified Eagle's Medium (DMEM) + 4500 mg/l D-Glucose | STEMCELL Technologies | 36250 | Used in cBD medium |
| Dulbecco's Modified Eagle's Medium (DMEM) 4.5 g/l glucose with l-glutamine | LONZA | LOBE12-604F | Used in cBD medium to compare with DMEM from other manufacturers |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, pyruvate | Thermo Fisher Scientific | 41966029 | Used in cBD medium to compare with DMEM from other manufacturers |
| Epidermal growth factor (EGF) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Ethylenediaminetetraacetic acid (EDTA) | Avantor VWR BDH CHEMICALS | 443885J | Used in soft trypsin |
| EVOM2 Epithelial Voltohmmeter | World Precision Instruments | 91799 | Used with the chopstick electrode set to measure electrical resistance in ALI-PBEC |
| Fibronectin solution, Human | PromoCell | C-43060 | Used in coating solution |
| Glutamax | Thermo Fisher Scientific | 35050038 | Used in cBD medium |
| Hanks balanced salt solution (HBSS) | ScienCell Research Laboratories | SCC0313 | Used to dissolve protease XIV |
| IQ SYBR Green Super mix | Bio-Rad | 170887 | qPCR reagent |
| Isoproterenol hydrochloride, (-)- | Sigma-Aldrich | I-6504 | Used in c-KSFM |
| Keratinocyte-SFM (KSFM) | Thermo Fisher Scientific | 17005-034 | Used in c-KSFM |
| Maxwell RSC Instrument | Promega | AS4500 | Automated RNA isolation system |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | Used to isolate total RNA with the Maxwell RSC Instrument |
| M-MLV Reverse transcriptase | Promega | M5301 | Used in the synthesis of cDNA |
| M-MLV Reverse transcriptase 5X reaction buffer | Promega | M531A | Used in the synthesis of cDNA |
| MycoStrip | InvivoGen | rep-mys-10 | Used to detect the presence of mycoplasma in cell culture samples |
| N-2-hydroxyethylpiperazine-N-2-ethane sulfonic acid (HEPES) | Thermo Fisher Scientific | 15630056 | Used in cBD medium |
| Oligo(dT)15 | Qiagen | 79237 | Used in the synthesis of cDNA |
| Penicillin/Streptomycin solution (Pen/Strep) | ScienCell Research Laboratories | SCC0513 | Used as antibiotic in c-KSFM and cBD medium |
| Phosphate buffered saline (PBS) | LUMC pharmacy | N/A | Used in different steps of the protocol |
| Pneumacult-ALI Medium | STEMCELL Technologies | 05002 | Used to grow cells in the differentiation stage to compare to cBD medium |
| Pneumacult-Ex Plus Medium | STEMCELL Technologies | 05040 | Used to grow cells in the submerged stage to compare to cBD medium |
| Primer, ATP5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: TCACCCAGGCTGGTTCAGA |
| Primer, ATP5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGTGGCCAGGGTAGGCTGAT |
| Primer, FOXJ1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGAGGGGACGTAAATCCCTA |
| Primer, FOXJ1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TTGGTCCCAGTAGTTCCAGC |
| Primer, MUC5AC, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCTTCGACGGACAGAGCTAC |
| Primer, MUC5AC, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCTCGGTGACAACACGAAAG |
| Primer, MUC5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGGCTTTGACAAGAGAGT |
| Primer, MUC5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGGATGGTCGTGTTGATGCG |
| Primer, RPL13A, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: AAGGTGGTGGTCGTACGCTGTG |
| Primer, RPL13A, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: CGGGAAGGGTTGGTGTTCATCC |
| Primer, SCGB1A1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: ACATGAGGGAGGCAGGGGCTC |
| Primer, SCGB1A1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: ACTCAAAGCATGGCAGCGGCA |
| Primer, TP63, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCACCTGGACGTATTCCACTG |
| Primer, TP63, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCGAATCAAATGACTAGGAGGGG |
| Primocin | InvivoGen | ant-pm-2 | Used as antimicrobial agent against bacteria, mycoplasma, and fungi in c-KSFM medium |
| Protease XIV | Sigma-Aldrich | P5147 | Used for the enzymatic treatment of the bronchial ring |
| RNAsin Recombinant Ribonuclease inhibitor | Promega | N2515 | Used in the synthesis of cDNA |
| Soybean trypsin inhibitor (SBTI) | Sigma-Aldrich | T9128 | Used to inhibit the action of soft trypsin |
| T100 Thermal Cycler | Bio-Rad | 1861096 | Used in the synthesis of cDNA |
| TissueSAFE plus | MILESTONE MEDICAL | N/A | Vacuum transfer system for biological specimens |
| Trypan blue solution | Thermo Fisher Scientific | 15250061 | Used to count live- and dead cells |
| Trypsin 1:250 | Thermo Fisher Scientific | 27250-018 | Used in soft trypsin |
| Type I collagen solution (PureCol) | Advanced BioMatrix | 5005-B | Used in coating solution |
| Universal container, PP, with PE screw cap | Avantor VWR | 216-2053 | Used in the protocol for the Protease XIV treatment of the bronchial ring |
Références
- Aghapour, M., et al. Role of air pollutants in airway epithelial barrier dysfunction in asthma and COPD. European Respiratory Review. 31 (163), 210112(2022).
- de Waal, A. M., Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Duchesne, M., Okoye, I., Lacy, P. Epithelial cell alarmin cytokines: Frontline mediators of the asthma inflammatory response. Frontiers in Immunology. 13, 975914(2022).
- Hewitt, R. J., Lloyd, C. M. Regulation of immune responses by the airway epithelial cell landscape. Nature Reviews Immunology. 21 (6), 347-362 (2021).
- Ruysseveldt, E., Martens, K., Steelant, B. Airway basal cells, protectors of epithelial walls in health and respiratory diseases. Frontiers in Allergy. 2, 787128(2021).
- Alysandratos, K. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Hammad, H., Lambrecht, B. N. Barrier epithelial cells and the control of type 2 immunity. Immunity. 43 (1), 29-40 (2015).
- Hynds, R. E., Bonfanti, P., Janes, S. M. Regenerating human epithelia with cultured stem cells: feeder cells, organoids and beyond. EMBO Molecular Medicine. 10 (2), 139-150 (2018).
- Hiemstra, P. S., Tetley, T. D., Janes, S. M. Airway and alveolar epithelial cells in culture. The European Respiratory Journal. 54 (5), 1900742(2019).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), 2137(2020).
- Leung, C., Wadsworth, S. J., Yang, S. J., Dorscheid, D. R. Structural and functional variations in human bronchial epithelial cells cultured in air-liquid interface using different growth media. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1063-L1073 (2020).
- Morgan, R., et al. A medium composition containing normal resting glucose that supports differentiation of primary human airway cells. Scientific Reports. 12 (1), 1540(2022).
- Ghosh, B., et al. Strong correlation between air-liquid interface cultures and in vivo transcriptomics of nasal brush biopsy. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1056-L1062 (2020).
- Pezzulo, A. A., et al. The air-liquid interface and use of primary cell cultures are important to recapitulate the transcriptional profile of in vivo airway epithelia. American Journal of Physiology. Lung Cellular and Molecular Physiology. 300 (1), L25-L31 (2011).
- Dvorak, A., Tilley, A. E., Shaykhiev, R., Wang, R., Crystal, R. G. Do airway epithelium air-liquid cultures represent the in vivo airway epithelium transcriptome. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 465-473 (2011).
- Legebeke, J., et al. Temporal whole-transcriptomic analysis of characterized in vitro and ex vivo primary nasal epithelia. Frontiers in Cell and Developmental Biology. 10, 907511(2022).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- van Wetering, S., et al. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. Journal of Investigative Medicine. 48 (5), 359-366 (2000).
- Balk, S. D. Calcium as a regulator of the proliferation of normal, but not of transformed, chicken fibroblasts in a plasma-containing medium. Proceedings of the National Academy of Sciences. 68 (2), 271-275 (1971).
- Gail, M. H., Boone, C. W., Thompson, C. S. A calcium requirement for fibroblast motility and prolifertion. Experimental Cell Research. 79 (2), 386-390 (1973).
- Dulbecco, R., Elkington, J. Induction of growth in resting fibroblastic cell cultures by Ca. Proceedings of the National Academy of Sciences. 72 (4), 1584-1588 (1975).
- van Wetering, S., et al. Epithelial differentiation is a determinant in the production of eotaxin-2 and -3 by bronchial epithelial cells in response to IL-4 and IL-13. Molecular Immunology. 44 (5), 803-811 (2007).
- Amatngalim, G. D., et al. Aberrant epithelial differentiation by cigarette smoke dysregulates respiratory host defence. The European Respiratory Journal. 51 (4), 1701009(2018).
- Christie, V. B., et al. Retinoid supplementation of differentiating human neural progenitors and embryonic stem cells leads to enhanced neurogenesis in vitro. Journal of Neuroscience Methods. 193 (2), 239-245 (2010).
- Schrumpf, J. A., Ninaber, D. K., vander Does, A. M., Hiemstra, P. S. TGF-β1 impairs vitamin D-induced and constitutive airway epithelial host defense mechanisms. Journal of Innate Immunity. 12 (1), 74-89 (2020).
- Schrumpf, J. A., et al. Proinflammatory cytokines impair vitamin D-induced host defense in cultured airway epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (6), 749-761 (2017).
- Boei, J. J. W. A., et al. Xenobiotic metabolism in differentiated human bronchial epithelial cells. Archives of Toxicology. 91 (5), 2093-2105 (2017).
- Wang, Y., et al. Impact of human airway epithelial cellular composition on SARS-CoV-2 infection biology. bioRxiv. , (2021).
- Nawroth, J. C., et al. Breathing on Chip: Dynamic flow and stretch tune cellular composition and accelerate mucociliary maturation of airway epithelium in vitro. bioRxiv. , (2022).
- Horani, A., Nath, A., Wasserman, M. G., Huang, T., Brody, S. L. Rho-associated protein kinase inhibition enhances airway epithelial Basal-cell proliferation and lentivirus transduction. American Journal of Respiratory Cell and Molecular Biology. 49 (3), 341-347 (2013).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300(2019).
- Eenjes, E., et al. Disease modeling following organoid-based expansion of airway epithelial cells. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (4), L775-L786 (2021).
- Butler, C. R., et al. Rapid expansion of human epithelial stem cells suitable for airway tissue engineering. American Journal of Respiratory and Critical Care Medicine. 194 (2), 156-168 (2016).
- Amatngalim, G. D., et al. Antibacterial defense of human airway epithelial cells from chronic obstructive pulmonary disease patients induced by acute exposure to nontypeable Haemophilus influenzae: modulation by cigarette smoke. Journal of Innate Immunity. 9 (4), 359-374 (2017).
- Plebani, R., et al. 3D lung tissue models for studies on SARS-CoV-2 pathophysiology and therapeutics. International Journal of Molecular Sciences. 23 (17), 10071(2022).
- Wong, A. P., et al. Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein. Nature Biotechnology. 30 (9), 876-882 (2012).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Biology. 107, 183-206 (2005).
- Cao, J., Wong, C. K., Yin, Y., Lam, C. W. K. Activation of human bronchial epithelial cells by inflammatory cytokines IL-27 and TNF-alpha: implications for immunopathophysiology of airway inflammation. The Journal of Cellular Physiology. 223 (3), 788-797 (2010).
- Tsao, P. N., et al. Notch signaling controls the balance of ciliated and secretory cell fates in developing airways. Development. 136 (13), 2297-2307 (2009).
- Laoukili, J., et al. IL-13 alters mucociliary differentiation and ciliary beating of human respiratory epithelial cells. The Journal of Clinical Investigation. 108 (12), 1817-1824 (2001).
- Mertens, T. C. J., et al. Cigarette smoke differentially affects IL-13-induced gene expression in human airway epithelial cells. Physiological Reports. 5 (13), e13347(2017).
- Zarcone, M. C., et al. Effect of diesel exhaust generated by a city bus engine on stress responses and innate immunity in primary bronchial epithelial cell cultures. Toxicology in Vitro. 48, 221-231 (2018).
- vander Does, A. M., et al. Early transcriptional responses of bronchial epithelial cells to whole cigarette smoke mirror those of in-vivo exposed human bronchial mucosa. Respiratory Research. 23 (1), 227(2022).
- Wang, Y., Ninaber, D. K., van Schadewijk, A., Hiemstra, P. S. Tiotropium and fluticasone inhibit rhinovirus-induced mucin production via multiple mechanisms in differentiated airway epithelial cells. Frontiers in Cellular and Infection Microbiology. 10, 278(2020).
- Ronaghan, N. J., et al. M1-like, but not M0- or M2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), 0276013(2022).
- Gindele, J. A., et al. Opposing effects of in vitro differentiated macrophages sub-type on epithelial wound healing. PLoS One. 12 (9), e0184386(2017).
- van Riet, S., et al. Modulation of airway epithelial innate immunity and wound repair by M(GM-CSF) and M(M-CSF) macrophages. Journal of Innate Immunity. 12 (5), 410-421 (2020).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Stucki, A. O., et al. A lung-on-a-chip array with an integrated bio-inspired respiration mechanism. Lab on a Chip. 15 (5), 1302-1310 (2015).
- Peters-Hall, J. R., et al. Long-term culture and cloning of primary human bronchial basal cells that maintain multipotent differentiation capacity and CFTR channel function. American Journal of Physiology. Lung Cellular and Molecular Physiology. 315 (2), L313-L327 (2018).
- Bartman, C. M., Stelzig, K. E., Linden, D. R., Prakash, Y. S., Chiarella, S. E. Passive siRNA transfection method for gene knockdown in air-liquid interface airway epithelial cell cultures. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), L280-L286 (2021).
- Koh, K. D., et al. Efficient RNP-directed human gene targeting reveals SPDEF is required for IL-13-induced mucostasis. American Journal of Respiratory Cell and Molecular Biology. 62 (3), 373-381 (2020).
- Bhargava, N., et al. Development of an efficient single-cell cloning and expansion strategy for genome edited induced pluripotent stem cells. Molecular Biology Reports. 49 (8), 7887-7898 (2022).
- Angelopoulou, A., Papaspyropoulos, A., Papantonis, A., Gorgoulis, V. G. CRISPR-Cas9-mediated induction of large chromosomal inversions in human bronchial epithelial cells. STAR Protocols. 3 (2), 101257(2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon