Method Article
Aislar células epiteliales bronquiales del tejido pulmonar resecado para biobancos y establecer cultivos de interfaz aire-líquido bien diferenciados
En este artículo
Resumen
Aquí se presenta un método reproducible, asequible y robusto para el aislamiento y la expansión de células epiteliales bronquiales primarias para biobancos a largo plazo y la generación de células epiteliales diferenciadas por cultivo en la interfaz aire-líquido.
Resumen
La capa de células epiteliales de las vías respiratorias forma la primera barrera entre el tejido pulmonar y el ambiente exterior y, por lo tanto, está constantemente expuesta a sustancias inhaladas, incluidos agentes infecciosos y contaminantes del aire. La capa epitelial de las vías respiratorias desempeña un papel central en una gran variedad de enfermedades pulmonares agudas y crónicas, y varios tratamientos dirigidos a este epitelio se administran por inhalación. Comprender el papel del epitelio en la patogénesis y cómo puede ser dirigido para la terapia requiere modelos sólidos y representativos. Los modelos de cultivo epitelial in vitro se utilizan cada vez más y ofrecen la ventaja de realizar experimentos en un ambiente controlado, exponiendo las células a diferentes tipos de estímulos, tóxicos o agentes infecciosos. El uso de células primarias en lugar de líneas celulares inmortalizadas o tumorales tiene la ventaja de que estas células se diferencian en cultivo a una capa celular epitelial polarizada pseudoestratificada con una mejor representación del epitelio en comparación con las líneas celulares.
Aquí se presenta un protocolo robusto, que se ha optimizado en las últimas décadas, para el aislamiento y cultivo de células epiteliales de las vías respiratorias a partir de tejido pulmonar. Este procedimiento permite el aislamiento, la expansión, el cultivo y la diferenciación mucociliar exitosos de las células epiteliales bronquiales primarias (PBEC) mediante el cultivo en la interfaz aire-líquido (ALI) e incluye un protocolo para biobancos. Además, se describe la caracterización de estos cultivos utilizando genes marcadores específicos de células. Estos cultivos ALI-PBEC se pueden utilizar para una variedad de aplicaciones, incluida la exposición al humo entero del cigarrillo o mediadores inflamatorios, y el cocultivo / infección con virus o bacterias.
Se espera que el protocolo proporcionado en este manuscrito, que ilustra el procedimiento paso a paso, proporcione una base y / o referencia para aquellos interesados en implementar o adaptar dichos sistemas de cultivo en su laboratorio.
Introducción
El papel del epitelio de las vías respiratorias en una variedad de enfermedades pulmonares agudas y crónicas ha sido descrito en varias revisiones 1,2,3,4,5,6,7. Los cultivos bien diferenciados de células epiteliales de las vías respiratorias son una herramienta importante para desentrañar el papel del epitelio de las vías respiratorias. El cultivo de células epiteliales de la vía aérea de la interfaz aire-líquido (LPA) se aplica ampliamente para promover la diferenciación de las células epiteliales basales de las vías respiratorias y, por lo tanto, estudiar el epitelio de las vías respiratorias de manera confiable in vitro 8,9. En los últimos años, el uso de tales modelos ha aumentado aún más como resultado de nuevas iniciativas de investigación relacionadas con la pandemia de COVID-19 y una transición mundial hacia la investigación libre de animales. Por lo tanto, el mayor uso de esta línea celular modelo enfatiza la necesidad de compartir procedimientos y experiencias para obtener resultados sólidos. Esto también permitirá la comparación de resultados entre grupos de investigación. La robustez del procedimiento es la característica clave y, por lo tanto, debe someterse a un control de calidad. Varios laboratorios han invertido en el desarrollo de protocolos para cultivar células epiteliales primarias de las vías respiratorias en el ALI. El tiempo, el esfuerzo y el presupuesto requerido se pueden reducir cuando estos procedimientos se comparten en detalle. Estos detalles incluyen, por ejemplo, la elección de plásticos y medios de cultivo celular proporcionados por varios fabricantes, ya que se encontró que esto influyó en las características de los cultivos obtenidos10,11,12. Esto enfatiza la importancia de compartir experiencias y detalles de los procedimientos de cultivo, ya que en ausencia de tales conocimientos, los resultados pueden verse afectados y / o los esfuerzos de validación en varios laboratorios pueden verse obstaculizados.
El epitelio pulmonar humano comprende varios tipos de células, incluidos los tipos principales, como las células basales, las células ciliadas, las células caliciformes y las células club. Para imitar de manera confiable la capa celular epitelial en las vías respiratorias in vitro, estos tipos de células deben estar representados en los modelos de cultivo, y su polarización y función deben mantenerse13,14,15,16. La comprensión de que las características del donante (incluido el estado de la enfermedad) y el origen anatómico de las células (es decir, las vías respiratorias nasales, traqueales, grandes y pequeñas) pueden afectar la composición celular y las respuestas funcionales del cultivo celular es igualmente importante. La experiencia y la práctica relevantes son un requisito previo para cultivar con éxito las células epiteliales primarias de las vías respiratorias y evaluar la calidad del cultivo tanto intuitivamente (mediante inspección visual durante el cultivo) como cuantificablemente. El objetivo de esta contribución es proporcionar un método rentable y eficaz en tiempo para el aislamiento y el cultivo de células epiteliales bronquiales humanas primarias (PBEC) que también se puede aplicar al cultivo de células epiteliales traqueales y de las vías respiratorias pequeñas. Además de describir un método para aislar dichas células del tejido pulmonar resecado, se presenta y discute un método para la expansión y el biobanco, y finalmente para el establecimiento y caracterización de un cultivo de LPA bien diferenciado dentro de un costo y período de tiempo razonables.
Protocolo
Las células se aislaron de tejido pulmonar macroscópicamente normal obtenido de pacientes sometidos a cirugía de resección por cáncer de pulmón en el Centro Médico de la Universidad de Leiden, Países Bajos. Los pacientes de los que se derivó este tejido pulmonar se inscribieron en el biobanco a través de un sistema de no objeción para el uso posterior anónimo codificado de dicho tejido (www.coreon.org). Sin embargo, desde el 01-09-2022, los pacientes se han inscrito en el biobanco utilizando el consentimiento informado activo de acuerdo con las regulaciones locales del biobanco LUMC con la aprobación del comité ético médico institucional (B20.042/Ab/ab y B20.042/Kb/kb).
NOTA: Todos los procedimientos se realizan en un gabinete de seguridad biológica, de acuerdo con las normas locales de seguridad biológica, y bajo condiciones de trabajo estériles mientras se usan guantes quirúrgicos y una bata de laboratorio, a menos que se indique lo contrario. Para todos los medios, reactivos y otras soluciones utilizadas en el protocolo, consulte la Tabla de materiales y la Tabla complementaria 1. Consulte la Figura 1 para conocer los pasos detallados del protocolo
1. Aislamiento de células epiteliales bronquiales del tejido pulmonar humano
NOTA: Para obtener una tasa de éxito óptima para el aislamiento de células epiteliales bronquiales, el anillo bronquial extirpado debe mantenerse sumergido a 4 °C durante un máximo de 24 h en solución salina tamponada con fosfato (PBS) con primocina añadida.
- Preparativos antes del inicio del procedimiento
- Prepare una solución de recubrimiento en PBS, como se describe en la Tabla suplementaria 1, y cubra un número apropiado de placas de 6 pocillos con 1.5 ml de solución de recubrimiento por pocillo. Incubar durante 2 h en una incubadora de cultivo celular a 37 °C y 5% deCO2.
NOTA: El número de pocillos a recubrir depende del tamaño del tejido extirpado. Como pauta aproximada, se recubren cuatro placas de 6 pocillos cuando el anillo bronquial extirpado tiene 10 mm de diámetro y 4 mm de ancho. - Preparar un medio completo sin suero de queratinocitos (c-KSFM), como se describe en la Tabla suplementaria 1; use 2 ml del medio por pocillo de una placa de 6 pocillos.
NOTA: Este c-KSFM se puede almacenar a 4 °C durante 7 días. c-KSFM es un medio bajo en calcio utilizado para la expansión de las células epiteliales de las vías respiratorias mientras inhibe el crecimiento de fibroblastos contaminantes.
- Prepare una solución de recubrimiento en PBS, como se describe en la Tabla suplementaria 1, y cubra un número apropiado de placas de 6 pocillos con 1.5 ml de solución de recubrimiento por pocillo. Incubar durante 2 h en una incubadora de cultivo celular a 37 °C y 5% deCO2.
- Limpie el anillo bronquial enjuagando suavemente el anillo con 10 ml de PBS estéril en una placa de Petri de 10 cm. Use pinzas para sostener cuidadosamente el anillo (solo toque afuera) y tijeras pequeñas para eliminar cualquier exceso de tejido conectivo y restos de sangre. Para su posterior procesamiento, corte el anillo en dos.
NOTA: Todas las herramientas utilizadas en el proceso deben esterilizarse antes de su uso. - Sumergir las dos mitades del anillo bronquial en 10 ml de una solución precalentada de proteasa XIV (1,8 mg/ml) en la solución salina balanceada de Hank (HBSS), incluyendo Primocina en un recipiente estéril cerrado, e incubar durante exactamente 2 h a 37 °C en una incubadora de cultivo celular.
NOTA: HBSS se utiliza como diluyente para la proteasa XIV para separar las células del tejido durante un período de incubación de 2 h. HBSS es una solución isotónica equilibrada que permite el mantenimiento de la viabilidad celular durante incubaciones a corto plazo. - Después de la incubación, transfiera los trozos de tejido a una placa de Petri con 10 ml de PBS caliente y raspe el interior del anillo con pinzas dobladas para obtener una solución celular.
NOTA: El tejido parece más blando y algo expandido. - Deseche el anillo, transfiera la solución celular a un tubo de 50 ml y agregue PBS caliente para obtener un volumen final de 50 ml. Centrifugar durante 7 min a 230 x g y a temperatura ambiente (RT).
- Aspirar el sobrenadante y resuspender el pellet en 10 mL de PBS caliente. Además, enrasar el volumen hasta 50 ml con PBS caliente. Centrífuga durante 7 min a 230 x g en RT.
- Aspirar el sobrenadante y resuspender el pellet celular en una cantidad adecuada de c-KSFM caliente que contenga Primocina.
NOTA: La primocina se usa durante un mínimo de 7 días para eliminar cualquier bacteria, hongo o micoplasma (lo que es más importante) que pueda haber estado presente en el tejido; Después de 7 días, la adición de sólo penicilina/estreptomicina al medio es suficiente. - Aspire la solución de recubrimiento de las placas de 6 pocillos y agregue 2 ml de suspensión celular por pocillo.
- Permita que las células crezcan hasta que se alcance una confluencia del 80% al 90% y cambie el medio tres veces por semana (por ejemplo, todos los lunes, miércoles y viernes). El grado de confluencia deseado suele alcanzarse entre 7 y 14 días; Si el tiempo requerido para alcanzar la confluencia deseada excede los 14 días, deseche las celdas.
NOTA: En los primeros días, sólo un pequeño número de células comienzan a proliferar; Los grupos de células se notan después de unos días.
2. Criopreservación de células epiteliales bronquiales primarias humanas (PBEC)
NOTA: Cuando se trabaja con temperaturas de -80 °C y -196 °C, se utilizan guantes criogénicos para la protección y pinzas para transferir viales congelados. Cuando se trabaja con nitrógeno líquido, se utilizan guantes criogénicos y un protector facial para la protección personal.
- Aspire el medio y lave los pocillos una vez con 2 ml de PBS caliente por pocillo.
- Tripsinizar las células añadiendo 0,5 ml de tripsina blanda por pocillo (ver Tabla suplementaria 1 para la composición de la solución de tripsina blanda). Incubar las células durante 5 a un máximo de 10 min a 37 °C. Agite la solución de tripsina en la placa y libere las células golpeando suavemente la placa.
- Transfiera las células desprendidas a un tubo de centrífuga de 50 ml que contenga 1,1 mg/ml de inhibidor de tripsina de soja (SBTI; para inhibir la actividad de la tripsina) disuelto en KSFM con penicilina/estreptomicina. El volumen de SBTI debe ser el doble del volumen total de tripsina blanda (es decir, 1 ml por pocillo).
NOTA: No agregue SBTI directamente a los pocillos, ya que las celdas se volverán a conectar en cuestión de minutos. - Centrifugar el tubo durante 7 min a 230 x g en RT.
- Desechar el sobrenadante y resuspender las células granuladas en 10 ml de RT KSFM que contenga penicilina/estreptomicina, pero sin otros aditivos. Cuente las células con un hemocitómetro o un contador celular automatizado. Realice un recuento de células vivas/muertas agregando azul de tripano en una proporción de 1:1, o utilice un procedimiento alternativo de recuento de células vivas/muertas.
- Creír las células a una concentración de 400.000 células por ml de medio de congelación (consultar la Tabla suplementaria 1 para la composición) y añadir 1 ml de esta suspensión por criovial. Transfiera los crioviales a un recipiente coolcell y colóquelo a -80 °C. Después de 24 h, transfiera los viales a -196 °C de nitrógeno líquido para su almacenamiento a largo plazo.
NOTA: Dos opciones son posibles para transferir las células al medio de congelación, las cuales funcionan bien: 1) Granular las células nuevamente por centrifugación y resuspenderlas en medio de congelación en frío a la concentración celular requerida; o 2) añadir medio de congelación en frío y ajustar la concentración del criopreservante (dimetilsulfóxido [DMSO]) en función del volumen de KSFM en el que están presentes las células.
3. Descongelar PBEC criopreservados y cultivarlos para su cultivo en insertos
- Cubrir un matraz de cultivo celular T75 durante la noche con 10 ml de solución de recubrimiento en PBS con las tapas bien cerradas. Incubar el matraz en una incubadora de cultivo celular a 37 °C y 5% deCO2.
- Antes de descongelar los PBEC criopreservados, retire la solución de recubrimiento del matraz y llénela con 10 ml de c-KSFM. Dejar calentar a 37 °C en una incubadora de cultivo celular, con tapas ligeramente abiertas para dejar entrar el aire de la incubadora.
- Descongele las células rápidamente en un baño de agua o cuentas a 37 °C.
NOTA: Se prefiere un baño de cuentas a un baño de agua debido al menor riesgo de contaminación y menor consumo de energía. - Añadir el contenido completo del criovial al matraz T75 precalentado con medio (paso 3.2) y distribuir las células uniformemente.
NOTA: No centrifugue las células en esta etapa, ya que no sobrevivirán al paso de centrifugación. - Después de aproximadamente 4 h, asegúrese de que las células estén suficientemente unidas. Reemplace el medio con 10 ml de c-KSFM fresco y caliente.
NOTA: De esta manera, se elimina el DMSO del medio de congelación. Este paso debe tener lugar entre 4 h y 24 h después de sembrar las células en el matraz. - Cultive las células hasta alcanzar una confluencia del 80% al 90%, cambiando el medio todos los lunes, miércoles y viernes.
4. Establecimiento de un cultivo de interfaz aire-líquido con células epiteliales bronquiales primarias (ALI-PBEC)
NOTA: El siguiente procedimiento es para el cultivo de PBEC en insertos de 11,9 mm de diámetro interior.
- Cubra un número adecuado de insertos de cultivo celular con 0,4 ml de solución de recubrimiento por inserto. Incubar durante la noche a 37 °C en una incubadora de cultivo celular.
- Preparar el medio BD completo (medio cBD), como se describe en la Tabla suplementaria 1.
NOTA: El medio cBD es un medio compuesto (ver Tabla Suplementaria 1) formulado para apoyar el crecimiento de las células epiteliales bronquiales durante períodos de tiempo más largos, al tiempo que permite su diferenciación después de un aumento en la concentración de ácido retinoico (AR) (o un análogo de la AR como se usa en el presente protocolo) y el cultivo en el ALI, como se describe en el paso 4.10. - Tripsinizar los PBEC en el matraz T75, utilizando 2 ml de tripsina blanda por matraz. Incubar las células durante 5 a 10 minutos para permitir que las células se desprendan (según la inspección visual). Después de 5 minutos de incubación, facilitar el desprendimiento de las células girando la tripsina en el matraz y golpeando suavemente el matraz (repetir si es necesario).
- Añadir 4 ml de SBTI al matraz y transferir directamente la suspensión celular a un tubo de centrífuga de 25 ml.
NOTA: Las celdas se vuelven a conectar en cuestión de minutos. Por lo tanto, cuando se trabaje con más de un matraz, la suspensión celular obtenida en la etapa 4.4 debe transferirse directamente a un tubo de centrífuga antes de añadir SBTI a un segundo matraz. En el procedimiento, se procesan simultáneamente un máximo de cinco frascos. - Centrifugar los tubos durante 7 min a 230 x g en RT.
- Resuspender las células en 6 ml de medio cBD y contar las células usando un hemocitómetro o contador celular automatizado. Realice un recuento de células vivas/muertas, por ejemplo, agregando azul de tripano en una proporción de 1:1, o utilizando otro procedimiento de conteo de células vivas/muertas.
- Retire la solución de recubrimiento de los insertos de cultivo celular.
- Diluir la suspensión celular, generada en el paso 4.6, con medio de cBD suplementado con 1 nM EC 23 a una concentración de 80.000 células por ml, y añadir 0,5 ml en la parte superior de la membrana en el inserto. Agregue 1.5 ml de medio de cBD suplementado con 1 nM EC 23 al pocillo debajo del inserto.
- Cambie el medio con medio cBD suplementado con 1 nM EC 23 tres veces por semana hasta que los cultivos estén listos para la exposición al aire (es decir, 2 días después de alcanzar el 100% de confluencia). Cada vez, se agregan 0,5 ml del medio dentro del inserto (en las celdas) y se agregan 1,5 ml al compartimiento inferior (el pozo).
NOTA: En general, la capa celular alcanza el 100% de confluencia aproximadamente 5 días después de sembrar los PBEC en los insertos. Sobre la base de la inspección visual de la confluencia de las células, se toma la decisión de transferir las células a la etapa ALI 2 días después. - Cuando las células estén listas para la transferencia al ALI (es decir, 2 días después de alcanzar el 100% de confluencia), retire el medio de los insertos y del pozo, no agregue un nuevo medio dentro del inserto y agregue un nuevo medio (1 ml de medio cBD suplementado con 50 nM EC 23) solo al pozo. Cambie el medio en los pozos tres veces por semana.
- Para eliminar el exceso de moco y restos celulares, añadir suavemente 200 μL de PBS caliente en el lado apical de la capa celular dentro del inserto (preferiblemente a través del lado del inserto y no pipeteando directamente sobre las células) e incubar durante 10 min en una incubadora de cultivo celular a 37 °C. Luego, aspire el PBS para eliminar el exceso de moco y desechos celulares.
NOTA: A partir de este punto en adelante (inicio del cultivo de ALI), antes de cambiar el medio del compartimiento inferior, lave el lado apical de las células con PBS cada vez. - Cultive las células en el ALI durante un mínimo de 2 semanas para asegurarse de que todos los tipos de células principales estén representados.
5. Establecimiento de un cultivo ALI-PBEC a partir de una población mixta de donantes
- Utilice células de hasta cinco donantes individuales para iniciar cultivos PBEC de una población mixta.
- Mezcle un número igual de células por donante utilizando las células generadas en el paso 4.7 para alcanzar un total de 150.000 células por inserto (es decir, 30.000 células por donante cuando se utilizan cinco donantes). Esto asegurará que la proliferación en el inserto se mantenga al mínimo y que el mismo número de células de los donantes individuales estén presentes en el cultivo.
- Continuar con el cultivo ALI-PBEC como se describe en los pasos 4.9-4.12.
6. Control de calidad de la cultura ALI-PBEC
- Monitorización de la resistencia eléctrica transepitelial (TEER) durante el cultivo celular
NOTA: La medición de la resistencia eléctrica, basada en el uso de un voltohmímetro, se puede realizar en cualquier momento durante el cultivo ALI-PBEC y se realiza cada vez de acuerdo con el mismo protocolo en las mismas condiciones, ya que la medición de la resistencia eléctrica está influenciada por varias variables, incluida la posición del electrodo, la temperatura, el medio y el manejo. TEER se puede calcular utilizando la resistencia eléctrica medida aplicando la siguiente fórmula basada en la ley de Ohm: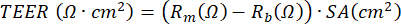 , donde Rm es la resistencia eléctrica medida, Rb es la resistencia eléctrica de referencia de un inserto sin recubrimiento y células, y SA es el área superficial de la membrana del inserto17.
, donde Rm es la resistencia eléctrica medida, Rb es la resistencia eléctrica de referencia de un inserto sin recubrimiento y células, y SA es el área superficial de la membrana del inserto17.- Agregue suavemente 200 μL de PBS caliente al lado apical de la capa celular para eliminar el moco y los desechos en las células. Incubar el inserto durante 10 minutos en una incubadora de cultivo celular a 37 °C y retirar de nuevo el PBS.
- Agregue suavemente 700 μL de PBS caliente al lado apical de la capa celular e incube el inserto durante 10 minutos a RT para permitir la estabilización de la temperatura para las mediciones.
- Calibre el voltohmímetro usando la resistencia de prueba de 1,000 Ω, configure el voltohmímetro para medir ohmios y use un destornillador para ajustar el tornillo de calibración "R ADJ" hasta que se ajuste a 1,000 Ω.
- Enjuague el electrodo moviéndolo hacia arriba y hacia abajo varias veces en agua estéril (RT) y luego en PBS estéril (RT).
- Mida la resistencia eléctrica de la capa celular en los insertos. Con este fin, coloque el electrodo en posición vertical en el pozo con el brazo largo del electrodo tocando el fondo de la placa. De esta manera, el brazo corto está por encima de la capa celular dentro del inserto. Lea el valor que se muestra en el voltohmímetro.
NOTA: El valor mostrado no se estabilizará completamente; Lea el valor en el momento en que el valor es intermitente. - Entre mediciones, limpie el electrodo moviéndolo hacia arriba y hacia abajo varias veces en PBS estéril (RT).
- Limpie el electrodo cuando terminen las mediciones moviéndolo hacia arriba y hacia abajo varias veces en agua estéril (RT), PBS estéril (RT) y etanol al 70% (RT). Guarde el electrodo seco.
- Realice una medición de referencia de un inserto (sin recubrimiento) y celdas agregando 700 μL de PBS caliente dentro del inserto y 1 ml de PBS caliente al pocillo y midiendo la resistencia eléctrica junto con los otros insertos.
- Evaluación de la composición celular del cultivo ALI-PBEC
- Durante la etapa ALI, verifique la diferenciación evaluando visualmente los cilios que vencen. Estos se pueden observar a través de microscopía estándar de campo claro tan pronto como 9 días después de la exposición al aire en el lado apical de las células.
NOTA: Los cilios batidos son mejor visibles directamente después de lavar la superficie apical. Las células caliciformes producen moco y, por lo tanto, la presencia de moco, como se observa durante el lavado de la superficie apical, es un signo de que se forman células caliciformes. Sin embargo, el nivel de células caliciformes y la cantidad de moco producido depende en gran medida del donante. La presencia de moco se puede ver al aspirar el PBS después de lavar la superficie apical de la capa celular en el inserto; en este caso, el PBS aspirado es más viscoso, y se pueden observar hilos de moco mientras se aspira. - La evaluación de la composición celular mediante inmunotinciones y microscopía fluorescente o clasificación celular activada por fluorescencia (FACS), o el análisis de la expresión génica mediante reacción en cadena de la polimerasa cuantitativa en tiempo real (RT-qPCR) proporciona información importante sobre el estado de diferenciación del cultivo, pero su descripción está más allá del alcance de esta contribución.
- Durante la etapa ALI, verifique la diferenciación evaluando visualmente los cilios que vencen. Estos se pueden observar a través de microscopía estándar de campo claro tan pronto como 9 días después de la exposición al aire en el lado apical de las células.
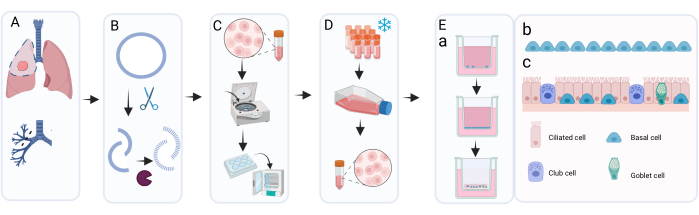
Figura 1: Descripción esquemática del procedimiento de aislamiento, expansión y cultivo de células epiteliales bronquiales primarias . (A) El tejido pulmonar se obtiene durante la cirugía de resección del cáncer y el patólogo extirpa el tejido del anillo bronquial que es macroscópicamente normal y libre de tumor. (B) El anillo bronquial se limpia y se expone a un tratamiento enzimático para desprender y disociar la capa celular. (C) La suspensión celular recuperada se lava y las celdas se distribuyen en pocillos de una placa de 6 pocillos para su expansión. (D) Tras la expansión suficiente de las células aisladas en c-KSFM con Primocina, las capas celulares se disocian por tripsinización y las células se resuspenden en medio de congelación para la criopreservación. Cuando es necesario, las células criopreservadas se descongelan y se expanden nuevamente usando c-KSFM con penicilina/estreptomicina en matraces de cultivo celular. Después de la expansión, se siembran en medio cBD en insertos de cultivo celular; (e bis) El cultivo de ALI-PBEC tiene lugar en dos etapas principales: la etapa sumergida en medio cBD suplementado con 1 nM EC 23 hasta que las células alcancen la confluencia completa, seguida de la eliminación del medio apical y el cultivo en el ALI para permitir la diferenciación; en esta fase ALI, las células se cultivan en medio cBD suplementado con 50 nM EC 23. (Eb) Representación gráfica de las células basales que cubren el inserto durante el cultivo sumergido. (CE) Representación gráfica de la capa celular epitelial diferenciada obtenida tras el cultivo en el ALI en presencia de concentraciones aumentadas de EC 23. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Expansión mediante cultivo sumergido
Usando el método presentado aquí, se puede obtener un promedio de ocho crioviales con 400,000 células / criovial de una placa de 6 pocillos para el almacenamiento a largo plazo en nitrógeno líquido (Figura 2A). Para lograr esto, los PBEC aislados se cultivan en placas de 6 pocillos durante un mínimo de 7 días y un máximo de 14 días (Figura 2B) en presencia de Primocina para excluir la contaminación microbiana (especialmente micoplasma). La Figura 2A,B proporciona información sobre el número de células obtenidas y el tiempo de cultivo requerido entre diferentes aislamientos de varios donantes. Antes de cosechar las células por tripsinización para su almacenamiento en nitrógeno líquido, la confluencia debe ser superior al 80%. Si esto no se logra dentro de los 14 días, las células no deben ser criopreservadas. Es importante destacar que, al recolectar para almacenamiento y paso, la confluencia de la capa celular no debe exceder ~ 95% (Figura 2C). Después del almacenamiento en nitrógeno líquido, las células pueden descongelarse y cultivarse para su expansión hasta que se obtenga un número suficiente de células para cultivos ALU. El medio utilizado para la expansión de las células en esta etapa es c-KSFM, similar al del cultivo inicial después de la cosecha del anillo bronquial18. Sin embargo, no hay necesidad de Primocina en esta etapa, porque el riesgo de contaminación microbiana adicional originada en el tejido pulmonar está ausente y, por lo tanto, Primocina puede cambiarse por penicilina/estreptomicina. Este medio favorece a las células epiteliales sobre los fibroblastos y, por lo tanto, evita un posible crecimiento excesivo del cultivo al proliferar más rápidamentelos fibroblastos 19,20,21. Utilizando el medio c-KSFM, las células se extienden en el matraz y no se conectan entre sí, lo que es marcadamente diferente de la morfología de las células cultivadas sumergidas en esta etapa en medio cBD (Figura 2D, E). Después de 5 o 6 días de cultivo de las células descongeladas en un matraz T75, la capa celular debe ser 80% -95% confluente, lo que se traduce en aproximadamente 3 x 106 células en total (Figura 2F). A partir de esto, se pueden generar aproximadamente 75 insertos (tamaño de placa de 12 pocillos) para el cultivo ALI.
El método de aislamiento y cultivo descrito en esta contribución también se puede adaptar para su uso con biopsias bronquiales o cepillos bronquiales como material de partida.
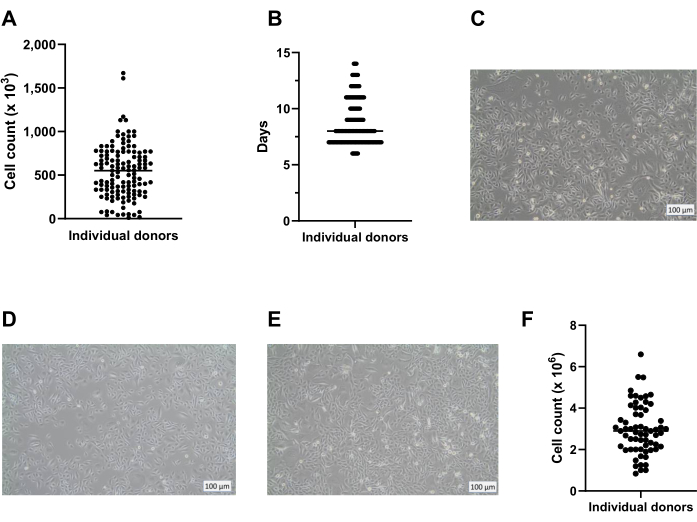
Figura 2: Expansión basocelular antes y después de la criopreservación. Las células se aislaron de acuerdo con el protocolo descrito y se cultivaron utilizando c-KSFM. Se monitoreó el número de células generadas por donante, los recuentos de células vivas se realizaron utilizando un contador celular automatizado (A) al recolectar el paso 0 (P0) células de las placas de 6 pocillos (paso 2 del protocolo), n = 123 donantes, el recuento de células se presentó como el número de células cosechadas por pocillo; Cada punto representa un donante y la mediana se indica mediante una barra horizontal. (B) Como parte del control de calidad, el tiempo requerido por las células P0 para alcanzar una confluencia del 80% al 90% en las placas de 6 pocillos se monitorizó y se mostró como días después de comenzar el cultivo sumergido en c-KSFM (n = 127 donantes diferentes). Cada donante individual se indica con un punto, todos los puntos pertenecientes a 1 día se fusionan en una línea; cuanto más amplia es la línea, más donantes representa; La mediana del número de días que las células están en cultivo se indica mediante una barra horizontal más delgada. (C) Imagen representativa de campo claro de células P0 cultivadas sumergidas en c-KSFM en el momento en que las células fueron cosechadas para la criopreservación a largo plazo. (D) Imagen representativa de campo claro de células P1 cultivadas sumergidas en c-KSFM en el momento en que las células fueron cosechadas y transferidas a insertos y (E) células P1 cultivadas sumergidas en medio cBD. (F) El número de células vivas generadas por donante se controló utilizando un contador de células automatizado al extraer células P1 del matraz T75 (sección 4 del protocolo), n = 63 donantes diferentes; el recuento de células se presenta como el número de células por matraz T75, cada donante se indica con un punto y el recuento medio de células se indica con una barra horizontal. Haga clic aquí para ver una versión más grande de esta figura.
Cultivo de interfaz aire-líquido (ALI)
A los 7 días de comenzar el cultivo ALI, se mide la resistencia eléctrica de la capa celular y debe ser superior a 300 Ω (Figura 3A); Si esto no se logra, el cultivo se considera fallido debido a una posible falta de formación de unión estrecha. Se recomienda excluir la posibilidad de obtener valores bajos de TEER causados por daños en la capa epitelial en insertos individuales como resultado, por ejemplo, del daño a la capa celular durante el lavado y la aspiración. Esto se puede verificar mediante una inspección microscópica visual de los insertos de cultivo. En nuestra experiencia, la variabilidad entre donantes en la resistencia eléctrica puede ser significativa (Figura 3B), que también se relata en la literatura14, y como se observa también está marcadamente influenciada por el origen del medio de águila modificado de Dulbecco (DMEM) utilizado (Figura 3C).
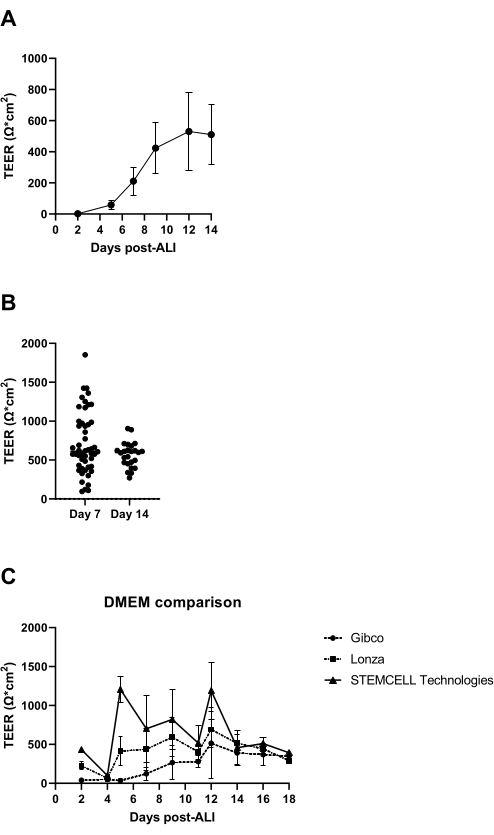
Figura 3: Resistencia eléctrica transepitelial como control de calidad de cultivos ALI-PBEC. Se aislaron y ampliaron los PBEC, y se establecieron cultivos ALI-PBEC bien diferenciados. En varios momentos durante el cultivo, se midió la resistencia eléctrica y, posteriormente, se calculó el TEER (Ω · cm2). (A) La resistencia eléctrica se midió en el transcurso de 14 días después de la LPA. n = 4 donantes diferentes. Los datos se representan como el valor medio ± desviación estándar (DE). (B) Como parte del control de calidad del cultivo celular ALI-PBEC, la resistencia eléctrica se midió en el día 7 (n = 50) y el día 14 después de ALI (n = 25); cada punto representa un donante y la mediana del TEER (Ω·cm2) se indica mediante una barra horizontal. La significancia de los datos se evaluó mediante una prueba no paramétrica de Mann-Whitney, y no se encontraron diferencias significativas. (C) Se probaron medios de tres proveedores diferentes de DMEM para evaluar la influencia en la formación de TEER. n = 4 donantes diferentes; los valores medios se representan ± DE. Haga clic aquí para ver una versión más grande de esta figura.
Mientras se establece un cultivo ALI-PBEC bien diferenciado, desde el inicio de la exposición al aire, la concentración de AR aumenta22. De esta manera, las células cambian de proliferación a diferenciación mucociliar, que es visible tan pronto como 9 días (dependiente del donante) después de la exposición al aire utilizando microscopía de campo claro. El movimiento de los primeros cilios es visible en este punto, y algo antes cuando se basa en la expresión génica de marcadores de células luminales diferenciadas23 (Figura 4).
Como se describe en el protocolo, la producción de moco también se puede observar al enjuagar la superficie apical durante el cambio de medio. La AR es muy sensible a la luz, lo que conduce a una actividad muy variable en la misma concentración de stock. Por esta razón, la AR se sustituye por el análogo sintético de la AR EC 23 y se utiliza en la misma concentración, con resultados similares a los determinados experimentalmente. Por esta razón y para evitar cambiar el procedimiento, la concentración EC 23 seleccionada se mantuvo igual a la concentración de AR (es decir, 50 nM) utilizada anteriormente24,25 (Figura 5). La Figura 5A muestra los valores de TEER alcanzados cuando se utilizan diferentes concentraciones de EC 23, mostrando un TEER máximo a 50 nM dentro de este rango de concentraciones probadas. Los resultados mostrados en la Figura 5B confirman que la expresión génica de los marcadores para células ciliadas y caliciformes es similar cuando se utiliza 50 nM EC 23 o AR. La EC 23 también se requiere durante el cultivo en la etapa sumergida (aunque a una concentración mucho menor), ya que omitirla en esta etapa sumergida y solo agregarla en la etapa ALI da como resultado un cultivo que nunca alcanza la confluencia completa. El tiempo necesario para generar un cultivo ALI-PBEC bien diferenciado con actividad de batido ciliar visible y producción de moco es de alrededor de 14 días, por lo que la mayoría de los experimentos se inician entre cultivos ALI de 14 a 21 días (Figura 4). Todos los principales tipos de células diferentes (células basales, ciliadas, caliciformes y clubes) se observan a los 14 días de cultivo de ALI, aunque los niveles de expresión son altamente dependientes del donante. Esto se demuestra mediante la evaluación de la expresión génica de TP63, FOXJ1, MUC5AC y SCGB1A1 por RT-qPCR, o expresión de proteínas utilizando anticuerpos dirigidos contra p63, α-tubulina, Muc5AC y CC-16 por tinción de fluorescencia inmune (IF), para detectar marcadores de células basales, ciliadas, caliciformes y clubes, respectivamente25,26. Sin embargo, mientras que 14-21 días pueden considerarse como una regla general para la mayoría de los experimentos, para experimentos seleccionados, se puede considerar una mayor duración de la diferenciación, como se encontró para el metabolismo xenobiótico, la infección por SARS-CoV-2 y la evaluación del aclaramiento mucociliar27,28,29.
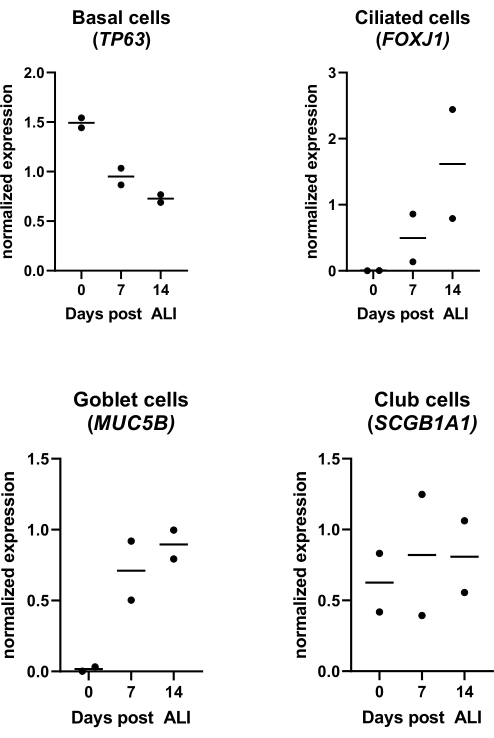
Figura 4: Cultivo de interfaz aire-líquido (ALI). Se aislaron y ampliaron los PBEC, y se establecieron cultivos ALI-PBEC bien diferenciados. Los cultivos de ALI-PBEC se monitorizaron en el transcurso de 14 días después de la LPA. Los cultivos celulares se lisaron para el aislamiento de ARN en los días 0, 7 y 14 post-ALI. Se muestran los datos de dos donantes diferentes, cada punto representa un donante individual monitoreado a lo largo del tiempo, y la mediana se indica con una barra horizontal. La expresión génica de los marcadores basales, ciliados, caliciformes y de células club (TP63, FOXJ1, MUC5B y SCGB1A1, respectivamente) se midió mediante qPCR y se normalizó para la expresión génica de RPL13A y ATP5B (ver referencia 23 para más detalles). Haga clic aquí para ver una versión más grande de esta figura.
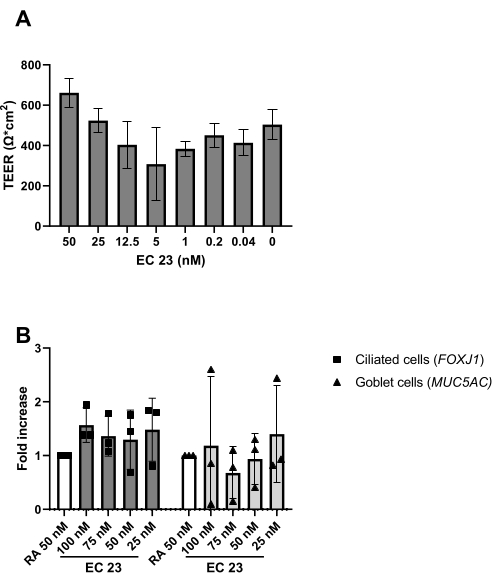
Figura 5: Comparación del ácido retinoico (AR) y su análogo sintético EC 23. Se aislaron y ampliaron los PBEC, y se establecieron cultivos ALI-PBEC bien diferenciados. Al inicio de la exposición al aire de los cultivos PBEC, la AR (50 nM) fue reemplazada por varias concentraciones de EC 23. (A ) La resistencia eléctrica se midió en el día 14 post-ALI y posteriormente se calculó el TEER (Ω·cm 2), n =2 donantes, las barras representan el valor medio ± DE. ( B) En el día 14 post-ALI, los cultivos celulares se lisaron para el aislamiento de ARN y el posterior análisis de expresión génica de marcadores celulares para células respectivamente ciliadas y caliciformes (FOXJ1, MUC5AC) utilizando qPCR, y normalizado para RPL13A (n = 3 donantes). Se muestra un aumento de pliegues contra ALI-PBEC cultivado con 50 nM RA y representado como el valor medio ± DE. (Ver referencia 23 para más detalles) Haga clic aquí para ver una versión más grande de esta figura.
En los últimos años, se ha examinado el rendimiento de productos alternativos en el sistema de cultivo, como los medios y los plásticos de cultivo. Hubo varias razones para tales evaluaciones, incluidos los cambios en la composición del medio por parte de los fabricantes, la introducción de nuevos medios, así como la escasez de productos durante la pandemia de COVID-19 (2020-2022). Se observó que productos similares de diferentes proveedores dan como resultado cultivos de células epiteliales diferenciadas basadas en la evaluación de marcadores de tipos de células epiteliales, aunque la composición celular final puede variar sustancialmente (Figura 6A), mientras que las diferencias en TEER fueron menos pronunciadas (Figura 6B). Por otro lado, el medio de diferentes proveedores dio lugar a diferencias sustanciales en la composición celular; cuando se utilizaron insertos de diferentes marcas, tales diferencias fueron limitadas (Figura 6C). En particular, cuando se utilizó el medio de cultivo de células epiteliales de las vías respiratorias PneumaCult de STEMCELL Technologies, se observó una morfología diferente y una formación más rápida de la actividad ciliar visible. Además de estas observaciones, también se observó una diferencia en los valores de TEER y una diferencia en la composición celular del ALI-PBEC en comparación con el medio cBD (Figura 6D).
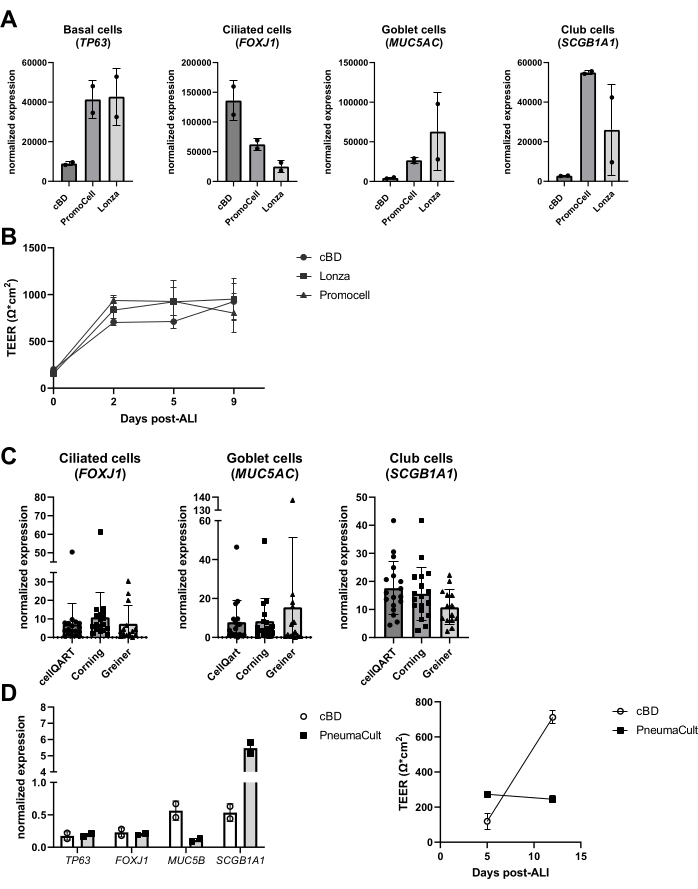
Figura 6: Comparación de diferentes proveedores de medio celular epitelial e insertos de cultivo celular. Se aislaron los PBEC, se expandieron y se establecieron cultivos ALI-PBEC bien diferenciados. (A) Los ALI-PBEC se cultivaron durante 14 días, y luego las capas celulares se lisaron para el aislamiento de ARN. La expresión génica de los marcadores basales, ciliados, caliciformes y de células club (TP63, FOXJ1, MUC5AC y SCGB1A1, respectivamente) se midió mediante qPCR y se normalizó para RPL13A y ATP5B. n = 2 donantes; las barras representan el valor medio ± DE. (B) En el transcurso de 9 días después de la ALI, se midió la resistencia eléctrica y, posteriormente, se calculó el TEER (Ω·cm2). n = 3 donantes diferentes; Los valores medios se representan ± SD. (C) Los ALI-PBEC se cultivaron durante 14 días utilizando insertos de cultivo celular comprados a tres proveedores diferentes, y luego las capas celulares se lisaron para el aislamiento de ARN. La expresión génica de los marcadores ciliados, caliciformes y de células club (FOXJ1, MUC5AC y SCGB1A1, respectivamente) se midió mediante qPCR y se normalizó para RPL13A. n = 18 donantes diferentes, las barras representan el valor medio ± DE. Los datos se probaron para determinar su importancia mediante una prueba de Kruskal-Wallis no paramétrica ANOVA unidireccional y no se encontraron diferencias significativas. (D) Los ALI-PBEC se cultivaron en medio cBD o en medio PneumaCult (tecnologías STEMMCELL) durante 14 días después de ALI, y luego las capas celulares se lisaron para el aislamiento de ARN. La expresión génica de los marcadores basales, ciliados, caliciformes y de células club (TP63, FOXJ1, MUC5B y SCGB1A1, respectivamente) se midió mediante qPCR y se normalizó para RPL13A (las barras representan el valor medio ± DE), y la resistencia eléctrica se midió en los días 5 y 12 post-ALI y se utilizó para calcular el TEER (Ω·cm2). n = 2; el valor medio se representa ± SD (consulte la referencia 23 para obtener más detalles). Haga clic aquí para ver una versión más grande de esta figura.
Tabla complementaria 1: Composición de las soluciones y medios utilizados en el protocolo. Haga clic aquí para descargar este archivo.
Discusión
El protocolo presentado aquí describe el aislamiento de células epiteliales bronquiales humanas a partir de tejido pulmonar resecado, un método para la expansión óptima de células sin pérdida de potencial de diferenciación, un procedimiento de criopreservación y un procedimiento para generar cultivos ALI-PBEC bien diferenciados. Además, se proporciona una descripción del control de calidad, así como instrucciones para el seguimiento y la evaluación de los ALI-PBEC diferenciados.
El protocolo descrito comienza con un anillo bronquial macroscópicamente normal y libre de tumor que se reseca desde un lóbulo pulmonar de pacientes sometidos a cirugía relacionada con su diagnóstico de cáncer de pulmón. Por lo tanto, debe tenerse en cuenta que estos anillos no pueden considerarse estrictamente como tejido sano, lo que puede afectar las características del cultivo celular. Las fuentes alternativas para obtener células epiteliales bronquiales incluyen el uso de biopsias bronquiales, cepillados bronquiales o tejido de un donante de trasplante o pulmones receptores. Independientemente de la fuente, cuando se utiliza tejido pulmonar, se debe considerar un riesgo de contaminación microbiana y, por lo tanto, se utilizan antibióticos en los diferentes medios de cultivo para reducir el riesgo de contaminación microbiana del cultivo celular. En particular, el micoplasma es un riesgo alto y común en el cultivo celular, debido a su amplia variedad de efectos sobre el cultivo celular, la resistencia a los antibióticos comúnmente utilizados en el cultivo celular y el hecho de que la contaminación por micoplasma solo puede confirmarse mediante ensayos de detección de micoplasma. Por lo tanto, en la etapa inicial del cultivo celular después del aislamiento de células del tejido pulmonar, se utiliza la formulación antimicrobiana de amplio espectro Primocin, y durante el proceso de cultivo, se analizan muestras seleccionadas al azar para detectar la presencia de micoplasma.
El procedimiento de aislamiento que comienza con un anillo bronquial proporciona suficiente material de partida para permitir el grado de expansión de estas células primarias necesarias para iniciar cultivos en el ALI sin comprometer la capacidad de diferenciación. Sin embargo, comenzar la expansión de las células epiteliales aisladas con un número limitado de células puede plantear problemas para obtener un número suficiente de insertos con suficientes células que puedan sembrarse para el cultivo de ALI. El cultivo prolongado y el paso repetido de células primarias pueden dar lugar a senescencia replicativa. Se han propuesto varias soluciones para superar esta limitación. Horani et al. demostraron que el inhibidor de la quinasa Rho (ROCK) Y-27632 aumentó la proliferación de células basales30, Mou et al. utilizaron la inhibición dual de Smad para expandir las células madre basales manteniendo las características de la capa de células epiteliales diferenciadas 31, y Sachs et al. han desarrollado un sistema organoide de las vías respiratorias que puede usarse para expandir las células epiteliales de las vías respiratorias y mantener su potencial de diferenciación en el transcurso de múltiples pasajes32. Este último método también se utilizó para expandir las células de fuentes con un número de células muy bajo, como aspirados traqueales (AT) de lactantes prematuros (33. Se encontró que las células aisladas de BAL y TAs mostraron una capacidad de diferenciación similar a las células generadas a partir de tejido bronquial, aunque se observaron diferencias cuando la diferenciación estaba sesgada hacia cultivos más ciliados o más caliciformes que contenían células utilizando la inhibición de señalización Notch o la citoquina Th2 IL-1333. Por lo tanto, se recomienda que si los ALI-PBEC se cultivan a partir de un material de partida con un bajo número de células epiteliales utilizando enfoques similares, siempre verifique los cultivos para los criterios básicos de calidad, como se discute en la sección 6 del protocolo. Es importante destacar que el uso de células alimentadoras también puede ayudar a obtener números de células más grandes, lo cual es esencial en un entorno para la ingeniería de andamios trasplantables donde el tiempo y el número de células son esenciales. Esto se ilustra con un estudio en el que se cultivaron células epiteliales autólogas a partir de biopsias derivadas de un paciente con enfermedad traqueal y las células se expandieron rápidamente en presencia de una capa alimentadora embrionaria murina (fibroblastos 3T3-J2 mitóticamente inactivados) y el inhibidor de la vía Rho/ROCK antes mencionado (Y-27632)34. Se encontró que el cultivo celular resultante era útil para la repoblación de andamios traqueales, y por lo tanto esto podría verse como un protocolo adecuado para un modelo de trasplante.
Cuando se utiliza el protocolo descrito en esta contribución, pero también cuando se utilizan otros protocolos de cultivo, inevitablemente se introduce un sesgo de selección. Es importante darse cuenta de que las diferencias en los detalles del protocolo, como el origen de las células utilizadas para iniciar cultivos, la composición del medio y otros detalles del protocolo, pueden conducir a cambios en la composición celular de los cultivos y, por lo tanto, cambios en la respuesta del cultivo ALI33,35. Además, también se han observado diferencias en las propiedades celulares al comparar diferentes medios para diferenciar las células de la vía aérea10,11. Al comparar PneumaCult y el medio cBD, se observaron diferencias en los marcadores de ARNm de células caliciformes y células club, valores de TEER y grosor de la capa celular. En base a estas observaciones, a pesar de la falta de sustento estadístico, debido al bajo número de donantes utilizados, la composición del medio es desconocida para los clientes y los mayores costos del medio PneumaCult, se tomó la decisión en nuestro laboratorio de utilizar el medio cBD.
Como se discutió, las células pueden expandirse inicialmente utilizando cultivo de organoides y posteriormente transferirse al sistema de inserción ALI 2D. Esto es importante, ya que los organoides epiteliales de las vías respiratorias no son adecuados para la exposición a sustancias en el aire, mientras que el uso del sistema ALI 2D permite evaluar el impacto de sustancias en suspensión como el humo del cigarrillo23,36 en las células epiteliales cultivadas de las vías respiratorias. Un enfoque diferente para establecer cultivos de células epiteliales de las vías respiratorias ALI es generar células epiteliales de las vías respiratorias mediante la diferenciación de células madre pluripotentes humanas (hiPSCs)37. En tales protocolos, en la etapa final del protocolo de diferenciación después de la diferenciación a progenitores de la vía aérea proximal, las células pueden diferenciarse por cultivo a la ALI utilizando procedimientos similares a los descritos aquí.
En el protocolo actual, el medio cBD se utiliza para la cultura en el ALI. El medio cBD es un medio sin suero que se prepara añadiendo una mezcla de diferentes suplementos, inspirado en Fulcher et al.38 así como en otros estudios. La solución suplementaria contiene 52 μg/ml de extracto hipofisario bovino (BPE), 0,5 μg/ml de hidrocortisona, 0,5 ng/ml de EGF humano, 0,5 μg/ml de epinefrina, 10 μg/ml de transferrina, 5 μg/ml de insulina, 6,5 ng/ml de triyodotironina y 0,1 ng/ml de RA39. Dado que el BPE es un extracto tisular y está sujeto a variaciones por lotes, el medio no puede considerarse como un medio completamente definido, ni está libre de animales. Se prefiere el medio de cultivo celular que está completamente definido para minimizar las diferencias de lote a lote. En vista de la transición a la investigación libre de animales, es importante que se realicen esfuerzos para producir medios definidos que no contengan productos animales y que sean asequibles para la comunidad científica.
Se pueden usar varias configuraciones experimentales basadas en el modelo ALI, dependiendo de la pregunta de investigación. Por ejemplo, para investigar el impacto de los compuestos que pueden influir en el proceso de diferenciación, esto se puede abordar agregando los compuestos al cultivo durante las diferentes etapas del cultivo sumergido, durante la diferenciación o en la etapa bien diferenciada. La composición celular del cultivo ALI-PBEC puede ser influenciada por la adición de compuestos específicos; por ejemplo, la diferenciación de ALI-PBEC en presencia de IL-13 genera un cultivo con más células caliciformes y menos células ciliadas, mientras que el tratamiento con el inhibidor de la γ-secretasa DAPT (utilizado para bloquear la señalización de Notch) durante la diferenciación da como resultado un cultivo con más células ciliadas a expensas de las células caliciformes 23,40,41,42.
Además, los agentes para estimular las células o bloquear ciertos procesos se pueden aplicar al compartimiento basal o (en un volumen muy pequeño) al compartimento apical del cultivo. Las células también pueden estar expuestas a sustancias en el aire desde el lado apical. Tales diseños de exposición se han utilizado para estudiar el efecto del escape diesel o del humo entero del cigarrillo en los PBEC23,43,44. El medio se puede cosechar cada vez que se cambia el medio para monitorear las proteínas secretadas en el lado basal; lo mismo se aplica para el lado apical de las células que se lava con PBS mientras se refresca el medio basal. Se cosecha el llamado lavado apical y se agrega ditioeritritol opcional (DTE) para disociar el moco producido por las células caliciformes de manera más eficiente. Se pueden obtener lisados celulares para el aislamiento de proteínas totales, ARN y ADN cromosómico y mitocondrial. Las células pueden ser estudiadas más a fondo utilizando anticuerpos para marcadores específicos, cortando la membrana de tereftalato de polietileno (PET) del inserto de plástico y cortando aún más esta membrana en trozos más pequeños para múltiples tinciones de inmunofluorescencia45. Además, la citometría de flujo o FACS también se puede utilizar después de la tripsinización de las células en los insertos. Durante la etapa ALI, el desarrollo de la barrera celular se puede monitorear midiendo la resistencia eléctrica y calculando posteriormente el TEER, donde la resistencia eléctrica es inversamente proporcional al área superficial del inserto de membrana. El cálculo se basa en la ley de Ohm utilizando la siguiente fórmula: 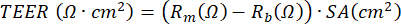 , donde Rm es la resistencia eléctrica medida, Rb es la resistencia eléctrica de referencia de un inserto sin recubrimiento y células, y SA es el área superficial de la membrana del inserto. La medición de la resistencia eléctrica utilizando electrodos EVOM2 y STX / palillos es sencilla, pero depende en gran medida de los procedimientos de manipulación al introducirlo en el pozo. Además, se ha sugerido que la forma del electrodo afecta la medición de la función de barrera del área de superficie relativamente grande17.
, donde Rm es la resistencia eléctrica medida, Rb es la resistencia eléctrica de referencia de un inserto sin recubrimiento y células, y SA es el área superficial de la membrana del inserto. La medición de la resistencia eléctrica utilizando electrodos EVOM2 y STX / palillos es sencilla, pero depende en gran medida de los procedimientos de manipulación al introducirlo en el pozo. Además, se ha sugerido que la forma del electrodo afecta la medición de la función de barrera del área de superficie relativamente grande17.
La mejora adicional en el sistema de cultivo celular ALI, dirigido a aumentar la representación tisular precisa, incluye el cocultivo de tipos celulares adicionales como leucocitos, fibroblastos o células endoteliales46,47,48. Se ha observado que ese cocultivo de ALI-PBEC con factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) o macrófagos diferenciados por M-CSF afecta marcadamente las respuestas epiteliales innatas y la reparación48. Es importante tener en cuenta que en tales modelos de cocultivo, la compatibilidad del medio puede ser un problema. Dado que el medio utilizado para el cultivo de células epiteliales de las vías respiratorias se desarrolla específicamente para PBEC y puede no ser adecuado para otros tipos de células, es necesaria la optimización. Otro tipo de avance observado en el campo de la biología de las vías respiratorias para el cual se pueden usar PBEC aislados es el uso de la tecnología Organs-on-Chips (OoC)49,50. Utilizando esta tecnología, se puede estudiar la influencia de las fuerzas mecánicas de la respiración y el flujo sanguíneo, como el estiramiento, el aire y el flujo medio29.
La variabilidad entre donantes puede ser significativa cuando se utilizan PBEC de varios donantes y, por lo tanto, es importante considerar el uso de células de varios donantes para tener en cuenta esta variabilidad en los estudios de cultivo de células epiteliales. Dado que el cultivo de ALI-PBEC requiere mucho tiempo y se asocia con costos considerables, se examina la opción de establecer cultivos ALI-PBEC mezclando células de diferentes donantes en un inserto de cultivo celular. De esta manera, los experimentos piloto se pueden realizar fácilmente utilizando células primarias, antes de analizar las respuestas de cultivos derivados de varios donantes individuales. Además, los donantes con diferentes características (por ejemplo, diferente categoría de edad o sexo) pueden agruparse para estudios exploratorios. Cuando se utilizan mezclas de donantes, es importante asegurarse de que haya el mismo número de células de diferentes donantes, para evitar la posibilidad de que un donante domine los resultados como resultado de una mayor tasa de proliferación. Por lo tanto, las células de donantes individuales se expanden por separado y se siembran a una densidad más alta en el inserto en comparación con las células de siembra de un donante individual, para minimizar la proliferación en el inserto antes de la transición al LPA. Las respuestas de las mezclas de donantes y los donantes individuales correspondientes se compararon mediante el estudio de la cinética de infección del SARS-CoV-2. Utilizando RT-qPCR y tinción por inmunofluorescencia, se observó que la mezcla de donantes proporcionó una buena representación de los diversos donantes individuales, al mostrar un número similar de partículas de virus producidas y un número similar de células infectadas28.
Para convertirse en una alternativa aceptable para los modelos animales, la edición génica de células epiteliales bronquiales cultivadas debe ser factible51. Se examina la tecnología de interferencia de ARN mediante el uso de pequeños ARN interferentes (ARNsi) en ALI-PBECs, sin embargo, dado que las células necesitan ser transfectadas con ARNip durante la fase sumergida del cultivo, la eliminación no se mantiene suficientemente durante el cultivo de ALI debido a la larga duración del cultivo, a menos que la transfección de ARNip se repita con frecuencia durante el cultivo52. Sin embargo, los ARNip se pueden utilizar con éxito para modificar la expresión génica en células basales sumergidas. Otros han utilizado con éxito la tecnología CRISPR/Cas9 para lograr la edición de genes en cultivos primarios de células epiteliales de las vías respiratorias ALI con administración de ribonucleoproteína (RNP) 53. Cuando se utilizan tales técnicas, es esencial que las células mantengan su capacidad de diferenciación completa. Debido a que los cultivos celulares primarios de las vías respiratorias no se pueden pasar indefinidamente, la expansión clonal de las células editadas genéticamente no es fácil y la adición de medio para seleccionar las células transfectadas es engorrosa. Por lo tanto, es difícil lograr el knockdown deseable en todas las células cultivadas. Una alternativa para generar clones knockout es el uso de estrategias knock-out en hiPSCs54 y el uso de estas células para generar células epiteliales de la vía aérea. Otra alternativa, aunque subóptima, es establecer una línea PBEC inmortalizada para expandir clonalmente las células editadas genéticamente55.
El protocolo presentado aquí es una forma de generar un ALI-PBEC pseudoestratificado bien diferenciado, pero también se han encontrado otros protocolos para establecer tal cultura, con diferencias cada vez mayores en comparación con el protocolo presentado. En nuestra opinión, la validación en el laboratorio de los métodos de cultivo y el estricto control de calidad son esenciales para que el sistema ALI-PBEC y sistemas de cultivo similares de células epiteliales de las vías respiratorias se conviertan en una alternativa válida para los experimentos con animales.
Divulgaciones
Los autores declaran que no tienen conflictos de intereses relevantes.
Agradecimientos
Los estudios que utilizan el modelo descrito en esta contribución han sido apoyados por una variedad de organizaciones de financiación, incluida la Fundación del Pulmón de los Países Bajos, la Organización Holandesa para la Investigación y el Desarrollo en Salud (ZonMw, subvención COVID-19 MKMD), la Sociedad Holandesa para el Reemplazo de Pruebas con Animales (Stichting Proefdiervrij, subvención # 114025007), así como subvenciones de investigación de compañías como Boehringer Ingelheim y Galápagos. La figura 1 se creó con BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,000 ohm test resistor | World Precision Instruments | N/A | Used to calibrate the EVOM2 Epithelial Voltohmmeter |
| 4-[2-(5,6,7,8-Tetrahydro-5,5,8,8-tetramethyl-2-naphthalenyl)ethynyl)-benzoic acid (EC 23) | Tocris | 4011 | Used in cBD medium |
| 6-well Clear TC-treated Multiple Well Plates | Corning | 3506 | Used in the first step to grow the cells isolated form the bronchial ring |
| Airway Epithelial Cell Growth Medium Kit | PromoCell | C-21160 | Used to compare to cBD medium |
| Bead Bath 20 Liter | Lab Armor | 74220-720 | Used to pre-warm cell culture solutions |
| BEGM Bronchial Epithelial Cell Growth Medium BulletKit | LONZA | CC-3170 | Used to compare to cBD medium |
| Bovine albumin fraction V (BSA) | Thermo Fisher Scientific | 15260037 | Used in coating solution |
| Bovine pituitary extract (BPE) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Bronchial epithelial cell growth supplement (BEpiCGS) | ScienCell Research Laboratories | 3262 | Used in cBD medium |
| Bronchial epithelial cell medium-basal (BEpiCM-b) | ScienCell Research Laboratories | SCC3211-b | Used in cBD medium |
| Cell culture inserts; 12 mm Transwell with 0.4 µm pore polyester membrane insert | Corning | 3460 | Cell culture inserts used in the protocol |
| Cell culture inserts; 12-well inserts, 0.4 µm PET clear | CellQART made by SABEU | 9310412 | Cell culture inserts used to compare with Corning cell culture inserts |
| Cell culture inserts; 12-well ThinCert Tissue culture Inserts | Greiner Bio-One | 82050-032 | Cell culture inserts used to compare with Corning cell culture inserts |
| CELLSTAR flask, TC, PS, 250 ml, 75 cm2 | Greiner Bio-One | 658170 | Used to expand the number cells |
| CFX Maestro 1.0 | Bio-Rad | N/A | Software program for analyzing qPCR data generated with the CFX384 System |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad | 1855484 | qPCR detection system |
| Chopstick electrode set | World Precision Instruments | STX2 | Used to measure electrical resistance in ALI-PBEC |
| CO2-Incubator | PHCbi | MCO-170AICUV-PE | Cell culture incubator used for mycplasma free cell cultures |
| CO2-Incubator | Hereaus | Heracell 150 | Cell culture incubator used for possibly mycplasma infected cell cultures |
| Coolcell Container | Corning | 432006 | Used to cryopreserve cells at -80 °C before transfer to liquid N2 |
| Countess 3 Automated cell counter | Thermo Fisher Scientific | AMQAX2000 | Used to count cells and determine the cell concentration |
| Cryovials | Nalgene | 479-3224 | Used to cryopreserve cells in |
| D-Glucose | Avantor VWR BDH CHEMICALS | 101174Y | Used in soft trypsin |
| Dimethyl sulfoxide (DMSO) | Avantor VWR | 0231 | Used in cell freeze medium |
| dNTP (10 mM) | Promega | U1515 | Used in the synthesis of cDNA |
| Dulbecco's Modified Eagle's Medium (DMEM) + 4500 mg/l D-Glucose | STEMCELL Technologies | 36250 | Used in cBD medium |
| Dulbecco's Modified Eagle's Medium (DMEM) 4.5 g/l glucose with l-glutamine | LONZA | LOBE12-604F | Used in cBD medium to compare with DMEM from other manufacturers |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, pyruvate | Thermo Fisher Scientific | 41966029 | Used in cBD medium to compare with DMEM from other manufacturers |
| Epidermal growth factor (EGF) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Ethylenediaminetetraacetic acid (EDTA) | Avantor VWR BDH CHEMICALS | 443885J | Used in soft trypsin |
| EVOM2 Epithelial Voltohmmeter | World Precision Instruments | 91799 | Used with the chopstick electrode set to measure electrical resistance in ALI-PBEC |
| Fibronectin solution, Human | PromoCell | C-43060 | Used in coating solution |
| Glutamax | Thermo Fisher Scientific | 35050038 | Used in cBD medium |
| Hanks balanced salt solution (HBSS) | ScienCell Research Laboratories | SCC0313 | Used to dissolve protease XIV |
| IQ SYBR Green Super mix | Bio-Rad | 170887 | qPCR reagent |
| Isoproterenol hydrochloride, (-)- | Sigma-Aldrich | I-6504 | Used in c-KSFM |
| Keratinocyte-SFM (KSFM) | Thermo Fisher Scientific | 17005-034 | Used in c-KSFM |
| Maxwell RSC Instrument | Promega | AS4500 | Automated RNA isolation system |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | Used to isolate total RNA with the Maxwell RSC Instrument |
| M-MLV Reverse transcriptase | Promega | M5301 | Used in the synthesis of cDNA |
| M-MLV Reverse transcriptase 5X reaction buffer | Promega | M531A | Used in the synthesis of cDNA |
| MycoStrip | InvivoGen | rep-mys-10 | Used to detect the presence of mycoplasma in cell culture samples |
| N-2-hydroxyethylpiperazine-N-2-ethane sulfonic acid (HEPES) | Thermo Fisher Scientific | 15630056 | Used in cBD medium |
| Oligo(dT)15 | Qiagen | 79237 | Used in the synthesis of cDNA |
| Penicillin/Streptomycin solution (Pen/Strep) | ScienCell Research Laboratories | SCC0513 | Used as antibiotic in c-KSFM and cBD medium |
| Phosphate buffered saline (PBS) | LUMC pharmacy | N/A | Used in different steps of the protocol |
| Pneumacult-ALI Medium | STEMCELL Technologies | 05002 | Used to grow cells in the differentiation stage to compare to cBD medium |
| Pneumacult-Ex Plus Medium | STEMCELL Technologies | 05040 | Used to grow cells in the submerged stage to compare to cBD medium |
| Primer, ATP5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: TCACCCAGGCTGGTTCAGA |
| Primer, ATP5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGTGGCCAGGGTAGGCTGAT |
| Primer, FOXJ1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGAGGGGACGTAAATCCCTA |
| Primer, FOXJ1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TTGGTCCCAGTAGTTCCAGC |
| Primer, MUC5AC, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCTTCGACGGACAGAGCTAC |
| Primer, MUC5AC, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCTCGGTGACAACACGAAAG |
| Primer, MUC5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGGCTTTGACAAGAGAGT |
| Primer, MUC5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGGATGGTCGTGTTGATGCG |
| Primer, RPL13A, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: AAGGTGGTGGTCGTACGCTGTG |
| Primer, RPL13A, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: CGGGAAGGGTTGGTGTTCATCC |
| Primer, SCGB1A1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: ACATGAGGGAGGCAGGGGCTC |
| Primer, SCGB1A1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: ACTCAAAGCATGGCAGCGGCA |
| Primer, TP63, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCACCTGGACGTATTCCACTG |
| Primer, TP63, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCGAATCAAATGACTAGGAGGGG |
| Primocin | InvivoGen | ant-pm-2 | Used as antimicrobial agent against bacteria, mycoplasma, and fungi in c-KSFM medium |
| Protease XIV | Sigma-Aldrich | P5147 | Used for the enzymatic treatment of the bronchial ring |
| RNAsin Recombinant Ribonuclease inhibitor | Promega | N2515 | Used in the synthesis of cDNA |
| Soybean trypsin inhibitor (SBTI) | Sigma-Aldrich | T9128 | Used to inhibit the action of soft trypsin |
| T100 Thermal Cycler | Bio-Rad | 1861096 | Used in the synthesis of cDNA |
| TissueSAFE plus | MILESTONE MEDICAL | N/A | Vacuum transfer system for biological specimens |
| Trypan blue solution | Thermo Fisher Scientific | 15250061 | Used to count live- and dead cells |
| Trypsin 1:250 | Thermo Fisher Scientific | 27250-018 | Used in soft trypsin |
| Type I collagen solution (PureCol) | Advanced BioMatrix | 5005-B | Used in coating solution |
| Universal container, PP, with PE screw cap | Avantor VWR | 216-2053 | Used in the protocol for the Protease XIV treatment of the bronchial ring |
Referencias
- Aghapour, M., et al. Role of air pollutants in airway epithelial barrier dysfunction in asthma and COPD. European Respiratory Review. 31 (163), 210112 (2022).
- de Waal, A. M., Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Duchesne, M., Okoye, I., Lacy, P. Epithelial cell alarmin cytokines: Frontline mediators of the asthma inflammatory response. Frontiers in Immunology. 13, 975914 (2022).
- Hewitt, R. J., Lloyd, C. M. Regulation of immune responses by the airway epithelial cell landscape. Nature Reviews Immunology. 21 (6), 347-362 (2021).
- Ruysseveldt, E., Martens, K., Steelant, B. Airway basal cells, protectors of epithelial walls in health and respiratory diseases. Frontiers in Allergy. 2, 787128 (2021).
- Alysandratos, K. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Hammad, H., Lambrecht, B. N. Barrier epithelial cells and the control of type 2 immunity. Immunity. 43 (1), 29-40 (2015).
- Hynds, R. E., Bonfanti, P., Janes, S. M. Regenerating human epithelia with cultured stem cells: feeder cells, organoids and beyond. EMBO Molecular Medicine. 10 (2), 139-150 (2018).
- Hiemstra, P. S., Tetley, T. D., Janes, S. M. Airway and alveolar epithelial cells in culture. The European Respiratory Journal. 54 (5), 1900742 (2019).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), 2137 (2020).
- Leung, C., Wadsworth, S. J., Yang, S. J., Dorscheid, D. R. Structural and functional variations in human bronchial epithelial cells cultured in air-liquid interface using different growth media. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1063-L1073 (2020).
- Morgan, R., et al. A medium composition containing normal resting glucose that supports differentiation of primary human airway cells. Scientific Reports. 12 (1), 1540 (2022).
- Ghosh, B., et al. Strong correlation between air-liquid interface cultures and in vivo transcriptomics of nasal brush biopsy. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1056-L1062 (2020).
- Pezzulo, A. A., et al. The air-liquid interface and use of primary cell cultures are important to recapitulate the transcriptional profile of in vivo airway epithelia. American Journal of Physiology. Lung Cellular and Molecular Physiology. 300 (1), L25-L31 (2011).
- Dvorak, A., Tilley, A. E., Shaykhiev, R., Wang, R., Crystal, R. G. Do airway epithelium air-liquid cultures represent the in vivo airway epithelium transcriptome. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 465-473 (2011).
- Legebeke, J., et al. Temporal whole-transcriptomic analysis of characterized in vitro and ex vivo primary nasal epithelia. Frontiers in Cell and Developmental Biology. 10, 907511 (2022).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- van Wetering, S., et al. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. Journal of Investigative Medicine. 48 (5), 359-366 (2000).
- Balk, S. D. Calcium as a regulator of the proliferation of normal, but not of transformed, chicken fibroblasts in a plasma-containing medium. Proceedings of the National Academy of Sciences. 68 (2), 271-275 (1971).
- Gail, M. H., Boone, C. W., Thompson, C. S. A calcium requirement for fibroblast motility and prolifertion. Experimental Cell Research. 79 (2), 386-390 (1973).
- Dulbecco, R., Elkington, J. Induction of growth in resting fibroblastic cell cultures by Ca. Proceedings of the National Academy of Sciences. 72 (4), 1584-1588 (1975).
- van Wetering, S., et al. Epithelial differentiation is a determinant in the production of eotaxin-2 and -3 by bronchial epithelial cells in response to IL-4 and IL-13. Molecular Immunology. 44 (5), 803-811 (2007).
- Amatngalim, G. D., et al. Aberrant epithelial differentiation by cigarette smoke dysregulates respiratory host defence. The European Respiratory Journal. 51 (4), 1701009 (2018).
- Christie, V. B., et al. Retinoid supplementation of differentiating human neural progenitors and embryonic stem cells leads to enhanced neurogenesis in vitro. Journal of Neuroscience Methods. 193 (2), 239-245 (2010).
- Schrumpf, J. A., Ninaber, D. K., vander Does, A. M., Hiemstra, P. S. TGF-β1 impairs vitamin D-induced and constitutive airway epithelial host defense mechanisms. Journal of Innate Immunity. 12 (1), 74-89 (2020).
- Schrumpf, J. A., et al. Proinflammatory cytokines impair vitamin D-induced host defense in cultured airway epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (6), 749-761 (2017).
- Boei, J. J. W. A., et al. Xenobiotic metabolism in differentiated human bronchial epithelial cells. Archives of Toxicology. 91 (5), 2093-2105 (2017).
- Wang, Y., et al. Impact of human airway epithelial cellular composition on SARS-CoV-2 infection biology. bioRxiv. , (2021).
- Nawroth, J. C., et al. Breathing on Chip: Dynamic flow and stretch tune cellular composition and accelerate mucociliary maturation of airway epithelium in vitro. bioRxiv. , (2022).
- Horani, A., Nath, A., Wasserman, M. G., Huang, T., Brody, S. L. Rho-associated protein kinase inhibition enhances airway epithelial Basal-cell proliferation and lentivirus transduction. American Journal of Respiratory Cell and Molecular Biology. 49 (3), 341-347 (2013).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Eenjes, E., et al. Disease modeling following organoid-based expansion of airway epithelial cells. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (4), L775-L786 (2021).
- Butler, C. R., et al. Rapid expansion of human epithelial stem cells suitable for airway tissue engineering. American Journal of Respiratory and Critical Care Medicine. 194 (2), 156-168 (2016).
- Amatngalim, G. D., et al. Antibacterial defense of human airway epithelial cells from chronic obstructive pulmonary disease patients induced by acute exposure to nontypeable Haemophilus influenzae: modulation by cigarette smoke. Journal of Innate Immunity. 9 (4), 359-374 (2017).
- Plebani, R., et al. 3D lung tissue models for studies on SARS-CoV-2 pathophysiology and therapeutics. International Journal of Molecular Sciences. 23 (17), 10071 (2022).
- Wong, A. P., et al. Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein. Nature Biotechnology. 30 (9), 876-882 (2012).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Biology. 107, 183-206 (2005).
- Cao, J., Wong, C. K., Yin, Y., Lam, C. W. K. Activation of human bronchial epithelial cells by inflammatory cytokines IL-27 and TNF-alpha: implications for immunopathophysiology of airway inflammation. The Journal of Cellular Physiology. 223 (3), 788-797 (2010).
- Tsao, P. N., et al. Notch signaling controls the balance of ciliated and secretory cell fates in developing airways. Development. 136 (13), 2297-2307 (2009).
- Laoukili, J., et al. IL-13 alters mucociliary differentiation and ciliary beating of human respiratory epithelial cells. The Journal of Clinical Investigation. 108 (12), 1817-1824 (2001).
- Mertens, T. C. J., et al. Cigarette smoke differentially affects IL-13-induced gene expression in human airway epithelial cells. Physiological Reports. 5 (13), e13347 (2017).
- Zarcone, M. C., et al. Effect of diesel exhaust generated by a city bus engine on stress responses and innate immunity in primary bronchial epithelial cell cultures. Toxicology in Vitro. 48, 221-231 (2018).
- vander Does, A. M., et al. Early transcriptional responses of bronchial epithelial cells to whole cigarette smoke mirror those of in-vivo exposed human bronchial mucosa. Respiratory Research. 23 (1), 227 (2022).
- Wang, Y., Ninaber, D. K., van Schadewijk, A., Hiemstra, P. S. Tiotropium and fluticasone inhibit rhinovirus-induced mucin production via multiple mechanisms in differentiated airway epithelial cells. Frontiers in Cellular and Infection Microbiology. 10, 278 (2020).
- Ronaghan, N. J., et al. M1-like, but not M0- or M2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), 0276013 (2022).
- Gindele, J. A., et al. Opposing effects of in vitro differentiated macrophages sub-type on epithelial wound healing. PLoS One. 12 (9), e0184386 (2017).
- van Riet, S., et al. Modulation of airway epithelial innate immunity and wound repair by M(GM-CSF) and M(M-CSF) macrophages. Journal of Innate Immunity. 12 (5), 410-421 (2020).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Stucki, A. O., et al. A lung-on-a-chip array with an integrated bio-inspired respiration mechanism. Lab on a Chip. 15 (5), 1302-1310 (2015).
- Peters-Hall, J. R., et al. Long-term culture and cloning of primary human bronchial basal cells that maintain multipotent differentiation capacity and CFTR channel function. American Journal of Physiology. Lung Cellular and Molecular Physiology. 315 (2), L313-L327 (2018).
- Bartman, C. M., Stelzig, K. E., Linden, D. R., Prakash, Y. S., Chiarella, S. E. Passive siRNA transfection method for gene knockdown in air-liquid interface airway epithelial cell cultures. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), L280-L286 (2021).
- Koh, K. D., et al. Efficient RNP-directed human gene targeting reveals SPDEF is required for IL-13-induced mucostasis. American Journal of Respiratory Cell and Molecular Biology. 62 (3), 373-381 (2020).
- Bhargava, N., et al. Development of an efficient single-cell cloning and expansion strategy for genome edited induced pluripotent stem cells. Molecular Biology Reports. 49 (8), 7887-7898 (2022).
- Angelopoulou, A., Papaspyropoulos, A., Papantonis, A., Gorgoulis, V. G. CRISPR-Cas9-mediated induction of large chromosomal inversions in human bronchial epithelial cells. STAR Protocols. 3 (2), 101257 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados