Method Article
Isolando Células Epiteliais Brônquicas de Tecido Pulmonar Ressecado para Biobanco e Estabelecendo Culturas de Interface Ar-Líquido Bem Diferenciadas
Neste Artigo
Resumo
Apresentamos aqui um método reprodutível, acessível e robusto para o isolamento e expansão de células epiteliais brônquicas primárias para biobanco de longo prazo e geração de células epiteliais diferenciadas por cultura na interface ar-líquido.
Resumo
A camada de células epiteliais das vias aéreas forma a primeira barreira entre o tecido pulmonar e o ambiente externo e, portanto, é constantemente exposta a substâncias inaladas, incluindo agentes infecciosos e poluentes atmosféricos. A camada epitelial das vias aéreas desempenha um papel central em uma grande variedade de doenças pulmonares agudas e crônicas, e vários tratamentos direcionados a esse epitélio são administrados por inalação. A compreensão do papel do epitélio na patogênese e como ele pode ser direcionado para terapia requer modelos robustos e representativos. Modelos de cultura epitelial in vitro são cada vez mais utilizados e oferecem a vantagem de realizar experimentos em ambiente controlado, expondo as células a diferentes tipos de estímulos, tóxicos ou agentes infecciosos. O uso de células primárias ao invés de linhagens celulares imortalizadas ou tumorais tem a vantagem de que essas células se diferenciam em cultura para uma camada de células epiteliais polarizadas pseudoestratificadas com melhor representação do epitélio em relação às linhagens celulares.
Apresenta-se aqui um protocolo robusto, que vem sendo otimizado nas últimas décadas, para o isolamento e cultura de células epiteliais das vias aéreas a partir de tecido pulmonar. Este procedimento permite o sucesso do isolamento, expansão, cultura e diferenciação mucociliar de células epiteliais brônquicas primárias (PBECs) por meio de cultura na interface ar-líquido (LPA) e inclui um protocolo para biobanco. Além disso, a caracterização dessas culturas utilizando genes marcadores específicos de células é descrita. Essas culturas de ALI-PBEC podem ser usadas para uma variedade de aplicações, incluindo exposição à fumaça de cigarro inteiro ou mediadores inflamatórios, e co-cultura/infecção por vírus ou bactérias.
Espera-se que o protocolo fornecido neste manuscrito, ilustrando o procedimento de forma passo a passo, forneça uma base e/ou referência para aqueles interessados em implementar ou adaptar tais sistemas de cultura em seu laboratório.
Introdução
O papel do epitélio das vias aéreas em uma variedade de doenças pulmonares agudas e crônicas tem sido descrito em várias revisões 1,2,3,4,5,6,7. Culturas bem diferenciadas de células epiteliais das vias aéreas são uma importante ferramenta para desvendar o papel do epitélio das vias aéreas. A cultura de células epiteliais das vias aéreas da interface ar-líquido (LPA) é amplamente aplicada para promover a diferenciação das células epiteliais basais das vias aéreas e, assim, estudar o epitélio das vias aéreas de forma confiável in vitro 8,9. Nos últimos anos, o uso de tais modelos aumentou ainda mais como resultado de novas iniciativas de pesquisa relacionadas à pandemia COVID-19 e uma transição mundial para a pesquisa livre de animais. Portanto, o aumento do uso dessa linhagem celular modelo enfatiza a necessidade de compartilhamento de procedimentos e experiências para a obtenção de resultados robustos. Isso também permitirá a comparação dos resultados entre os grupos de pesquisa. A robustez do procedimento é a principal característica e, portanto, precisa ser submetida a um controle de qualidade. Vários laboratórios têm investido no desenvolvimento de protocolos para a cultura de células epiteliais primárias das vias aéreas na LPA. O tempo, o esforço e o orçamento necessários podem ser reduzidos quando esses procedimentos são compartilhados em detalhes. Esses detalhes incluem, por exemplo, a escolha dos plásticos e meios de cultura celular fornecidos por vários fabricantes, uma vez que se verificou que isso influencia as características das culturas obtidas10,11,12. Isso ressalta a importância de compartilhar experiências e detalhes dos procedimentos de cultura, uma vez que, na ausência de tais insights, os resultados podem ser afetados e/ou os esforços de validação em vários laboratórios podem ser prejudicados.
O epitélio pulmonar humano compreende vários tipos celulares, incluindo os principais tipos como células basais, células ciliadas, células caliciformes e células club. Para mimetizar de forma confiável a camada de células epiteliais das vias aéreas in vitro, esses tipos celulares precisam ser representados nos modelos de cultura, e sua polarização e função mantidas13,14,15,16. A constatação de que as características do doador (incluindo o estado da doença) e a origem anatômica das células (isto é, nasal, traqueal, grandes e pequenas vias aéreas) podem afetar a composição celular e as respostas funcionais da cultura celular é igualmente importante. Experiência e prática relevantes são um pré-requisito para cultivar com sucesso células epiteliais primárias das vias aéreas e avaliar a qualidade da cultura intuitivamente (por inspeção visual durante a cultura) e quantitativamente. O objetivo desta contribuição é fornecer um método custo-efetivo e eficaz em termos de tempo para o isolamento e cultivo de células epiteliais brônquicas humanas primárias (CBECs) que também possa ser aplicado na cultura de células epiteliais traqueais e de pequenas vias aéreas. Além de descrever um método para isolar essas células do tecido pulmonar ressecado, um método para expansão e biobanco e, finalmente, para o estabelecimento e caracterização de uma cultura de LPA bem diferenciada dentro de um período de tempo e custo razoáveis é apresentado e discutido.
Protocolo
As células foram isoladas de tecido pulmonar macroscopicamente normal obtido de pacientes submetidos à cirurgia de ressecção por câncer de pulmão no Leiden University Medical Center, Holanda. Os pacientes dos quais esse tecido pulmonar foi derivado foram incluídos no biobanco por meio de um sistema sem objeção para uso adicional anônimo codificado desse tecido (www.coreon.org). No entanto, desde 01-09-2022, os pacientes foram incluídos no biobanco usando consentimento informado ativo de acordo com as regulamentações locais do biobanco LUMC com aprovação pelo comitê de ética médica institucional (B20.042/Ab/ab e B20.042/Kb/kb).
NOTA: Todos os procedimentos são realizados em um gabinete de segurança biológica, de acordo com as normas locais de segurança biológica, e sob condições de trabalho estéreis, usando luvas cirúrgicas e jaleco, salvo indicação em contrário. Para todas as mídias, reagentes e outras soluções usadas no protocolo, consulte a Tabela de Materiais e Tabela Suplementar 1. Consulte a Figura 1 para obter etapas detalhadas do protocolo
1. Isolamento de células epiteliais brônquicas do tecido pulmonar humano
NOTA: Para obter uma taxa de sucesso ideal para o isolamento de células epiteliais brônquicas, o anel brônquico excisado deve ser mantido submerso a 4 °C por um máximo de 24 h em solução salina tamponada com fosfato (PBS) com Primocina adicionada.
- Preparações antes do início do procedimento
- Preparar uma solução de revestimento em PBS, conforme descrito na Tabela Suplementar 1, e revestir um número adequado de placas de 6 poços com 1,5 mL de solução de revestimento por poço. Incubar por 2 h em estufa de cultura celular a 37 °C e 5% de CO2.
NOTA: O número de poços a serem revestidos depende do tamanho do tecido excisado. Como diretriz aproximada, quatro placas de 6 poços são revestidas quando o anel brônquico excisado tem 10 mm de diâmetro e 4 mm de largura. - Preparar meio sem soro completo de queratinócitos (c-KSFM), conforme descrito na Tabela Suplementar 1; usar 2 mL do meio por poço de uma placa de 6 poços.
NOTA: Este c-KSFM pode ser armazenado a 4 °C durante 7 dias. c-KSFM é um meio de baixo teor de cálcio usado para a expansão de células epiteliais das vias aéreas, inibindo o crescimento de fibroblastos contaminantes.
- Preparar uma solução de revestimento em PBS, conforme descrito na Tabela Suplementar 1, e revestir um número adequado de placas de 6 poços com 1,5 mL de solução de revestimento por poço. Incubar por 2 h em estufa de cultura celular a 37 °C e 5% de CO2.
- Limpe o anel brônquico enxaguando suavemente o anel em 10 mL de PBS estéril em uma placa de Petri de 10 cm. Use pinças para segurar cuidadosamente o anel (toque apenas para fora) e pequenas tesouras para remover qualquer excesso de tecido conjuntivo e restos de sangue. Para processamento posterior, corte o anel em dois.
NOTA: Todas as ferramentas utilizadas no processo devem ser esterilizadas antes do uso. - Submergir as duas metades do anel brônquico em 10 mL de uma solução pré-aquecida de protease XIV (1,8 mg/mL) em solução salina balanceada de Hank (HBSS), incluindo Primocina em um recipiente estéril fechado, e incubar por exatamente 2 h a 37 °C em uma incubadora de cultura celular.
NOTA: HBSS é usado como um diluente para protease XIV para separar as células do tecido durante um período de incubação de 2 h. O HBSS é uma solução isotônica balanceada que permite a manutenção da viabilidade celular durante incubações de curta duração. - Após a incubação, transferir os pedaços de tecido para uma placa de Petri com 10 mL de PBS quente e raspar o interior do anel usando uma pinça dobrada para obter uma solução celular.
NOTA: O tecido parece mais macio e um pouco expandido. - Descarte o anel, transfira a solução celular para um tubo de 50 mL e adicione PBS aquecido para obter um volume final de 50 mL. Centrifugar por 7 min a 230 x g e à temperatura ambiente (TR).
- Aspirar o sobrenadante e ressuspender o pellet em 10 mL de PBS aquecido. Além disso, completar o volume até 50 mL com PBS quente. Centrifugar por 7 min a 230 x g em RT.
- Aspirar o sobrenadante e ressuspender o pellet celular em uma quantidade apropriada de c-KSFM quente contendo Primocina.
NOTA: A Primocina é usada por um período mínimo de 7 dias para eliminar quaisquer bactérias, fungos ou (importante) micoplasma que possam ter estado presentes no tecido; Após 7 dias, a adição apenas de penicilina/estreptomicina ao meio é suficiente. - Aspirar a solução de revestimento das placas de 6 poços e adicionar 2 mL de suspensão celular por poço.
- Permita que as células cresçam até que 80% a 90% de confluência seja alcançada e troque o meio três vezes por semana (por exemplo, todas as segundas, quartas e sextas-feiras). O grau de confluência desejado é geralmente atingido entre 7 e 14 dias; Se o tempo necessário para atingir a confluência desejada exceder 14 dias, descarte as células.
NOTA: Nos primeiros dias, apenas um pequeno número de células começa a proliferar; grupos de células são perceptíveis após alguns dias.
2. Criopreservação de células epiteliais brônquicas primárias humanas (PBECs)
NOTA: Ao trabalhar com temperaturas de -80 °C e -196 °C, as luvas criogênicas são usadas para proteção e as pinças são usadas para transferir frascos congelados. Ao trabalhar com nitrogênio líquido, luvas criogênicas e um protetor facial são usados para proteção pessoal.
- Aspirar o meio e lavar os poços uma vez com 2 mL de PBS quente por poço.
- Tripsinizar as células adicionando 0,5 ml de tripsina mole por poço (ver Tabela Suplementar 1 para composição da solução de tripsina mole). Incubar as células durante 5 a um máximo de 10 minutos a 37 °C. Agite a solução de tripsina na placa e solte as células batendo suavemente na placa.
- Transferir as células destacadas para um tubo de centrífuga de 50 mL contendo 1,1 mg/mL de inibidor de tripsina de soja (SBTI; para inibir a atividade da tripsina) dissolvido em KSFM com penicilina/estreptomicina. O volume de SBTI deve ser o dobro do volume total de tripsina mole (ou seja, 1 mL por poço).
NOTA: Não adicione SBTI diretamente aos poços, pois as células serão reconectadas dentro de minutos. - Centrifugar o tubo por 7 min a 230 x g em RT.
- Eliminar o sobrenadante e ressuspender as células peletizadas em 10 mL de RT KSFM contendo penicilina/estreptomicina, mas sem outros aditivos. Conte as células usando um hemocitômetro ou contador de células automatizado. Execute uma contagem de células vivas/mortas adicionando azul de tripano em uma proporção de 1:1 ou use um procedimento alternativo de contagem de células vivas/mortas.
- Criopreservar as células na concentração de 400.000 células por mL de meio de congelação (ver Tabela Suplementar 1 para composição) e adicionar 1 mL dessa suspensão por criovial. Transfira os crióscos para um recipiente de células frias e coloque-o a -80 °C. Após 24 horas, transfira os frascos para injetáveis para azoto líquido -196 °C para armazenamento a longo prazo.
NOTA: Duas opções são possíveis para transferir as células para o meio de congelamento, ambas as quais funcionam bem: 1) Pellet as células novamente por centrifugação e ressuspensão em meio de congelamento a frio na concentração celular necessária; ou 2) adicionar meio de congelamento a frio e ajustar a concentração do crioconservante (dimetilsulfóxido [DMSO]) com base no volume de KSFM em que as células estão presentes.
3. Descongelar PBECs criopreservados e cultivá-los para cultura em pastilhas
- Revestir um frasco de cultura de células T75 durante a noite com 10 mL de solução de revestimento em PBS com as tampas bem fechadas. Incubar o balão numa estufa de cultura celular a 37 °C e 5% de CO2.
- Antes de descongelar os PBECs criopreservados retirar a solução de revestimento do balão e enchê-la com 10 mL de c-KSFM. Deixe aquecer a 37 °C em uma incubadora de cultura celular, com tampas ligeiramente abertas para deixar o ar da incubadora entrar.
- Descongele as células rapidamente em um banho de água ou miçanga a 37 °C.
NOTA: Um banho de contas é preferível a um banho-maria devido ao menor risco de contaminação e menor consumo de energia. - Adicionar o conteúdo completo do criovial ao balão T75 pré-aquecido com meio (passo 3.2) e distribuir uniformemente as células.
NOTA: Não centrifugar as células nesta fase, uma vez que estas não sobreviverão à etapa de centrifugação. - Após aproximadamente 4 h, certifique-se de que as células estão suficientemente ligadas. Substitua o meio por 10 mL de c-KSFM fresco e quente.
NOTA: Desta forma, o DMSO do meio de congelamento é removido. Esta etapa deve ocorrer entre 4 h e 24 h após a semeadura das células no frasco. - Cultivar as células até atingir 80% a 90% de confluência, trocando o meio todas as segundas, quartas e sextas-feiras.
4. Estabelecimento de cultura de interface ar-líquido com células epiteliais brônquicas primárias (LPA-PBEC)
NOTA: O procedimento a seguir é para a cultura de PBECs em insertos de 11,9 mm de diâmetro interno.
- Revestir um número adequado de pastilhas de cultura celular com 0,4 mL de solução de revestimento por inserção. Incubar durante a noite a 37 °C numa incubadora de cultura celular.
- Preparar meio BD completo (meio cBD), conforme descrito na Tabela Suplementar 1.
NOTA: O meio cBD é um meio composto (ver Tabela Suplementar 1) formulado para suportar o crescimento de células epiteliais brônquicas por períodos mais longos de tempo, permitindo sua diferenciação após um aumento na concentração de ácido retinóico (AR) (ou um análogo da AR, como usado no presente protocolo) e cultura na LPA, conforme descrito na etapa 4.10. - Tripsinizar as CBPs no frasco T75, utilizando 2 mL de tripsina mole por frasco. Incubar as células por 5 a 10 min para permitir que as células se desprendam (com base na inspeção visual). Após 5 min de incubação, facilitar o descolamento das células girando a tripsina no frasco e batendo suavemente no frasco (repetir se necessário).
- Adicionar 4 mL de SBTI ao balão e transferir diretamente a suspensão celular para um tubo de centrífuga de 25 mL.
Observação : as células reanexar dentro de minutos. Portanto, ao trabalhar com mais de um frasco, a suspensão celular obtida na etapa 4.4 deve ser transferida diretamente para um tubo de centrífuga antes de adicionar SBTI a um segundo frasco. No procedimento, no máximo cinco frascos são processados simultaneamente. - Centrifugar os tubos por 7 min a 230 x g em RT.
- Ressuspender as células em 6 mL de meio cBD e contar as células usando um hemocitômetro ou contador automático de células. Execute uma contagem de células vivas/mortas, por exemplo, adicionando azul de tripano em uma proporção de 1:1 ou usando outro procedimento de contagem de células vivas/mortas.
- Remova a solução de revestimento das pastilhas de cultura celular.
- Diluir a suspensão celular, gerada na etapa 4.6, com meio cBD suplementado com 1 nM EC 23 até uma concentração de 80.000 células por mL, e adicionar 0,5 mL no topo da membrana na inserção. Adicionar 1,5 mL de meio cBD suplementado com 1 nM EC 23 ao poço abaixo da pastilha.
- Troque o meio com meio cBD suplementado com 1 nM EC 23 três vezes por semana até que as culturas estejam prontas para exposição ao ar (ou seja, 2 dias após 100% de confluência). Toda vez, 0,5 mL do meio é adicionado dentro da pastilha (nas células) e 1,5 mL é adicionado ao compartimento inferior (o poço).
OBS: Em geral, a camada celular atinge 100% de confluência aproximadamente 5 dias após a semeadura dos PBECs nas pastilhas. Com base na inspeção visual da confluência das células, é tomada a decisão de transferir as células para o estágio de LPA 2 dias depois. - Quando as células estiverem prontas para transferência para a LPA (ou seja, 2 dias após atingir 100% de confluência), remova o meio das pastilhas e do poço, não adicione novo meio dentro da inserção e adicione novo meio (1 mL de meio cBD suplementado com 50 nM EC 23) apenas ao poço. Troque o meio nos poços três vezes por semana.
- Para remover o excesso de muco e detritos celulares, adicione suavemente 200 μL de PBS quente no lado apical da camada celular dentro da inserção (de preferência através do lado da inserção e não por pipetagem direta nas células) e incube por 10 min em uma incubadora de cultura celular a 37 °C. Em seguida, aspirar o PBS para remover o excesso de muco e restos celulares.
NOTA: A partir deste ponto (início da cultura de LPA), antes de mudar o meio do compartimento inferior, lave sempre o lado apical das células com PBS. - Cultive as células na LPA por um mínimo de 2 semanas para garantir que todos os principais tipos de células estejam representados.
5. Estabelecimento de uma cultura ALI-PBEC a partir de uma população mista de doadores
- Use células de até cinco doadores individuais para iniciar culturas de PBEC de uma população mista.
- Misturar um número igual de células por doador usando as células geradas na etapa 4.7 para atingir um total de 150.000 células por inserção (ou seja, 30.000 células por doador quando se usa cinco doadores). Isso garantirá que a proliferação na inserção seja mantida a um número mínimo e igual de células dos doadores individuais esteja presente na cultura.
- Continue a cultura ALI-PBEC conforme descrito nas etapas 4.9-4.12.
6. Controle de qualidade da cultura ALI-PBEC
- Monitoramento da resistência elétrica transepitelial (TEER) durante cultura celular
OBS: A medida da resistência elétrica, baseada no uso de um voltômetro, pode ser realizada a qualquer momento durante a cultura de LPA-PBEC e é realizada todas as vezes de acordo com o mesmo protocolo sob as mesmas condições, uma vez que a medida da resistência elétrica é influenciada por várias variáveis, incluindo a posição do eletrodo, temperatura, meio e manuseio. O TEER pode ser calculado usando a resistência elétrica medida aplicando a seguinte fórmula baseada na lei de Ohm: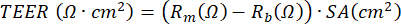 , em que Rm é a resistência elétrica medida, Rb é a resistência elétrica basal de uma pastilha sem revestimento e células, e SA é a área de superfície da membrana da inserção17.
, em que Rm é a resistência elétrica medida, Rb é a resistência elétrica basal de uma pastilha sem revestimento e células, e SA é a área de superfície da membrana da inserção17.- Adicione suavemente 200 μL de PBS quente ao lado apical da camada celular para remover o muco e os detritos nas células. Incubar a pastilha durante 10 minutos numa incubadora de cultura celular a 37 °C e remover novamente o PBS.
- Adicione suavemente 700 μL de PBS quente ao lado apical da camada celular e incube a pastilha por 10 minutos em RT para permitir a estabilização da temperatura para medições.
- Calibre o voltohmímetro usando o resistor de teste de 1.000 Ω, ajuste o voltohmímetro para medir Ohms e use uma chave de fenda para ajustar o parafuso de calibração "R ADJ" até ajustar para 1.000 Ω.
- Enxágue o eletrodo movendo-o para cima e para baixo algumas vezes em água estéril (RT) e, em seguida, em PBS estéril (RT).
- Medir a resistência elétrica da camada celular nas pastilhas. Para isso, coloque o eletrodo em posição vertical no poço com o braço longo do eletrodo tocando o fundo da placa. Dessa forma, o braço curto fica acima da camada celular dentro da inserção. Leia o valor exibido no voltômetro.
Observação : O valor exibido não será totalmente estabilizado; Leia o valor no momento em que o valor é intermitente. - Entre as medições, limpe o eletrodo movendo-o para cima e para baixo algumas vezes em PBS (RT) estéril.
- Limpe o eletrodo quando as medições terminarem, movendo-o para cima e para baixo algumas vezes em água estéril (RT), PBS estéril (RT) e etanol 70% (RT). Armazenar o eletrodo seco.
- Realizar uma medição basal de uma pastilha (sem revestimento) e células adicionando 700 μL de PBS quente dentro da pastilha e 1 mL de PBS quente ao poço e medindo a resistência elétrica ao lado das outras pastilhas.
- Avaliação da composição celular da cultura de LPA-PBEC
- Durante a etapa de LPA, verificar a diferenciação avaliando visualmente os cílios batidos. Estes podem ser observados através da microscopia de campo claro padrão já 9 dias após a exposição ao ar no lado apical das células.
NOTA: Os cílios batendo são mais visíveis diretamente após a lavagem da superfície apical. As células caliciformes produzem muco e, portanto, a presença de muco, como observado durante a lavagem da superfície apical, é um sinal de que as células caliciformes estão formadas. No entanto, o nível de células caliciformes e a quantidade de muco produzido é altamente dependente do doador. A presença de muco pode ser observada ao aspirar o PBS após a lavagem da superfície apical da camada celular na inserção; neste caso, a PBS aspirada é mais viscosa, e fios mucosos podem ser observados durante a aspiração. - A avaliação da composição celular por imunomarcação e microscopia fluorescente ou fluorescence-activated cell sorting (FACS), ou análise da expressão gênica por reação em cadeia da polimerase quantitativa em tempo real (RT-qPCR) fornece informações importantes sobre o estado de diferenciação da cultura, mas sua descrição foge ao escopo desta contribuição.
- Durante a etapa de LPA, verificar a diferenciação avaliando visualmente os cílios batidos. Estes podem ser observados através da microscopia de campo claro padrão já 9 dias após a exposição ao ar no lado apical das células.
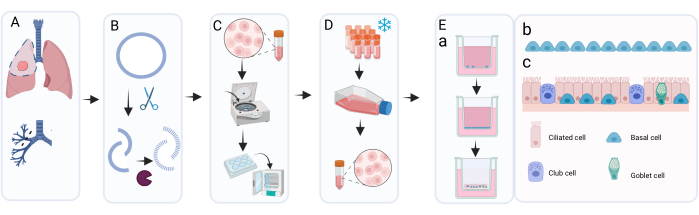
Figura 1: Visão geral esquemática do procedimento de isolamento, expansão e cultura de células epiteliais brônquicas primárias . (A) O tecido pulmonar é obtido durante a cirurgia de ressecção do câncer e o patologista excisa o tecido do anel brônquico que é macroscopicamente normal e livre de tumor. (B) O anel brônquico é limpo e exposto a tratamento enzimático para desprendimento e dissociação da camada celular. (C) A suspensão celular recuperada é lavada e as células são distribuídas em poços de uma placa de 6 poços para expansão. (D) Após expansão suficiente das células isoladas em c-KSFM com Primocina, as camadas celulares são dissociadas por tripsinização e as células são ressuspensas em meio de congelamento para criopreservação. Quando necessário, as células criopreservadas são descongeladas e novamente expandidas usando c-KSFM com penicilina/estreptomicina em frascos de cultura celular. Após a expansão, são semeadas em meio cBD em pastilhas de cultura celular; (EA) A cultura da LPA-PBEC ocorre em duas etapas principais: a fase submersa em meio cBD suplementado com 1 nM EC 23 até que as células atinjam a confluência completa, seguida da remoção do meio apical e cultura na LPA para permitir a diferenciação; nesta fase de LPA, as células são cultivadas em meio cBD suplementado com EC 23 50 nM. (EB) Representação gráfica das células basais que cobrem a inserção durante a cultura submersa. e-C) Representação gráfica da camada celular epitelial diferenciada obtida após cultura na LPA na presença de concentrações aumentadas de EC 23. Clique aqui para ver uma versão maior desta figura.
Resultados
Expansão usando cultura submersa
Utilizando o método aqui apresentado, uma média de oito crióforos com 400.000 células/criovial pode ser obtida de uma placa de 6 poços para armazenamento em nitrogênio líquido a longo prazo (Figura 2A). Para isso, PBECs isolados são cultivados em placas de 6 poços por um mínimo de 7 dias e um máximo de 14 dias (Figura 2B) na presença de Primocina para excluir contaminação microbiana (especialmente micoplasma). A Figura 2A,B fornece informações sobre o número de células obtidas e o tempo de cultura necessário entre diferentes isolamentos de vários doadores. Antes da colheita das células por tripsinização para armazenamento em nitrogênio líquido, a confluência deve ser superior a 80%. Se isso não for alcançado dentro de 14 dias, as células não devem ser criopreservadas. É importante ressaltar que, ao colher para armazenamento e passagem, a confluência da camada celular não deve exceder ~95% (Figura 2C). Após o armazenamento em nitrogênio líquido, as células podem ser descongeladas e cultivadas para expansão até que números suficientes de células sejam obtidos para culturas de LPA. O meio utilizado para expansão das células nessa fase é o c-KSFM, semelhante ao da cultura inicial após a colheita do anel brônquico18. No entanto, não há necessidade de Primocina nesta fase, porque o risco de contaminação microbiana adicional proveniente do tecido pulmonar está ausente e, portanto, a Primocina pode ser trocada por penicilina/estreptomicina. Esse meio favorece as células epiteliais em detrimento dos fibroblastos e, portanto, evita o possível crescimento excessivo da cultura por fibroblastos de proliferação mais rápida 19,20,21. Usando o meio c-KSFM, as células são espalhadas no frasco e não se conectam entre si, o que é marcadamente diferente da morfologia das células cultivadas submersas nesta fase em meio cBD (Figura 2D,E). Após 5 ou 6 dias da cultura das células descongeladas em frasco T75, a camada celular deve ser 80%-95% confluente, o que se traduz em aproximadamente 3 x 106 células no total (Figura 2F). A partir disso, aproximadamente 75 insertos (tamanho de placa de 12 poços) podem ser gerados para a cultura de LPA.
O método de isolamento e cultura descrito nesta contribuição também pode ser adaptado para uso com biópsias brônquicas ou escovas brônquicas como material de partida.
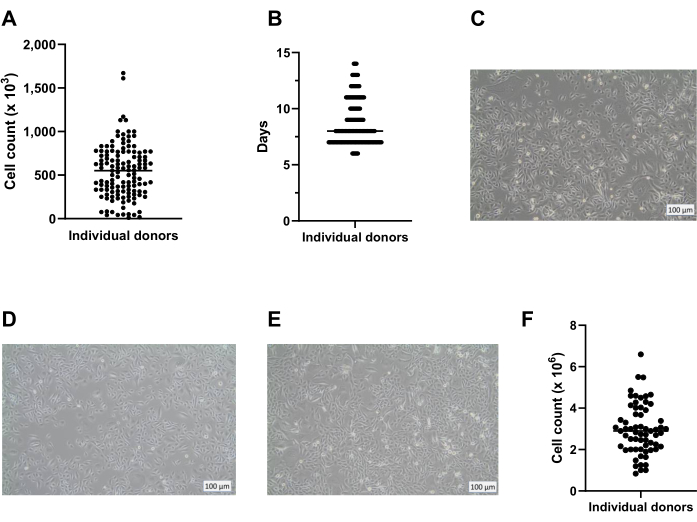
Figura 2: Expansão basocelular antes e após a criopreservação. As células foram isoladas de acordo com o protocolo descrito e cultivadas usando c-KSFM. O número de células geradas por doador foi monitorado, as contagens de células vivas foram realizadas utilizando um contador automático de células (A) ao colher a passagem 0 (P0) de células das placas de 6 poços (etapa 2 do protocolo), n = 123 doadores, a contagem de células foi apresentada como o número de células colhidas por poço; Cada ponto representa um doador e a mediana é indicada por uma barra horizontal. (B) Como parte do controle de qualidade, o tempo necessário para que as células P0 atingissem 80% a 90% de confluência nas placas de 6 poços foi monitorado e mostrado como dias após o início da cultura submersa em c-KSFM (n = 127 doadores diferentes). Cada doador individual é indicado por um ponto, todos os pontos pertencentes a 1 dia se fundem em uma linha; quanto maior a linha, mais doadores ela representa; O número mediano de dias em que as células estão em cultura é indicado por uma barra horizontal mais fina. (C) Imagem de campo claro representativa de células P0 crescidas submersas em c-KSFM no momento em que as células foram colhidas para criopreserva de longo prazo. (D) Imagem representativa de campo claro de células P1 crescidas submersas em c-KSFM no momento em que as células foram colhidas e transferidas para inserções e (E) células P1 crescidas submersas em meio cBD. (F) O número de células vivas geradas por doador foi monitorado por contador automático de células na coleta de células P1 do frasco T75 (seção 4 do protocolo), n = 63 doadores diferentes; a contagem de células é apresentada como o número de células por frasco T75, cada doador é indicado por um ponto e a contagem mediana de células é indicada por uma barra horizontal. Clique aqui para ver uma versão maior desta figura.
Cultura de interface ar-líquido (ALI)
Aos 7 dias após o início da cultura de LPA, a resistência elétrica da camada celular é medida, devendo ser superior a 300 Ω (Figura 3A); Se isso não for alcançado, a cultura é considerada fracassada por causa de uma possível falta de formação de tight junction. Recomenda-se excluir a possibilidade de obter baixos valores de TEER causados por danos à camada epitelial em inserções individuais resultantes, por exemplo, de danos à camada celular durante a lavagem e aspiração. Isso pode ser verificado pela inspeção visual microscópica das bulas de cultura. Em nossa experiência, a variabilidade interdoadores na resistência elétrica pode ser significativa (Figura 3B), o que também é relatado naliteratura14, e como observado também é marcadamente influenciado pela origem do meio de águia modificado de Dulbecco (DMEM) utilizado (Figura 3C).
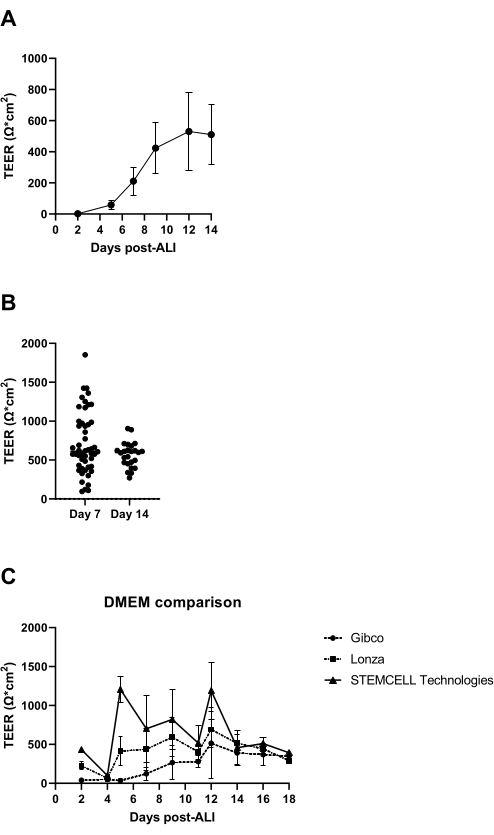
Figura 3: Resistência elétrica transepitelial como controle de qualidade das culturas de LPA-PBEC. PBECs foram isolados e expandidos, e culturas bem diferenciadas de LPA-PBEC foram estabelecidas. Em vários momentos durante a cultura, a resistência elétrica foi medida e, posteriormente, o TEER foi calculado (Ω·cm2). (A) A resistência elétrica foi medida ao longo de 14 dias pós-LPA. n = 4 doadores diferentes. Os dados são representados como o valor médio ± desvio padrão (DP). (B) Como parte do controle de qualidade da cultura de células ALI-PBEC, a resistência elétrica foi medida no dia 7 (n = 50) e no dia 14 pós-LPA (n = 25); cada ponto representa um doador e a mediana TEER (Ω·cm2) é indicada por uma barra horizontal. Os dados foram testados quanto à significância por meio do teste não paramétrico de Mann-Whitney, não sendo encontrada diferença significativa. (C) Meios de três fornecedores diferentes de DMEM foram testados para avaliar a influência na formação de TEA. n = 4 doadores diferentes; os valores médios estão representados ± DP. Clique aqui para ver uma versão maior desta figura.
Ao estabelecer uma cultura bem diferenciada de LPA-PBEC, desde o início da exposição ao ar, a concentração de AR aumenta22. Dessa forma, as células mudam da proliferação para a diferenciação mucociliar, que é visível a partir de 9 dias (doador-dependente) após a exposição ao ar usando microscopia de campo claro. O movimento dos primeiros cílios é visível nesse ponto, e um pouco mais precocemente quando baseado na expressão gênica de marcadores de células luminaisdiferenciadas23 (Figura 4).
Conforme descrito no protocolo, a produção de muco também pode ser observada ao enxaguar a superfície apical durante a troca do meio. A AR é muito sensível à luz, o que leva a uma atividade altamente variável na mesma concentração de estoque. Por esta razão, o RA é substituído pelo análogo sintético EC 23 do RA e utilizado na mesma concentração, com resultados semelhantes aos determinados experimentalmente. Por esse motivo e para evitar a mudança de procedimento, a concentração de EC 23 selecionada foi mantida igual à concentração de AR (i.e., 50 nM) utilizada anteriormente24,25 (Figura 5). A Figura 5A ilustra os valores de TEER obtidos ao utilizar diferentes concentrações de EC 23, mostrando um TEER máximo a 50 nM dentro desta faixa de concentrações testadas. Os resultados apresentados na Figura 5B confirmam que a expressão gênica dos marcadores para células ciliadas e caliciformes é semelhante quando se utiliza 50 nM EC 23 ou RA. A EC 23 também é necessária durante a cultura no estágio submerso (embora em uma concentração muito menor), uma vez que omiti-lo neste estágio submerso e adicioná-lo apenas no estágio ALI resulta em uma cultura que nunca atinge a confluência total. O tempo necessário para gerar uma cultura bem diferenciada de LPA-PBEC com atividade de batimento ciliar visível e produção de muco é em torno de 14 dias, e a maioria dos experimentos é, portanto, iniciada entre culturas de LPA de 14-21 dias (Figura 4). Todos os principais tipos celulares diferentes (basais, ciliados, caliciformes e club) são observados após 14 dias de cultura de LPA, embora os níveis de expressão sejam altamente dependentes do doador. Isso é demonstrado pela avaliação da expressão gênica de TP63, FOXJ1, MUC5AC e SCGB1A1 por RT-qPCR, ou pela expressão de proteínas usando anticorpos direcionados contra p63, α-tubulina, Muc5AC e CC-16 por imunofluorescência (IF), para detectar marcadores de células basais, ciliadas, caliciformes e club, respectivamente25,26. No entanto, enquanto 14-21 dias pode ser considerado como uma regra prática para a maioria dos experimentos, para experimentos selecionados, uma duração mais longa da diferenciação pode ser considerada, como encontrado para o metabolismo xenobiótico, infecção por SARS-CoV-2 e a avaliação do clearance mucociliar27,28,29.
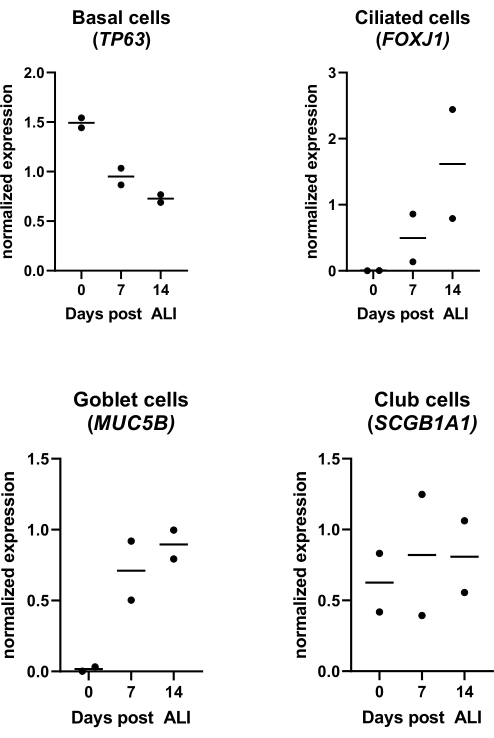
Figura 4: Cultura da interface ar-líquido (LPA). PBECs foram isolados e expandidos, e culturas bem diferenciadas de LPA-PBEC foram estabelecidas. As culturas de LPA-PBEC foram monitoradas ao longo de 14 dias pós-LPA. Culturas celulares foram lisadas para isolamento de RNA nos dias 0, 7 e 14 pós-LPA. Dados de dois doadores diferentes são mostrados, cada ponto representa um doador individual monitorado ao longo do tempo, e a mediana é indicada por uma barra horizontal. A expressão gênica de marcadores basais, ciliados, caliciformes e de células clubísticas (TP63, FOXJ1, MUC5B e SCGB1A1, respectivamente) foi medida por qPCR e normalizada para a expressão dos genes RPL13A e ATP5B (ver referência 23 para detalhes). Clique aqui para ver uma versão maior desta figura.
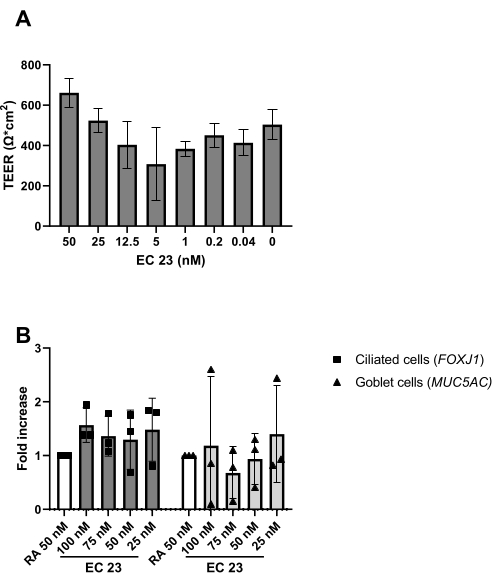
Figura 5: Comparação entre o ácido retinóico (AR) e seu análogo sintético EC 23. PBECs foram isolados e expandidos, e culturas bem diferenciadas de LPA-PBEC foram estabelecidas. No início da exposição aérea das culturas de CBP, a AR (50 nM) foi substituída por várias concentrações de CE 23. (A ) A resistência elétrica foi medida no 14º dia pós-LPA e, posteriormente, o TEER foi calculado (Ω·cm 2), n =2 doadores, as barras representam o valor médio ± DP. ( B) No dia 14 pós-LPA, culturas celulares foram lisadas para isolamento de RNA e subsequente análise da expressão gênica de marcadores celulares para células ciliadas e caliciformes (FOXJ1, MUC5AC) respectivamente usando qPCR, e normalizado para RPL13A (n = 3 doadores). Um aumento de dobras é mostrado contra ALI-PBEC cultivado com 50 nM RA e representado como o valor médio ± DP. (Veja a referência 23 para detalhes) Clique aqui para ver uma versão maior desta figura.
Nos últimos anos, o desempenho de produtos alternativos no sistema de cultura tem sido examinado, como a mídia e os plásticos de cultura. Houve várias razões para tais avaliações, incluindo mudanças na composição do meio pelos fabricantes, novas mídias introduzidas, bem como uma escassez de produtos durante a pandemia COVID-19 (2020-2022). Observou-se que produtos similares de diferentes fornecedores resultam em culturas de células epiteliais diferenciadas com base na avaliação de marcadores de tipos celulares epiteliais, embora a composição celular final possa variar substancialmente (Figura 6A), enquanto as diferenças no TEER foram menos pronunciadas (Figura 6B). Por outro lado, meios de diferentes fornecedores resultaram em diferenças substanciais na composição celular; quando se utilizaram insertos de diferentes marcas, tais diferenças foram limitadas (Figura 6C). Em particular, ao utilizar o meio de cultura de células epiteliais das vias aéreas PneumaCult da STEMCELL Technologies, observou-se uma morfologia diferente e formação mais rápida da atividade ciliar visível. Além dessas observações, também foi observada uma diferença nos valores de TEER e uma diferença na composição celular do meio ALI-PBEC em comparação com o meio cBD (Figura 6D).
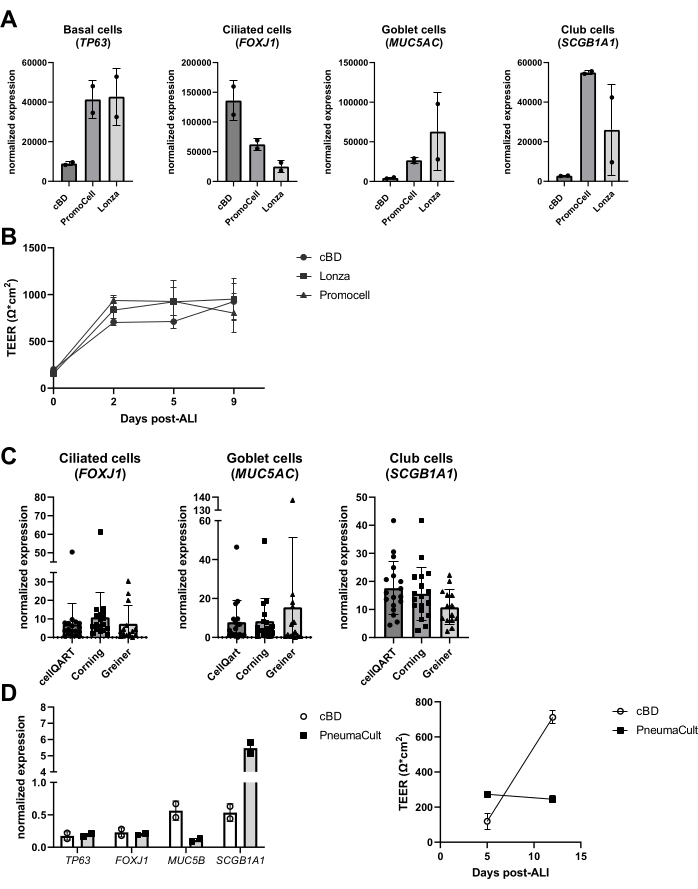
Figura 6: Comparação entre diferentes fornecedores de meio celular epitelial e pastilhas de cultura celular. PBEC foram isolados, expandidos e culturas bem diferenciadas de ALI-PBEC foram estabelecidas. (A) ALI-PBECs foram cultivadas por 14 dias e, em seguida, as camadas celulares foram lisadas para isolamento de RNA. A expressão gênica de marcadores basais, ciliados, caliciformes e de células clubísticas (TP63, FOXJ1, MUC5AC e SCGB1A1, respectivamente) foi medida por qPCR e normalizada para RPL13A e ATP5B. n = 2 doadores; as barras representam o valor médio ± DP. (B) Ao longo de 9 dias pós-LPA, a resistência elétrica foi medida e, posteriormente, o TEER foi calculado (Ω·cm2). n = 3 doadores diferentes; ±(C) ALI-PBECs foram cultivados por 14 dias usando pastilhas de cultura celular adquiridas de três fornecedores diferentes e, em seguida, as camadas celulares foram lisadas para isolamento de RNA. A expressão gênica de marcadores ciliados, caliciformes e de células clubísticas (FOXJ1, MUC5AC e SCGB1A1, respectivamente) foi medida por qPCR e normalizada para RPL13A. n = 18 doadores diferentes, as barras representam o valor médio ± DP. Os dados foram testados quanto à significância usando um teste não paramétrico de Kruskal-Wallis ANOVA one-way e nenhuma diferença significativa foi encontrada. (D) ALI-PBECs foram cultivadas em meio cBD ou meio PneumaCult (tecnologias STEMMCELL) por 14 dias pós-LPA e, em seguida, as camadas celulares foram lisadas para isolamento de RNA. A expressão gênica de marcadores basais, ciliados, caliciformes e de células do clube (TP63, FOXJ1, MUC5B e SCGB1A1, respectivamente) foi medida por qPCR e normalizada para RPL13A (as barras representam o valor médio ± DP), e a resistência elétrica foi medida nos dias 5 e 12 pós-LPA e usada para calcular o TEER (Ω·cm2). n = 2; o valor médio é representado ± DP (ver referência 23 para detalhes). Clique aqui para ver uma versão maior desta figura.
Tabela Suplementar 1: Composição das soluções e meios utilizados no protocolo. Clique aqui para baixar este arquivo.
Discussão
O protocolo aqui apresentado descreve o isolamento de células epiteliais brônquicas humanas do tecido pulmonar ressecado, um método para a expansão ótima das células sem perda do potencial de diferenciação, um procedimento de criopreservação e um procedimento para gerar culturas bem diferenciadas de LPA-PBEC. Além disso, uma descrição do controle de qualidade é fornecida, bem como instruções para monitoramento e avaliação dos PBECs diferenciados da LPA.
O protocolo descrito inicia-se com um anel brônquico macroscopicamente normal, livre de tumor, que é ressecado de um lobo pulmonar de pacientes submetidos à cirurgia relacionada ao diagnóstico de câncer de pulmão. Por conseguinte, é necessário notar que estes anéis não podem ser considerados estritamente como tecido saudável, o que pode, por conseguinte, afectar as características da cultura celular. Fontes alternativas para a obtenção de células epiteliais brônquicas incluem o uso de biópsias brônquicas, escovações brônquicas ou tecido de um doador transplantado ou pulmões receptores. Independentemente da fonte, ao usar tecido pulmonar, um risco de contaminação microbiana deve ser considerado e, portanto, antibióticos são usados nos diferentes meios de cultura para reduzir o risco de contaminação microbiana da cultura celular. Em particular, o micoplasma é um risco alto e comum em cultura celular, devido à sua ampla variedade de efeitos sobre a cultura celular, resistência a antibióticos comumente usados em cultura de células e ao fato de que a contaminação por micoplasma só pode ser confirmada por ensaios de detecção de micoplasmas. Portanto, na fase inicial da cultura celular após o isolamento de células do tecido pulmonar, utiliza-se a formulação antimicrobiana de amplo espectro Primocina e, durante o processo de cultura, amostras selecionadas aleatoriamente são testadas quanto à presença de micoplasma.
O procedimento de isolamento iniciado com um anel brônquico fornece material de partida suficiente para permitir o grau de expansão dessas células primárias necessário para iniciar culturas na LPA sem comprometer a capacidade de diferenciação. No entanto, iniciar a expansão das células epiteliais isoladas com um número limitado de células pode representar problemas para a obtenção de um número suficiente de inserções com células suficientes que possam ser semeadas para cultura de LPA. Cultura prolongada e passagem repetida de células primárias podem resultar em senescência replicativa. Várias soluções têm sido propostas para superar essa limitação. mostraram que o inibidor de Rho quinase (ROCK) Y-27632 aumentou a proliferação de células basais30, Mou e col. utilizaram dupla inibição de Smad para expandir células-tronco basais mantendo as características da camada de células epiteliais diferenciadas 31, e Sachs e col. desenvolveram um sistema organoide das vias aéreas que pode ser usado para expandir as células epiteliais das vias aéreas e manter seu potencial de diferenciação ao longo de múltiplas passagens32. Este último método também foi utilizado para expandir células de fontes com número muito baixo de células, como aspirados traqueais (ATs) de recém-nascidos prematuros (<28 semanas de idade gestacional) e lavado broncoalveolar (LBA), antes da transferência para a cultura de LPA, como descrito aqui33. Verificou-se que as células isoladas do LBA e dos AT apresentaram uma capacidade de diferenciação semelhante às células geradas a partir do tecido brônquico, embora diferenças tenham sido observadas quando a diferenciação foi enviesada para culturas mais ciliadas ou mais caliciformes usando a inibição da sinalização Notch ou a citocina Th2 IL-1333. Recomenda-se, portanto, que, se os PBEC-LPA forem cultivados a partir de um material de partida com baixo número de células epiteliais usando abordagens semelhantes, sempre verifique as culturas quanto aos critérios básicos de qualidade, conforme discutido na seção 6 do protocolo. É importante ressaltar que o uso de células alimentadoras também pode ajudar na obtenção de números maiores de células, o que é essencial em um ambiente para engenharia de andaimes transplantáveis onde o tempo e o número de células são essenciais. Isso é ilustrado por um estudo no qual células epiteliais autólogas foram cultivadas a partir de biópsias derivadas de um paciente com doença traqueal e as células foram rapidamente expandidas na presença de uma camada alimentadora embrionária murina (fibroblastos 3T3-J2 mitoticamente inativados) e do inibidor da via Rho/ROCK (Y-27632)34. A cultura celular resultante mostrou-se útil para o repovoamento de arcabouços traqueais e, portanto, pode ser vista como um protocolo adequado para um modelo de transplante.
Ao utilizar o protocolo descrito nesta contribuição, mas também ao utilizar outros protocolos de cultura, inevitavelmente um viés de seleção é introduzido. É importante perceber que diferenças nos detalhes do protocolo, como a origem das células usadas para iniciar as culturas, a composição do meio e outros detalhes do protocolo, podem levar a mudanças na composição celular das culturas e, consequentemente, alterações na resposta da cultura de LPA33,35. Além disso, diferenças nas propriedades celulares também têm sido observadas quando comparados diferentes meios para diferenciar as células das vias aéreas10,11. Ao comparar o meio PneumaCult e cBD, foram observadas diferenças nos marcadores de mRNA de células caliciformes e club, valores de TEER e espessura da camada celular. Com base nessas observações, apesar da falta de embasamento estatístico, devido ao baixo número de doadores utilizados, a composição do meio ser desconhecida pelos clientes e os maiores custos do meio PneumaCult, optou-se em nosso laboratório pelo uso do meio cBD.
Como discutido, as células podem ser inicialmente expandidas usando cultura de organoides e posteriormente transferidas para o sistema de inserção de ALI 2D. Isso é importante, uma vez que organoides epiteliais das vias aéreas não são adequados para exposição a substâncias transportadas pelo ar, enquanto o uso do sistema ALI 2D permite avaliar o impacto de substâncias transportadas pelo ar, como a fumaça de cigarro23,36, sobre células epiteliais das vias aéreas cultivadas. Uma abordagem diferente para o estabelecimento de culturas de células epiteliais das vias aéreas é gerar células epiteliais das vias aéreas pela diferenciação de células-tronco pluripotentes humanas (hiPSCs)37. Nesses protocolos, na etapa final do protocolo de diferenciação após a diferenciação para progenitores proximais das vias aéreas, as células podem ser diferenciadas por cultura para LPA utilizando procedimentos semelhantes aos aqui descritos.
No protocolo atual, o meio cBD é utilizado para cultura na LPA. O meio cBD é um meio livre de soro que é preparado pela adição de uma mistura de diferentes suplementos, inspirado em Fulcher et al.38 , bem como em outros estudos. A solução suplementar contém 52 μg/mL de extrato hipofisário bovino (BPE), 0,5 μg/mL de hidrocortisona, 0,5 ng/mL de EGF humano, 0,5 μg/mL de epinefrina, 10 μg/mL de transferrina, 5 μg/mL de insulina, 6,5 ng/mL de triiodotironina e 0,1 ng/mL de RA39. Uma vez que o BPE é um extrato tecidual e está sujeito a variações em lote, o meio não pode ser considerado como um meio totalmente definido, nem é livre de animais. O meio de cultura celular totalmente definido é preferido para minimizar as diferenças de lote para lote. Tendo em vista a transição para a investigação sem animais, é importante que sejam envidados esforços para produzir meios definidos que não contenham produtos de origem animal e que sejam acessíveis para a comunidade científica.
Vários arranjos experimentais podem ser utilizados com base no modelo ALI, dependendo da questão de pesquisa. Por exemplo, para investigar o impacto de compostos que podem influenciar o processo de diferenciação, isso pode ser abordado adicionando os compostos à cultura durante os diferentes estágios da cultura submersa, durante a diferenciação ou no estágio bem diferenciado. A composição celular da cultura ALI-PBEC pode ser influenciada pela adição de compostos específicos; por exemplo, diferenciar ALI-PBECs na presença de IL-13 gera uma cultura com mais células caliciformes e menos células ciliadas, enquanto o tratamento com o inibidor de γ-secretase DAPT (usado para bloquear a sinalização de Notch) durante a diferenciação resulta em uma cultura com mais células ciliadas em detrimento das células caliciformes 23,40,41,42.
Além disso, agentes para estimular células ou bloquear certos processos podem ser aplicados no compartimento basal ou (em um volume muito pequeno) no compartimento apical da cultura. As células também podem ser expostas a substâncias transportadas pelo ar do lado apical. Tais desenhos de exposição têm sido utilizados para estudar o efeito do escapamento do diesel ou da fumaça total do cigarro sobre os PBECs23,43,44. O meio pode ser colhido toda vez que o meio é trocado para monitorar as proteínas secretadas no lado basal; o mesmo se aplica ao lado apical das células que é lavado com PBS enquanto refresca o meio basal. A chamada lavagem apical é colhida e o ditioeritritol (DTE) opcional é adicionado para dissociar o muco que é produzido pelas células caliciformes de forma mais eficiente. Lisados celulares podem ser obtidos para isolamento de proteínas totais, RNA e DNA cromossômico e mitocondrial. As células podem ser estudadas com anticorpos para marcadores específicos, cortando-se a membrana de polietileno tereftalato (PET) da inserção plástica e cortando-a em pedaços menores para múltiplas colorações de imunofluorescência45. Além disso, a citometria de fluxo ou FACS também pode ser usada após a tripsinização das células nas inserções. Durante o estágio de LPA, o desenvolvimento da barreira celular pode ser monitorado medindo-se a resistência elétrica e, posteriormente, calculando-se o TEER, onde a resistência elétrica é inversamente proporcional à área superficial de inserção da membrana. O cálculo é baseado na lei de Ohm usando a seguinte fórmula: 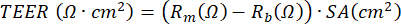 , em que Rm é a resistência elétrica medida, Rb é a resistência elétrica basal de uma pastilha sem revestimento e células, e SA é a área de superfície da membrana da inserção. A medição da resistência elétrica usando eletrodos EVOM2 e STX/pauzinho é simples, mas altamente dependente de procedimentos de manuseio ao introduzi-la no poço. Além disso, foi sugerido que a forma do eletrodo afeta a medida da função de barreira da área superficial relativamente grande17.
, em que Rm é a resistência elétrica medida, Rb é a resistência elétrica basal de uma pastilha sem revestimento e células, e SA é a área de superfície da membrana da inserção. A medição da resistência elétrica usando eletrodos EVOM2 e STX/pauzinho é simples, mas altamente dependente de procedimentos de manuseio ao introduzi-la no poço. Além disso, foi sugerido que a forma do eletrodo afeta a medida da função de barreira da área superficial relativamente grande17.
Melhorias adicionais no sistema de cultura de células de LPA, com o objetivo de aumentar a representação tecidual precisa, incluem o cocultivo de tipos celulares adicionais, como leucócitos, fibroblastos ou células endoteliais46,47,48. Observou-se que o co-cultivo de LPA-PBEC com fator estimulador de colônias de granulócitos e macrófagos (GM-CSF) ou macrófagos M-CSF diferenciados afeta marcadamente as respostas epiteliais inatas e o reparo48. É importante notar que, em tais modelos de cocultura, a compatibilidade de meios pode ser um problema. Uma vez que o meio utilizado para a cultura de células epiteliais das vias aéreas é desenvolvido especificamente para PBECs e pode não ser ideal para outros tipos celulares, a otimização é necessária. Outro tipo de avanço observado no campo da biologia das vias aéreas para o qual PBECs isolados podem ser utilizados é o uso da tecnologia Organs-on-Chips (OoC)49,50. Com o uso dessa tecnologia, pode-se estudar a influência das forças mecânicas da respiração e do fluxo sanguíneo, como estiramento, ar e fluxo médio29.
A variabilidade interdoadores pode ser significativa quando se utilizam CBPBs de vários doadores e, portanto, é importante considerar o uso de células de vários doadores para explicar essa variabilidade em estudos de cultura de células epiteliais. Uma vez que a cultura de LPA-PBECs é demorada e associada a custos consideráveis, a opção de estabelecer culturas de LPA-PBEC misturando células de diferentes doadores em uma inserção de cultura celular é examinada. Dessa forma, experimentos-piloto podem ser prontamente realizados utilizando células primárias, antes de analisar as respostas de culturas derivadas de vários doadores individuais. Além disso, doadores com diferentes características (por exemplo, diferentes categorias etárias ou sexo) podem ser agrupados para estudos exploratórios. Ao usar misturas de doadores, é importante certificar-se de que um número igual de células de diferentes doadores esteja presente, para evitar a possibilidade de que um doador domine os desfechos como resultado de uma maior taxa de proliferação. Portanto, células de doadores individuais são expandidas separadamente e semeadas em uma densidade maior na inserção em comparação com células semeadoras de um doador individual, para minimizar a proliferação na inserção antes da transição para a LPA. As respostas das misturas de doadores e doadores individuais correspondentes foram comparadas estudando a cinética da infecção do SARS-CoV-2. Utilizando RT-qPCR e coloração por imunofluorescência, observou-se que a mistura de doadores proporcionou uma boa representação dos vários doadores individuais, por mostrar números semelhantes de partículas virais produzidas e números semelhantes de células infectadas28.
Para se tornar uma alternativa aceitável para modelos animais, a edição gênica de células epiteliais brônquicas cultivadas deve ser viável51. A tecnologia de interferência de RNA usando pequenos RNAs interferentes (siRNAs) em ALI-PBECs é examinada, no entanto, como as células precisam ser transfectadas com siRNA durante a fase submersa da cultura, o knockdown não é suficientemente mantido durante a cultura de LPA devido à longa duração da cultura, a menos que a transfecção de siRNA seja frequentemente repetida durante a cultura52. No entanto, siRNAs podem ser usados com sucesso para modificar a expressão gênica em células basais submersas. Outros utilizaram com sucesso a tecnologia CRISPR/Cas9 para realizar a edição gênica em culturas primárias de células epiteliais das vias aéreas com liberação de ribonucleoproteína (RNP) 53. Ao utilizar tais técnicas, é essencial que as células mantenham sua plena capacidade de diferenciação. Como as culturas de células primárias das vias aéreas não podem ser transmitidas indefinidamente, a expansão clonal das células editadas pelo gene não é fácil e a adição de meio para selecionar células transfectadas é complicada. Portanto, é difícil alcançar o knockdown desejável em todas as células cultivadas. Uma alternativa para gerar clones knockout é o uso de estratégias knock-out emhiPSCs 54 e o uso dessas células para gerar células epiteliais das vias aéreas. Outra alternativa, embora subótima, é o estabelecimento de uma linhagem imortalizada de PBEC para expandir clonalmente células editadas por genes55.
O protocolo aqui apresentado é uma forma de gerar uma LPA-PBEC pseudoestratificada bem diferenciada, mas outros protocolos também foram encontrados para estabelecer tal cultura, com diferenças menores e maiores em comparação com o protocolo apresentado. Em nossa opinião, a validação laboratorial de métodos de cultura e o rigoroso controle de qualidade são essenciais para que o sistema ALI-PBEC e sistemas similares de cultura de células epiteliais das vias aéreas se tornem uma alternativa válida para experimentos com animais.
Divulgações
Os autores declaram não haver conflitos de interesse relevantes.
Agradecimentos
Os estudos usando o modelo descrito nesta contribuição foram apoiados por uma variedade de organizações de financiamento, incluindo a Lung Foundation Netherlands, a Organização Holandesa para Pesquisa e Desenvolvimento em Saúde (ZonMw, concessão COVID-19 MKMD), a Sociedade Holandesa para a Substituição de Testes em Animais (Stichting Proefdiervrij, concessão #114025007), bem como bolsas de pesquisa de empresas como Boehringer Ingelheim e Galapagos. A Figura 1 foi criada com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 1,000 ohm test resistor | World Precision Instruments | N/A | Used to calibrate the EVOM2 Epithelial Voltohmmeter |
| 4-[2-(5,6,7,8-Tetrahydro-5,5,8,8-tetramethyl-2-naphthalenyl)ethynyl)-benzoic acid (EC 23) | Tocris | 4011 | Used in cBD medium |
| 6-well Clear TC-treated Multiple Well Plates | Corning | 3506 | Used in the first step to grow the cells isolated form the bronchial ring |
| Airway Epithelial Cell Growth Medium Kit | PromoCell | C-21160 | Used to compare to cBD medium |
| Bead Bath 20 Liter | Lab Armor | 74220-720 | Used to pre-warm cell culture solutions |
| BEGM Bronchial Epithelial Cell Growth Medium BulletKit | LONZA | CC-3170 | Used to compare to cBD medium |
| Bovine albumin fraction V (BSA) | Thermo Fisher Scientific | 15260037 | Used in coating solution |
| Bovine pituitary extract (BPE) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Bronchial epithelial cell growth supplement (BEpiCGS) | ScienCell Research Laboratories | 3262 | Used in cBD medium |
| Bronchial epithelial cell medium-basal (BEpiCM-b) | ScienCell Research Laboratories | SCC3211-b | Used in cBD medium |
| Cell culture inserts; 12 mm Transwell with 0.4 µm pore polyester membrane insert | Corning | 3460 | Cell culture inserts used in the protocol |
| Cell culture inserts; 12-well inserts, 0.4 µm PET clear | CellQART made by SABEU | 9310412 | Cell culture inserts used to compare with Corning cell culture inserts |
| Cell culture inserts; 12-well ThinCert Tissue culture Inserts | Greiner Bio-One | 82050-032 | Cell culture inserts used to compare with Corning cell culture inserts |
| CELLSTAR flask, TC, PS, 250 ml, 75 cm2 | Greiner Bio-One | 658170 | Used to expand the number cells |
| CFX Maestro 1.0 | Bio-Rad | N/A | Software program for analyzing qPCR data generated with the CFX384 System |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad | 1855484 | qPCR detection system |
| Chopstick electrode set | World Precision Instruments | STX2 | Used to measure electrical resistance in ALI-PBEC |
| CO2-Incubator | PHCbi | MCO-170AICUV-PE | Cell culture incubator used for mycplasma free cell cultures |
| CO2-Incubator | Hereaus | Heracell 150 | Cell culture incubator used for possibly mycplasma infected cell cultures |
| Coolcell Container | Corning | 432006 | Used to cryopreserve cells at -80 °C before transfer to liquid N2 |
| Countess 3 Automated cell counter | Thermo Fisher Scientific | AMQAX2000 | Used to count cells and determine the cell concentration |
| Cryovials | Nalgene | 479-3224 | Used to cryopreserve cells in |
| D-Glucose | Avantor VWR BDH CHEMICALS | 101174Y | Used in soft trypsin |
| Dimethyl sulfoxide (DMSO) | Avantor VWR | 0231 | Used in cell freeze medium |
| dNTP (10 mM) | Promega | U1515 | Used in the synthesis of cDNA |
| Dulbecco's Modified Eagle's Medium (DMEM) + 4500 mg/l D-Glucose | STEMCELL Technologies | 36250 | Used in cBD medium |
| Dulbecco's Modified Eagle's Medium (DMEM) 4.5 g/l glucose with l-glutamine | LONZA | LOBE12-604F | Used in cBD medium to compare with DMEM from other manufacturers |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, pyruvate | Thermo Fisher Scientific | 41966029 | Used in cBD medium to compare with DMEM from other manufacturers |
| Epidermal growth factor (EGF) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Ethylenediaminetetraacetic acid (EDTA) | Avantor VWR BDH CHEMICALS | 443885J | Used in soft trypsin |
| EVOM2 Epithelial Voltohmmeter | World Precision Instruments | 91799 | Used with the chopstick electrode set to measure electrical resistance in ALI-PBEC |
| Fibronectin solution, Human | PromoCell | C-43060 | Used in coating solution |
| Glutamax | Thermo Fisher Scientific | 35050038 | Used in cBD medium |
| Hanks balanced salt solution (HBSS) | ScienCell Research Laboratories | SCC0313 | Used to dissolve protease XIV |
| IQ SYBR Green Super mix | Bio-Rad | 170887 | qPCR reagent |
| Isoproterenol hydrochloride, (-)- | Sigma-Aldrich | I-6504 | Used in c-KSFM |
| Keratinocyte-SFM (KSFM) | Thermo Fisher Scientific | 17005-034 | Used in c-KSFM |
| Maxwell RSC Instrument | Promega | AS4500 | Automated RNA isolation system |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | Used to isolate total RNA with the Maxwell RSC Instrument |
| M-MLV Reverse transcriptase | Promega | M5301 | Used in the synthesis of cDNA |
| M-MLV Reverse transcriptase 5X reaction buffer | Promega | M531A | Used in the synthesis of cDNA |
| MycoStrip | InvivoGen | rep-mys-10 | Used to detect the presence of mycoplasma in cell culture samples |
| N-2-hydroxyethylpiperazine-N-2-ethane sulfonic acid (HEPES) | Thermo Fisher Scientific | 15630056 | Used in cBD medium |
| Oligo(dT)15 | Qiagen | 79237 | Used in the synthesis of cDNA |
| Penicillin/Streptomycin solution (Pen/Strep) | ScienCell Research Laboratories | SCC0513 | Used as antibiotic in c-KSFM and cBD medium |
| Phosphate buffered saline (PBS) | LUMC pharmacy | N/A | Used in different steps of the protocol |
| Pneumacult-ALI Medium | STEMCELL Technologies | 05002 | Used to grow cells in the differentiation stage to compare to cBD medium |
| Pneumacult-Ex Plus Medium | STEMCELL Technologies | 05040 | Used to grow cells in the submerged stage to compare to cBD medium |
| Primer, ATP5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: TCACCCAGGCTGGTTCAGA |
| Primer, ATP5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGTGGCCAGGGTAGGCTGAT |
| Primer, FOXJ1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGAGGGGACGTAAATCCCTA |
| Primer, FOXJ1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TTGGTCCCAGTAGTTCCAGC |
| Primer, MUC5AC, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCTTCGACGGACAGAGCTAC |
| Primer, MUC5AC, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCTCGGTGACAACACGAAAG |
| Primer, MUC5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGGCTTTGACAAGAGAGT |
| Primer, MUC5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGGATGGTCGTGTTGATGCG |
| Primer, RPL13A, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: AAGGTGGTGGTCGTACGCTGTG |
| Primer, RPL13A, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: CGGGAAGGGTTGGTGTTCATCC |
| Primer, SCGB1A1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: ACATGAGGGAGGCAGGGGCTC |
| Primer, SCGB1A1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: ACTCAAAGCATGGCAGCGGCA |
| Primer, TP63, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCACCTGGACGTATTCCACTG |
| Primer, TP63, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCGAATCAAATGACTAGGAGGGG |
| Primocin | InvivoGen | ant-pm-2 | Used as antimicrobial agent against bacteria, mycoplasma, and fungi in c-KSFM medium |
| Protease XIV | Sigma-Aldrich | P5147 | Used for the enzymatic treatment of the bronchial ring |
| RNAsin Recombinant Ribonuclease inhibitor | Promega | N2515 | Used in the synthesis of cDNA |
| Soybean trypsin inhibitor (SBTI) | Sigma-Aldrich | T9128 | Used to inhibit the action of soft trypsin |
| T100 Thermal Cycler | Bio-Rad | 1861096 | Used in the synthesis of cDNA |
| TissueSAFE plus | MILESTONE MEDICAL | N/A | Vacuum transfer system for biological specimens |
| Trypan blue solution | Thermo Fisher Scientific | 15250061 | Used to count live- and dead cells |
| Trypsin 1:250 | Thermo Fisher Scientific | 27250-018 | Used in soft trypsin |
| Type I collagen solution (PureCol) | Advanced BioMatrix | 5005-B | Used in coating solution |
| Universal container, PP, with PE screw cap | Avantor VWR | 216-2053 | Used in the protocol for the Protease XIV treatment of the bronchial ring |
Referências
- Aghapour, M., et al. Role of air pollutants in airway epithelial barrier dysfunction in asthma and COPD. European Respiratory Review. 31 (163), 210112 (2022).
- de Waal, A. M., Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Duchesne, M., Okoye, I., Lacy, P. Epithelial cell alarmin cytokines: Frontline mediators of the asthma inflammatory response. Frontiers in Immunology. 13, 975914 (2022).
- Hewitt, R. J., Lloyd, C. M. Regulation of immune responses by the airway epithelial cell landscape. Nature Reviews Immunology. 21 (6), 347-362 (2021).
- Ruysseveldt, E., Martens, K., Steelant, B. Airway basal cells, protectors of epithelial walls in health and respiratory diseases. Frontiers in Allergy. 2, 787128 (2021).
- Alysandratos, K. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Hammad, H., Lambrecht, B. N. Barrier epithelial cells and the control of type 2 immunity. Immunity. 43 (1), 29-40 (2015).
- Hynds, R. E., Bonfanti, P., Janes, S. M. Regenerating human epithelia with cultured stem cells: feeder cells, organoids and beyond. EMBO Molecular Medicine. 10 (2), 139-150 (2018).
- Hiemstra, P. S., Tetley, T. D., Janes, S. M. Airway and alveolar epithelial cells in culture. The European Respiratory Journal. 54 (5), 1900742 (2019).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), 2137 (2020).
- Leung, C., Wadsworth, S. J., Yang, S. J., Dorscheid, D. R. Structural and functional variations in human bronchial epithelial cells cultured in air-liquid interface using different growth media. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1063-L1073 (2020).
- Morgan, R., et al. A medium composition containing normal resting glucose that supports differentiation of primary human airway cells. Scientific Reports. 12 (1), 1540 (2022).
- Ghosh, B., et al. Strong correlation between air-liquid interface cultures and in vivo transcriptomics of nasal brush biopsy. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1056-L1062 (2020).
- Pezzulo, A. A., et al. The air-liquid interface and use of primary cell cultures are important to recapitulate the transcriptional profile of in vivo airway epithelia. American Journal of Physiology. Lung Cellular and Molecular Physiology. 300 (1), L25-L31 (2011).
- Dvorak, A., Tilley, A. E., Shaykhiev, R., Wang, R., Crystal, R. G. Do airway epithelium air-liquid cultures represent the in vivo airway epithelium transcriptome. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 465-473 (2011).
- Legebeke, J., et al. Temporal whole-transcriptomic analysis of characterized in vitro and ex vivo primary nasal epithelia. Frontiers in Cell and Developmental Biology. 10, 907511 (2022).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- van Wetering, S., et al. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. Journal of Investigative Medicine. 48 (5), 359-366 (2000).
- Balk, S. D. Calcium as a regulator of the proliferation of normal, but not of transformed, chicken fibroblasts in a plasma-containing medium. Proceedings of the National Academy of Sciences. 68 (2), 271-275 (1971).
- Gail, M. H., Boone, C. W., Thompson, C. S. A calcium requirement for fibroblast motility and prolifertion. Experimental Cell Research. 79 (2), 386-390 (1973).
- Dulbecco, R., Elkington, J. Induction of growth in resting fibroblastic cell cultures by Ca. Proceedings of the National Academy of Sciences. 72 (4), 1584-1588 (1975).
- van Wetering, S., et al. Epithelial differentiation is a determinant in the production of eotaxin-2 and -3 by bronchial epithelial cells in response to IL-4 and IL-13. Molecular Immunology. 44 (5), 803-811 (2007).
- Amatngalim, G. D., et al. Aberrant epithelial differentiation by cigarette smoke dysregulates respiratory host defence. The European Respiratory Journal. 51 (4), 1701009 (2018).
- Christie, V. B., et al. Retinoid supplementation of differentiating human neural progenitors and embryonic stem cells leads to enhanced neurogenesis in vitro. Journal of Neuroscience Methods. 193 (2), 239-245 (2010).
- Schrumpf, J. A., Ninaber, D. K., vander Does, A. M., Hiemstra, P. S. TGF-β1 impairs vitamin D-induced and constitutive airway epithelial host defense mechanisms. Journal of Innate Immunity. 12 (1), 74-89 (2020).
- Schrumpf, J. A., et al. Proinflammatory cytokines impair vitamin D-induced host defense in cultured airway epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (6), 749-761 (2017).
- Boei, J. J. W. A., et al. Xenobiotic metabolism in differentiated human bronchial epithelial cells. Archives of Toxicology. 91 (5), 2093-2105 (2017).
- Wang, Y., et al. Impact of human airway epithelial cellular composition on SARS-CoV-2 infection biology. bioRxiv. , (2021).
- Nawroth, J. C., et al. Breathing on Chip: Dynamic flow and stretch tune cellular composition and accelerate mucociliary maturation of airway epithelium in vitro. bioRxiv. , (2022).
- Horani, A., Nath, A., Wasserman, M. G., Huang, T., Brody, S. L. Rho-associated protein kinase inhibition enhances airway epithelial Basal-cell proliferation and lentivirus transduction. American Journal of Respiratory Cell and Molecular Biology. 49 (3), 341-347 (2013).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Eenjes, E., et al. Disease modeling following organoid-based expansion of airway epithelial cells. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (4), L775-L786 (2021).
- Butler, C. R., et al. Rapid expansion of human epithelial stem cells suitable for airway tissue engineering. American Journal of Respiratory and Critical Care Medicine. 194 (2), 156-168 (2016).
- Amatngalim, G. D., et al. Antibacterial defense of human airway epithelial cells from chronic obstructive pulmonary disease patients induced by acute exposure to nontypeable Haemophilus influenzae: modulation by cigarette smoke. Journal of Innate Immunity. 9 (4), 359-374 (2017).
- Plebani, R., et al. 3D lung tissue models for studies on SARS-CoV-2 pathophysiology and therapeutics. International Journal of Molecular Sciences. 23 (17), 10071 (2022).
- Wong, A. P., et al. Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein. Nature Biotechnology. 30 (9), 876-882 (2012).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Biology. 107, 183-206 (2005).
- Cao, J., Wong, C. K., Yin, Y., Lam, C. W. K. Activation of human bronchial epithelial cells by inflammatory cytokines IL-27 and TNF-alpha: implications for immunopathophysiology of airway inflammation. The Journal of Cellular Physiology. 223 (3), 788-797 (2010).
- Tsao, P. N., et al. Notch signaling controls the balance of ciliated and secretory cell fates in developing airways. Development. 136 (13), 2297-2307 (2009).
- Laoukili, J., et al. IL-13 alters mucociliary differentiation and ciliary beating of human respiratory epithelial cells. The Journal of Clinical Investigation. 108 (12), 1817-1824 (2001).
- Mertens, T. C. J., et al. Cigarette smoke differentially affects IL-13-induced gene expression in human airway epithelial cells. Physiological Reports. 5 (13), e13347 (2017).
- Zarcone, M. C., et al. Effect of diesel exhaust generated by a city bus engine on stress responses and innate immunity in primary bronchial epithelial cell cultures. Toxicology in Vitro. 48, 221-231 (2018).
- vander Does, A. M., et al. Early transcriptional responses of bronchial epithelial cells to whole cigarette smoke mirror those of in-vivo exposed human bronchial mucosa. Respiratory Research. 23 (1), 227 (2022).
- Wang, Y., Ninaber, D. K., van Schadewijk, A., Hiemstra, P. S. Tiotropium and fluticasone inhibit rhinovirus-induced mucin production via multiple mechanisms in differentiated airway epithelial cells. Frontiers in Cellular and Infection Microbiology. 10, 278 (2020).
- Ronaghan, N. J., et al. M1-like, but not M0- or M2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), 0276013 (2022).
- Gindele, J. A., et al. Opposing effects of in vitro differentiated macrophages sub-type on epithelial wound healing. PLoS One. 12 (9), e0184386 (2017).
- van Riet, S., et al. Modulation of airway epithelial innate immunity and wound repair by M(GM-CSF) and M(M-CSF) macrophages. Journal of Innate Immunity. 12 (5), 410-421 (2020).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Stucki, A. O., et al. A lung-on-a-chip array with an integrated bio-inspired respiration mechanism. Lab on a Chip. 15 (5), 1302-1310 (2015).
- Peters-Hall, J. R., et al. Long-term culture and cloning of primary human bronchial basal cells that maintain multipotent differentiation capacity and CFTR channel function. American Journal of Physiology. Lung Cellular and Molecular Physiology. 315 (2), L313-L327 (2018).
- Bartman, C. M., Stelzig, K. E., Linden, D. R., Prakash, Y. S., Chiarella, S. E. Passive siRNA transfection method for gene knockdown in air-liquid interface airway epithelial cell cultures. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), L280-L286 (2021).
- Koh, K. D., et al. Efficient RNP-directed human gene targeting reveals SPDEF is required for IL-13-induced mucostasis. American Journal of Respiratory Cell and Molecular Biology. 62 (3), 373-381 (2020).
- Bhargava, N., et al. Development of an efficient single-cell cloning and expansion strategy for genome edited induced pluripotent stem cells. Molecular Biology Reports. 49 (8), 7887-7898 (2022).
- Angelopoulou, A., Papaspyropoulos, A., Papantonis, A., Gorgoulis, V. G. CRISPR-Cas9-mediated induction of large chromosomal inversions in human bronchial epithelial cells. STAR Protocols. 3 (2), 101257 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados