Method Article
从切除的肺组织中分离支气管上皮细胞用于生物样本库并建立分化的气液界面培养物
摘要
这里介绍的是一种可重复、经济实惠且稳健的方法,用于分离和扩增原代支气管上皮细胞以进行长期生物样本库,并通过在气液界面培养产生分化的上皮细胞。
摘要
气道上皮细胞层形成肺组织和外部环境之间的第一道屏障,因此不断暴露于吸入物质,包括传染因子和空气污染物。气道上皮层在多种急性和慢性肺部疾病中起核心作用,并且通过吸入进行针对该上皮的各种治疗。了解上皮在发病机制中的作用以及如何将其靶向用于治疗需要可靠且具有代表性的模型。 体外 上皮培养模型越来越多地被使用,并提供了在受控环境中进行实验的优势,使细胞暴露于不同种类的刺激、毒物或感染因子。使用原代细胞代替永生化或肿瘤细胞系的优点是,与细胞系相比,这些细胞在培养中分化为假分层极化上皮细胞层,上皮的代表性更好。
这里介绍的是一个强大的方案,在过去几十年中进行了优化,用于从肺组织中分离和培养气道上皮细胞。该程序允许通过在气液界面 (ALI) 上培养来成功分离、扩增、培养和粘液纤毛分化原发性支气管上皮细胞 (PBEC),并包括生物样本库方案。此外,还描述了使用细胞特异性标记基因表征这些培养物。这些 ALI-PBEC 培养物可用于一系列应用,包括暴露于全香烟烟雾或炎症介质,以及与病毒或细菌共培养/感染。
本手稿中提供的协议以逐步的方式说明了该程序,预计将为那些有兴趣在其实验室中实施或调整此类培养系统的人提供基础和/或参考。
引言
气道上皮在各种急性和慢性肺部疾病中的作用已在各种综述中描述1,2,3,4,5,6,7。气道上皮细胞的良好分化培养是揭示气道上皮作用的重要工具。气液界面(ALI)气道上皮细胞培养广泛用于促进气道基底上皮细胞的分化,从而在体外可靠地研究气道上皮8,9。在过去的几年中,由于与 COVID-19 大流行相关的新研究计划以及全球向无动物研究的过渡,此类模型的使用进一步增加。因此,该模型细胞系的使用增加强调了共享程序和经验以获得稳健结果的必要性。这也将允许比较研究小组之间的结果。程序的稳健性是关键特征,因此需要进行质量控制。一些实验室已经投资开发在ALI培养原代气道上皮细胞的方案。详细共享这些程序时,可以减少时间、精力和所需的预算。这些细节包括,例如,由各种制造商提供的细胞培养塑料和培养基的选择,因为发现这会影响所获得的培养物的特性10,11,12。这强调了分享培养程序的经验和细节的重要性,因为如果没有这样的见解,结果可能会受到影响和/或各个实验室的验证工作可能会受到阻碍。
人肺上皮包括多种细胞类型,包括基底细胞、纤毛细胞、杯状细胞和俱乐部细胞等主要类型。为了在体外可靠地模拟气道中的上皮细胞层,需要在培养模型中表示这些细胞类型,并且它们的极化和功能保持13,14,15,16。认识到供体特征(包括疾病状态)和细胞的解剖起源(即鼻腔、气管、大气道和小气道)可能影响细胞培养物的细胞组成和功能反应同样重要。相关专业知识和实践是成功培养原代气道上皮细胞和直观(通过培养过程中的目视检查)和定量评估培养质量的先决条件。该贡献的目的是为原代人支气管上皮细胞(PBEC)的分离和培养提供一种经济和时间有效的方法,该方法也可以应用于气管和小气道上皮细胞的培养。除了描述从切除的肺组织中分离这些细胞的方法外,还介绍和讨论了一种扩增和生物库的方法,以及最终在合理的成本和时间段内建立和表征分化的ALI培养物的方法。
研究方案
从荷兰莱顿大学医学中心接受肺癌切除手术的患者获得的肉眼正常肺组织中分离细胞。从中获取这种肺组织的患者通过无异议系统 入 组生物库,以便匿名编码进一步使用此类组织(www.coreon.org)。但是,自 2022 年 9 月 1 日起,经机构医学伦理委员会批准(B20.042/Ab/ab 和 B20.042/Kb/kb),根据 LUMC 生物库的当地法规,使用主动知情同意将患者纳入生物库。
注意:除非另有说明,否则所有程序均在生物安全柜中根据当地生物安全规则在无菌工作条件下进行,同时戴上手术手套和实验室外套。有关实验方案中使用的所有培养基、试剂和其他溶液,请参阅材料表和补充表1。有关详细的协议步骤,请参见图 1
1.从人肺组织中分离支气管上皮细胞
注意:为了获得支气管上皮细胞分离的最佳成功率,切除的支气管环应将切除的支气管环浸没在4°C下,在添加Primocin的磷酸盐缓冲盐水(PBS)中最多24小时。
- 程序开始前的准备工作
- 如 补充表1所述,在PBS中制备包衣溶液,并在每孔中涂覆适当数量的6孔板,并用1.5 mL包衣溶液包被。在37°C和5%CO2的细胞培养箱中孵育2小时。
注意:要包被的孔数取决于切除组织的大小。作为粗略的指南,当切除的支气管环直径为 10 mm,宽度为 4 mm 时,涂覆四个 6 孔板。 - 制备完整的无血清角质形成细胞培养基(c-KSFM),如 补充表1中所述;6 孔板每孔使用 2 mL 培养基。
注意:此c-KSFM可以在4°C下储存7天。c-KSFM是一种低钙培养基,用于扩增气道上皮细胞,同时抑制污染成纤维细胞的生长。
- 如 补充表1所述,在PBS中制备包衣溶液,并在每孔中涂覆适当数量的6孔板,并用1.5 mL包衣溶液包被。在37°C和5%CO2的细胞培养箱中孵育2小时。
- 通过在10cm培养皿中的10mL无菌PBS中轻轻冲洗环来清洁支气管环。用镊子小心地握住戒指(只能触摸外面),用小剪刀去除任何多余的结缔组织和血液残留物。为了进一步加工,将戒指切成两半。
注意:过程中使用的所有工具在使用前都应进行消毒。 - 将支气管环的两半浸没在汉克平衡盐溶液(HBSS)中的10mL蛋白酶XIV预热溶液(1.8mg / mL)中,包括Primocin在封闭的无菌容器中,并在细胞培养箱中于37°C孵育2小时。
注意:HBSS用作蛋白酶XIV的稀释剂,以在2小时孵育期间将细胞从组织中分离。HBSS是一种平衡等渗解决方案,可在短期孵育期间保持细胞活力。 - 孵育后,将组织碎片转移到装有10mL温热PBS的培养皿中,并使用弯曲的镊子刮擦环的内部以获得细胞溶液。
注意:组织看起来更柔软,有点膨胀。 - 弃去环,将细胞溶液转移到 50 mL 管中,然后加入温热的 PBS 以获得 50 mL 的最终体积。在230× g 和室温(RT)下离心7分钟。
- 吸出上清液并将沉淀重悬于10mL温热的PBS中。此外,用温热的 PBS 补足体积至 50 mL。在室温下以230× g 离心7分钟。
- 吸出上清液并将细胞沉淀重悬于适量的含有普罗莫辛的温热c-KSFM中。
注意:Primocin使用至少7天,以消除组织中可能存在的任何细菌,真菌或(重要的是)支原体;7天后,仅向培养基中添加青霉素/链霉素就足够了。 - 从 6 孔板中吸出包被溶液,每孔加入 2 mL 细胞悬液。
- 让细胞生长至达到80%至90%的汇合度,并每周更换培养基三次(例如,每周一,周三和周五)。通常在 7 到 14 天之间达到所需的汇合程度;如果达到所需汇合所需的时间超过14天,则丢弃细胞。
注意:在最初的几天里,只有少数细胞开始增殖;几天后细胞组很明显。
2. 人原发性支气管上皮细胞(PBEC)的冷冻保存
注意:在-80°C和-196°C的温度下工作时,使用冷冻手套进行保护,镊子用于转移冷冻小瓶。使用液氮时,使用冷冻手套和面罩进行个人防护。
- 吸出培养基,每孔用 2 mL 温热的 PBS 洗涤孔一次。
- 通过每孔加入0.5mL软胰蛋白酶来胰蛋白酶消化细胞(有关软胰蛋白酶溶液的组成,请参见 补充表1 )。将细胞在37°C孵育5至最多10分钟。 在平板中旋转胰蛋白酶溶液,并通过轻轻敲击平板释放细胞。
- 将分离的细胞转移到含有1.1 mg / mL大豆胰蛋白酶抑制剂(SBTI;以抑制胰蛋白酶活性)的50 mL离心管中,该离心管与青霉素/链霉素一起溶解在KSFM中。SBTI 的体积必须是软胰蛋白酶总体积的两倍(即每孔 1 mL)。
注意:不要将SBTI直接添加到孔中,因为细胞将在几分钟内重新附着。 - 在室温下以230× g 离心管7分钟。
- 弃去上清液并将沉淀细胞重悬于含有青霉素/链霉素但没有其他添加剂的 10 mL RT KSFM 中。使用血细胞计数器或自动细胞计数器计数细胞。通过以 1:1 的比例添加台盼蓝进行活/死细胞计数,或使用替代活/死细胞计数程序。
- 以每mL冷冻培养基400,000个细胞的浓度冷冻保存细胞(参见 补充表 1的组成),并在每次冷冻管中加入1 mL该悬浮液。将冷冻管转移到冷室容器中,并将其置于-80°C。 24小时后,将小瓶转移到-196°C液氮中长期储存。
注意:将细胞转移到冷冻培养基有两种选择,这两种选择都效果很好:1)通过离心再次沉淀细胞并以所需的细胞浓度重悬于冷冷冻培养基中;或2)加入冷冷冻培养基,并根据细胞所在的KSFM体积调整冷冻保存剂(二甲基亚砜[DMSO])的浓度。
3. 解冻冷冻保存的 PBEC 并培养它们以在插入物上培养
- 在 PBS 中用 10 mL 包衣溶液涂覆 T75 细胞培养瓶过夜,盖子紧闭。将烧瓶在37°C和5%CO2的细胞培养箱中孵育。
- 在解冻冷冻保存的PBEC之前,从烧瓶中取出涂层溶液并填充10mL的c-KSFM。在细胞培养箱中将其加热至37°C,稍微打开盖子让培养箱空气进入。
- 在37°C水浴或珠浴中快速解冻细胞。
注意:珠浴比水浴更受欢迎,因为污染风险较低,能耗较低。 - 将冷冻管的全部内容物加入带有培养基的预热T75烧瓶中(步骤3.2),并将细胞均匀分布。
注意:请勿在此阶段离心细胞,因为它们将无法在离心步骤中存活。 - 大约4小时后,确保细胞充分附着。用 10 mL 新鲜、温热的 c-KSFM 替换培养基。
注意:这样,冷冻介质中的DMSO就会被去除。此步骤应在将细胞接种在烧瓶中后4小时至24小时之间进行。 - 培养细胞直到达到80%至90%的汇合度,每周一,周三和周五更换培养基。
4. 建立与原代支气管上皮细胞(ALI-PBEC)的气液界面培养
注意:以下程序适用于在11.9 mm内径插入物上培养PBEC。
- 每次插入用0.4 mL包衣溶液涂覆适当数量的细胞培养物。在细胞培养箱中于37°C孵育过夜。
- 制备完整的BD培养基(cBD培养基),如 补充表1中所述。
注意:cBD培养基是一种复合培养基(见 补充表1),配制用于支持支气管上皮细胞的生长更长时间,同时允许它们在ALI的视黄酸(RA)(或本协议中使用的RA类似物)浓度和培养物增加后分化,如步骤4.10中所述。 - 在T75烧瓶中胰蛋白酶消化PBEC,每个烧瓶使用2mL软胰蛋白酶。孵育细胞5至10分钟以使细胞分离(基于目视检查)。孵育5分钟后,通过在烧瓶中旋转胰蛋白酶并轻轻敲击烧瓶来促进细胞的分离(如果需要,重复)。
- 向烧瓶中加入 4 mL SBTI,并将细胞悬液直接转移到 25 mL 离心管中。
注意:细胞在几分钟内重新附着。因此,当使用多个烧瓶时,在将SBTI加入第二个烧瓶之前,必须将步骤4.4中获得的细胞悬液直接转移到离心管中。在此过程中,最多同时处理五个烧瓶。 - 在室温下以230× g 离心管7分钟。
- 将细胞重悬于6 mL cBD培养基中,并使用血细胞计数器或自动细胞计数器对细胞进行计数。例如,通过以 1:1 的比例添加台盼蓝或使用其他活/死细胞计数程序来执行活/死细胞计数。
- 从细胞培养插入物中取出包衣溶液。
- 用补充有1nM EC 23的cBD培养基稀释步骤4.6中产生的细胞悬液至浓度为80,000个细胞/mL,并在插入物的膜顶部加入0.5mL。将 1.5 mL 补充有 1 nM EC 23 的 cBD 培养基加入插入物下方的孔中。
- 用补充有1nM EC 23的cBD培养基更换培养基,每周三次,直到培养物准备好暴露在空气中(即,达到100%汇合后2天)。每次在插入物内(在细胞上)添加0.5 mL培养基,将1.5 mL添加到底部隔室(孔上)。
注意:通常,在将PBEC接种到插入物上约5天后,细胞层达到100%汇合度。根据对细胞汇合度的目视检查,决定在2天后将细胞转移到ALI阶段。 - 当细胞准备好转移到ALI时(即,达到100%汇合后2天),从插入物和孔中取出培养基,不要在插入物内添加新培养基,并仅向孔中添加新培养基(1mL补充有50nM EC 23的cBD培养基)。每周更换三次孔中的培养基。
- 为了去除多余的粘液和细胞碎片,在插入物内细胞层的顶端轻轻添加200μL温热的PBS(最好 通过 插入物的侧面,而不是直接移液细胞),并在37°C的细胞培养箱中孵育10分钟。 然后,吸出PBS以去除多余的粘液和细胞碎片。
注意:从这一点开始(ALI培养的开始),在更换下部隔室的培养基之前,每次都用PBS清洗细胞的顶端。 - 在ALI培养细胞至少2周,以确保所有主要细胞类型都有代表。
5. 从混合捐赠人群中建立ALI-PBEC文化
- 使用来自多达五个个体供体的细胞从混合群体开始PBEC培养。
- 使用步骤4.7中产生的细胞混合每个供体相同数量的细胞,以达到每个插入片段总共150,000个细胞(即,当使用五个供体时,每个供体30,000个细胞)。这将确保插入片段中的增殖保持在最低限度,并且培养物中存在来自个体供体的相同数量的细胞。
- 按照步骤 4.9-4.12 中所述继续 ALI-PBEC 培养。
6. ALI-PBEC菌种的质量控制
- 在细胞培养过程中监测经上皮电阻(TEER)
注意:基于伏欧计的电阻测量可以在ALI-PBEC培养过程中的任何给定时间进行,并且每次在相同条件下根据相同的协议进行,因为电阻测量受各种变量的影响,包括电极位置,温度,介质和处理。TEER可以通过应用以下基于欧姆定律的公式来计算测量的电阻: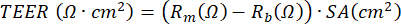 其中Rm 是测量的电阻,Rb 是没有涂层和电池的插入物的基线电阻,SA是插入件17的膜的表面积。
其中Rm 是测量的电阻,Rb 是没有涂层和电池的插入物的基线电阻,SA是插入件17的膜的表面积。- 将 200 μL 温热的 PBS 轻轻添加到细胞层的顶端侧,以去除细胞上的粘液和碎片。将插入物在37°C的细胞培养箱中孵育10分钟,然后再次除去PBS。
- 将 700 μL 温热的 PBS 轻轻添加到细胞层的顶端侧,并将插入物在室温下孵育 10 分钟,以稳定测量温度。
- 使用 1,000 Ω测试电阻校准伏欧表,设置伏欧表以测量欧姆,并使用螺丝刀调整"R ADJ"校准螺钉,直到设置为 1,000 Ω。
- 通过在无菌水 (RT) 中上下移动电极几次,然后在无菌 PBS (RT) 中冲洗电极。
- 测量插入物中细胞层的电阻。为此,将电极放置在孔中的垂直位置,电极的长臂接触板的底部。这样,短臂位于插入物内的细胞层上方。读取伏欧表上显示的值。
注意:显示的值不会完全稳定;在值间歇性时读取该值。 - 在测量之间,通过在无菌PBS (RT)中上下移动电极几次来清洁电极。
- 测量完成后,通过在无菌水 (RT)、无菌 PBS (RT) 和 70% 乙醇 (RT) 中上下移动几次来清洁电极。将电极干燥存放。
- 通过在插入物内加入 700 μL 温 PBS 和孔中 1 mL 温热的 PBS 并与其他插入物一起测量电阻,对插入物(无涂层)和细胞进行基线测量。
- 评估 ALI-PBEC 培养物的细胞组成
- 在ALI阶段,通过目视评估跳动纤毛来检查鉴别。这些可以通过标准明场显微镜 在 细胞顶端侧暴露空气后9天观察到。
注意:清洗顶端表面后,最好直接看到跳动的纤毛。杯状细胞产生粘液,因此在清洗顶端表面期间观察到的粘液的存在是杯状细胞形成的标志。然而,杯状细胞的水平和产生的粘液量是高度依赖供体的。在洗涤插入物中细胞层的顶端表面后吸出PBS时可以看到粘液的存在;在这种情况下,吸出的PBS更粘稠,并且在吸气时可能会观察到粘液线。 - 使用免疫染色和荧光显微镜或荧光激活细胞分选(FACS)或通过实时定量聚合酶链反应(RT-qPCR)进行基因表达分析来评估细胞组成,提供了有关培养物分化状态的重要信息,但其描述超出了本文的范围。
- 在ALI阶段,通过目视评估跳动纤毛来检查鉴别。这些可以通过标准明场显微镜 在 细胞顶端侧暴露空气后9天观察到。
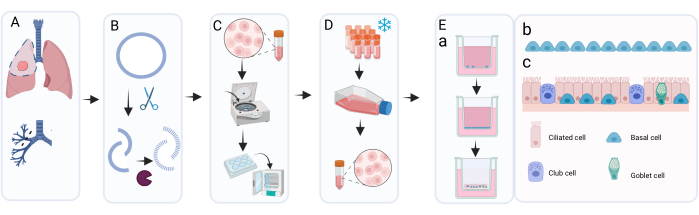
图 1:原代支气管上皮细胞的分离、扩增和培养过程的示意图。 (A)在癌症切除手术期间获得肺组织,病理学家切除肉眼下正常且无肿瘤的支气管环组织。(B)清洁支气管环并暴露于酶处理以分离和解离细胞层。(C)洗涤回收的细胞悬液,并将细胞分布在6孔板的孔中以进行扩增。(D)在c-KSFM中用伯莫辛充分扩增分离的细胞后,通过胰蛋白酶消化解离细胞层,并将细胞重悬于冷冻培养基中以进行冷冻保存。需要时,冷冻保存的细胞解冻并使用c-KSFM在细胞培养瓶中与青霉素/链霉素再次扩增。扩增后,将它们接种在细胞培养插入物上的cBD培养基中;(伊)ALI-PBEC培养分两个主要阶段进行:浸没在cBD培养基中,补充有1nM EC 23,直到细胞完全汇合,然后去除顶端培养基并在ALI培养以允许分化;在此ALI阶段,将细胞在补充有50nM EC 23的cBD培养基中培养。(埃布)浸没培养过程中覆盖插入片段的基底细胞的图形表示。(欧共体)在 ALI 培养后在 EC 23 浓度增加的情况下获得的分化上皮细胞层的图形表示。 请点击此处查看此图的大图。
结果
使用浸没式培养物进行扩展
使用此处介绍的方法,从一个6孔板中平均可以获得8个具有400,000个细胞/冷冻管的冷冻管,以便在液氮中长期储存(图2A)。为了实现这一目标,将分离的PBEC在伯莫星存在下在6孔板中培养至少7天,最多14天(图2B),以排除微生物(特别是支原体)污染。图2A,B提供了来自不同供体的不同分离中获得的细胞数量和所需培养时间的见解。在通过胰蛋白酶消化收获细胞以储存在液氮中之前,汇合度必须超过80%。如果在14天内没有达到这一点,则不应冷冻保存细胞。重要的是,当收获用于储存和传代时,细胞层的汇合度不应超过~95%(图2C)。在液氮中储存后,可以将细胞解冻并培养以进行扩增,直到获得足够的细胞数用于ALI培养。在此阶段用于扩增细胞的培养基是c-KSFM,类似于从支气管环18收获后的初始培养。然而,现阶段不需要伯莫星,因为不存在源自肺组织的额外微生物污染的风险,因此可以将伯莫星改为青霉素/链霉素。该培养基有利于上皮细胞而不是成纤维细胞,因此通过更快地增殖成纤维细胞来防止培养物可能的过度生长19,20,21。使用c-KSFM培养基,细胞在烧瓶中展开并且不相互连接,这与现阶段浸没在cBD培养基中的培养细胞的形态明显不同(图2D,E)。在T75烧瓶中培养解冻的细胞5或6天后,细胞层应为80%-95%汇合,这意味着总共约3 x 106个细胞(图2F)。由此,可以生成大约75个用于ALI培养的插入物(12孔板大小)。
本文中描述的分离和培养方法也可以适用于支气管活检或支气管刷作为起始材料。
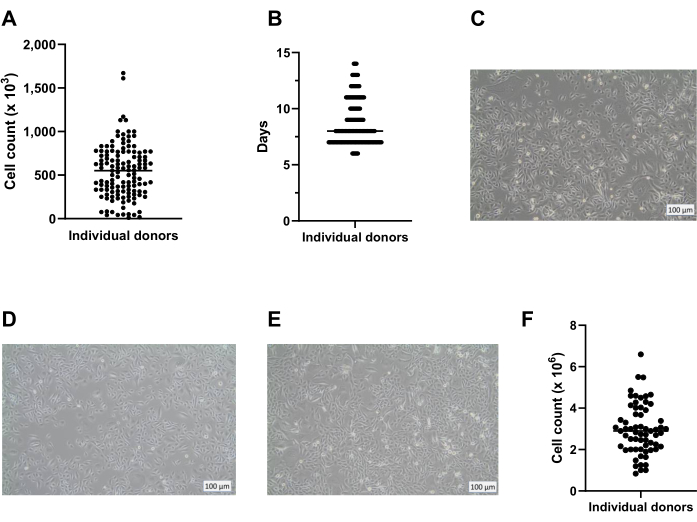
图2:冷冻保存前后的基底细胞扩增。 根据所述方案分离细胞并使用c-KSFM培养。监测每个供体产生的细胞数,当从6孔板(协议的步骤2)中收获传代0(P0)细胞时,使用自动细胞计数器(A)进行活细胞计数,n = 123供体,细胞计数表示为每孔收获的细胞数;每个点代表一个供体,中位数由水平条表示。(B)作为质量控制的一部分,监测P0细胞在6孔板中达到80%至90%汇合度所需的时间,并显示为在c-KSFM中开始浸没培养后的天数(n = 127个不同的供体)。每个捐赠者都用一个点表示,属于 1 天的所有点合并成一条线;线越宽,它所代表的捐助者就越多;细胞培养的中位数天数由较细的水平条表示。(C)在收获细胞进行长期冷冻保存的那一刻浸没在c-KSFM中生长的P0细胞的代表性明场图像。(D)在收获细胞并转移到插入物和(E)浸没在cBD培养基中生长的P1细胞的代表性明场图像。(F)从T75烧瓶(协议第4节)中收获P1细胞时,使用自动细胞计数器监测每个供体产生的活细胞数,n = 63个不同的供体;细胞计数表示为每个T75烧瓶的细胞数,每个供体用点表示,中位数细胞计数用水平条表示。 请点击此处查看此图的大图。
气液界面 (ALI) 培养
在开始ALI培养后7天,测量细胞层的电阻,应大于300 Ω(图3A);如果不能做到这一点,则由于可能缺乏紧密的连接形成,培养被视为失败。建议排除由于单个插入物中上皮层的损伤而导致的TEER值低的可能性,例如,在洗涤和抽吸过程中细胞层的损伤。这可以通过对培养物插入物的目视显微镜检查来检查。根据我们的经验,供体间电阻的变化可能很大(图3B),这也在文献14中报道,并且正如观察到的那样,也受到Dulbecco改性鹰培养基(DMEM)来源的显着影响(图3C)。
图3:经上皮电阻作为ALI-PBEC培养物的质量控制。 分离和扩增PBEC,建立分化的ALI-PBEC培养物。在培养过程中的几个时间点,测量电阻,随后计算TEER(Ω·cm2)。(A)在ALI后14天内测量电阻。n = 4 个不同的供体。数据表示为标准偏差 (SD) ±平均值。(B)作为ALI-PBEC细胞培养质量控制的一部分,在ALI后第7天(n = 50)和第14天(n = 25)测量电阻;每个点代表一个供体,中位数TEER(Ω·cm2)由水平条表示。使用非参数曼-惠特尼检验检验数据的显著性,未发现显著差异。(C) 测试了来自三个不同 DMEM 供应商的培养基,以评估对 TEER 形成的影响。n = 4个不同的供体;平均值±标示。 请点击此处查看此图的大图。
在建立差异化的ALI-PBEC培养物的同时,从空气暴露开始,RA的浓度增加22。通过这种方式,细胞从增殖切换到粘液纤毛分化,这早在使用明场显微镜暴露空气后 9 天(供体依赖性)可见。此时可以看到第一纤毛的运动,并且当基于分化管腔细胞23 标记的基因表达时,运动稍早一些(图4)。
如协议中所述,在更换培养基期间冲洗顶端表面时也可以观察到粘液的产生。RA对光非常敏感,这导致在相同原液浓度下活性变化很大。因此,RA被合成RA类似物EC 23取代,并以相同的浓度使用,其结果与实验测定的结果相似。出于这个原因并为了避免改变程序,所选的EC 23浓度保持等于先前使用的RA浓度(即50nM)24,25(图5)。图5A描述了使用不同浓度的EC 23时达到的TEER值,显示了在此测试浓度范围内50 nM处的最大TEER。图5B所示的结果证实,当使用50nM EC 23或RA时,纤毛细胞和杯状细胞标记的基因表达相似。在浸没阶段的培养过程中也需要EC 23(尽管浓度要低得多),因为在此浸没阶段省略它,仅在ALI阶段添加它会导致培养物永远不会达到完全汇合。产生具有可见睫状跳动活性和粘液产生的分化良好的ALI-PBEC培养物所需的时间约为14天,因此大多数实验在14-21天的ALI培养物之间开始(图4)。在ALI培养14天时观察到所有主要的不同细胞类型(基底细胞,纤毛细胞,杯状细胞和俱乐部细胞),尽管表达水平高度依赖于供体。通过 RT-qPCR 评估 TP63、FOXJ1、MUC5AC 和 SCGB1A1 的基因表达,或通过免疫荧光 (IF) 染色使用针对 p63、α-微管蛋白、Muc5AC 和 CC-16 的抗体进行蛋白质表达,以分别检测基底细胞、纤毛细胞、杯状细胞和俱乐部细胞的标志物25,26.然而,虽然 14-21 天可能被视为大多数实验的经验法则,但对于选定的实验,可以考虑更长的分化持续时间,如异生代谢、SARS-CoV-2 感染和粘膜纤毛清除评估27,28,29。
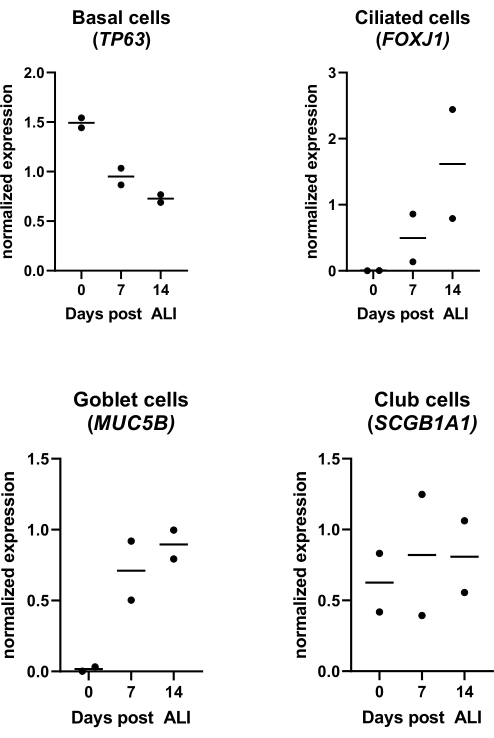
图 4:气液界面 (ALI) 培养物。分离和扩增PBEC,建立分化的ALI-PBEC培养物。在ALI后14天内监测ALI-PBEC培养物。在ALI后第0、7和14天裂解细胞培养物以分离RNA。显示了来自两个不同供体的数据,每个点代表随时间监测的一个供体,中位数由水平条表示。通过qPCR测量基底细胞、纤毛细胞、杯状细胞和俱乐部细胞标志物(分别为TP63、FOXJ1、MUC5B和SCGB1A1)的基因表达,并对RPL13A和ATP5B基因表达进行标准化(详见参考文献23)。 请点击此处查看此图的大图。
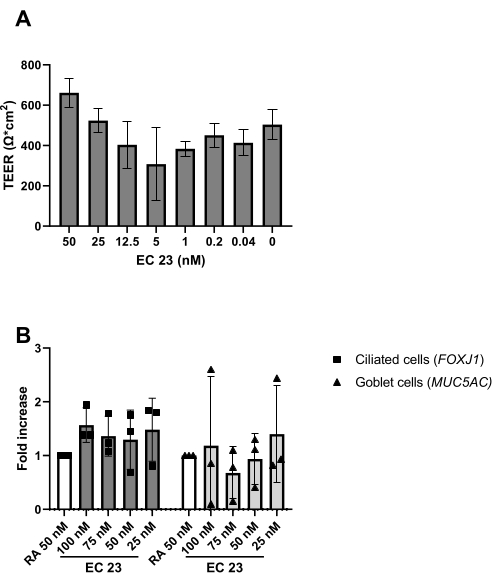
图 5:维甲酸 (RA) 及其合成类似物 EC 23 的比较。 分离和扩增PBEC,建立分化的ALI-PBEC培养物。在PBEC培养物开始暴露于空气时,RA(50 nM)被各种浓度的EC 23所取代。( A) 在ALI后第14天测量电阻,随后计算TEER(Ω·cm 2),n =2个供体,条形表示SD±平均值。 ( B) 在ALI后第14天,使用qPCR裂解细胞培养物以进行RNA分离,并随后对纤毛细胞和杯状细胞(FOXJ1,MUC5AC)的细胞标志物进行基因表达分析, 并针对 RPL13A 进行标准化(n = 3个供体)。与用50 nM RA培养的ALI-PBEC相比,显示其倍数增加,并描述为SD±平均值。 (详见参考文献 23 ) 请点击此处查看此图的大图。
在过去的几年中,已经研究了培养系统中替代产品的性能,例如培养基和文化塑料。进行此类评估的原因多种多样,包括制造商对培养基成分的变化、引入的新媒体以及 COVID-19 大流行期间(2020-2022 年)的产品短缺。根据对上皮细胞类型标志物的评估,观察到来自不同供应商的类似产品导致分化的上皮细胞培养物,尽管最终的细胞组成可能有很大差异(图6A),而TEER的差异不太明显(图6B)。另一方面,来自不同供应商的培养基确实导致细胞组成存在实质性差异;当使用不同品牌的刀片时,这种差异是有限的(图6C)。特别是,当使用来自STEMCELL Technologies的气道上皮细胞培养基PneumaCult时,观察到不同的形态和更快速的可见睫状活动形成。除了这些观察结果外,还注意到与cBD培养基相比,ALI-PBEC的TEER值和细胞组成的差异(图6D)。
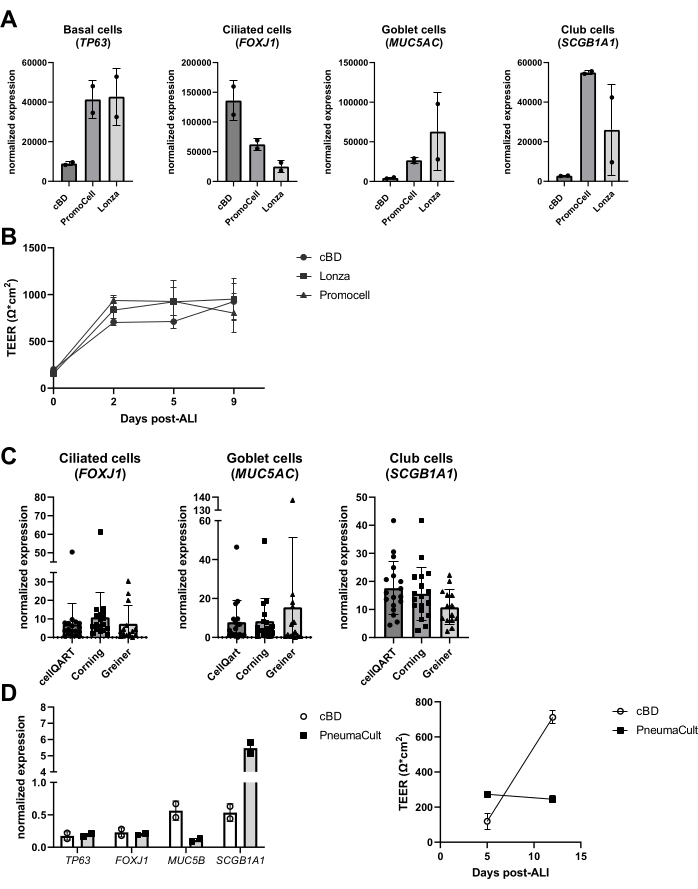
图 6:比较上皮细胞培养基和细胞培养插入物的不同供应商。分离、扩增和分化的PBEC培养物ALI-PBEC培养物。(A)将ALI-PBEC培养14天,然后裂解细胞层以进行RNA分离。通过qPCR测量基底细胞、纤毛细胞、杯状细胞和俱乐部细胞标志物(分别为TP63、FOXJ1、MUC5AC和SCGB1A1)的基因表达,并针对RPL13A和ATP5B进行标准化。n = 2个捐助者;条形表示平均值±SD。 (B)在ALI后9天内,测量电阻,随后计算TEER(Ω·cm2)。n = 3个不同的供体;(C)使用从三个不同供应商处购买的细胞培养插入物将ALI-PBEC培养14天,然后裂解细胞层以进行RNA分离。±通过qPCR测量纤毛,杯状和俱乐部细胞标记物(分别为FOXJ1,MUC5AC和SCGB1A1)的基因表达,并针对RPL13A进行标准化。 n = 18个不同的供体,条形表示SD±平均值。 使用单因素方差分析非参数Kruskal-Wallis检验对数据进行显著性检验,未发现显著差异。(D)在ALI后,在cBD培养基或PneumaCult培养基(STEMMCELL技术)中培养ALI-PBEC14天,然后裂解细胞层以进行RNA分离。通过qPCR测量基底细胞、纤毛细胞、杯状细胞和俱乐部细胞标记物(分别为TP63、FOXJ1、MUC5B和SCGB1A1)的基因表达,并标准化RPL13A(条形表示SD±平均值),并在ALI后第5天和第12天测量电阻,并用于计算TEER(Ω·cm2)。n = 2;平均值表示±SD(详见参考文献23)。请点击此处查看此图的大图。
补充表1:协议中使用的溶液和培养基的组成。请点击此处下载此文件。
讨论
这里介绍的方案描述了从切除的肺组织中分离人支气管上皮细胞,一种在不损失分化潜力的情况下优化细胞扩增的方法,冷冻保存程序以及产生分化良好的ALI-PBEC培养物的程序。此外,还提供了质量控制的说明,以及监测和评估差异化的ALI-PBEC的说明。
所描述的方案从肉眼下正常的无肿瘤支气管环开始,该支气管环从接受与肺癌诊断相关的手术的患者的肺叶中切除。因此需要注意的是,这些环严格不能被视为健康组织,因此可能会影响细胞培养特性。获得支气管上皮细胞的替代来源包括使用支气管活检、支气管刷或来自移植供体或受体肺的组织。无论来源如何,在使用肺组织时,应考虑微生物污染的风险,因此在不同的培养基中使用抗生素以降低细胞培养物微生物污染的风险。特别是,支原体在细胞培养中是一种高且常见的风险,因为它对细胞培养的影响多种多样,对细胞培养中常用的抗生素具有耐药性,并且支原体污染只能通过支原体检测测定来确认。因此,在从肺组织中分离细胞后的细胞培养初始阶段,使用广谱抗菌制剂Primocin,并且在培养过程中,随机选择的样品测试支原体的存在。
从支气管环开始的分离程序提供了足够的起始材料,允许这些原代细胞在ALI开始培养所需的扩增程度,而不会影响分化能力。然而,用有限数量的细胞开始扩增分离的上皮细胞可能会带来问题,即获得足够数量的插入片段和足够的细胞,可以接种用于ALI培养。原代细胞的扩展培养和重复传代可能导致复制性衰老。已经提出了各种解决方案来克服这一限制。Horani等人表明,Rho激酶抑制剂(ROCK)Y-27632增加了基底细胞的增殖30,Mou等人利用双重Smad抑制在保持分化上皮细胞层特性的同时扩增基底干细胞31,Sachs等人开发了一种气道类器官系统,可用于扩增气道上皮细胞并在多次传代过程中保持其分化潜力32.后一种方法还用于从细胞数量非常低的来源扩增细胞,例如早产儿(<28 周胎龄)的气管抽吸物 (TA) 和支气管肺泡灌洗液 (BAL),然后转移到 ALI 培养物中,如此处所述33。结果发现,从BAL和TAs分离的细胞显示出与支气管组织产生的细胞相似的分化能力,尽管当分化偏向使用Notch信号抑制或Th2细胞因子IL-1333的更纤毛或含有杯状细胞的培养物时观察到差异。因此,建议如果使用类似方法从具有低上皮细胞数的起始材料培养ALI-PBEC,请始终检查培养物的基本质量标准,如协议第6节所述。重要的是,使用饲养层细胞也可能有助于获得更大的细胞数量,这在时间和细胞数量至关重要的可移植支架工程环境中至关重要。一项研究说明了这一点,其中自体上皮细胞从来自气管疾病患者的活检中培养,并且在鼠胚胎饲养层(有丝分裂灭活的 3T3-J2 成纤维细胞)和上述 Rho/ROCK 途径抑制剂 (Y-27632)的存在下细胞迅速扩增34。发现所得细胞培养物可用于气管支架的再增殖,因此这可以被视为移植模型的合适方案。
当使用本贡献中描述的方案时,以及使用其他培养方案时,不可避免地会引入选择偏差。重要的是要认识到,方案细节的差异,例如用于启动培养物的细胞来源、培养基组成和其他方案细节,可能导致培养物的细胞组成发生变化,从而改变ALI培养物的反应33,35。此外,在比较用于分化气道细胞的不同培养基时,也观察到细胞特性的差异10,11。在比较PneumaCult和cBD培养基时,观察到杯状细胞和俱乐部细胞mRNA标记物,TEER值和细胞层厚度的差异。基于这些观察结果,尽管缺乏统计基础,但由于使用的供体数量少,客户不知道培养基成分,以及PneumaCult培养基的成本较高,我们的实验室决定使用cBD培养基。
如前所述,细胞最初可以使用类器官培养物扩增,随后转移到2D ALI插入系统。这一点很重要,因为气道上皮类器官不适合暴露于空气中的物质,而使用ALI 2D系统可以评估空气中物质(如香烟烟雾23,36)对培养的气道上皮细胞的影响。建立ALI气道上皮细胞培养物的另一种方法是通过人多能干细胞(hiPSC)的分化产生气道上皮细胞37。在此类方案中,在分化为近端气道祖细胞后的分化方案的最后阶段,可以使用类似于此处描述的程序通过培养到ALI来分化细胞。
在当前的协议中,cBD培养基用于ALI的培养。cBD培养基是一种无血清培养基,通过添加不同补充剂的混合物而制备,灵感来自Fulcher等人38 以及其他研究。补充溶液含有 52 μg/mL 牛垂体提取物 (BPE)、0.5 μg/mL 氢化可的松、0.5 ng/mL 人 EGF、0.5 μg/mL 肾上腺素、10 μg/mL 转铁蛋白、5 μg/mL 胰岛素、6.5 ng/mL 三碘甲状腺原氨酸和 0.1 ng/mL RA39。由于BPE是一种组织提取物,并且会受到批次变化的影响,因此该培养基不能被视为完全定义的培养基,也不是无动物的。最好使用完全定义的细胞培养基,以最大程度地减少批次间的差异。鉴于向无动物研究的过渡,重要的是要努力生产不含动物产品且科学界负担得起的特定培养基。
根据研究问题,可以使用基于ALI模型的各种实验设置。例如,为了研究可能影响分化过程的化合物的影响,可以通过在浸没培养的不同阶段、分化期间或分化良好阶段将化合物添加到培养物中来解决。ALI-PBEC培养物的细胞组成可以通过添加特定化合物来影响;例如,在IL-13存在下分化ALI-PBEC会产生具有更多杯状细胞和更少纤毛细胞的培养物,而在分化过程中使用γ分泌酶抑制剂DAPT(用于阻断Notch信号传导)处理导致具有更多纤毛细胞的培养物,而牺牲杯状细胞23,40,41,42。
此外,刺激细胞或阻断某些过程的试剂可以应用于基底隔室或(体积非常小)培养物的顶端隔室。细胞也可以从顶端暴露于空气中的物质。这种暴露设计已被用于研究柴油机尾气或整个香烟烟雾对PBEC的影响23,43,44。每次更换培养基时都可以收获培养基以监测基底侧分泌的蛋白质;这同样适用于用PBS洗涤的细胞顶端,同时刷新基础培养基。收获所谓的顶端洗涤液,并添加可选的二硫代赤藓糖醇(DTE)以更有效地解离由杯状细胞产生的粘液。可以获得细胞裂解物以分离总蛋白、RNA 以及染色体和线粒体 DNA。可以使用特异性标记物的抗体进一步研究细胞,方法是从塑料插入物上切割聚对苯二甲酸乙二醇酯(PET)膜,并将该膜进一步切割成更小的碎片以进行多次免疫荧光染色45。此外,流式细胞术或FACS也可以在插入片段中的细胞胰蛋白酶消化后使用。在ALI阶段,可以通过测量电阻并随后计算TEER来监测细胞屏障的发展,其中电阻与膜插入物的表面积成反比。计算基于欧姆定律,使用以下公式: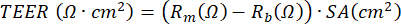 ,其中Rm是测量的电阻,Rb是没有涂层和电池的插入物的基线电阻,SA是插入物膜的表面积。使用EVOM2和STX/筷子电极测量电阻很简单,但在将其引入孔中时,高度依赖于处理程序。同样,电极的形状已被提出影响测量相对较大的表面积17的阻挡函数。
,其中Rm是测量的电阻,Rb是没有涂层和电池的插入物的基线电阻,SA是插入物膜的表面积。使用EVOM2和STX/筷子电极测量电阻很简单,但在将其引入孔中时,高度依赖于处理程序。同样,电极的形状已被提出影响测量相对较大的表面积17的阻挡函数。
ALI细胞培养系统的进一步改进,旨在提高准确的组织表征,包括其他细胞类型的共培养,例如白细胞,成纤维细胞或内皮细胞46,47,48。已经观察到,ALI-PBEC与粒细胞-巨噬细胞集落刺激因子(GM-CSF)或M-CSF分化的巨噬细胞共培养显着影响先天上皮反应和修复48。需要注意的是,在这种共培养模型中,介质兼容性可能是一个问题。由于用于气道上皮细胞培养的培养基是专门为PBEC开发的,可能不适合其他细胞类型,因此需要进行优化。在气道生物学领域可以看到的另一种可以使用隔离PBEC的进步是使用器官芯片(OoC)技术49,50。使用这项技术,可以研究呼吸和血液流动的机械力的影响,例如拉伸、空气和介质流动 29.
当使用来自不同供体的PBEC时,供体间变异性可能很大,因此在上皮细胞培养研究中考虑使用来自多个供体的细胞来解释这种变异性非常重要。由于ALI-PBEC的培养非常耗时且成本高昂,因此研究了通过将来自不同供体的细胞混合在一个细胞培养插入物中来建立ALI-PBEC培养物的选择。这样,在分析来自各种个体供体的培养物的反应之前,可以使用原代细胞轻松进行试点实验。此外,可以将具有不同特征(例如,不同年龄类别或性别)的捐赠者分组进行探索性研究。当使用供体混合物时,重要的是要确保存在相同数量的不同供体的细胞,以防止由于较高的增殖率而导致一个供体主导结果的可能性。因此,与来自单个供体的接种细胞相比,来自单个供体的细胞被单独扩增并以更高的密度接种在插入物中,以在过渡到ALI之前最大限度地减少插入物中的增殖。通过研究SARS-CoV-2的感染动力学,比较了供体混合物和相应个体供体的反应。使用RT-qPCR和免疫荧光染色,观察到供体混合物通过显示相似数量的病毒颗粒和相似数量的感染细胞28,提供了各种个体供体的良好代表性。
为了成为动物模型可接受的替代方案,培养的支气管上皮细胞的基因编辑应该是可行的51。研究了在ALI-PBEC中使用小干扰RNA(siRNA)的RNA干扰技术,但是由于细胞需要在培养的浸没期用siRNA转染,因此在ALI培养过程中由于培养持续时间长而无法充分维持敲低,除非在培养过程中经常重复siRNA转染52.然而,siRNA可以成功地用于修饰浸没基底细胞中的基因表达。其他人已经成功地使用CRISPR / Cas9技术在原代ALI气道上皮细胞培养物中实现了核糖核蛋白(RNP)递送的基因编辑 53。当使用这种技术时,细胞必须保持其完全的分化能力。由于原代气道细胞培养物不能无限期传代,基因编辑细胞的克隆扩增并不容易,并且添加培养基以选择转染细胞很麻烦。因此,很难在所有培养的细胞中实现所需的敲低。产生敲除克隆的另一种方法是在hiPSC54 中使用敲除策略并使用这些细胞产生气道上皮细胞。另一种尽管不是最佳的替代方案是建立永生化的PBEC系,以便克隆扩增基因编辑的细胞55。
这里提出的协议是生成分化良好的伪分层ALI-PBEC的一种方法,但也发现其他协议可以建立这种培养物,与所提出的协议相比,差异越来越小。我们认为,培养方法的实验室验证和严格的质量控制对于ALI-PBEC系统和气道上皮细胞的类似培养系统至关重要,成为动物实验的有效替代方案。
披露声明
提交人声明他们没有相关的利益冲突。
致谢
使用本贡献中描述的模型的研究得到了各种资助组织的支持,包括荷兰肺脏基金会、荷兰卫生研究与发展组织(ZonMw,COVID-19 MKMD 赠款)、荷兰动物试验替代协会(Stichting Proefdiervrij,赠款 #114025007),以及勃林格殷格翰和加拉帕戈斯等公司的研究资助。 图 1 是使用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 1,000 ohm test resistor | World Precision Instruments | N/A | Used to calibrate the EVOM2 Epithelial Voltohmmeter |
| 4-[2-(5,6,7,8-Tetrahydro-5,5,8,8-tetramethyl-2-naphthalenyl)ethynyl)-benzoic acid (EC 23) | Tocris | 4011 | Used in cBD medium |
| 6-well Clear TC-treated Multiple Well Plates | Corning | 3506 | Used in the first step to grow the cells isolated form the bronchial ring |
| Airway Epithelial Cell Growth Medium Kit | PromoCell | C-21160 | Used to compare to cBD medium |
| Bead Bath 20 Liter | Lab Armor | 74220-720 | Used to pre-warm cell culture solutions |
| BEGM Bronchial Epithelial Cell Growth Medium BulletKit | LONZA | CC-3170 | Used to compare to cBD medium |
| Bovine albumin fraction V (BSA) | Thermo Fisher Scientific | 15260037 | Used in coating solution |
| Bovine pituitary extract (BPE) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Bronchial epithelial cell growth supplement (BEpiCGS) | ScienCell Research Laboratories | 3262 | Used in cBD medium |
| Bronchial epithelial cell medium-basal (BEpiCM-b) | ScienCell Research Laboratories | SCC3211-b | Used in cBD medium |
| Cell culture inserts; 12 mm Transwell with 0.4 µm pore polyester membrane insert | Corning | 3460 | Cell culture inserts used in the protocol |
| Cell culture inserts; 12-well inserts, 0.4 µm PET clear | CellQART made by SABEU | 9310412 | Cell culture inserts used to compare with Corning cell culture inserts |
| Cell culture inserts; 12-well ThinCert Tissue culture Inserts | Greiner Bio-One | 82050-032 | Cell culture inserts used to compare with Corning cell culture inserts |
| CELLSTAR flask, TC, PS, 250 ml, 75 cm2 | Greiner Bio-One | 658170 | Used to expand the number cells |
| CFX Maestro 1.0 | Bio-Rad | N/A | Software program for analyzing qPCR data generated with the CFX384 System |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad | 1855484 | qPCR detection system |
| Chopstick electrode set | World Precision Instruments | STX2 | Used to measure electrical resistance in ALI-PBEC |
| CO2-Incubator | PHCbi | MCO-170AICUV-PE | Cell culture incubator used for mycplasma free cell cultures |
| CO2-Incubator | Hereaus | Heracell 150 | Cell culture incubator used for possibly mycplasma infected cell cultures |
| Coolcell Container | Corning | 432006 | Used to cryopreserve cells at -80 °C before transfer to liquid N2 |
| Countess 3 Automated cell counter | Thermo Fisher Scientific | AMQAX2000 | Used to count cells and determine the cell concentration |
| Cryovials | Nalgene | 479-3224 | Used to cryopreserve cells in |
| D-Glucose | Avantor VWR BDH CHEMICALS | 101174Y | Used in soft trypsin |
| Dimethyl sulfoxide (DMSO) | Avantor VWR | 0231 | Used in cell freeze medium |
| dNTP (10 mM) | Promega | U1515 | Used in the synthesis of cDNA |
| Dulbecco's Modified Eagle's Medium (DMEM) + 4500 mg/l D-Glucose | STEMCELL Technologies | 36250 | Used in cBD medium |
| Dulbecco's Modified Eagle's Medium (DMEM) 4.5 g/l glucose with l-glutamine | LONZA | LOBE12-604F | Used in cBD medium to compare with DMEM from other manufacturers |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, pyruvate | Thermo Fisher Scientific | 41966029 | Used in cBD medium to compare with DMEM from other manufacturers |
| Epidermal growth factor (EGF) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Ethylenediaminetetraacetic acid (EDTA) | Avantor VWR BDH CHEMICALS | 443885J | Used in soft trypsin |
| EVOM2 Epithelial Voltohmmeter | World Precision Instruments | 91799 | Used with the chopstick electrode set to measure electrical resistance in ALI-PBEC |
| Fibronectin solution, Human | PromoCell | C-43060 | Used in coating solution |
| Glutamax | Thermo Fisher Scientific | 35050038 | Used in cBD medium |
| Hanks balanced salt solution (HBSS) | ScienCell Research Laboratories | SCC0313 | Used to dissolve protease XIV |
| IQ SYBR Green Super mix | Bio-Rad | 170887 | qPCR reagent |
| Isoproterenol hydrochloride, (-)- | Sigma-Aldrich | I-6504 | Used in c-KSFM |
| Keratinocyte-SFM (KSFM) | Thermo Fisher Scientific | 17005-034 | Used in c-KSFM |
| Maxwell RSC Instrument | Promega | AS4500 | Automated RNA isolation system |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | Used to isolate total RNA with the Maxwell RSC Instrument |
| M-MLV Reverse transcriptase | Promega | M5301 | Used in the synthesis of cDNA |
| M-MLV Reverse transcriptase 5X reaction buffer | Promega | M531A | Used in the synthesis of cDNA |
| MycoStrip | InvivoGen | rep-mys-10 | Used to detect the presence of mycoplasma in cell culture samples |
| N-2-hydroxyethylpiperazine-N-2-ethane sulfonic acid (HEPES) | Thermo Fisher Scientific | 15630056 | Used in cBD medium |
| Oligo(dT)15 | Qiagen | 79237 | Used in the synthesis of cDNA |
| Penicillin/Streptomycin solution (Pen/Strep) | ScienCell Research Laboratories | SCC0513 | Used as antibiotic in c-KSFM and cBD medium |
| Phosphate buffered saline (PBS) | LUMC pharmacy | N/A | Used in different steps of the protocol |
| Pneumacult-ALI Medium | STEMCELL Technologies | 05002 | Used to grow cells in the differentiation stage to compare to cBD medium |
| Pneumacult-Ex Plus Medium | STEMCELL Technologies | 05040 | Used to grow cells in the submerged stage to compare to cBD medium |
| Primer, ATP5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: TCACCCAGGCTGGTTCAGA |
| Primer, ATP5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGTGGCCAGGGTAGGCTGAT |
| Primer, FOXJ1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGAGGGGACGTAAATCCCTA |
| Primer, FOXJ1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TTGGTCCCAGTAGTTCCAGC |
| Primer, MUC5AC, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCTTCGACGGACAGAGCTAC |
| Primer, MUC5AC, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCTCGGTGACAACACGAAAG |
| Primer, MUC5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGGCTTTGACAAGAGAGT |
| Primer, MUC5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGGATGGTCGTGTTGATGCG |
| Primer, RPL13A, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: AAGGTGGTGGTCGTACGCTGTG |
| Primer, RPL13A, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: CGGGAAGGGTTGGTGTTCATCC |
| Primer, SCGB1A1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: ACATGAGGGAGGCAGGGGCTC |
| Primer, SCGB1A1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: ACTCAAAGCATGGCAGCGGCA |
| Primer, TP63, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCACCTGGACGTATTCCACTG |
| Primer, TP63, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCGAATCAAATGACTAGGAGGGG |
| Primocin | InvivoGen | ant-pm-2 | Used as antimicrobial agent against bacteria, mycoplasma, and fungi in c-KSFM medium |
| Protease XIV | Sigma-Aldrich | P5147 | Used for the enzymatic treatment of the bronchial ring |
| RNAsin Recombinant Ribonuclease inhibitor | Promega | N2515 | Used in the synthesis of cDNA |
| Soybean trypsin inhibitor (SBTI) | Sigma-Aldrich | T9128 | Used to inhibit the action of soft trypsin |
| T100 Thermal Cycler | Bio-Rad | 1861096 | Used in the synthesis of cDNA |
| TissueSAFE plus | MILESTONE MEDICAL | N/A | Vacuum transfer system for biological specimens |
| Trypan blue solution | Thermo Fisher Scientific | 15250061 | Used to count live- and dead cells |
| Trypsin 1:250 | Thermo Fisher Scientific | 27250-018 | Used in soft trypsin |
| Type I collagen solution (PureCol) | Advanced BioMatrix | 5005-B | Used in coating solution |
| Universal container, PP, with PE screw cap | Avantor VWR | 216-2053 | Used in the protocol for the Protease XIV treatment of the bronchial ring |
参考文献
- Aghapour, M., et al. Role of air pollutants in airway epithelial barrier dysfunction in asthma and COPD. European Respiratory Review. 31 (163), 210112 (2022).
- de Waal, A. M., Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Duchesne, M., Okoye, I., Lacy, P. Epithelial cell alarmin cytokines: Frontline mediators of the asthma inflammatory response. Frontiers in Immunology. 13, 975914 (2022).
- Hewitt, R. J., Lloyd, C. M. Regulation of immune responses by the airway epithelial cell landscape. Nature Reviews Immunology. 21 (6), 347-362 (2021).
- Ruysseveldt, E., Martens, K., Steelant, B. Airway basal cells, protectors of epithelial walls in health and respiratory diseases. Frontiers in Allergy. 2, 787128 (2021).
- Alysandratos, K. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Hammad, H., Lambrecht, B. N. Barrier epithelial cells and the control of type 2 immunity. Immunity. 43 (1), 29-40 (2015).
- Hynds, R. E., Bonfanti, P., Janes, S. M. Regenerating human epithelia with cultured stem cells: feeder cells, organoids and beyond. EMBO Molecular Medicine. 10 (2), 139-150 (2018).
- Hiemstra, P. S., Tetley, T. D., Janes, S. M. Airway and alveolar epithelial cells in culture. The European Respiratory Journal. 54 (5), 1900742 (2019).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), 2137 (2020).
- Leung, C., Wadsworth, S. J., Yang, S. J., Dorscheid, D. R. Structural and functional variations in human bronchial epithelial cells cultured in air-liquid interface using different growth media. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1063-L1073 (2020).
- Morgan, R., et al. A medium composition containing normal resting glucose that supports differentiation of primary human airway cells. Scientific Reports. 12 (1), 1540 (2022).
- Ghosh, B., et al. Strong correlation between air-liquid interface cultures and in vivo transcriptomics of nasal brush biopsy. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1056-L1062 (2020).
- Pezzulo, A. A., et al. The air-liquid interface and use of primary cell cultures are important to recapitulate the transcriptional profile of in vivo airway epithelia. American Journal of Physiology. Lung Cellular and Molecular Physiology. 300 (1), L25-L31 (2011).
- Dvorak, A., Tilley, A. E., Shaykhiev, R., Wang, R., Crystal, R. G. Do airway epithelium air-liquid cultures represent the in vivo airway epithelium transcriptome. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 465-473 (2011).
- Legebeke, J., et al. Temporal whole-transcriptomic analysis of characterized in vitro and ex vivo primary nasal epithelia. Frontiers in Cell and Developmental Biology. 10, 907511 (2022).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- van Wetering, S., et al. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. Journal of Investigative Medicine. 48 (5), 359-366 (2000).
- Balk, S. D. Calcium as a regulator of the proliferation of normal, but not of transformed, chicken fibroblasts in a plasma-containing medium. Proceedings of the National Academy of Sciences. 68 (2), 271-275 (1971).
- Gail, M. H., Boone, C. W., Thompson, C. S. A calcium requirement for fibroblast motility and prolifertion. Experimental Cell Research. 79 (2), 386-390 (1973).
- Dulbecco, R., Elkington, J. Induction of growth in resting fibroblastic cell cultures by Ca. Proceedings of the National Academy of Sciences. 72 (4), 1584-1588 (1975).
- van Wetering, S., et al. Epithelial differentiation is a determinant in the production of eotaxin-2 and -3 by bronchial epithelial cells in response to IL-4 and IL-13. Molecular Immunology. 44 (5), 803-811 (2007).
- Amatngalim, G. D., et al. Aberrant epithelial differentiation by cigarette smoke dysregulates respiratory host defence. The European Respiratory Journal. 51 (4), 1701009 (2018).
- Christie, V. B., et al. Retinoid supplementation of differentiating human neural progenitors and embryonic stem cells leads to enhanced neurogenesis in vitro. Journal of Neuroscience Methods. 193 (2), 239-245 (2010).
- Schrumpf, J. A., Ninaber, D. K., vander Does, A. M., Hiemstra, P. S. TGF-β1 impairs vitamin D-induced and constitutive airway epithelial host defense mechanisms. Journal of Innate Immunity. 12 (1), 74-89 (2020).
- Schrumpf, J. A., et al. Proinflammatory cytokines impair vitamin D-induced host defense in cultured airway epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (6), 749-761 (2017).
- Boei, J. J. W. A., et al. Xenobiotic metabolism in differentiated human bronchial epithelial cells. Archives of Toxicology. 91 (5), 2093-2105 (2017).
- Wang, Y., et al. Impact of human airway epithelial cellular composition on SARS-CoV-2 infection biology. bioRxiv. , (2021).
- Nawroth, J. C., et al. Breathing on Chip: Dynamic flow and stretch tune cellular composition and accelerate mucociliary maturation of airway epithelium in vitro. bioRxiv. , (2022).
- Horani, A., Nath, A., Wasserman, M. G., Huang, T., Brody, S. L. Rho-associated protein kinase inhibition enhances airway epithelial Basal-cell proliferation and lentivirus transduction. American Journal of Respiratory Cell and Molecular Biology. 49 (3), 341-347 (2013).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Eenjes, E., et al. Disease modeling following organoid-based expansion of airway epithelial cells. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (4), L775-L786 (2021).
- Butler, C. R., et al. Rapid expansion of human epithelial stem cells suitable for airway tissue engineering. American Journal of Respiratory and Critical Care Medicine. 194 (2), 156-168 (2016).
- Amatngalim, G. D., et al. Antibacterial defense of human airway epithelial cells from chronic obstructive pulmonary disease patients induced by acute exposure to nontypeable Haemophilus influenzae: modulation by cigarette smoke. Journal of Innate Immunity. 9 (4), 359-374 (2017).
- Plebani, R., et al. 3D lung tissue models for studies on SARS-CoV-2 pathophysiology and therapeutics. International Journal of Molecular Sciences. 23 (17), 10071 (2022).
- Wong, A. P., et al. Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein. Nature Biotechnology. 30 (9), 876-882 (2012).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Biology. 107, 183-206 (2005).
- Cao, J., Wong, C. K., Yin, Y., Lam, C. W. K. Activation of human bronchial epithelial cells by inflammatory cytokines IL-27 and TNF-alpha: implications for immunopathophysiology of airway inflammation. The Journal of Cellular Physiology. 223 (3), 788-797 (2010).
- Tsao, P. N., et al. Notch signaling controls the balance of ciliated and secretory cell fates in developing airways. Development. 136 (13), 2297-2307 (2009).
- Laoukili, J., et al. IL-13 alters mucociliary differentiation and ciliary beating of human respiratory epithelial cells. The Journal of Clinical Investigation. 108 (12), 1817-1824 (2001).
- Mertens, T. C. J., et al. Cigarette smoke differentially affects IL-13-induced gene expression in human airway epithelial cells. Physiological Reports. 5 (13), e13347 (2017).
- Zarcone, M. C., et al. Effect of diesel exhaust generated by a city bus engine on stress responses and innate immunity in primary bronchial epithelial cell cultures. Toxicology in Vitro. 48, 221-231 (2018).
- vander Does, A. M., et al. Early transcriptional responses of bronchial epithelial cells to whole cigarette smoke mirror those of in-vivo exposed human bronchial mucosa. Respiratory Research. 23 (1), 227 (2022).
- Wang, Y., Ninaber, D. K., van Schadewijk, A., Hiemstra, P. S. Tiotropium and fluticasone inhibit rhinovirus-induced mucin production via multiple mechanisms in differentiated airway epithelial cells. Frontiers in Cellular and Infection Microbiology. 10, 278 (2020).
- Ronaghan, N. J., et al. M1-like, but not M0- or M2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), 0276013 (2022).
- Gindele, J. A., et al. Opposing effects of in vitro differentiated macrophages sub-type on epithelial wound healing. PLoS One. 12 (9), e0184386 (2017).
- van Riet, S., et al. Modulation of airway epithelial innate immunity and wound repair by M(GM-CSF) and M(M-CSF) macrophages. Journal of Innate Immunity. 12 (5), 410-421 (2020).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Stucki, A. O., et al. A lung-on-a-chip array with an integrated bio-inspired respiration mechanism. Lab on a Chip. 15 (5), 1302-1310 (2015).
- Peters-Hall, J. R., et al. Long-term culture and cloning of primary human bronchial basal cells that maintain multipotent differentiation capacity and CFTR channel function. American Journal of Physiology. Lung Cellular and Molecular Physiology. 315 (2), L313-L327 (2018).
- Bartman, C. M., Stelzig, K. E., Linden, D. R., Prakash, Y. S., Chiarella, S. E. Passive siRNA transfection method for gene knockdown in air-liquid interface airway epithelial cell cultures. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), L280-L286 (2021).
- Koh, K. D., et al. Efficient RNP-directed human gene targeting reveals SPDEF is required for IL-13-induced mucostasis. American Journal of Respiratory Cell and Molecular Biology. 62 (3), 373-381 (2020).
- Bhargava, N., et al. Development of an efficient single-cell cloning and expansion strategy for genome edited induced pluripotent stem cells. Molecular Biology Reports. 49 (8), 7887-7898 (2022).
- Angelopoulou, A., Papaspyropoulos, A., Papantonis, A., Gorgoulis, V. G. CRISPR-Cas9-mediated induction of large chromosomal inversions in human bronchial epithelial cells. STAR Protocols. 3 (2), 101257 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。