Method Article
Isolare le cellule epiteliali bronchiali dal tessuto polmonare resecato per il biobanking e stabilire colture di interfaccia aria-liquido ben differenziate
In questo articolo
Riepilogo
Presentato qui è un metodo riproducibile, economico e robusto per l'isolamento e l'espansione delle cellule epiteliali bronchiali primarie per il biobanking a lungo termine e la generazione di cellule epiteliali differenziate mediante coltura all'interfaccia aria-liquido.
Abstract
Lo strato di cellule epiteliali delle vie aeree costituisce la prima barriera tra il tessuto polmonare e l'ambiente esterno ed è quindi costantemente esposto a sostanze inalate, compresi agenti infettivi e inquinanti atmosferici. Lo strato epiteliale delle vie aeree svolge un ruolo centrale in una grande varietà di malattie polmonari acute e croniche e vari trattamenti mirati a questo epitelio vengono somministrati per inalazione. Comprendere il ruolo dell'epitelio nella patogenesi e come può essere mirato alla terapia richiede modelli robusti e rappresentativi. I modelli di coltura epiteliale in vitro sono sempre più utilizzati e offrono il vantaggio di eseguire esperimenti in un ambiente controllato, esponendo le cellule a diversi tipi di stimoli, tossici o agenti infettivi. L'uso di cellule primarie al posto di linee cellulari immortalizzate o tumorali ha il vantaggio che queste cellule si differenziano in coltura per uno strato cellulare epiteliale polarizzato pseudostratificato con una migliore rappresentazione dell'epitelio rispetto alle linee cellulari.
Qui è presentato un protocollo robusto, che è stato ottimizzato negli ultimi decenni, per l'isolamento e la coltura di cellule epiteliali delle vie aeree dal tessuto polmonare. Questa procedura consente di isolare, espandere, coltivare e differenziare mucociliare con successo le cellule epiteliali bronchiali primarie (PBEC) mediante coltura all'interfaccia aria-liquido (ALI) e include un protocollo per il biobanking. Inoltre, viene descritta la caratterizzazione di queste colture utilizzando geni marcatori cellula-specifici. Queste colture ALI-PBEC possono essere utilizzate per una vasta gamma di applicazioni, tra cui l'esposizione al fumo di sigaretta intero o ai mediatori infiammatori e la co-coltura / infezione con virus o batteri.
Il protocollo fornito in questo manoscritto, che illustra la procedura in modo graduale, dovrebbe fornire una base e / o un riferimento per coloro che sono interessati a implementare o adattare tali sistemi di coltura nel loro laboratorio.
Introduzione
Il ruolo dell'epitelio delle vie aeree in una varietà di malattie polmonari acute e croniche è stato descritto in varie revisioni 1,2,3,4,5,6,7. Colture ben differenziate di cellule epiteliali delle vie aeree sono uno strumento importante per svelare il ruolo dell'epitelio delle vie aeree. La coltura di cellule epiteliali delle vie aeree con interfaccia aria-liquido (ALI) è ampiamente applicata per promuovere la differenziazione delle cellule epiteliali basali delle vie aeree e quindi studiare l'epitelio delle vie aeree in modo affidabile in vitro 8,9. Negli ultimi anni, l'uso di tali modelli è aumentato ulteriormente a seguito di nuove iniziative di ricerca legate alla pandemia di COVID-19 e di una transizione mondiale verso la ricerca senza animali. Pertanto, l'aumento dell'uso di questa linea cellulare modello sottolinea la necessità di condividere procedure ed esperienze per ottenere risultati solidi. Ciò consentirà anche il confronto dei risultati tra gruppi di ricerca. La robustezza della procedura è la caratteristica chiave e quindi deve essere sottoposta a controllo di qualità. Diversi laboratori hanno investito nello sviluppo di protocolli per la coltura di cellule epiteliali primarie delle vie aeree presso l'ALI. Il tempo, l'impegno e il budget richiesto possono essere ridotti quando queste procedure sono condivise in dettaglio. Questi dettagli includono, ad esempio, la scelta di plastiche e terreni di coltura cellulare forniti da vari produttori, poiché si è scoperto che ciò influenza le caratteristiche delle colture ottenute10,11,12. Ciò sottolinea l'importanza di condividere esperienze e dettagli delle procedure colturali, poiché in assenza di tali approfondimenti, i risultati possono essere influenzati e / o gli sforzi di convalida tra i vari laboratori possono essere ostacolati.
L'epitelio polmonare umano comprende vari tipi di cellule, compresi i tipi principali come cellule basali, cellule ciliate, cellule caliciformi e cellule club. Al fine di imitare in modo affidabile lo strato cellulare epiteliale nelle vie aeree in vitro, questi tipi di cellule devono essere rappresentati nei modelli di coltura e la loro polarizzazione e funzione mantenute13,14,15,16. La consapevolezza che le caratteristiche del donatore (incluso lo stato di malattia) e l'origine anatomica delle cellule (cioè vie aeree nasali, tracheali, grandi e piccole) possono influenzare la composizione cellulare e le risposte funzionali della coltura cellulare è altrettanto importante. Le competenze e le pratiche pertinenti sono un prerequisito per coltivare con successo cellule epiteliali primarie delle vie aeree e valutare la qualità della coltura sia intuitivamente (mediante ispezione visiva durante la coltura) che quantificabile. Lo scopo di questo contributo è quello di fornire un metodo economico e tempestivo per l'isolamento e la coltura di cellule epiteliali bronchiali umane primarie (PBEC) che può essere applicato anche alla coltura di cellule epiteliali tracheali e delle piccole vie aeree. Oltre a descrivere un metodo per isolare tali cellule dal tessuto polmonare resecato, viene presentato e discusso un metodo per l'espansione e il biobanking e, infine, per la creazione e la caratterizzazione di una coltura ALI ben differenziata entro un ragionevole costo e periodo di tempo.
Protocollo
Le cellule sono state isolate da tessuto polmonare macroscopicamente normale ottenuto da pazienti sottoposti a chirurgia di resezione per cancro del polmone presso il Leiden University Medical Center, nei Paesi Bassi. I pazienti da cui deriva questo tessuto polmonare sono stati arruolati nella biobanca tramite un sistema di non obiezione per l'ulteriore utilizzo anonimo codificato di tale tessuto (www.coreon.org). Tuttavia, dal 01-09-2022, i pazienti sono stati arruolati nella biobanca utilizzando il consenso informato attivo in conformità con le normative locali della biobanca LUMC con l'approvazione del comitato etico medico istituzionale (B20.042 / Ab / ab e B20.042 / Kb / kb).
NOTA: Tutte le procedure vengono eseguite in un armadio di sicurezza biologica, secondo le norme locali di sicurezza biologica e in condizioni di lavoro sterili indossando guanti chirurgici e un camice da laboratorio, salvo diversa indicazione. Per tutti i supporti, i reagenti e le altre soluzioni utilizzate nel protocollo, consultare la tabella dei materiali e la tabella supplementare 1. Vedere la Figura 1 per i passaggi dettagliati del protocollo
1. Isolamento delle cellule epiteliali bronchiali dal tessuto polmonare umano
NOTA: Per ottenere una percentuale di successo ottimale per l'isolamento delle cellule epiteliali bronchiali, l'anello bronchiale asportato deve essere tenuto immerso a 4 °C per un massimo di 24 ore in soluzione salina tamponata fosfato (PBS) con aggiunta di Primocina.
- Preparativi prima dell'inizio della procedura
- Preparare una soluzione di rivestimento in PBS, come descritto nella Tabella supplementare 1, e rivestire un numero appropriato di piastre a 6 pozzetti con 1,5 ml di soluzione di rivestimento per pozzetto. Incubare per 2 ore in un incubatore di coltura cellulare a 37 °C e 5% CO2.
NOTA: Il numero di pozzetti da rivestire dipende dalle dimensioni del tessuto asportato. Come linea guida approssimativa, quattro piastre a 6 pozzetti sono rivestite quando l'anello bronchiale asportato ha un diametro di 10 mm e una larghezza di 4 mm. - Preparare un mezzo completo privo di siero di cheratinociti (c-KSFM), come descritto nella Tabella supplementare 1; utilizzare 2 ml del mezzo per pozzetto di una piastra a 6 pozzetti.
NOTA: Questo c-KSFM può essere conservato a 4 °C per 7 giorni. c-KSFM è un mezzo a basso contenuto di calcio utilizzato per l'espansione delle cellule epiteliali delle vie aeree, inibendo la crescita dei fibroblasti contaminanti.
- Preparare una soluzione di rivestimento in PBS, come descritto nella Tabella supplementare 1, e rivestire un numero appropriato di piastre a 6 pozzetti con 1,5 ml di soluzione di rivestimento per pozzetto. Incubare per 2 ore in un incubatore di coltura cellulare a 37 °C e 5% CO2.
- Pulire l'anello bronchiale sciacquando delicatamente l'anello in 10 ml di PBS sterile in una capsula di Petri da 10 cm. Utilizzare una pinzetta per tenere con cura l'anello (solo toccare all'esterno) e piccole forbici per rimuovere eventuali residui di tessuto connettivo e sangue in eccesso. Per ulteriori elaborazioni, tagliare l'anello in due.
NOTA: Tutti gli strumenti utilizzati nel processo devono essere sterilizzati prima dell'uso. - Immergere le due metà dell'anello bronchiale in 10 mL di una soluzione preriscaldata di proteasi XIV (1,8 mg/ml) nella soluzione salina bilanciata di Hank (HBSS), compresa Primocin in un contenitore sterile chiuso, e incubare per esattamente 2 ore a 37 °C in un incubatore di colture cellulari.
NOTA: HBSS è usato come diluente per la proteasi XIV per staccare le cellule dal tessuto durante un periodo di incubazione di 2 ore. HBSS è una soluzione isotonica bilanciata che consente il mantenimento della vitalità cellulare durante le incubazioni a breve termine. - Dopo l'incubazione, trasferire i pezzi di tessuto in una capsula di Petri con 10 ml di PBS caldo e raschiare l'interno dell'anello usando pinzette piegate per ottenere una soluzione cellulare.
NOTA: Il tessuto appare più morbido e leggermente espanso. - Scartare l'anello, trasferire la soluzione cellulare in una provetta da 50 mL e aggiungere PBS caldo per ottenere un volume finale di 50 ml. Centrifugare per 7 minuti a 230 x g e a temperatura ambiente (RT).
- Aspirare il surnatante e risospendere il pellet in 10 ml di PBS caldo. Inoltre, aumentare il volume fino a 50 ml con PBS caldo. Centrifugare per 7 minuti a 230 x g a RT.
- Aspirare il surnatante e risospendere il pellet cellulare in una quantità appropriata di c-KSFM caldo contenente Primocin.
NOTA: La Primocina viene utilizzata per un minimo di 7 giorni per eliminare eventuali batteri, funghi o (soprattutto) micoplasma che potrebbero essere stati presenti nel tessuto; Dopo 7 giorni, è sufficiente l'aggiunta di solo penicillina / streptomicina al mezzo. - Aspirare la soluzione di rivestimento dalle piastre a 6 pozzetti e aggiungere 2 ml di sospensione cellulare per pozzetto.
- Lasciare che le cellule crescano fino a raggiungere l'80-90% di confluenza e cambiare il terreno tre volte alla settimana (ad esempio, ogni lunedì, mercoledì e venerdì). Il grado di confluenza desiderato viene solitamente raggiunto tra 7 e 14 giorni; Se il tempo necessario per raggiungere la confluenza desiderata supera i 14 giorni, scartare le celle.
NOTA: Nei primi giorni, solo un piccolo numero di cellule inizia a proliferare; I gruppi di cellule sono evidenti dopo alcuni giorni.
2. Crioconservazione delle cellule epiteliali bronchiali primarie umane (PBEC)
NOTA: Quando si lavora con temperature di -80 °C e -196 °C, i crioguanti vengono utilizzati per la protezione e le pinzette vengono utilizzate per trasferire le fiale congelate. Quando si lavora con azoto liquido, i crioguanti e una visiera vengono utilizzati per la protezione personale.
- Aspirare il mezzo e lavare i pozzetti una volta con 2 ml di PBS caldo per pozzetto.
- Tripsinizzare le cellule aggiungendo 0,5 ml di tripsina molle per pozzetto (vedere Tabella supplementare 1 per la composizione della soluzione di tripsina molle). Incubare le cellule per 5 fino ad un massimo di 10 minuti a 37 °C. Ruotare la soluzione di tripsina nella piastra e rilasciare le cellule picchiettando delicatamente la piastra.
- Trasferire le cellule distaccate in una provetta da centrifuga da 50 mL contenente 1,1 mg/ml di inibitore della tripsina di soia (SBTI; per inibire l'attività della tripsina) sciolta in KSFM con penicillina/streptomicina. Il volume di SBTI deve essere il doppio del volume totale di tripsina molle (cioè 1 mL per pozzetto).
NOTA: non aggiungere SBTI direttamente ai pozzetti, poiché le celle si riattaccheranno in pochi minuti. - Centrifugare il tubo per 7 minuti a 230 x g a RT.
- Scartare il surnatante e risospendere le cellule pellettate in 10 ml di RT KSFM contenente penicillina/streptomicina ma nessun altro additivo. Contare le cellule utilizzando un emocitometro o un contatore automatico delle cellule. Eseguire un conteggio delle cellule vive/morte aggiungendo il blu di tripano in un rapporto 1:1 o utilizzare una procedura alternativa di conteggio delle cellule vive/morte.
- Crioconservare le cellule ad una concentrazione di 400.000 cellule per mL di mezzo di congelamento (fare riferimento alla Tabella supplementare 1 per la composizione) e aggiungere 1 mL di questa sospensione per crioviale. Trasferire i crioviali in un contenitore a celle frigorifere e porlo a -80 °C. Dopo 24 ore, trasferire i flaconcini ad azoto liquido a -196 °C per la conservazione a lungo termine.
NOTA: Sono possibili due opzioni per trasferire le celle al mezzo di congelamento, entrambe funzionano bene: 1) pellettare nuovamente le celle mediante centrifugazione e risospenderle nel mezzo di congelamento a freddo alla concentrazione cellulare richiesta; oppure 2) aggiungere il mezzo di congelamento a freddo e regolare la concentrazione del crioconservante (dimetilsolfossido [DMSO]) in base al volume di KSFM in cui sono presenti le cellule.
3. Scongelare i PBEC crioconservati e coltivarli per la coltura su inserti
- Rivestire un pallone per coltura cellulare T75 per una notte con 10 ml di soluzione di rivestimento in PBS con i coperchi ben chiusi. Incubare il matraccio in un incubatore per colture cellulari a 37 °C e 5% di CO2.
- Prima di scongelare i PBEC crioconservati, rimuovere la soluzione di rivestimento dal pallone e riempirla con 10 mL di c-KSFM. Lasciare riscaldare a 37 °C in un incubatore per colture cellulari, con coperchi leggermente aperti per far entrare l'aria dell'incubatore.
- Scongelare rapidamente le cellule in un bagno d'acqua o di perline a 37 °C.
NOTA: Un bagno di perline è preferito a un bagno d'acqua a causa del minor rischio di contaminazione e del minor consumo di energia. - Aggiungere il contenuto completo del crioviale al matraccio T75 preriscaldato con mezzo (fase 3.2) e distribuire uniformemente le celle.
NOTA: Non centrifugare le cellule in questa fase, poiché non sopravviveranno alla fase di centrifugazione. - Dopo circa 4 ore, assicurarsi che le celle siano sufficientemente attaccate. Sostituire il mezzo con 10 ml di c-KSFM fresco e caldo.
NOTA: in questo modo, il DMSO dal mezzo di congelamento viene rimosso. Questo passaggio dovrebbe avvenire tra le 4 h e le 24 h dopo la semina delle cellule nel pallone. - Coltiva le cellule fino a raggiungere l'80-90% di confluenza, cambiando il terreno ogni lunedì, mercoledì e venerdì.
4. Stabilire una coltura di interfaccia aria-liquido con cellule epiteliali bronchiali primarie (ALI-PBEC)
NOTA: La seguente procedura è per la coltura di PBEC su inserti di diametro interno di 11,9 mm.
- Rivestire un numero appropriato di inserti di coltura cellulare con 0,4 ml di soluzione di rivestimento per inserto. Incubare per una notte a 37 °C in un incubatore di coltura cellulare.
- Preparare il mezzo BD completo (mezzo cBD), come descritto nella Tabella supplementare 1.
NOTA: il mezzo cBD è un mezzo composito (vedi Tabella supplementare 1) formulato per supportare la crescita delle cellule epiteliali bronchiali per periodi di tempo più lunghi, consentendo al contempo la loro differenziazione a seguito di un aumento della concentrazione e della coltura di acido retinoico (RA) (o di un analogo dell'AR come usato nel presente protocollo) presso l'ALI, come delineato al punto 4.10. - Tripsinizzare i PBEC nel matraccio T75, utilizzando 2 mL di tripsina morbida per pallone. Incubare le cellule per 5-10 minuti per consentire alle cellule di staccarsi (in base all'ispezione visiva). Dopo 5 minuti di incubazione, facilitare il distacco delle cellule facendo roteare la tripsina nel matraccio e picchiettando delicatamente il matraccio (ripetere se necessario).
- Aggiungere 4 mL di SBTI al matraccio e trasferire direttamente la sospensione cellulare in una provetta da centrifuga da 25 ml.
NOTA: le celle si riattaccano in pochi minuti. Pertanto, quando si lavora con più di un pallone, la sospensione cellulare ottenuta al punto 4.4 deve essere trasferita direttamente in una provetta da centrifuga prima di aggiungere SBTI ad un secondo pallone. Nella procedura, un massimo di cinque palloni vengono lavorati contemporaneamente. - Centrifugare i tubi per 7 minuti a 230 x g a RT.
- Risospendere le cellule in 6 ml di terreno cBD e contare le cellule utilizzando un emocitometro o un contatore automatico delle cellule. Eseguire un conteggio delle cellule vive/morte, ad esempio, aggiungendo il blu di tripano in un rapporto 1: 1 o utilizzando un'altra procedura di conteggio delle cellule vive / morte.
- Rimuovere la soluzione di rivestimento dagli inserti di coltura cellulare.
- Diluire la sospensione cellulare, generata nella fase 4.6, con mezzo cBD integrato con 1 nM EC 23 ad una concentrazione di 80.000 cellule per ml e aggiungere 0,5 ml sulla parte superiore della membrana nell'inserto. Aggiungere 1,5 mL di cBD medium integrato con 1 nM EC 23 al pozzo sotto l'inserto.
- Cambiare il terreno con cBD integrato con 1 nM EC 23 tre volte alla settimana fino a quando le colture sono pronte per l'esposizione all'aria (cioè 2 giorni dopo aver raggiunto il 100% di confluenza). Ogni volta, 0,5 ml del mezzo vengono aggiunti all'interno dell'inserto (sulle celle) e 1,5 ml vengono aggiunti al compartimento inferiore (il pozzetto).
NOTA: In generale, lo strato cellulare raggiunge il 100% di confluenza circa 5 giorni dopo la semina dei PBEC sugli inserti. Sulla base dell'ispezione visiva della confluenza delle cellule, viene presa la decisione di trasferire le cellule allo stadio ALI 2 giorni dopo. - Quando le cellule sono pronte per il trasferimento all'ALI (cioè 2 giorni dopo aver raggiunto il 100% di confluenza), rimuovere il mezzo dagli inserti e dal pozzetto, non aggiungere nuovo mezzo all'interno dell'inserto e aggiungere nuovo mezzo (1 mL di mezzo cBD integrato con 50 nM EC 23) solo al pozzetto. Cambia il mezzo nei pozzetti tre volte a settimana.
- Per rimuovere il muco in eccesso e i detriti cellulari, aggiungere delicatamente 200 μL di PBS caldo sul lato apicale dello strato cellulare all'interno dell'inserto (preferibilmente attraverso il lato dell'inserto e non mediante pipettaggio diretto sulle cellule) e incubare per 10 minuti in un incubatore di coltura cellulare a 37 °C. Quindi, aspirare il PBS per rimuovere il muco in eccesso e i detriti cellulari.
NOTA: Da questo punto in poi (inizio della coltura di ALI), prima di cambiare il mezzo del compartimento inferiore, lavare ogni volta il lato apicale delle cellule con PBS. - Coltivare le cellule all'ALI per un minimo di 2 settimane per assicurarsi che tutti i principali tipi di cellule siano rappresentati.
5. Stabilire una coltura ALI-PBEC da una popolazione donatrice mista
- Utilizzare cellule da un massimo di cinque singoli donatori per avviare colture PBEC da una popolazione mista.
- Mescolare un numero uguale di cellule per donatore utilizzando le cellule generate nella fase 4.7 per raggiungere un totale di 150.000 cellule per inserto (cioè 30.000 cellule per donatore quando si utilizzano cinque donatori). Ciò assicurerà che la proliferazione nell'inserto sia ridotta al minimo e che nella coltura siano presenti un numero uguale di cellule dei singoli donatori.
- Continuare la coltura ALI-PBEC come descritto nei passaggi 4.9-4.12.
6. Controllo di qualità della cultura ALI-PBEC
- Monitoraggio della resistenza elettrica transepiteliale (TEER) durante la coltura cellulare
NOTA: La misura della resistenza elettrica, basata sull'utilizzo di un voltohmmetro, può essere eseguita in qualsiasi momento durante la coltura ALI-PBEC e viene eseguita ogni volta secondo lo stesso protocollo nelle stesse condizioni, poiché la misurazione della resistenza elettrica è influenzata da varie variabili, tra cui la posizione dell'elettrodo, la temperatura, il mezzo e la manipolazione. TEER può essere calcolato utilizzando la resistenza elettrica misurata applicando la seguente formula basata sulla legge di Ohm: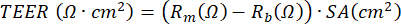 , in cui Rm è la resistenza elettrica misurata, Rb è la resistenza elettrica di base di un inserto senza rivestimento e celle e SA è la superficie della membrana dell'inserto17.
, in cui Rm è la resistenza elettrica misurata, Rb è la resistenza elettrica di base di un inserto senza rivestimento e celle e SA è la superficie della membrana dell'inserto17.- Aggiungere delicatamente 200 μL di PBS caldo sul lato apicale dello strato cellulare per rimuovere il muco e i detriti sulle cellule. Incubare l'inserto per 10 minuti in un incubatore per colture cellulari a 37 °C e rimuovere nuovamente il PBS.
- Aggiungere delicatamente 700 μL di PBS caldo sul lato apicale dello strato cellulare e incubare l'inserto per 10 minuti a RT per consentire la stabilizzazione della temperatura per le misurazioni.
- Calibrare il voltohmmetro utilizzando la resistenza di prova da 1.000 Ω, impostare il voltohmmetro per misurare gli ohm e utilizzare un cacciavite per regolare la vite di calibrazione "R ADJ" fino a impostarla a 1.000 Ω.
- Risciacquare l'elettrodo spostandolo su e giù alcune volte in acqua sterile (RT) e poi in PBS sterile (RT).
- Misurare la resistenza elettrica dello strato cellulare negli inserti. A tal fine, posizionare l'elettrodo in posizione verticale nel pozzetto con il braccio lungo dell'elettrodo che tocca il fondo della piastra. In questo modo, il braccio corto si trova sopra lo strato cellulare all'interno dell'inserto. Leggere il valore visualizzato sul voltohmmetro.
NOTA: il valore visualizzato non si stabilizzerà completamente; Leggere il valore nel momento in cui il valore è intermittente. - Tra una misurazione e l'altra, pulire l'elettrodo spostandolo su e giù alcune volte in PBS sterile (RT).
- Pulire l'elettrodo al termine delle misurazioni spostandolo su e giù alcune volte in acqua sterile (RT), PBS sterile (RT) e etanolo al 70% (RT). Conservare l'elettrodo asciutto.
- Eseguire una misurazione di base di un inserto (senza rivestimento) e delle celle aggiungendo 700 μL di PBS caldo all'interno dell'inserto e 1 mL di PBS caldo al pozzetto e misurando la resistenza elettrica insieme agli altri inserti.
- Valutazione della composizione cellulare della coltura ALI-PBEC
- Durante la fase ALI, controllare la differenziazione valutando visivamente le ciglia battenti. Questi possono essere osservati tramite microscopia standard a campo chiaro già 9 giorni dopo l'esposizione all'aria sul lato apicale delle cellule.
NOTA: Le ciglia che battono sono meglio visibili subito dopo aver lavato la superficie apicale. Le cellule caliciformi producono muco, e quindi la presenza di muco, come osservato durante il lavaggio della superficie apicale, è un segno che si formano cellule caliciformi. Tuttavia, il livello delle cellule caliciformi e la quantità di muco prodotto è altamente dipendente dal donatore. La presenza di muco può essere vista quando si aspira il PBS dopo aver lavato la superficie apicale dello strato cellulare nell'inserto; in questo caso, il PBS aspirato è più viscoso e si possono osservare fili di muco durante l'aspirazione. - La valutazione della composizione cellulare mediante immunocolorazione e microscopia fluorescente o selezione cellulare attivata da fluorescenza (FACS), o analisi dell'espressione genica mediante reazione a catena della polimerasi quantitativa in tempo reale (RT-qPCR) fornisce importanti informazioni sullo stato di differenziazione della coltura, ma la sua descrizione va oltre lo scopo di questo contributo.
- Durante la fase ALI, controllare la differenziazione valutando visivamente le ciglia battenti. Questi possono essere osservati tramite microscopia standard a campo chiaro già 9 giorni dopo l'esposizione all'aria sul lato apicale delle cellule.
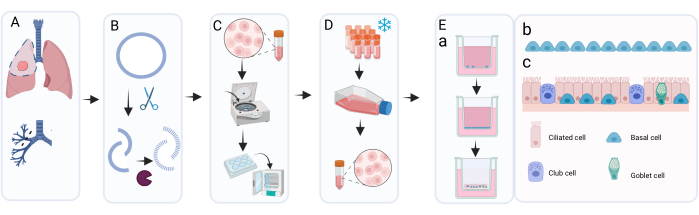
Figura 1: Panoramica schematica della procedura di isolamento, espansione e coltura delle cellule epiteliali bronchiali primarie . (A) Il tessuto polmonare viene ottenuto durante l'intervento chirurgico di resezione del cancro e il patologo asporta il tessuto dell'anello bronchiale che è macroscopicamente normale e privo di tumore. (B) L'anello bronchiale viene pulito ed esposto a trattamento enzimatico per staccare e dissociare lo strato cellulare. (C) La sospensione cellulare recuperata viene lavata e le celle vengono distribuite in pozzetti di una piastra a 6 pozzetti per l'espansione. (D) Dopo sufficiente espansione delle cellule isolate in c-KSFM con Primocin, gli strati cellulari vengono dissociati mediante tripsinizzazione e le cellule vengono risospese in mezzo di congelamento per la crioconservazione. Quando necessario, le cellule crioconservate vengono scongelate e nuovamente espanse utilizzando c-KSFM con penicillina / streptomicina in palloni di coltura cellulare. Dopo l'espansione, vengono seminati in mezzo cBD su inserti di coltura cellulare; (e bis) La coltura di ALI-PBEC avviene in due fasi principali: lo stadio sommerso in mezzo cBD integrato con 1 nM EC 23 fino a quando le cellule raggiungono la piena confluenza, seguito dalla rimozione del mezzo apicale e della coltura all'ALI per consentire la differenziazione; in questa fase ALI, le cellule vengono coltivate in terreno cBD integrato con 50 nM EC 23. e ter) Rappresentazione grafica delle cellule basali che ricoprono l'inserto durante la coltura sommersa. e quater) Rappresentazione grafica dello strato cellulare epiteliale differenziato ottenuto in seguito a coltura presso l'ALI in presenza di concentrazioni aumentate di EC 23. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
Espansione mediante coltura sommersa
Utilizzando il metodo qui presentato, una media di otto crioviali con 400.000 cellule/crioviale può essere ottenuta da una piastra a 6 pozzetti per la conservazione a lungo termine in azoto liquido (Figura 2A). Per raggiungere questo obiettivo, i PBEC isolati vengono coltivati in piastre a 6 pozzetti per un minimo di 7 giorni e un massimo di 14 giorni (Figura 2B) in presenza di Primocina per escludere la contaminazione microbica (in particolare micoplasma). La figura 2A,B fornisce informazioni sul numero di cellule ottenute e sul tempo di coltura richiesto tra i diversi isolamenti da vari donatori. Prima di raccogliere le cellule mediante tripsinizzazione per la conservazione in azoto liquido, la confluenza deve essere superiore all'80%. Se questo non viene raggiunto entro 14 giorni, le cellule non devono essere crioconservate. È importante sottolineare che, durante la raccolta per lo stoccaggio e il passaggio, la confluenza dello strato cellulare non deve superare ~ 95% (Figura 2C). Dopo lo stoccaggio in azoto liquido, le cellule possono essere scongelate e coltivate per l'espansione fino a ottenere un numero sufficiente di cellule per le colture di ALI. Il mezzo utilizzato per l'espansione delle cellule in questa fase è c-KSFM, simile a quello della coltura iniziale dopo il prelievo dall'anello bronchiale18. Non vi è tuttavia alcuna necessità di Primocin in questa fase, perché il rischio di ulteriore contaminazione microbica proveniente dal tessuto polmonare è assente, e quindi Primocin può essere cambiato per penicillina / streptomicina. Questo mezzo favorisce le cellule epiteliali rispetto ai fibroblasti e quindi previene la possibile crescita eccessiva della coltura con una proliferazione più rapida dei fibroblasti 19,20,21. Utilizzando il mezzo c-KSFM, le cellule sono distribuite nel pallone e non si collegano tra loro, il che è marcatamente diverso dalla morfologia delle cellule in coltura immerse in questa fase nel mezzo cBD (Figura 2D,E). Dopo 5 o 6 giorni di coltura delle cellule scongelate in un pallone T75, lo strato cellulare dovrebbe essere confluente all'80% -95%, il che si traduce in circa 3 x 106 cellule in totale (Figura 2F). Da questo, è possibile generare circa 75 inserti (dimensioni della piastra a 12 pozzetti) per la coltura ALI.
Il metodo per l'isolamento e la coltura descritto in questo contributo può anche essere adattato per l'uso con biopsie bronchiali o spazzole bronchiali come materiale di partenza.
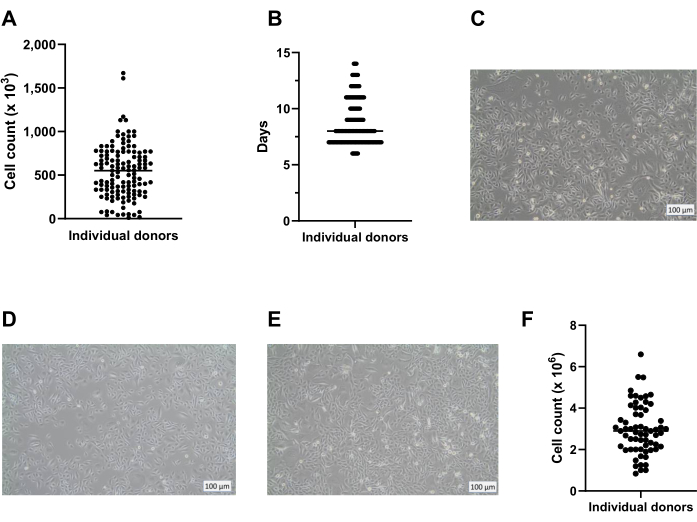
Figura 2: Espansione delle cellule basali prima e dopo la crioconservazione. Le cellule sono state isolate secondo il protocollo descritto e coltivate utilizzando c-KSFM. Il numero di cellule generate per donatore è stato monitorato, i conteggi delle cellule vive sono stati eseguiti utilizzando un contatore automatico delle cellule (A) durante la raccolta delle cellule di passaggio 0 (P0) dalle piastre a 6 pozzetti (fase 2 del protocollo), n = 123 donatori, il conteggio delle cellule è stato presentato come il numero di cellule raccolte per pozzetto; Ogni punto rappresenta un donatore e la mediana è indicata da una barra orizzontale. (B) Come parte del controllo di qualità, il tempo richiesto dalle cellule P0 per raggiungere l'80% al 90% di confluenza nelle piastre a 6 pozzetti è stato monitorato e mostrato come giorni dopo l'inizio della coltura sommersa in c-KSFM (n = 127 donatori diversi). Ogni singolo donatore è indicato da un punto, tutti i punti appartenenti a 1 giorno si fondono in una linea; più ampia è la linea, più donatori rappresenta; Il numero mediano di giorni in cui le cellule sono in coltura è indicato da una barra orizzontale più sottile. (C) Immagine rappresentativa in campo chiaro delle cellule P0 cresciute sommerse in c-KSFM nel momento in cui le cellule sono state raccolte per la crioconservazione a lungo termine. (D) Immagine rappresentativa in campo chiaro delle cellule P1 cresciute sommerse in c-KSFM nel momento in cui le cellule sono state raccolte e trasferite in inserti e (E) cellule P1 cresciute immerse in mezzo cBD. (F) Il numero di cellule vive generate per donatore è stato monitorato utilizzando un contatore automatico di cellule al momento del prelievo di cellule P1 dal matraccio T75 (sezione 4 del protocollo), n = 63 donatori diversi; la conta cellulare è presentata come il numero di cellule per pallone T75, ogni donatore è indicato da un punto e la conta cellulare mediana è indicata da una barra orizzontale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Coltura dell'interfaccia aria-liquido (ALI)
A 7 giorni dall'inizio della coltura di ALI, viene misurata la resistenza elettrica dello strato cellulare e dovrebbe essere superiore a 300 Ω (Figura 3A); Se ciò non viene raggiunto, la cultura è considerata fallita a causa di una possibile mancanza di formazione di giunzioni strette. Si raccomanda di escludere la possibilità di ottenere bassi valori di TEER causati da danni allo strato epiteliale in singoli inserti derivanti, ad esempio, da danni allo strato cellulare durante il lavaggio e l'aspirazione. Questo può essere verificato mediante ispezione visiva microscopica degli inserti di coltura. Nella nostra esperienza, la variabilità inter-donatore nella resistenza elettrica può essere significativa (Figura 3B), che è anche riportata nella letteratura14, e come osservato è anche marcatamente influenzata dall'origine del mezzo di aquila modificato di Dulbecco (DMEM) utilizzato (Figura 3C).
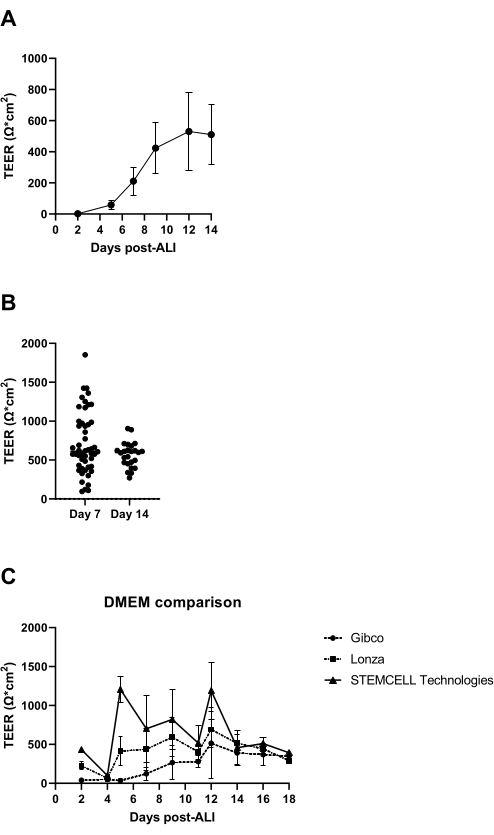
Figura 3: Resistenza elettrica transepiteliale come controllo di qualità delle colture ALI-PBEC. I PBEC sono stati isolati ed ampliati e sono state stabilite colture ALI-PBEC ben differenziate. In diversi momenti durante la coltura è stata misurata la resistenza elettrica e successivamente è stato calcolato il TEER (Ω·cm2). (A) La resistenza elettrica è stata misurata nel corso di 14 giorni post-ALI. n = 4 donatori diversi. I dati sono rappresentati come il valore medio ± deviazione standard (SD). (B) Nell'ambito del controllo di qualità della coltura cellulare ALI-PBEC, la resistenza elettrica è stata misurata al giorno 7 (n = 50) e al giorno 14 post-ALI (n = 25); ogni punto rappresenta un donatore e il TEER mediano (Ω·cm2) è indicato da una barra orizzontale. I dati sono stati testati per la significatività utilizzando un test di Mann-Whitney non parametrico e non è stata trovata alcuna differenza significativa. (C) I media di tre diversi fornitori di DMEM sono stati testati per valutare l'influenza sulla formazione di TEER. n = 4 donatori diversi; i valori medi sono rappresentati ± SD. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Mentre si stabilisce una coltura ALI-PBEC ben differenziata, dall'inizio dell'esposizione all'aria, la concentrazione di RA aumentadi 22. In questo modo, le cellule passano dalla proliferazione alla differenziazione mucociliare, che è visibile già da 9 giorni (dipendente dal donatore) dopo l'esposizione all'aria utilizzando la microscopia a campo chiaro. Il movimento delle prime ciglia è visibile a questo punto, e un po 'prima quando si basa sull'espressione genica dei marcatori delle cellule luminali differenziate23 (Figura 4).
Come descritto nel protocollo, la produzione di muco può essere osservata anche durante il risciacquo della superficie apicale durante il cambio del mezzo. L'AR è molto sensibile alla luce, il che porta ad un'attività altamente variabile alla stessa concentrazione di stock. Per questo motivo, RA è sostituito dall'analogo sintetico RA EC 23 e utilizzato nella stessa concentrazione, con risultati simili a quelli determinati sperimentalmente. Per questo motivo e per evitare di modificare la procedura, la concentrazione EC 23 selezionata è stata mantenuta uguale alla concentrazione RA (cioè 50 nM) precedentemente utilizzata24,25 (Figura 5). La figura 5A mostra i valori TEER raggiunti quando si utilizzano diverse concentrazioni di EC 23, mostrando un TEER massimo a 50 nM all'interno di questo intervallo di concentrazioni testate. I risultati mostrati nella Figura 5B confermano che l'espressione genica dei marcatori per le cellule ciliate e caliciformi è simile quando si utilizza 50 nM EC 23 o RA. EC 23 è richiesto anche durante la coltura allo stadio sommerso (anche se ad una concentrazione molto più bassa), poiché ometterlo in questo stadio sommerso e aggiungerlo solo allo stadio ALI si ottiene una coltura che non raggiunge mai la piena confluenza. Il tempo necessario per generare una coltura ALI-PBEC ben differenziata con attività di battitura ciliare visibile e produzione di muco è di circa 14 giorni, e la maggior parte degli esperimenti sono quindi iniziati tra colture ALI di 14-21 giorni (Figura 4). Tutti i principali tipi di cellule diverse (basale, ciliata, calice e cellule club) sono osservati dopo 14 giorni di coltura ALI, sebbene i livelli di espressione siano altamente dipendenti dal donatore. Ciò è dimostrato valutando l'espressione genica di TP63, FOXJ1, MUC5AC e SCGB1A1 mediante RT-qPCR, o l'espressione proteica utilizzando anticorpi diretti contro p63, α-tubulina, Muc5AC e CC-16 mediante colorazione a fluorescenza immunitaria (IF), per rilevare marcatori per cellule basali, ciliate, caliciforme e club, rispettivamente25,26. Tuttavia, mentre 14-21 giorni possono essere considerati una regola empirica per la maggior parte degli esperimenti, per esperimenti selezionati, può essere presa in considerazione una durata più lunga della differenziazione, come riscontrato per il metabolismo xenobiotico, l'infezione da SARS-CoV-2 e la valutazione della clearance mucociliare27,28,29.
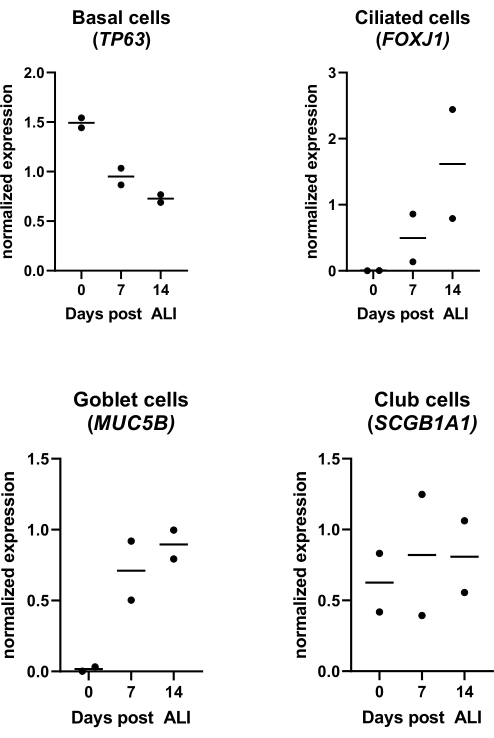
Figura 4: Coltura dell'interfaccia aria-liquido (ALI). I PBEC sono stati isolati ed ampliati e sono state stabilite colture ALI-PBEC ben differenziate. Le colture ALI-PBEC sono state monitorate nel corso di 14 giorni post-ALI. Le colture cellulari sono state lisate per l'isolamento dell'RNA nei giorni 0, 7 e 14 post-ALI. Vengono mostrati i dati di due donatori diversi, ogni punto rappresenta un singolo donatore monitorato nel tempo e la mediana è indicata da una barra orizzontale. L'espressione genica dei marcatori basali, ciliati, calici e delle cellule club (TP63, FOXJ1, MUC5B e SCGB1A1, rispettivamente) è stata misurata mediante qPCR e normalizzata per l'espressione genica di RPL13A e ATP5B (vedere riferimento 23 per i dettagli). Fare clic qui per visualizzare una versione ingrandita di questa figura.
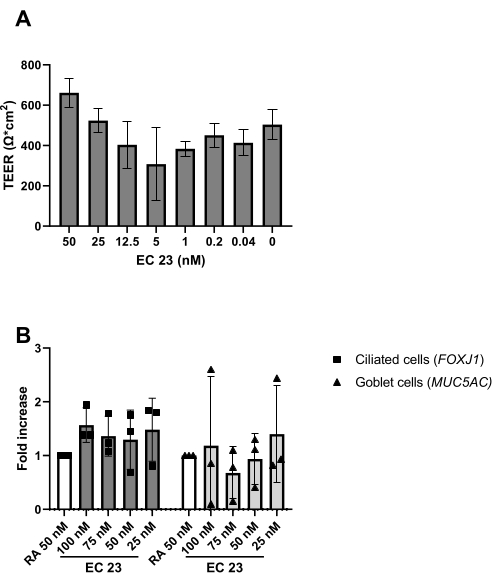
Figura 5: Confronto tra l'acido retinoico (RA) e il suo analogo sintetico EC 23. I PBEC sono stati isolati ed ampliati e sono state stabilite colture ALI-PBEC ben differenziate. All'inizio dell'esposizione all'aria delle colture PBEC, RA (50 nM) è stato sostituito da varie concentrazioni di EC 23. (A) La resistenza elettrica è stata misurata al giorno 14 post-ALI e successivamente è stato calcolato il TEER (Ω·cm 2), n =2 donatori, le barre rappresentano il valore medio ± SD. (B) Al giorno 14 post-ALI, le colture cellulari sono state lisate per l'isolamento dell'RNA e la successiva analisi dell'espressione genica di marcatori cellulari rispettivamente per cellule ciliate e caliciformi (FOXJ1, MUC5AC) utilizzando qPCR, e normalizzato per RPL13A (n = 3 donatori). Un aumento di piega è mostrato rispetto ad ALI-PBEC coltivato con 50 nM RA e rappresentato come valore medio ± SD. (Vedi riferimento 23 per i dettagli) Fare clic qui per visualizzare una versione ingrandita di questa figura.
Negli ultimi anni sono state esaminate le prestazioni di prodotti alternativi nel sistema di coltura, come i terreni e le materie plastiche di coltura. Tali valutazioni hanno avuto varie ragioni, tra cui cambiamenti nella composizione del mezzo da parte dei produttori, nuovi media introdotti e una carenza di prodotti durante la pandemia di COVID-19 (2020-2022). È stato osservato che prodotti simili di fornitori diversi danno luogo a colture cellulari epiteliali differenziate basate sulla valutazione dei marcatori dei tipi di cellule epiteliali, sebbene la composizione cellulare finale possa variare sostanzialmente (Figura 6A), mentre le differenze nel TEER erano meno pronunciate (Figura 6B). D'altra parte, i terreni di diversi fornitori hanno comportato differenze sostanziali nella composizione cellulare; quando si utilizzavano inserti di marche diverse, tali differenze erano limitate (Figura 6C). In particolare, quando si utilizza il terreno di coltura cellulare epiteliale delle vie aeree PneumaCult di STEMCELL Technologies, è stata osservata una morfologia diversa e una formazione più rapida dell'attività ciliare visibile. Oltre a queste osservazioni, è stata notata anche una differenza nei valori di TEER e una differenza nella composizione cellulare dell'ALI-PBEC rispetto al mezzo cBD (Figura 6D).
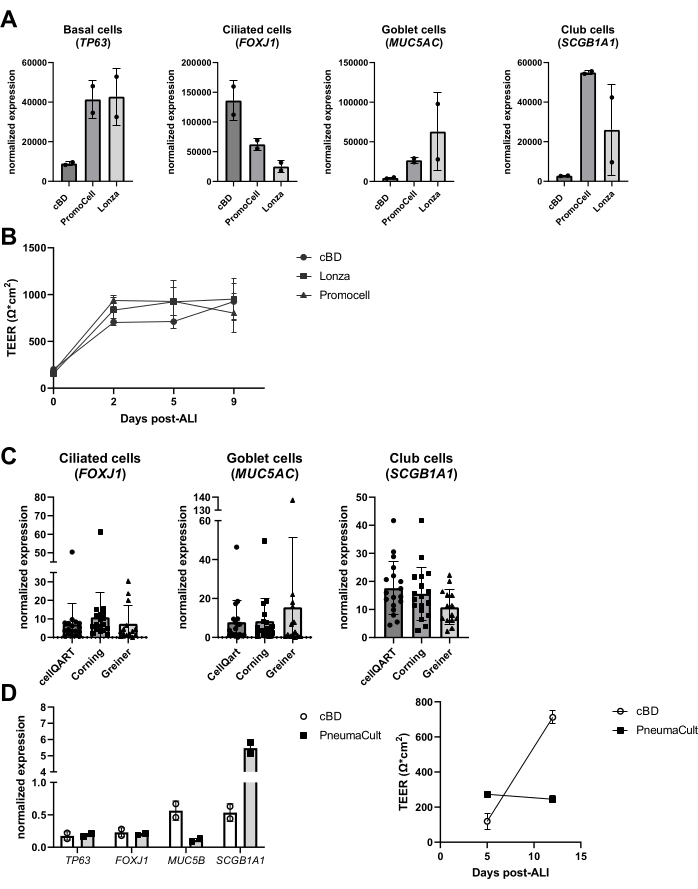
Figura 6: Confronto tra diversi fornitori di terreno cellulare epiteliale e inserti di coltura cellulare. Le PBEC sono state isolate, espanse e sono state stabilite culture ALI-PBEC ben differenziate. (A) GLI ALI-BBEC sono stati coltivati per 14 giorni, quindi gli strati cellulari sono stati lisati per l'isolamento dell'RNA. L'espressione genica dei marcatori basali, ciliati, calici e delle cellule club (TP63, FOXJ1, MUC5AC e SCGB1A1, rispettivamente) è stata misurata mediante qPCR e normalizzata per RPL13A e ATP5B. n = 2 donatori; le barre rappresentano il valore medio ± SD. (B) Nel corso di 9 giorni post-ALI, è stata misurata la resistenza elettrica e successivamente è stato calcolato il TEER (Ω·cm2). n = 3 donatori diversi; I valori medi sono rappresentati ± SD. (C) ALI-PBEC sono stati coltivati per 14 giorni utilizzando inserti di coltura cellulare acquistati da tre diversi fornitori, quindi gli strati cellulari sono stati lisati per l'isolamento dell'RNA. L'espressione genica dei marcatori ciliati, calici e delle cellule club (FOXJ1, MUC5AC e SCGB1A1, rispettivamente) è stata misurata mediante qPCR e normalizzata per RPL13A. n = 18 donatori diversi, le barre rappresentano il valore medio ± SD. I dati sono stati testati per la significatività utilizzando un test di Kruskal-Wallis non parametrico ANOVA unidirezionale e non è stata trovata alcuna differenza significativa. (D) Gli ALI-PBEC sono stati coltivati in mezzo cBD o in mezzo PneumaCult (tecnologie STEMMCELL) per 14 giorni post-ALI, e poi gli strati cellulari sono stati lisati per l'isolamento dell'RNA. L'espressione genica dei marcatori basali, ciliati, calici e delle cellule club (TP63, FOXJ1, MUC5B e SCGB1A1, rispettivamente) è stata misurata mediante qPCR e normalizzata per RPL13A (le barre rappresentano il valore medio ± SD), e la resistenza elettrica è stata misurata ai giorni 5 e 12 post-ALI e utilizzata per calcolare il TEER (Ω·cm2). n = 2; il valore medio è rappresentato ± SD (vedere riferimento 23 per i dettagli). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella supplementare 1: Composizione delle soluzioni e dei mezzi utilizzati nel protocollo. Clicca qui per scaricare questo file.
Discussione
Il protocollo qui presentato descrive l'isolamento di cellule epiteliali bronchiali umane da tessuto polmonare resecato, un metodo per l'espansione ottimale delle cellule senza perdita di potenziale di differenziazione, una procedura di crioconservazione e una procedura per generare colture ALI-PBEC ben differenziate. Inoltre, viene fornita una descrizione del controllo di qualità, nonché istruzioni per il monitoraggio e la valutazione degli ALI-PBEC differenziati.
Il protocollo descritto inizia con un anello bronchiale macroscopicamente normale, privo di tumore che viene resecato da un lobo polmonare da pazienti sottoposti a intervento chirurgico correlato alla loro diagnosi di cancro del polmone. Va quindi notato che questi anelli non possono essere considerati strettamente come tessuto sano, che può quindi influenzare le caratteristiche della coltura cellulare. Le fonti alternative per ottenere cellule epiteliali bronchiali includono l'utilizzo di biopsie bronchiali, spazzole bronchiali o tessuti da un donatore di trapianto o polmoni riceventi. Indipendentemente dalla fonte, quando si utilizza il tessuto polmonare, deve essere considerato un rischio di contaminazione microbica, e quindi gli antibiotici vengono utilizzati nei diversi terreni di coltura per ridurre il rischio di contaminazione microbica della coltura cellulare. In particolare, il micoplasma è un rischio elevato e comune nella coltura cellulare, a causa della sua ampia varietà di effetti sulla coltura cellulare, della resistenza agli antibiotici comunemente usati nelle colture cellulari e del fatto che la contaminazione da micoplasma può essere confermata solo dai saggi di rilevamento del micoplasma. Pertanto, nella fase iniziale della coltura cellulare dopo l'isolamento delle cellule dal tessuto polmonare, viene utilizzata la formulazione antimicrobica ad ampio spettro Primocin e, durante il processo di coltura, vengono testati campioni selezionati casualmente per la presenza di micoplasma.
La procedura di isolamento che inizia con un anello bronchiale fornisce materiale di partenza sufficiente per consentire il grado di espansione di queste cellule primarie necessarie per avviare le colture presso l'ALI senza compromettere la capacità di differenziazione. Tuttavia, iniziare l'espansione delle cellule epiteliali isolate con un numero limitato di cellule può porre problemi con l'ottenimento di un numero sufficiente di inserti con abbastanza cellule che possono essere seminate per la coltura di ALI. La coltura prolungata e il passaggio ripetuto delle cellule primarie possono provocare senescenza replicativa. Sono state proposte varie soluzioni per superare questa limitazione. Horani et al. hanno dimostrato che l'inibitore della Rho chinasi (ROCK) Y-27632 ha aumentato la proliferazione delle cellule basali30, Mou et al. hanno usato la doppia inibizione di Smad per espandere le cellule staminali basali mantenendo le caratteristiche dello strato di cellule epiteliali differenziate 31, e Sachs et al. hanno sviluppato un sistema organoide delle vie aeree che può essere utilizzato per espandere le cellule epiteliali delle vie aeree e mantenere il loro potenziale di differenziazione nel corso di passaggi multipli32. Quest'ultimo metodo è stato utilizzato anche per espandere cellule da fonti con numero di cellule molto basso, come aspirati tracheali (TA) da neonati pretermine (33. È stato riscontrato che le cellule isolate da BAL e TA mostravano una capacità di differenziazione simile alle cellule generate dal tessuto bronchiale, sebbene siano state osservate differenze quando la differenziazione è stata inclinata verso colture più ciliate o più contenenti cellule caliciali utilizzando l'inibizione della segnalazione di Notch o la citochina Th2 IL-1333. Si raccomanda pertanto che, se gli ALI-PBEC sono coltivati a partire da un materiale di partenza con un basso numero di cellule epiteliali utilizzando approcci simili, di controllare sempre le colture per i criteri di qualità di base, come discusso nella sezione 6 del protocollo. È importante sottolineare che l'uso di cellule di alimentazione può anche aiutare a ottenere numeri di cellule più grandi, che è essenziale in un contesto per l'ingegneria delle impalcature trapiantabili in cui il tempo e il numero di cellule sono essenziali. Ciò è illustrato da uno studio in cui cellule epiteliali autologhe sono state coltivate da biopsie derivate da un paziente con malattia tracheale e le cellule sono state rapidamente espanse in presenza di uno strato di alimentazione embrionale murino (fibroblasti 3T3-J2 mitoticamente inattivati) e del suddetto inibitore della via Rho / ROCK (Y-27632) 34. La coltura cellulare risultante si è rivelata utile per il ripopolamento degli scaffold tracheali, e quindi questo potrebbe essere visto come un protocollo adatto per un modello di trapianto.
Quando si utilizza il protocollo descritto in questo contributo, ma anche quando si utilizzano altri protocolli culturali, viene inevitabilmente introdotto un bias di selezione. È importante rendersi conto che le differenze nei dettagli del protocollo, come l'origine delle cellule utilizzate per avviare le colture, la composizione del terreno e altri dettagli del protocollo, possono portare a cambiamenti nella composizione cellulare delle colture e quindi cambiamenti nella risposta della coltura ALI33,35. Inoltre, sono state osservate differenze nelle proprietà cellulari anche confrontando diversi mezzi per differenziare le cellule delle vie aeree10,11. Confrontando PneumaCult e il mezzo cBD, sono state osservate differenze nei marcatori mRNA delle cellule caliciformi e delle cellule club, nei valori TEER e nello spessore dello strato cellulare. Sulla base di queste osservazioni, nonostante la mancanza di basi statistiche, a causa del basso numero di donatori utilizzati, la composizione del mezzo è sconosciuta ai clienti e dei costi più elevati del mezzo PneumaCult, nel nostro laboratorio è stata presa la decisione di utilizzare il mezzo cBD.
Come discusso, le cellule possono essere inizialmente espanse utilizzando la coltura di organoidi e successivamente trasferite al sistema di inserti ALI 2D. Questo è importante, poiché gli organoidi epiteliali delle vie aeree non sono adatti all'esposizione a sostanze aerodisperse, mentre l'uso del sistema ALI 2D consente di valutare l'impatto di sostanze aerodisperse come il fumo di sigaretta23,36 sulle cellule epiteliali delle vie aeree in coltura. Un approccio diverso per stabilire colture di cellule epiteliali delle vie aeree ALI consiste nel generare cellule epiteliali delle vie aeree mediante la differenziazione delle cellule staminali pluripotenti umane (hiPSCs)37. In tali protocolli, nella fase finale del protocollo di differenziazione dopo la differenziazione in progenitori prossimali delle vie aeree, le cellule possono essere differenziate per coltura all'ALI utilizzando procedure simili a quelle qui descritte.
Nel protocollo attuale, il mezzo cBD viene utilizzato per la coltura presso l'ALI. Il mezzo cBD è un mezzo privo di siero che viene preparato aggiungendo un mix di diversi integratori, ispirato da Fulcher et al.38 e da altri studi. La soluzione di supplemento contiene 52 μg/mL di estratto ipofisario bovino (BPE), 0,5 μg/mL idrocortisone, 0,5 ng/mL EGF umano, 0,5 μg/mL epinefrina, 10 μg/mL transferrina, 5 μg/mL di insulina, 6,5 ng/mL di triiodotironina e 0,1 ng/mL di RA39. Poiché il BPE è un estratto tissutale ed è soggetto a variazioni per lotti, il mezzo non può essere considerato un mezzo completamente definito, né è privo di animali. Il terreno di coltura cellulare completamente definito è preferibile per ridurre al minimo le differenze tra batch. In vista della transizione verso una ricerca senza animali, è importante che si compiano sforzi per produrre terreni definiti che non contengano prodotti animali e che siano accessibili per la comunità scientifica.
Varie configurazioni sperimentali possono essere utilizzate sulla base del modello ALI, a seconda della domanda di ricerca. Ad esempio, per studiare l'impatto dei composti che possono influenzare il processo di differenziazione, questo può essere affrontato aggiungendo i composti alla coltura durante le diverse fasi della coltura sommersa, durante la differenziazione o nella fase ben differenziata. La composizione cellulare della coltura ALI-PBEC può essere influenzata dall'aggiunta di composti specifici; ad esempio, differenziando gli ALI-PBEC in presenza di IL-13 si genera una coltura con più cellule caliciformi e meno cellule ciliate, mentre il trattamento con l'inibitore della γ-secretasi DAPT (usato per bloccare la segnalazione di Notch) durante la differenziazione si traduce in una coltura con più cellule ciliate a spese delle cellule caliciformi 23,40,41,42.
Inoltre, gli agenti per stimolare le cellule o bloccare determinati processi possono essere applicati al compartimento basale o (in un volume molto piccolo) al compartimento apicale della coltura. Le cellule possono anche essere esposte a sostanze aerodisperse dal lato apicale. Tali modelli di esposizione sono stati utilizzati per studiare l'effetto dei gas di scarico diesel o del fumo di sigaretta intero sui PBEC23,43,44. Il terreno può essere raccolto ogni volta che il terreno viene cambiato per monitorare le proteine secrete sul lato basale; lo stesso vale per il lato apicale delle cellule che viene lavato con PBS mentre rinfresca il mezzo basale. Il cosiddetto lavaggio apicale viene raccolto e viene aggiunto ditioeritritolo opzionale (DTE) per dissociare il muco prodotto dalle cellule caliciformi in modo più efficiente. Gli lisati cellulari possono essere ottenuti per l'isolamento di proteine totali, RNA e DNA cromosomico e mitocondriale. Le cellule possono essere ulteriormente studiate utilizzando anticorpi per marcatori specifici, tagliando la membrana di polietilene tereftalato (PET) dall'inserto di plastica e tagliando ulteriormente questa membrana in pezzi più piccoli per colorazioni multiple di immunofluorescenza45. Inoltre, la citometria a flusso o FACS può essere utilizzata anche dopo tripsinizzazione delle cellule negli inserti. Durante la fase ALI, lo sviluppo della barriera cellulare può essere monitorato misurando la resistenza elettrica e successivamente calcolando il TEER, dove la resistenza elettrica è inversamente proporzionale alla superficie dell'inserto della membrana. Il calcolo si basa sulla legge di Ohm utilizzando la seguente formula: 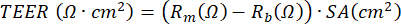 , in cui Rm è la resistenza elettrica misurata, Rb è la resistenza elettrica di base di un inserto senza rivestimento e celle e SA è l'area superficiale della membrana dell'inserto. La misurazione della resistenza elettrica utilizzando elettrodi EVOM2 e STX / bacchette è semplice, ma dipende fortemente dalle procedure di manipolazione quando viene introdotta nel pozzo. Inoltre, è stato suggerito che la forma dell'elettrodo influenzi la misurazione della funzione barriera della superficie relativamente grande17.
, in cui Rm è la resistenza elettrica misurata, Rb è la resistenza elettrica di base di un inserto senza rivestimento e celle e SA è l'area superficiale della membrana dell'inserto. La misurazione della resistenza elettrica utilizzando elettrodi EVOM2 e STX / bacchette è semplice, ma dipende fortemente dalle procedure di manipolazione quando viene introdotta nel pozzo. Inoltre, è stato suggerito che la forma dell'elettrodo influenzi la misurazione della funzione barriera della superficie relativamente grande17.
Un ulteriore miglioramento del sistema di coltura cellulare ALI, volto ad aumentare la rappresentazione accurata dei tessuti, include la cocoltura di ulteriori tipi cellulari come leucociti, fibroblasti o cellule endoteliali46,47,48. È stato osservato che la co-coltura di ALI-PBEC con il fattore stimolante le colonie di granulociti-macrofagi (GM-CSF) o i macrofagi differenziati M-CSF influenza marcatamente le risposte epiteliali innate e la riparazione48. È importante notare che in tali modelli di cocultura, la compatibilità media può essere un problema. Poiché il mezzo utilizzato per la coltura di cellule epiteliali delle vie aeree è sviluppato specificamente per i PBEC e potrebbe non essere adatto in modo ottimale per altri tipi di cellule, è necessaria un'ottimizzazione. Un altro tipo di progresso osservato nel campo della biologia delle vie aeree per il quale possono essere utilizzati PBEC isolati è l'uso della tecnologia Organs-on-Chips (OoC)49,50. Utilizzando questa tecnologia, l'influenza delle forze meccaniche della respirazione e del flusso sanguigno, come l'allungamento, l'aria e il flusso medio, può essere studiata 29.
La variabilità tra donatori può essere significativa quando si utilizzano PBEC di vari donatori e pertanto è importante considerare l'utilizzo di cellule di diversi donatori per tenere conto di questa variabilità negli studi di coltura di cellule epiteliali. Poiché la coltura di ALI-PBEC richiede molto tempo e comporta costi considerevoli, viene esaminata l'opzione di stabilire colture ALI-PBEC mescolando cellule di donatori diversi in un inserto di coltura cellulare. In questo modo, gli esperimenti pilota possono essere facilmente eseguiti utilizzando cellule primarie, prima di analizzare le risposte delle colture derivate da vari singoli donatori. Inoltre, i donatori con caratteristiche diverse (ad esempio, diversa categoria di età o sesso) possono essere raggruppati per studi esplorativi. Quando si utilizzano miscele di donatori, è importante assicurarsi che siano presenti numeri di cellule uguali di donatori diversi, per evitare la possibilità che un donatore domini i risultati a causa di un tasso di proliferazione più elevato. Pertanto, le cellule dei singoli donatori vengono espanse separatamente e seminate a una densità più elevata nell'inserto rispetto alle cellule di semina di un singolo donatore, per ridurre al minimo la proliferazione nell'inserto prima della transizione all'ALI. Le risposte dei mix di donatori e dei singoli donatori corrispondenti sono state confrontate studiando la cinetica di infezione di SARS-CoV-2. Utilizzando RT-qPCR e colorazione a immunofluorescenza, è stato osservato che il mix di donatori ha fornito una buona rappresentazione dei vari singoli donatori, mostrando un numero simile di particelle virali prodotte e un numero simile di cellule infette28.
Per diventare un'alternativa accettabile per i modelli animali, l'editing genetico di cellule epiteliali bronchiali in coltura dovrebbe essere fattibile51. Viene esaminata la tecnologia di interferenza dell'RNA utilizzando piccoli RNA interferenti (siRNA) negli ALI-PBEC, tuttavia poiché le cellule devono essere trasfettate con siRNA durante la fase sommersa della coltura, il knockdown non è sufficientemente mantenuto durante la coltura ALI a causa della lunga durata della coltura, a meno che la trasfezione di siRNA non venga frequentemente ripetuta durante la coltura52. Tuttavia, i siRNA possono essere utilizzati con successo per modificare l'espressione genica nelle cellule basali sommerse. Altri hanno utilizzato con successo la tecnologia CRISPR / Cas9 per ottenere l'editing genetico in colture primarie di cellule epiteliali delle vie aeree ALI con rilascio di ribonucleoproteina (RNP) 53. Quando si utilizzano tali tecniche, è essenziale che le cellule mantengano la loro piena capacità di differenziazione. Poiché le colture cellulari primarie delle vie aeree non possono essere passate indefinitamente, l'espansione clonale delle cellule geneticamente modificate non è facile e l'aggiunta di terreno per selezionare le cellule trasfettate è ingombrante. Pertanto, è difficile ottenere il knockdown desiderabile in tutte le cellule coltivate. Un'alternativa per generare cloni knockout è l'uso di strategie knock-out in hiPSCs54 e l'uso di queste cellule per generare cellule epiteliali delle vie aeree. Un'altra alternativa, anche se non ottimale, è stabilire una linea PBEC immortalata per espandere clonalmente le cellule geneticamente modificate55.
Il protocollo presentato qui è un modo per generare un ALI-PBEC pseudostratificato ben differenziato, ma sono stati trovati anche altri protocolli per stabilire una tale cultura, con differenze sempre più piccole rispetto al protocollo presentato. A nostro avviso, attraverso la validazione in laboratorio dei metodi di coltura e un rigoroso controllo di qualità sono essenziali affinché il sistema ALI-PBEC e simili sistemi di coltura di cellule epiteliali delle vie aeree, diventino una valida alternativa per gli esperimenti sugli animali.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse rilevanti.
Riconoscimenti
Gli studi che utilizzano il modello descritto in questo contributo sono stati supportati da una varietà di organizzazioni di finanziamento, tra cui la Lung Foundation Netherlands, l'Organizzazione olandese per la ricerca e lo sviluppo sanitario (ZonMw, COVID-19 MKMD grant), la Dutch Society for the Replacement of Animal Testing (Stichting Proefdiervrij, grant #114025007), nonché borse di ricerca di aziende come Boehringer Ingelheim e Galapagos. La Figura 1 è stata creata con BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 1,000 ohm test resistor | World Precision Instruments | N/A | Used to calibrate the EVOM2 Epithelial Voltohmmeter |
| 4-[2-(5,6,7,8-Tetrahydro-5,5,8,8-tetramethyl-2-naphthalenyl)ethynyl)-benzoic acid (EC 23) | Tocris | 4011 | Used in cBD medium |
| 6-well Clear TC-treated Multiple Well Plates | Corning | 3506 | Used in the first step to grow the cells isolated form the bronchial ring |
| Airway Epithelial Cell Growth Medium Kit | PromoCell | C-21160 | Used to compare to cBD medium |
| Bead Bath 20 Liter | Lab Armor | 74220-720 | Used to pre-warm cell culture solutions |
| BEGM Bronchial Epithelial Cell Growth Medium BulletKit | LONZA | CC-3170 | Used to compare to cBD medium |
| Bovine albumin fraction V (BSA) | Thermo Fisher Scientific | 15260037 | Used in coating solution |
| Bovine pituitary extract (BPE) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Bronchial epithelial cell growth supplement (BEpiCGS) | ScienCell Research Laboratories | 3262 | Used in cBD medium |
| Bronchial epithelial cell medium-basal (BEpiCM-b) | ScienCell Research Laboratories | SCC3211-b | Used in cBD medium |
| Cell culture inserts; 12 mm Transwell with 0.4 µm pore polyester membrane insert | Corning | 3460 | Cell culture inserts used in the protocol |
| Cell culture inserts; 12-well inserts, 0.4 µm PET clear | CellQART made by SABEU | 9310412 | Cell culture inserts used to compare with Corning cell culture inserts |
| Cell culture inserts; 12-well ThinCert Tissue culture Inserts | Greiner Bio-One | 82050-032 | Cell culture inserts used to compare with Corning cell culture inserts |
| CELLSTAR flask, TC, PS, 250 ml, 75 cm2 | Greiner Bio-One | 658170 | Used to expand the number cells |
| CFX Maestro 1.0 | Bio-Rad | N/A | Software program for analyzing qPCR data generated with the CFX384 System |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad | 1855484 | qPCR detection system |
| Chopstick electrode set | World Precision Instruments | STX2 | Used to measure electrical resistance in ALI-PBEC |
| CO2-Incubator | PHCbi | MCO-170AICUV-PE | Cell culture incubator used for mycplasma free cell cultures |
| CO2-Incubator | Hereaus | Heracell 150 | Cell culture incubator used for possibly mycplasma infected cell cultures |
| Coolcell Container | Corning | 432006 | Used to cryopreserve cells at -80 °C before transfer to liquid N2 |
| Countess 3 Automated cell counter | Thermo Fisher Scientific | AMQAX2000 | Used to count cells and determine the cell concentration |
| Cryovials | Nalgene | 479-3224 | Used to cryopreserve cells in |
| D-Glucose | Avantor VWR BDH CHEMICALS | 101174Y | Used in soft trypsin |
| Dimethyl sulfoxide (DMSO) | Avantor VWR | 0231 | Used in cell freeze medium |
| dNTP (10 mM) | Promega | U1515 | Used in the synthesis of cDNA |
| Dulbecco's Modified Eagle's Medium (DMEM) + 4500 mg/l D-Glucose | STEMCELL Technologies | 36250 | Used in cBD medium |
| Dulbecco's Modified Eagle's Medium (DMEM) 4.5 g/l glucose with l-glutamine | LONZA | LOBE12-604F | Used in cBD medium to compare with DMEM from other manufacturers |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, pyruvate | Thermo Fisher Scientific | 41966029 | Used in cBD medium to compare with DMEM from other manufacturers |
| Epidermal growth factor (EGF) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Ethylenediaminetetraacetic acid (EDTA) | Avantor VWR BDH CHEMICALS | 443885J | Used in soft trypsin |
| EVOM2 Epithelial Voltohmmeter | World Precision Instruments | 91799 | Used with the chopstick electrode set to measure electrical resistance in ALI-PBEC |
| Fibronectin solution, Human | PromoCell | C-43060 | Used in coating solution |
| Glutamax | Thermo Fisher Scientific | 35050038 | Used in cBD medium |
| Hanks balanced salt solution (HBSS) | ScienCell Research Laboratories | SCC0313 | Used to dissolve protease XIV |
| IQ SYBR Green Super mix | Bio-Rad | 170887 | qPCR reagent |
| Isoproterenol hydrochloride, (-)- | Sigma-Aldrich | I-6504 | Used in c-KSFM |
| Keratinocyte-SFM (KSFM) | Thermo Fisher Scientific | 17005-034 | Used in c-KSFM |
| Maxwell RSC Instrument | Promega | AS4500 | Automated RNA isolation system |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | Used to isolate total RNA with the Maxwell RSC Instrument |
| M-MLV Reverse transcriptase | Promega | M5301 | Used in the synthesis of cDNA |
| M-MLV Reverse transcriptase 5X reaction buffer | Promega | M531A | Used in the synthesis of cDNA |
| MycoStrip | InvivoGen | rep-mys-10 | Used to detect the presence of mycoplasma in cell culture samples |
| N-2-hydroxyethylpiperazine-N-2-ethane sulfonic acid (HEPES) | Thermo Fisher Scientific | 15630056 | Used in cBD medium |
| Oligo(dT)15 | Qiagen | 79237 | Used in the synthesis of cDNA |
| Penicillin/Streptomycin solution (Pen/Strep) | ScienCell Research Laboratories | SCC0513 | Used as antibiotic in c-KSFM and cBD medium |
| Phosphate buffered saline (PBS) | LUMC pharmacy | N/A | Used in different steps of the protocol |
| Pneumacult-ALI Medium | STEMCELL Technologies | 05002 | Used to grow cells in the differentiation stage to compare to cBD medium |
| Pneumacult-Ex Plus Medium | STEMCELL Technologies | 05040 | Used to grow cells in the submerged stage to compare to cBD medium |
| Primer, ATP5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: TCACCCAGGCTGGTTCAGA |
| Primer, ATP5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGTGGCCAGGGTAGGCTGAT |
| Primer, FOXJ1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGAGGGGACGTAAATCCCTA |
| Primer, FOXJ1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TTGGTCCCAGTAGTTCCAGC |
| Primer, MUC5AC, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCTTCGACGGACAGAGCTAC |
| Primer, MUC5AC, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCTCGGTGACAACACGAAAG |
| Primer, MUC5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGGCTTTGACAAGAGAGT |
| Primer, MUC5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGGATGGTCGTGTTGATGCG |
| Primer, RPL13A, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: AAGGTGGTGGTCGTACGCTGTG |
| Primer, RPL13A, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: CGGGAAGGGTTGGTGTTCATCC |
| Primer, SCGB1A1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: ACATGAGGGAGGCAGGGGCTC |
| Primer, SCGB1A1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: ACTCAAAGCATGGCAGCGGCA |
| Primer, TP63, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCACCTGGACGTATTCCACTG |
| Primer, TP63, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCGAATCAAATGACTAGGAGGGG |
| Primocin | InvivoGen | ant-pm-2 | Used as antimicrobial agent against bacteria, mycoplasma, and fungi in c-KSFM medium |
| Protease XIV | Sigma-Aldrich | P5147 | Used for the enzymatic treatment of the bronchial ring |
| RNAsin Recombinant Ribonuclease inhibitor | Promega | N2515 | Used in the synthesis of cDNA |
| Soybean trypsin inhibitor (SBTI) | Sigma-Aldrich | T9128 | Used to inhibit the action of soft trypsin |
| T100 Thermal Cycler | Bio-Rad | 1861096 | Used in the synthesis of cDNA |
| TissueSAFE plus | MILESTONE MEDICAL | N/A | Vacuum transfer system for biological specimens |
| Trypan blue solution | Thermo Fisher Scientific | 15250061 | Used to count live- and dead cells |
| Trypsin 1:250 | Thermo Fisher Scientific | 27250-018 | Used in soft trypsin |
| Type I collagen solution (PureCol) | Advanced BioMatrix | 5005-B | Used in coating solution |
| Universal container, PP, with PE screw cap | Avantor VWR | 216-2053 | Used in the protocol for the Protease XIV treatment of the bronchial ring |
Riferimenti
- Aghapour, M., et al. Role of air pollutants in airway epithelial barrier dysfunction in asthma and COPD. European Respiratory Review. 31 (163), 210112 (2022).
- de Waal, A. M., Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Duchesne, M., Okoye, I., Lacy, P. Epithelial cell alarmin cytokines: Frontline mediators of the asthma inflammatory response. Frontiers in Immunology. 13, 975914 (2022).
- Hewitt, R. J., Lloyd, C. M. Regulation of immune responses by the airway epithelial cell landscape. Nature Reviews Immunology. 21 (6), 347-362 (2021).
- Ruysseveldt, E., Martens, K., Steelant, B. Airway basal cells, protectors of epithelial walls in health and respiratory diseases. Frontiers in Allergy. 2, 787128 (2021).
- Alysandratos, K. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Hammad, H., Lambrecht, B. N. Barrier epithelial cells and the control of type 2 immunity. Immunity. 43 (1), 29-40 (2015).
- Hynds, R. E., Bonfanti, P., Janes, S. M. Regenerating human epithelia with cultured stem cells: feeder cells, organoids and beyond. EMBO Molecular Medicine. 10 (2), 139-150 (2018).
- Hiemstra, P. S., Tetley, T. D., Janes, S. M. Airway and alveolar epithelial cells in culture. The European Respiratory Journal. 54 (5), 1900742 (2019).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), 2137 (2020).
- Leung, C., Wadsworth, S. J., Yang, S. J., Dorscheid, D. R. Structural and functional variations in human bronchial epithelial cells cultured in air-liquid interface using different growth media. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1063-L1073 (2020).
- Morgan, R., et al. A medium composition containing normal resting glucose that supports differentiation of primary human airway cells. Scientific Reports. 12 (1), 1540 (2022).
- Ghosh, B., et al. Strong correlation between air-liquid interface cultures and in vivo transcriptomics of nasal brush biopsy. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1056-L1062 (2020).
- Pezzulo, A. A., et al. The air-liquid interface and use of primary cell cultures are important to recapitulate the transcriptional profile of in vivo airway epithelia. American Journal of Physiology. Lung Cellular and Molecular Physiology. 300 (1), L25-L31 (2011).
- Dvorak, A., Tilley, A. E., Shaykhiev, R., Wang, R., Crystal, R. G. Do airway epithelium air-liquid cultures represent the in vivo airway epithelium transcriptome. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 465-473 (2011).
- Legebeke, J., et al. Temporal whole-transcriptomic analysis of characterized in vitro and ex vivo primary nasal epithelia. Frontiers in Cell and Developmental Biology. 10, 907511 (2022).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- van Wetering, S., et al. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. Journal of Investigative Medicine. 48 (5), 359-366 (2000).
- Balk, S. D. Calcium as a regulator of the proliferation of normal, but not of transformed, chicken fibroblasts in a plasma-containing medium. Proceedings of the National Academy of Sciences. 68 (2), 271-275 (1971).
- Gail, M. H., Boone, C. W., Thompson, C. S. A calcium requirement for fibroblast motility and prolifertion. Experimental Cell Research. 79 (2), 386-390 (1973).
- Dulbecco, R., Elkington, J. Induction of growth in resting fibroblastic cell cultures by Ca. Proceedings of the National Academy of Sciences. 72 (4), 1584-1588 (1975).
- van Wetering, S., et al. Epithelial differentiation is a determinant in the production of eotaxin-2 and -3 by bronchial epithelial cells in response to IL-4 and IL-13. Molecular Immunology. 44 (5), 803-811 (2007).
- Amatngalim, G. D., et al. Aberrant epithelial differentiation by cigarette smoke dysregulates respiratory host defence. The European Respiratory Journal. 51 (4), 1701009 (2018).
- Christie, V. B., et al. Retinoid supplementation of differentiating human neural progenitors and embryonic stem cells leads to enhanced neurogenesis in vitro. Journal of Neuroscience Methods. 193 (2), 239-245 (2010).
- Schrumpf, J. A., Ninaber, D. K., vander Does, A. M., Hiemstra, P. S. TGF-β1 impairs vitamin D-induced and constitutive airway epithelial host defense mechanisms. Journal of Innate Immunity. 12 (1), 74-89 (2020).
- Schrumpf, J. A., et al. Proinflammatory cytokines impair vitamin D-induced host defense in cultured airway epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (6), 749-761 (2017).
- Boei, J. J. W. A., et al. Xenobiotic metabolism in differentiated human bronchial epithelial cells. Archives of Toxicology. 91 (5), 2093-2105 (2017).
- Wang, Y., et al. Impact of human airway epithelial cellular composition on SARS-CoV-2 infection biology. bioRxiv. , (2021).
- Nawroth, J. C., et al. Breathing on Chip: Dynamic flow and stretch tune cellular composition and accelerate mucociliary maturation of airway epithelium in vitro. bioRxiv. , (2022).
- Horani, A., Nath, A., Wasserman, M. G., Huang, T., Brody, S. L. Rho-associated protein kinase inhibition enhances airway epithelial Basal-cell proliferation and lentivirus transduction. American Journal of Respiratory Cell and Molecular Biology. 49 (3), 341-347 (2013).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Eenjes, E., et al. Disease modeling following organoid-based expansion of airway epithelial cells. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (4), L775-L786 (2021).
- Butler, C. R., et al. Rapid expansion of human epithelial stem cells suitable for airway tissue engineering. American Journal of Respiratory and Critical Care Medicine. 194 (2), 156-168 (2016).
- Amatngalim, G. D., et al. Antibacterial defense of human airway epithelial cells from chronic obstructive pulmonary disease patients induced by acute exposure to nontypeable Haemophilus influenzae: modulation by cigarette smoke. Journal of Innate Immunity. 9 (4), 359-374 (2017).
- Plebani, R., et al. 3D lung tissue models for studies on SARS-CoV-2 pathophysiology and therapeutics. International Journal of Molecular Sciences. 23 (17), 10071 (2022).
- Wong, A. P., et al. Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein. Nature Biotechnology. 30 (9), 876-882 (2012).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Biology. 107, 183-206 (2005).
- Cao, J., Wong, C. K., Yin, Y., Lam, C. W. K. Activation of human bronchial epithelial cells by inflammatory cytokines IL-27 and TNF-alpha: implications for immunopathophysiology of airway inflammation. The Journal of Cellular Physiology. 223 (3), 788-797 (2010).
- Tsao, P. N., et al. Notch signaling controls the balance of ciliated and secretory cell fates in developing airways. Development. 136 (13), 2297-2307 (2009).
- Laoukili, J., et al. IL-13 alters mucociliary differentiation and ciliary beating of human respiratory epithelial cells. The Journal of Clinical Investigation. 108 (12), 1817-1824 (2001).
- Mertens, T. C. J., et al. Cigarette smoke differentially affects IL-13-induced gene expression in human airway epithelial cells. Physiological Reports. 5 (13), e13347 (2017).
- Zarcone, M. C., et al. Effect of diesel exhaust generated by a city bus engine on stress responses and innate immunity in primary bronchial epithelial cell cultures. Toxicology in Vitro. 48, 221-231 (2018).
- vander Does, A. M., et al. Early transcriptional responses of bronchial epithelial cells to whole cigarette smoke mirror those of in-vivo exposed human bronchial mucosa. Respiratory Research. 23 (1), 227 (2022).
- Wang, Y., Ninaber, D. K., van Schadewijk, A., Hiemstra, P. S. Tiotropium and fluticasone inhibit rhinovirus-induced mucin production via multiple mechanisms in differentiated airway epithelial cells. Frontiers in Cellular and Infection Microbiology. 10, 278 (2020).
- Ronaghan, N. J., et al. M1-like, but not M0- or M2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), 0276013 (2022).
- Gindele, J. A., et al. Opposing effects of in vitro differentiated macrophages sub-type on epithelial wound healing. PLoS One. 12 (9), e0184386 (2017).
- van Riet, S., et al. Modulation of airway epithelial innate immunity and wound repair by M(GM-CSF) and M(M-CSF) macrophages. Journal of Innate Immunity. 12 (5), 410-421 (2020).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Stucki, A. O., et al. A lung-on-a-chip array with an integrated bio-inspired respiration mechanism. Lab on a Chip. 15 (5), 1302-1310 (2015).
- Peters-Hall, J. R., et al. Long-term culture and cloning of primary human bronchial basal cells that maintain multipotent differentiation capacity and CFTR channel function. American Journal of Physiology. Lung Cellular and Molecular Physiology. 315 (2), L313-L327 (2018).
- Bartman, C. M., Stelzig, K. E., Linden, D. R., Prakash, Y. S., Chiarella, S. E. Passive siRNA transfection method for gene knockdown in air-liquid interface airway epithelial cell cultures. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), L280-L286 (2021).
- Koh, K. D., et al. Efficient RNP-directed human gene targeting reveals SPDEF is required for IL-13-induced mucostasis. American Journal of Respiratory Cell and Molecular Biology. 62 (3), 373-381 (2020).
- Bhargava, N., et al. Development of an efficient single-cell cloning and expansion strategy for genome edited induced pluripotent stem cells. Molecular Biology Reports. 49 (8), 7887-7898 (2022).
- Angelopoulou, A., Papaspyropoulos, A., Papantonis, A., Gorgoulis, V. G. CRISPR-Cas9-mediated induction of large chromosomal inversions in human bronchial epithelial cells. STAR Protocols. 3 (2), 101257 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon