Method Article
Bronşiyal Epitel Hücrelerinin Biyobankacılık için Rezeke Akciğer Dokusundan İzole Edilmesi ve İyi Diferansiye Hava-Sıvı Arayüz Kültürlerinin Oluşturulması
Bu Makalede
Özet
Burada, uzun süreli biyobankacılık için primer bronşiyal epitel hücrelerinin izolasyonu ve genişletilmesi ve hava-sıvı arayüzünde kültür yoluyla farklılaşmış epitel hücrelerinin üretilmesi için tekrarlanabilir, uygun fiyatlı ve sağlam bir yöntem sunulmaktadır.
Özet
Hava yolu epitel hücre tabakası, akciğer dokusu ile dış çevre arasındaki ilk bariyeri oluşturur ve böylece enfeksiyöz ajanlar ve hava kirleticileri de dahil olmak üzere sürekli olarak solunan maddelere maruz kalır. Hava yolu epitel tabakası çok çeşitli akut ve kronik akciğer hastalıklarında merkezi bir rol oynar ve bu epiteli hedef alan çeşitli tedaviler inhalasyon yoluyla uygulanır. Patogenezde epitelin rolünün ve tedavi için nasıl hedeflenebileceğinin anlaşılması sağlam ve temsili modeller gerektirir. İn vitro epitel kültürü modelleri giderek daha fazla kullanılmaktadır ve kontrollü bir ortamda deneyler yapmanın, hücreleri farklı uyaranlara, toksik maddelere veya enfeksiyöz ajanlara maruz bırakmanın avantajını sunmaktadır. Ölümsüzleştirilmiş veya tümör hücre hatları yerine birincil hücrelerin kullanılması, bu hücrelerin kültürde, hücre hatlarına kıyasla epitelin daha iyi bir temsili ile psödostratifiye polarize epitel hücre tabakasına farklılaşması avantajına sahiptir.
Burada, hava yolu epitel hücrelerinin akciğer dokusundan izolasyonu ve kültürü için son on yılda optimize edilmiş sağlam bir protokol sunulmaktadır. Bu prosedür, hava-sıvı arayüzünde (ALI) kültürlenerek primer bronşiyal epitel hücrelerinin (PBEC'ler) başarılı bir şekilde izole edilmesine, genişlemesine, kültürüne ve mukosiliyer farklılaşmasına izin verir ve biyobankacılık için bir protokol içerir. Ayrıca, bu kültürlerin hücreye özgü belirteç genleri kullanılarak karakterizasyonu tanımlanmıştır. Bu ALI-PBEC kültürleri, tüm sigara dumanına veya enflamatuar mediatörlere maruz kalma ve virüs veya bakterilerle ko-kültür / enfeksiyon dahil olmak üzere bir dizi uygulama için kullanılabilir.
Bu makalede verilen ve prosedürü adım adım gösteren protokolün, bu tür kültür sistemlerini laboratuvarlarında uygulamak veya uyarlamak isteyenler için bir temel ve / veya referans sağlaması beklenmektedir.
Giriş
Hava yolu epitelinin çeşitli akut ve kronik akciğer hastalıklarındaki rolü çeşitli derlemelerde tanımlanmıştır 1,2,3,4,5,6,7. Hava yolu epitel hücrelerinin iyi farklılaşmış kültürleri, hava yolu epitelinin rolünü çözmek için önemli bir araçtır. Hava-sıvı arayüzü (ALI) hava yolu epitel hücre kültürü, hava yolu bazal epitel hücrelerinin farklılaşmasını teşvik etmek ve böylece hava yolu epitelini in vitro 8,9 güvenilir bir şekilde incelemek için geniş çapta uygulanır. Geçtiğimiz yıllarda, COVID-19 pandemisi ile ilgili yeni araştırma girişimleri ve dünya çapında hayvansız araştırmalara geçişin bir sonucu olarak bu tür modellerin kullanımı daha da artmıştır. Bu nedenle, bu model hücre hattının artan kullanımı, sağlam sonuçlar elde etmek için prosedürlerin ve deneyimlerin paylaşılması ihtiyacını vurgulamaktadır. Bu aynı zamanda araştırma grupları arasında sonuçların karşılaştırılmasına da izin verecektir. Prosedürün sağlamlığı temel özelliktir ve bu nedenle kalite kontrolüne tabi tutulması gerekir. Birkaç laboratuvar, ALI'deki birincil hava yolu epitel hücrelerini kültürlemek için protokoller geliştirmeye yatırım yapmıştır. Bu prosedürler ayrıntılı olarak paylaşıldığında zaman, çaba ve gerekli bütçe azaltılabilir. Bu ayrıntılar, örneğin, çeşitli üreticiler tarafından sağlanan hücre kültürü plastikleri ve ortamlarının seçimini içerir, çünkü bunun elde edilen kültürlerin özelliklerini etkilediği bulunmuştur10,11,12. Bu, kültür prosedürlerinin deneyimlerinin ve ayrıntılarının paylaşılmasının önemini vurgulamaktadır, çünkü bu tür içgörülerin yokluğunda, sonuçlar etkilenebilir ve / veya çeşitli laboratuvarlardaki doğrulama çabaları engellenebilir.
İnsan akciğer epiteli, bazal hücreler, siliye hücreler, kadeh hücreleri ve kulüp hücreleri gibi ana tipler de dahil olmak üzere çeşitli hücre tiplerini içerir. Epitel hücre tabakasını in vitro hava yollarında güvenilir bir şekilde taklit etmek için, bu hücre tiplerinin kültür modellerinde temsil edilmesi ve polarizasyonlarının ve işlevlerinin 13,14,15,16 olarak korunması gerekir. Donör özelliklerinin (hastalık durumu dahil) ve hücrelerin anatomik kökeninin (yani nazal, trakeal, büyük ve küçük hava yolları) hücre kültürünün hücresel kompozisyonunu ve fonksiyonel yanıtlarını etkileyebileceğinin anlaşılması da aynı derecede önemlidir. İlgili uzmanlık ve uygulama, primer hava yolu epitel hücrelerini başarılı bir şekilde kültürlemek ve kültürün kalitesini hem sezgisel olarak (kültür sırasında görsel muayene yoluyla) hem de nicel olarak değerlendirmek için bir ön koşuldur. Bu katkının amacı, trakeal ve küçük hava yolu epitel hücrelerinin kültürüne de uygulanabilen primer insan bronşiyal epitel hücrelerinin (PBEC'ler) izolasyonu ve kültürü için maliyet ve zaman açısından etkili bir yöntem sağlamaktır. Bu tür hücrelerin rezeke edilmiş akciğer dokusundan izole edilmesine yönelik bir yöntemin tanımlanmasına ek olarak, genişleme ve biyobankacılık için bir yöntem ve son olarak makul bir maliyet ve zaman dilimi içinde iyi farklılaşmış bir ALI kültürünün kurulması ve karakterizasyonu için bir yöntem sunulmakta ve tartışılmaktadır.
Protokol
Hücreler, Hollanda'daki Leiden Üniversitesi Tıp Merkezi'nde akciğer kanseri nedeniyle rezeksiyon ameliyatı geçiren hastalardan elde edilen makroskopik olarak normal akciğer dokusundan izole edildi. Bu akciğer dokusunun türetildiği hastalar, bu dokunun kodlanmış anonim olarak daha fazla kullanılması için itirazsız bir sistem aracılığıyla biyobankaya kaydedildi (www.coreon.org). Bununla birlikte, 01-09-2022 tarihinden itibaren hastalar, kurumsal tıbbi etik kurul (B20.042/Ab/ab ve B20.042/Kb/kb) onayı ile LUMC biyobankasının yerel düzenlemelerine uygun olarak aktif bilgilendirilmiş onam kullanılarak biyobankaya kaydedilmiştir.
NOT: Tüm prosedürler, aksi belirtilmedikçe, biyolojik bir güvenlik kabininde, yerel biyolojik güvenlik kurallarına göre ve cerrahi eldiven ve laboratuvar önlüğü giyerken steril çalışma koşulları altında gerçekleştirilir. Protokolde kullanılan tüm medya, reaktifler ve diğer çözümler için lütfen Malzeme Tablosu ve Ek Tablo 1'e bakın. Ayrıntılı protokol adımları için lütfen Şekil 1'e bakın
1. Bronşiyal epitel hücrelerinin insan akciğer dokusundan izolasyonu
NOT: Bronşiyal epitel hücre izolasyonu için optimal bir başarı oranı elde etmek için, eksize edilen bronşiyal halka, Primosin eklenmiş fosfat tamponlu salin (PBS) içinde maksimum 24 saat boyunca 4 ° C'de suya batırılmış halde tutulmalıdır.
- Prosedürün başlamasından önceki hazırlıklar
- Ek Tablo 1'de açıklandığı gibi PBS'de bir kaplama çözeltisi hazırlayın ve kuyu başına 1,5 mL kaplama çözeltisi ile uygun sayıda 6 delikli plakayı kaplayın. Bir hücre kültürü inkübatöründe 37 ° C'de ve% 5 CO 2'de2 saat inkübe edin.
NOT: Kaplanacak kuyucuk sayısı, eksize edilen dokunun boyutuna bağlıdır. Kaba bir kılavuz olarak, eksize edilen bronşiyal halka 10 mm çapında ve 4 mm genişliğinde olduğunda dört adet 6 delikli plaka kaplanır. - Ek Tablo 1'de açıklandığı gibi komple keratinosit serumsuz ortam (c-KSFM) hazırlayın; 6 delikli bir plakanın kuyucuğu başına 2 mL ortam kullanın.
NOT: Bu c-KSFM, 7 gün boyunca 4 °C'de saklanabilir. c-KSFM, kirletici fibroblastların büyümesini inhibe ederken hava yolu epitel hücrelerinin genişlemesi için kullanılan düşük kalsiyumlu bir ortamdır.
- Ek Tablo 1'de açıklandığı gibi PBS'de bir kaplama çözeltisi hazırlayın ve kuyu başına 1,5 mL kaplama çözeltisi ile uygun sayıda 6 delikli plakayı kaplayın. Bir hücre kültürü inkübatöründe 37 ° C'de ve% 5 CO 2'de2 saat inkübe edin.
- Halkayı 10 cm'lik bir Petri kabında 10 mL steril PBS içinde nazikçe durulayarak bronşiyal halkayı temizleyin. Halkayı dikkatlice tutmak için cımbız kullanın (sadece dışarıya dokunun) ve fazla bağ dokusunu ve kan kalıntılarını çıkarmak için küçük makas kullanın. Daha fazla işlem için, halkayı ikiye bölün.
NOT: İşlemde kullanılan tüm aletler kullanılmadan önce sterilize edilmelidir. - Bronşiyal halkanın iki yarısını, kapalı bir steril kapta Primosin de dahil olmak üzere Hank'in dengeli tuz çözeltisinde (HBSS) önceden ısıtılmış bir proteaz XIV (1.8 mg / mL) çözeltisinin 10 mL'sine batırın ve bir hücre kültürü inkübatöründe 37 ° C'de tam olarak 2 saat inkübe edin.
NOT: HBSS, 2 saatlik bir inkübasyon süresi boyunca hücreleri dokudan ayırmak için proteaz XIV için bir seyreltici olarak kullanılır. HBSS, kısa süreli inkübasyonlar sırasında hücre canlılığının korunmasını sağlayan dengeli bir izotonik çözümdür. - İnkübasyondan sonra, doku parçalarını 10 mL ılık PBS içeren bir Petri kabına aktarın ve bir hücre çözeltisi elde etmek için bükülmüş cımbız kullanarak halkanın içini kazıyın.
NOT: Doku daha yumuşak ve biraz genişlemiş görünür. - Halkayı atın, hücre çözeltisini 50 mL'lik bir tüpe aktarın ve 50 mL'lik son bir hacim elde etmek için ılık PBS ekleyin. 230 x g'de ve oda sıcaklığında (RT) 7 dakika boyunca santrifüj.
- Süpernatantı aspire edin ve peletleri 10 mL sıcak PBS'de yeniden askıya alın. Ayrıca, sıcak PBS ile 50 mL'ye kadar ses seviyesini yükseltin. RT'de 230 x g'de 7 dakika boyunca santrifüj.
- Süpernatantı aspire edin ve hücre peletini Primosin içeren uygun miktarda sıcak c-KSFM içinde yeniden askıya alın.
NOT: Primosin, dokuda bulunabilecek herhangi bir bakteri, mantar veya (daha da önemlisi) mikoplazmayı ortadan kaldırmak için en az 7 gün boyunca kullanılır; 7 gün sonra, ortama sadece penisilin / streptomisin ilavesi yeterlidir. - Kaplama çözeltisini 6 delikli plakalardan aspire edin ve kuyucuk başına 2 mL hücre süspansiyonu ekleyin.
- Hücrelerin% 80 ila% 90 akıcılığa ulaşana kadar büyümesine izin verin ve ortamı haftada üç kez değiştirin (örneğin, her Pazartesi, Çarşamba ve Cuma). İstenilen akıcılık derecesine genellikle 7 ila 14 gün arasında ulaşılır; İstenilen akıcılığa ulaşmak için gereken süre 14 günü aşarsa, hücreleri atın.
NOT: İlk birkaç günde, sadece az sayıda hücre çoğalmaya başlar; hücre grupları birkaç gün sonra fark edilir.
2. İnsan primer bronşiyal epitel hücrelerinin (PBEC'ler) kriyoprezervasyonu
NOT: -80 °C ve -196 °C sıcaklıklarda çalışırken, koruma için kriyo-eldivenler kullanılır ve dondurulmuş şişeleri aktarmak için cımbız kullanılır. Sıvı azotla çalışırken, kişisel koruma için kriyo-eldivenler ve bir yüz kalkanı kullanılır.
- Ortamı aspire edin ve kuyucukları bir kez kuyucuk başına 2 mL ılık PBS ile yıkayın.
- Kuyu başına 0.5 mL yumuşak tripsin ekleyerek hücreleri tripsin yapın (yumuşak tripsin çözeltisinin bileşimi için Ek Tablo 1'e bakınız). Hücreleri 37 ° C'de 5 ila maksimum 10 dakika boyunca inkübe edin. Tripsin çözeltisini plakada döndürün ve plakaya hafifçe dokunarak hücreleri serbest bırakın.
- Ayrılmış hücreleri, penisilin / streptomisin ile KSFM'de çözünmüş 1.1 mg / mL soya fasulyesi tripsin inhibitörü (SBTI; tripsin aktivitesini inhibe etmek için) içeren 50 mL'lik bir santrifüj tüpüne aktarın. SBTI'nin hacmi, toplam yumuşak tripsin hacminin iki katı olmalıdır (yani, kuyucuk başına 1 mL).
NOT: SBTI'yi doğrudan kuyucuklara eklemeyin, çünkü hücreler dakikalar içinde yeniden bağlanacaktır. - RT'de 230 x g'de tüpü 7 dakika boyunca santrifüjleyin.
- Süpernatantı atın ve peletlenmiş hücreleri penisilin / streptomisin içeren ancak başka hiçbir katkı maddesi içermeyen 10 mL RT KSFM'de yeniden askıya alın. Bir hemositometre veya otomatik hücre sayacı kullanarak hücreleri sayın. 1: 1 oranında tripan mavisi ekleyerek canlı/ölü hücre sayımı gerçekleştirin veya alternatif bir canlı/ölü hücre sayma prosedürü kullanın.
- Kriyoproteksiyon hücrelerini mL dondurma ortamı başına 400.000 hücre konsantrasyonunda koruyun (bileşim için Ek Tablo 1'e bakın) ve kriyoviyal başına bu süspansiyonun 1 mL'sini ekleyin. Kriyovyalleri bir soğutma hücresi kabına aktarın ve -80 ° C'ye yerleştirin. 24 saat sonra, şişeleri uzun süreli depolama için -196 ° C sıvı azota aktarın.
NOT: Hücreleri dondurma ortamına aktarmak için iki seçenek mümkündür, her ikisi de iyi çalışır: 1) Hücreleri santrifüjleme yoluyla tekrar pelet haline getirin ve gerekli hücre konsantrasyonunda soğuk dondurma ortamında tekrar askıya alın; veya 2) soğuk dondurma ortamı ekleyin ve hücrelerin bulunduğu KSFM hacmine bağlı olarak kriyopreservin (dimetil sülfoksit [DMSO]) konsantrasyonunu ayarlayın.
3. Kriyo-korunmuş PBEC'lerin çözülmesi ve kesici uçlarda kültür için büyütülmesi
- Bir T75 hücre kültürü şişesini, kapakları sıkıca kapatılmış olarak PBS'de 10 mL kaplama çözeltisi ile gece boyunca kaplayın. Şişeyi bir hücre kültürü inkübatöründe 37 ° C'de ve% 5 CO2'de inkübe edin.
- Kriyokorunmuş PBEC'leri çözmeden önce, kaplama çözeltisini şişeden çıkarın ve 10 mL c-KSFM ile doldurun. Bir hücre kültürü inkübatöründe 37 ° C'ye kadar ısınmasına izin verin, inkübatörün havalanmasını sağlamak için hafifçe açılmış kapakları vardır.
- Hücreleri 37 ° C'lik bir su veya boncuk banyosunda hızla çözün.
NOT: Daha düşük kontaminasyon riski ve daha düşük enerji tüketimi nedeniyle boncuk banyosu su banyosu yerine tercih edilir. - Kriyoviyalin tüm içeriğini önceden ısıtılmış T75 şişesine orta (adım 3.2) ile ekleyin ve hücreleri eşit olarak dağıtın.
NOT: Bu aşamada hücreleri santrifüj yapmayın, çünkü santrifüjleme adımında hayatta kalamazlar. - Yaklaşık 4 saat sonra, hücrelerin yeterince bağlandığından emin olun. Ortamı 10 mL taze, ılık c-KSFM ile değiştirin.
NOT: Bu şekilde, dondurucu ortamdaki DMSO çıkarılır. Bu adım, şişedeki hücrelerin tohumlanmasından sonra 4 saat ile 24 saat arasında gerçekleşmelidir. - Hücreleri% 80 ila% 90 akıcılığa ulaşana kadar büyütün, ortamı her pazartesi, çarşamba ve cuma günleri değiştirin.
4. Primer bronşiyal epitel hücreleri (ALI-PBEC) ile hava-sıvı arayüz kültürünün oluşturulması
NOT: Aşağıdaki prosedür, 11,9 mm iç çaplı kesici uçlardaki PBEC'lerin kültürü içindir.
- Uygun sayıda hücre kültürü kesici ucunu, kesici uç başına 0,4 mL kaplama çözeltisi ile kaplayın. Bir hücre kültürü inkübatöründe 37 ° C'de gece boyunca inkübe edin.
- Ek Tablo 1'de açıklandığı gibi komple BD ortamını (cBD ortamı) hazırlayın.
NOT: cBD besiyeri, bronşiyal epitel hücrelerinin büyümesini daha uzun süre desteklemek için formüle edilmiş kompozit bir ortamdır (Ek Tablo 1'e bakınız), aynı zamanda adım 4.10'da belirtildiği gibi, ALI'deki retinoik asit (RA) konsantrasyonunda ve kültüründe bir artışı takiben farklılaşmalarına izin verir. - Şişe başına 2 mL yumuşak tripsin kullanarak T75 şişesindeki PBEC'leri deneyin. Hücrelerin ayrılmasına izin vermek için hücreleri 5 ila 10 dakika boyunca inkübe edin (görsel incelemeye dayanarak). 5 dakikalık inkübasyondan sonra, tripsini şişede döndürerek ve şişeye hafifçe dokunarak hücrelerin ayrılmasını kolaylaştırın (gerekirse tekrarlayın).
- Şişeye 4 mL SBTI ekleyin ve hücre süspansiyonunu doğrudan 25 mL'lik bir santrifüj tüpüne aktarın.
NOT: Hücreler dakikalar içinde yeniden eklenir. Bu nedenle, birden fazla şişe ile çalışırken, adım 4.4'te elde edilen hücre süspansiyonu, SBTI'yi ikinci bir şişeye eklemeden önce doğrudan bir santrifüj tüpüne aktarılmalıdır. Prosedürde, aynı anda en fazla beş şişe işlenir. - Tüpleri RT'de 230 x g'de 7 dakika boyunca santrifüjleyin.
- Hücreleri 6 mL cBD ortamında yeniden askıya alın ve bir hemositometre veya otomatik hücre sayacı kullanarak hücreleri sayın. Örneğin, 1:1 oranında tripan mavisi ekleyerek veya başka bir canlı/ölü hücre sayma prosedürü kullanarak canlı/ölü hücre sayımı gerçekleştirin.
- Kaplama çözeltisini hücre kültürü eklerinden çıkarın.
- Adım 4.6'da üretilen hücre süspansiyonunu, 1 nM EC 23 ile takviye edilmiş cBD ortamı ile mL başına 80.000 hücre konsantrasyonuna kadar seyreltin ve kesici uçtaki membranın üstüne 0,5 mL ekleyin. Kesici ucun altındaki kuyucuğa 1 nM EC 23 ile desteklenmiş 1,5 mL cBD ortamı ekleyin.
- Kültürler havaya maruz kalmaya hazır olana kadar (yani,% 100 akıcılığa ulaşıldıktan 2 gün sonra) haftada üç kez 1 nM EC 23 ile desteklenmiş cBD ortamı ile ortamı değiştirin. Her seferinde, kesici ucun içine (hücreler üzerinde) 0,5 mL ortam eklenir ve alt bölmeye (kuyu) 1,5 mL eklenir.
NOT: Genel olarak, hücre katmanı, PBEC'lerin ekler üzerine tohumlanmasından yaklaşık 5 gün sonra% 100 akıcılığa ulaşır. Hücrelerin akıcılığının görsel incelemesine dayanarak, hücrelerin 2 gün sonra ALI aşamasına aktarılmasına karar verilir. - Hücreler ALI'ye transfer için hazır olduğunda (yani,% 100 akıcılığa ulaştıktan 2 gün sonra), ortamı eklerden ve kuyudan çıkarın, kesici ucun içine yeni ortam eklemeyin ve yalnızca kuyuya yeni ortam (50 nM EC 23 ile desteklenmiş 1 mL cBD ortamı) ekleyin. Kuyulardaki ortamı haftada üç kez değiştirin.
- Fazla mukus ve hücresel kalıntıları gidermek için, kesici ucun içindeki hücre tabakasının apikal tarafına yavaşça 200 μL ılık PBS ekleyin (tercihen kesici ucun yan tarafından ve doğrudan hücrelere pipetleme yaparak değil) ve 37 ° C'de bir hücre kültürü inkübatöründe 10 dakika boyunca inkübe edin. Ardından, aşırı mukus ve hücresel kalıntıları gidermek için PBS'yi aspire edin.
NOT: Bu noktadan itibaren (ALI kültürünün başlangıcı), alt bölmenin ortamını değiştirmeden önce, hücrelerin apikal tarafını her seferinde PBS ile yıkayın. - Tüm ana hücre tiplerinin temsil edildiğinden emin olmak için ALI'deki hücreleri en az 2 hafta boyunca kültürleyin.
5. Karışık bir donör popülasyonundan bir ALI-PBEC kültürü oluşturmak
- PBEC kültürlerini karışık bir popülasyondan başlatmak için beş adede kadar bireysel donörden alınan hücreleri kullanın.
- Uç başına toplam 150.000 hücreye ulaşmak için adım 4.7'de üretilen hücreleri kullanarak donör başına eşit sayıda hücreyi karıştırın (yani, beş donör kullanırken donör başına 30.000 hücre). Bu, ekteki proliferasyonun minimumda tutulmasını ve kültürde bireysel donörlerden eşit sayıda hücrenin bulunmasını sağlayacaktır.
- ALI-PBEC kültürüne adım 4.9-4.12'de açıklandığı şekilde devam edin.
6. ALI-PBEC kültürünün kalite kontrolü
- Hücre kültürü sırasında trans epitelyal elektrik direncinin (TEER) izlenmesi
NOT: Bir voltohmmetre kullanımına dayanan elektriksel direnç ölçümü, ALI-PBEC kültürü sırasında herhangi bir zamanda gerçekleştirilebilir ve elektriksel direnç ölçümü elektrot konumu, sıcaklık, ortam ve kullanım dahil olmak üzere çeşitli değişkenlerden etkilendiğinden, her seferinde aynı koşullar altında aynı protokole göre gerçekleştirilir. TEER, Ohm yasasına dayanan aşağıdaki formülü uygulayarak ölçülen elektrik direnci kullanılarak hesaplanabilir:burada Rm, ölçülen elektrik direncidir, Rb,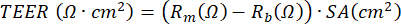 kaplama ve hücreler içermeyen bir kesici ucun temel elektrik direncidir ve SA, kesici uç17'nin zarının yüzey alanıdır.
kaplama ve hücreler içermeyen bir kesici ucun temel elektrik direncidir ve SA, kesici uç17'nin zarının yüzey alanıdır.- Hücrelerdeki mukus ve kalıntıları gidermek için hücre tabakasının apikal tarafına yavaşça 200 μL ılık PBS ekleyin. Kesici ucu 37 °C'de bir hücre kültürü inkübatöründe 10 dakika boyunca inkübe edin ve PBS'yi tekrar çıkarın.
- Hücre tabakasının apikal tarafına yavaşça 700 μL sıcak PBS ekleyin ve ölçümler için sıcaklığın dengelenmesini sağlamak için kesici ucu RT'de 10 dakika boyunca inkübe edin.
- 1.000 Ω test direncini kullanarak voltohmetreyi kalibre edin, voltohmetreyi Ohm'ları ölçecek şekilde ayarlayın ve "R ADJ" kalibrasyon vidasını 1.000 Ω'ye ayarlanana kadar ayarlamak için bir tornavida kullanın.
- Elektrodu steril suda (RT) ve ardından steril PBS'de (RT) birkaç kez yukarı ve aşağı hareket ettirerek durulayın.
- Eklerdeki hücre tabakasının elektriksel direncini ölçün. Bu amaçla, elektrotun uzun kolu plakanın dibine temas edecek şekilde elektrodu kuyuya dikey bir konuma yerleştirin. Bu şekilde, kısa kol kesici ucun içindeki hücre tabakasının üzerindedir. Voltohmmetrede görüntülenen değeri okuyun.
NOT: Görüntülenen değer tam olarak stabilize olmaz; Değer aralıklı olduğu anda değeri okuyun. - Ölçümler arasında, elektrodu steril PBS'de (RT) birkaç kez yukarı ve aşağı hareket ettirerek temizleyin.
- Ölçümler bittiğinde elektrodu steril su (RT), steril PBS (RT) ve% 70 etanol (RT) içinde birkaç kez yukarı ve aşağı hareket ettirerek temizleyin. Elektrodu kuru saklayın.
- Kesici ucun içine 700 μL sıcak PBS ve kuyuya 1 mL sıcak PBS ekleyerek ve diğer kesici uçların yanında elektrik direncini ölçerek bir kesici uç (kaplamasız) ve hücrelerin taban çizgisi ölçümünü gerçekleştirin.
- ALI-PBEC kültürünün hücresel bileşiminin değerlendirilmesi
- ALI aşamasında, dayak kirpiklerini görsel olarak değerlendirerek farklılaşmayı kontrol edin. Bunlar, hücrelerin apikal tarafında havaya maruz kaldıktan 9 gün sonra standart parlak alan mikroskobu ile gözlemlenebilir.
NOT: Dövülen kirpikler en iyi apikal yüzeyi yıkadıktan hemen sonra görülebilir. Kadeh hücreleri mukus üretir ve bu nedenle apikal yüzeyin yıkanması sırasında gözlenen mukus varlığı, kadeh hücrelerinin oluştuğunun bir işaretidir. Bununla birlikte, kadeh hücrelerinin seviyesi ve üretilen mukus miktarı oldukça donöre bağımlıdır. Mukus varlığı, hücre tabakasının apikal yüzeyini kesici uçta yıkadıktan sonra PBS'yi aspire ederken görülebilir; Bu durumda, aspire edilen PBS daha viskozdur ve aspire ederken mukus iplikleri gözlenebilir. - İmmün boyamalar ve floresan mikroskobu veya floresan ile aktive hücre sıralama (FACS) kullanılarak hücresel bileşimin değerlendirilmesi veya gerçek zamanlı-kantitatif polimeraz zincir reaksiyonu (RT-qPCR) ile gen ekspresyon analizi, kültürün farklılaşma durumu hakkında önemli bilgiler sağlar, ancak tanımı bu katkının kapsamı dışındadır.
- ALI aşamasında, dayak kirpiklerini görsel olarak değerlendirerek farklılaşmayı kontrol edin. Bunlar, hücrelerin apikal tarafında havaya maruz kaldıktan 9 gün sonra standart parlak alan mikroskobu ile gözlemlenebilir.
Şekil 1: Primer bronşiyal epitel hücrelerinin izolasyonu, genişlemesi ve kültür prosedürüne şematik genel bakış . (A) Kanser rezeksiyon cerrahisi sırasında akciğer dokusu elde edilir ve patolog makroskopik olarak normal ve tümörsüz olan bronşiyal halka dokusunu uyarır. (B) Bronşiyal halka temizlenir ve hücre tabakasını ayırmak ve ayrıştırmak için enzimatik tedaviye maruz bırakılır. (C) Alınan hücre süspansiyonu yıkanır ve hücreler genişleme için 6 delikli bir plakanın kuyucuklarına dağıtılır. (D) c-KSFM'de izole edilmiş hücrelerin Primosin ile yeterli genişlemesi üzerine, hücre katmanları tripsinizasyon ile ayrıştırılır ve hücreler kriyoprezervasyon için dondurucu ortamda yeniden askıya alınır. Gerektiğinde, kriyokorunmuş hücreler çözülür ve hücre kültürü şişelerinde penisilin / streptomisin ile c-KSFM kullanılarak tekrar genişletilir. Genişlemeden sonra, hücre kültürü ekleri üzerinde cBD ortamında tohumlanırlar; (Ea) ALI-PBEC kültürü iki ana aşamada gerçekleşir: cBD ortamındaki batık aşama, hücreler tam birleşmeye ulaşana kadar 1 nM EC 23 ile desteklenir, ardından farklılaşmaya izin vermek için ALI'de apikal ortamın ve kültürün çıkarılması; Bu ALI fazında, hücreler 50 nM EC 23 ile desteklenmiş cBD ortamında kültürlenir. (EB) Batık kültür sırasında kesici ucu kaplayan bazal hücrelerin grafiksel gösterimi. (EC) EC 23'ün artmış konsantrasyonlarının varlığında ALI'de kültürü takiben elde edilen farklılaşmış epitel hücre tabakasının grafiksel gösterimi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Sonuçlar
Batık kültürü kullanarak genişletme
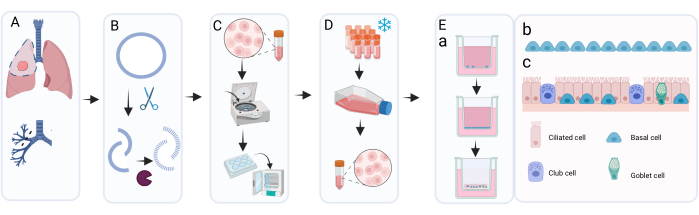
Burada sunulan yöntemi kullanarak, sıvı azotta uzun süreli depolama için bir 6 delikli plakadan 400.000 hücre/kriyoviyal içeren ortalama sekiz kriyoyal elde edilebilir (Şekil 2A). Bunu başarmak için, izole PBEC'ler, mikrobiyal (özellikle mikoplazma) kontaminasyonu dışlamak için Primosin varlığında en az 7 gün ve en fazla 14 gün boyunca 6 kuyucuklu plakalarda kültürlenir (Şekil 2B). Şekil 2A, B, çeşitli donörlerden farklı izolasyonlar arasında elde edilen hücre sayıları ve gerekli kültür süresi hakkında fikir vermektedir. Hücreleri sıvı azotta depolanmak üzere tripsinizasyon yoluyla toplamadan önce, akıcılık% 80'in üzerinde olmalıdır. Bu 14 gün içinde sağlanamazsa, hücreler kriyoprezerve edilmemelidir. Önemli olarak, depolama ve geçiş için hasat yaparken, hücre tabakasının akıcılığı ~% 95'i geçmemelidir (Şekil 2C). Sıvı azotta depolandıktan sonra, hücreler ALI kültürleri için yeterli hücre sayısı elde edilene kadar genişleme için çözülebilir ve kültürlenebilir. Bu aşamada hücrelerin genişlemesi için kullanılan ortam, bronşiyal halka18'den hasadı takip eden ilk kültürde olduğu gibi c-KSFM'dir. Bununla birlikte, bu aşamada Primosin'e gerek yoktur, çünkü akciğer dokusundan kaynaklanan ek mikrobiyal kontaminasyon riski yoktur ve bu nedenle Primosin, penisilin / streptomisin için değiştirilebilir. Bu ortam, epitel hücrelerini fibroblastlara göre tercih eder ve bu nedenle fibroblastları daha hızlı çoğaltarak kültürün olası aşırı büyümesini önler 19,20,21. c-KSFM ortamı kullanılarak, hücreler şişeye yayılır ve birbirlerine bağlanmaz, bu da bu aşamada cBD ortamına batırılmış kültürlenmiş hücrelerin morfolojisinden belirgin şekilde farklıdır (Şekil 2D, E). Çözülmüş hücrelerin bir T75 şişesinde kültürlenmesinden 5 veya 6 gün sonra, hücre tabakası% 80 -% 95 oranında birleşik olmalıdır, bu da toplamda yaklaşık 3 x 106 hücreye karşılık gelir (Şekil 2F). Bundan, ALI kültürü için yaklaşık 75 kesici uç (12 delikli plaka boyutu) üretilebilir.
Bu katkıda açıklanan izolasyon ve kültür yöntemi, başlangıç materyali olarak bronşiyal biyopsiler veya bronşiyal fırçalarla kullanılmak üzere de uyarlanabilir.
Şekil 2: Kriyoprezervasyon öncesi ve sonrası bazal hücre genişlemesi. Hücreler tarif edilen protokole göre izole edildi ve c-KSFM kullanılarak kültürlendi. Donör başına üretilen hücre sayısı izlendi, canlı hücre sayımları otomatik bir hücre sayacı kullanılarak gerçekleştirildi (A) 6 kuyucuklu plakalardan geçiş 0 (P0) hücrelerini toplarken (protokolün 2. adımı), n = 123 donör, hücre sayısı kuyu başına toplanan hücre sayısı olarak sunuldu; Her nokta bir donörü temsil eder ve medyan yatay bir çubukla gösterilir. (B) Kalite kontrolün bir parçası olarak, P0 hücrelerinin 6 kuyucuklu plakalarda %80 ila %90 akıcılığa ulaşması gereken süre izlendi ve c-KSFM'de (n = 127 farklı donör) batık kültüre başladıktan sonraki günler olarak gösterildi. Her bir donör bir nokta ile gösterilir, 1 güne ait tüm noktalar bir çizgide birleşir; çizgi ne kadar geniş olursa, o kadar çok bağışçıyı temsil eder; Hücrelerin kültürde bulunduğu medyan gün sayısı, daha ince bir yatay çubukla gösterilir. (C) Hücrelerin uzun süreli kriyoprezervasyon için toplandığı anda c-KSFM'ye batırılmış olarak yetiştirilen P0 hücrelerinin temsili parlak alan görüntüsü. (D) Hücrelerin toplandığı ve eklere aktarıldığı anda c-KSFM'ye batırılmış olarak yetiştirilen P1 hücrelerinin temsili parlak alan görüntüsü ve (E) cBD ortamında suya batırılmış olarak yetiştirilen P1 hücreleri. (F) Donör başına üretilen canlı hücre sayısı, T75 şişesinden P1 hücreleri toplanırken otomatik bir hücre sayacı kullanılarak izlenmiştir (protokolün 4. bölümü), n = 63 farklı donör; hücre sayısı, T75 şişesi başına düşen hücre sayısı olarak sunulur, her donör bir nokta ile gösterilir ve medyan hücre sayısı yatay bir çubukla gösterilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Hava-sıvı arayüzü (ALI) kültürü
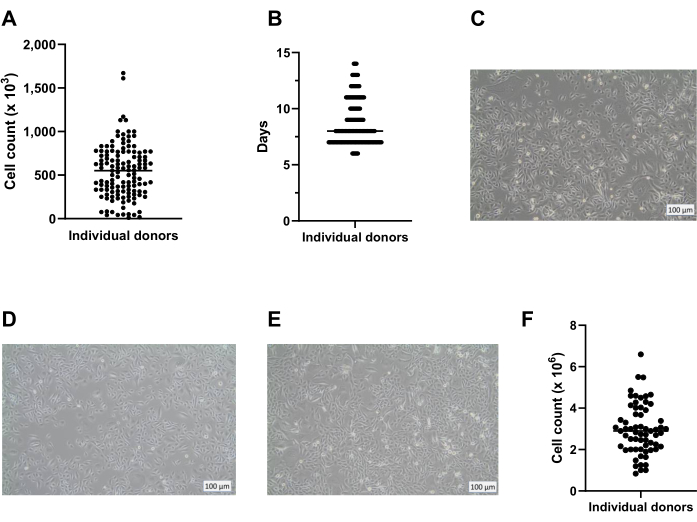
ALI kültürüne başladıktan 7 gün sonra, hücre tabakasının elektriksel direnci ölçülür ve 300 Ω'den fazla olmalıdır (Şekil 3A); Bu sağlanamazsa, kültür olası bir sıkı kavşak oluşumu eksikliği nedeniyle başarısız olarak kabul edilir. Münferit kesici uçlarda epitel tabakasının hasar görmesinin, örneğin yıkama ve aspirasyon sırasında hücre tabakasının zarar görmesinden kaynaklanan düşük TEER değerlerinin elde edilmesi olasılığının dışlanması önerilir. Bu, kültür eklerinin görsel mikroskobik incelemesi ile kontrol edilebilir. Deneyimlerimize göre, elektrik direncindeki donörler arası değişkenlik önemli olabilir (Şekil 3B), literatür14'te de bildirilmiştir ve gözlemlendiği gibi, kullanılan Dulbecco'nun modifiye kartal ortamının (DMEM) kökeninden de belirgin bir şekilde etkilenmektedir (Şekil 3C).
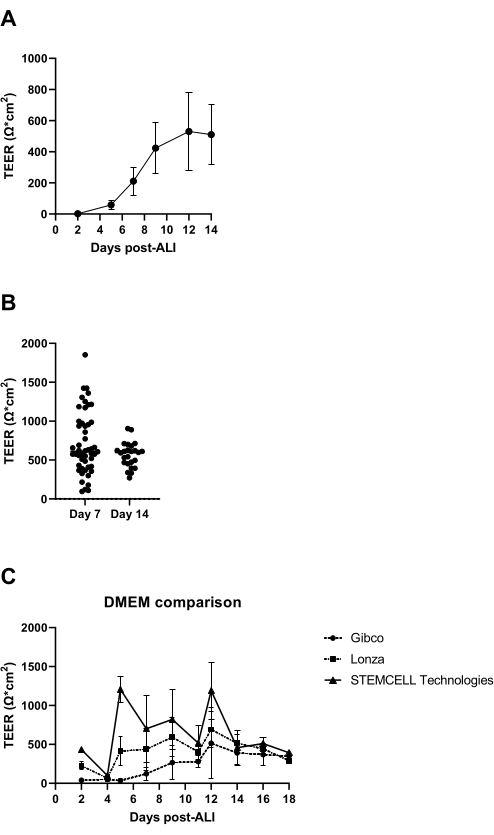
Şekil 3: ALI-PBEC kültürlerinin kalite kontrolü olarak trans-epitelyal elektrik direnci. PBEC'ler izole edildi ve genişletildi ve iyi farklılaşmış ALI-PBEC kültürleri kuruldu. Kültür sırasında birkaç zaman noktasında, elektrik direnci ölçüldü ve daha sonra TEER hesaplandı (Ω ·cm2). (A) Elektrik direnci, ALI'den sonraki 14 gün boyunca ölçülmüştür. n = 4 farklı donör. Veriler ortalama değer ± standart sapma (SD) olarak gösterilmiştir. (B) ALI-PBEK hücre kültürü kalite kontrolünün bir parçası olarak, elektrik direnci ALI sonrası 7. günde (n = 50) ve 14. günde (n = 25) ölçülmüştür; her nokta bir donörü temsil eder ve medyan TEER (Ω ·cm2) yatay bir çubukla gösterilir. Veriler, parametrik olmayan bir Mann-Whitney testi kullanılarak anlamlılık açısından test edildi ve anlamlı bir fark bulunamadı. (C) TEER oluşumu üzerindeki etkisini değerlendirmek için üç farklı DMEM tedarikçisinin medyası test edilmiştir. n = 4 farklı donör; ortalama değerler SD ± gösterilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
İyi farklılaşmış bir ALI-PBEC kültürü oluştururken, havaya maruz kalmanın başlangıcından itibaren, RA konsantrasyonu22 artar. Bu şekilde, hücreler proliferasyondan, parlak alan mikroskobu kullanılarak havaya maruz kaldıktan 9 gün sonra (donöre bağlı) görülebilen mukosiliyer farklılaşmaya geçer. İlk kirpiklerin hareketi bu noktada görülebilir ve farklılaşmış luminal hücrelerin belirteçlerinin gen ekspresyonuna dayandığında biraz daha erken görülür23 (Şekil 4).
Protokolde açıklandığı gibi, ortam değişimi sırasında apikal yüzeyi durularken mukus üretimi de gözlenebilir. RA ışığa karşı çok hassastır, bu da aynı stok konsantrasyonunda oldukça değişken aktiviteye yol açar. Bu nedenle, RA sentetik RA analoğu EC 23 ile değiştirilir ve deneysel olarak belirlenen benzer sonuçlarla aynı konsantrasyonda kullanılır. Bu nedenle ve prosedürün değişmesini önlemek için, seçilen EC 23 konsantrasyonu, daha önce24,25 kullanılan RA konsantrasyonuna (yani 50 nM) eşit tutulmuştur (Şekil 5). Şekil 5A, EC 23'ün farklı konsantrasyonları kullanıldığında elde edilen TEER değerlerini göstermektedir ve test edilen bu konsantrasyon aralığında 50 nM'de maksimum TEER'yi göstermektedir. Şekil 5B'de gösterilen sonuçlar, siliyer ve kadeh hücreleri için belirteçlerin gen ekspresyonunun 50 nM EC 23 veya RA kullanıldığında benzer olduğunu doğrulamaktadır. EC 23, daldırılmış aşamada (çok daha düşük bir konsantrasyonda olmasına rağmen) kültür sırasında da gereklidir, çünkü bu batık aşamada atlanması ve sadece ALI aşamasında eklenmesi, hiçbir zaman tam akıcılığa ulaşmayan bir kültürle sonuçlanır. Görünür siliyer dayak aktivitesi ve mukus üretimi ile iyi farklılaşmış bir ALI-PBEC kültürü oluşturmak için gereken süre yaklaşık 14 gündür ve bu nedenle deneylerin çoğu 14-21 günlük ALI kültürleri arasında başlatılmıştır (Şekil 4). Tüm ana farklı hücre tipleri (bazal, siliyer, kadeh ve kulüp hücreleri) 14 günlük ALI kültüründe gözlenir, ancak ekspresyon seviyeleri oldukça donöre bağımlıdır. Bu, TP63, FOXJ1, MUC5AC ve SCGB1A1'nin RT-qPCR ile gen ekspresyonunun değerlendirilmesi veya sırasıyla bazal, siliyer, kadeh ve kulüp hücreleri için belirteçleri tespit etmek için immün floresan (IF) boyaması ile p63, α-tübülin, Muc5AC ve CC-16'ya karşı yönlendirilen antikorlar kullanılarak protein ekspresyonu ile gösterilmiştir 25,26. Bununla birlikte, çoğu deney için 14-21 gün temel bir kural olarak kabul edilebilirken, seçilmiş deneyler için, ksenobiyotik metabolizma, SARS-CoV-2 enfeksiyonu ve mukosiliyer klirensin değerlendirilmesi 27,28,29 için daha uzun bir farklılaşma süresi düşünülebilir.
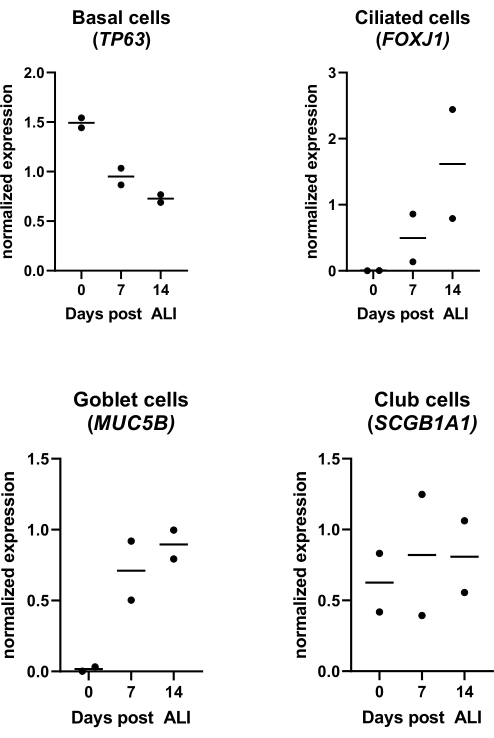
Şekil 4: Hava-sıvı arayüzü (ALI) kültürü. PBEC'ler izole edildi ve genişletildi ve iyi farklılaşmış ALI-PBEC kültürleri kuruldu. ALI-PBEC kültürleri ALI'den sonraki 14 gün boyunca izlendi. Hücre kültürleri, ALI sonrası 0, 7 ve 14. günlerde RNA'nın izolasyonu için lize edildi. İki farklı donörden gelen veriler gösterilir, her nokta zaman içinde izlenen tek bir donörü temsil eder ve medyan yatay bir çubukla gösterilir. Bazal, siliyer, kadeh ve kulüp hücre belirteçlerinin (sırasıyla TP63, FOXJ1, MUC5B ve SCGB1A1) gen ekspresyonu qPCR ile ölçüldü ve RPL13A ve ATP5B gen ekspresyonu için normalleştirildi (ayrıntılar için referans 23'e bakınız). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
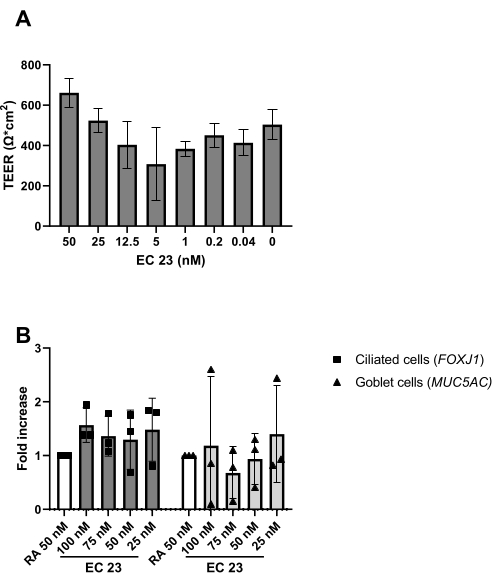
Resim 5: Retinoik asit (RA) ve sentetik analoğu EC 23'ün karşılaştırılması. PBEC'ler izole edildi ve genişletildi ve iyi farklılaşmış ALI-PBEC kültürleri kuruldu. PBEC kültürlerinin havaya maruz kalmaya başlaması üzerine, RA (50 nM) çeşitli EC 23 konsantrasyonları ile değiştirildi. (A) Elektrik direnci ALI sonrası 14. günde ölçüldü ve daha sonra TEER hesaplandı (Ω · cm 2), n =2 donörler, çubuklar SD'± ortalama değerini göstermektedir. (B) ALI sonrası 14. günde, hücre kültürleri RNA izolasyonu için lize edildi ve qPCR kullanılarak sırasıyla siliyer ve kadeh hücreleri (FOXJ1, MUC5AC) için hücre belirteçlerinin gen ekspresyon analizi, ve RPL13A için normalleştirilir (n = 3 donör). 50 nM RA ile kültürlenmiş ve SD'± ortalama değeri olarak gösterilen ALI-PBEC'e karşı bir kat artış gösterilmiştir. (Ayrıntılar için referans 23'e bakınız) Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Geçtiğimiz yıllarda, medya ve kültür plastikleri gibi alternatif ürünlerin kültür sistemindeki performansı incelenmiştir. Bu tür değerlendirmelerin, üreticiler tarafından orta kompozisyondaki değişiklikler, tanıtılan yeni medya ve COVID-19 pandemisi (2020-2022) sırasında ürün sıkıntısı da dahil olmak üzere çeşitli nedenleri vardı. Farklı tedarikçilerden gelen benzer ürünlerin, epitel hücre tiplerinin belirteçlerinin değerlendirilmesine dayanarak farklılaşmış epitel hücre kültürlerine yol açtığı, ancak nihai hücresel kompozisyonun önemli ölçüde değişebileceği (Şekil 6A), TEER'deki farklılıkların ise daha az belirgin olduğu gözlemi yapılmıştır (Şekil 6B). Öte yandan, farklı tedarikçilerden gelen ortamlar, hücresel bileşimde önemli farklılıklara neden olmuştur; farklı markalardan kesici uçlar kullanıldığında, bu farklılıklar sınırlıydı (Şekil 6C). Özellikle, STEMCELL Technologies'den hava yolu epitel hücre kültürü ortamı PneumaCult kullanıldığında, farklı bir morfoloji ve görünür siliyer aktivitenin daha hızlı oluşumu gözlenmiştir. Bu gözlemlerin yanı sıra, TEER değerlerinde bir fark ve ALI-PBEC'in hücresel bileşiminde cBD ortamına kıyasla bir fark da kaydedildi (Şekil 6D).
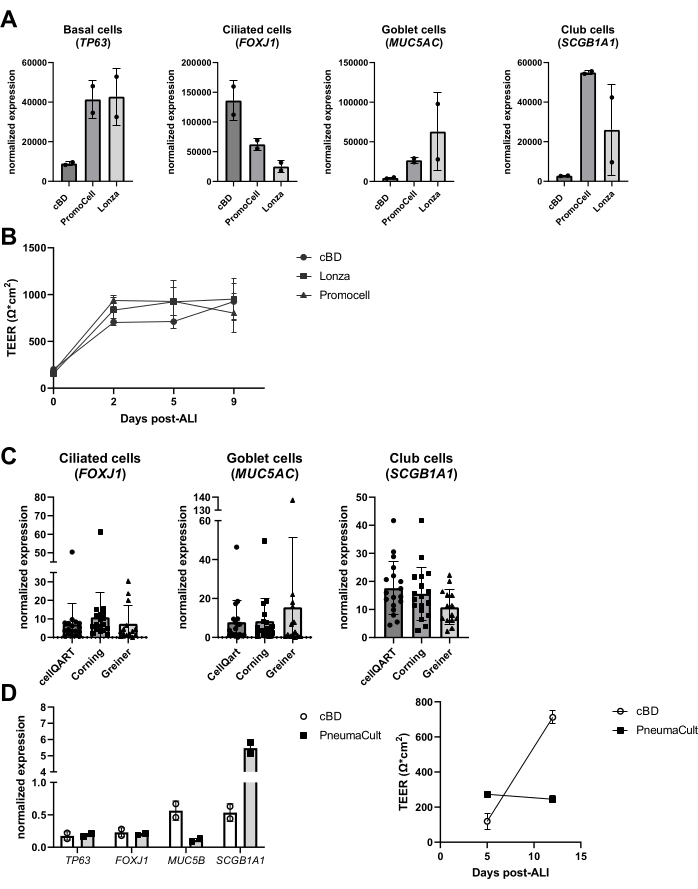
Şekil 6: Epitel hücre ortamı ve hücre kültürü eklerinin farklı tedarikçilerinin karşılaştırılması. PBEC izole edilmiş, genişletilmiş ve iyi farklılaşmış ALI-PBEC kültürleri oluşturulmuştur. (A) ALI-PBEC'ler 14 gün boyunca kültürlendi ve daha sonra hücre katmanları RNA izolasyonu için lize edildi. Bazal, siliyer, kadeh ve kulüp hücre belirteçlerinin (sırasıyla TP63, FOXJ1, MUC5AC ve SCGB1A1) gen ekspresyonu qPCR ile ölçüldü ve RPL13A ve ATP5B için normalleştirildi. n = 2 donör; çubuklar SD± ortalama değerini göstermektedir. (B) ALI'den sonraki 9 gün boyunca, elektrik direnci ölçüldü ve ardından TEER hesaplandı (Ω ·cm2). n = 3 farklı donör; (C) ALI-PBEC'ler, üç farklı tedarikçiden satın alınan hücre kültürü ekleri kullanılarak 14 gün boyunca kültürlendi ve daha sonra hücre katmanları RNA izolasyonu için lize edildi.± Silili, kadeh ve kulüp hücre belirteçlerinin (sırasıyla FOXJ1, MUC5AC ve SCGB1A1) gen ekspresyonu qPCR ile ölçüldü ve RPL13A için normalleştirildi. n = 18 farklı donör, çubuklar SD± ortalama değerini göstermektedir. Veriler, tek yönlü bir ANOVA parametrik olmayan Kruskal-Wallis testi kullanılarak anlamlılık açısından test edilmiş ve anlamlı bir fark bulunmamıştır. (D) ALI-PBEC'ler, ALI'den sonraki 14 gün boyunca cBD ortamında veya PneumaCult ortamında (STEMMCELL teknolojileri) kültürlendi ve daha sonra hücre katmanları RNA izolasyonu için lize edildi. Bazal, siliyer, kadeh ve kulüp hücre belirteçlerinin (sırasıyla TP63, FOXJ1, MUC5B ve SCGB1A1) gen ekspresyonu qPCR ile ölçüldü ve RPL13A için normalleştirildi (çubuklar SD± ortalama değerini gösterir) ve elektrik direnci ALI sonrası 5. ve 12. günlerde ölçüldü ve TEER'i (Ω ·cm2) hesaplamak için kullanıldı. n = 2; ortalama değer SD ± gösterilmiştir (ayrıntılar için referans 23'e bakın). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Ek Tablo 1: Protokolde kullanılan çözeltilerin ve ortamların bileşimi. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada sunulan protokol, insan bronşiyal epitel hücrelerinin rezeke edilmiş akciğer dokusundan izolasyonunu, farklılaşma potansiyeli kaybı olmadan hücrelerin optimal genişlemesi için bir yöntem, bir kriyoprezervasyon prosedürü ve iyi diferansiye ALI-PBEC kültürleri üretmek için bir prosedürü açıklamaktadır. Ayrıca, kalite kontrolün bir tanımının yanı sıra farklılaştırılmış ALI-PBEC'lerin izlenmesi ve değerlendirilmesi için talimatlar da verilmektedir.
Tarif edilen protokol, akciğer kanseri tanısı ile ilgili ameliyat geçiren hastalardan akciğer lobundan rezeke edilen makroskopik olarak normal, tümörsüz bir bronşiyal halka ile başlar. Bu nedenle, bu halkaların kesinlikle sağlıklı doku olarak kabul edilemeyeceğine ve bu nedenle hücre kültürü özelliklerini etkileyebileceğine dikkat edilmelidir. Bronşiyal epitel hücrelerini elde etmek için alternatif kaynaklar, bronşiyal biyopsilerin, bronşiyal fırçalamaların veya bir nakil donöründen veya alıcı akciğerlerden doku kullanılmasını içerir. Kaynağı ne olursa olsun, akciğer dokusu kullanılırken, mikrobiyal kontaminasyon riski göz önünde bulundurulmalıdır ve bu nedenle hücre kültürünün mikrobiyal kontaminasyon riskini azaltmak için farklı kültür ortamlarında antibiyotikler kullanılır. Özellikle, mikoplazma, hücre kültürü üzerindeki çok çeşitli etkileri, hücre kültüründe yaygın olarak kullanılan antibiyotiklere direnci ve mikoplazma kontaminasyonunun sadece mikoplazma tespit testleri ile doğrulanabilmesi nedeniyle hücre kültüründe yüksek ve yaygın bir risktir. Bu nedenle, hücrelerin akciğer dokusundan izole edilmesini takiben hücre kültürünün ilk aşamasında, geniş spektrumlu antimikrobiyal formülasyon Primosin kullanılır ve kültür işlemi sırasında, rastgele seçilen örnekler mikoplazmanın varlığı için test edilir.
Bir bronşiyal halka ile başlayan izolasyon prosedürü, farklılaşma kapasitesinden ödün vermeden ALI'de kültürleri başlatmak için gereken bu birincil hücrelerin genişleme derecesine izin vermek için yeterli başlangıç materyali sağlar. Bununla birlikte, izole edilmiş epitel hücrelerinin sınırlı sayıda hücre ile genişlemesine başlanması, ALI kültürü için tohumlanabilecek yeterli sayıda hücreye sahip yeterli sayıda ekin elde edilmesinde sorunlara neden olabilir. Genişletilmiş kültür ve primer hücrelerin tekrar tekrar geçmesi, replikatif yaşlanmaya neden olabilir. Bu sınırlamanın üstesinden gelmek için çeşitli çözümler önerilmiştir. Horani ve ark., Rho kinaz inhibitörü (ROCK) Y-27632'nin bazal hücrelerin proliferasyonunu arttırdığını göstermiştir 30, Mou ve ark. farklılaşmış epitel hücre tabakası31'in özelliklerini korurken bazal kök hücreleri genişletmek için ikili Smad inhibisyonu kullanmışlardır ve Sachs ve ark. hava yolu epitel hücrelerini genişletmek ve çoklu pasajlar boyunca farklılaşma potansiyellerini korumak için kullanılabilecek bir hava yolu organoid sistemi geliştirmişlerdir 32. İkinci yöntem ayrıca, burada tarif edildiği gibi ALI kültürüne aktarılmadan önce, preterm bebeklerden (<28 haftalık gebelik yaşı) trakeal aspiratlar (TA'lar) ve bronkoalveoler lavaj (BAL) sıvısı gibi çok düşük hücre sayısına sahip kaynaklardan hücreleri genişletmek için de kullanılmıştır33. BAL ve TA'lardan izole edilen hücrelerin, bronşiyal dokudan üretilen hücrelere benzer bir farklılaşma kapasitesi gösterdiği bulunmuştur, ancak farklılaşma, Çentik sinyal inhibisyonu veya Th2 sitokin IL-1333 kullanılarak daha siliyer veya daha fazla kadeh hücresi içeren kültürlere doğru çarpıtıldığında farklılıklar gözlenmiştir. Bu nedenle, ALI-PBEC'ler benzer yaklaşımlar kullanılarak düşük epitel hücre sayısına sahip bir başlangıç materyalinden kültürlenirse, protokolün 6. bölümünde tartışıldığı gibi, kültürleri her zaman temel kalite kriterleri açısından kontrol etmeleri önerilir. Önemli olarak, besleyici hücrelerin kullanımı, zamanın ve hücre numarasının gerekli olduğu nakledilebilir iskele mühendisliği için gerekli olan daha büyük hücre sayılarının elde edilmesine de yardımcı olabilir. Bu, otolog epitel hücrelerinin trakea hastalığı olan bir hastadan türetilen biyopsilerden kültürlendiği ve hücrelerin bir murin embriyonik besleyici tabakası (mitotik olarak inaktive edilmiş 3T3-J2 fibroblastları) ve yukarıda belirtilen Rho / ROCK yolunun inhibitörü (Y-27632) varlığında hızla genişlediği bir çalışma ile gösterilmiştir (Y-27632)34. Elde edilen hücre kültürünün, trakea iskelelerinin yeniden popülasyonu için yararlı olduğu bulundu ve bu nedenle bu, bir nakil modeli için uygun bir protokol olarak görülebilir.
Bu katkıda açıklanan protokolü kullanırken, aynı zamanda diğer kültür protokollerini kullanırken, kaçınılmaz olarak bir seçim yanlılığı ortaya çıkar. Kültürleri başlatmak için kullanılan hücrelerin kökeni, orta bileşim ve diğer protokol detayları gibi protokol detaylarındaki farklılıkların, kültürlerin hücresel bileşiminde değişikliklere ve dolayısıyla ALI kültürünün yanıtında değişikliklere yol açabileceğini anlamak önemlidir33,35. Ek olarak, hava yolu hücrelerini ayırt etmek için farklı ortamları karşılaştırırken hücre özelliklerinde farklılıklar da gözlenmiştir10,11. PneumaCult ve cBD besiyeri karşılaştırıldığında, kadeh hücresi ve kulüp hücresi mRNA belirteçleri, TEER değerleri ve hücre tabakası kalınlığında farklılıklar gözlendi. Bu gözlemlere dayanarak, istatistiksel dayanak eksikliğine rağmen, kullanılan donör sayısının düşük olması, ortam bileşiminin müşteriler tarafından bilinmemesi ve PneumaCult ortamının daha yüksek maliyetleri nedeniyle, laboratuvarımızda cBD ortamını kullanma kararı alınmıştır.
Tartışıldığı gibi, hücreler başlangıçta organoid kültür kullanılarak genişletilebilir ve daha sonra 2D ALI insert sistemine aktarılabilir. Bu önemlidir, çünkü hava yolu epitel organoidleri havadaki maddelere maruz kalmak için uygun değildir, oysa ALI 2D sisteminin kullanımı, sigara dumanı23,36 gibi havadaki maddelerin kültürlenmiş hava yolu epitel hücreleri üzerindeki etkisinin değerlendirilmesine izin verir. ALI hava yolu epitel hücre kültürlerini oluşturmak için farklı bir yaklaşım, insan pluripotent kök hücrelerinin (hiPSC'ler) farklılaşmasıyla hava yolu epitel hücreleri üretmektir37. Bu tür protokollerde, proksimal hava yolu progenitörlerine farklılaşmadan sonra farklılaşma protokolünün son aşamasında, hücreler burada tarif edilenlere benzer prosedürler kullanılarak kültürle ALI'ye ayırt edilebilir.
Mevcut protokolde, cBD ortamı ALI'de kültür için kullanılmaktadır. cBD ortamı, Fulcher ve ark.38'den ve diğer çalışmalardan esinlenen farklı takviyelerin bir karışımı eklenerek hazırlanan serumsuz bir ortamdır. Ek çözelti 52 μg / mL sığır hipofiz ekstresi (BPE), 0.5 μg / mL hidrokortizon, 0.5 ng / mL insan EGF, 0.5 μg / mL epinefrin, 10 μg / mL transferrin, 5 μg / mL insülin, 6.5 ng / mL triiyodotironin ve 0.1 ng / mL RA39 içerir. BPE bir doku ekstresi olduğundan ve partiye göre varyasyona maruz kaldığından, ortam tam olarak tanımlanmış bir ortam olarak kabul edilemez ve hayvansız değildir. Tamamen tanımlanmış hücre kültürü ortamı, toplu işlemden partiye farklılıkları en aza indirmek için tercih edilir. Hayvansız araştırmaya geçiş göz önüne alındığında, hayvansal ürünler içermeyen ve bilimsel topluluk için uygun fiyatlı tanımlanmış medya üretmek için çaba gösterilmesi önemlidir.
Araştırma sorusuna bağlı olarak ALI modeline dayalı olarak çeşitli deney düzenekleri kullanılabilir. Örneğin, farklılaşma sürecini etkileyebilecek bileşiklerin etkisini araştırmak için, bu, batık kültürün farklı aşamalarında, farklılaşma sırasında veya iyi farklılaşmış aşamada bileşikleri kültüre ekleyerek ele alınabilir. ALI-PBEC kültürünün hücresel bileşimi, spesifik bileşiklerin eklenmesiyle etkilenebilir; Örneğin, IL-13 varlığında ALI-PBEC'leri ayırt etmek, daha fazla kadeh hücresi ve daha az siliye hücreli bir kültür üretirken, farklılaşma sırasında γ-sekretaz inhibitörü DAPT (Çentik sinyalini bloke etmek için kullanılır) ile tedavi, kadeh hücreleri pahasına daha siliyer hücrelere sahip bir kültürle sonuçlanır 23,40,41,42.
Ayrıca, hücreleri uyarmak veya belirli süreçleri bloke etmek için kullanılan ajanlar ya bazal bölmeye ya da (çok küçük bir hacimde) kültürün apikal bölmesine uygulanabilir. Hücreler ayrıca apikal taraftan havadaki maddelere de maruz kalabilir. Bu tür maruz kalma tasarımları, dizel egzozunun veya tam sigara dumanının PBEC'ler üzerindeki etkisini incelemek için kullanılmıştır 23,43,44. Ortam, bazal tarafta salgılanan proteinleri izlemek için ortam her değiştirildiğinde hasat edilebilir; aynısı, bazal ortamı yenilerken PBS ile yıkanan hücrelerin apikal tarafı için de geçerlidir. Apikal yıkama adı verilen yıkama hasat edilir ve kadeh hücreleri tarafından üretilen mukusun daha verimli bir şekilde ayrışması için isteğe bağlı ditiyoeritritol (DTE) eklenir. Hücre lizatları, toplam protein, RNA ve kromozomal ve mitokondriyal DNA'nın izolasyonu için elde edilebilir. Hücreler, polietilen tereftalat (PET) membranını plastik uçtan keserek ve bu zarı çoklu immünofloresan boyamaları için daha küçük parçalara ayırarak spesifik belirteçler için antikorlar kullanılarak daha fazla çalışılabilir45. Ayrıca, akış sitometrisi veya FACS, eklerdeki hücrelerin tripsinizasyonunu takiben de kullanılabilir. ALI aşamasında, hücresel bariyerin gelişimi, elektrik direncini ölçerek ve daha sonra elektrik direncinin membran ekinin yüzey alanıyla ters orantılı olduğu TEER'i hesaplayarak izlenebilir. Hesaplama, aşağıdaki formülü kullanarak Ohm yasasına dayanır: buradaRm, ölçülen elektrik direncidir, Rb, 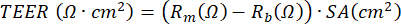 kaplama ve hücreler içermeyen bir kesici ucun temel elektrik direncidir ve SA, kesici ucun zarının yüzey alanıdır. EVOM2 ve STX / çubuk elektrotları kullanarak elektrik direncini ölçmek basittir, ancak kuyuya sokulduğunda taşıma prosedürlerine büyük ölçüde bağlıdır. Ayrıca, elektrotun şeklinin, nispeten geniş yüzey alanının bariyer fonksiyonunun ölçümünü etkilediği öne sürülmüştür17.
kaplama ve hücreler içermeyen bir kesici ucun temel elektrik direncidir ve SA, kesici ucun zarının yüzey alanıdır. EVOM2 ve STX / çubuk elektrotları kullanarak elektrik direncini ölçmek basittir, ancak kuyuya sokulduğunda taşıma prosedürlerine büyük ölçüde bağlıdır. Ayrıca, elektrotun şeklinin, nispeten geniş yüzey alanının bariyer fonksiyonunun ölçümünü etkilediği öne sürülmüştür17.
Doğru doku temsilini arttırmayı amaçlayan ALI hücre kültürü sistemindeki daha fazla gelişme, lökositler, fibroblastlar veya endotel hücreleri gibi ek hücre tiplerinin kokültürünü içerir46,47,48. ALI-PBEC'in granülosit-makrofaj koloni stimüle edici faktör (GM-CSF) veya M-CSF farklılaşmış makrofajlarla birlikte kültürlenmesinin doğuştan gelen epitel yanıtlarını ve onarımını belirgin şekilde etkilediği gözlenmiştir48. Bu tür kokültür modellerinde, orta uyumluluğun bir sorun olabileceğine dikkat etmek önemlidir. Hava yolu epitel hücre kültürü için kullanılan ortam özellikle PBEC'ler için geliştirildiğinden ve diğer hücre tipleri için en uygun olmayabilir, optimizasyon gereklidir. İzole PBEC'lerin kullanılabileceği hava yolu biyolojisi alanında görülen bir diğer ilerleme türü, Çip Üzerinde Organlar (OoC) teknolojisinin kullanılmasıdır49,50. Bu teknolojiyi kullanarak, gerilme, hava ve orta akış gibi solunum ve kan akışının mekanik kuvvetlerinin etkisi incelenebilir 29.
Çeşitli donörlerden PBEC'ler kullanılırken donörler arası değişkenlik önemli olabilir ve bu nedenle epitel hücre kültürü çalışmalarında bu değişkenliği hesaba katmak için birkaç donörden alınan hücreleri kullanmayı düşünmek önemlidir. ALI-PBEC'lerin kültürü zaman alıcı olduğundan ve önemli maliyetlerle ilişkili olduğundan, farklı donörlerden gelen hücreleri tek bir hücre kültürü ekinde karıştırarak ALI-PBEC kültürleri oluşturma seçeneği incelenmiştir. Bu şekilde, pilot deneyler, çeşitli bireysel donörlerden türetilen kültürlerin tepkilerini analiz etmeden önce birincil hücreler kullanılarak kolayca gerçekleştirilebilir. Ek olarak, farklı özelliklere sahip donörler (örneğin, farklı yaş kategorisi veya cinsiyet) keşif çalışmaları için gruplandırılabilir. Donör karışımlarını kullanırken, bir donörün daha yüksek bir proliferasyon oranının bir sonucu olarak sonuçlara hakim olma olasılığını önlemek için farklı donörlerin eşit hücre sayılarının mevcut olduğundan emin olmak önemlidir. Bu nedenle, bireysel donörlerden gelen hücreler ayrı ayrı genişletilir ve ALI'ye geçişten önce ekteki çoğalmayı en aza indirmek için tek bir donörden gelen tohumlama hücrelerine kıyasla ekte daha yüksek bir yoğunlukta tohumlanır. Donör karışımlarının ve ilgili bireysel donörlerin yanıtları, SARS-CoV-2'nin enfeksiyon kinetiği incelenerek karşılaştırıldı. RT-qPCR ve immünofloresan boyama kullanılarak, donör karışımının, üretilen benzer sayıda virüs partikülünü ve benzer sayıda enfekte olmuş hücreyi göstererek çeşitli bireysel donörlerin iyi bir temsilini sağladığı gözlenmiştir28.
Hayvan modelleri için kabul edilebilir bir alternatif olmak için, kültürlenmiş bronşiyal epitel hücrelerinin gen düzenlemesi uygulanabilir olmalıdır51. ALI-PBEC'lerde küçük enterferan RNA'lar (siRNA'lar) kullanılarak RNA girişim teknolojisi incelenmiştir, ancak kültürün batık fazı sırasında hücrelerin siRNA ile transfekte edilmesi gerektiğinden, kültür sırasında siRNA transfeksiyonu sıklıkla tekrarlanmadığı sürece, uzun kültür süresi nedeniyle ALI kültürü sırasında nakavt yeterince sürdürülmemektedir52. Bununla birlikte, siRNA'lar batık bazal hücrelerde gen ekspresyonunu değiştirmek için başarıyla kullanılabilir. Diğerleri, ribonükleoprotein (RNP) dağıtımı 53 ile primer ALI hava yolu epitel hücre kültürlerinde gen düzenlemeyi başarmak için CRISPR / Cas9 teknolojisini başarıyla kullanmışlardır. Bu tür teknikleri kullanırken, hücrelerin tam farklılaşma kapasitelerini korumaları esastır. Primer hava yolu hücre kültürleri süresiz olarak geçilemediğinden, gen düzenlenmiş hücrelerin klonal genişlemesi kolay değildir ve transfekte hücreleri seçmek için ortamın eklenmesi zahmetlidir. Bu nedenle, tüm kültürlü hücrelerde istenen yıkımı elde etmek zordur. Nakavt klonları üretmenin bir alternatifi, hiPSC54'te nakavt stratejilerinin kullanılması ve bu hücrelerin hava yolu epitel hücreleri üretmek için kullanılmasıdır. Bir diğeri, optimal olmasa da, gen düzenlenmiş hücreleri klonal olarak genişletmek için ölümsüzleştirilmiş bir PBEC hattı oluşturmaktır55.
Burada sunulan protokol, iyi farklılaştırılmış bir psödostratifiye ALI-PBEC üretmenin bir yoludur, ancak diğer protokollerin de sunulan protokole kıyasla daha küçük ve daha büyük farklılıklarla böyle bir kültür oluşturduğu bulunmuştur. Bize göre, ALI-PBEC sisteminin ve hava yolu epitel hücrelerinin benzer kültür sistemlerinin hayvan deneyleri için geçerli bir alternatif haline gelmesi için kültür yöntemlerinin laboratuvar genelinde doğrulanması ve sıkı kalite kontrolü şarttır.
Açıklamalar
Yazarlar, ilgili çıkar çatışmalarının olmadığını beyan ederler.
Teşekkürler
Bu katkıda açıklanan modeli kullanan çalışmalar, Hollanda Akciğer Vakfı, Hollanda Sağlık Araştırma ve Geliştirme Örgütü (ZonMw, COVID-19 MKMD hibesi), Hollanda Hayvan Testlerinin Değiştirilmesi Derneği (Stichting Proefdiervrij, hibe #114025007) ve Boehringer Ingelheim ve Galapagos gibi şirketlerden araştırma hibeleri de dahil olmak üzere çeşitli finansman kuruluşları tarafından desteklenmiştir. Şekil 1 BioRender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,000 ohm test resistor | World Precision Instruments | N/A | Used to calibrate the EVOM2 Epithelial Voltohmmeter |
| 4-[2-(5,6,7,8-Tetrahydro-5,5,8,8-tetramethyl-2-naphthalenyl)ethynyl)-benzoic acid (EC 23) | Tocris | 4011 | Used in cBD medium |
| 6-well Clear TC-treated Multiple Well Plates | Corning | 3506 | Used in the first step to grow the cells isolated form the bronchial ring |
| Airway Epithelial Cell Growth Medium Kit | PromoCell | C-21160 | Used to compare to cBD medium |
| Bead Bath 20 Liter | Lab Armor | 74220-720 | Used to pre-warm cell culture solutions |
| BEGM Bronchial Epithelial Cell Growth Medium BulletKit | LONZA | CC-3170 | Used to compare to cBD medium |
| Bovine albumin fraction V (BSA) | Thermo Fisher Scientific | 15260037 | Used in coating solution |
| Bovine pituitary extract (BPE) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Bronchial epithelial cell growth supplement (BEpiCGS) | ScienCell Research Laboratories | 3262 | Used in cBD medium |
| Bronchial epithelial cell medium-basal (BEpiCM-b) | ScienCell Research Laboratories | SCC3211-b | Used in cBD medium |
| Cell culture inserts; 12 mm Transwell with 0.4 µm pore polyester membrane insert | Corning | 3460 | Cell culture inserts used in the protocol |
| Cell culture inserts; 12-well inserts, 0.4 µm PET clear | CellQART made by SABEU | 9310412 | Cell culture inserts used to compare with Corning cell culture inserts |
| Cell culture inserts; 12-well ThinCert Tissue culture Inserts | Greiner Bio-One | 82050-032 | Cell culture inserts used to compare with Corning cell culture inserts |
| CELLSTAR flask, TC, PS, 250 ml, 75 cm2 | Greiner Bio-One | 658170 | Used to expand the number cells |
| CFX Maestro 1.0 | Bio-Rad | N/A | Software program for analyzing qPCR data generated with the CFX384 System |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad | 1855484 | qPCR detection system |
| Chopstick electrode set | World Precision Instruments | STX2 | Used to measure electrical resistance in ALI-PBEC |
| CO2-Incubator | PHCbi | MCO-170AICUV-PE | Cell culture incubator used for mycplasma free cell cultures |
| CO2-Incubator | Hereaus | Heracell 150 | Cell culture incubator used for possibly mycplasma infected cell cultures |
| Coolcell Container | Corning | 432006 | Used to cryopreserve cells at -80 °C before transfer to liquid N2 |
| Countess 3 Automated cell counter | Thermo Fisher Scientific | AMQAX2000 | Used to count cells and determine the cell concentration |
| Cryovials | Nalgene | 479-3224 | Used to cryopreserve cells in |
| D-Glucose | Avantor VWR BDH CHEMICALS | 101174Y | Used in soft trypsin |
| Dimethyl sulfoxide (DMSO) | Avantor VWR | 0231 | Used in cell freeze medium |
| dNTP (10 mM) | Promega | U1515 | Used in the synthesis of cDNA |
| Dulbecco's Modified Eagle's Medium (DMEM) + 4500 mg/l D-Glucose | STEMCELL Technologies | 36250 | Used in cBD medium |
| Dulbecco's Modified Eagle's Medium (DMEM) 4.5 g/l glucose with l-glutamine | LONZA | LOBE12-604F | Used in cBD medium to compare with DMEM from other manufacturers |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, pyruvate | Thermo Fisher Scientific | 41966029 | Used in cBD medium to compare with DMEM from other manufacturers |
| Epidermal growth factor (EGF) | Thermo Fisher Scientific | 37000-015 | Used in c-KSFM |
| Ethylenediaminetetraacetic acid (EDTA) | Avantor VWR BDH CHEMICALS | 443885J | Used in soft trypsin |
| EVOM2 Epithelial Voltohmmeter | World Precision Instruments | 91799 | Used with the chopstick electrode set to measure electrical resistance in ALI-PBEC |
| Fibronectin solution, Human | PromoCell | C-43060 | Used in coating solution |
| Glutamax | Thermo Fisher Scientific | 35050038 | Used in cBD medium |
| Hanks balanced salt solution (HBSS) | ScienCell Research Laboratories | SCC0313 | Used to dissolve protease XIV |
| IQ SYBR Green Super mix | Bio-Rad | 170887 | qPCR reagent |
| Isoproterenol hydrochloride, (-)- | Sigma-Aldrich | I-6504 | Used in c-KSFM |
| Keratinocyte-SFM (KSFM) | Thermo Fisher Scientific | 17005-034 | Used in c-KSFM |
| Maxwell RSC Instrument | Promega | AS4500 | Automated RNA isolation system |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | Used to isolate total RNA with the Maxwell RSC Instrument |
| M-MLV Reverse transcriptase | Promega | M5301 | Used in the synthesis of cDNA |
| M-MLV Reverse transcriptase 5X reaction buffer | Promega | M531A | Used in the synthesis of cDNA |
| MycoStrip | InvivoGen | rep-mys-10 | Used to detect the presence of mycoplasma in cell culture samples |
| N-2-hydroxyethylpiperazine-N-2-ethane sulfonic acid (HEPES) | Thermo Fisher Scientific | 15630056 | Used in cBD medium |
| Oligo(dT)15 | Qiagen | 79237 | Used in the synthesis of cDNA |
| Penicillin/Streptomycin solution (Pen/Strep) | ScienCell Research Laboratories | SCC0513 | Used as antibiotic in c-KSFM and cBD medium |
| Phosphate buffered saline (PBS) | LUMC pharmacy | N/A | Used in different steps of the protocol |
| Pneumacult-ALI Medium | STEMCELL Technologies | 05002 | Used to grow cells in the differentiation stage to compare to cBD medium |
| Pneumacult-Ex Plus Medium | STEMCELL Technologies | 05040 | Used to grow cells in the submerged stage to compare to cBD medium |
| Primer, ATP5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: TCACCCAGGCTGGTTCAGA |
| Primer, ATP5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGTGGCCAGGGTAGGCTGAT |
| Primer, FOXJ1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGAGGGGACGTAAATCCCTA |
| Primer, FOXJ1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TTGGTCCCAGTAGTTCCAGC |
| Primer, MUC5AC, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCTTCGACGGACAGAGCTAC |
| Primer, MUC5AC, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCTCGGTGACAACACGAAAG |
| Primer, MUC5B, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: GGGCTTTGACAAGAGAGT |
| Primer, MUC5B, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: AGGATGGTCGTGTTGATGCG |
| Primer, RPL13A, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: AAGGTGGTGGTCGTACGCTGTG |
| Primer, RPL13A, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: CGGGAAGGGTTGGTGTTCATCC |
| Primer, SCGB1A1, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: ACATGAGGGAGGCAGGGGCTC |
| Primer, SCGB1A1, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: ACTCAAAGCATGGCAGCGGCA |
| Primer, TP63, forward | Integrated DNA Technologies | N/A | Nucleotide sequence: CCACCTGGACGTATTCCACTG |
| Primer, TP63, reverse | Integrated DNA Technologies | N/A | Nucleotide sequence: TCGAATCAAATGACTAGGAGGGG |
| Primocin | InvivoGen | ant-pm-2 | Used as antimicrobial agent against bacteria, mycoplasma, and fungi in c-KSFM medium |
| Protease XIV | Sigma-Aldrich | P5147 | Used for the enzymatic treatment of the bronchial ring |
| RNAsin Recombinant Ribonuclease inhibitor | Promega | N2515 | Used in the synthesis of cDNA |
| Soybean trypsin inhibitor (SBTI) | Sigma-Aldrich | T9128 | Used to inhibit the action of soft trypsin |
| T100 Thermal Cycler | Bio-Rad | 1861096 | Used in the synthesis of cDNA |
| TissueSAFE plus | MILESTONE MEDICAL | N/A | Vacuum transfer system for biological specimens |
| Trypan blue solution | Thermo Fisher Scientific | 15250061 | Used to count live- and dead cells |
| Trypsin 1:250 | Thermo Fisher Scientific | 27250-018 | Used in soft trypsin |
| Type I collagen solution (PureCol) | Advanced BioMatrix | 5005-B | Used in coating solution |
| Universal container, PP, with PE screw cap | Avantor VWR | 216-2053 | Used in the protocol for the Protease XIV treatment of the bronchial ring |
Referanslar
- Aghapour, M., et al. Role of air pollutants in airway epithelial barrier dysfunction in asthma and COPD. European Respiratory Review. 31 (163), 210112 (2022).
- de Waal, A. M., Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Duchesne, M., Okoye, I., Lacy, P. Epithelial cell alarmin cytokines: Frontline mediators of the asthma inflammatory response. Frontiers in Immunology. 13, 975914 (2022).
- Hewitt, R. J., Lloyd, C. M. Regulation of immune responses by the airway epithelial cell landscape. Nature Reviews Immunology. 21 (6), 347-362 (2021).
- Ruysseveldt, E., Martens, K., Steelant, B. Airway basal cells, protectors of epithelial walls in health and respiratory diseases. Frontiers in Allergy. 2, 787128 (2021).
- Alysandratos, K. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Hammad, H., Lambrecht, B. N. Barrier epithelial cells and the control of type 2 immunity. Immunity. 43 (1), 29-40 (2015).
- Hynds, R. E., Bonfanti, P., Janes, S. M. Regenerating human epithelia with cultured stem cells: feeder cells, organoids and beyond. EMBO Molecular Medicine. 10 (2), 139-150 (2018).
- Hiemstra, P. S., Tetley, T. D., Janes, S. M. Airway and alveolar epithelial cells in culture. The European Respiratory Journal. 54 (5), 1900742 (2019).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), 2137 (2020).
- Leung, C., Wadsworth, S. J., Yang, S. J., Dorscheid, D. R. Structural and functional variations in human bronchial epithelial cells cultured in air-liquid interface using different growth media. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1063-L1073 (2020).
- Morgan, R., et al. A medium composition containing normal resting glucose that supports differentiation of primary human airway cells. Scientific Reports. 12 (1), 1540 (2022).
- Ghosh, B., et al. Strong correlation between air-liquid interface cultures and in vivo transcriptomics of nasal brush biopsy. American Journal of Physiology. Lung Cellular and Molecular Physiology. 318 (5), L1056-L1062 (2020).
- Pezzulo, A. A., et al. The air-liquid interface and use of primary cell cultures are important to recapitulate the transcriptional profile of in vivo airway epithelia. American Journal of Physiology. Lung Cellular and Molecular Physiology. 300 (1), L25-L31 (2011).
- Dvorak, A., Tilley, A. E., Shaykhiev, R., Wang, R., Crystal, R. G. Do airway epithelium air-liquid cultures represent the in vivo airway epithelium transcriptome. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 465-473 (2011).
- Legebeke, J., et al. Temporal whole-transcriptomic analysis of characterized in vitro and ex vivo primary nasal epithelia. Frontiers in Cell and Developmental Biology. 10, 907511 (2022).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- van Wetering, S., et al. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. Journal of Investigative Medicine. 48 (5), 359-366 (2000).
- Balk, S. D. Calcium as a regulator of the proliferation of normal, but not of transformed, chicken fibroblasts in a plasma-containing medium. Proceedings of the National Academy of Sciences. 68 (2), 271-275 (1971).
- Gail, M. H., Boone, C. W., Thompson, C. S. A calcium requirement for fibroblast motility and prolifertion. Experimental Cell Research. 79 (2), 386-390 (1973).
- Dulbecco, R., Elkington, J. Induction of growth in resting fibroblastic cell cultures by Ca. Proceedings of the National Academy of Sciences. 72 (4), 1584-1588 (1975).
- van Wetering, S., et al. Epithelial differentiation is a determinant in the production of eotaxin-2 and -3 by bronchial epithelial cells in response to IL-4 and IL-13. Molecular Immunology. 44 (5), 803-811 (2007).
- Amatngalim, G. D., et al. Aberrant epithelial differentiation by cigarette smoke dysregulates respiratory host defence. The European Respiratory Journal. 51 (4), 1701009 (2018).
- Christie, V. B., et al. Retinoid supplementation of differentiating human neural progenitors and embryonic stem cells leads to enhanced neurogenesis in vitro. Journal of Neuroscience Methods. 193 (2), 239-245 (2010).
- Schrumpf, J. A., Ninaber, D. K., vander Does, A. M., Hiemstra, P. S. TGF-β1 impairs vitamin D-induced and constitutive airway epithelial host defense mechanisms. Journal of Innate Immunity. 12 (1), 74-89 (2020).
- Schrumpf, J. A., et al. Proinflammatory cytokines impair vitamin D-induced host defense in cultured airway epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (6), 749-761 (2017).
- Boei, J. J. W. A., et al. Xenobiotic metabolism in differentiated human bronchial epithelial cells. Archives of Toxicology. 91 (5), 2093-2105 (2017).
- Wang, Y., et al. Impact of human airway epithelial cellular composition on SARS-CoV-2 infection biology. bioRxiv. , (2021).
- Nawroth, J. C., et al. Breathing on Chip: Dynamic flow and stretch tune cellular composition and accelerate mucociliary maturation of airway epithelium in vitro. bioRxiv. , (2022).
- Horani, A., Nath, A., Wasserman, M. G., Huang, T., Brody, S. L. Rho-associated protein kinase inhibition enhances airway epithelial Basal-cell proliferation and lentivirus transduction. American Journal of Respiratory Cell and Molecular Biology. 49 (3), 341-347 (2013).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Eenjes, E., et al. Disease modeling following organoid-based expansion of airway epithelial cells. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (4), L775-L786 (2021).
- Butler, C. R., et al. Rapid expansion of human epithelial stem cells suitable for airway tissue engineering. American Journal of Respiratory and Critical Care Medicine. 194 (2), 156-168 (2016).
- Amatngalim, G. D., et al. Antibacterial defense of human airway epithelial cells from chronic obstructive pulmonary disease patients induced by acute exposure to nontypeable Haemophilus influenzae: modulation by cigarette smoke. Journal of Innate Immunity. 9 (4), 359-374 (2017).
- Plebani, R., et al. 3D lung tissue models for studies on SARS-CoV-2 pathophysiology and therapeutics. International Journal of Molecular Sciences. 23 (17), 10071 (2022).
- Wong, A. P., et al. Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein. Nature Biotechnology. 30 (9), 876-882 (2012).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Biology. 107, 183-206 (2005).
- Cao, J., Wong, C. K., Yin, Y., Lam, C. W. K. Activation of human bronchial epithelial cells by inflammatory cytokines IL-27 and TNF-alpha: implications for immunopathophysiology of airway inflammation. The Journal of Cellular Physiology. 223 (3), 788-797 (2010).
- Tsao, P. N., et al. Notch signaling controls the balance of ciliated and secretory cell fates in developing airways. Development. 136 (13), 2297-2307 (2009).
- Laoukili, J., et al. IL-13 alters mucociliary differentiation and ciliary beating of human respiratory epithelial cells. The Journal of Clinical Investigation. 108 (12), 1817-1824 (2001).
- Mertens, T. C. J., et al. Cigarette smoke differentially affects IL-13-induced gene expression in human airway epithelial cells. Physiological Reports. 5 (13), e13347 (2017).
- Zarcone, M. C., et al. Effect of diesel exhaust generated by a city bus engine on stress responses and innate immunity in primary bronchial epithelial cell cultures. Toxicology in Vitro. 48, 221-231 (2018).
- vander Does, A. M., et al. Early transcriptional responses of bronchial epithelial cells to whole cigarette smoke mirror those of in-vivo exposed human bronchial mucosa. Respiratory Research. 23 (1), 227 (2022).
- Wang, Y., Ninaber, D. K., van Schadewijk, A., Hiemstra, P. S. Tiotropium and fluticasone inhibit rhinovirus-induced mucin production via multiple mechanisms in differentiated airway epithelial cells. Frontiers in Cellular and Infection Microbiology. 10, 278 (2020).
- Ronaghan, N. J., et al. M1-like, but not M0- or M2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), 0276013 (2022).
- Gindele, J. A., et al. Opposing effects of in vitro differentiated macrophages sub-type on epithelial wound healing. PLoS One. 12 (9), e0184386 (2017).
- van Riet, S., et al. Modulation of airway epithelial innate immunity and wound repair by M(GM-CSF) and M(M-CSF) macrophages. Journal of Innate Immunity. 12 (5), 410-421 (2020).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Stucki, A. O., et al. A lung-on-a-chip array with an integrated bio-inspired respiration mechanism. Lab on a Chip. 15 (5), 1302-1310 (2015).
- Peters-Hall, J. R., et al. Long-term culture and cloning of primary human bronchial basal cells that maintain multipotent differentiation capacity and CFTR channel function. American Journal of Physiology. Lung Cellular and Molecular Physiology. 315 (2), L313-L327 (2018).
- Bartman, C. M., Stelzig, K. E., Linden, D. R., Prakash, Y. S., Chiarella, S. E. Passive siRNA transfection method for gene knockdown in air-liquid interface airway epithelial cell cultures. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), L280-L286 (2021).
- Koh, K. D., et al. Efficient RNP-directed human gene targeting reveals SPDEF is required for IL-13-induced mucostasis. American Journal of Respiratory Cell and Molecular Biology. 62 (3), 373-381 (2020).
- Bhargava, N., et al. Development of an efficient single-cell cloning and expansion strategy for genome edited induced pluripotent stem cells. Molecular Biology Reports. 49 (8), 7887-7898 (2022).
- Angelopoulou, A., Papaspyropoulos, A., Papantonis, A., Gorgoulis, V. G. CRISPR-Cas9-mediated induction of large chromosomal inversions in human bronchial epithelial cells. STAR Protocols. 3 (2), 101257 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır