Method Article
اضطراب الحاجز الدموي للحبل الشوكي باستخدام الموجات فوق الصوتية المركزة منخفضة الكثافة في نموذج الفئران
In This Article
Summary
يمكن تحقيق اضطراب حاجز الحبل الشوكي الدموي (BSCB) بنجاح من خلال إعطاء الفقاعات الدقيقة عن طريق الوريد وتطبيق الموجات فوق الصوتية المركزة منخفضة الكثافة (LIFU). يوضح هذا البروتوكول تفاصيل فتح BSCB باستخدام LIFU في نموذج القوارض ، بما في ذلك إعداد المعدات ، وحقن الفقاعات الدقيقة ، وتوطين الهدف ، وتصور اضطراب BSCB.
Abstract
تستخدم الموجات فوق الصوتية المركزة منخفضة الكثافة (LIFU) نبضات فوق صوتية بكثافة أقل من الموجات فوق الصوتية ويتم اختبارها كتقنية تعديل عصبي دقيقة وقابلة للعكس. على الرغم من استكشاف فتحة الحاجز الدموي الدماغي بوساطة ليفو (BBB) بالتفصيل ، لم يتم إنشاء تقنية موحدة لفتح حاجز الدم والحبل الشوكي (BSCB) حتى الآن. لذلك ، يقدم هذا البروتوكول طريقة لتعطيل BSCB الناجح باستخدام صوتنة LIFU في نموذج الفئران ، بما في ذلك أوصاف إعداد الحيوانات ، وإدارة الفقاعات الدقيقة ، واختيار الهدف وتوطينه ، بالإضافة إلى تصور وتأكيد اضطراب BSCB. النهج المذكور هنا مفيد بشكل خاص للباحثين الذين يحتاجون إلى طريقة سريعة وفعالة من حيث التكلفة لاختبار وتأكيد توطين الهدف وتعطيل BSCB الدقيق في نموذج حيواني صغير مع محول طاقة بالموجات فوق الصوتية المركز ، أو تقييم فعالية BSCB لمعلمات الصوتنة ، أو استكشاف تطبيقات LIFU في الحبل الشوكي ، مثل توصيل الدواء ، التعديل المناعي ، والتعديل العصبي. يوصى بتحسين هذا البروتوكول للاستخدام الفردي ، خاصة لتعزيز العمل قبل السريري والسريري والانتقالي في المستقبل.
Introduction
على غرار الحاجز الدموي الدماغي (BBB) ، ينظم حاجز الحبل الدموي الشوكي (BSCB) حركة المواد المذابة والخلايا ومكونات البلازما المنتشرة في الحمة الشوكية1. هذه الميزة الوقائية هي نتيجة لنظام متخصص من الخلايا البطانية المربوطة بإحكام وغير المبطنة للشعيرات الدموية الشوكية2. عادة ، فقط الجزيئات منخفضة الوزن والمحبة للدهون ذات الشحنة الموجبة يمكنها عبور كلا الحاجزين3. على الرغم من الدراسات التي تشير إلى أن BSCB لديه نفاذية أعلى قليلا من BBB ، فإن كلا الحاجزين يحدان من توصيل العلاجات إلى الجهاز العصبي المركزي4. تم تطوير العديد من الاستراتيجيات لزيادة نقل الأدوية عبر BSCB ، بما في ذلك تقنيات لزيادة الضغط الاسموزي في الشعيرات الدموية الشوكية ، وتطوير الأدوية التي تتفاعل مع مستقبلات براديكينين ، وإنشاء جسيمات نانوية وظيفية5.
يمكن أيضا تحقيق اضطراب BSCB عن طريق الحقن الوريدي للفقاعات الدقيقة (MBs) متبوعا بصوتنة الموجات فوق الصوتية المركزة منخفضة الكثافة (LIFU)6. يتسبب المجال الصوتي الناتج عن محول الموجات فوق الصوتية في تذبذبات MB ، والتي بدورها تطبق ضغطا على الجدار البطاني وتخفف التقاطعات الضيقة7. يخلق ارتخاء الوصلة الضيقة فجوات عابرة في الشعيرات الدموية ، مما يسمح للعلاجات بالتغلغل في حمة العمود الفقري (الشكل 1). يمكن أن تؤدي هذه العملية أيضا إلى إنشاء عمليات تعدد عبر بطانة الرحم ، وزيادة انتقال الخلايا ، وتقليل تنظيم ناقلات الكاسيت المرتبطة ب ATP ، مثل P-glycoprotein 8,9. الفائدة الرئيسية لهذه التقنية هي القدرة على تقليل الآثار غير المستهدفة عن طريق توجيه المنطقة البؤرية من صوتنة إلى موقع الاهتمام في الحبل الشوكي. حققت العديد من التجارب السريرية في فعالية فتحة BBB بوساطة LIFU لعلاج أمراض الجهاز العصبي المركزي ، بما في ذلك الأورام الدبقية والتصلب الجانبي الضموري ومرض الزهايمر ومرض باركنسون. على الرغم من أن اضطراب BSCB بوساطة LIFU لا يتميز على نطاق واسع باضطراب BBB بوساطة LIVU ، فقد أبلغت العديد من المجموعات عن اضطراب BSCB ناجح في نماذج القوارض والأرانب والخنازير10،11،12. بشكل عام ، يتزايد الاهتمام بهذه التقنية بسرعة ، خاصة كوسيلة قابلة للتطبيق لتوصيل الدواء.
في هذا البروتوكول ، يتم وصف تقنية لتعطيل BSCB بوساطة LIFU في نموذج الفئران. يتضمن الإجراء وصفا تفصيليا لإعداد الحيوانات ، وإعداد معدات LIFU ، وإدارة MB ، وتحديد موقع الهدف ، واستخراج الحبل الشوكي. يتم تقييم تأكيد التوطين المستهدف واضطراب BSCB عن طريق تسرب صبغة إيفانز الزرقاء (EBD) إلى الحبل الشوكي. EBD هو مركب غير سام يرتبط بألبومين المصل ويمكن التعرف عليه من خلال لونه الأزرق الغني بصريا والتألق الذاتي الأحمر تحت المجهر13.
تقدم الخطوات المذكورة هنا بديلا سريعا وغير مكلف لأنظمة LIFU التقليدية الموجهة بالموجات فوق الصوتية (الولايات المتحدة) أو الرنين المغناطيسي (MR). نتيجة لذلك ، تعد هذه الطريقة مفيدة للباحثين المهتمين بالاختبار السريع وتأكيد قدرات الاستهداف وتعطيل BSCB لمحول LIFU الخاص بهم قبل الحصول على معدات ومواد إضافية أو متابعة تطبيقات LIFU في الحبل الشوكي ، مثل توصيل الدواء والتعديل المناعي والتعديل العصبي.
Protocol
تمت الموافقة على جميع الدراسات على الحيوانات وأجريت وفقا للجنة رعاية واستخدام الحيوان المؤسسية بجامعة جونز هوبكنز (IACUC RA20M223). تم استخدام إناث الفئران البالغة Sprague-Dawley فقط (متوسط الوزن: 250 جم ؛ العمر: 11 أسبوعا) في هذه الدراسة.
1. تجميع الموجات فوق الصوتية المركزة منخفضة الكثافة والإعداد
- الحصول على نظام محول طاقة بالموجات فوق الصوتية المركزة بمواصفات كافية لتحقيق فتح BSCB في الفئران. تشمل المعلمات المقترحة من الأدبيات ترددا مركزيا بين 0.25-4 ميجاهرتز والقدرة على إنتاج ضغوط ذروة بين 0.2-2.1 ميجا باسكال 10،14،15،16،17. تأكد من أن النظام يتضمن معدات القيادة / التحكم ، والتي تتضمن على الأقل مولد موجة / إشارة ، ومحرك تردد لاسلكي (RF) / مضخم طاقة ، وشبكة مطابقة (الشكل 2 أ).
ملاحظة: يستخدم الإعداد الموصوف هنا محول طاقة متعدد العناصر متاحا تجاريا بتردد مركزي يبلغ 250 كيلو هرتز وقطر 64 مم (الشكل 2B). - قم بتثبيت حامل المسبار المطبوع 3D ومخروط الماء على محول الطاقة (الشكل 2C). تأكد من وجود مانع تسرب مانع لتسرب الماء بين المخروط ومحول الطاقة.
ملاحظة: تم تضمين مخروط مخصص وحامل مسبار مع محول الطاقة المستخدم في هذه التجربة. يتم تثبيت حامل المخروط والمسبار على محول الطاقة بمسامير ، والتي يتم توفيرها أيضا. - تعقيم غشاء بوليستر شفاف صوتيا بسمك 50 ميكرومتر وتثبيته في قاع مخروط الماء باستخدام شريط مطاطي.
- املأ مخروط الماء بالماء منزوع الغازات ومنزوع الأيونات باستخدام أنابيب المدخل والمخرج. احرص على تجنب فقاعات الهواء داخل المخروط ، لأنها يمكن أن تعطل الاقتران الصوتي بين محول الطاقة والهدف. يجب تضخيم غشاء البوليستر قليلا.
ملاحظة: لإزالة فقاعات الهواء من المخروط ، قم بتوجيه الفقاعات إلى صمام المخرج أثناء ملء المخروط بالماء من خلال صمام المدخل. في حالة وجود العديد من الفقاعات الصغيرة ، أغلق جميع الصمامات وقم بتدوير المخروط حتى تبقى فقاعة واحدة كبيرة. قم بتوجيه هذه الفقاعة إلى صمام المخرج واستأنف ملء المخروط. - قم بتوصيل معدات القيادة ، والتي تشمل مولد الموجة ومضخم محرك التردد اللاسلكي ، بمحول الطاقة. سيتصل كبل محول الطاقة بجانب الإخراج للشبكة المطابقة ، وسيتصل مولد الإشارة / مضخم الطاقة بجانب الإدخال في الشبكة المطابقة. يجب توصيل الكابلات برقم القناة المقابل لها (الشكل 2D-G).
ملاحظة: في النظام التجاري المستخدم في هذه الدراسة ، يعد مولد الموجة ومضخم محرك التردد اللاسلكي من مكونات خرج طاقة محول الطاقة (TPO) (الشكل 2D). - قم بتوصيل حامل المسبار بذراع التوضيع التجسيمي. قم بتثبيت ذراع التوضيع التجسيمي على مجموعة لوحة التثبيت. سيسمح ذلك بوضع محول الطاقة بدقة فوق القوارض أثناء الصوتنة.
2. إعداد الحيوان واستئصال الصفيحة الفقرية الجراحية
- تخدير الفئران بمزيج من الأيزوفلوران والهواء الطبي في غرفة تحريض متصلة بعلبة مرشح الفحم. اضبط معدل تدفق الغاز على 400 مل / دقيقة ومبخر الأيزوفلوران بين 1.5٪ -2.5٪ لتحريض التخدير. مقدار الوقت الذي يقضيه في الغرفة قبل التخدير الكامل متغير ، على الرغم من أنه يتراوح عادة من 3-6 دقائق.
- سجل وزن الفئران المخدرة وقم بإجراء اختبار قرصة إصبع القدم. إذا لوحظ الرجيج أو الحركة استجابة للقرص ، ضع الجرذ مرة أخرى داخل غرفة الحث لمدة 1 دقيقة إضافية وكرر اختبار قرصة إصبع القدم. كرر حسب الضرورة للتأكد من أن الجرذ مخدر بالكامل ويبقى مخدرا.
- ضع وسادة تدفئة ووسادة ماصة معقمة على لوحة التثبيت. ضع الجرذ على الوسادة الماصة ، ضع مرهما للعين ، وضع مقياس حرارة المستقيم لمراقبة درجة حرارة الجسم.
ملاحظة: خلال مدة العملية الجراحية ، يجب مراقبة درجة حرارة الفئران ومعدل ضربات القلب (من الناحية المثالية ، يجب أن يكون معدل ضربات القلب بين 330-480 نبضة في الدقيقة ودرجة الحرارة بين 35.9-37.5 درجة مئوية) 18،19. اضبط الإيزوفلوران أو وسادة التدفئة وفقا لذلك لمنع الوفاة المبكرة. يمكن ضبط وسادة التدفئة على درجة حرارة حوالي 37 درجة مئوية ويجب تشغيلها وإيقافها حسب الحاجة للحفاظ على درجة حرارة الجسم المثلى. - جس الضلع الأخير من الفئران ، والذي يرتبط بالعمود الفقري فيالفقرة الصدرية الثالثة عشرة (T13). استخدم ماكينة حلاقة كهربائية لحلق الفراء من السطح الظهري بين الضلع الأخير والرقبة. امسح الجلد المكشوف بشاش مغموس في 10٪ يودوبوفيدون.
- قم بإنشاء شق في خط الوسط باستخدام مقص القزحية وقم بتشريحه من خلال اللفافة حتى تنكشف العمليات الشائكة والصفيحة. قم بإزالة العظام باستخدام كماشة عظمية أوفست ومقص قزحية الشفرة بزاوية حتى يتعرض الحبل الشوكي20. يختلف طول استئصال الصفيحة الفقرية والشق بناء على عدد الأهداف المختلفة التي سيتم صوتنها. في هذه الدراسة ، تم إجراء استئصال الصفيحة الفقرية من ثلاثة مستويات باستخدام شق 3 سم.
ملاحظة: تجنب لمس الحبل الشوكي أو الضغط عليه أثناء إزالة العظام لمنع الإصابة. إذا كانت الأطراف الخلفية للفأر ترتعش أثناء استئصال الصفيحة الفقرية ، استخدام الكثير من القوة على الحبل أو جذور الأعصاب. - تأمين الفئران إلى لوحة التثبيت عن طريق تثبيت العمليات الشائكة المجاورة لاستئصال الصفيحة الفقرية. اسحب العمود الفقري مشدودا قليلا لتقليل الانحناء قبل قفل المشابك.
3. توطين الهدف باستخدام التوجيه بالليزر
- اضبط موضع محول الطاقة باستخدام ذراع التوضيع التجسيمي حتى يقع بالضبط فوق استئصال الصفيحة الفقرية (الشكل 3 أ). يسمح الإطار بالحركة في المحاور x و y و z ، بالإضافة إلى دوران 180 درجة في المستوى الرأسي ودوران 360 درجة في المستوى الأفقي.
- ثبت جهاز الليزر في قاع مخروط الماء وقم بخفضه حتى تظهر نقطة الليزر. اضبط الموضع الجانبي لمحول الطاقة حتى تصبح نقطة الليزر أعلى من الموقع المستهدف لتعطيل BSCB (الشكل 3B ، C).
ملاحظة: يتم تضمين ملف تصميم بمساعدة الكمبيوتر (CAD) لجهاز الليزر في القسم التكميلي (الشكل التكميلي 1). - قم بإزالة جهاز الليزر واملأ الفراغ بين المخروط والحبل الشوكي بهلام الموجات فوق الصوتية المنزوع الغازات (الشكل 3D). للحصول على أقصى اقتران ، تأكد من عدم وجود فقاعات هواء في الجل.
ملاحظة: في هذه الدراسة ، تم خفض محول الطاقة مع مخروط الماء الملصقة حتى يقع 1 سم فوق الحبل. نظرا لأن مخروط الماء كان طوله 30 مم ، كانت المسافة الإجمالية من محول الطاقة إلى السلك 40 مم. تم وضع مخروط الماء على بعد 1 سم من الحبل الشوكي لأن جلد الجرذ واللفافة والعضلات على جانبي الشق تمنع الاتصال المباشر بين طرف المخروط والحبل. قد يكون استخدام الأرقام الموجودة على المحور الصادي للذراع التجسيمي مفيدا في تتبع المسافة الرأسية التي يكون فيها المخروط على بعد 1 سم من الحبل ، خاصة وأن الجل سيجعل التأكيد البصري لمسافة المخروط من الحبل أمرا صعبا. - تعيين المعلمات لصوتنة على TPO. يمكن استخدام مجموعة من القيم لتحقيق اضطراب BSCB ناجح. للحصول على أقصى قدر من الطاقة ، اضبط تردد الصوتنة بالقرب من التردد المركزي للمحول. القيم المستخدمة في هذه الدراسة مدرجة في الجدول 1.
ملاحظة: تم تكييف المعلمات المدرجة هنا من العمل السابق مع LIFU ، بتردد مركزي يبلغ 500 كيلو هرتز ، ومدة انفجار نغمة 500 ميكرو ثانية ، ودورة عمل بنسبة 50٪ ، وأوقات صوتنة تبلغ 5 أو 10 دقائق لتعديل الحبل الشوكي للقوارض بأمان21. استنادا إلى الدراسات التي نجحت في تحقيق اضطراب BSCB ، فإن المعلمات الأخرى التي يمكن استخدامها هي الترددات المركزية بين 500 كيلو هرتز -1 ميجاهرتز ، وضغوط 0.2-2.1 ميجا باسكال ، وأطوال انفجار من 10-25 مللي ثانية ، وأوقات صوتنة 2-5 دقيقة6،10،11،22.
| البارامتر | قيمة |
| التردد (كيلو هرتز) | 250 |
| مسافة التركيز (مم) | 40 |
| ضغط الذروة الصوتية (MPa) | 0.47 |
| دورة العمل | 40% |
| طول الانفجار (مللي ثانية) | 400 |
| الفترة (الفترات) | 1 |
| وقت الصوتنة (دقيقة) | 5 |
الجدول 1: معلمات الصوتنة المستخدمة لتعطيل BSCB.
4. إدارة الفقاعات الدقيقة
- قم بإعداد حل MB وفقا للتعليمات المقدمة من الشركة المصنعة. تجنب إدخال الهواء في المحلول.
ملاحظة: تكون MBs هشة وتتجمع معا بالقرب من الجزء العلوي من القارورة / المحقنة إذا تركت ثابتة لبضع دقائق. رج القارورة والمحقنة بانتظام لمنع التشتت غير المتكافئ ل MBs. MBs لها عمر قصير. تحقق من دليل الشركة المصنعة لتحديد وقت انتهاء الصلاحية. - أدخل قسطرة وريد الذيل 22 جم واغسلها ب 0.2 مل من محلول ملحي هيبارين (500 وحدة دولية / مل) 23. لزيادة فرص نجاح قسطرة الوريد الذيلي ، اغمس الذيل في ماء دافئ وضع عاصبة في قاعدة الذيل لتكبير قطر الوريد.
ملاحظة: يمكن إجراء قسطرة الوريد الذيل قبل استئصال الصفيحة الفقرية الحيوانية وتحديد المواقع والاستهداف لتوفير وقت الدراسة. - حقن 1 مل / كجم من 3٪ EBD في القسطرة. دافق مع 0.2 مل من محلول ملحي هيبارين. سوف تتحول أطراف الفئران وعينيها إلى اللون الأزرق. تأكد من نجاح قسطرة الوريد الذيل عن طريق التحقق من تغير اللون الأزرق في الوريد الفقري الظهري للفأر (الشكل 4).
ملاحظة: يمكن حقن EBD جيدا قبل حقن MB ولن يؤثر على صوتنة. بالإضافة إلى ذلك ، نظرا لأن إدارة الغذاء والدواء (FDA) لم توافق حاليا على صوتنة الأدوية الموجودة بالفعل في النظام ، يمكن أيضا إعطاء EBD بعد صوتنة. سيؤدي ذلك إلى امتصاص أقل للصبغة ، ولكنه قد يكون أكثر صلة سريريا. - حقن 0.2 مل بلعة من MBs في القسطرة وتدفق مع 0.2 مل من محلول ملحي هيبارين. بدء صوتنة 1-2 دقيقة بعد حقن MBs. لا يجمع الإعداد المستخدم هنا ملاحظات صوتنة في الوقت الحقيقي.
ملاحظة: عادة ما تستخدم دراسات اضطراب BSCB تركيزا أعلى من MBs مما هو محدد للتصوير التشخيصي. تتضمن بعض تركيزات العلامات التجارية الشائعة لبروميد الميثيل المستخدمة في تعطيل BBB و BSCB في نماذج الفئران 0.02-0.2 مل / كجم و 200 ميكرولتر بولوز10،15،24،25.
5. استخراج الحبل الشوكي ومعالجة الأنسجة
- بعد الانتهاء من صوتنة ، perfise عبر القلب الفئران مع 100 مل من محلول ملحي الفوسفات البارد (PBS) حتى يصبح الدم واضحا تماما. يجب أن يتلاشى الكبد ، وهو لون أزرق غني بسبب الصبغة ، إلى اللون الأزرق البنيالفاتح 26.
ملاحظة: الغرض من التروية هو إزالة الدم الزائد من الأوعية الدموية للحبل الشوكي. نظرا لأن EBD يرتبط بالألبومين ، فإن هذا يزيل أيضا EBD الزائد. هذا يضمن أن أي EBD المكتشفة إما بصريا أو من خلال الفحص المجهري الفلوري في الحبل الشوكي هو من تسرب الصبغة إلى حمة العمود الفقري. - بيرفيوز عبر القلب مع 100 مل من البرد 4٪ بارافورمالدهيد (PFA). سوف ترتعش أطراف الفئران أثناء هذا التثبيت إذا تم ذلك جيدا. هذا التروية مع PFA القتل الرحيم للفئران.
- قم بإزالة الحبل الشوكي ووضعه في 4٪ PFA عند 4 درجات مئوية طوال الليل. استبدل PFA ب PBS في اليوم التالي.
6. تصور اضطراب BSCB
- عزل قسم 2 سم يحيط بموقع صوتنة باستخدام شفرة حلاقة. قسم القسم أسفل خط الوسط بالشفرة والمقطع إلى أقسام بسمك 10 ميكرومتر باستخدام ميكروتوم. لتصور المجال الساطع ، وصمة عار مع بقعة الهيماتوكسيلين يوزين (H&E).
ملاحظة: تم تلطيخ عينات الحبل الشوكي H&E الموضحة في هذه الدراسة بالهيماتوكسيلين لمدة 3 دقائق ويوزين لمدة 1 دقيقة27. - بالنسبة للفحص المجهري الفلوري ، قم بإزالة الشرائح التي تحتوي على أقسام الحبل الشوكي والبقع المضادة مع 25 ميكرولتر من 4 ′ ، 6-diamidino-2-phenylindole (DAPI) المذاب في وسط التركيب (0.5 ميكروغرام / مل). احتضان في 4 درجات مئوية لمدة 10 دقائق على الأقل. تجنب الضوء لمنع التبييض.
ملاحظة: يمكن استبدال إزالة البارافين باستخدام cryostat للحصول على أقسام مجمدة. - استخدم مجهر الفلورسنت لتصوير جميع الشرائح. التألق الذاتي EBD (الإثارة: 470 نانومتر و 540 نانومتر ؛ الانبعاث: 680 نانومتر) مرئي في القناة الحمراء ، بينما DAPI موجود في القناة الزرقاء. استخدم مجهرا ضوئيا لتصوير شرائح H&E .
ملاحظة: على الرغم من أن هذا البروتوكول وصف إجراء عدم البقاء على قيد الحياة ، فقد تم إجراؤه أيضا باستخدام تقنيات جراحية للبقاء على قيد الحياة. لجراحة البقاء على قيد الحياة ، قم بتطهير الجلد قبل الشق باستخدام 3 تطبيقات متناوبة من يودوبوفيدون وتطبيق البوبرينورفين تحت الجلد (0.05 مجم / كجم) قبل الجراحة. استمر في توفير البوبرينورفين تحت الجلد كل 12 ساعة على الأقل 3 أيام بعد الجراحة ، مع أيام إضافية إذا أظهر الفئران علامات الألم. في حالة حدوث إصابة في الحبل الشوكي ، قد تظهر الفئران احتباس البول أو مشية غير طبيعية. سيظهر هذا على شكل سحب أو تأخر حركة الأطراف الخلفية أو المثانة المنتفخة الملموسة. في حالة حدوث ذلك ، فإن الفئران المنزلية التي تحتوي على جل ماء مدعم غذائيا للطعام والترطيب وتعبر يدويا عن المثانة مرتين يوميا حتى يتم استرداد الإفراغ الانعكاسي. إذا كان هناك شلل كامل في الأطراف الخلفية أو ألم مستعصي ، القتل الرحيم للفئران.
النتائج
توضح هذه الورقة أن التطبيق المتزامن لصوتنة LIFU وإدارة MB هو تقنية فعالة لتعطيل BSCB الموضعي. يشار إلى افتتاح BSCB من خلال وجود تسرب EBD في حمة العمود الفقري. التغييرات واضحة بصريا وتحت المجهر الفلوري. يمكن رؤية الأوعية الدموية للحبل الشوكي بعد استئصال الصفيحة الفقرية وتظهر الوريد الشوكي الخلفي مع عدة أوعية أصغر تشع بشكل جانبي (الشكل 4 أ). يؤدي الحقن الوريدي ل EBD من خلال قسطرة الوريد الذيل إلى إثراء هذه الأوعية الدموية بصبغة زرقاء (الشكل 4B). هذه نقطة جيدة في الإجراء للتحقق من أن استئصال الصفيحة الفقرية لم يؤد إلى تمزق أي أوعية دموية في العمود الفقري ، لأن هذا من شأنه أن يؤدي إلى تجمع الدم الأزرق على الحبل السري. بعد الصوتنة ، يجب أن تصبح بقعة زرقاء مرئية فوق الموقع المستهدف ، مما يشير إلى تسرب EBD إلى الحمة البيضاء بسبب اضطراب BSCB (الشكل 4C). يختلف حجم هذه البقعة بناء على عدد من العوامل ، بما في ذلك حجم المنطقة البؤرية لمحول الطاقة ومقدار الوقت بعد الصوتنة. لزيادة فرص رؤية تسرب EBD ، ينبغي للمرء أن يطيل مقدار الوقت بين صوتنة واستخراج الحبل الشوكي.
على الرغم من أن نضح PFA ليس خطوة ضرورية قبل استخراج الحبل السري وتحليل الأنسجة اللاحق ، إلا أنه يزيل الدم من العينة ويزيد من التباين بين الحمة الشوكية البيضاء والمناطق الملطخة ب EBD الأزرق. تظهر جميع الفئران التي تلقت إدارة MB وصوتنة LIFU تسربا واضحا ل EBD في الحبل الشوكي ، في حين أن الضوابط السلبية التي تلقت MBs و EBD بدون صوتنة LIFU لا تفعل ذلك. الصور التمثيلية موضحة في الشكل 5. تكشف التخفيضات السهمية عبر الأنسجة أن تسرب EBD ليس سطحيا فحسب ، بل يمتد جيدا إلى الحبل نفسه. هذا متوقع ، لأن المنطقة البؤرية لمحول الطاقة المستخدم في هذه الدراسة أكبر من قطر الحبل الشوكي للفئران. في بعض الأحيان ، يمكن رؤية كميات صغيرة من النزف في الجروح السهمية. هذا يمكن أن يكون بسبب استئصال الصفيحة الفقرية أو صوتنة الموجات فوق الصوتية. إذا كان النزف قريبا من المحيط الظهري للحبل ، فمن المرجح أن يكون ذلك بسبب استئصال الصفيحة الفقرية.
لمزيد من التقييم لتسرب EBD ، تم تلطيخ أقسام الحبل الشوكي السهمي ب DAPI (علامة نووية) وتصويرها باستخدام مجهر الفلورسنت. أظهرت جميع الحبال التي تلقت صوتنة LIFU (n = 3) كثافة أكبر بكثير من التألق الذاتي EBD (p = 0.016) من الحبال التي لم تتلق صوتنة ، مع وجود شدة مماثلة من DAPI في كليهما (الشكل 6). كشف تحليل H&E كذلك عن عدم وجود تلف عصبي أو نزيف أو آفات تجويف موجودة في المواقع الصوتية ، مما يدعم سلامة هذا الإجراء. يتم عرض أمثلة على الحبال المصابة بسبب سوء التعامل الجراحي وصوتنة عالية الطاقة كمقارنة. يتم تصنيف النزف وتلف الأنسجة وآفات التجويف والفراغ المحتمل. على الرغم من أن مثال صوتنة عالية الطاقة لا يظهر نزيفا ، فقد تم الإبلاغ عن ذلك أيضا كتأثير لاضطراب الموجات فوق الصوتية.
علاوة على ذلك ، تم إجراء تحليل سلوكي على الفئران التي تلقت MBs و EBD و LIFU صوتنة. على الرغم من أن هذه الطريقة لا تستبعد تماما تلف الأنسجة ، إلا أنها تختبر ما إذا كان العجز الحركي قد حدث بسبب هذا الإجراء. تم تسجيل الفئران وهي تمشي في قفص لمدة 5 دقائق كل يوم على مدار 5 أيام ، وتم تصنيف الوظيفة الحركية بناء على مقياس باسو بيتي بريسناهان الحركي (ملف الفيديو التكميلي 1). حصلت جميع الفئران (ن = 5) على أعلى الدرجات قبل صوتنة ، ما بعد صوتنة ، وكل يوم من فترة البقاء على قيد الحياة (الشكل 7).
أخيرا ، تم قياس التأثيرات الحرارية لمعلمات الصوتنة المستخدمة في هذه الدراسة باستخدام عينتين من الحبل الشوكي للفئران خارج الجسم الحي ومسبار مقياس حرارة رقمي مع طرف رفيع يتم إدخاله في الحبل. تم تتبع درجة حرارة عينات الحبل الشوكي لمدة 5 دقائق قبل وأثناء وبعد صوتنة ، لمدة 15 دقيقة. شوهدت تغييرات طفيفة في درجة الحرارة. في الواقع ، كان هناك تغيير ≤1.3 درجة مئوية بسبب صوتنة في كلتا العينتين ، مما يقلل من احتمال إصابة ارتفاع الحرارة نتيجة لصوتنة (الشكل 8).
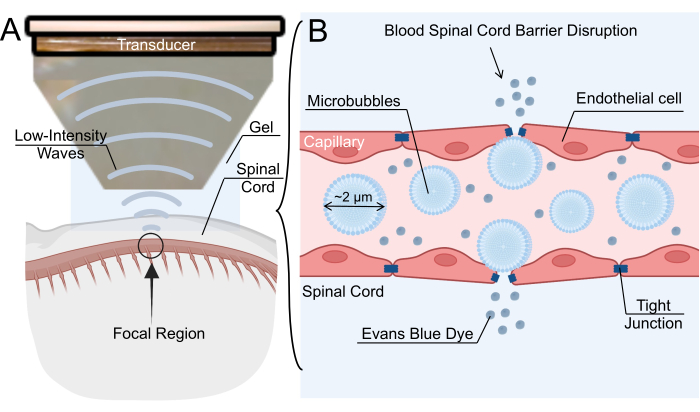
الشكل 1: آلية فتح الحاجز الدموي للحبل الشوكي المركزة منخفضة الكثافة بوساطة الموجات فوق الصوتية. (أ) نظرة عامة تخطيطية على صوتنة الموجات فوق الصوتية المركزة منخفضة الكثافة (LIFU) للحبل الشوكي للفئران. (ب) آلية فتح حاجز الحبل الشوكي الدموي (BSCB) عبر صوتنة LIFU للفقاعات الدقيقة الوريدية (MBs). تتذبذب MBs استجابة ل LIFU ، مما يتسبب في اتساع الوصلات الضيقة بين الخلايا البطانية. يسمح هذا الاضطراب في BSCB بتسرب الجسيمات النانوية أو الأدوية العلاجية أو صبغة إيفانز الزرقاء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: إعداد وتوصيل منضدة الموجات فوق الصوتية المركزة منخفضة الكثافة. (أ) تمثيل تخطيطي يوضح مكونات الموجات فوق الصوتية المركزة النموذجية. (ب) صورة عامة لإعداد الموجات فوق الصوتية المركزة ، بما في ذلك: 1. خرج طاقة محول الطاقة (TPO) ، 2. شبكة مطابقة ، 3. محول LIFU ، 4. أداة التجسيم ، 5. المشابك المتنقلة. (ج) محول الطاقة ، بما في ذلك: 1. حامل التحقيق ، 2. محول حلقة ، 3. مخروط الماء ، 4. أنبوب مدخل الماء ، 5. أنبوب مخرج المياه ، 6. غشاء مؤمن بشريط مطاطي. (د) الجزء الأمامي من TPO ، بما في ذلك: 1. العلبة المحمية RF ، 2. لوحة عرض أمامية حساسة للمس مع قائمة قابلة للتعديل ، 3. مقبض دوار لتعديل المعلمة ، 4. مفتاح بدء / إيقاف الإخراج. (ه) الجزء الخلفي من TPO ، بما في ذلك: 1. موصلات إخراج القناة ، 2. الأرض ، 3. منفذ إدخال USB للتحكم في البرامج ، 4. الزناد الداخلي ، 5. مزامنة موصل الإخراج ، 6. مقبس إدخال الطاقة وإمداداتها ، 7. تشغيل / إيقاف مفتاح الطاقة. (و) مطابقة خرج الشبكة، مع مطابقة الأسلاك لأرقام القنوات. (ز) مطابقة مدخلات XDR للشبكة ، مع مطابقة الأسلاك لأرقام القنوات يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
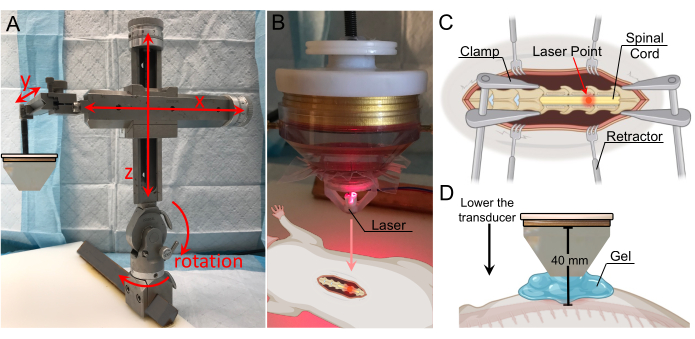
الشكل 3: توطين الهدف باستخدام التوجيه بالليزر . (أ) ذراع التوجيه التجسيمي مع نطاق الحركة في جميع المحاور الثلاثة وقدرات الدوران. يتم لصقه على لوحة التثبيت أدناه. (ب) جهاز ليزر لتحديد المنطقة البؤرية. يتم وضع الليزر على طرف محول الطاقة ويتماشى مع المنطقة البؤرية. (ج) رسم توضيحي يوضح الليزر الموجود على الحبل الشوكي المكشوف، والذي يشير إلى أن المنطقة البؤرية للتجسيم موجهة الآن إلى هذا الموقع. (د) يخفض الترجام حتى يقع طرف المخروط على ارتفاع 1 سم فوق السلك، وتمتلئ الفجوة بالهلام لضمان أقصى قدر من الاقتران. المسافة من محول الطاقة إلى الحبل الشوكي هي 40 مم (المسافة البؤرية). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
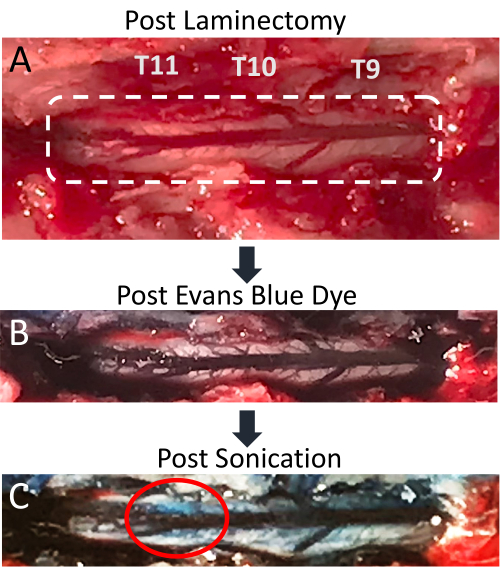
الشكل 4: تسرب صبغة إيفانز الزرقاء في الحبل الشوكي بعد الصوتنة . (أ) صورة لشق استئصال الصفيحة الفقرية للفئران T9-T11 ، مع ظهور الحبل الشوكي المكشوف والوريد الظهري الخلفي بوضوح. (ب) تصبح الأنسجة المحيطة والأوعية الدموية للحبل الشوكي زرقاء بعد الحقن الوريدي لصبغة إيفانز الزرقاء (EBD). (ج) تسرب EBD إلى حمة الحبل الشوكي في موقع الصوتنة ، مما يشير إلى حدوث اضطراب BSCB. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: استخراج الحبل الشوكي وتصور فتحة BSCB بعد التروية. (أ) استئصال الحبل الشوكي من الفئران الضابطة دون علاج LIFU. تلقى هذا الجرذ فقط MBs و EBD. تظهر شريحة منتصف السهمي من الحبل المدمج في البارافين في الجزء الداخلي ، ولا يظهر أي تسرب EBD. (ب) استئصال الحبل الشوكي من الفئران مع علاج LIFU. تلقى هذا الجرذ أيضا MBs و EBD. عمود تسرب EBD مرئي وموضعي في المنطقة الصوتية. تظهر شريحة منتصف السهمي من الحبل المضمن في البارافين في الجزء الداخلي ، مع سهم يشير إلى تركيز EBD المرئي داخل الموقع الصوتي. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
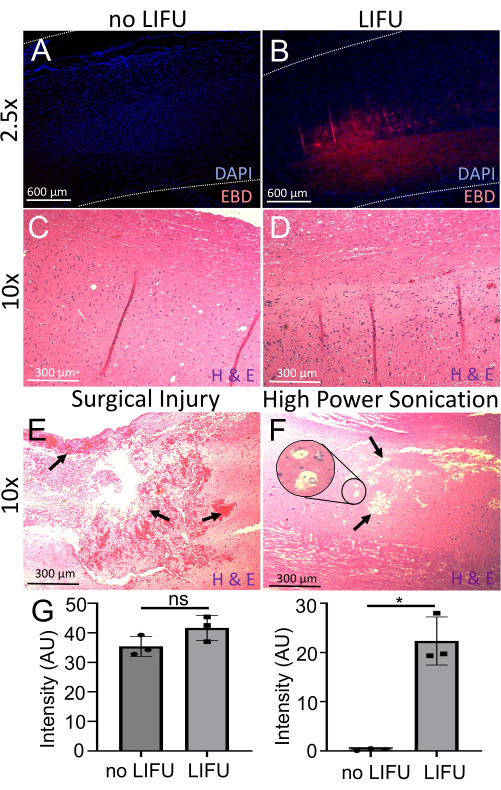
الشكل 6: الكشف عن فتحة BSCB وتقييمها. (أ) الحبل الشوكي ملطخ ب DAPI (علامة نووية، زرقاء). الحد الأدنى من التألق الذاتي EBD (أحمر) مرئي. هذا الجرذ لم يتلق ليفو. ب: الحبل الشوكي ملطخ ب DAPI (علامة نووية، زرقاء). التألق الذاتي الموضعي EBD (أحمر) في الموقع المستهدف الصوتي مرئي. تلقى هذا الجرذ LIFU و MBs. (C) الحبل الشوكي للفأر بدون LIFU ملطخ بالهيماتوكسيلين (صبغة الحمض النووي) ويوزين (صبغة بروتين غير محددة) (H&E). لا يوجد تلف عصبي أو نزيف أو آفات تجويف مرئية. د: الحبل الشوكي للفأر المصاب ب LIFU الملون ب H&E . لا يوجد تلف عصبي أو نزيف أو آفات تجويف مرئية. (ه) الحبل الشوكي لفأر مصاب بجروح جراحية ملطخة ب H&E. تشير الأسهم إلى نزيف وتلف كبير في الأنسجة. (F) الحبل الشوكي للفأر مع تلف بسبب صوتنة عالية الطاقة ملطخة ب H&E. تشير الأسهم إلى آفات التجويف ، ويظهر الجزء الداخلي فراغا محتملا. (G) الرسوم البيانية الشريطية التي توضح شدة DAPI و EBD في الحبل الشوكي للفئران مع صوتنة LIFU وبدونها. هناك كثافة EBD أكبر بكثير في الحبل الشوكي LIFU بالمقارنة مع السيطرة السلبية (p = 0.016) ، على الرغم من شدة DAPI مماثلة (p > 0.05). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
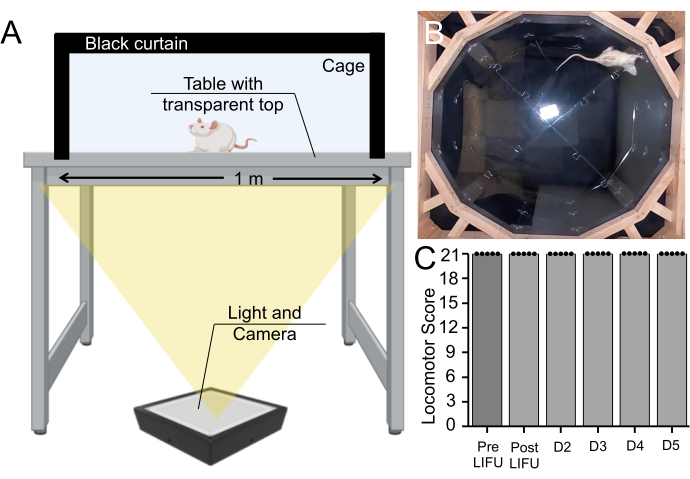
الشكل 7: الفحص السلوكي قبل وبعد الصوتنة . (أ) إعداد جهاز باسو ، بيتي ، بريسناهان ، حيث تم تسجيل الفئران وهي تمشي لمدة 5 دقائق من الأسفل. (ب) صورة ثابتة من فيديو مسجل. تم استخدام هذا الفيديو لتقييم التنسيق الحركي للفأر ومشيته على مقياس باسو وبيتي وبريسناهان. (C) Boxplot (ن = 5) لا يظهر أي تغيير في الدرجات الحركية قبل الصوتنة أو ما بعد الصوتنة أو خلال فترة البقاء على قيد الحياة لمدة 5 أيام في الفئران التي تلقت MBs وعلاج LIFU (p > 0.05). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: تحليل درجة الحرارة باستخدام الأحبال الشوكية خارج الجسم الحي. رسم بياني يصور التغيرات في درجات الحرارة في عينتين من الحبل الشوكي خارج الجسم الحي لمدة 5 دقائق قبل وأثناء وبعد الصوتنة. يتم سرد المعلمات المستخدمة لصوتنة في الجدول 1. بالنسبة للعينة 1 ، كان متوسط درجات الحرارة قبل وأثناء وبعد الصوتنة 21.9 درجة مئوية ± 0.1 درجة مئوية و 22.1 درجة مئوية ± 0.1 درجة مئوية و 22.0 درجة مئوية ± 0.1 درجة مئوية على التوالي. بالنسبة للعينة 2 ، كانت درجات الحرارة قبل وأثناء وبعد الصوتنة 21.9 درجة مئوية ± 0.1 درجة مئوية و 22.5 درجة مئوية ± 0.3 درجة مئوية و 22.4 درجة مئوية ± 0.2 درجة مئوية على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: ملف CAD لجهاز الاستهداف بالليزر. ( أ) منظر لجهاز الليزر من الأسفل. يمكن وضع أي ليزر داخل الفتحة المركزية في المنتصف. ب: منظر جانبي لجهاز الليزر. ج: أبعاد جهاز الليزر، بوحدة بالبوصة. الرجاء الضغط هنا لتنزيل هذا الملف.
ملف فيديو تكميلي 1: فيديو لفأر يمشي في جهاز باسو وبيتي وبريسناهان. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
هنا ، يتم وصف المعدات والخطوات المطلوبة لتعطيل BSCB الفعال والمستهدف باستخدام الموجات فوق الصوتية المركزة منخفضة الكثافة (LIFU) جنبا إلى جنب مع إدارة الفقاعات الدقيقة (MB). هذا البروتوكول مرن ويمكن تحسينه للاستخدام الفردي مع محولات الطاقة ذات المواصفات المختلفة. تعتمد التقنيات الأخرى لتعطيل BSCB بوساطة LIFU على استخدام أنظمة التصوير بالرنين المغناطيسي (MRI) الموجهة لتحديد موقع الهدف ، وهو مورد مكلف16. تكمن مزايا التقنية المعروضة هنا في التأكيد البصري السريع في الوقت الفعلي لتعطيل BSCB وسهولة الاستهداف بسبب الطبيعة المفتوحة للإجراء. علاوة على ذلك ، فإن جهاز الليزر سهل الاستخدام والبناء ، ويتم تضمين ملف CAD في القسم التكميلي. نتيجة لذلك ، يمكن للباحثين المهتمين بإجراء اختبارات أولية على قدرات الاستهداف لمحول LIFU الخاص بهم في نموذج حيواني صغير استخدام هذا البروتوكول كأداة لتأكيد تحديد موقع المنطقة البؤرية بسرعة على موقع مهم. يمكن أيضا استخدام هذه التقنية من قبل المختبرات التي بدأت في دراسة التطبيقات السريرية للليفو ، مثل توصيل الأدوية ، قبل الاستثمار في طرق توجيه أكثر تعقيدا مثل أنظمة الولايات المتحدة أو التصوير بالرنين المغناطيسي. في الوقت الحالي ، تقدم الطرائق الموجهة من الولايات المتحدة مسارا واعدا وفعالا من حيث التكلفة مقارنة بأنظمة MR ، على الرغم من أن الأخيرة تظهر بشكل متكرر في الأدبيات.
هناك العديد من الخطوات الحاسمة في هذا الإجراء التي يجب تنفيذها بعناية لضمان تعطيل BSCB بنجاح. من الضروري تجنب الضغط غير الضروري على الحبل الشوكي أثناء استئصال الصفيحة الفقرية الجراحي. الكثير من التلاعب الجسدي للحبل يزيد من احتمال تلف BSCB. يظهر التلف كبقعة بنية داكنة داخل الحبل بعد الاستخراج بسبب النزيف وزيادة تسرب EBD. علاوة على ذلك ، يجب ضمان أقصى اقتران بين محول الطاقة والحبل الشوكي المكشوف. نتيجة لذلك ، يجب توخي الحذر لإزالة الفقاعات من مخروط الماء وهلام الموجات فوق الصوتية. يجب ألا تكون هناك فجوات بين قاع مخروط الماء والسلك لضمان النقل الكامل للموجة الصوتية. أثناء قسطرة الوريد الخلفي ، يجب على المرء تجنب تمرير الهواء عن طريق الخطأ مع محلول ملحي للهيبارين أو EBD أو MB. يزيد حقن الهواء بشكل كبير من فرصة حدوث انسداد رئوي يؤدي إلى وفاة القوارض قبل الانتهاء من الإجراء28.
من المشكلات الشائعة التي قد تتم مواجهتها أثناء هذا الإجراء فشل حقن EBD الناجح. بالنسبة للأفراد الذين لديهم خبرة قليلة في قسطرة الوريد الذيلي ، فإن تنفيذ هذه الخطوة قبل استئصال الصفيحة الفقرية للحيوانات أو تحديد المواقع أو الاستهداف سيوفر الوقت. يمكن أيضا حقن EBD جيدا قبل حقن MB دون التأثير على صوتنة. سيساعد استخدام العاصبة وحمام الماء الدافئ المقترح في هذا البروتوكول على توسيع أوردة الذيل وزيادة معدل النجاح. علاوة على ذلك ، يقلل جفاف الفئران من احتمالية وضع القسطرة الصحيح. قد يساعد الحقن بالمحلول الملحي داخل الصفاق قبل 10-15 دقيقة من قسطرة الوريد الذيل. أثناء القسطرة ، يجب أن يبدأ المرء 2 فوق نهاية الذيل ويتحرك في اتجاه ذيلي إلى الجمجمة. التحرك في الاتجاه المعاكس يقلل من احتمال النجاح بسبب انهيار الوريد المحتمل أو النزيف.
تحد شائع آخر ينطوي على عدم وجود تسرب EBD على الرغم من صوتنة. قد يشير هذا إلى أن المعلمات المستخدمة في الصوتنة غير كافية لتعطيل BSCB. على سبيل المثال ، إذا تم تعيين تردد الصوتنة على قيمة تختلف اختلافا كبيرا عن التردد المركزي لمحول الطاقة ، فستكون قوة الصوتنة منخفضة جدا بحيث لا تتذبذب ميغا بايت وتتسبب في تخفيف الوصلة الضيقة. علاوة على ذلك ، كلما زاد عدد الواجهات بين محول الطاقة والحبل (على سبيل المثال ، مخروط الماء ، الغشاء ، الهلام ، فقاعات الهواء في الماء / الهلام) ، كلما انخفضت كثافة الصوتنة الحقيقية عند الهدف. إن تقليل هذه الواجهات ، مثل استخدام هلام منزوع الغازات وإزالة الفقاعات تماما داخل المخروط ، سيساعد على نقل الإمكانات الكاملة للصوتنة. يشجع البروتوكول أيضا على زيادة الوقت بين الصوتنة والتروية لإتاحة المزيد من الوقت لتسرب EBD في حمة العمود الفقري. على الرغم من أن اضطراب BSCB هو إجراء عابر ، إلا أن الفجوات موجودة لعدة ساعات قبل الإغلاق. يزيد وقت الانتظار الطويل من التعرض للأيزوفلوران ، ولكنه يؤدي أيضا إلى زيادة تسرب EBD في الحبل. بدلا من ذلك ، قد يكون تسرب EBD موجودا على الرغم من عدم وجود صوتنة مع LIFU. لاستكشاف هذه المشكلة وإصلاحها ، يجب توخي الحذر أثناء استئصال الصفيحة الفقرية لمنع أي تلف عرضي ل BSCB. تشمل الحلول المحتملة رفع العمود الفقري للفئران أثناء التثبيت لزيادة مقدار المسافة بين الصفيحة والحبل السري ، بالإضافة إلى استئصال الصفيحة الفقرية الأقصر. يقلل التروية الشاملة ل PFA أيضا من تلطيخ الخلفية عن طريق إزالة الدم المخصب ب EBD من الأوعية الدموية داخل الحبل الشوكي. أثناء التروية عبر القلب ، يجب توخي الحذر لمنع التمزق العرضي للقلب ، مما قد يؤدي إلى تسرب PBS أو PFA.
من المهم ملاحظة أن هذه الدراسة تمثل تجربة مركز واحد لتعطيل BSCB بوساطة LIFU. علاوة على ذلك ، لا يختبر هذا البروتوكول أو يحسن معلمات طاقة الصوتنة المختلفة وتركيزات MB. نتيجة لذلك ، يتم تشجيع الباحثين على التحقيق في المعلمات والتركيزات المختلفة عند إجراء هذه التقنية لتحسين توطين الهدف وتعطيل BSCB لاحتياجاتهم البحثية الخاصة ، خاصة إذا كانت النتائج الأولية تنتج أي آثار ضارة. يمكن للمجموعات التي ترغب في عدم رؤية أي تغيرات في درجات الحرارة ، على سبيل المثال ، اختبار معلمات مختلفة حتى تجد مجموعة تفي بهذا المعيار وتحقق اضطرابا كافيا في BSCB. علاوة على ذلك ، يمكن إجراء تجارب إضافية لتأكيد سلامة هذه التقنية. على سبيل المثال ، يمكن زيادة أحجام العينات ، ويمكن تمديد فترة البقاء على قيد الحياة ، ويمكن إجراء دراسات تحليل كهربية العضل / المشي. للبقاء على قيد الحياة لفترة أطول ، من المهم أن تضع في اعتبارك أن بعض الدراسات تظهر أن الجرعات العالية من EBD يمكن أن تسبب أحيانا سمية جهازية مزمنة ، لذلك قد تكون الجرعة الأقل حكيمة29.
هناك قيد آخر لهذا الإجراء وهو الطبيعة الغازية لاستئصال الصفيحة الفقرية (وهو أمر مطلوب لأي تقنية تستخدم LIFU لفتح BSCB لأن الموجات فوق الصوتية لا يمكنها اختراق العظام). يمكن تقليل الطبيعة الغازية لهذا الإجراء عن طريق الحد من طول استئصال الصفيحة الفقرية. يمكن أن يؤدي إجراء استئصال الصفيحة الفقرية في الفقرات الصدرية العلوية ، والتي تكون أقصر وأرق ، إلى تقليل الوقت اللازم لاستئصال الصفيحة الفقرية إلى أقل من 10 دقائق. نظرا للطبيعة الهشة ل MBs ، فضلا عن عمر النصف القصير ، فإن الوقت محدود خلال هذا البروتوكول. يجب أن يحدث حقن MBs قبل 1-2 دقيقة من العلاج باستخدام LIFU ، ويجب إعطاء MBs جديدة قبل كل صوتنة إذا تم إجراء علاجات LIFU متعددة. بالنسبة للتجارب التي تنطوي على تعطيل BSCB للعديد من الفئران ، قد يلزم تحضير العديد من قوارير MB. نظرا لأن الفقاعات الدقيقة باهظة الثمن ، يفضل تغيير سير العمل الجراحي لتقليل الوقت بين الصوتيات للحفاظ على عدد ميغابايت المستخدمة.
التقنية الموصوفة هنا هي في المقام الأول للاستخدام كبروتوكول بحث. على الرغم من أن جهاز الاستهداف بالليزر لن يحل محل طرق الاستهداف التقليدية في جميع الإعدادات السريرية ، إلا أنه قد يكون مفيدا في حالات أخرى. بالنسبة للجراحات غير الباضعة ، يمكن استخدام طرق التصوير بالرنين المغناطيسي التقليدية بشكل موثوق لاستهداف30. بالنسبة للعمليات الجراحية الغازية التي تتضمن استئصال الصفيحة الفقرية التي يتم إجراؤها ، يمكن استخدام جهاز نقطة الليزر الموصوف في هذا البروتوكول لتحديد موقع مركز المنطقة البؤرية للصوتنة بسرعة على منطقة معينة (على سبيل المثال ، ورم أو موقع إصابة الحبل الشوكي) لأغراض توصيل الدواء أو العلاج المناعي أثناء استكمال أي إرشادات MR قد تحدث.
بشكل عام ، يصف هذا البروتوكول تقنية فعالة وناجحة لتعطيل BSCB ويتضمن العديد من الخيارات لتأكيد فتح BSCB ، سواء في الوقت الفعلي أو بعد المعالجة. مع عمل BSCB كحاجز للدخول إلى حمة الحبل الشوكي ، يعد تعطيل BSCB طريقة ممكنة لتحسين تقديم العلاجات. على سبيل المثال ، استخدم Weber-Adrian et al. LIFU بتردد 1.114 ميجاهرتز وطول انفجار 10 مللي ثانية للتوسط في توصيل الجينات إلى العمود الفقري العنقي6. وبالمثل ، أظهر سميث وآخرون أن LIFU بتردد 580 كيلو هرتز ، ومتوسط ضغوط الذروة الصوتية حوالي 0.46 ميجا باسكال ، وطول انفجار يبلغ 10 مللي ثانية يمكن أن يساعد في توصيل جسم مضاد وحيد النسيلة ، تراستوزوماب ، إلى الحبل الشوكي في نموذج القوارض من النقائل leptomeningeal10. ركزت معظم الدراسات على استخدام LIFU ، بدلا من HIFU ، نظرا لقدرة LIFU على اختراق BSCB بشكل عابر مع تجنب تلف الأنسجة الأساسية. عادة ، يستخدم LIFU شدة تتراوح بين 0.125-3 واط / سم 2 ، بينما يستخدم HIFU شدة من 100-10000 واط / سم2 أو أعلى31. نتيجة لذلك ، يمارس HIFU آثاره بشكل أساسي من خلال تسخين الأنسجة ، بينما يعمل LIFU ، مع الإدارة المشتركة ل MBs ، من خلال تأثيرات التجويف الميكانيكية. يمكن أن يؤدي الإعطاء المتزامن للعلاجات مع MBs إلى زيادة تسرب الدواء إلى حمة العمود الفقري ، بالإضافة إلى إمكانية تحميل MBs بالدواء وتحلل MBs بالموجات فوق الصوتية لتوصيل الدواء المستهدف.
يمكن تغيير معلمات الصوتنة وتركيز MB ونوع محول الطاقة المستخدم في هذه الدراسة بناء على الاحتياجات التجريبية. على سبيل المثال ، قد يكون محول الطاقة ذو المنطقة البؤرية الأصغر مفضلا للتجارب التي تتطلب قدرا أكبر من التحكم في الاستهداف الموضعي ، بينما يمكن استخدام محول طاقة ذي طاقة أعلى للتجارب التي تتطلب تعطيلا قويا في فترة زمنية أقصر. نظرا للمرونة التي يوفرها هذا البروتوكول ، هناك إمكانات كبيرة للاستخدام في الأبحاث قبل السريرية والسريرية والانتقالية.
Disclosures
يعلن المؤلفون أن البحث قد أجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح. أمير منباشي يدرس ويقدم الاستشارات لشركة BK Medical (GE Healthcare) ، و Neurosonics Medical ، وهو مخترع في عدد من تقنيات FUS التي تنتظر الحصول على براءة اختراع. بيتي تايلر لديها تمويل بحثي من المعاهد الوطنية للصحة وهي شريك في ملكية تسريع العلاجات المركبة (بما في ذلك الأسهم أو الخيارات). قامت شركة Ashvattha Therapeutics Inc. أيضا بترخيص إحدى براءات الاختراع الخاصة بها وهي أحد المساهمين في شركة Peabody Pharmaceuticals. يتلقى نيكولاس ثيودور إتاوات من Globus Medical ويمتلك أسهما فيها. وهو مستشار لشركة Globus Medical وعمل في المجلس الاستشاري العلمي / مكتب آخر لشركة Globus Medical. المؤلفون الباقون ليس لديهم تضارب في المصالح للكشف عنه.
Acknowledgements
بدعم من T32GM136577 (D.R.) ؛ N660012024075 (ن. ت. ، ن. ف. ت. ، أ. م. ، ك. ك. ل.) ؛ R01 HL139158-01A1 وR01 HL071568-15 (N.V.T.) ؛ برنامج جونز هوبكنز ICTR لعلماء البحوث السريرية (KL2) (AM). العديد من الشخصيات التي تم إنشاؤها مع BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% Heparinized Sodium Chloride | Baxter | FKB0953G | Flush tail vein catheter with heparinized saline to prevent clotting. |
| 100 mL Luer Lock Tip Syringe (2) | Wilburn Medical | WUSA/120 | One syringe can be used to inject PBS and one for PFA (during transcardial perfusion) |
| 1x Phosphate buffered saline (PBS) | Thermo Scientific | 10010001 | For transcardial perfusion. |
| 22 G catheter | Med Vet International | 50-209-1694 | Use to place a tail vein catheter. |
| 97% Isoflurane | Thermo Scientific Chemicals | 247-897-7 | While rat is under isoflurane, be careful not to administer too much. A high dose can euthanize the rat. |
| Betadine 7.5% | Purdue Products | 4677 | |
| Class A clear threaded glass vial | Fisherbrand | 14-955-314 | Use to store spinal cord extraction. |
| Digital balance scale | Kent Scientific | SCL-4000 | |
| Electric razor | Wahl Home Products | 79449-200 | Shave fur off skin at incision site before surgery |
| Eosin-Y with Phloxine | Epredia | 71304 | |
| Evans blue dye | MP Biomedicals | 02151108-CF | Although it is non-toxic, it will stain skin blue if direct contact occurs. |
| Fixation Plate Assembly with 0.5 mm Forceps | PSI Impactors | 7001-2 | Affix the stereotactic arm to this frame |
| Gauze | Fisherbrand | 13-761-52 | |
| Heating pad | Kent Scientific | RT-0515 | |
| Hematoxylin | Epredia | 7211 | |
| Iris Scissors with Angled Blades | ProDentUSA | 12-15315 | |
| Isoflurane induction system | Kent Scientific | SOMNO-RATKIT | |
| Laser targetting apparatus | NA | custom | CAD design file provided in supplemental section. Simply place a laser inside the apparatus created from the file. |
| Lubricating eye ointment | Systane | N/A | |
| Luer Lock 3-Way Stopcock | Sigma | SAS7521-10EA | Can use to fill water cone through inlet valve |
| Lumason microbubbles kit | Bracco | 0270-7099-16 | |
| Microscope cover glass | Fisherbrand | 12-545J | |
| Microscope slides | Fisherbrand | 12-550-15 | |
| Microtome | Epredia | 23-900-671 | |
| Mounting medium with 4',6-diamidino-2-phenylindole (DAPI) | Vector Laboratories | H-2000-2 | |
| Mylar membrane | Chemplex | 3016 | Can cut membrane to appropriate size if too large for cone |
| NeuroFUS 2.52" diameter 250 kHz transducer | Sonic Concepts | CTX-250 | Transducer system includes custom water cone and probe holder |
| NeuroFUS PRO v2.0 system | Sonic Concepts | NFS102v2 | Includes Transducer Power Output, Matching Network and associated cables |
| Offset Bone Nippers | Fine Science Tools | 16101-10 | Use to remove spinous processes and laminae for laminectomy |
| Paraffin | Polysciences | 24364-1 | Can place spinal cord sample in paraffin to slice into thin sections for histology. |
| Paraformaldehyde (4%) | Thermo Scientific | J61899-AK | For transcardial perfusion. |
| Rat Surgical Kit | Kent Scientific | INSRATKIT | Consists of tweezer #5, needle holder, McPherson-Vannas scissors, Iris scissors, ALM self-retaining retractors, Iris forceps, and blunt probe. These products should be sufficient to perform a laminectomy. |
| Razor blade | Fisherbrand | 12-640 | Use to cut spinal cord extraction to desirable length and split section down midline. |
| Rectal thermometer | Kent Scientific | RET-2 | Maintain rat temperature between 35.9–37.5 °C |
| Rubber band | Fisherbrand | 50-205-1983 | |
| Single animal vaporizer unit | Kent Scientific | SF-01 | |
| Stereotactic arm | Kopf Instruments | Model 963 | |
| Sterile absorbent pad | McKesson | 4033-CS150 | Place under rat and above heating pad and fixation plate before laminectomy |
| Ultrasound gel | Aquasonic | PLI 01-34 | Ensure gel is free of bubbles to the best of your ability. |
References
- Chopra, N., et al. Blood-spinal cord barrier: Its role in spinal disorders and emerging therapeutic strategies. NeuroSci. 3 (1), 1-27 (2021).
- Bartanusz, V., Jezova, D., Alajajian, B., Digicaylioglu, M. The blood-spinal cord barrier: morphology and clinical implications. Annals of Neurology. 70 (2), 194-206 (2011).
- Hersh, A. M., Alomari, S., Tyler, B. M. Crossing the blood-brain barrier: Advances in nanoparticle technology for drug delivery in neuro-oncology. International Journal of Molecular Sciences. 23 (8), 4153 (2022).
- Pan, W., Banks, W. A., Kastin, A. J. Permeability of the blood-brain and blood-spinal cord barriers to interferons. Journal of Neuroimmunology. 76 (1-2), 105-111 (1997).
- Bellettato, C. M., Scarpa, M. Possible strategies to cross the blood-brain barrier. Italian Journal of Pediatrics. 44, 131 (2018).
- Weber-Adrian, D., et al. Gene delivery to the spinal cord using MRI-guided focused ultrasound. Gene Therapy. 22 (7), 568-577 (2015).
- Hersh, A. M., et al. Applications of focused ultrasound for the treatment of glioblastoma: A new frontier. Cancers. 14 (19), 4920 (2022).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Cho, H., et al. Localized down-regulation of P-glycoprotein by focused ultrasound and microbubbles induced blood-brain barrier disruption in rat brain. Scientific Reports. 6, 31201 (2016).
- Smith, P., Ogrodnik, N., Satkunarajah, J., O'Reilly, M. A. Characterization of ultrasound-mediated delivery of trastuzumab to normal and pathologic spinal cord tissue. Scientific Reports. 11 (1), 4412 (2021).
- Montero, A. S., et al. Ultrasound-induced blood-spinal cord barrier opening in rabbits. Ultrasound in Medicine & Biology. 45 (9), 2417-2426 (2019).
- Fletcher, S. P., Choi, M., Ogrodnik, N., O'Reilly, M. A. A porcine model of transvertebral ultrasound and microbubble-mediated blood-spinal cord barrier opening. Theranostics. 10 (17), 7758-7774 (2020).
- Honeycutt, S. E., O'Brien, L. L. Injection of Evans blue dye to fluorescently label and image intact vasculature. BioTechniques. 70 (3), 181-185 (2021).
- Fletcher, S. P., Choi, M., Ramesh, R., O'Reilly, M. A. Focused ultrasound-induced blood-spinal cord barrier opening using short-burst phase-keying exposures in rats: A parameter study. Ultrasound in Medicine & Biology. 47 (7), 1747-1760 (2021).
- Cross, C. G., et al. Technical note: Quantification of blood-spinal cord barrier permeability after application of magnetic resonance-guided focused ultrasound in spinal cord injury. Medical Physics. 48 (8), 4395-4401 (2021).
- Hong, Y. R., et al. Ultrasound stimulation improves inflammatory resolution, neuroprotection, and functional recovery after spinal cord injury. Scientific Reports. 12 (1), 3636 (2021).
- Liao, Y. H., et al. Low-intensity focused ultrasound alleviates spasticity and increases expression of the neuronal K-Cl cotransporter in the L4-L5 sections of rats following spinal cord injury. Frontiers in Cellular Neuroscience. 16, 882127 (2022).
- Redfors, B., Shao, Y., Omerovic, E. Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Laboratory Animals. 48 (1), 6-14 (2014).
- Lillie, L. E., Temple, N. J., Florence, L. Z. Reference values for young normal Sprague-Dawley rats: weight gain, hematology and clinical chemistry. Human & Experimental Toxicology. 15 (8), 612-616 (1996).
- Lin, X. J., et al. Spinal cord lateral hemisection and asymmetric behavioral assessments in adult rats. Journal of Visualized Experiments. (157), e57126 (2020).
- Tsehay, Y., et al. Low-intensity pulsed ultrasound neuromodulation of a rodent's spinal cord suppresses motor evoked potentials. IEEE Transactions on Biomedical Engineering. , (2023).
- Payne, A. H., et al. Magnetic resonance imaging-guided focused ultrasound to increase localized blood-spinal cord barrier permeability. Neural Regeneration Research. 12 (12), 2045-2049 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. Journal of Visualized Experiments. (146), e59295 (2019).
- Sabbagh, A., et al. Opening of the blood-brain barrier using low-intensity pulsed ultrasound enhances responses to immunotherapy in preclinical glioma models. Clinical Cancer Research. 27 (15), 4325-4337 (2021).
- Dréan, A., et al. Temporary blood-brain barrier disruption by low intensity pulsed ultrasound increases carboplatin delivery and efficacy in preclinical models of glioblastoma. Journal of Neuro-Oncology. 144 (1), 33-41 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Yamamoto, H., Imai, S., Okuyama, T., Tsubura, Y. Pulmonary lesions in rats caused by intravenous injection. Acta Pathologica Japonica. 32 (5), 741-747 (1982).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Scientific Reports. 9 (1), 321 (2019).
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved