Method Article
Störung der Blut-Rückenmark-Schranke mittels fokussiertem Ultraschall niedriger Intensität im Rattenmodell
In diesem Artikel
Zusammenfassung
Die Störung der Blut-Rückenmark-Schranke (BSCB) kann durch die intravenöse Verabreichung von Mikrobläschen und die Anwendung von fokussiertem Ultraschall niedriger Intensität (LIFU) erfolgreich erreicht werden. Dieses Protokoll beschreibt die Eröffnung des BSCB unter Verwendung von LIFU in einem Nagetiermodell, einschließlich der Einrichtung der Ausrüstung, der Mikroblaseninjektion, der Ziellokalisierung und der Visualisierung der BSCB-Störung.
Zusammenfassung
Fokussierter Ultraschall mit niedriger Intensität (LIFU) verwendet Ultraschallpulsationen mit niedrigeren Intensitäten als Ultraschall und wird als reversible und präzise neuromodulatorische Technologie getestet. Obwohl die LIFU-vermittelte Öffnung der Blut-Hirn-Schranke (BHS) im Detail untersucht wurde, wurde bisher keine standardisierte Technik für die Öffnung der Blut-Rückenmark-Schranke (BSCB) etabliert. Daher stellt dieses Protokoll eine Methode für eine erfolgreiche BSCB-Störung unter Verwendung von LIFU-Beschallung in einem Rattenmodell vor, einschließlich Beschreibungen der Tierpräparation, der Verabreichung von Mikrobläschen, der Zielauswahl und -lokalisierung sowie der Visualisierung und Bestätigung von BSCB-Störungen. Der hier beschriebene Ansatz ist besonders nützlich für Forscher, die eine schnelle und kostengünstige Methode benötigen, um die Ziellokalisierung und die präzise BSCB-Störung in einem Kleintiermodell mit einem fokussierten Ultraschallwandler zu testen und zu bestätigen, die BSCB-Wirksamkeit von Beschallungsparametern zu bewerten oder Anwendungen für LIFU am Rückenmark zu untersuchen, wie z. B. die Verabreichung von Medikamenten. Immunmodulation und Neuromodulation. Es wird empfohlen, dieses Protokoll für den individuellen Gebrauch zu optimieren, insbesondere um zukünftige präklinische, klinische und translationale Arbeiten voranzutreiben.
Einleitung
Ähnlich wie die Blut-Hirn-Schranke (BHS) reguliert die Blut-Rückenmark-Schranke (BSCB) die Bewegung zirkulierender gelöster Stoffe, Zellen und Plasmabestandteile in das Spinalparenchym1. Diese Schutzfunktion ist das Ergebnis eines spezialisierten Systems von eng gebundenen, nicht fenestrierten Endothelzellen, die die Spinalkapillaren auskleiden2. Typischerweise können nur leichte, lipophile Moleküle mit einer positiven Ladung beide Barrieren überwinden3. Trotz Studien, die darauf hindeuten, dass die BSCB eine etwas höhere Permeabilität als die BHS aufweist, begrenzen beide Barrieren die Abgabe von Therapeutika an das zentrale Nervensystem4. Es wurden mehrere Strategien entwickelt, um den Transport von Medikamenten durch das BSCB zu erhöhen, darunter Techniken zur Erhöhung des osmotischen Drucks in den Wirbelsäulenkapillaren, die Entwicklung von Medikamenten, die mit Bradykininrezeptoren interagieren, und die Herstellung funktionalisierter Nanopartikel5.
Die BSCB-Störung kann auch durch die intravenöse Verabreichung von Mikrobläschen (MBs) erreicht werden, gefolgt von einer Beschallung mit fokussiertem Ultraschall (LIFU) mit niedriger Intensität6. Das vom Ultraschallwandler erzeugte akustische Feld verursacht MB-Oszillationen, die wiederum Druck auf die Endothelwand ausüben und Tight Junctions lockern7. Durch die Lockerung der Tight Junction entstehen vorübergehende Lücken in den Kapillaren, so dass Therapeutika in das Spinalparenchym eindringen können (Abbildung 1). Dieser Prozess kann auch transendotheliale Fenestrationen erzeugen, die Transzytose erhöhen und ATP-bindende Kassettentransporter wie P-Glykoprotein 8,9 herunterregulieren. Ein wesentlicher Vorteil dieser Technik ist die Fähigkeit, Off-Target-Effekte zu minimieren, indem die fokale Region der Beschallung auf die gewünschte Stelle im Rückenmark gelenkt wird. Mehrere klinische Studien haben die Wirksamkeit der LIFU-vermittelten BHS-Öffnung zur Behandlung von Pathologien des Zentralnervensystems, einschließlich Gliomen, amyotropher Lateralsklerose, Alzheimer-Krankheit und Parkinson-Krankheit, untersucht. Obwohl die LIFU-vermittelte BSCB-Störung nicht so umfassend charakterisiert ist wie die LIFU-vermittelte BHS-Störung, haben mehrere Gruppen über eine erfolgreiche BSCB-Störung in Nagetier-, Kaninchen- und Schweinemodellen berichtet10,11,12. Insgesamt wächst das Interesse an der Technik rapide, insbesondere als praktikabler Weg für die Verabreichung von Medikamenten.
In diesem Protokoll wird eine Technik zur LIFU-vermittelten BSCB-Störung in einem Rattenmodell beschrieben. Das Verfahren umfasst detaillierte Beschreibungen der Tierpräparation, der Einrichtung der LIFU-Ausrüstung, der MB-Verabreichung, der Ziellokalisierung und der Rückenmarksextraktion. Die Bestätigung der Ziellokalisation und der BSCB-Störung wird durch die Extravasation des Evans-Blaufarbstoffs (EBD) in das Rückenmark ausgewertet. EBD ist eine ungiftige Verbindung, die an Serumalbumin bindet und durch ihre satte blaue Farbe visuell und die rote Autofluoreszenz unter der Mikroskopie identifiziert werdenkann 13.
Die hier aufgeführten Schritte bieten eine schnelle und kostengünstige Alternative zu herkömmlichen Ultraschall- (US) oder Magnetresonanz (MR)-gesteuerten LIFU-Systemen. Daher ist diese Methode nützlich für Forscher, die daran interessiert sind, die Targeting- und BSCB-Disruptionsfähigkeiten ihres LIFU-Schallkopfs schnell zu testen und zu bestätigen, bevor sie zusätzliche Geräte und Materialien erwerben oder LIFU-Anwendungen am Rückenmark verfolgen, wie z. B. Medikamentenverabreichung, Immunmodulation und Neuromodulation.
Protokoll
Alle Tierstudien wurden in Übereinstimmung mit dem Johns Hopkins University Institutional Animal Care and Use Committee (IACUC RA20M223) genehmigt und durchgeführt. Für die vorliegende Studie wurden nur adulte weibliche Sprague-Dawley-Ratten (Durchschnittsgewicht: 250 g; Alter: 11 Wochen) verwendet.
1. Aufbau und Einrichtung von fokussiertem Ultraschall mit niedriger Intensität
- Erwerben Sie ein fokussiertes Ultraschallwandlersystem mit Spezifikationen, die ausreichen, um eine BSCB-Öffnung bei Ratten zu erreichen. Zu den in der Literatur vorgeschlagenen Parametern gehören eine Zentralfrequenz zwischen 0,25 und 4 MHz und die Fähigkeit, Spitzendrücke zwischen 0,2 und 2,1 MPa 10,14,15,16,17 zu erzeugen. Stellen Sie sicher, dass das System die Antriebs-/Steuerausrüstung enthält, die mindestens einen Wellen-/Signalgenerator, einen Hochfrequenzantrieb/Leistungsverstärker und ein Anpassungsnetzwerk umfasst (Abbildung 2A).
HINWEIS: Der hier beschriebene Aufbau verwendet einen handelsüblichen Multielement-Wandler mit einer Zentralfrequenz von 250 kHz und einem Durchmesser von 64 mm (Abbildung 2B). - Befestigen Sie den 3D-gedruckten Sondenhalter und den Wasserkegel am Wandler (Abbildung 2C). Achten Sie auf eine wasserdichte Abdichtung zwischen Kegel und Wandler.
HINWEIS: Ein kundenspezifischer Kegel- und Sondenhalter wurde mit dem in diesem Experiment verwendeten Wandler geliefert. Der Kegel und der Sondenhalter werden mit Schrauben am Messkopf befestigt, die ebenfalls mitgeliefert werden. - Sterilisieren Sie eine 50 μm dicke, akustisch transparente Polyestermembran und befestigen Sie sie mit einem Gummiband an der Unterseite des Wasserkegels.
- Füllen Sie den Wasserkegel mit entgastem und deionisiertem Wasser über die Ein- und Auslassrohre. Achten Sie darauf, Luftblasen im Inneren der Membran zu vermeiden, da diese die akustische Kopplung zwischen Wandler und Messobjekt stören können. Die Polyestermembran sollte leicht aufgeblasen sein.
HINWEIS: Um Luftblasen aus dem Kegel zu entfernen, führen Sie die Blasen zum Auslassventil, während Sie den Kegel durch das Einlassventil mit Wasser füllen. Wenn viele kleine Blasen vorhanden sind, schließen Sie alle Ventile und drehen Sie den Kegel, bis eine große Blase übrig bleibt. Führen Sie diese Blase zum Auslassventil und füllen Sie den Kegel weiter. - Schließen Sie die Antriebsausrüstung, zu der der Wellengenerator und der HF-Antriebsverstärker gehören, an den Wandler an. Das Wandlerkabel wird mit der Ausgangsseite des Anpassungsnetzwerks verbunden, und der Signalgenerator/Leistungsverstärker wird mit der Eingangsseite des Anpassungsnetzwerks verbunden. Die Kabel sollten an die entsprechende Kanalnummer angeschlossen werden (Abbildung 2D-G).
ANMERKUNG: In dem kommerziellen System, das in dieser Studie verwendet wird, sind der Wellengenerator und der HF-Antriebsverstärker Komponenten der Wandlerleistung (TPO) (Abbildung 2D). - Befestigen Sie den Sondenhalter am stereotaktischen Arm. Befestigen Sie den stereotaktischen Arm an der Fixierplattenbaugruppe. Dadurch kann der Schallkopf während der Beschallung genau über dem Nagetier positioniert werden.
2. Tierpräparation und chirurgische Laminektomie
- Betäuben Sie die Ratte mit einer Mischung aus Isofluran und medizinischer Luft in einer Induktionskammer, die an einem Aktivkohlefilterkanister befestigt ist. Stellen Sie die Gasdurchflussrate auf 400 ml/min und den Isofluran-Verdampfer auf 1,5 % bis 2,5 % für die Anästhesieeinleitung ein. Die Zeit, die vor der vollständigen Sedierung in der Kammer verbracht wird, ist variabel, obwohl sie in der Regel zwischen 3 und 6 Minuten liegt.
- Notieren Sie das Gewicht der sedierten Ratte und führen Sie einen Zehenklemmtest durch. Wenn ein Ruck oder eine Bewegung als Reaktion auf das Kneifen beobachtet wird, setzen Sie die Ratte für weitere 1 Minute zurück in die Induktionskammer und wiederholen Sie den Zehenkneiftest. Wiederholen Sie den Vorgang nach Bedarf, um sicherzustellen, dass die Ratte vollständig betäubt ist und bleibt.
- Legen Sie ein Heizkissen und ein steriles, saugfähiges Pad auf die Fixierplatte. Positionieren Sie die Ratte auf dem saugfähigen Pad, tragen Sie Augensalbe auf und legen Sie ein Rektalthermometer auf, um die Körpertemperatur zu überwachen.
HINWEIS: Während der Dauer des chirurgischen Eingriffs sollten die Temperatur und die Herzfrequenz der Ratte überwacht werden (idealerweise sollte die Herzfrequenz zwischen 330 und 480 Schlägen pro Minute und die Temperatur zwischen 35,9 und 37,5 °C liegen)18,19. Stellen Sie das Isofluran oder Heizkissen entsprechend ein, um einen vorzeitigen Tod zu verhindern. Das Heizkissen kann auf eine Temperatur von etwa 37 °C eingestellt werden und sollte bei Bedarf ein- und ausgeschaltet werden, um die optimale Körpertemperatur aufrechtzuerhalten. - Abtasten Sie die letzte Rippe der Ratte, die am 13. Brustwirbel (T13) an der Wirbelsäule befestigt ist. Verwende einen elektrischen Rasierer, um das Fell von der Rückenfläche zwischen der letzten Rippe und dem Hals zu rasieren. Wischen Sie die exponierte Haut mit Gaze ab, die in 10% Jodopovidon getaucht ist.
- Legen Sie mit einer Irisschere einen Mittellinienschnitt an und präparieren Sie durch die Faszie, bis die Dornfortsätze und die Lamina freiliegen. Entfernen Sie den Knochen mit einer versetzten Knochenzange und einer Irisschere mit abgewinkelter Klinge, bis das Rückenmark freiliegt20. Die Länge der Laminektomie und Inzision hängt von der Anzahl der verschiedenen zu beschallenden Ziele ab. In dieser Studie wurde eine dreistufige Laminektomie mit einem 3 cm langen Schnitt durchgeführt.
HINWEIS: Vermeiden Sie es, das Rückenmark zu berühren oder Druck darauf auszuüben, während Sie Knochen entfernen, um Verletzungen zu vermeiden. Wenn die Hintergliedmaßen der Ratte während der Laminektomie zucken, dann wurde zu viel Kraft auf die Nabelschnur- oder Nervenwurzeln angewendet. - Befestigen Sie die Ratte an der Fixationsplatte, indem Sie die Dornfortsätze neben der Laminektomie einklemmen. Ziehen Sie die Wirbelsäule leicht an, um die Krümmung zu minimieren, bevor Sie die Klemmen verriegeln.
3. Zielortung mittels Laserführung
- Passen Sie die Position des Schallkopfes mit dem stereotaktischen Arm an, bis er sich genau über der Laminektomie befindet (Abbildung 3A). Der Rahmen ermöglicht Bewegungen in der x-, y- und z-Achse sowie eine 180°-Drehung in der vertikalen Ebene und eine 360°-Drehung in der horizontalen Ebene.
- Befestigen Sie das Lasergerät an der Unterseite des Wasserkegels und senken Sie es ab, bis der Laserpunkt sichtbar ist. Stellen Sie die seitliche Position des Wandlers ein, bis sich der Laserpunkt über der Stelle befindet, die das Ziel für die BSCB-Störung ist (Abbildung 3B, C).
ANMERKUNG: Eine CAD-Datei (Computer-Aided Design) für das Lasergerät ist im Abschnitt "Ergänzend" enthalten (Ergänzende Abbildung 1). - Entfernen Sie das Lasergerät und füllen Sie den Raum zwischen Kegel und Rückenmark mit entgastem Ultraschallgel (Abbildung 3D). Für eine maximale Kopplung ist darauf zu achten, dass keine Luftblasen im Gel vorhanden sind.
HINWEIS: In dieser Studie wurde der Wandler mit einem aufgeklebten Wasserkegel abgesenkt, bis er sich 1 cm über dem Kabel befand. Da der Wasserkegel 30 mm lang war, betrug der Gesamtabstand vom Wandler zum Kabel 40 mm. Der Wasserkegel wurde 1 cm vom Rückenmark entfernt platziert, da die Haut, die Faszie und die Muskulatur der Ratte auf beiden Seiten des Einschnitts einen direkten Kontakt zwischen der Spitze des Zapfens und der Schnur verhindern. Die Verwendung der Zahlen auf der y-Achse des stereotaktischen Arms kann hilfreich sein, um den vertikalen Abstand zu verfolgen, in dem der Zapfen 1 cm von der Schnur entfernt ist, zumal das Gel die visuelle Bestätigung des Abstands des Zapfens von der Schnur erschwert. - Stellen Sie die Parameter für die Beschallung des TPO ein. Eine Reihe von Werten kann verwendet werden, um eine erfolgreiche BSCB-Störung zu erreichen. Um eine maximale Leistung zu erzielen, stellen Sie die Beschallungsfrequenz nahe der Mittenfrequenz des Schallkopfes ein. Die in dieser Studie verwendeten Werte sind in Tabelle 1 aufgeführt.
ANMERKUNG: Die hier aufgeführten Parameter wurden aus früheren Arbeiten mit LIFU mit einer Mittenfrequenz von 500 kHz, einer Tonstoßdauer von 500 μs, einem Tastverhältnis von 50 % und Beschallungszeiten von 5 oder 10 Minuten angepasst, um das Rückenmark eines Nagetieres sicher zu neuromodulieren21. Basierend auf Studien, in denen BSCB-Störungen erfolgreich erreicht wurden, können auch zentrale Frequenzen zwischen 500 kHz und 1 MHz, Drücke von 0,2 bis 2,1 MPa, Burst-Längen von 10 bis 25 ms und Beschallungszeiten von 2 bis 5 Minuten 6,10,11,22 verwendet werden.
| Parameter | Wert |
| Frequenz (kHz) | 250 |
| Fokusabstand (mm) | 40 |
| Akustischer Spitzendruck (MPa) | 0.47 |
| Arbeitszyklus | 40% |
| Burst-Länge (ms) | 400 |
| Zeitraum(e) | 1 |
| Beschallungszeit (min) | 5 |
Tabelle 1: Beschallungsparameter, die für die BSCB-Störung verwendet werden.
4. Verabreichung von Mikrobläschen
- Bereiten Sie eine MB-Lösung gemäß den Anweisungen des Herstellers vor. Vermeiden Sie es, Luft in die Lösung einzubringen.
HINWEIS: Die MBs sind zerbrechlich und verklumpen in der Nähe der Oberseite der Durchstechflasche/Spritze, wenn sie einige Minuten lang still stehen. Schütteln Sie die Durchstechflasche und die Spritze regelmäßig, um eine ungleichmäßige Verteilung der MBs zu vermeiden. Schauen Sie in der Bedienungsanleitung des Herstellers nach, um die Verfallszeit zu bestimmen. - Führen Sie einen 22-G-Schwanzvenenkatheter ein und spülen Sie ihn mit 0,2 ml heparinisierter Kochsalzlösung (500 I.E./ml)23. Um die Chancen auf eine erfolgreiche Katheterisierung der Schwanzvene zu erhöhen, tauchen Sie den Schwanz in warmes Wasser und legen Sie ein Tourniquet an der Basis des Schwanzes, um den Durchmesser der Vene zu vergrößern.
HINWEIS: Die Schwanzvenenkatheterisierung kann vor der Laminektomie, Positionierung und Zielsetzung des Tieres durchgeführt werden, um Studienzeit zu sparen. - Injizieren Sie 1 ml/kg 3 % EBD in den Katheter. Spülen Sie mit 0,2 ml heparinisierter Kochsalzlösung. Die Extremitäten und Augen der Ratte färben sich blau. Bestätigen Sie die erfolgreiche Schwanzvenenkatheterisierung, indem Sie die dorsale Spinalvene der Ratte auf eine blaue Farbveränderung überprüfen (Abbildung 4).
HINWEIS: EBD kann lange vor der MB-Injektion injiziert werden und hat keinen Einfluss auf die Beschallung. Da die Food and Drug Administration (FDA) die Beschallung mit bereits im System befindlichen Medikamenten derzeit nicht zugelassen hat, kann EBD auch nach der Beschallung verabreicht werden. Dies führt zu einer geringeren Farbstoffaufnahme, kann aber klinisch relevanter sein. - Injizieren Sie einen 0,2-ml-Bolus MBs in den Katheter und spülen Sie mit 0,2 ml heparinisierter Kochsalzlösung. Beginnen Sie die Beschallung 1-2 Minuten nach der Injektion von MBs. Das hier verwendete Setup sammelt kein Echtzeit-Beschallungsfeedback.
HINWEIS: Studien zur BSCB-Störung verwenden in der Regel eine höhere Konzentration von MBs als für die diagnostische Bildgebung angegeben. Einige Konzentrationen gängiger MB-Marken, die in Rattenmodellen für den BHS- und BSCB-Aufschluss verwendet werden, umfassen 0,02-0,2 ml/kg und 200-μl-Boli 10,15,24,25.
5. Rückenmarksextraktion und Gewebeaufbereitung
- Nach Beendigung der Beschallung wird die Ratte transkardial mit 100 ml kalter phosphatgepufferter Kochsalzlösung (PBS) perfundiert, bis das Blut vollständig klar ist. Die Leber, die durch den Farbstoff eine satte blaue Farbe hat, sollte zu einer hell bräunlich-blauen26 verblassen.
HINWEIS: Der Zweck der Perfusion besteht darin, überschüssiges Blut aus dem Gefäßsystem des Rückenmarks zu entfernen. Da EBD an Albumin bindet, wird dadurch auch überschüssiges EBD entfernt. Dadurch wird sichergestellt, dass jede EBD, die entweder visuell oder durch Fluoreszenzmikroskopie im Rückenmark nachgewiesen wird, aus der Extravasation von Farbstoff in das Spinalparenchym stammt. - Transkardiale Perfusion mit 100 ml kaltem 4%igem Paraformaldehyd (PFA). Die Gliedmaßen der Ratte zucken während dieser Fixierung, wenn sie gründlich durchgeführt wird. Diese Perfusion mit PFA schläfert die Ratte ein.
- Entfernen Sie das Rückenmark und legen Sie es über Nacht bei 4 °C in 4% PFA. Ersetzen Sie die PFA am nächsten Tag durch PBS.
6. Visualisierung der BSCB-Störung
- Isolieren Sie mit einer Rasierklinge einen 2 cm großen Abschnitt, der die Stelle der Beschallung umgibt. Teilen Sie den Abschnitt mit der Klinge entlang der Mittellinie und teilen Sie den Abschnitt mit einem Mikrotom in 10 μm dicke Abschnitte. Für die Hellfeld-Visualisierung mit Hämatoxylin-Eosin-Färbung (H&E) färben.
HINWEIS: Die in dieser Studie gezeigten H&E-Rückenmarksproben wurden 3 Minuten lang mit Hämatoxylin und 1 Minute lang mit Eosin gefärbt27. - Für die Fluoreszenzmikroskopie werden die Objektträger, die die Rückenmarksabschnitte enthalten, entparaffiniert und mit 25 μl 4′,6-Diamidino-2-phenylindol (DAPI), gelöst im Einbettmedium (0,5 μg/ml), gegengefärbt. Bei 4 °C mindestens 10 min inkubieren. Vermeiden Sie Licht, um ein Ausbleichen zu verhindern.
HINWEIS: Die Entparaffinierung kann durch die Verwendung eines Kryostaten ersetzt werden, um Gefrierschnitte zu erhalten. - Verwenden Sie ein Fluoreszenzmikroskop, um alle Objektträger abzubilden. EBD-Autofluoreszenz (Anregung: 470 nm und 540 nm; Emission: 680 nm) ist im roten Kanal sichtbar, während DAPI im blauen Kanal vorhanden ist. Verwenden Sie ein Lichtmikroskop, um die H&E-Objektträger abzubilden.
HINWEIS: Obwohl dieses Protokoll ein Verfahren ohne Überleben beschrieb, wurde es auch mit chirurgischen Überlebenstechniken durchgeführt. Für eine Überlebensoperation desinfizieren Sie die Haut vor der Inzision mit 3 abwechselnden Anwendungen von Jodopovidon und verabreichen Sie Buprenorphin subkutan (0,05 mg/kg) vor der Operation. Subkutanes Buprenorphin ist weiterhin mindestens 3 Tage nach der Operation alle 12 Stunden zu verabreichen, mit zusätzlichen Tagen, wenn die Ratte Anzeichen von Schmerzen zeigt. Wenn eine Rückenmarksverletzung auftritt, können Ratten Harnverhalt oder einen abnormalen Gang aufweisen. Dies äußert sich in Form eines Ziehens oder einer verzögerten Bewegung der Hintergliedmaßen oder einer tastbaren, aufgeblähten Blase. Wenn dies der Fall ist, sollten Sie Ratten mit mit Nährstoffen angereichertes Wassergel für Futter und Flüssigkeitszufuhr eintragen und die Blase zweimal täglich manuell abpumpen, bis die reflexartige Blasenentleerung wiederhergestellt ist. Wenn es eine vollständige Lähmung der Hintergliedmaßen oder hartnäckige Schmerzen gibt, schläfere die Ratte ein.
Ergebnisse
Diese Arbeit zeigt, dass die gleichzeitige Anwendung von LIFU-Beschallung und MB-Verabreichung eine effektive Technik zur lokalisierten BSCB-Störung ist. Die Eröffnung des BSCB wird durch das Vorhandensein einer EBD-Extravasation in das Spinalparenchym angezeigt. Die Veränderungen sind sowohl visuell als auch unter der Fluoreszenzmikroskopie sichtbar. Das Rückenmarksgefäßsystem ist nach der Laminektomie sichtbar und zeigt die hintere Spinalvene mit mehreren kleineren Gefäßen, die seitlich ausstrahlen (Abbildung 4A). Die intravenöse Injektion von EBD durch den Schwanzvenenkatheter führt dazu, dass dieses Gefäßsystem mit blauem Farbstoff angereichert wird (Abbildung 4B). Dies ist ein guter Punkt im Verfahren, um zu überprüfen, ob die Laminektomie nicht zur Ruptur eines Wirbelsäulengefäßes geführt hat, da dies dazu führen würde, dass sich blaues Blut über der Nabelschnur sammelt. Nach der Beschallung sollte ein blauer Fleck über der Zielstelle sichtbar werden, was auf die Extravasation von EBD in das weiße Parenchym aufgrund einer BSCB-Störung hinweist (Abbildung 4C). Die Größe dieses Flecks hängt von einer Reihe von Faktoren ab, einschließlich der Größe der Brennregion des Schallkopfes und der Zeit nach der Beschallung. Um die Wahrscheinlichkeit einer EBD-Extravasation zu erhöhen, sollte man die Zeitspanne zwischen Beschallung und Rückenmarksextraktion verlängern.
Obwohl die PFA-Perfusion kein notwendiger Schritt vor der Nabelschnurextraktion und der anschließenden Gewebeanalyse ist, entfernt sie Blut aus der Probe und erhöht den Kontrast zwischen dem weißen Spinalparenchym und den blau EBD-gefärbten Regionen. Alle Ratten, die MB-Verabreichung und LIFU-Beschallung erhielten, zeigten eine offensichtliche Extravasation von EBD in das Rückenmark, während Negativkontrollen, die MBs und EBD ohne LIFU-Beschallung erhielten, dies nicht taten. Repräsentative Bilder sind in Abbildung 5 dargestellt. Sagittale Schnitte durch das Gewebe zeigen, dass die EBD-Extravasation nicht nur oberflächlich ist, sondern sich bis weit in die Nabelschnur selbst erstreckt. Dies ist zu erwarten, da die fokale Region des in dieser Studie verwendeten Schallkopfes größer ist als der Durchmesser des Rückenmarks der Ratte. Manchmal können kleine Blutungen in den sagittalen Schnitten zu sehen sein. Dies kann an der Laminektomie oder der Ultraschallbeschallung liegen. Befindet sich die Blutung in der Nähe der dorsalen Peripherie der Nabelschnur, ist sie eher auf die Laminektomie zurückzuführen.
Um die EBD-Extravasation weiter zu untersuchen, wurden sagittale Rückenmarksschnitte mit DAPI (Kernmarker) gefärbt und mit einem Fluoreszenzmikroskop abgebildet. Alle Schnüre, die LIFU-Beschallung erhielten (n = 3), zeigten eine signifikant höhere Intensität der EBD-Autofluoreszenz (p = 0,016) als Schnüre, die keine Beschallung erhielten, wobei bei beiden ähnliche Intensitäten von DAPI vorhanden waren (Abbildung 6). Die H&E-Analyse ergab außerdem keine neuronalen Schäden, Blutungen oder Hohlraumläsionen an den beschallten Stellen, was die Sicherheit dieses Verfahrens unterstützt. Zum Vergleich werden Beispiele für verletzte Nabelschnüre aufgrund von chirurgischer Fehlbehandlung und einer leistungsstarken Beschallung gezeigt. Blutungen, Gewebeschäden, Hohlraumläsionen und mögliche Vakuolisierungen werden markiert. Obwohl das Beispiel der Hochleistungsbeschallung keine Blutungen zeigt, wurde dies auch als Folge von Ultraschallstörungen berichtet.
Darüber hinaus wurde eine Verhaltensanalyse an Ratten durchgeführt, die MBs, EBD und LIFU-Beschallung erhielten. Diese Methode schließt Gewebeschäden zwar nicht vollständig aus, testet aber, ob motorische Defizite durch dieses Verfahren entstanden sind. Die Ratten wurden aufgezeichnet, wie sie über einen Zeitraum von 5 Tagen jeden Tag 5 Minuten lang in einem Käfig spazieren gingen, und die lokomotorische Funktion wurde auf der Grundlage der Basso Beattie Bresnahan lokomotorischen Skala (Supplemental Video File 1) eingestuft. Alle Ratten (n = 5) erhielten die höchste Punktzahl vor der Beschallung, nach der Beschallung und an jedem Tag der Überlebensperiode (Abbildung 7).
Schließlich wurden die thermischen Effekte der in dieser Studie verwendeten Beschallungsparameter mit zwei ex vivo Ratten-Rückenmarksproben und einer digitalen Thermometersonde mit einer feinen Spitze, die in die Nabelschnur eingeführt wurde, gemessen. Die Temperatur der Rückenmarksproben wurde vor, während und nach der Beschallung für insgesamt 15 Minuten 5 Minuten lang verfolgt. Es wurden minimale Temperaturänderungen beobachtet. Tatsächlich gab es in beiden Proben eine Veränderung von ≤1,3 °C aufgrund der Beschallung, was die Wahrscheinlichkeit einer hyperthermischen Verletzung als Folge der Beschallung verringerte (Abbildung 8).
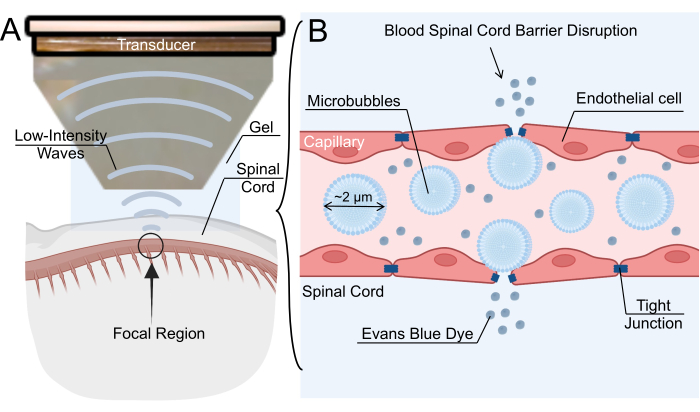
Abbildung 1: Öffnungsmechanismus der Blut-Rückenmark-Schranke mit fokussiertem Ultraschall niedriger Intensität. (A) Schematische Übersicht über die Beschallung des Rückenmarks von Ratten mit fokussiertem Ultraschall (LIFU) mit niedriger Intensität. (B) Der Mechanismus für die Öffnung der Blut-Rückenmark-Schranke (BSCB) durch LIFU-Beschallung von intravenösen Mikrobläschen (MBs). MBs oszillieren als Reaktion auf LIFU, was zu einer Erweiterung der Tight Junctions zwischen den Endothelzellen führt. Diese Störung des BSCB ermöglicht die Extravasation von Nanopartikeln, therapeutischen Medikamenten oder dem blauen Farbstoff Evans. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Fokussierter Ultraschall mit niedriger Intensität und Konnektivität. (A) Schematische Darstellung typischer fokussierter Ultraschallkomponenten. (B) Übersichtsbild des fokussierten Ultraschallaufbaus, einschließlich: 1. Schallkopfleistung (TPO), 2. Matching-Netzwerk, 3. LIFU-Wandler, 4. das stereotaktische Instrument, 5. bewegliche Klemmen. (C) Wandler, einschließlich: 1. Sondenhalter, 2. Ringwandler, 3. Wasserkegel, 4. Wassereinlassrohr, 5. Wasserauslassrohr, 6. Membran, die mit einem Gummiband gesichert ist. (D) Vorderseite des TPO, einschließlich: 1. HF-abgeschirmtes Gehäuse, 2. berührungsempfindliches Frontdisplay mit einstellbarem Menü, 3. Drehknopf zur Parametereinstellung, 4. Start/Stopp-Ausgangsschalter. (E) Rückseite des TPO, einschließlich: 1. Kanalausgangsanschlüsse, 2. Masse, 3. USB-Eingangsanschluss für Softwaresteuerung, 4. interner Trigger, 5. Sync-Ausgangsanschluss, 6. Stromeingangsbuchse und -versorgung, 7. Ein-/Aus-Netzschalter. (F) Passender Netzwerkausgang mit Drähten, die den Kanalnummern entsprechen. (G) Passender Netzwerk-XDR-Eingang mit Kabeln, die den Kanalnummern entsprechen Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
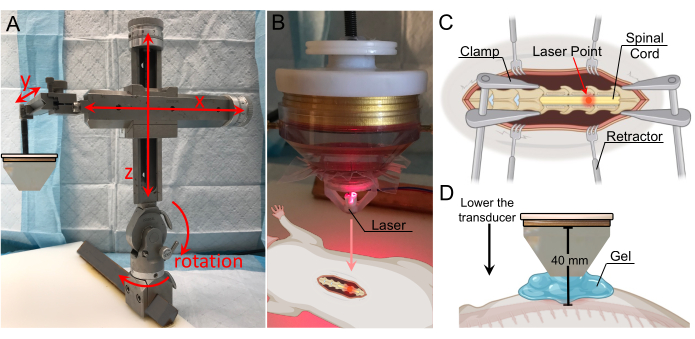
Abbildung 3: Ziellokalisierung mit Laserführung . (A) Stereotaktischer Arm mit Bewegungsumfang in allen drei Achsen und Rotationsfunktionen. Er wird auf der darunter liegenden Befestigungsplatte befestigt. (B) Lasergerät zur Identifizierung der Fokuszone. Der Laser wird an der Spitze des Wandlers positioniert und befindet sich in einer Linie mit dem Fokusbereich. (C) Illustration, die den Laser auf dem freigelegten Rückenmark zeigt, was darauf hinweist, dass die Fokusregion des Schallkopfes nun auf diese Stelle gerichtet ist. (D) Der Wandler wird abgesenkt, bis sich die Spitze des Kegels 1 cm über dem Kabel befindet, und der Spalt wird mit Gel gefüllt, um eine maximale Kopplung zu gewährleisten. Der Abstand vom Schallkopf zum Rückenmark beträgt 40 mm (Brennweite). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
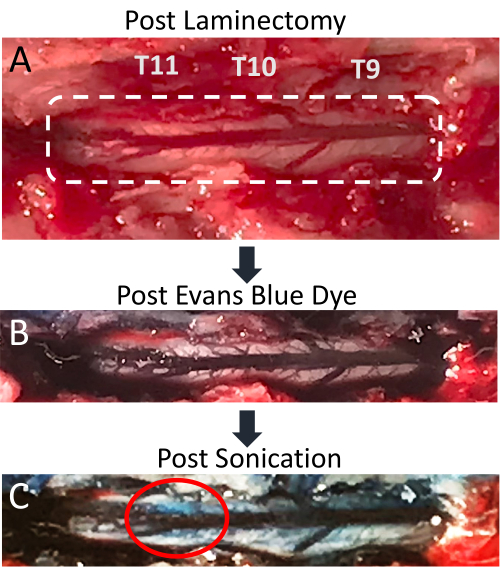
Abbildung 4: Evans-Blau-Farbstoff-Extravasation im Rückenmark nach der Beschallung . (A) Bild der T9-T11-Rattenlaminektomie-Inzision, wobei das freiliegende Rückenmark und die hintere Rückenvene deutlich sichtbar sind. (B) Das umgebende Gewebe und das Rückenmarksgefäßsystem färben sich nach intravenöser Injektion von Evansblau (EBD) blau. (C) EBD-Extravasation in das Rückenmarkparenchym am Ort der Beschallung, was auf eine BSCB-Störung hinweist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Rückenmarksextraktion und Visualisierung der BSCB-Öffnung nach Perfusion. (A) Herausgeschnittenes Rückenmark von Kontrollratten ohne LIFU-Behandlung. Diese Ratte erhielt nur MBs und EBD. Der mittlere sagittale Schnitt der Nabelschnur, der in Paraffin eingebettet ist, ist in der Einschub zu sehen, und es ist keine EBD-Extravasation sichtbar. (B) Herausgeschnittenes Rückenmark von Ratten mit LIFU-Behandlung. Diese Ratte erhielt auch MBs und EBD. Die Spalte der EBD-Extravasation ist sichtbar und in der beschallten Region lokalisiert. Der mittlere sagittale Schnitt der Nabelschnur, der in Paraffin eingebettet ist, ist in der Einschub dargestellt, mit einem Pfeil, der auf die EBD-Konzentration zeigt, die innerhalb der beschallten Stelle sichtbar ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
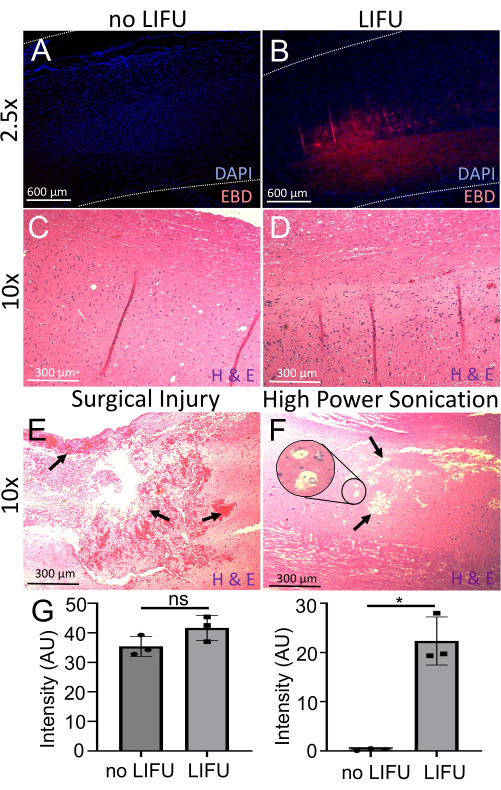
Abbildung 6: Detektion und Bewertung der BSCB-Öffnung. (A) Rückenmark gefärbt mit DAPI (Kernmarker, blau). Minimale EBD-Autofluoreszenz (rot) ist sichtbar. Diese Ratte erhielt kein LIFU. (B) Rückenmark gefärbt mit DAPI (Kernmarker, blau). Lokalisierte EBD-Autofluoreszenz (rot) an der beschallten Zielstelle ist sichtbar. Diese Ratte erhielt LIFU und MBs. (C) Das Rückenmark einer Ratte ohne LIFU, gefärbt mit Hämatoxylin (Nukleinsäurefärbung) und Eosin (unspezifische Proteinfärbung) (H&E). Es sind keine neuronalen Schäden, Blutungen oder Hohlraumläsionen sichtbar. (D) Das Rückenmark einer Ratte mit LIFU, gefärbt mit H&E. Es sind keine neuronalen Schäden, Blutungen oder Hohlraumläsionen sichtbar. (E) Rückenmark einer Ratte mit chirurgischer Verletzung, die mit H&E-Pfeilen gefärbt ist. Pfeile deuten auf starke Blutungen und Gewebeschäden hin. (F) Das Rückenmark einer Ratte mit Schädigung durch Hochleistungsbeschallung, gefärbt mit H&E. Pfeilen, deutet auf Hohlraumläsionen hin, und der Einschub zeigt eine mögliche Vakuolisierung. (G) Balkendiagramme, die die Intensität von DAPI und EBD im Rückenmark von Ratten mit und ohne LIFU-Beschallung zeigen. Im Vergleich zur Negativkontrolle (p = 0,016) ist die EBD-Intensität im LIFU-Rückenmark signifikant höher (p = 0,016), trotz ähnlicher DAPI-Intensität (p > 0,05). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
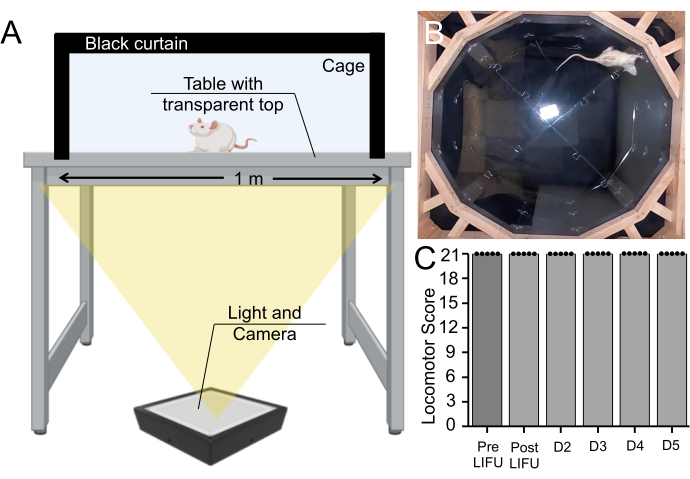
Abbildung 7: Verhaltenstest vor und nach der Beschallung . (A) Basso-, Beattie-, Bresnahan-Apparatur, bei der Ratten 5 Minuten lang von unten gelaufen wurden. (B) Standbild aus einem aufgezeichneten Video. Dieses Video wurde verwendet, um die motorische Koordination und den Gang der Ratte auf der Basso-, Beattie-, Bresnahan-Skala zu bewerten. (C) Boxplot (n = 5), der keine Veränderung der motorischen Werte vor, nach der Beschallung oder während einer 5-tägigen Überlebensphase bei Ratten zeigte, die MBs und LIFU-Behandlung erhielten (p > 0,05). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Temperaturanalyse mit Hilfe von ex vivo Rückenmark. Grafik zur Darstellung von Temperaturänderungen in zwei ex vivo Rückenmarksproben für eine Dauer von 5 Minuten vor, während und nach der Beschallung. Die für die Beschallung verwendeten Parameter sind in Tabelle 1 aufgeführt. Für Probe 1 betrugen die Durchschnittstemperaturen vor, während und nach der Beschallung 21,9 °C ± 0,1 °C, 22,1 °C ± 0,1 °C bzw. 22,0 °C ± 0,1 °C. Für Probe 2 betrugen die Temperaturen vor, während und nach der Beschallung 21,9 °C ± 0,1 °C, 22,5 °C ± 0,3 °C bzw. 22,4 °C ± 0,2 °C. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: CAD-Datei eines Laserzielgeräts. (A) Ansicht des Lasergeräts von unten. Jeder Laser kann innerhalb des zentralen Lochs in der Mitte platziert werden. (B) Seitenansicht des Lasergeräts. (C) Abmessungen des Lasergeräts mit Einheiten in Zoll. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Videodatei 1: Video einer Ratte, die im Basso-, Beattie-, Bresnahan-Apparat läuft. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Hier werden die Geräte und Schritte beschrieben, die für eine effektive und gezielte BSCB-Störung unter Verwendung von fokussiertem Ultraschall mit niedriger Intensität (LIFU) in Kombination mit Mikroblasengabe (MB) erforderlich sind. Dieses Protokoll ist flexibel und kann für den individuellen Einsatz mit Wandlern mit unterschiedlichen Spezifikationen optimiert werden. Andere Techniken zur LIFU-vermittelten BSCB-Störung beruhen auf der Verwendung von Magnetresonanztomographie (MRT)-gesteuerten Systemen zur Ziellokalisierung, was eine teure Ressource ist16. Die Vorteile der hier vorgestellten Technik liegen in der schnellen visuellen Bestätigung der BSCB-Störung in Echtzeit und der einfachen Zielerfassung aufgrund der Offenheit des Verfahrens. Darüber hinaus ist die Laservorrichtung einfach zu bedienen und zu konstruieren, und eine CAD-Datei ist im ergänzenden Abschnitt enthalten. Daher können Forscher, die daran interessiert sind, erste Tests zu den Targeting-Fähigkeiten ihres LIFU-Wandlers in einem Kleintiermodell durchzuführen, dieses Protokoll als Werkzeug verwenden, um die Positionierung der Fokuszone über einem Ort von Interesse schnell zu bestätigen. Diese Technik kann auch von Laboren verwendet werden, die mit der Untersuchung klinischer Anwendungen von LIFU, wie z. B. der Verabreichung von Medikamenten, beginnen, bevor sie in komplexere Behandlungsmodalitäten wie US- oder MR-Systeme investieren. Derzeit stellen US-gesteuerte Modalitäten im Vergleich zu MR-Systemen einen vielversprechenderen und kostengünstigeren Weg dar, obwohl letztere in der Literatur häufiger zu sehen sind.
Es gibt mehrere kritische Schritte in diesem Verfahren, die sorgfältig ausgeführt werden müssen, um eine erfolgreiche BSCB-Unterbrechung zu gewährleisten. Es ist unbedingt zu vermeiden, dass während der chirurgischen Laminektomie unnötiger Druck auf das Rückenmark ausgeübt wird. Eine zu starke physische Manipulation des Kabels erhöht die Wahrscheinlichkeit einer Beschädigung des BSCB. Die Schädigung erscheint nach der Extraktion als dunkelbrauner Fleck im Inneren der Nabelschnur aufgrund von Blutungen und erhöhter EBD-Extravasation. Des Weiteren muss eine maximale Kopplung zwischen dem Schallkopf und dem freiliegenden Rückenmark gewährleistet sein. Daher muss darauf geachtet werden, dass Blasen aus dem Wasserkegel und dem Ultraschallgel entfernt werden. Es sollten keine Lücken zwischen der Unterseite des Wasserkegels und dem Kabel vorhanden sein, um eine vollständige Übertragung der akustischen Welle zu gewährleisten. Während der Schwanzvenenkatheteruntersuchung sollte vermieden werden, dass versehentlich Luft mit der heparinisierten Kochsalzlösung, EBD oder MB-Lösung austritt. Die Injektion von Luft erhöht die Wahrscheinlichkeit einer Lungenembolie, die zum Tod von Nagetieren führt, vor Abschluss des Eingriffs erheblich28.
Ein häufiges Problem, das während dieses Verfahrens auftreten kann, ist das Scheitern einer erfolgreichen EBD-Injektion. Für Personen mit minimaler Erfahrung in der Schwanzvenenkatheterisierung spart die Durchführung dieses Schritts vor der Laminektomie, Positionierung oder Zielbehandlung des Tieres Zeit. EBD kann auch lange vor der MB-Injektion injiziert werden, ohne die Beschallung zu beeinflussen. Die Verwendung des Tourniquets und des warmen Wasserbads, die in diesem Protokoll vorgeschlagen werden, hilft, die Schwanzvenen zu erweitern und die Erfolgsrate zu erhöhen. Darüber hinaus verringert die Dehydrierung von Ratten die Wahrscheinlichkeit einer korrekten Katheterplatzierung. Eine intraperitoneale Kochsalzinjektion 10-15 Minuten vor der Schwanzvenenkatheteruntersuchung kann helfen. Während der Katheterisierung sollte man 2 cm oberhalb des Schwanzendes beginnen und sich in kaudaler bis kranialer Richtung bewegen. Eine Bewegung in die entgegengesetzte Richtung verringert die Erfolgswahrscheinlichkeit aufgrund eines möglichen Venenkollapses oder einer Blutung.
Eine weitere häufige Herausforderung ist das Fehlen einer EBD-Extravasation trotz Beschallung. Dies kann darauf hindeuten, dass die Parameter, die für die Beschallung verwendet werden, für eine BSCB-Störung nicht ausreichen. Wenn beispielsweise die Beschallungsfrequenz auf einen Wert eingestellt ist, der stark von der Zentralfrequenz des Wandlers abweicht, ist die Beschallungsleistung zu gering, um MBs zu schwingen und eine Lockerung der Tight Junction zu verursachen. Je mehr Schnittstellen zwischen dem Schallkopf und dem Kabel vorhanden sind (z. B. Wasserkegel, Membran, Gel, Luftblasen in Wasser/Gel), desto geringer ist die tatsächliche Beschallungsintensität am Ziel. Die Minimierung dieser Grenzflächen, z. B. durch die Verwendung von entgastem Gel und die gründliche Entfernung von Blasen im Inneren des Kegels, trägt dazu bei, das volle Potenzial der Beschallung zu übertragen. Das Protokoll ermutigt auch, die Zeit zwischen Beschallung und Perfusion zu verlängern, um mehr Zeit für die EBD-Extravasation in das Spinalparenchym zu haben. Obwohl es sich bei der BSCB-Störung um einen vorübergehenden Vorgang handelt, sind die Lücken mehrere Stunden lang vorhanden, bevor sie sich schließen. Eine lange Wartezeit erhöht die Exposition gegenüber Isofluran, führt aber auch zu einer stärkeren EBD-Extravasation in der Nabelschnur. Alternativ kann eine EBD-Extravasation auch ohne Beschallung mit LIFU vorliegen. Um dieses Problem zu beheben, muss während der Laminektomie darauf geachtet werden, dass das BSCB nicht versehentlich beschädigt wird. Mögliche Lösungen sind das Anheben der Rattenwirbelsäule während des Klemmens, um den Abstand zwischen den Laminae und der Nabelschnur zu vergrößern, sowie eine kürzere Laminektomie. Eine gründliche PFA-Perfusion reduziert auch die Hintergrundfärbung, indem EBD-angereichertes Blut aus dem Gefäßsystem im Rückenmark entfernt wird. Während der transkardialen Perfusion muss darauf geachtet werden, eine versehentliche Ruptur des Herzens zu verhindern, die zu einem Austritt von PBS oder PFA führen kann.
Es ist wichtig anzumerken, dass diese Studie eine einzige Zentrumserfahrung für LIFU-vermittelte BSCB-Störung darstellt. Darüber hinaus werden in diesem Protokoll verschiedene Beschallungsenergieparameter und MB-Konzentrationen nicht getestet oder optimiert. Infolgedessen werden die Forscher ermutigt, bei der Durchführung dieser Technik verschiedene Parameter und Konzentrationen zu untersuchen, um die Ziellokalisierung und die BSCB-Störung für ihre speziellen Forschungsanforderungen zu optimieren, insbesondere wenn die ersten Ergebnisse zu unerwünschten Wirkungen führen. Gruppen, die z.B. keine Temperaturänderungen sehen möchten, können verschiedene Parameter testen, bis sie ein Set finden, das dieses Kriterium erfüllt und eine ausreichende BSCB-Störung erreicht. Darüber hinaus können zusätzliche Experimente durchgeführt werden, um die Sicherheit dieser Technik zu bestätigen. So können beispielsweise die Stichprobengrößen erhöht, die Überlebenszeit verlängert und Elektromyographie-/Ganganalysestudien durchgeführt werden. Für längere Überlebenszeiten ist es wichtig zu bedenken, dass einige Studien zeigen, dass hohe Dosen von EBD manchmal eine chronische systemische Toxizität verursachen können, so dass eine niedrigere Dosis ratsam sein kann29.
Eine weitere Einschränkung dieses Verfahrens ist der invasive Charakter der Laminektomie (die für jede Technik erforderlich ist, die LIFU für die BSCB-Eröffnung verwendet, da Ultraschall nicht durch den Knochen eindringen kann). Der invasive Charakter dieses Verfahrens kann durch eine Begrenzung der Länge der Laminektomie reduziert werden. Die Durchführung der Laminektomie in den oberen Brustwirbeln, die kürzer und dünner sind, kann die Zeit für die Laminektomie auf unter 10 Minuten reduzieren. Aufgrund der Fragilität der MBs sowie ihrer kurzen Halbwertszeit ist die Zeit während dieses Protokolls begrenzt. Die Injektion von MBs sollte 1-2 Minuten vor der Behandlung mit LIFU erfolgen, und neue MBs sollten vor jeder Beschallung verabreicht werden, wenn mehrere LIFU-Behandlungen durchgeführt werden. Für Experimente, bei denen BSCB-Störungen an mehreren Ratten durchgeführt werden, müssen möglicherweise mehrere MB-Fläschchen vorbereitet werden. Da Mikrobläschen teuer sind, wird es vorgezogen, den chirurgischen Arbeitsablauf zu ändern, um die Zeit zwischen den Beschallungen zu minimieren, um die Anzahl der verwendeten MBs zu sparen.
Die hier beschriebene Technik ist in erster Linie für die Verwendung als Forschungsprotokoll gedacht. Obwohl das Laser-Targeting-Gerät die traditionellen Targeting-Modalitäten nicht in allen klinischen Umgebungen ersetzen wird, kann es in anderen Situationen nützlich sein. Bei nicht-invasiven Operationen können herkömmliche MRT-Modalitäten zuverlässig für das Targetingvon 30 verwendet werden. Bei invasiven Operationen, bei denen eine Laminektomie durchgeführt wird, kann das in diesem Protokoll beschriebene Laserpunktgerät verwendet werden, um das Zentrum der fokalen Zone der Beschallung über einer bestimmten Region (z. B. einem Tumor oder einer Stelle einer Rückenmarksverletzung) zum Zwecke der Medikamentenverabreichung oder immunmodulatorischen Therapie schnell zu lokalisieren und gleichzeitig eine MR-Führung zu ergänzen.
Insgesamt beschreibt dieses Protokoll eine effektive und erfolgreiche Technik zur Störung von BSCB und enthält mehrere Optionen zur Bestätigung der BSCB-Öffnung, sowohl in Echtzeit als auch in der Nachbearbeitung. Da das BSCB als Barriere für den Eintritt in das Rückenmarkparenchym fungiert, ist die Störung des BSCB eine mögliche Methode, um die Verabreichung von Therapeutika zu verbessern. Zum Beispiel verwendeten Weber-Adrian et al. LIFU mit einer Frequenz von 1,114 MHz und einer Burst-Länge von 10 ms, um die Genabgabe an die Halswirbelsäule zu vermitteln6. In ähnlicher Weise zeigten Smith et al., dass LIFU mit einer Frequenz von 580 kHz, durchschnittlichen akustischen Spitzendrücken um 0,46 MPa und einer Burst-Länge von 10 ms bei der Abgabe eines monoklonalen Antikörpers, Trastuzumab, an das Rückenmark in einem Nagetiermodell für leptomeningeale Metastasen helfen könnte10. Die meisten Studien konzentrierten sich auf die Verwendung von LIFU, anstelle von HIFU, da LIFU in der Lage ist, das BSCB vorübergehend zu permeabilisieren und gleichzeitig eine Schädigung des darunter liegenden Gewebes zu vermeiden. Typischerweise verwendet LIFU Intensitäten zwischen 0,125-3 W/cm2, während HIFU Intensitäten von 100-10.000 W/cm2 oder höher verwendet31. Infolgedessen entfaltet HIFU seine Wirkung hauptsächlich durch Erwärmung des Gewebes, während LIFU bei gleichzeitiger Verabreichung von MBs durch mechanische Kavitationseffekte wirkt. Die gleichzeitige Verabreichung von Therapeutika mit MBs kann zu einer stärkeren Extravasation des Arzneimittels in das Spinalparenchym führen, sowie zu dem Potenzial, MBs mit Arzneimitteln zu beladen und die MBs mit Ultraschall für eine gezielte Arzneimittelverabreichung zu lysieren.
Die Beschallungsparameter, die MB-Konzentration und die Art des in dieser Studie verwendeten Wandlers können je nach experimentellen Anforderungen geändert werden. Zum Beispiel kann ein Wandler mit einem kleineren Fokusbereich für Experimente bevorzugt werden, bei denen eine größere Kontrolle über die lokale Zielerfassung erforderlich ist, während ein Wandler mit höherer Leistung für Experimente verwendet werden kann, die eine starke Unterbrechung in kürzerer Zeit erfordern. Aufgrund der Flexibilität, die dieses Protokoll bietet, besteht ein großes Potenzial für den Einsatz in der präklinischen, klinischen und translationalen Forschung.
Offenlegungen
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten. Amir Manbachi unterrichtet und berät für BK Medical (GE Healthcare) und Neurosonics Medical und ist Erfinder einer Reihe von zum Patent angemeldeten FUS-Technologien. Betty Tyler erhält Forschungsgelder von den NIH und ist Miteigentümerin von Accelerating Combination Therapies (einschließlich Eigenkapital oder Optionen). Ashvattha Therapeutics Inc. hat ebenfalls eines ihrer Patente lizenziert und ist Aktionär von Peabody Pharmaceuticals. Nicholas Theodore erhält Lizenzgebühren von Globus Medical und besitzt Aktien von Globus Medical. Er ist Berater für Globus Medical und war Mitglied des wissenschaftlichen Beirats bzw. anderer Büros von Globus Medical. Die übrigen Autoren haben keinen Interessenkonflikt offenzulegen.
Danksagungen
Unterstützt von T32GM136577 (D.R.); N660012024075 (N.T., N.V.T., A.M., K.K.L.); R01 HL139158-01A1 und R01 HL071568-15 (N.V.T.); Johns Hopkins ICTR Clinical Research Scholars Program (KL2) (A.M.). Mehrere Figuren, die mit BioRender.com erstellt wurden.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9% Heparinized Sodium Chloride | Baxter | FKB0953G | Flush tail vein catheter with heparinized saline to prevent clotting. |
| 100 mL Luer Lock Tip Syringe (2) | Wilburn Medical | WUSA/120 | One syringe can be used to inject PBS and one for PFA (during transcardial perfusion) |
| 1x Phosphate buffered saline (PBS) | Thermo Scientific | 10010001 | For transcardial perfusion. |
| 22 G catheter | Med Vet International | 50-209-1694 | Use to place a tail vein catheter. |
| 97% Isoflurane | Thermo Scientific Chemicals | 247-897-7 | While rat is under isoflurane, be careful not to administer too much. A high dose can euthanize the rat. |
| Betadine 7.5% | Purdue Products | 4677 | |
| Class A clear threaded glass vial | Fisherbrand | 14-955-314 | Use to store spinal cord extraction. |
| Digital balance scale | Kent Scientific | SCL-4000 | |
| Electric razor | Wahl Home Products | 79449-200 | Shave fur off skin at incision site before surgery |
| Eosin-Y with Phloxine | Epredia | 71304 | |
| Evans blue dye | MP Biomedicals | 02151108-CF | Although it is non-toxic, it will stain skin blue if direct contact occurs. |
| Fixation Plate Assembly with 0.5 mm Forceps | PSI Impactors | 7001-2 | Affix the stereotactic arm to this frame |
| Gauze | Fisherbrand | 13-761-52 | |
| Heating pad | Kent Scientific | RT-0515 | |
| Hematoxylin | Epredia | 7211 | |
| Iris Scissors with Angled Blades | ProDentUSA | 12-15315 | |
| Isoflurane induction system | Kent Scientific | SOMNO-RATKIT | |
| Laser targetting apparatus | NA | custom | CAD design file provided in supplemental section. Simply place a laser inside the apparatus created from the file. |
| Lubricating eye ointment | Systane | N/A | |
| Luer Lock 3-Way Stopcock | Sigma | SAS7521-10EA | Can use to fill water cone through inlet valve |
| Lumason microbubbles kit | Bracco | 0270-7099-16 | |
| Microscope cover glass | Fisherbrand | 12-545J | |
| Microscope slides | Fisherbrand | 12-550-15 | |
| Microtome | Epredia | 23-900-671 | |
| Mounting medium with 4',6-diamidino-2-phenylindole (DAPI) | Vector Laboratories | H-2000-2 | |
| Mylar membrane | Chemplex | 3016 | Can cut membrane to appropriate size if too large for cone |
| NeuroFUS 2.52" diameter 250 kHz transducer | Sonic Concepts | CTX-250 | Transducer system includes custom water cone and probe holder |
| NeuroFUS PRO v2.0 system | Sonic Concepts | NFS102v2 | Includes Transducer Power Output, Matching Network and associated cables |
| Offset Bone Nippers | Fine Science Tools | 16101-10 | Use to remove spinous processes and laminae for laminectomy |
| Paraffin | Polysciences | 24364-1 | Can place spinal cord sample in paraffin to slice into thin sections for histology. |
| Paraformaldehyde (4%) | Thermo Scientific | J61899-AK | For transcardial perfusion. |
| Rat Surgical Kit | Kent Scientific | INSRATKIT | Consists of tweezer #5, needle holder, McPherson-Vannas scissors, Iris scissors, ALM self-retaining retractors, Iris forceps, and blunt probe. These products should be sufficient to perform a laminectomy. |
| Razor blade | Fisherbrand | 12-640 | Use to cut spinal cord extraction to desirable length and split section down midline. |
| Rectal thermometer | Kent Scientific | RET-2 | Maintain rat temperature between 35.9–37.5 °C |
| Rubber band | Fisherbrand | 50-205-1983 | |
| Single animal vaporizer unit | Kent Scientific | SF-01 | |
| Stereotactic arm | Kopf Instruments | Model 963 | |
| Sterile absorbent pad | McKesson | 4033-CS150 | Place under rat and above heating pad and fixation plate before laminectomy |
| Ultrasound gel | Aquasonic | PLI 01-34 | Ensure gel is free of bubbles to the best of your ability. |
Referenzen
- Chopra, N., et al. Blood-spinal cord barrier: Its role in spinal disorders and emerging therapeutic strategies. NeuroSci. 3 (1), 1-27 (2021).
- Bartanusz, V., Jezova, D., Alajajian, B., Digicaylioglu, M. The blood-spinal cord barrier: morphology and clinical implications. Annals of Neurology. 70 (2), 194-206 (2011).
- Hersh, A. M., Alomari, S., Tyler, B. M. Crossing the blood-brain barrier: Advances in nanoparticle technology for drug delivery in neuro-oncology. International Journal of Molecular Sciences. 23 (8), 4153 (2022).
- Pan, W., Banks, W. A., Kastin, A. J. Permeability of the blood-brain and blood-spinal cord barriers to interferons. Journal of Neuroimmunology. 76 (1-2), 105-111 (1997).
- Bellettato, C. M., Scarpa, M. Possible strategies to cross the blood-brain barrier. Italian Journal of Pediatrics. 44, 131 (2018).
- Weber-Adrian, D., et al. Gene delivery to the spinal cord using MRI-guided focused ultrasound. Gene Therapy. 22 (7), 568-577 (2015).
- Hersh, A. M., et al. Applications of focused ultrasound for the treatment of glioblastoma: A new frontier. Cancers. 14 (19), 4920 (2022).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Cho, H., et al. Localized down-regulation of P-glycoprotein by focused ultrasound and microbubbles induced blood-brain barrier disruption in rat brain. Scientific Reports. 6, 31201 (2016).
- Smith, P., Ogrodnik, N., Satkunarajah, J., O'Reilly, M. A. Characterization of ultrasound-mediated delivery of trastuzumab to normal and pathologic spinal cord tissue. Scientific Reports. 11 (1), 4412 (2021).
- Montero, A. S., et al. Ultrasound-induced blood-spinal cord barrier opening in rabbits. Ultrasound in Medicine & Biology. 45 (9), 2417-2426 (2019).
- Fletcher, S. P., Choi, M., Ogrodnik, N., O'Reilly, M. A. A porcine model of transvertebral ultrasound and microbubble-mediated blood-spinal cord barrier opening. Theranostics. 10 (17), 7758-7774 (2020).
- Honeycutt, S. E., O'Brien, L. L. Injection of Evans blue dye to fluorescently label and image intact vasculature. BioTechniques. 70 (3), 181-185 (2021).
- Fletcher, S. P., Choi, M., Ramesh, R., O'Reilly, M. A. Focused ultrasound-induced blood-spinal cord barrier opening using short-burst phase-keying exposures in rats: A parameter study. Ultrasound in Medicine & Biology. 47 (7), 1747-1760 (2021).
- Cross, C. G., et al. Technical note: Quantification of blood-spinal cord barrier permeability after application of magnetic resonance-guided focused ultrasound in spinal cord injury. Medical Physics. 48 (8), 4395-4401 (2021).
- Hong, Y. R., et al. Ultrasound stimulation improves inflammatory resolution, neuroprotection, and functional recovery after spinal cord injury. Scientific Reports. 12 (1), 3636 (2021).
- Liao, Y. H., et al. Low-intensity focused ultrasound alleviates spasticity and increases expression of the neuronal K-Cl cotransporter in the L4-L5 sections of rats following spinal cord injury. Frontiers in Cellular Neuroscience. 16, 882127 (2022).
- Redfors, B., Shao, Y., Omerovic, E. Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Laboratory Animals. 48 (1), 6-14 (2014).
- Lillie, L. E., Temple, N. J., Florence, L. Z. Reference values for young normal Sprague-Dawley rats: weight gain, hematology and clinical chemistry. Human & Experimental Toxicology. 15 (8), 612-616 (1996).
- Lin, X. J., et al. Spinal cord lateral hemisection and asymmetric behavioral assessments in adult rats. Journal of Visualized Experiments. (157), e57126 (2020).
- Tsehay, Y., et al. Low-intensity pulsed ultrasound neuromodulation of a rodent's spinal cord suppresses motor evoked potentials. IEEE Transactions on Biomedical Engineering. , (2023).
- Payne, A. H., et al. Magnetic resonance imaging-guided focused ultrasound to increase localized blood-spinal cord barrier permeability. Neural Regeneration Research. 12 (12), 2045-2049 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. Journal of Visualized Experiments. (146), e59295 (2019).
- Sabbagh, A., et al. Opening of the blood-brain barrier using low-intensity pulsed ultrasound enhances responses to immunotherapy in preclinical glioma models. Clinical Cancer Research. 27 (15), 4325-4337 (2021).
- Dréan, A., et al. Temporary blood-brain barrier disruption by low intensity pulsed ultrasound increases carboplatin delivery and efficacy in preclinical models of glioblastoma. Journal of Neuro-Oncology. 144 (1), 33-41 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Yamamoto, H., Imai, S., Okuyama, T., Tsubura, Y. Pulmonary lesions in rats caused by intravenous injection. Acta Pathologica Japonica. 32 (5), 741-747 (1982).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Scientific Reports. 9 (1), 321 (2019).
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten