Method Article
Нарушение гематоспинномозгового барьера с использованием низкоинтенсивного фокусированного ультразвука на модели крысы
В этой статье
Резюме
Нарушение гематоспинномозгового барьера (БСКБ) может быть успешно достигнуто с помощью внутривенного введения микропузырьков и применения низкоинтенсивного фокусированного ультразвука (LIFU). В этом протоколе подробно описано открытие BSCB с использованием LIFU на модели грызуна, включая настройку оборудования, впрыскивание микропузырьков, локализацию мишени и визуализацию сбоев BSCB.
Аннотация
Низкоинтенсивный фокусированный ультразвук (LIFU) использует ультразвуковые пульсации с более низкой интенсивностью, чем ультразвук, и тестируется как обратимая и точная нейромодулирующая технология. Несмотря на то, что LIFU-опосредованное открытие гематоэнцефалического барьера (ГЭБ) было детально изучено, до настоящего времени не было разработано стандартизированной методики открытия гематоэнцефалического барьера (BSCB). Таким образом, в данном протоколе представлен метод успешного разрушения BSCB с использованием ультразвуковой обработки LIFU на модели крысы, включая описание подготовки животных, введения микропузырьков, выбора и локализации мишеней, а также визуализацию и подтверждение нарушения BSCB. Представленный здесь подход особенно полезен для исследователей, которым нужен быстрый и экономичный метод для тестирования и подтверждения локализации мишени и точного разрушения BSCB на модели мелкого животного с помощью сфокусированного ультразвукового датчика, оценки эффективности параметров ультразвуковой обработки BSCB или изучения применений LIFU в спинном мозге, таких как доставка лекарств. иммуномодуляция и нейромодуляция. Рекомендуется оптимизировать этот протокол для индивидуального использования, особенно для продвижения будущих доклинических, клинических и трансляционных исследований.
Введение
Подобно гематоэнцефалическому барьеру (ГЭБ), гематоэнцефалический барьер (ГСКБ) регулирует движение циркулирующих растворенных веществ, клеток и компонентов плазмы в спинномозговую паренхиму1. Это защитное свойство является результатом специализированной системы плотно связанных, нефенестрированных эндотелиальных клеток, выстилающих спинномозговые капилляры2. Как правило, только легкие липофильные молекулы с положительным зарядом могут пересекать обабарьера3. Несмотря на исследования, которые показывают, что BSCB имеет несколько более высокую проницаемость, чем ГЭБ, оба барьера ограничивают доставку терапевтических средств в центральную нервнуюсистему. Было разработано несколько стратегий для увеличения транспортировки лекарств через BSCB, включая методы повышения осмотического давления в спинномозговых капиллярах, разработку препаратов, взаимодействующих с рецепторами брадикинина, и создание функционализированных наночастиц5.
Разрушение BSCB также может быть достигнуто путем внутривенного введения микропузырьков (МБ) с последующим ультразвуковым воздействием низкоинтенсивного фокусированного ультразвука (LIFU)6. Акустическое поле, создаваемое ультразвуковым преобразователем, вызывает колебания MB, которые, в свою очередь, оказывают давление на эндотелиальную стенку и ослабляют плотные соединения7. Плотное ослабление соединений создает временные промежутки в капиллярах, позволяя терапевтическим препаратам проникать в паренхиму позвоночника (рис. 1). Этот процесс также может создавать трансэндотелиальные фенестрации, усиливать трансцитоз и подавлять регуляцию АТФ-связывающих кассетных транспортеров, таких как Р-гликопротеин 8,9. Ключевым преимуществом этого метода является возможность свести к минимуму нецелевые эффекты, направляя фокальную область ультразвука в интересующее место в спинном мозге. В нескольких клинических исследованиях изучалась эффективность LIFU-опосредованного вскрытия ГЭБ для лечения патологий центральной нервной системы, включая глиомы, боковой амиотрофический склероз, болезнь Альцгеймера и болезнь Паркинсона. Несмотря на то, что LIFU-опосредованное нарушение BSCB не так широко характеризуется, как LIFU-опосредованное нарушение ГЭБ, несколько групп сообщили об успешном разрушении BSCB в моделях грызунов, кроликов и свиней10,11,12. В целом, интерес к этому методу быстро растет, особенно в качестве жизнеспособного способа доставки лекарств.
В этом протоколе описана методика LIFU-опосредованного разрушения BSCB на крысиной модели. Процедура включает в себя подробное описание подготовки животного, настройки оборудования LIFU, введения MB, локализации мишени и извлечения спинного мозга. Подтверждение локализации мишени и нарушения BSCB оценивается с помощью экстравазации синего красителя Эванса (EBD) в спинной мозг. EBD представляет собой нетоксичное соединение, которое связывается с сывороточным альбумином и может быть идентифицировано по его насыщенному синему цвету визуально и красной автофлуоресценции при микроскопии13.
Перечисленные здесь шаги представляют собой быструю и недорогую альтернативу традиционным системам LIFU под контролем ультразвука (УЗИ) или магнитно-резонансной томографии (МРТ). В результате, этот метод полезен для исследователей, заинтересованных в быстром тестировании и подтверждении возможностей нацеливания и разрушения BSCB их датчика LIFU до приобретения дополнительного оборудования и материалов или применения LIFU в спинном мозге, таких как доставка лекарств, иммуномодуляция и нейромодуляция.
протокол
Все исследования на животных были одобрены и проведены в соответствии с Комитетом по уходу за животными и их использованию при Университете Джонса Хопкинса (IACUC RA20M223). Для настоящего исследования использовались только взрослые самки крыс Спрэг-Доули (средний вес: 250 г, возраст: 11 недель).
1. Сборка и настройка низкоинтенсивного сфокусированного ультразвука
- Приобретите систему сфокусированного ультразвукового датчика с характеристиками, достаточными для достижения вскрытия BSCB у крыс. Предлагаемые параметры из литературы включают центральную частоту в диапазоне 0,25-4 МГц и способность создавать пиковое давление в диапазоне 0,2-2,1 МПа 10,14,15,16,17. Убедитесь в том, что система включает в себя приводное/управляющее оборудование, которое, как минимум, включает в себя генератор волн/сигналов, радиочастотный (РЧ) привод/усилитель мощности и согласующую сеть (рис. 2A).
ПРИМЕЧАНИЕ: В описанной здесь установке используется коммерчески доступный многоэлементный преобразователь с центральной частотой 250 кГц и диаметром 64 мм (рис. 2B). - Прикрепите напечатанный на 3D-принтере держатель зонда и водяной конус к датчику (рис. 2C). Обеспечьте водонепроницаемое уплотнение между диффузором и датчиком.
ПРИМЕЧАНИЕ: Специальный конус и держатель зонда поставлялись в комплекте с преобразователем, используемым в этом эксперименте. Конус и держатель зонда крепятся к преобразователю с помощью винтов, которые также входят в комплект поставки. - Стерилизуйте акустически прозрачную полиэфирную мембрану толщиной 50 мкм и прикрепите к нижней части водяного конуса с помощью резиновой ленты.
- Наполните водяной конус дегазированной и деионизированной водой с помощью впускной и выпускной трубок. Следите за тем, чтобы внутри диффузора не было пузырьков воздуха, так как они могут нарушить акустическую связь между преобразователем и мишенью. Полиэфирная мембрана должна быть слегка надута.
ПРИМЕЧАНИЕ: Чтобы удалить пузырьки воздуха из конуса, направьте пузырьки к выпускному клапану, заполняя конус водой через впускной клапан. Если присутствует много мелких пузырьков, закройте все клапаны и вращайте конус, пока не останется один большой пузырь. Направьте этот пузырь к выпускному клапану и возобновите заполнение конуса. - Подключите к преобразователю приводную аппаратуру, которая включает в себя генератор волн и усилитель ВЧ-привода. Кабель преобразователя подключается к выходной стороне согласующей сети, а генератор сигнала/усилитель мощности подключается к входной стороне согласующей сети. Кабели должны быть подключены к соответствующему номеру канала (Рисунок 2D-G).
ПРИМЕЧАНИЕ: В коммерческой системе, используемой в данном исследовании, генератор волн и усилитель ВЧ-привода являются компонентами выходной мощности преобразователя (TPO) (рис. 2D). - Прикрепите держатель датчика к стереотаксическому кронштейну. Прикрепите стереотаксический кронштейн к фиксирующей пластине в сборе. Это позволит расположить датчик точно над грызуном во время ультразвукового воздействия.
2. Подготовка животных и хирургическая ламинэктомия
- Обезболивайте крысу смесью изофлурана и медицинского воздуха в индукционной камере, прикрепленной к канистре с угольным фильтром. Установите скорость потока газа 400 мл/мин, а испаритель изофлурана в диапазоне 1,5%-2,5% для индукции анестезии. Время, проведенное в камере до полной седации, варьируется, хотя обычно составляет от 3 до 6 минут.
- Запишите вес крысы, находящейся под действием седативных препаратов, и проведите тест на защемление пальца ноги. Если в ответ на щипку наблюдается подергивание или движение, поместите крысу обратно в индукционную камеру еще на 1 минуту и повторите тест на сжатие пальца ноги. При необходимости повторите процедуру, чтобы убедиться, что крыса находится под полным наркозом.
- Поместите грелку и стерильную впитывающую салфетку на фиксирующую пластину. Положите крысу на впитывающую прокладку, нанесите глазную мазь и поместите ректальный термометр для контроля температуры тела.
ПРИМЕЧАНИЕ: В течение всей хирургической процедуры следует контролировать температуру и частоту сердечных сокращений крысы (в идеале частота сердечных сокращений должна быть в пределах 330-480 уд/мин и температура в пределах 35,9-37,5 °C)18,19. Отрегулируйте изофлуран или грелку соответствующим образом, чтобы предотвратить преждевременную смерть. Грелку можно настроить на температуру около 37 °C, и ее следует включать и выключать по мере необходимости для поддержания оптимальной температуры тела. - Пальпируют последнее ребро крысы, которое прикреплено к позвоночнику у13-го грудного позвонка (Т13). Используйте электрическую бритву, чтобы сбрить шерсть со спинной поверхности между последним ребром и шеей. Протрите открытые участки кожи марлей, смоченной в 10% йодоповидоне.
- Сделайте разрез по средней линии с помощью ножниц по радужной оболочке и рассеките фасцию до тех пор, пока остистые отростки и листовая пластинка не обнажутся. Удаляют кость со смещенными кусачками и ножницами для радужной оболочки под углом до тех пор, пока спинной мозг не обнажится20. Продолжительность ламинэктомии и разреза варьируется в зависимости от количества различных мишеней, подлежащих ультразвуковому обработке. В данном исследовании была выполнена трехуровневая ламинэктомия с использованием разреза 3 см.
ПРИМЕЧАНИЕ: Избегайте прикосновения или давления на спинной мозг во время извлечения кости, чтобы предотвратить травму. Если задние конечности крысы дергаются во время ламинэктомии, значит, на спинной мозг или нервные корешки было приложено слишком большое усилие. - Закрепите крысу на фиксирующей пластине, зажав остистые отростки, прилегающие к ламинэктомии. Слегка натяните позвоночник, чтобы свести к минимуму искривление, прежде чем зафиксировать зажимы.
3. Локализация цели с помощью лазерного наведения
- Отрегулируйте положение датчика с помощью стереотаксического рычага до тех пор, пока он не окажется точно над местом ламинэктомии (рис. 3A). Рама позволяет перемещаться по осям X, Y и Z, а также поворачиваться на 180° в вертикальной плоскости и на 360° в горизонтальной плоскости.
- Прикрепите лазерный аппарат ко дну водяного конуса и опускайте его до тех пор, пока лазерная точка не станет видимой. Отрегулируйте боковое положение преобразователя до тех пор, пока лазерная точка не окажется над местом, которое является мишенью для разрушения BSCB (Рисунок 3B, C).
ПРИМЕЧАНИЕ: Файл системы автоматизированного проектирования (САПР) для лазерного аппарата включен в дополнительный раздел (дополнительный рисунок 1). - Извлеките лазерный аппарат и заполните пространство между конусом и спинным мозгом дегазированным ультразвуковым гелем (рис. 3D). Для максимального сцепления убедитесь, что в геле нет пузырьков воздуха.
ПРИМЕЧАНИЕ: В этом исследовании датчик с прикрепленным водяным конусом опускали до тех пор, пока он не оказался на 1 см выше шнура. Поскольку водяной конус имел длину 30 мм, общее расстояние от преобразователя до шнура составляло 40 мм. Водяной конус был помещен на расстоянии 1 см от спинного мозга, потому что кожа, фасции и мускулатура крысы по обе стороны от разреза препятствуют прямому контакту между кончиком конуса и спинным мозгом. Использование цифр на оси Y стереотаксического манипулятора может быть полезно для отслеживания вертикального расстояния, на котором конус находится на расстоянии 1 см от шнура, тем более, что гель затруднит визуальное подтверждение расстояния конуса от шнура. - Задайте параметры ультразвуковой обработки на TPO. Для успешного разрушения BSCB может быть использован целый ряд значений. Для максимальной мощности установите частоту ультразвука, близкую к центральной частоте преобразователя. Значения, использованные в данном исследовании, приведены в таблице 1.
ПРИМЕЧАНИЕ: Параметры, перечисленные здесь, были адаптированы из предыдущей работы с LIFU, с центральной частотой 500 кГц, длительностью тонального всплеска 500 мкс, рабочим циклом 50% и временем ультразвуковой обработки 5 или 10 минут для безопасной нейромодуляции спинного мозга грызунов21. Основываясь на исследованиях, в которых было успешно достигнуто разрушение BSCB, другими параметрами, которые могут быть использованы, являются центральные частоты в диапазоне от 500 кГц до 1 МГц, давление 0,2-2,1 МПа, длина всплеска 10-25 мс и время ультразвукового воздействия 2-5 мин 6,10,11,22.
| Параметр | Ценность |
| Частота (кГц) | 250 |
| Дистанция фокусировки (мм) | 40 |
| Акустическое пиковое давление (МПа) | 0.47 |
| Рабочий цикл | 40% |
| Длина пакета (мс) | 400 |
| Период(ы) | 1 |
| Время ультразвуковой обработки (мин) | 5 |
Таблица 1: Параметры ультразвуковой обработки, используемые для разрушения BSCB.
4. Введение микропузырьков
- Приготовьте раствор МБ в соответствии с инструкциями, предоставленными производителем. Избегайте попадания воздуха в раствор.
ПРИМЕЧАНИЕ: MB хрупкие и слипаются в верхней части флакона/шприца, если оставить их неподвижными в течение нескольких минут. Регулярно встряхивайте флакон и шприц, чтобы предотвратить неравномерное диспергирование MBs. MB имеют короткий срок службы; Обратитесь к руководству производителя, чтобы определить срок годности. - Введите катетер хвостовой вены 22 G и промойте 0,2 мл гепаринизированного физиологического раствора (500 МЕ/мл)23. Чтобы увеличить шансы на успешную катетеризацию хвостовой вены, окуните хвост в теплую воду и наложите жгут на основание хвоста, чтобы увеличить диаметр вены.
ПРИМЕЧАНИЕ: Катетеризация хвостовой вены может быть проведена до ламинэктомии животного, позиционирования и нацеливания для экономии времени исследования. - Введите в катетер 1 мл/кг 3% EBD. Смыть 0,2 мл гепаринизированного физиологического раствора. Конечности и глаза крысы посинеют. Подтвердите успешную катетеризацию хвостовой вены, проверив изменение синего цвета в дорсальной спинномозговой вене крысы (рис. 4).
ПРИМЕЧАНИЕ: EBD может быть введен задолго до инъекции MB и не влияет на воздействие ультразвука. Кроме того, поскольку Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в настоящее время не одобрило ультразвуковую терапию для лекарств, уже находящихся в системе, EBD также может быть введен после ультразвуковой обработки. Это приведет к меньшему поглощению красителя, но может быть более клинически значимым. - Введите 0,2 мл болюса МБ в катетер и промойте 0,2 мл гепаринизированного физиологического раствора. Начинайте ультразвуковую терапию через 1-2 мин после введения МБ. Используемая здесь настройка не собирает обратную связь по ультразвуку в режиме реального времени.
ПРИМЕЧАНИЕ: В исследованиях по нарушению BSCB обычно используется более высокая концентрация MBs, чем показано для диагностической визуализации. Некоторые концентрации распространенных марок MB, используемых для разрушения ГЭБ и BSCB на крысах, включают 0,02-0,2 мл/кг и болюсы 200 мкл 10,15,24,25.
5. Экстракция спинного мозга и обработка тканей
- После завершения ультразвуковой обработки транскардиально перфузии крысы 100 мл холодного фосфатно-солевого буфера (PBS) до тех пор, пока кровь не станет полностью прозрачной. Печень, которая имеет насыщенный синий цвет из-за красителя, должна потускнеть до светло-коричневато-голубого цвета26.
ПРИМЕЧАНИЕ: Целью перфузии является удаление лишней крови из сосудистой сети спинного мозга. Поскольку EBD связывается с альбумином, он также удаляет избыток EBD. Это гарантирует, что любой EBD, обнаруженный визуально или с помощью флуоресцентной микроскопии в спинном мозге, является результатом экстравазации красителя в спинномозговую паренхиму. - Транскардиально перфузии со 100 мл холодного 4% параформальдегида (PFA). Конечности крысы будут дергаться во время этой фиксации, если делать ее тщательно. Эта перфузия PFA усыпляет крысу.
- Извлеките спинной мозг и поместите его в 4% PFA при температуре 4 °C на ночь. Замените PFA на PBS на следующий день.
6. Визуализация разрушения BSCB
- Изолируйте 2-сантиметровый участок, окружающий место ультразвукового воздействия, с помощью бритвенного лезвия. Разделите отрезок по средней линии с помощью лезвия и разделите его на участки толщиной 10 мкм с помощью микротома. Для светлопольной визуализации используйте краситель гематоксилин-эозин (H&E).
ПРИМЕЧАНИЕ: Образцы спинного мозга H&E, показанные в этом исследовании, были окрашены гематоксилином в течение 3 мин и эозином в течение 1 мин27. - Для флуоресцентной микроскопии депарафинизируют предметные стекла, содержащие срезы спинного мозга, и контрокрашивают 25 мкл 4′,6-диамидино-2-фенилиндола (DAPI), растворенного в монтажной среде (0,5 мкг/мл). Инкубировать при 4 °C не менее 10 мин. Избегайте света, чтобы предотвратить обесцвечивание.
ПРИМЕЧАНИЕ: Депарафинизацию можно заменить с помощью криостата для получения замороженных срезов. - Используйте флуоресцентный микроскоп, чтобы получить изображение всех предметных стекол. Автофлуоресценция EBD (возбуждение: 470 нм и 540 нм; излучение: 680 нм) видна в красном канале, в то время как DAPI присутствует в синем канале. Используйте световой микроскоп для получения изображений предметных стекол H&E.
ПРИМЕЧАНИЕ: Несмотря на то, что этот протокол описывал процедуру, не приносящую выживания, она также выполнялась с использованием хирургических методов выживания. Для проведения операции по выживанию необходимо продезинфицировать кожу перед разрезом с помощью 3 чередующихся аппликации йодоповидона и ввести бупренорфин подкожно (0,05 мг/кг) перед операцией. Продолжайте вводить бупренорфин подкожно каждые 12 ч, по крайней мере, в течение 3 дней после операции, с дополнительными днями, если крыса проявляет признаки боли. При повреждении спинного мозга у крыс может наблюдаться задержка мочи или нарушение походки. Это проявляется в виде волочения или задержки движения задних конечностей или пальпируемого, растянутого мочевого пузыря. Если это происходит, домашние крысы получают обогащенный питательными веществами водный гель для еды и гидратации, а также вручную сцеживают мочевой пузырь два раза в день до тех пор, пока не восстановится рефлекторное мочеиспускание. Если наблюдается полный паралич задних конечностей или непреодолимая боль, усыпьте крысу.
Результаты
В данной работе показано, что одновременное применение ультразвуковой обработки LIFU и введения MB является эффективным методом локализации нарушений BSCB. На открытие БСКБ указывает наличие экстравазации EBD в спинномозговую паренхиму. Изменения заметны как визуально, так и при флуоресцентной микроскопии. Сосудистая сеть спинного мозга видна после ламинэктомии и представляет собой заднюю спинномозговую вену с несколькими более мелкими сосудами, расходящимися латерально (рис. 4А). Внутривенное введение EBD через катетер хвостовой вены приводит к тому, что эта сосудистая сеть обогащается синим красителем (рис. 4B). Это хороший момент в процедуре, чтобы убедиться, что ламинэктомия не привела к разрыву какой-либо сосудистой сети позвоночника, так как это привело бы к скоплению синей крови на спинном мозге. После ультразвуковой обработки над целевым местом должно стать видно пятно синего цвета, указывающее на экстравазацию EBD в белую паренхиму из-за нарушения BSCB (рис. 4C). Размер этого пятна варьируется в зависимости от ряда факторов, включая размер фокальной области преобразователя и количество времени после ультразвуковой обработки. Чтобы увеличить вероятность появления экстравазации EBD, следует увеличить интервал времени между ультразвуковой экстракцией и экстракцией спинного мозга.
Несмотря на то, что перфузия PFA не является обязательным этапом перед экстракцией пуповины и последующим анализом тканей, она удаляет кровь из образца и увеличивает контраст между белой паренхимой позвоночника и синими участками, окрашенными EBD. У всех крыс, получавших МБ и ультразвуковую терапию LIFU, наблюдалась явная экстравазация EBD в спинной мозг, в то время как у негативной контрольной группы, получавшей MBs и EBD без ультразвуковой обработки LIFU, этого не было. Репрезентативные изображения показаны на рисунке 5. Сагиттальные разрезы тканей показывают, что экстравазация EBD не только поверхностная, но и распространяется далеко в сам спинной мозг. Это ожидаемо, так как фокальная область датчика, используемого в данном исследовании, больше, чем диаметр спинного мозга крысы. Иногда в сагиттальных разрезах можно заметить небольшое кровоизлияние. Это может быть связано с ламинэктомией или ультразвуковым ультразвуком. Если кровоизлияние находится близко к дорсальной периферии спинного мозга, это, скорее всего, связано с ламинэктомией.
Для дальнейшей оценки экстравазации EBD сагиттальные срезы спинного мозга были окрашены DAPI (ядерным маркером) и визуализированы с помощью флуоресцентного микроскопа. Все шнуры, получившие ультразвуковую обработку LIFU (n = 3), показали значительно большую интенсивность автофлуоресценции EBD (p = 0,016), чем шнуры, не получавшие ультразвуковой обработки, с одинаковой интенсивностью DAPI, присутствующей в обоих случаях (рис. 6). Кроме того, анализ H&E не выявил повреждений нейронов, кровоизлияний или повреждений полостей в местах ультразвуковой обработки, что подтверждает безопасность этой процедуры. В качестве сравнения приведены примеры повреждений шнура из-за хирургического неправильного обращения и мощного ультразвукового воздействия. Маркируются кровоизлияния, повреждения тканей, поражения полостей и возможная вакуолизация. Несмотря на то, что в примере с мощным ультразвуковым излучением не видно кровоизлияния, сообщалось, что это также является эффектом ультразвукового нарушения.
Кроме того, был проведен поведенческий анализ на крысах, которые получали ультразвуковую терапию MBs, EBD и LIFU. Хотя этот метод не исключает полностью повреждение тканей, он проверяет, возник ли двигательный дефицит из-за этой процедуры. Крысы гуляли в клетке в течение 5 минут каждый день в течение 5 дней, а локомоторная функция оценивалась на основе локомоторной шкалы Бассо Битти Бреснахана (Дополнительный видеофайл 1). Все крысы (n = 5) получали наивысший балл до ультразвуковой обработки, после ультразвуковой обработки и каждый день периода выживания (рис. 7).
Наконец, тепловые эффекты параметров ультразвука, использованных в этом исследовании, были измерены с использованием двух образцов спинного мозга крыс ex vivo и зонда цифрового термометра с тонким наконечником, вставленным в спинной мозг. Температуру образцов спинного мозга отслеживали в течение 5 минут до, во время и после ультразвуковой обработки, в общей сложности в течение 15 минут. Наблюдались минимальные изменения температуры. Фактически, в обоих образцах наблюдалось изменение температуры на ≤1,3 °C из-за воздействия ультразвука, что снижало вероятность гипертермического повреждения в результате воздействия ультразвука (рис. 8).
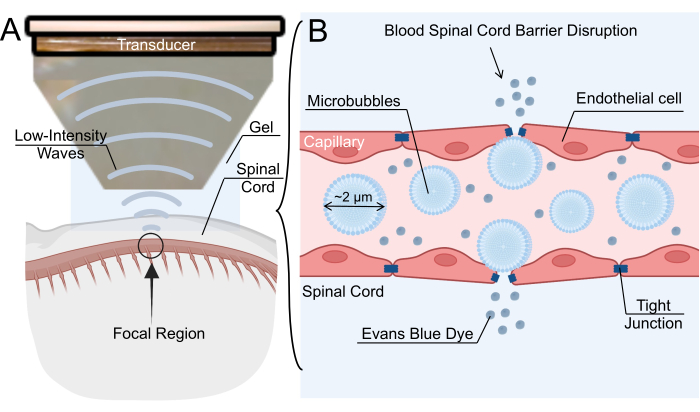
Рисунок 1: Низкоинтенсивный механизм открытия гематоспинно-спинного барьера, опосредованный фокусированным ультразвуком. (A) Схематический обзор ультразвукового ультразвукового ультразвука низкой интенсивности (LIFU) ультразвуковой обработки спинного мозга крыс. (B) Механизм открытия гемато-спинномозгового барьера (БСКБ) с помощью ультразвуковой обработки LIFU внутривенных микропузырьков (МБ). MB колеблются в ответ на LIFU, вызывая расширение плотных соединений между эндотелиальными клетками. Это нарушение BSCB позволяет экстравазировать наночастицы, терапевтические препараты или синий краситель Эванса. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Иллюстрация 2: Настольная настройка и подключение низкоинтенсивного сфокусированного ультразвука. (A) Схематическое изображение, показывающее типичные компоненты сфокусированного ультразвука. (B) Обзорное изображение установки сфокусированного ультразвука, в том числе: 1. выходная мощность преобразователя (TPO), 2. Сеть сопоставления, 3. Преобразователь LIFU, 4. стереотаксический инструмент, 5. подвижные зажимы. (C) Преобразователь, в том числе: 1. держатель зонда, 2. кольцевой преобразователь, 3. водяной конус, 4. впускная труба для воды, 5. водовыпускная трубка, 6. мембрана, закрепленная резинкой. (D) Передняя часть TPO, в том числе: 1. Экранированный радиочастотный корпус, 2. сенсорная передняя панель дисплея с регулируемым меню, 3. вращающаяся ручка для регулировки параметров, 4. выходной переключатель пуск/стоп. (E) Задняя часть TPO, в том числе: 1. Выходные разъемы канала, 2. Земля, 3. Входной USB-порт для программного управления, 4. Внутренний триггер, 5. Выходной разъем синхронизации, 6. Разъем для входа питания и питания, 7. Выключатель питания. (F) Согласование сетевого выхода с проводами, совпадающими с номерами каналов. (G) Согласование сетевого входа XDR с проводами, соответствующими номерам каналов Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
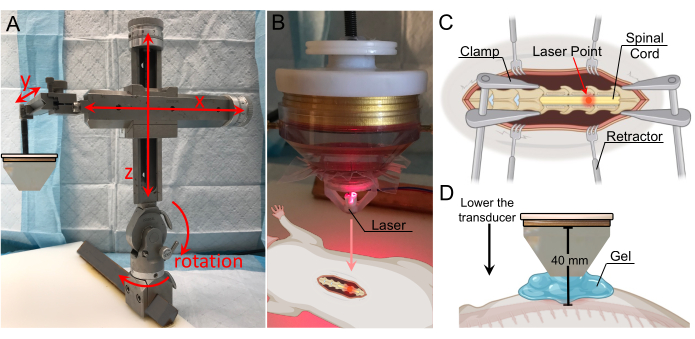
Рисунок 3: Локализация цели с лазерным наведением . (A) Стереотаксический манипулятор с диапазоном движения по всем трем осям и возможностью вращения. Он крепится к фиксирующей пластине внизу. (Б) Лазерный аппарат для идентификации фокальной зоны. Лазер расположен на кончике преобразователя и находится на одной линии с фокальной областью. (C) Иллюстрация, показывающая лазер на обнаженном спинном мозге, указывающая на то, что фокальная область датчика теперь направлена в это место. (D) Датчик опускается до тех пор, пока кончик конуса не окажется на 1 см выше шнура, а зазор заполняется гелем для обеспечения максимального сцепления. Расстояние от датчика до спинного мозга составляет 40 мм (фокусное расстояние). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
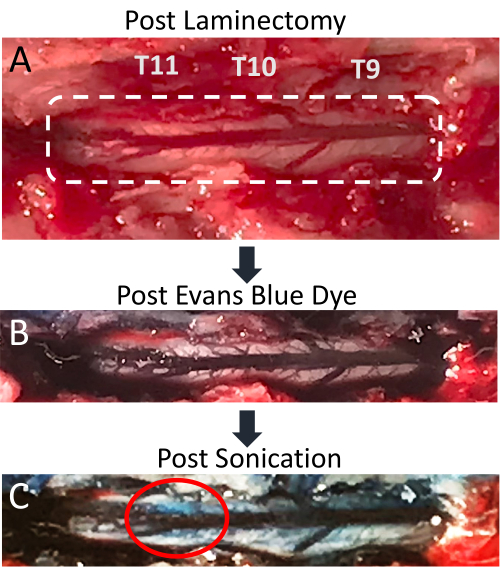
Рисунок 4: Экстравазация синего красителя Эванса при постультразвуковой терапии спинного мозга . (A) Изображение разреза ламинэктомии крысы T9-T11 с отчетливо видны обнаженный спинной мозг и задняя дорсальная вена. (B) Окружающие ткани и сосудистая сеть спинного мозга приобретают синий цвет после внутривенной инъекции синего красителя Эванса (EBD). (C) Экстравазация EBD в паренхиму спинного мозга в месте ультразвукового воздействия, указывающая на то, что произошло нарушение BSCB. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 5: Экстракция спинного мозга и визуализация вскрытия BSCB после перфузии. (А) Иссечение спинного мозга у контрольной крысы без лечения LIFU. Эта крыса получала только MB и EBD. Срединно-сагиттальный срез спинного мозга, погруженный в парафин, показан на врезке, экстравазация EBD не видна. (B) Иссечение спинного мозга у крыс с помощью LIFU. Эта крыса также получала MB и EBD. Колонка экстравазации EBD видна и локализуется в ультразвуковой области. Срединно-сагиттальный срез шнура, погруженного в парафин, показан на врезке со стрелкой, указывающей на концентрацию EBD, видимую внутри места ультразвукового контроля. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
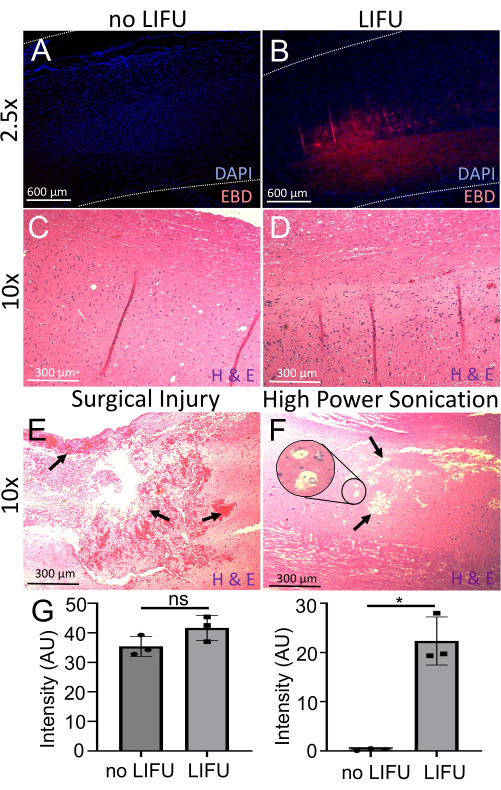
Рисунок 6: Обнаружение и оценка вскрытия BSCB. (A) Спинной мозг, окрашенный DAPI (ядерный маркер, синий). Видна минимальная автофлуоресценция EBD (красный). Эта крыса не получала LIFU. (B) Спинной мозг, окрашенный DAPI (ядерный маркер, синий). Видна локализованная автофлуоресценция EBD (красная) в месте ультразвуковой мишени. Эта крыса получала LIFU и MBs. (C) Спинной мозг крысы без LIFU, окрашенный гематоксилином (окрашивание нуклеиновыми кислотами) и эозином (неспецифическое белковое окрашивание) (H&E). Повреждений нейронов, кровоизлияний или поражений полостей не видно. (D) Спинной мозг крысы с LIFU, окрашенный H&E. Повреждений нейронов, кровоизлияний или поражений полости не видно. (E) Спинной мозг крысы с хирургической травмой, окрашенный H&E. Стрелки указывают на обильное кровоизлияние и повреждение тканей. (F) Спинной мозг крысы с повреждением из-за высокомощного ультразвукового воздействия окрашен H&E. Стрелки указывают на поражения полости, а врезка показывает возможную вакуолизацию. (G) Гистограммы, показывающие интенсивность DAPI и EBD в спинном мозге крыс с ультразвуковой обработкой LIFU и без нее. В спинном мозге LIFU наблюдается значительно большая интенсивность EBD по сравнению с отрицательным контролем (p = 0,016), несмотря на аналогичную интенсивность DAPI (p > 0,05). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
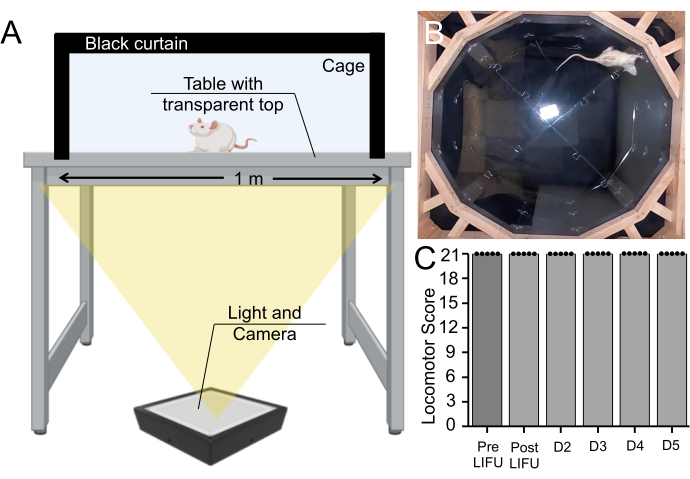
Рисунок 7: Поведенческий анализ до и после ультразвуковой обработки . (А) Установка аппарата Бассо, Битти, Бреснахана, в которой крысы ходили в течение 5 минут снизу. (B) Неподвижное изображение из записанного видео. Это видео было использовано для оценки координации движений и походки крысы по шкале Бассо, Битти, Бреснахана. (C) Блочная диаграмма (n = 5), показывающая отсутствие изменений в моторных показателях до и после ультразвуковой обработки или в течение 5-дневного периода выживаемости у крыс, получавших MBs и лечение LIFU (p > 0,05). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 8: Температурный анализ с использованием спинного мозга ex vivo . График, показывающий изменения температуры в двух образцах спинного мозга ex vivo в течение 5 минут до, во время и после ультразвуковой обработки. Параметры, используемые для ультразвуковой обработки, приведены в таблице 1. Для образца 1 средние температуры до, во время и после ультразвуковой обработки составили 21,9 °C ± 0,1 °C, 22,1 °C ± 0,1 °C и 22,0 °C ± 0,1 °C соответственно. Для образца 2 температуры до, во время и после ультразвуковой обработки составили 21,9 °C ± 0,1 °C, 22,5 °C ± 0,3 °C и 22,4 °C ± 0,2 °C соответственно. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Дополнительный рисунок 1: CAD-файл лазерной целеуказательной аппаратуры. (А) Вид на лазерный аппарат снизу. Любой лазер может быть помещен в центральное отверстие посередине. (Б) Вид лазерного аппарата сбоку. (C) Размеры лазерного аппарата с единицами измерения в дюймах. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный видеофайл 1: Видео крысы, гуляющей в аппарате Бассо, Битти, Бреснахана. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В данной статье описаны оборудование и шаги, необходимые для эффективного и целенаправленного разрушения BSCB с использованием низкоинтенсивного фокусированного ультразвука (LIFU) в сочетании с введением микропузырьков (MB). Этот протокол является гибким и может быть оптимизирован для индивидуального использования с датчиками различных спецификаций. Другие методы LIFU-опосредованного разрушения BSCB основаны на использовании систем под контролем магнитно-резонансной томографии (МРТ) для локализации мишеней, что является дорогостоящим ресурсом16. Преимущества представленной здесь методики заключаются в быстром визуальном подтверждении сбоев в работе BSCB в режиме реального времени и простоте таргетирования благодаря открытому характеру процедуры. Кроме того, лазерный аппарат прост в использовании и изготовлении, а файл САПР включен в дополнительный раздел. В результате, исследователи, заинтересованные в проведении первоначальных тестов возможностей наведения своего датчика LIFU на модели небольшого животного, могут использовать этот протокол в качестве инструмента для быстрого подтверждения позиционирования фокальной зоны над интересующим их местом. Этот метод также может быть использован лабораториями, начинающими изучать клиническое применение LIFU, например, для доставки лекарств, прежде чем инвестировать в более сложные методы руководства, такие как УЗИ или МРТ-системы. В настоящее время методы, управляемые УЗИ, представляют собой более перспективный и экономичный путь по сравнению с системами МРТ, хотя последние чаще встречаются в литературе.
В этой процедуре есть несколько важных шагов, которые должны быть тщательно выполнены, чтобы обеспечить успешное нарушение работы BSCB. Крайне важно избегать излишнего давления на спинной мозг во время хирургической ламинэктомии. Слишком частые физические манипуляции со шнуром увеличивают вероятность повреждения BSCB. Повреждение проявляется в виде темно-коричневого пятна внутри спинного мозга после удаления из-за кровоизлияния и повышенной экстравазации EBD. Кроме того, должна быть обеспечена максимальная связь между датчиком и обнаженным спинным мозгом. В результате необходимо позаботиться об удалении пузырьков с водяного конуса и геля для УЗИ. Между дном водяного конуса и шнуром не должно быть зазоров, чтобы обеспечить полноценную передачу акустической волны. Во время катетеризации хвостовых вен следует избегать случайного пропускания воздуха вместе с гепаринизированным физиологическим раствором, растворами EBD или MB. Впрыск воздуха значительно увеличивает вероятность тромбоэмболии легочной артерии, которая приводит к гибели грызунов до завершения процедуры28.
Распространенной проблемой, с которой можно столкнуться во время этой процедуры, является неудача успешной инъекции EBD. Для людей с минимальным опытом катетеризации хвостовых вен выполнение этого шага перед ламинэктомией животного, позиционированием или нацеливанием сэкономит время. EBD также может быть введен задолго до инъекции MB без влияния ультразвука. Использование жгута и ванны с теплой водой, предложенных в этом протоколе, поможет расширить хвостовые вены и увеличить вероятность успеха. Кроме того, обезвоживание крыс снижает вероятность правильной установки катетера. Может помочь внутрибрюшинная инъекция физиологического раствора за 10-15 минут до катетеризации хвостовой вены. Во время катетеризации следует начинать на 2 дюйма выше конца хвоста и двигаться в каудальном направлении к краниальному. Движение в противоположном направлении снижает вероятность успеха из-за потенциального коллапса вен или кровотечения.
Еще одна распространенная проблема связана с отсутствием экстравазации EBD, несмотря на ультразвуковое воздействие. Это может указывать на то, что параметры, используемые для ультразвуковой обработки, недостаточны для нарушения работы СЧС. Например, если частота ультразвука установлена на значение, которое сильно отличается от центральной частоты преобразователя, мощность ультразвука будет слишком низкой, чтобы осциллировать мегабайты и вызвать плотное ослабление перехода. Кроме того, чем больше интерфейсов между преобразователем и шнуром (например, водяной конус, мембрана, гель, пузырьки воздуха в воде/геле), тем ниже будет истинная интенсивность ультразвука в мишени. Сведение к минимуму этих интерфейсов, например, за счет использования дегазированного геля и тщательного удаления пузырьков внутри конуса, поможет передать весь потенциал ультразвукового излучения. Протокол также рекомендует увеличить время между ультразвуковой и перфузионной терапией, чтобы дать больше времени для экстравазации EBD в спинномозговую паренхиму. Несмотря на то, что сбои в работе BSCB являются временной процедурой, пробелы присутствуют в течение нескольких часов, прежде чем они закроются. Длительное время ожидания увеличивает воздействие изофлурана, но также приводит к большей экстравазации EBD в пуповине. В качестве альтернативы экстравазация EBD может присутствовать, несмотря на отсутствие ультразвуковой обработки при использовании LIFU. Чтобы устранить эту проблему, во время ламинэктомии необходимо соблюдать осторожность, чтобы предотвратить случайное повреждение BSCB. Потенциальные решения включают подъем позвоночника крысы во время пережатия, чтобы увеличить расстояние между пластинками и спинным мозгом, а также более короткую ламинэктомию. Тщательная перфузия PFA также уменьшает фоновое окрашивание, удаляя кровь, обогащенную EBD, из сосудистой сети спинного мозга. Во время транскардиальной перфузии необходимо соблюдать осторожность, чтобы предотвратить случайный разрыв сердца, который может привести к утечке PBS или PFA.
Важно отметить, что это исследование представляет собой единый центр для LIFU-опосредованного разрушения BSCB. Кроме того, этот протокол не тестирует и не оптимизирует различные параметры энергии ультразвука и концентрации MB. В результате, исследователям рекомендуется исследовать различные параметры и концентрации при выполнении этого метода, чтобы оптимизировать локализацию мишени и нарушение BSCB для их конкретных исследовательских потребностей, особенно если первоначальные результаты вызывают какие-либо неблагоприятные эффекты. Например, группы, которые хотели бы не видеть изменений температуры, могут тестировать различные параметры до тех пор, пока не найдут набор, который соответствует этому критерию и не достигнет достаточного нарушения BSCB. Кроме того, могут быть проведены дополнительные эксперименты, подтверждающие безопасность этого метода. Например, можно увеличить размер выборки, продлить период выживаемости, а также провести электромиографию/анализ походки. Для более длительной выживаемости важно иметь в виду, что некоторые исследования показывают, что высокие дозы EBD иногда могут вызывать хроническую системную токсичность, поэтому более низкая доза может быть разумной29.
Еще одним ограничением этой процедуры является инвазивный характер ламинэктомии (которая требуется для любой техники, использующей LIFU для вскрытия BSCB, поскольку ультразвук не может проникнуть через кость). Инвазивный характер этой процедуры можно уменьшить, ограничив длину ламинэктомии. Выполнение ламинэктомии в верхних грудных позвонках, которые короче и тоньше, может сократить время, необходимое для ламинэктомии, до менее чем 10 минут. Из-за хрупкой природы МБ, а также их короткого периода полураспада, время выполнения этого протокола ограничено. Инъекция МБ должна происходить за 1-2 мин до лечения LIFU, а новые МБ следует вводить перед каждым ультразвуковым обработкой, если проводится несколько процедур LIFU. Для экспериментов, связанных с разрушением BSCB на нескольких крысах, может потребоваться подготовить несколько пробирок MB. Поскольку микропузырьки стоят дорого, изменение хирургического рабочего процесса для минимизации времени между ультразвуковыми воздействиями предпочтительнее для экономии количества используемых МБ.
Описанная здесь методика предназначена в первую очередь для использования в качестве протокола исследования. Несмотря на то, что лазерный нацеливатель не заменит традиционные методы наведения во всех клинических условиях, он может быть полезен и в других ситуациях. Для неинвазивных операций можно надежно использовать традиционные методы МРТ для нацеливанияна 30. При инвазивных операциях, включающих ламинэктомию, лазерный точечный аппарат, описанный в этом протоколе, может быть использован для быстрой локализации центра фокальной зоны ультразвуковой обработки над определенной областью (например, опухолью или местом повреждения спинного мозга) с целью доставки лекарств или иммуномодулирующей терапии в дополнение к любому проводимому МР-наведению.
В целом, этот протокол описывает эффективную и успешную технику нарушения работы BSCB и включает в себя несколько вариантов подтверждения открытия BSCB, как в режиме реального времени, так и при постобработке. Поскольку BSCB функционирует как барьер для проникновения в паренхиму спинного мозга, нарушение BSCB является возможным методом улучшения доставки терапевтических средств. Например, Weber-Adrian et al. использовали LIFU с частотой 1,114 МГц и длиной всплеска 10 мс для опосредования доставки генов в шейный отдел позвоночника6. Аналогичным образом, Smith et al. показали, что LIFU с частотой 580 кГц, средним акустическим пиковым давлением около 0,46 МПа и длиной всплеска 10 мс может способствовать доставке моноклонального антитела, трастузумаба, в спинной мозг в модели лептоменингеальных метастазов грызунов. Большинство исследований были сосредоточены на использовании LIFU, а не HIFU, из-за способности LIFU временно проникать в BSCB, избегая при этом повреждения подлежащих тканей. Как правило, LIFU использует интенсивность от 0,125 до 3 Вт/см2, в то время как HIFU использует интенсивность от 100 до 10 000 Вт/см2 или выше31. В результате, HIFU оказывает свое действие в основном за счет нагревания тканей, в то время как LIFU, при совместном введении MBs, работает за счет механических кавитационных эффектов. Одновременное применение терапевтических препаратов с МБ может привести к большей экстравазации препарата в паренхиму позвоночника, а также к возможности загрузки МБ препаратом и лизиса МБ ультразвуком для адресной доставки лекарственного средства.
Параметры ультразвука, концентрация МБ и тип преобразователя, используемые в этом исследовании, могут быть изменены в зависимости от экспериментальных потребностей. Например, преобразователь с меньшей фокальной областью может быть предпочтительнее для экспериментов, в которых требуется больший контроль над локализованным наведением, в то время как преобразователь с большей мощностью может быть использован для экспериментов, требующих мощного разрушения за более короткий промежуток времени. Благодаря гибкости, предлагаемой этим протоколом, существует большой потенциал для использования в доклинических, клинических и трансляционных исследованиях.
Раскрытие информации
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов. Амир Манбачи преподает и консультирует компании BK Medical (GE Healthcare), Neurosonics Medical, а также является изобретателем ряда запатентованных технологий FUS. Бетти Тайлер финансирует исследования от NIH и является совладельцем компании Accelerating Combination Therapies (включая акции или опционы). Ashvattha Therapeutics Inc. также лицензировала один из ее патентов и является акционером Peabody Pharmaceuticals. Николас Теодор получает роялти и владеет акциями Globus Medical. Он является консультантом Globus Medical и работал в научно-консультативном совете/другом офисе Globus Medical. Остальные авторы не имеют конфликта интересов, подлежащего раскрытию.
Благодарности
При поддержке T32GM136577 (D.R.); N660012024075 (Н.Т., Н.В.Т., А.М., К.К.Л.); R01 HL139158-01A1 и R01 HL071568-15 (без НДС); Стипендиальная программа клинических исследований Университета Джонса Хопкинса (KL2) (A.M.). Несколько фигур, созданных с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% Heparinized Sodium Chloride | Baxter | FKB0953G | Flush tail vein catheter with heparinized saline to prevent clotting. |
| 100 mL Luer Lock Tip Syringe (2) | Wilburn Medical | WUSA/120 | One syringe can be used to inject PBS and one for PFA (during transcardial perfusion) |
| 1x Phosphate buffered saline (PBS) | Thermo Scientific | 10010001 | For transcardial perfusion. |
| 22 G catheter | Med Vet International | 50-209-1694 | Use to place a tail vein catheter. |
| 97% Isoflurane | Thermo Scientific Chemicals | 247-897-7 | While rat is under isoflurane, be careful not to administer too much. A high dose can euthanize the rat. |
| Betadine 7.5% | Purdue Products | 4677 | |
| Class A clear threaded glass vial | Fisherbrand | 14-955-314 | Use to store spinal cord extraction. |
| Digital balance scale | Kent Scientific | SCL-4000 | |
| Electric razor | Wahl Home Products | 79449-200 | Shave fur off skin at incision site before surgery |
| Eosin-Y with Phloxine | Epredia | 71304 | |
| Evans blue dye | MP Biomedicals | 02151108-CF | Although it is non-toxic, it will stain skin blue if direct contact occurs. |
| Fixation Plate Assembly with 0.5 mm Forceps | PSI Impactors | 7001-2 | Affix the stereotactic arm to this frame |
| Gauze | Fisherbrand | 13-761-52 | |
| Heating pad | Kent Scientific | RT-0515 | |
| Hematoxylin | Epredia | 7211 | |
| Iris Scissors with Angled Blades | ProDentUSA | 12-15315 | |
| Isoflurane induction system | Kent Scientific | SOMNO-RATKIT | |
| Laser targetting apparatus | NA | custom | CAD design file provided in supplemental section. Simply place a laser inside the apparatus created from the file. |
| Lubricating eye ointment | Systane | N/A | |
| Luer Lock 3-Way Stopcock | Sigma | SAS7521-10EA | Can use to fill water cone through inlet valve |
| Lumason microbubbles kit | Bracco | 0270-7099-16 | |
| Microscope cover glass | Fisherbrand | 12-545J | |
| Microscope slides | Fisherbrand | 12-550-15 | |
| Microtome | Epredia | 23-900-671 | |
| Mounting medium with 4',6-diamidino-2-phenylindole (DAPI) | Vector Laboratories | H-2000-2 | |
| Mylar membrane | Chemplex | 3016 | Can cut membrane to appropriate size if too large for cone |
| NeuroFUS 2.52" diameter 250 kHz transducer | Sonic Concepts | CTX-250 | Transducer system includes custom water cone and probe holder |
| NeuroFUS PRO v2.0 system | Sonic Concepts | NFS102v2 | Includes Transducer Power Output, Matching Network and associated cables |
| Offset Bone Nippers | Fine Science Tools | 16101-10 | Use to remove spinous processes and laminae for laminectomy |
| Paraffin | Polysciences | 24364-1 | Can place spinal cord sample in paraffin to slice into thin sections for histology. |
| Paraformaldehyde (4%) | Thermo Scientific | J61899-AK | For transcardial perfusion. |
| Rat Surgical Kit | Kent Scientific | INSRATKIT | Consists of tweezer #5, needle holder, McPherson-Vannas scissors, Iris scissors, ALM self-retaining retractors, Iris forceps, and blunt probe. These products should be sufficient to perform a laminectomy. |
| Razor blade | Fisherbrand | 12-640 | Use to cut spinal cord extraction to desirable length and split section down midline. |
| Rectal thermometer | Kent Scientific | RET-2 | Maintain rat temperature between 35.9–37.5 °C |
| Rubber band | Fisherbrand | 50-205-1983 | |
| Single animal vaporizer unit | Kent Scientific | SF-01 | |
| Stereotactic arm | Kopf Instruments | Model 963 | |
| Sterile absorbent pad | McKesson | 4033-CS150 | Place under rat and above heating pad and fixation plate before laminectomy |
| Ultrasound gel | Aquasonic | PLI 01-34 | Ensure gel is free of bubbles to the best of your ability. |
Ссылки
- Chopra, N., et al. Blood-spinal cord barrier: Its role in spinal disorders and emerging therapeutic strategies. NeuroSci. 3 (1), 1-27 (2021).
- Bartanusz, V., Jezova, D., Alajajian, B., Digicaylioglu, M. The blood-spinal cord barrier: morphology and clinical implications. Annals of Neurology. 70 (2), 194-206 (2011).
- Hersh, A. M., Alomari, S., Tyler, B. M. Crossing the blood-brain barrier: Advances in nanoparticle technology for drug delivery in neuro-oncology. International Journal of Molecular Sciences. 23 (8), 4153 (2022).
- Pan, W., Banks, W. A., Kastin, A. J. Permeability of the blood-brain and blood-spinal cord barriers to interferons. Journal of Neuroimmunology. 76 (1-2), 105-111 (1997).
- Bellettato, C. M., Scarpa, M. Possible strategies to cross the blood-brain barrier. Italian Journal of Pediatrics. 44, 131 (2018).
- Weber-Adrian, D., et al. Gene delivery to the spinal cord using MRI-guided focused ultrasound. Gene Therapy. 22 (7), 568-577 (2015).
- Hersh, A. M., et al. Applications of focused ultrasound for the treatment of glioblastoma: A new frontier. Cancers. 14 (19), 4920 (2022).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Cho, H., et al. Localized down-regulation of P-glycoprotein by focused ultrasound and microbubbles induced blood-brain barrier disruption in rat brain. Scientific Reports. 6, 31201 (2016).
- Smith, P., Ogrodnik, N., Satkunarajah, J., O'Reilly, M. A. Characterization of ultrasound-mediated delivery of trastuzumab to normal and pathologic spinal cord tissue. Scientific Reports. 11 (1), 4412 (2021).
- Montero, A. S., et al. Ultrasound-induced blood-spinal cord barrier opening in rabbits. Ultrasound in Medicine & Biology. 45 (9), 2417-2426 (2019).
- Fletcher, S. P., Choi, M., Ogrodnik, N., O'Reilly, M. A. A porcine model of transvertebral ultrasound and microbubble-mediated blood-spinal cord barrier opening. Theranostics. 10 (17), 7758-7774 (2020).
- Honeycutt, S. E., O'Brien, L. L. Injection of Evans blue dye to fluorescently label and image intact vasculature. BioTechniques. 70 (3), 181-185 (2021).
- Fletcher, S. P., Choi, M., Ramesh, R., O'Reilly, M. A. Focused ultrasound-induced blood-spinal cord barrier opening using short-burst phase-keying exposures in rats: A parameter study. Ultrasound in Medicine & Biology. 47 (7), 1747-1760 (2021).
- Cross, C. G., et al. Technical note: Quantification of blood-spinal cord barrier permeability after application of magnetic resonance-guided focused ultrasound in spinal cord injury. Medical Physics. 48 (8), 4395-4401 (2021).
- Hong, Y. R., et al. Ultrasound stimulation improves inflammatory resolution, neuroprotection, and functional recovery after spinal cord injury. Scientific Reports. 12 (1), 3636 (2021).
- Liao, Y. H., et al. Low-intensity focused ultrasound alleviates spasticity and increases expression of the neuronal K-Cl cotransporter in the L4-L5 sections of rats following spinal cord injury. Frontiers in Cellular Neuroscience. 16, 882127 (2022).
- Redfors, B., Shao, Y., Omerovic, E. Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Laboratory Animals. 48 (1), 6-14 (2014).
- Lillie, L. E., Temple, N. J., Florence, L. Z. Reference values for young normal Sprague-Dawley rats: weight gain, hematology and clinical chemistry. Human & Experimental Toxicology. 15 (8), 612-616 (1996).
- Lin, X. J., et al. Spinal cord lateral hemisection and asymmetric behavioral assessments in adult rats. Journal of Visualized Experiments. (157), e57126 (2020).
- Tsehay, Y., et al. Low-intensity pulsed ultrasound neuromodulation of a rodent's spinal cord suppresses motor evoked potentials. IEEE Transactions on Biomedical Engineering. , (2023).
- Payne, A. H., et al. Magnetic resonance imaging-guided focused ultrasound to increase localized blood-spinal cord barrier permeability. Neural Regeneration Research. 12 (12), 2045-2049 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. Journal of Visualized Experiments. (146), e59295 (2019).
- Sabbagh, A., et al. Opening of the blood-brain barrier using low-intensity pulsed ultrasound enhances responses to immunotherapy in preclinical glioma models. Clinical Cancer Research. 27 (15), 4325-4337 (2021).
- Dréan, A., et al. Temporary blood-brain barrier disruption by low intensity pulsed ultrasound increases carboplatin delivery and efficacy in preclinical models of glioblastoma. Journal of Neuro-Oncology. 144 (1), 33-41 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Yamamoto, H., Imai, S., Okuyama, T., Tsubura, Y. Pulmonary lesions in rats caused by intravenous injection. Acta Pathologica Japonica. 32 (5), 741-747 (1982).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Scientific Reports. 9 (1), 321 (2019).
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены