Method Article
쥐 모델에서 저강도 집속 초음파를 사용한 혈액-척수 장벽 파괴
요약
혈액-척수 장벽(BSCB)의 파괴는 마이크로버블의 정맥 투여와 저강도 집속 초음파(LIFU)의 적용으로 성공적으로 달성할 수 있습니다. 이 프로토콜은 장비 설정, 미세 기포 주입, 표적 위치 파악 및 BSCB 파괴 시각화를 포함하여 설치류 모델에서 LIFU를 사용하여 BSCB를 개방하는 방법을 자세히 설명합니다.
초록
저강도 집속 초음파(LIFU)는 초음파보다 낮은 강도의 초음파 맥동을 사용하며 가역적이고 정밀한 신경 조절 기술로 테스트되고 있습니다. LIFU 매개 혈액-뇌 장벽(BBB) 개방에 대해 자세히 연구되었지만, 현재까지 혈액-척수 장벽(BSCB) 개방에 대한 표준화된 기술은 확립되지 않았습니다. 따라서이 프로토콜은 동물 준비, 마이크로 버블 관리, 표적 선택 및 국소화, BSCB 붕괴 시각화 및 확인에 대한 설명을 포함하여 쥐 모델에서 LIFU 초음파 처리를 사용하여 성공적인 BSCB 붕괴 방법을 제시합니다. 여기에 보고된 접근 방식은 집속 초음파 변환기를 사용하여 소동물 모델에서 표적 국소화 및 정확한 BSCB 파괴를 테스트 및 확인하거나, 초음파 매개변수의 BSCB 효능을 평가하거나, 약물 전달과 같은 척수에서 LIFU의 응용 분야를 탐색하기 위해 빠르고 비용 효율적인 방법이 필요한 연구자에게 특히 유용합니다. 면역 조절 및 신경 조절. 이 프로토콜을 개별 사용에 맞게 최적화하는 것이 좋으며, 특히 향후 전임상, 임상 및 중개 작업을 발전시키는 데 권장됩니다.
서문
혈액-뇌 장벽(BBB)과 유사하게, 혈액-척수 장벽(BSCB)은 순환하는 용질, 세포 및 혈장 성분이 척추 실질로 이동하는 것을 조절한다1. 이러한 보호 기능은 척추 모세혈관을 둘러싸고 있는 단단히 결합된 비천공 내피 세포의 특수 시스템의 결과이다2. 전형적으로, 양전하를 띤 저중량의 친유성 분자만이 두 장벽을 모두 통과할 수 있다3. BSCB가 BBB보다 투과성이 약간 더 높다는 연구 결과에도 불구하고, 두 장벽 모두 중추신경계에 대한 치료제 전달을 제한한다4. 척추 모세혈관의 삼투압을 증가시키는 기술, 브라디키닌 수용체와 상호 작용하는 약물 개발, 기능성 나노 입자 생성 등 BSCB를 통한 약물 수송을 증가시키기 위한 몇 가지 전략이 개발되었다5.
BSCB 파괴는 마이크로 버블 (MB)의 정맥 투여에 이어 저강도 집속 초음파 (LIFU) 초음파 처리를 통해 달성 될 수 있습니다6. 초음파 변환기에 의해 생성된 음향장은 MB 진동을 유발하고, 이는 차례로 내피벽에 응력을 가하고 단단한 접합부(7)를 느슨하게 한다. 단단한 접합부의 느슨함은 모세혈관에 일시적인 틈을 만들어 치료제가 척추 실질에 침투할 수 있도록 합니다(그림 1). 이 과정은 또한 경내피 창호를 생성하고, transcytosis를 증가시키며, P-glycoprotein 8,9와 같은 ATP-결합 카세트 수송체를 하향 조절할 수 있습니다. 이 기술의 주요 이점은 초음파 처리의 초점 영역을 척수의 관심 위치로 향하게 하여 표적 이탈 효과를 최소화할 수 있다는 것입니다. 여러 임상 시험에서 신경교종, 근위축성 측삭 경화증, 알츠하이머병 및 파킨슨병을 포함한 중추신경계 병리의 치료를 위한 LIFU 매개 BBB 개방의 효능을 조사했습니다. LIFU에 의한 BSCB 붕괴가 LIFU에 의한 BBB 붕괴만큼 광범위하게 특징지어지지는 않지만, 몇몇 그룹들은 설치류, 토끼 및 돼지 모델에서 성공적인 BSCB 붕괴를 보고하였다10,11,12. 전반적으로, 이 기술에 대한 관심은 특히 약물 전달을 위한 실행 가능한 방법으로 빠르게 증가하고 있습니다.
이 프로토콜에서는 랫트 모델에서 LIFU 매개 BSCB 파괴 기술에 대해 설명합니다. 이 절차에는 동물 준비, LIFU 장비 설정, MB 투여, 표적 국소화 및 척수 추출에 대한 자세한 설명이 포함됩니다. 표적 국소화 및 BSCB 파괴의 확인은 척수로의 Evans blue dye(EBD) 유출을 통해 평가됩니다. EBD는 혈청 알부민에 결합하는 무독성 화합물로, 시각적으로 풍부한 청색과 현미경 검사에서 적색 자가형광으로 식별할 수 있다13.
여기에 나열된 단계는 기존의 초음파(US) 또는 자기 공명(MR) 유도 LIFU 시스템에 대한 빠르고 저렴한 대안을 제공합니다. 결과적으로 이 방법은 추가 장비 및 재료를 구입하거나 약물 전달, 면역 조절 및 신경 조절과 같은 척수에서 LIFU 응용 분야를 추구하기 전에 LIFU 변환기의 표적화 및 BSCB 파괴 기능을 신속하게 테스트하고 확인하는 데 관심이 있는 연구자에게 유용합니다.
프로토콜
모든 동물 연구는 존스 홉킨스 대학 기관 동물 관리 및 사용 위원회(IACUC RA20M223)에 따라 승인 및 수행되었습니다. 본 연구에는 성인 Sprague-Dawley 암컷 쥐(평균 체중: 250g, 연령: 11주)만 사용되었습니다.
1. 저강도 집속 초음파 조립 및 설정
- 쥐에서 BSCB 개방을 달성하기에 충분한 사양의 집속 초음파 변환기 시스템을 획득합니다. 문헌에서 제안된 매개변수에는 0.25-4MHz 사이의 중심 주파수와 0.2-2.1MPa 10,14,15,16,17 사이의 피크 압력을 생성할 수 있는 기능이 포함됩니다. 시스템에 최소한 파동/신호 발생기, 무선 주파수(RF) 구동/전력 증폭기 및 정합 네트워크가 포함된 구동/제어 장비가 포함되어 있는지 확인합니다(그림 2A).
참고: 여기에 설명된 설정은 중심 주파수가 250kHz이고 직경이 64mm인 상용 다중 요소 변환기를 사용합니다(그림 2B). - 3D 프린팅된 프로브 홀더와 워터 콘을 변환기에 부착합니다(그림 2C). 콘과 변환기 사이의 방수 밀봉을 확인하십시오.
알림: 맞춤형 원뿔 및 프로브 홀더는 이 실험에 사용된 변환기와 함께 제공되었습니다. 콘과 프로브 홀더는 나사로 변환기에 고정되며 나사도 제공됩니다. - 50μm 두께의 음향적으로 투명한 폴리에스터 멤브레인을 멸균하고 고무 밴드를 사용하여 물방울 바닥에 부착합니다.
- 입구 및 출구 튜브를 사용하여 탈기 및 탈이온수로 물 콘을 채웁니다. 콘 내부의 기포는 변환기와 대상 사이의 음향 결합을 방해할 수 있으므로 주의하십시오. 폴리에스터 멤브레인은 약간 팽창되어야 합니다.
알림: 원뿔에서 기포를 제거하려면 입구 밸브를 통해 콘에 물을 채우면서 기포를 배출 밸브로 안내하십시오. 작은 기포가 많으면 모든 밸브를 닫고 큰 기포가 하나 남을 때까지 원뿔을 돌립니다. 이 기포를 배출 밸브로 안내하고 원뿔 채우기를 재개합니다. - 파동 발생기와 RF 구동 증폭기를 포함하는 구동 장비를 변환기에 연결합니다. 변환기 케이블은 매칭 네트워크의 출력 측에 연결되고 신호 발생기/전력 증폭기는 매칭 네트워크의 입력 측에 연결됩니다. 케이블은 해당 채널 번호에 연결해야 합니다(그림 2D-G).
참고: 이 연구에 사용된 상용 시스템에서 파동 발생기와 RF 구동 증폭기는 TPO(변환기 전력 출력)의 구성 요소입니다(그림 2D). - 프로브 홀더를 정위 암에 부착합니다. 정위 암을 고정 플레이트 어셈블리에 부착합니다. 이렇게 하면 초음파 처리 중에 변환기가 설치류 위에 정확하게 위치할 수 있습니다.
2. 동물 준비 및 수술 후궁 절제술
- 숯 필터 캐니스터에 부착된 유도 챔버에서 이소플루란과 의료용 공기의 혼합물로 쥐를 마취합니다. 마취 유도를 위해 가스 유량을 400mL/min으로 설정하고 이소플루란 기화기를 1.5%-2.5% 사이로 설정합니다. 완전한 진정 전에 챔버에서 보내는 시간은 다양하지만 일반적으로 3-6분 범위입니다.
- 진정제를 투여한 쥐의 체중을 기록하고 발가락 꼬집기 테스트를 수행합니다. 꼬집음에 대한 반응으로 경련이나 움직임이 관찰되면 쥐를 유도 챔버 안에 다시 1분 더 넣고 발가락 꼬집기 테스트를 반복합니다. 쥐가 완전히 마취된 상태를 유지하도록 필요에 따라 반복합니다.
- 가열 패드와 멸균 흡수 패드를 고정판에 놓습니다. 쥐를 흡수 패드에 놓고 눈 연고를 바르고 직장 체온계를 올려 체온을 모니터링합니다.
알림: 수술 절차가 진행되는 동안 쥐의 체온과 심박수를 모니터링해야 합니다(이상적으로는 심박수는 330-480bpm, 체온은 35.9-37.5°C 사이여야 함)18,19. 조기 사망을 방지하기 위해 그에 따라 이소플루란 또는 가열 패드를 조정하십시오. 가열 패드는 약 37°C의 온도로 설정할 수 있으며 최적의 체온을 유지하기 위해 필요에 따라 켜고 꺼야 합니다. - 13번째 흉추(T13)의 척추에 부착된 쥐의 마지막 갈비뼈를 촉진합니다. 전기 면도기를 사용하여 마지막 갈비뼈와 목 사이의 등쪽 표면에서 털을 깎습니다. 노출된 피부를 10% 요오드포비돈에 적신 거즈로 닦습니다.
- 홍채 가위를 사용하여 정중선을 절개하고 가시돌기와 판판이 노출될 때까지 근막을 절개합니다. 오프셋 뼈 집게발과 각진 칼날 홍채 가위로 척수가 노출될 때까지 뼈를 제거합니다20. 후궁 절제술과 절개의 길이는 초음파 처리 할 다른 표적의 수에 따라 다릅니다. 이 연구에서는 3cm 절개를 사용하여 3단계 후궁 절제술을 수행했습니다.
알림: 부상을 방지하기 위해 뼈를 제거하는 동안 척수를 만지거나 압력을 가하지 마십시오. 후궁 절제술 중에 쥐의 뒷다리가 경련을 일으킨다면 탯줄이나 신경근에 너무 많은 힘이 가해진 것입니다. - 후궁 절제술에 인접한 가시 돌기를 고정하여 쥐를 고정판에 고정합니다. cl을 잠그기 전에 척추를 팽팽하게 당겨 곡률을 최소화합니다.amps.
3. 레이저 유도를 이용한 표적 위치 파악
- 후궁 절제술 바로 위에 위치할 때까지 정위 암으로 변환기의 위치를 조정합니다(그림 3A). 프레임은 x축, y축, z축에서 이동할 수 있을 뿐만 아니라 수직면에서 180° 회전, 수평면에서 360° 회전할 수 있습니다.
- 레이저 장치를 물방울 바닥에 부착하고 레이저 포인트가 보일 때까지 내립니다. 레이저 포인트가 BSCB 중단 대상 위치 위에 올 때까지 변환기의 측면 위치를 조정합니다(그림 3B,C).
참고: 레이저 장치에 대한 CAD(Computer-Aided Design) 파일은 보충 섹션에 포함되어 있습니다(보충 그림 1). - 레이저 장치를 제거하고 원뿔과 척수 사이의 공간을 가스가 제거된 초음파 젤로 채웁니다(그림 3D). 최대 결합을 위해 젤에 기포가 없는지 확인하십시오.
알림: 이 연구에서는 워터 콘이 부착된 변환기를 코드 위 1cm까지 내렸습니다. 워터 콘의 길이가 30mm였기 때문에 변환기에서 코드까지의 총 거리는 40mm였습니다. 물원뿔은 척수에서 1cm 떨어진 곳에 배치되었는데, 이는 절개 부위 양쪽의 쥐의 피부, 근막, 근육 조직이 원뿔 끝과 탯줄 사이의 직접적인 접촉을 막기 때문입니다. 정위 팔의 y축에 있는 숫자를 사용하면 특히 젤이 원뿔과 코드의 거리를 시각적으로 확인하기 어렵기 때문에 원뿔이 코드에서 1cm 떨어져 있는 수직 거리를 추적하는 데 도움이 될 수 있습니다. - TPO에서 초음파 처리 매개 변수를 설정합니다. BSCB 중단을 성공적으로 달성하기 위해 다양한 값을 사용할 수 있습니다. 최대 전력을 위해 초음파 처리 주파수를 변환기의 중심 주파수에 가깝게 설정하십시오. 본 연구에서 사용된 값은 표 1에 기재되어 있다.
참고 : 여기에 나열된 매개 변수는 설치류 척수21을 안전하게 신경 조절하기 위해 500kHz의 중심 주파수, 500μs의 톤 버스트 지속 시간, 50 %의 듀티 사이클 및 5 또는 10 분의 초음파 처리 시간을 가진 LIFU와의 이전 작업에서 채택되었습니다. BSCB 중단을 성공적으로 달성 한 연구를 기반으로 사용할 수있는 다른 매개 변수는 500kHz-1MHz 사이의 중심 주파수, 0.2-2.1 MPa의 압력, 10-25ms의 버스트 길이 및 2-5 분 6,10,11,22의 초음파 처리 시간입니다.
| 매개 변수 | 값 |
| 주파수(kHz) | 250 |
| 초점 거리 (mm) | 40 |
| 음향 피크 압력(MPa) | 0.47 |
| 듀티 사이클 | 40% |
| 버스트 길이(ms) | 400 |
| 기간(들) | 1 |
| 초음파 처리 시간 (분) | 5 |
표 1: BSCB 중단에 사용되는 초음파 처리 매개변수.
4. 마이크로버블 투여
- 제조업체에서 제공한 지침에 따라 MB 솔루션을 준비합니다. 용액에 공기가 유입되지 않도록 하십시오.
알림: MB는 깨지기 쉬우며 몇 분 동안 가만히 두면 바이알/주사기 상단 근처에서 뭉칩니다. MB의 고르지 않은 분산을 방지하기 위해 바이알과 주사기를 정기적으로 흔듭니다. MB는 수명이 짧습니다. 제조업체의 안내서를 확인하여 만료 시간을 확인하십시오. - 22G 꼬리 정맥 카테터를 삽입하고 0.2mL의 헤파린 처리 식염수(500IU/mL)로 씻어냅니다.23. 성공적인 꼬리 정맥 카테터 삽입 가능성을 높이려면 꼬리를 따뜻한 물에 담그고 꼬리 바닥에 지혈대를 놓아 정맥의 직경을 확대하십시오.
알림: 꼬리 정맥 카테터 삽입은 연구 시간을 절약하기 위해 동물 후궁 절제술, 위치 지정 및 표적화 전에 수행할 수 있습니다. - 3% EBD 1mL/kg을 카테터에 주입합니다. 0.2mL의 헤파린화 식염수로 씻어냅니다. 쥐의 팔다리와 눈이 파랗게 변합니다. 쥐의 등쪽 척추 정맥에서 파란색 변화를 확인하여 성공적인 꼬리 정맥 카테터 삽입을 확인합니다(그림 4).
참고 : EBD는 MB 주입 전에 잘 주입 할 수 있으며 초음파 처리에 영향을 미치지 않습니다. 또한 미국 식품의약국(FDA)은 현재 시스템에 이미 있는 약물로 초음파 처리를 승인하지 않았기 때문에 EBD는 초음파 처리 후에도 투여할 수 있습니다. 이렇게 하면 염료 흡수가 줄어들지만 임상적으로 더 관련성이 있을 수 있습니다. - 0.2mL의 MB 볼루스를 카테터에 주입하고 0.2mL의 헤파린화 식염수로 세척합니다. MB 주입 후 1-2 분 후에 초음파 처리를 시작하십시오. 여기에 사용 된 설정은 실시간 초음파 처리 피드백을 수집하지 않습니다.
참고: BSCB 중단에 대한 연구는 일반적으로 진단 영상에 표시된 것보다 더 높은 농도의 MB를 사용합니다. 쥐 모델에서 BBB 및 BSCB 파괴에 사용되는 일반적인 MB 브랜드의 일부 농도에는 0.02-0.2mL/kg 및 200μL 볼루스 10,15,24,25가 포함됩니다.
5. 척수 적출 및 조직 가공
- 초음파 처리 완료 후, 혈액이 완전히 맑아질 때까지 100mL의 차가운 인산염 완충 식염수 (PBS)로 쥐를 심 경 관류하십시오. 염료로 인해 진한 파란색을 띠는 간은 밝은 갈색을 띤 파란색으로 퇴색해야 합니다26.
알림: 관류의 목적은 척수 혈관에서 과도한 혈액을 제거하는 것입니다. EBD는 알부민에 결합하기 때문에 과도한 EBD도 제거합니다. 이를 통해 육안으로 또는 형광 현미경 검사를 통해 척수에서 검출되는 모든 EBD는 척추 실질에 염료를 주입하여 검출됩니다. - 100mL의 차가운 4% 파라포름알데히드(PFA)로 심내식 관류. 이 고정을 철저히 수행하면 쥐의 팔다리가 경련을 일으킵니다. PFA와의 관류는 쥐를 안락사시킵니다.
- 척수를 제거하고 4 °C에서 밤새 4 % PFA에 담근다. 다음날 PFA를 PBS로 교체하십시오.
6. BSCB 중단의 시각화
- 면도날을 사용하여 초음파 처리 위치를 둘러싼 2cm 섹션을 분리하십시오. 칼날로 정중선 아래로 단면을 분할하고 마이크로톰을 사용하여 10μm 두께의 단면으로 나눕니다. 명시야 시각화를 위해 hematoxylin-eosin(H&E) 염색으로 염색합니다.
참고: 이 연구에 표시된 H&E 척수 샘플은 3분 동안 헤마톡실린으로, 1분 동안 에오신으로 염색되었습니다.27. - 형광 현미경 검사의 경우 척수 절편이 포함된 슬라이드를 탈파라핀화하고 장착 배지(0.5μg/mL)에 용해된 25μL의 4′,6-디아미디노-2-페닐린돌(DAPI)로 대조염색합니다. 4 °C에서 최소 10분 동안 배양합니다. 표백을 방지하기 위해 빛을 피하십시오.
알림: 탈파라핀화는 냉동 단면을 얻기 위해 냉동 유지 장치를 사용하여 대체할 수 있습니다. - 형광 현미경을 사용하여 모든 슬라이드를 이미지화합니다. EBD 자가형광(여기: 470nm 및 540nm, 방출: 680nm)은 빨간색 채널에서 볼 수 있고 DAPI는 파란색 채널에서 볼 수 있습니다. 광학 현미경을 사용하여 H&E 슬라이드를 이미지화합니다.
참고: 이 프로토콜은 비생존 수술을 설명했지만, 생존 수술 기법을 사용하여 수행되기도 했습니다. 생존 수술의 경우 절개 전 피부를 소독하여 요오도포비돈을 3회 번갈아 도포하고 수술 전 부프레노르핀을 피하(0.05mg/kg)로 투여합니다. 수술 후 최소 12일마다 최소 3시간마다 피하 부프레노르핀을 계속 공급하고 쥐가 통증 징후를 보이면 추가로 투여합니다. 척수 손상이 발생하면 쥐는 요폐 또는 비정상적인 보행을 보일 수 있습니다. 이것은 뒷다리의 끌림 또는 지연된 움직임 또는 만져지고 팽창된 방광으로 나타납니다. 이런 일이 발생하면 음식과 수분 공급을 위해 영양이 강화된 물 젤을 쥐에 먹이고 반사 배뇨가 회복될 때까지 하루에 두 번 수동으로 방광을 표현합니다. 뒷다리가 완전히 마비되거나 난치성 통증이 있는 경우 쥐를 안락사시킵니다.
결과
이 논문은 LIFU 초음파 처리와 MB 관리의 동시 적용이 국부적인 BSCB 중단을 위한 효과적인 기술임을 보여줍니다. BSCB의 개방은 척추 실질로의 EBD 유출의 존재로 표시됩니다. 이러한 변화는 육안과 형광 현미경 검사 모두에서 뚜렷하게 나타납니다. 척수 혈관 구조는 후궁 절제술 후 볼 수 있으며 측면으로 방사되는 여러 개의 작은 혈관이 있는 후방 척추 정맥을 보여줍니다(그림 4A). 꼬리 정맥 카테터를 통해 EBD를 정맥 주사하면 이 혈관이 파란색 염료로 풍부해집니다(그림 4B). 이것은 후궁 절제술이 척수 혈관의 파열을 초래하지 않았는지 확인하는 절차에서 좋은 포인트입니다. 초음파 처리 후 표적 위치 위에 파란색 점이 표시되어야 하며, 이는 BSCB 붕괴로 인해 EBD가 백색 실질로 유출되었음을 나타냅니다(그림 4C). 이 지점의 크기는 변환기의 초점 영역의 크기와 초음파 처리 후 시간을 포함한 여러 요인에 따라 달라집니다. EBD 외래를 볼 가능성을 높이려면 초음파 처리와 척수 적출 사이의 시간을 늘려야 합니다.
PFA 관류는 탯줄 적출 및 후속 조직 분석 전에 수행해야 하는 단계는 아니지만 샘플에서 혈액을 제거하고 흰색 척추 실질과 파란색 EBD 염색 영역 사이의 대비를 증가시킵니다. MB 투여 및 LIFU 초음파 처리를받은 모든 쥐는 척수로 EBD의 명백한 유출을 보여주는 반면, LIFU 초음파 처리가없는 MB 및 EBD를받은 음성 대조군은 그렇지 않습니다. 대표적인 이미지는 그림 5에 나와 있습니다. 조직을 뚫고 나온 시상은 EBD 유출이 표면적일 뿐만 아니라 탯줄 자체까지 잘 확장되어 있음을 보여줍니다. 이 연구에 사용된 변환기의 초점 영역이 쥐 척수의 직경보다 크기 때문에 예상됩니다. 때때로, 시상 상처에서 소량의 출혈이 보일 수 있습니다. 이것은 후궁 절제술 또는 초음파 음파 때문일 수 있습니다. 출혈이 탯줄의 등쪽 주변부에 가까우면 후궁 절제술로 인한 것일 가능성이 더 큽니다.
EBD 유출을 추가로 평가하기 위해 시상 척수 절편을 DAPI(핵 마커)로 염색하고 형광 현미경을 사용하여 이미지화했습니다. LIFU 초음파 처리 (n = 3)를받은 모든 코드는 초음파 처리를받지 않은 코드보다 EBD 자가 형광 (p = 0.016)의 강도가 훨씬 더 높았으며 둘 다에 유사한 강도의 DAPI가 존재했습니다 (그림 6). H&E 분석에서는 초음파 처리 부위에 신경 손상, 출혈 또는 충치 병변이 없는 것으로 밝혀져 이 절차의 안전성을 뒷받침합니다. 외과적 취급 부주의와 고출력 초음파 처리로 인한 손상된 코드의 예가 비교로 표시됩니다. 출혈, 조직 손상, 충치 병변 및 가능한 액포화가 표시됩니다. 고출력 초음파 처리 예는 출혈을 나타내지 않지만 이것은 또한 초음파 중단의 영향으로보고되었습니다.
또한, MB, EBD 및 LIFU 초음파 처리를받은 쥐에 대해 행동 분석을 수행했습니다. 이 방법은 조직 손상을 완전히 배제하지는 않지만 이 절차로 인해 운동 결손이 발생했는지 테스트합니다. 쥐는 5일 동안 매일 5분 동안 새장에서 걷는 것을 기록했으며, Basso Beattie Bresnahan 운동 척도(보충 비디오 파일 1)를 기반으로 운동 기능을 평가했습니다. 모든 쥐 (n = 5)는 초음파 처리 전, 초음파 처리 후 및 생존 기간의 매일 가장 높은 점수를 받았습니다 (그림 7).
마지막으로, 본 연구에 사용된 초음파 처리 매개변수의 열 효과는 2개의 생체 외 쥐 척수 샘플과 탯줄에 삽입된 미세한 팁이 있는 디지털 온도계 프로브를 사용하여 측정되었습니다. 척수 샘플의 온도는 초음파 처리 전, 도중 및 후에 총 15 분 동안 5 분 동안 추적되었습니다. 온도 변화가 거의 없었습니다. 실제로, 두 샘플 모두에서 초음파 처리로 인해 ≤ 1.3 °C의 변화가 있었으며, 초음파 처리로 인한 고열 손상의 가능성이 감소했습니다 (그림 8).
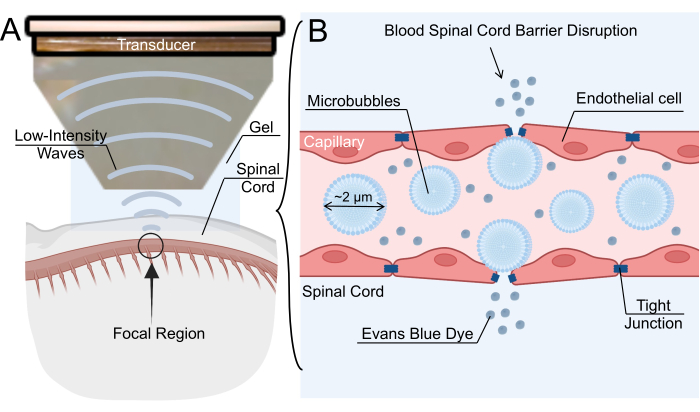
그림 1: 저강도 집속 초음파 매개 혈액-척수 장벽 개방 메커니즘. (A) 쥐 척수의 저강도 집속 초음파(LIFU) 초음파 처리의 개략도. (B) 정맥 내 마이크로 버블 (MB)의 LIFU 초음파 처리를 통한 혈액 척수 장벽 (BSCB) 개방 메커니즘. MB는 LIFU에 반응하여 진동하여 내피 세포 사이의 단단한 접합부를 넓히게 합니다. BSCB의 이러한 붕괴는 나노 입자, 치료 약물 또는 Evans blue 염료의 유출을 허용합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 저강도 집속 초음파 벤치탑 설정 및 연결. (A) 전형적인 집속 초음파 구성 요소를 보여주는 개략도. (B) 다음을 포함한 집속 초음파 설정의 개요 사진: 1. 변환기 전원 출력(TPO), 2. 매칭 네트워크, 3. LIFU 변환기, 4. 입체 악기, 5. 모바일 클램프. (C) 변환기, 다음을 포함하여: 1. 프로브 홀더, 2. 링 변환기, 3. 물 원뿔, 4. 물 입구 튜브, 5. 물 출구 튜브, 6. 멤브레인은 고무 밴드로 고정됩니다. (D) 다음을 포함한 TPO 전면: 1. RF 차폐 인클로저, 2. 조정 가능한 메뉴가 있는 터치 감지 전면 디스플레이 패널, 3. 매개변수 조정을 위한 회전 노브, 4. 시작/정지 출력 스위치. (E) 다음을 포함한 TPO 뒷면: 1. 채널 출력 커넥터, 2. 접지, 3. 소프트웨어 제어용 USB 입력 포트, 4. 내부 트리거, 5. 동기 출력 커넥터, 6. 전원 입력 잭 및 공급 장치, 7. 온/오프 전원 스위치. (F) 채널 번호와 일치하는 와이어가 있는 일치하는 네트워크 출력. (G) 채널 번호와 일치하는 와이어가 있는 일치하는 네트워크 XDR 입력 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
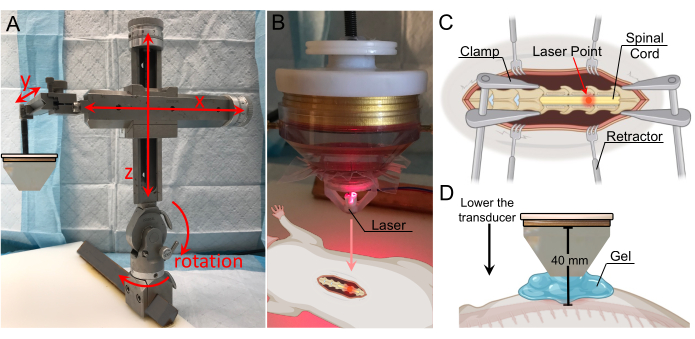
그림 3: 레이저 유도를 통한 표적 위치 파악 . (A) 세 축 모두에서 동작 범위와 회전 기능이 있는 정위 암. 아래 고정판에 부착되어 있습니다. (B) 초점 영역의 식별을 위한 레이저 장치. 레이저는 변환기의 끝에 위치하며 초점 영역과 일치합니다. (C) 노출된 척수의 레이저를 보여주는 그림으로, 변환기의 초점 영역이 이제 이 위치를 향하고 있음을 나타냅니다. (D) 콘의 끝이 코드에서 1cm 위에 위치할 때까지 변환기를 낮추고 최대 결합을 보장하기 위해 틈을 젤로 채웁니다. 변환기에서 척수까지의 거리는 40mm(초점 거리)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
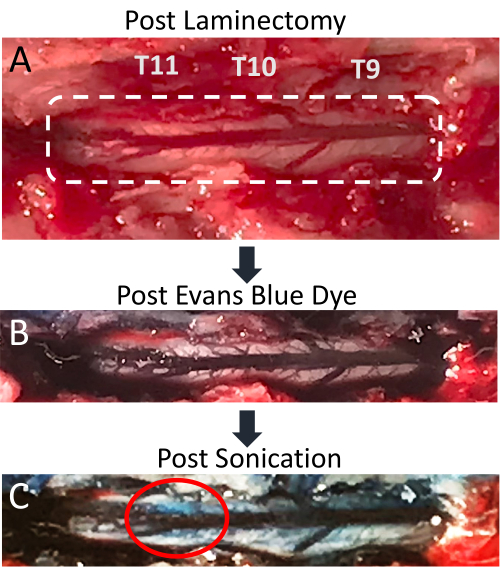
그림 4 : 초음파 처리 후 척수의 Evans 파란색 염료 유출. (A) 노출된 척수와 후방 등쪽 정맥이 선명하게 보이는 T9-T11 쥐 후궁 절개 사진. (B) 에반스 블루 염료(EBD)를 정맥 주사한 후 주변 조직과 척수 혈관이 파란색으로 변합니다. (C) 초음파 처리 부위에서 척수 실질로의 EBD 유출, BSCB 중단이 발생했음을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 척수 적출 및 관류 후 BSCB 개방의 시각화. (A) LIFU 치료 없이 대조군 쥐로부터 절제된 척수. 이 쥐는 MB와 EBD만 받았습니다. 파라핀에 박힌 탯줄의 중간 시상 조각이 삽입물에 표시되며 EBD 유출이 보이지 않습니다. (B) LIFU 처리로 쥐의 척수를 절제했습니다. 이 쥐는 또한 MB와 EBD를 받았습니다. EBD 유출 컬럼은 가시적이며 초음파 처리 된 영역에 국한됩니다. 파라핀에 내장 된 코드의 중간 시상 조각이 삽입물에 표시되며 초음파 처리 된 위치 내부에서 볼 수있는 EBD 농도를 가리키는 화살표가 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
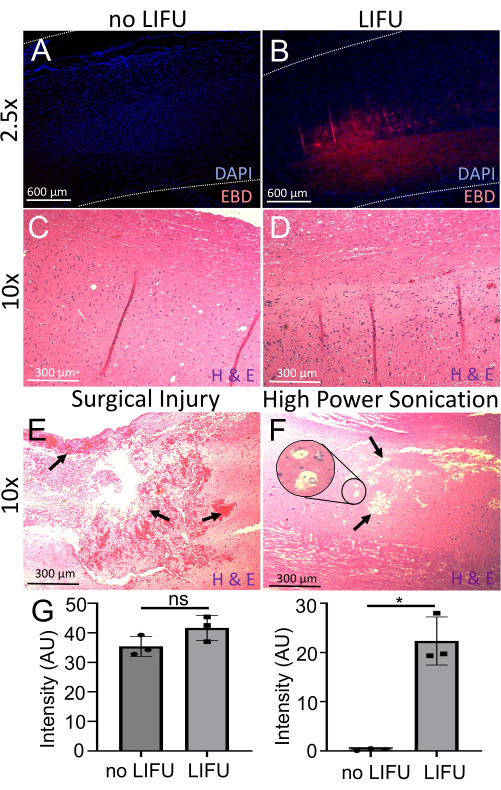
그림 6: BSCB 개방 감지 및 평가. (A) DAPI(핵 마커, 파란색)로 염색된 척수. 최소 EBD 자가형광(빨간색)이 보입니다. 이 쥐는 LIFU를 받지 않았습니다. (B) DAPI(핵 마커, 파란색)로 염색된 척수. 초음파 처리 된 표적 위치에서 국소 적 EBD 자가 형광 (빨간색)을 볼 수 있습니다. 이 쥐는 LIFU 및 MB를 받았습니다. (C) 헤마톡실린(핵산 염색) 및 에오신(비특이적 단백질 염색)(H&E)으로 염색된 LIFU가 없는 쥐의 척수. 신경 손상, 출혈 또는 충치 병변은 보이지 않습니다. (D) H&E로 염색된 LIFU가 있는 쥐의 척수. 신경 손상, 출혈 또는 공동 병변이 보이지 않습니다. (E) H&E로 염색된 수술 상처를 입은 쥐의 척수. 화살표는 충분한 출혈과 조직 손상을 가리킨다. (F) H&E로 염색된 고출력 초음파 처리로 인해 손상된 쥐의 척수는 공동 병변을 가리키며 삽입물은 액포화 가능성을 보여줍니다. (G) LIFU 초음파 처리가 있거나 없는 쥐의 척수에서 DAPI 및 EBD의 강도를 보여주는 막대 그래프. 유사한 DAPI 강도(p > 0.05)에도 불구하고 음성 대조군(p = 0.016)과 비교할 때 LIFU 척수에서 EBD 강도가 훨씬 더 높습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
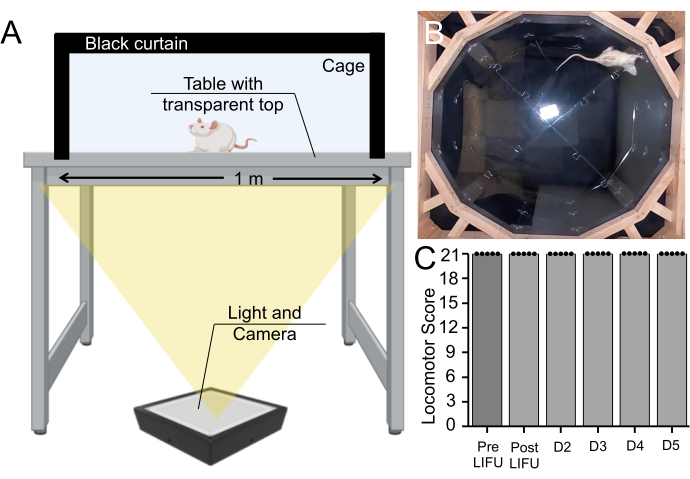
그림 7 : 행동 분석 전후 초음파 처리. (A) Basso, Beattie, Bresnahan 장치 설정, 쥐가 아래에서 5분 동안 걷는 것을 기록했습니다. (B) 녹화된 비디오의 정지 이미지. 이 비디오는 Basso, Beattie, Bresnahan 척도에서 쥐의 운동 협응과 보행을 평가하는 데 사용되었습니다. (C) MB와 LIFU 처리를받은 쥐의 초음파 처리 전, 초음파 처리 후 또는 5 일 생존 기간 동안 운동 점수의 변화가 없음을 보여주는 상자 그림 (n = 5) (p > 0.05). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: 체외 척수를 사용한 온도 분석. 초음파 처리 전, 중, 후 5분 동안 두 개의 생체 외 척수 샘플의 온도 변화를 묘사한 그래프. 초음파 처리에 사용되는 매개 변수는 표 1에 나열되어 있습니다. 샘플 1의 경우, 초음파 처리 전, 중 및 초음파 처리 후 평균 온도는 각각 21.9 °C ± 0.1 °C, 22.1 °C ± 0.1 °C, 22.0 °C ± 0.1 °C였습니다. 샘플 2의 경우, 초음파 처리 전, 중 및 초음파 처리 후 온도는 각각 21.9 °C ± 0.1 °C, 22.5 °C ± 0.3 °C, 22.4 °C ± 0.2 °C였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 레이저 표적 장치의 CAD 파일. (A) 아래에서 레이저 장치의 모습. 모든 레이저는 중앙의 중앙 구멍 내에 배치할 수 있습니다. (B) 레이저 장치의 측면도. (C) 레이저 장치의 치수(단위는 인치)입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 비디오 파일 1: Basso, Beattie, Bresnahan 장치에서 걷는 쥐의 비디오. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에서는 마이크로버블(MB) 투여와 결합된 저강도 집속 초음파(LIFU)를 사용하여 효과적이고 표적화된 BSCB 파괴에 필요한 장비 및 단계를 설명합니다. 이 프로토콜은 유연하며 다양한 사양의 트랜스듀서와 함께 개별 사용에 최적화할 수 있습니다. LIFU 매개 BSCB 파괴를 위한 다른 기술들은 표적 국소화를 위한 자기공명영상(MRI) 유도 시스템의 사용에 의존하는데, 이는 비용이 많이 든다16. 여기에 제시된 기법의 장점은 BSCB 중단에 대한 빠른 실시간 시각적 확인과 절차의 개방적 특성으로 인한 타겟팅의 용이성에 있습니다. 또한 레이저 장치는 사용 및 구성이 간단하며 CAD 파일이 보충 섹션에 포함되어 있습니다. 결과적으로, 소동물 모델에서 LIFU 트랜스듀서의 표적화 능력에 대한 초기 테스트를 수행하는 데 관심이 있는 연구원은 이 프로토콜을 도구로 사용하여 관심 위치에 대한 초점 영역 위치를 신속하게 확인할 수 있습니다. 이 기술은 미국 또는 MR 시스템과 같은 더 복잡한 지침 양식에 투자하기 전에 약물 전달과 같은 LIFU의 임상 응용 프로그램을 연구하기 시작하는 실험실에서도 사용할 수 있습니다. 현재 미국 가이드 양식은 MR 시스템에 비해 더 유망하고 비용 효율적인 경로를 제시하지만 후자가 문헌에서 더 자주 볼 수 있습니다.
이 절차에는 성공적인 BSCB 중단을 보장하기 위해 신중하게 실행해야 하는 몇 가지 중요한 단계가 있습니다. 후궁 절제술을 받는 동안 척수에 불필요한 압력을 가하지 않는 것이 중요합니다. 코드를 너무 많이 물리적으로 조작하면 BSCB가 손상될 가능성이 높아집니다. 손상은 출혈과 EBD 유출 증가로 인해 발치 후 탯줄 내부에 짙은 갈색 반점으로 나타납니다. 또한 변환기와 노출된 척수 사이에 최대한의 결합이 보장되어야 합니다. 결과적으로 물방울과 초음파 젤에서 기포를 제거하는 데 주의를 기울여야 합니다. 음파의 완전한 전송을 보장하기 위해 물방울의 바닥과 코드 사이에 틈이 없어야 합니다. 꼬리 정맥 카테터를 삽입하는 동안 헤파린화 식염수, EBD 또는 MB 용액과 함께 실수로 공기를 통과시키지 않아야 합니다. 공기의 주입은 시술이 끝나기 전에 설치류의 죽음을 초래하는 폐색전증의 가능성을 크게 증가시킨다28.
이 절차 중에 발생할 수 있는 일반적인 문제는 성공적인 EBD 주입의 실패입니다. 꼬리 정맥 카테터 삽입에 대한 경험이 거의 없는 개인의 경우 동물 후궁 절제술, 위치 지정 또는 표적화 전에 이 단계를 수행하면 시간을 절약할 수 있습니다. EBD는 또한 초음파 처리에 영향을 미치지 않고 MB 주입 전에 잘 주입 할 수 있습니다. 이 프로토콜에서 제안하는 지혈대와 온수 목욕을 활용하면 꼬리 정맥을 확장하고 성공률을 높이는 데 도움이 됩니다. 또한 쥐의 탈수는 올바른 카테터 배치의 가능성을 감소시킵니다. 꼬리 정맥 카테터 삽입 10-15분 전에 복강내 식염수 주사가 도움이 될 수 있습니다. 카테터를 삽입하는 동안 꼬리 끝에서 2를 시작하여 꼬리에서 두개골 방향으로 움직여야 합니다. 반대 방향으로 움직이면 잠재적인 정맥 붕괴 또는 출혈로 인한 성공 가능성이 줄어듭니다.
또 다른 일반적인 문제는 초음파 처리에도 불구하고 EBD 유출이 부족하다는 것입니다. 이는 초음파 처리에 사용되는 매개 변수가 BSCB 중단에 충분하지 않음을 나타낼 수 있습니다. 예를 들어, 초음파 처리 주파수가 변환기의 중심 주파수와 크게 다른 값으로 설정되면 초음파 처리 전력이 너무 낮아 MB를 진동시키고 단단한 접합부 풀림을 유발합니다. 또한 변환기와 코드 (예 : 물 원뿔, 멤브레인, 젤, 물 / 젤의 기포) 사이에 인터페이스가 많을수록 실제 초음파 처리 강도가 목표에 낮아집니다. 가스가 제거 된 젤을 사용하고 원뿔 내부의 기포를 완전히 제거하는 것과 같이 이러한 인터페이스를 최소화하면 초음파 처리의 잠재력을 최대한 전달하는 데 도움이됩니다. 이 프로토콜은 또한 척추 실질로 EBD 유출에 더 많은 시간을 허용하기 위해 초음파 처리와 관류 사이의 시간을 늘리도록 권장합니다. BSCB 중단은 일시적인 절차이지만 닫히기 전에 몇 시간 동안 간격이 존재합니다. 대기 시간이 길면 이소플루란에 대한 노출이 증가하지만 탯줄에서 EBD 유출이 더 커집니다. 또는 LIFU와의 초음파 처리가 없음에도 불구하고 EBD 유출이 존재할 수 있습니다. 이 문제를 해결하려면 후궁 절제술 중에 BSCB의 우발적인 손상을 방지하기 위해 주의를 기울여야 합니다. 잠재적인 해결책으로는 클램핑 중에 쥐의 척추를 들어 올려 층판과 탯줄 사이의 공간을 늘리고 더 짧은 후궁 절제술을 시행하는 것이 있습니다. 또한 철저한 PFA 관류는 척수 내 혈관에서 EBD가 풍부한 혈액을 제거하여 배경 염색을 줄입니다. 심내막 관류 중에는 PBS 또는 PFA가 누출될 수 있는 우발적인 심장 파열을 방지하기 위해 주의를 기울여야 합니다.
이 연구는 LIFU 매개 BSCB 중단에 대한 단일 센터 경험을 나타낸다는 점에 유의하는 것이 중요합니다. 또한이 프로토콜은 다양한 초음파 처리 에너지 매개 변수 및 MB 농도를 테스트하거나 최적화하지 않습니다. 결과적으로, 연구자들은 특히 초기 결과가 부작용을 일으키는 경우 특정 연구 요구에 맞게 표적 국소화 및 BSCB 파괴를 최적화하기 위해 이 기술을 수행할 때 다양한 파라미터와 농도를 조사하는 것이 좋습니다. 예를 들어, 온도 변화가 없는 것을 보고 싶은 그룹은 이 기준을 충족하고 충분한 BSCB 중단을 달성할 수 있는 세트를 찾을 때까지 다양한 매개변수를 테스트할 수 있습니다. 또한 이 기술의 안전성을 확인하기 위해 추가 실험을 수행할 수 있습니다. 예를 들어, 시료 크기를 늘리고, 생존 기간을 연장하고, 근전도/보행 분석 연구를 수행할 수 있습니다. 생존 기간을 연장하기 위해서는 일부 연구에서 EBD를 다량 투여하면 만성 전신 독성을 유발할 수 있으므로 저용량을 사용하는 것이 현명할 수 있다는 점을 명심해야 한다29.
이 절차의 또 다른 한계는 후궁 절제술의 침습적 특성입니다(초음파가 뼈를 관통할 수 없기 때문에 BSCB 개구에 LIFU를 사용하는 모든 기술에 필요함). 이 절차의 침습적 특성은 후궁 절제술의 길이를 제한하여 줄일 수 있습니다. 더 짧고 얇은 상부 흉추 후궁 절제술을 시행하면 후궁 절제술에 필요한 시간을 10분 미만으로 줄일 수 있습니다. MB의 취약한 특성과 짧은 반감기로 인해 이 프로토콜 동안에는 시간이 제한됩니다. MB의 주입은 LIFU로 치료하기 1-2 분 전에 발생해야하며, 여러 LIFU 치료가 수행되는 경우 모든 초음파 처리 전에 새로운 MB를 투여해야합니다. 여러 쥐에 대한 BSCB 파괴와 관련된 실험의 경우 여러 MB 바이알을 준비해야 할 수 있습니다. 마이크로 버블은 비싸기 때문에, 초음파 처리 사이의 시간을 최소화하기 위해 수술 워크 플로우를 변경하는 것은 사용 된 MB의 수를 보존하는 것이 바람직합니다.
여기에 설명된 기술은 주로 연구 프로토콜로 사용하기 위한 것입니다. 레이저 표적화 장치가 모든 임상 환경에서 전통적인 표적화 방식을 대체하지는 않겠지만, 다른 상황에서는 유용할 수 있다. 비침습적 수술의 경우 기존 MRI 방식을 사용하여30명을 표적화할 수 있습니다. 수행되는 후궁 절제술을 포함하는 침습적 수술의 경우, 이 프로토콜에 설명된 레이저 포인트 장치를 사용하여 약물 전달 또는 면역 조절 요법을 목적으로 특정 영역(예: 종양 또는 척수 손상 부위)에 걸쳐 초음파 처리의 초점 영역의 중심을 신속하게 국소화하는 동시에 발생하는 MR 유도를 보완할 수 있습니다.
전반적으로 이 프로토콜은 BSCB 중단을 위한 효과적이고 성공적인 기술을 설명하며 실시간 및 사후 처리 모두에서 BSCB 개방을 확인하기 위한 몇 가지 옵션을 포함합니다. BSCB가 척수 실질로의 진입 장벽으로 기능하기 때문에 BSCB의 중단은 치료제 전달을 개선할 수 있는 가능한 방법입니다. 예를 들어, Weber-Adrian et al.은 1.114MHz의 주파수와 10ms의 버스트 길이를 가진 LIFU를 사용하여 경추6로의 유전자 전달을 매개하였다. 유사하게, Smith et al.은 580kHz의 주파수, 약 0.46MPa의 평균 음향 피크 압력, 10ms의 버스트 길이를 갖는 LIFU가 연수막 전이의 설치류 모델에서 단클론 항체인 트라스투주맙(trastuzumab)을 척수에 전달하는 데 도움이 될 수 있음을 보여주었다10. 대부분의 연구는 LIFU 활용에 중점을 두었습니다. HIFU보다는 기초 조직의 손상을 피하면서 BSCB를 일시적으로 투과시키는 LIFU의 능력 때문입니다. 전형적으로, LIFU는 0.125-3 W/cm2 사이의 강도를 사용하는 반면, HIFU는 100-10,000 W/cm2 이상의 강도를 사용한다31. 그 결과, HIFU는 주로 조직 가열을 통해 효과를 발휘하는 반면, LIFU는 MB의 공동 투여와 함께 기계적 캐비테이션 효과를 통해 작동합니다. 치료제와 MB를 병용투여하면 약물이 척수 실질로 더 많이 유출될 수 있을 뿐만 아니라 MB에 약물을 로드하고 표적 약물 전달을 위해 초음파로 MB를 용해할 가능성이 있습니다.
이 연구에 사용된 초음파 처리 매개변수, MB 농도 및 변환기 유형은 실험적 필요에 따라 변경될 수 있습니다. 예를 들어, 초점 영역이 더 작은 트랜스듀서는 국부적인 표적화에 대해 더 큰 제어가 필요한 실험에 더 적합할 수 있는 반면, 더 높은 출력을 가진 트랜스듀서는 더 짧은 시간에 강력한 파괴가 필요한 실험에 사용될 수 있습니다. 이 프로토콜이 제공하는 유연성으로 인해 전임상, 임상 및 중개 연구에 사용할 수 있는 큰 잠재력이 있습니다.
공개
저자는 이 연구가 잠재적인 이해 상충으로 해석될 수 있는 상업적 또는 재정적 관계가 없는 상태에서 수행되었음을 선언합니다. 아미르 만바치(Amir Manbachi)는 BK Medical(GE Healthcare), Neurosonics Medical에서 강의와 컨설팅을 담당하고 있으며, 특허 출원 중인 다수의 FUS 기술을 발명한 사람입니다. 베티 타일러(Betty Tyler)는 미국 국립보건원(NIH)으로부터 연구 자금을 지원받고 있으며, 액셀러레이팅 조합 요법(Accelerating Combination Therapies)의 공동 소유주입니다(지분 또는 옵션 포함). Ashvattha Therapeutics Inc.는 또한 그녀의 특허 중 하나에 대한 라이선스를 취득했으며 Peabody Pharmaceuticals의 주주입니다. 니콜라스 테오도르(Nicholas Theodore)는 글로버스 메디컬(Globus Medical)로부터 로열티를 받고 주식을 소유하고 있습니다. 그는 Globus Medical의 컨설턴트이며 Globus Medical의 과학 자문 위원회/기타 사무실에서 근무했습니다. 나머지 저자는 공개할 이해 상충이 없습니다.
감사의 말
T32GM136577(DR)에서 지원; N660012024075 (N.T., N.V.T., A.M., K.K.L.); R01 HL139158-01A1 및 R01 HL071568-15 (N.V.T.); 존스 홉킨스 ICTR 임상 연구 장학생 프로그램(KL2)(AM). BioRender.com 로 만든 여러 인물.
자료
| Name | Company | Catalog Number | Comments |
| 0.9% Heparinized Sodium Chloride | Baxter | FKB0953G | Flush tail vein catheter with heparinized saline to prevent clotting. |
| 100 mL Luer Lock Tip Syringe (2) | Wilburn Medical | WUSA/120 | One syringe can be used to inject PBS and one for PFA (during transcardial perfusion) |
| 1x Phosphate buffered saline (PBS) | Thermo Scientific | 10010001 | For transcardial perfusion. |
| 22 G catheter | Med Vet International | 50-209-1694 | Use to place a tail vein catheter. |
| 97% Isoflurane | Thermo Scientific Chemicals | 247-897-7 | While rat is under isoflurane, be careful not to administer too much. A high dose can euthanize the rat. |
| Betadine 7.5% | Purdue Products | 4677 | |
| Class A clear threaded glass vial | Fisherbrand | 14-955-314 | Use to store spinal cord extraction. |
| Digital balance scale | Kent Scientific | SCL-4000 | |
| Electric razor | Wahl Home Products | 79449-200 | Shave fur off skin at incision site before surgery |
| Eosin-Y with Phloxine | Epredia | 71304 | |
| Evans blue dye | MP Biomedicals | 02151108-CF | Although it is non-toxic, it will stain skin blue if direct contact occurs. |
| Fixation Plate Assembly with 0.5 mm Forceps | PSI Impactors | 7001-2 | Affix the stereotactic arm to this frame |
| Gauze | Fisherbrand | 13-761-52 | |
| Heating pad | Kent Scientific | RT-0515 | |
| Hematoxylin | Epredia | 7211 | |
| Iris Scissors with Angled Blades | ProDentUSA | 12-15315 | |
| Isoflurane induction system | Kent Scientific | SOMNO-RATKIT | |
| Laser targetting apparatus | NA | custom | CAD design file provided in supplemental section. Simply place a laser inside the apparatus created from the file. |
| Lubricating eye ointment | Systane | N/A | |
| Luer Lock 3-Way Stopcock | Sigma | SAS7521-10EA | Can use to fill water cone through inlet valve |
| Lumason microbubbles kit | Bracco | 0270-7099-16 | |
| Microscope cover glass | Fisherbrand | 12-545J | |
| Microscope slides | Fisherbrand | 12-550-15 | |
| Microtome | Epredia | 23-900-671 | |
| Mounting medium with 4',6-diamidino-2-phenylindole (DAPI) | Vector Laboratories | H-2000-2 | |
| Mylar membrane | Chemplex | 3016 | Can cut membrane to appropriate size if too large for cone |
| NeuroFUS 2.52" diameter 250 kHz transducer | Sonic Concepts | CTX-250 | Transducer system includes custom water cone and probe holder |
| NeuroFUS PRO v2.0 system | Sonic Concepts | NFS102v2 | Includes Transducer Power Output, Matching Network and associated cables |
| Offset Bone Nippers | Fine Science Tools | 16101-10 | Use to remove spinous processes and laminae for laminectomy |
| Paraffin | Polysciences | 24364-1 | Can place spinal cord sample in paraffin to slice into thin sections for histology. |
| Paraformaldehyde (4%) | Thermo Scientific | J61899-AK | For transcardial perfusion. |
| Rat Surgical Kit | Kent Scientific | INSRATKIT | Consists of tweezer #5, needle holder, McPherson-Vannas scissors, Iris scissors, ALM self-retaining retractors, Iris forceps, and blunt probe. These products should be sufficient to perform a laminectomy. |
| Razor blade | Fisherbrand | 12-640 | Use to cut spinal cord extraction to desirable length and split section down midline. |
| Rectal thermometer | Kent Scientific | RET-2 | Maintain rat temperature between 35.9–37.5 °C |
| Rubber band | Fisherbrand | 50-205-1983 | |
| Single animal vaporizer unit | Kent Scientific | SF-01 | |
| Stereotactic arm | Kopf Instruments | Model 963 | |
| Sterile absorbent pad | McKesson | 4033-CS150 | Place under rat and above heating pad and fixation plate before laminectomy |
| Ultrasound gel | Aquasonic | PLI 01-34 | Ensure gel is free of bubbles to the best of your ability. |
참고문헌
- Chopra, N., et al. Blood-spinal cord barrier: Its role in spinal disorders and emerging therapeutic strategies. NeuroSci. 3 (1), 1-27 (2021).
- Bartanusz, V., Jezova, D., Alajajian, B., Digicaylioglu, M. The blood-spinal cord barrier: morphology and clinical implications. Annals of Neurology. 70 (2), 194-206 (2011).
- Hersh, A. M., Alomari, S., Tyler, B. M. Crossing the blood-brain barrier: Advances in nanoparticle technology for drug delivery in neuro-oncology. International Journal of Molecular Sciences. 23 (8), 4153 (2022).
- Pan, W., Banks, W. A., Kastin, A. J. Permeability of the blood-brain and blood-spinal cord barriers to interferons. Journal of Neuroimmunology. 76 (1-2), 105-111 (1997).
- Bellettato, C. M., Scarpa, M. Possible strategies to cross the blood-brain barrier. Italian Journal of Pediatrics. 44, 131 (2018).
- Weber-Adrian, D., et al. Gene delivery to the spinal cord using MRI-guided focused ultrasound. Gene Therapy. 22 (7), 568-577 (2015).
- Hersh, A. M., et al. Applications of focused ultrasound for the treatment of glioblastoma: A new frontier. Cancers. 14 (19), 4920 (2022).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Cho, H., et al. Localized down-regulation of P-glycoprotein by focused ultrasound and microbubbles induced blood-brain barrier disruption in rat brain. Scientific Reports. 6, 31201 (2016).
- Smith, P., Ogrodnik, N., Satkunarajah, J., O'Reilly, M. A. Characterization of ultrasound-mediated delivery of trastuzumab to normal and pathologic spinal cord tissue. Scientific Reports. 11 (1), 4412 (2021).
- Montero, A. S., et al. Ultrasound-induced blood-spinal cord barrier opening in rabbits. Ultrasound in Medicine & Biology. 45 (9), 2417-2426 (2019).
- Fletcher, S. P., Choi, M., Ogrodnik, N., O'Reilly, M. A. A porcine model of transvertebral ultrasound and microbubble-mediated blood-spinal cord barrier opening. Theranostics. 10 (17), 7758-7774 (2020).
- Honeycutt, S. E., O'Brien, L. L. Injection of Evans blue dye to fluorescently label and image intact vasculature. BioTechniques. 70 (3), 181-185 (2021).
- Fletcher, S. P., Choi, M., Ramesh, R., O'Reilly, M. A. Focused ultrasound-induced blood-spinal cord barrier opening using short-burst phase-keying exposures in rats: A parameter study. Ultrasound in Medicine & Biology. 47 (7), 1747-1760 (2021).
- Cross, C. G., et al. Technical note: Quantification of blood-spinal cord barrier permeability after application of magnetic resonance-guided focused ultrasound in spinal cord injury. Medical Physics. 48 (8), 4395-4401 (2021).
- Hong, Y. R., et al. Ultrasound stimulation improves inflammatory resolution, neuroprotection, and functional recovery after spinal cord injury. Scientific Reports. 12 (1), 3636 (2021).
- Liao, Y. H., et al. Low-intensity focused ultrasound alleviates spasticity and increases expression of the neuronal K-Cl cotransporter in the L4-L5 sections of rats following spinal cord injury. Frontiers in Cellular Neuroscience. 16, 882127 (2022).
- Redfors, B., Shao, Y., Omerovic, E. Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Laboratory Animals. 48 (1), 6-14 (2014).
- Lillie, L. E., Temple, N. J., Florence, L. Z. Reference values for young normal Sprague-Dawley rats: weight gain, hematology and clinical chemistry. Human & Experimental Toxicology. 15 (8), 612-616 (1996).
- Lin, X. J., et al. Spinal cord lateral hemisection and asymmetric behavioral assessments in adult rats. Journal of Visualized Experiments. (157), e57126 (2020).
- Tsehay, Y., et al. Low-intensity pulsed ultrasound neuromodulation of a rodent's spinal cord suppresses motor evoked potentials. IEEE Transactions on Biomedical Engineering. , (2023).
- Payne, A. H., et al. Magnetic resonance imaging-guided focused ultrasound to increase localized blood-spinal cord barrier permeability. Neural Regeneration Research. 12 (12), 2045-2049 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. Journal of Visualized Experiments. (146), e59295 (2019).
- Sabbagh, A., et al. Opening of the blood-brain barrier using low-intensity pulsed ultrasound enhances responses to immunotherapy in preclinical glioma models. Clinical Cancer Research. 27 (15), 4325-4337 (2021).
- Dréan, A., et al. Temporary blood-brain barrier disruption by low intensity pulsed ultrasound increases carboplatin delivery and efficacy in preclinical models of glioblastoma. Journal of Neuro-Oncology. 144 (1), 33-41 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Yamamoto, H., Imai, S., Okuyama, T., Tsubura, Y. Pulmonary lesions in rats caused by intravenous injection. Acta Pathologica Japonica. 32 (5), 741-747 (1982).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Scientific Reports. 9 (1), 321 (2019).
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유