Method Article
Bir sıçan modelinde düşük yoğunluklu odaklanmış ultrason kullanılarak kan-omurilik bariyerinin bozulması
Bu Makalede
Özet
Kan-omurilik bariyerinin (BSCB) bozulması, mikrokabarcıkların intravenöz uygulaması ve düşük yoğunluklu odaklanmış ultrason (LIFU) uygulaması ile başarılı bir şekilde sağlanabilir. Bu protokol, ekipman kurulumu, mikro kabarcık enjeksiyonu, hedef lokalizasyonu ve BSCB bozulma görselleştirmesi dahil olmak üzere bir kemirgen modelinde LIFU kullanılarak BSCB'nin açılmasını detaylandırır.
Özet
Düşük yoğunluklu odaklanmış ultrason (LIFU), ultrasondan daha düşük yoğunluklarda ultrasonik titreşimler kullanır ve geri dönüşümlü ve hassas bir nöromodülatör teknoloji olarak test edilmektedir. LIFU aracılı kan-beyin bariyeri (BBB) açılması ayrıntılı olarak araştırılmasına rağmen, bugüne kadar kan-omurilik bariyeri (BSCB) açılması için standart bir teknik oluşturulmamıştır. Bu nedenle, bu protokol, hayvan hazırlama, mikro kabarcık yönetimi, hedef seçimi ve lokalizasyonunun yanı sıra BSCB bozulma görselleştirme ve onaylama açıklamaları da dahil olmak üzere bir sıçan modelinde LIFU sonikasyonunu kullanarak başarılı BSCB bozulması için bir yöntem sunar. Burada bildirilen yaklaşım, odaklanmış bir ultrason dönüştürücüsü olan küçük bir hayvan modelinde hedef lokalizasyonu ve kesin BSCB bozulmasını test etmek ve onaylamak, sonikasyon parametrelerinin BSCB etkinliğini değerlendirmek veya ilaç dağıtımı gibi omurilikte LIFU uygulamalarını keşfetmek için hızlı ve uygun maliyetli bir yönteme ihtiyaç duyan araştırmacılar için özellikle yararlıdır. immünomodülasyon ve nöromodülasyon. Bu protokolün bireysel kullanım için optimize edilmesi, özellikle gelecekteki klinik öncesi, klinik ve translasyonel çalışmaları ilerletmek için önerilir.
Giriş
Kan-beyin bariyerine (BBB) benzer şekilde, kan-omurilik bariyeri (BSCB), dolaşımdaki çözünen maddelerin, hücrelerin ve plazma bileşenlerinin spinal parankim1'e hareketini düzenler. Bu koruyucu özellik, omurilik kılcal damarlarını kaplayan sıkıca bağlanmış, fenestre edilmemiş endotel hücrelerinden oluşan özel bir sistemin sonucudur2. Tipik olarak, yalnızca pozitif yüklü düşük ağırlıklı, lipofilik moleküller her iki engelide geçebilir 3. BSCB'nin BBB'den biraz daha yüksek geçirgenliğe sahip olduğunu öne süren çalışmalara rağmen, her iki engel de terapötiklerin merkezi sinir sistemineverilmesini sınırlar 4. Spinal kılcal damarlarda ozmotik basıncı arttırma teknikleri, bradikinin reseptörleri ile etkileşime giren ilaçların geliştirilmesi ve işlevselleştirilmiş nanopartiküllerin oluşturulması dahil olmak üzere, ilaçların BSCB boyunca taşınmasını artırmak için çeşitli stratejiler geliştirilmiştir5.
BSCB bozulması, mikrokabarcıkların (MB'ler) intravenöz uygulaması ve ardından düşük yoğunluklu odaklanmış ultrason (LIFU) sonikasyonu ile de sağlanabilir6. Ultrason dönüştürücüsü tarafından üretilen akustik alan, MB salınımlarına neden olur ve bu da endotel duvarına baskı uygular ve sıkı bağlantıları gevşetir7. Sıkı bağlantı gevşemesi, kılcal damarlarda geçici boşluklar oluşturarak terapötiklerin spinal parankimine nüfuz etmesine izin verir (Şekil 1). Bu işlem aynı zamanda transendotelyal fenestratiyonlar oluşturabilir, transsitozu artırabilir ve P-glikoprotein 8,9 gibi ATP bağlayıcı kaset taşıyıcılarını aşağı regüle edebilir. Bu tekniğin önemli bir yararı, sonikasyonun odak bölgesini omurilikteki ilgilenilen yere yönlendirerek hedef dışı etkileri en aza indirgeme yeteneğidir. Birkaç klinik çalışma, gliomlar, amyotrofik lateral skleroz, Alzheimer hastalığı ve Parkinson hastalığı dahil olmak üzere merkezi sinir sistemi patolojilerinin tedavisi için LIFU aracılı BBB açılmasının etkinliğini araştırmıştır. LIFU aracılı BSCB bozulması, LIFU aracılı BBB bozulması kadar yaygın bir şekilde karakterize edilmese de, birkaç grup kemirgen, tavşan ve domuz modellerinde başarılı BSCB bozulması bildirmiştir10,11,12. Genel olarak, tekniğe olan ilgi, özellikle ilaç dağıtımı için uygun bir yol olarak hızla artmaktadır.
Bu protokolde, bir sıçan modelinde LIFU aracılı BSCB bozulması için bir teknik açıklanmaktadır. Prosedür, hayvan hazırlama, LIFU ekipman kurulumu, MB uygulaması, hedef lokalizasyonu ve omurilik ekstraksiyonunun ayrıntılı açıklamalarını içerir. Hedef lokalizasyonun ve BSCB bozulmasının doğrulanması, omuriliğe Evans mavi boya (EBD) ekstravazasyonu ile değerlendirilir. EBD, serum albüminine bağlanan toksik olmayan bir bileşiktir ve görsel olarak zengin mavi rengi ve mikroskopi altında kırmızı otofloresansıile tanımlanabilir 13.
Burada listelenen adımlar, geleneksel ultrason (US) veya manyetik rezonans (MR) kılavuzluğunda LIFU sistemlerine hızlı ve ucuz bir alternatif sunar. Sonuç olarak, bu yöntem, ek ekipman ve malzemeler edinmeden veya omurilikte ilaç dağıtımı, immünomodülasyon ve nöromodülasyon gibi LIFU uygulamalarını takip etmeden önce LIFU dönüştürücülerinin hedefleme ve BSCB bozulma yeteneklerini hızlı bir şekilde test etmek ve onaylamakla ilgilenen araştırmacılar için yararlıdır.
Protokol
Tüm hayvan çalışmaları, Johns Hopkins Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC RA20M223) tarafından onaylanmış ve yürütülmüştür. Bu çalışma için sadece yetişkin Sprague-Dawley dişi sıçanları (ortalama ağırlık: 250 g; yaş: 11 hafta) kullanıldı.
1. Düşük yoğunluklu odaklanmış ultrason montajı ve kurulumu
- Sıçanlarda BSCB açılmasını sağlamak için yeterli özelliklere sahip odaklanmış bir ultrason dönüştürücü sistemi edinin. Literatürden önerilen parametreler arasında 0.25-4 MHz arasında bir merkezi frekans ve 0.2-2.1 MPa arasında pik basınç üretme kapasitesi bulunmaktadır 10,14,15,16,17. Sistemin, en azından bir dalga/sinyal üreteci, radyo frekansı (RF) sürücüsü/güç içeren sürüş/kontrol ekipmanını içerdiğinden emin olun.
NOT: Burada açıklanan kurulum, merkezi frekansı 250 kHz ve 64 mm çapında olan, piyasada bulunan çok elemanlı bir dönüştürücü kullanır (Şekil 2B). - 3D baskılı prob tutucuyu ve su konisini dönüştürücüye yapıştırın (Şekil 2C). Koni ve dönüştürücü arasında su geçirmez bir sızdırmazlık sağlayın.
NOT: Bu Deneyde kullanılan dönüştürücüyle birlikte özel bir koni ve prob tutucu geldi. Koni ve prob tutucu, dönüştürücüye ayrıca sağlanan vidalarla tutturulur. - 50 μm kalınlığında, akustik olarak şeffaf bir polyester membranı sterilize edin ve bir lastik bant kullanarak su konisinin dibine yapıştırın.
- Giriş ve çıkış borularını kullanarak su konisini gazdan arındırılmış ve deiyonize suyla doldurun. Dönüştürücü ile hedef arasındaki akustik bağlantıyı bozabileceğinden, koninin içindeki hava kabarcıklarından kaçınmaya dikkat edin. Polyester membran hafifçe şişirilmelidir.
NOT: Konideki hava kabarcıklarını gidermek için, koniyi giriş valfinden suyla doldururken kabarcıkları çıkış valfine yönlendirin. Çok sayıda küçük kabarcık varsa, tüm valfleri kapatın ve büyük bir kabarcık kalana kadar koniyi döndürün. Bu balonu çıkış valfine yönlendirin ve koniyi doldurmaya devam edin. - Dalga üreteci ve RF sürücü amplifikatörünü içeren sürüş ekipmanını dönüştürücüye bağlayın. Dönüştürücü kablosu, eşleşen ağın çıkış tarafına bağlanacak ve sinyal üreteci/güç amplifikatörü, eşleşen ağın giriş tarafına bağlanacaktır. Kablolar ilgili kanal numaralarına bağlanmalıdır (Şekil 2D-G).
NOT: Bu çalışmada kullanılan ticari sistemde, dalga üreteci ve RF sürücü amplifikatörü, dönüştürücü güç çıkışının (TPO) bileşenleridir (Şekil 2D). - Prob tutucuyu stereotaktik kola takın. Stereotaktik kolu sabitleme plakası tertibatına takın. Bu, dönüştürücünün sonikasyon sırasında kemirgenin tam olarak üzerine yerleştirilmesine izin verecektir.
2. Hayvan hazırlama ve cerrahi laminektomi
- Sıçanı, bir kömür filtre kabına bağlı bir indüksiyon odasında izofluran ve tıbbi hava karışımı ile uyuşturun. Anestezi indüksiyonu için gaz akış hızını 400 mL/dk'ya ve izofluran buharlaştırıcıyı %1,5-%2,5 arasına ayarlayın. Tam sedasyondan önce odada geçirilen süre değişkendir, ancak tipik olarak 3-6 dakika arasında değişir.
- Sakinleştirilen sıçanın ağırlığını kaydedin ve ayak parmağı sıkışma testi yapın. Kıstırmaya tepki olarak sarsıntı veya hareket gözlenirse, fareyi 1 dakika daha indüksiyon odasının içine yerleştirin ve ayak parmağı kıstırma testini tekrarlayın. Sıçanın tamamen uyuşturulduğundan ve uyuşturulduğundan emin olmak için gerektiği kadar tekrarlayın.
- Sabitleme plakasına bir ısıtma yastığı ve steril emici ped yerleştirin. Fareyi emici ped üzerine yerleştirin, göz merhemi uygulayın ve vücut ısısını izlemek için rektal bir termometre yerleştirin.
NOT: Cerrahi işlemin uzunluğu boyunca, sıçanın sıcaklığı ve kalp atış hızı izlenmelidir (ideal olarak, kalp atış hızı 330-480 bpm arasında ve sıcaklık 35.9-37.5 °C arasında olmalıdır)18,19. Erken ölümü önlemek için izofluran veya ısıtma yastığını buna göre ayarlayın. Isıtma yastığı yaklaşık 37 °C sıcaklığa ayarlanabilir ve optimum vücut sıcaklığını korumak için gerektiğinde açılıp kapatılmalıdır. - 13. torasik vertebrada (T13) omurgaya bağlı olan sıçanın son kaburgasını palpe edin. Son kaburga ile boyun arasındaki sırt yüzeyindeki kürkü tıraş etmek için elektrikli bir tıraş bıçağı kullanın. Açıkta kalan cildi% 10 iyodopovidon içine batırılmış gazlı bezle silin.
- İris makası kullanarak bir orta hat kesisi oluşturun ve dikenli süreçler ve lamina ortaya çıkana kadar fasya boyunca diseksiyon yapın. Omurilik20 açığa çıkana kadar ofset kemik penseleri ve açılı bıçaklı iris makası ile kemiği çıkarın. Laminektomi ve insizyon uzunluğu, sonikleştirilecek farklı hedeflerin sayısına göre değişir. Bu çalışmada 3 cm'lik bir kesi kullanılarak üç seviyeli laminektomi uygulandı.
NOT: Yaralanmayı önlemek için kemiği çıkarırken omuriliğe dokunmaktan veya baskı uygulamaktan kaçının. Laminektomi sırasında sıçanın arka ayakları sarsılırsa, kord veya sinir kökleri üzerinde çok fazla kuvvet kullanılmıştır. - Laminektomiye bitişik dikenli işlemleri sıkıştırarak sıçanı sabitleme plakasına sabitleyin. Kelepçeleri kilitlemeden önce eğriliği en aza indirmek için omurgayı hafifçe gergin bir şekilde çekin.
3. Lazer kılavuzluğunu kullanarak hedef lokalizasyonu
- Transdüserin pozisyonunu, laminektominin tam üzerine yerleşene kadar stereotaktik kolla ayarlayın (Şekil 3A). Çerçeve, x, y ve z eksenlerinde hareketin yanı sıra dikey düzlemde 180° ve yatay düzlemde 360° dönüşe izin verir.
- Lazer aparatını su konisinin altına takın ve lazer noktası görünene kadar indirin. Lazer noktası, BSCB bozulması için hedef olan konumun üzerine gelene kadar dönüştürücünün yanal konumunu ayarlayın (Şekil 3B,C).
NOT: Lazer aparatı için bir bilgisayar destekli tasarım (CAD) dosyası ek bölümde yer almaktadır (Ek Şekil 1). - Lazer aparatını çıkarın ve koni ile omurilik arasındaki boşluğu gazı alınmış ultrason jeli ile doldurun (Şekil 3D). Maksimum bağlantı için, jelde hava kabarcığı bulunmadığından emin olun.
NOT: Bu çalışmada, yapıştırılmış bir su konisi olan dönüştürücü, kablonun 1 cm yukarısına yerleştirilene kadar indirilmiştir. Su konisi 30 mm uzunluğunda olduğundan, dönüştürücüden kabloya olan toplam mesafe 40 mm idi. Su konisi omurilikten 1 cm uzağa yerleştirildi, çünkü sıçanın derisi, fasyası ve insizyonun her iki tarafındaki kas sistemi koninin ucu ile kordon arasında doğrudan teması engelliyor. Stereotaktik kolun y eksenindeki sayıları kullanmak, koninin kordondan 1 cm uzakta olduğu dikey mesafeyi takip etmede yardımcı olabilir, çünkü özellikle jel, koninin kordondan uzaklığının görsel olarak doğrulanmasını zorlaştıracaktır. - TPO'da sonikasyon için parametreleri ayarlayın. Başarılı bir BSCB kesintisi elde etmek için bir dizi değer kullanılabilir. Maksimum güç için, sonikasyon frekansını dönüştürücünün merkez frekansına yakın ayarlayın. Bu çalışmada kullanılan değerler Tablo 1'de listelenmiştir.
NOT: Burada listelenen parametreler, bir kemirgen omuriliğini güvenli bir şekilde nöromodüle etmek için 500 kHz merkez frekansı, 500 μs ton patlaması süresi,% 50 görev döngüsü ve 5 veya 10 dakikalık sonikasyon süreleri ile LIFU ile yapılan önceki çalışmalardan uyarlanmıştır21. BSCB bozulmasını başarıyla sağlayan çalışmalara dayanarak, kullanılabilecek diğer parametreler 500 kHz-1 MHz arasındaki merkezi frekanslar, 0.2-2.1 MPa basınçlar, 10-25 ms patlama uzunlukları ve 2-5 dakikalık sonikasyon süreleridir 6,10,11,22.
| Parametre | Değer |
| Frekans (kHz) | 250 |
| Odak Mesafesi (mm) | 40 |
| Akustik Tepe Basıncı (MPa) | 0.47 |
| Görev Döngüsü | 40% |
| Seri Çekim Uzunluğu (ms) | 400 |
| Periyot(lar) | 1 |
| Sonikasyon Süresi (dk) | 5 |
Tablo 1: BSCB bozulması için kullanılan sonikasyon parametreleri.
4. Mikro kabarcık yönetimi
- Üretici tarafından sağlanan talimatlara uygun olarak bir MB çözümü hazırlayın. Çözeltiye hava girmesinden kaçının.
NOT: MB'ler kırılgandır ve birkaç dakika hareketsiz bırakılırsa flakonun/şırınganın üst kısmına yakın bir yerde toplanır. MB'lerin eşit olmayan dağılımını önlemek için şişeyi ve şırıngayı düzenli olarak sallayın. MB'lerin ömürleri kısadır; Son kullanma süresini belirlemek için üreticinin kılavuzuna bakın. - 22 G'lik bir kuyruk ven kateteri yerleştirin ve 0.2 mL heparinize salin (500 IU / mL) ile yıkayın23. Başarılı kuyruk damarı kateterizasyonu şansını artırmak için kuyruğu ılık suya batırın ve damarın çapını büyütmek için kuyruğun tabanına bir turnike yerleştirin.
NOT: Kuyruk ven kateterizasyonu, çalışma süresinden tasarruf etmek için hayvan laminektomisi, konumlandırma ve hedeflemeden önce yapılabilir. - Katetere 1 mL/kg %3 EBD enjekte edin. 0.2 mL heparinize salin ile yıkayın. Sıçanın ekstremiteleri ve gözleri maviye döner. Sıçanın dorsal spinal veninde mavi renk değişikliğini kontrol ederek başarılı kuyruk veni kateterizasyonunu onaylayın (Şekil 4).
NOT: EBD, MB enjeksiyonundan önce iyi enjekte edilebilir ve sonikasyonu etkilemez. Buna ek olarak, Gıda ve İlaç İdaresi (FDA) şu anda sistemde bulunan ilaçlarla sonikasyonu onaylamadığından, EBD de sonikasyondan sonra uygulanabilir. Bu, daha az boya alımına neden olur, ancak klinik olarak daha anlamlı olabilir. - Katetere 0.2 mL MBs bolus enjekte edin ve 0.2 mL heparinize salin ile yıkayın. MB'lerin enjeksiyonundan 1-2 dakika sonra sonikasyonu başlatın. Burada kullanılan kurulum gerçek zamanlı sonikasyon geri bildirimi toplamaz.
NOT: BSCB bozulması için yapılan çalışmalar tipik olarak tanısal görüntüleme için belirtilenden daha yüksek bir MB konsantrasyonu kullanır. Sıçan modellerinde BBB ve BSCB bozulması için kullanılan yaygın MB markalarının bazı konsantrasyonları arasında 0.02-0.2 mL/kg ve 200 μL boluslarbulunur 10,15,24,25.
5. Omurilik ekstraksiyonu ve doku işleme
- Sonikasyonun tamamlanmasından sonra, kan tamamen temizlenene kadar sıçanı 100 mL soğuk fosfat tamponlu salin (PBS) ile transkardiyal olarak perfüze edin. Boya nedeniyle zengin bir mavi renk olan karaciğer, açık kahverengimsi mavi bir renge dönüşmelidir26.
NOT: Perfüzyonun amacı, omuriliğin damar sisteminden fazla kanın alınmasıdır. EBD albümine bağlandığından, bu aynı zamanda fazla EBD'yi de giderir. Bu, omurilikte görsel olarak veya floresan mikroskobu ile tespit edilen herhangi bir EBD'nin, boyanın spinal parankime ekstravazasyonundan kaynaklanmasını sağlar. - 100 mL soğuk% 4 paraformaldehit (PFA) ile transkardiyal perfüz. İyice yapılırsa farenin uzuvları bu sabitleme sırasında seğirir. PFA ile yapılan bu perfüzyon, sıçanı ötenazi yapar.
- Omuriliği çıkarın ve gece boyunca 4 °C'de %4 PFA'ya yerleştirin. Ertesi gün PFA'yı PBS ile değiştirin.
6. BSCB kesintisinin görselleştirilmesi
- Bir tıraş bıçağı kullanarak sonikasyon yerini çevreleyen 2 cm'lik bir bölümü izole edin. Kesiti bıçakla orta hattan aşağı doğru bölün ve bir mikrotom kullanarak 10 μm kalınlığında bölümlere ayırın. Parlak alan görselleştirmesi için hematoksilen-eozin (H&E) boyası ile boyayın.
NOT: Bu çalışmada gösterilen H&E omurilik örnekleri 3 dakika hematoksilen ve 1 dakika27 eozin ile boyandı. - Floresan mikroskobu için, omurilik bölümlerini içeren slaytları deparafinize edin ve montaj ortamında (0.5 μg/mL) çözünmüş 25 μL 4',6-diamidino-2-fenilindol (DAPI) ile karşı boyayın. 4 °C'de en az 10 dakika inkübe edin. Ağartmayı önlemek için ışıktan kaçının.
NOT: Deparafinizasyon, donmuş kesitler elde etmek için bir kriyostat kullanılarak değiştirilebilir. - Tüm slaytları görüntülemek için bir floresan mikroskop kullanın. EBD otofloresansı (uyarma: 470 nm ve 540 nm; emisyon: 680 nm) kırmızı kanalda görünürken, DAPI mavi kanalda bulunur. H&E slaytlarını görüntülemek için bir ışık mikroskobu kullanın.
NOT: Bu protokol hayatta kalmayan bir prosedürü tanımlasa da, hayatta kalma cerrahi teknikleri kullanılarak da gerçekleştirildi. Hayatta kalma ameliyatı için, insizyondan önce cildi 3 alternatif iyodopovidon uygulamasıyla dezenfekte edin ve ameliyattan önce deri altına (0.05 mg / kg) buprenorfin uygulayın. Ameliyattan en az 3 gün sonra her 12 saatte bir deri altı buprenorfin vermeye devam edin, sıçan ağrı belirtileri gösteriyorsa ek günler ekleyin. Omurilik yaralanması meydana gelirse, sıçanlar idrar retansiyonu veya anormal yürüyüş sergileyebilir. Bu, arka bacakların veya aşikar, şişmiş mesanelerin sürüklenmesi veya gecikmiş hareketi olarak ortaya çıkacaktır. Bu meydana gelirse, yiyecek ve hidrasyon için besinsel olarak güçlendirilmiş su jeli olan ev fareleri ve refleks işeme iyileşene kadar mesaneleri günde iki kez manuel olarak ifade eder. Arka bacaklarda tam felç veya inatçı ağrı varsa, sıçanı ötenazi yapın.
Sonuçlar
Bu makale, LIFU sonikasyon ve MB uygulamasının eşzamanlı uygulamasının lokalize BSCB bozulması için etkili bir teknik olduğunu göstermektedir. BSCB'nin açılması, spinal parankimde EBD ekstravazasyonunun varlığı ile gösterilir. Değişiklikler hem görsel olarak hem de floresan mikroskobu altında belirgindir. Spinal kord damar sistemi laminektomi sonrası görülebilir ve posterior spinal veni laterale yayılan çok sayıda küçük damarla gösterir (Şekil 4A). EBD'nin kuyruk ven kateterinden intravenöz enjeksiyonu, bu damar sisteminin mavi boya ile zenginleştirilmesine neden olur (Şekil 4B). Bu, laminektominin herhangi bir spinal vaskülatür yırtılmasına neden olmadığını doğrulamak için prosedürde iyi bir noktadır, çünkü bu, kordon üzerinde mavi kan birikmesine neden olur. Sonikasyondan sonra, BSCB bozulması nedeniyle EBD'nin beyaz parankime ekstravazasyonunu gösteren hedeflenen konum üzerinde mavi bir nokta görünür hale gelmelidir (Şekil 4C). Bu noktanın boyutu, dönüştürücünün odak bölgesinin boyutu ve sonikasyondan sonraki süre dahil olmak üzere bir dizi faktöre bağlı olarak değişir. EBD ekstravazasyonunu görme şansını artırmak için, sonikasyon ve omurilik ekstraksiyonu arasındaki süreyi uzatmak gerekir.
PFA perfüzyonu, kordon ekstraksiyonu ve müteakip doku analizinden önce gerçekleştirilmesi gereken bir adım olmasa da, numuneden kanı uzaklaştırır ve beyaz spinal parankim ile mavi EBD boyalı bölgeler arasındaki kontrastı arttırır. MB uygulaması ve LIFU sonikasyonu alan tüm sıçanlar, EBD'nin omuriliğe belirgin ekstravazasyonunu gösterirken, LIFU sonikasyonu olmadan MB'leri ve EBD'yi alan negatif kontroller yoktur. Temsili resimler Şekil 5'te gösterilmektedir. Dokulardan geçen sagital kesikler, EBD ekstravazasyonunun sadece yüzeysel olmadığını, aynı zamanda kordun içine de uzandığını ortaya koymaktadır. Bu çalışmada kullanılan dönüştürücünün odak bölgesi, sıçan omuriliğinin çapından daha büyük olduğu için bu beklenen bir durumdur. Bazen sagital kesilerde az miktarda kanama görülebilir. Bunun nedeni laminektomi veya ultrason sonikasyonu olabilir. Kanama kordun dorsal çevresine yakınsa, laminektomiye bağlı olma olasılığı daha yüksektir.
EBD ekstravazasyonunu daha fazla değerlendirmek için sagital omurilik kesitleri DAPI (nükleer belirteç) ile boyandı ve floresan mikroskop kullanılarak görüntülendi. LIFU sonikasyonu (n = 3) alan tüm kordonlar, her ikisinde de DAPI'nin benzer yoğunlukları ile sonikasyon almayan kablolardan önemli ölçüde daha yüksek bir EBD otofloresan yoğunluğu (p = 0.016) gösterdi (Şekil 6). H & E analizi ayrıca, bu prosedürün güvenliğini destekleyen, sonikasyonlu yerlerde nöronal hasar, kanama veya boşluk lezyonları bulunmadığını ortaya çıkardı. Cerrahi yanlış kullanım ve yüksek güçlü bir sonikasyon nedeniyle yaralı kordon örnekleri bir karşılaştırma olarak gösterilmiştir. Kanama, doku hasarı, kavite lezyonları ve olası vakuolizasyon etiketlenir. Yüksek güçlü sonikasyon örneği kanama göstermese de, bu aynı zamanda ultrason bozulmasının bir etkisi olarak da bildirilmiştir.
Ayrıca, MB, EBD ve LIFU sonikasyonu alan sıçanlar üzerinde davranış analizi yapıldı. Bu yöntem doku hasarını tamamen dışlamasa da, bu prosedür nedeniyle motor defisitlerin oluşup oluşmadığını test eder. Sıçanlar 5 günlük bir süre boyunca her gün 5 dakika boyunca bir kafeste yürürken kaydedildi ve lokomotor fonksiyon Basso Beattie Bresnahan lokomotor ölçeğine göre derecelendirildi (Ek Video Dosyası 1). Tüm sıçanlar (n = 5) sonikasyondan önce, sonikasyon sonrası ve hayatta kalma süresinin her günü en yüksek puanı aldı (Şekil 7).
Son olarak, bu çalışmada kullanılan sonikasyon parametrelerinin termal etkileri, iki ex vivo sıçan omurilik örneği ve kordona yerleştirilmiş ince uçlu bir dijital termometre probu kullanılarak ölçüldü. Omurilik örneklerinin sıcaklığı, sonikasyon öncesinde, sırasında ve sonrasında toplam 15 dakika boyunca 5 dakika boyunca izlendi. Sıcaklıkta minimum değişiklikler görüldü. Aslında, her iki örnekte de sonikasyona bağlı ≤1.3 °C değişiklik vardı ve sonikasyon sonucu hipertermik yaralanma olasılığını azalttı (Şekil 8).
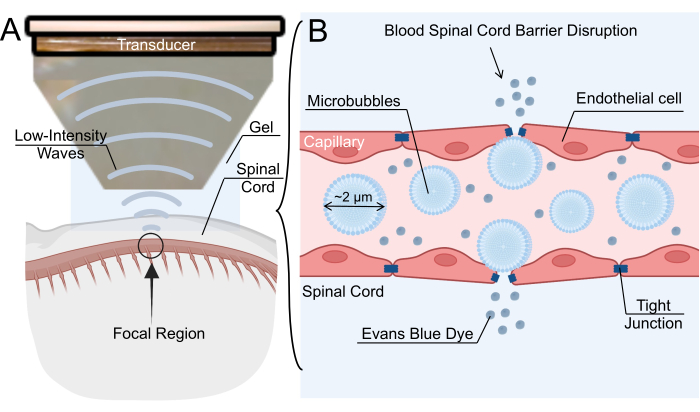
Şekil 1: Düşük yoğunluklu odaklanmış ultrason aracılı kan-omurilik bariyeri açma mekanizması. (A) Sıçan omuriliğinin düşük yoğunluklu odaklanmış ultrason (LIFU) sonikasyonuna şematik genel bakış. (B) İntravenöz mikro kabarcıkların (MB'ler) LIFU sonikasyonu yoluyla kan-omurilik bariyeri (BSCB) açma mekanizması. MB'ler LIFU'ya yanıt olarak salınır ve endotel hücreleri arasındaki sıkı bağlantıların genişlemesine neden olur. BSCB'nin bu bozulması, nanopartiküllerin, terapötik ilaçların veya Evans mavi boyasının ekstravazasyonuna izin verir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Düşük yoğunluklu odaklanmış ultrason tezgah üstü kurulumu ve bağlantısı. (A) Tipik odaklanmış ultrason bileşenlerini gösteren şematik gösterim. (B) Aşağıdakiler dahil olmak üzere odaklanmış ultrason kurulumunun genel bakış resmi: 1. dönüştürücü güç çıkışı (TPO), 2. eşleşen ağ, 3. LIFU dönüştürücü, 4. Stereotaksik alet, 5. mobil kelepçeler. (C) Dönüştürücü, aşağıdakileri içerir: 1. prob tutucu, 2. halka dönüştürücü, 3. su konisi, 4. su giriş borusu, 5. su çıkış borusu, 6. lastik bantla sabitlenmiş membran. (D) TPO'nun ön tarafı, aşağıdakileri içerir: 1. RF korumalı muhafaza, 2. ayarlanabilir menüye sahip dokunmaya duyarlı ön ekran paneli, 3. parametre ayarı için döner düğme, 4. Başlat / durdur çıkış anahtarı. (E) TPO'nun arkası, şunları içerir: 1. kanal çıkış konektörleri, 2. toprak, 3. Yazılım kontrolü için USB giriş bağlantı noktası, 4. dahili tetik, 5. senkronizasyon çıkış konektörü, 6. güç giriş jakı ve beslemesi, 7. Açma/kapama güç anahtarı. (F) Kanal numaralarıyla eşleşen kablolarla eşleşen ağ çıkışı. (G) Kanal numaralarıyla eşleşen kablolarla eşleşen ağ XDR girişi Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
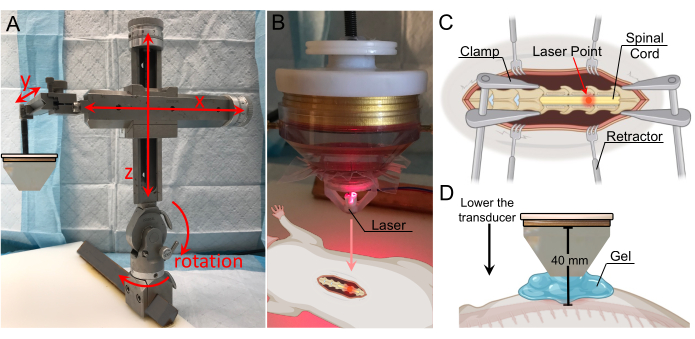
Şekil 3: Lazer kılavuzluğu ile hedef lokalizasyonu . (A) Her üç eksende de hareket açıklığına ve dönme özelliklerine sahip stereotaktik kol. Aşağıdaki sabitleme plakasına yapıştırılmıştır. (B) Odak bölgesinin tanımlanması için lazer cihazı. Lazer, dönüştürücünün ucuna yerleştirilir ve odak bölgesi ile aynı hizadadır. (C) Lazeri açıkta kalan omurilik üzerinde gösteren, dönüştürücünün odak bölgesinin şimdi bu konuma yönlendirildiğini gösteren resim. (D) Dönüştürücü, koninin ucu kablonun 1 cm yukarısına yerleştirilene kadar indirilir ve maksimum bağlantı sağlamak için boşluk jel ile doldurulur. Dönüştürücüden omuriliğe olan mesafe 40 mm'dir (odak mesafesi). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
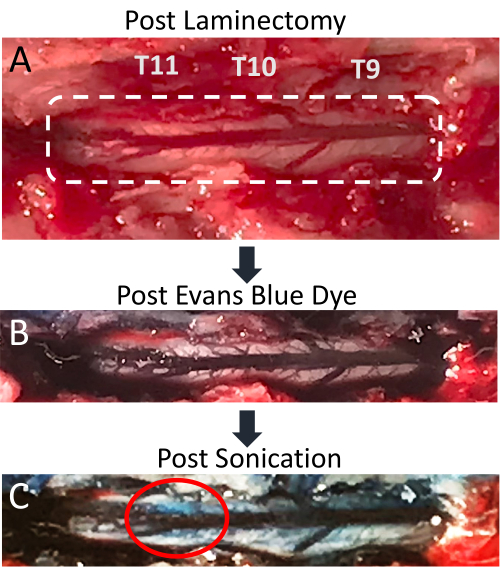
Şekil 4: Sonikasyon sonrası omurilikte Evans mavi boya ekstravazasyonu . (A) T9-T11 sıçan laminektomi insizyonunun resmi, açıkta kalan omurilik ve posterior dorsal ven açıkça görülebilir. (B) Çevreleyen doku ve omurilik damar sistemi, intravenöz Evans mavi boya (EBD) enjeksiyonundan sonra maviye döner. (C) Sonikasyon bölgesinde omurilik parankimine EBD ekstravazasyonu, BSCB bozulmasının meydana geldiğini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Omurilik ekstraksiyonu ve perfüzyon sonrası BSCB açıklığının görselleştirilmesi. (A) LIFU tedavisi olmadan kontrol sıçanından eksize edilen omurilik. Bu sıçan sadece MB ve EBD aldı. Parafine gömülü kordonun orta sagital kesiti ekte gösterilmiştir ve EBD ekstravazasyonu görülmemektedir. (B) LIFU tedavisi ile sıçandan eksize edilen omurilik. Bu sıçan ayrıca MB'ler ve EBD aldı. EBD ekstravazasyon sütunu görülebilir ve sonikasyonlu bölgeye lokalizedir. Parafine gömülü kordonun orta sagital dilimi, sonikasyonlu konumun içinde görünen EBD konsantrasyonuna işaret eden bir okla iç kısımda gösterilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
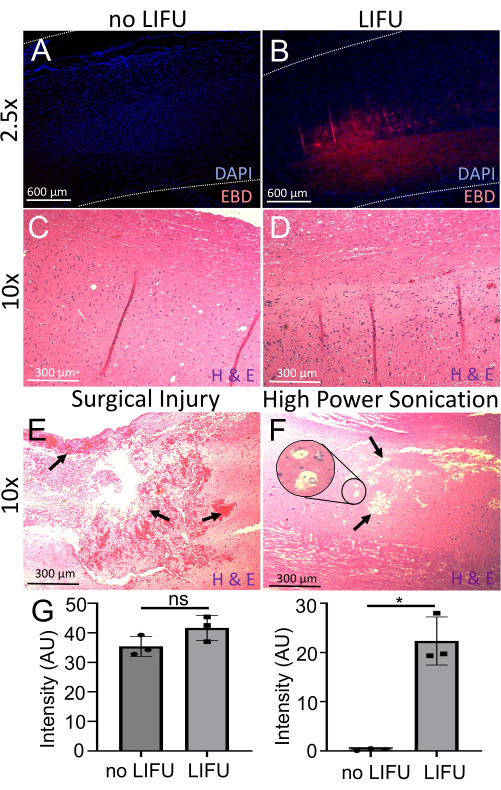
Şekil 6: BSCB açıklığının tespiti ve değerlendirilmesi. (A) DAPI ile boyanmış omurilik (nükleer işaretleyici, mavi). Minimal EBD otofloresan (kırmızı) görülebilir. Bu sıçan LIFU almadı. (B) DAPI ile boyanmış omurilik (nükleer işaretleyici, mavi). Sonikasyonlu hedef konumda lokalize EBD otofloresan (kırmızı) görülebilir. Bu sıçan LIFU ve MB'leri aldı. (C) LIFU olmayan bir sıçanın omuriliği hematoksilen (nükleik asit boyası) ve eozin (spesifik olmayan protein boyası) (H &E) ile boyandı. Nöronal hasar, kanama veya kavite lezyonları görülmez. (D) LIFU'lu bir sıçanın omuriliği H & E ile boyanmıştır. Hiçbir nöronal hasar, kanama veya boşluk lezyonu görülmez. (E) Cerrahi yaralanması olan bir sıçanın omuriliği H & E ile boyanmıştır. Oklar bol miktarda kanama ve doku hasarına işaret ediyor. (F) H & E ile boyanmış yüksek güçlü sonikasyon nedeniyle hasar görmüş bir sıçanın omuriliği. Oklar boşluk lezyonlarına işaret eder ve iç kısım olası vakuolizasyonu gösterir. (G) LIFU sonikasyonu olan ve olmayan sıçanların omuriliklerinde DAPI ve EBD'nin yoğunluğunu gösteren çubuk grafikler. Benzer DAPI yoğunluğuna rağmen (p > 0.05) negatif kontrole kıyasla LIFU omuriliğinde anlamlı olarak daha fazla EBD yoğunluğu vardır (p = 0.016). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
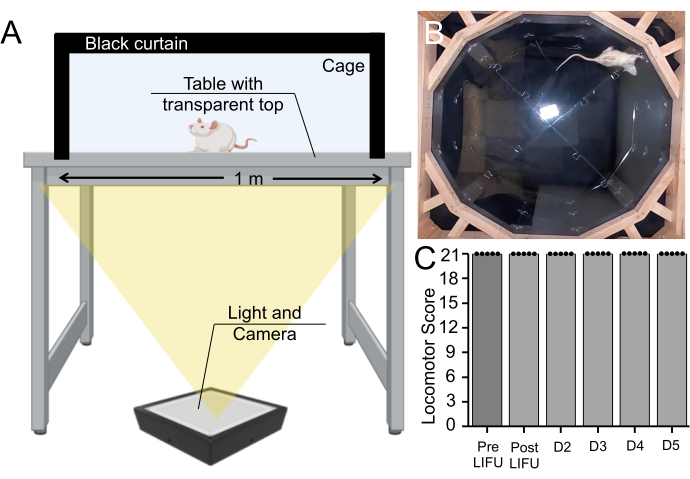
Şekil 7: Sonikasyon öncesi ve sonrası davranışsal tahlil. (A) Basso, Beattie, Bresnahan aygıtı kurulumu, sıçanların aşağıdan 5 dakika boyunca yürüdüğü kaydedildi. (B) Kaydedilmiş bir videodan hareketsiz görüntü. Bu video, farenin motor koordinasyonunu ve yürüyüşünü Basso, Beattie, Bresnahan ölçeğinde derecelendirmek için kullanıldı. (C) MBs ve LIFU tedavisi alan sıçanlarda sonikasyon öncesi, sonikasyon sonrası veya 5 günlük sağkalım süresi boyunca motor skorlarında hiçbir değişiklik göstermeyen boxplot (n = 5) (p > 0.05). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8: Ex vivo omurilikler kullanılarak sıcaklık analizi. Sonikasyon öncesi, sırası ve sonrası 5 dakikalık bir süre boyunca iki ex vivo omurilik örneğindeki sıcaklık değişikliklerini gösteren grafik. Sonikasyon için kullanılan parametreler Tablo 1'de listelenmiştir. Örnek 1 için, sonikasyon öncesi, sırası ve sonrası ortalama sıcaklıklar sırasıyla 21.9 °C ± 0.1 °C, 22.1 °C ± 0.1 °C ve 22.0 °C ± 0.1 °C idi. Örnek 2 için, sonikasyon öncesi, sırası ve sonrası sıcaklıklar sırasıyla 21.9 °C ± 0.1 °C, 22.5 °C ± 0.3 °C ve 22.4 °C ± 0.2 °C idi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Lazer hedefleme aparatının CAD dosyası. (A) Lazer cihazının aşağıdan görünümü. Ortadaki merkezi deliğin içine herhangi bir lazer yerleştirilebilir. (B) Lazer aparatının yandan görünümü. (C) Lazer aparatının boyutları, inç cinsinden birimlerle. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Video Dosyası 1: Basso, Beattie, Bresnahan aygıtında yürüyen bir farenin videosu. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada, mikrokabarcık (MB) uygulaması ile birlikte düşük yoğunluklu odaklanmış ultrason (LIFU) kullanılarak etkili ve hedefe yönelik BSCB bozulması için gerekli ekipman ve adımlar açıklanmaktadır. Bu protokol esnektir ve farklı özelliklere sahip dönüştürücülerle bireysel kullanım için optimize edilebilir. LIFU aracılı BSCB bozulması için diğer teknikler, pahalı bir kaynak olan hedef lokalizasyonu için manyetik rezonans görüntüleme (MRI) kılavuzlu sistemlerin kullanımına dayanır16. Burada sunulan tekniğin avantajları, BSCB bozulmasının hızlı ve gerçek zamanlı görsel olarak doğrulanmasında ve prosedürün açık doğası nedeniyle hedefleme kolaylığında yatmaktadır. Ayrıca, lazer aparatının kullanımı ve yapımı kolaydır ve ek bölüme bir CAD dosyası dahildir. Sonuç olarak, küçük bir hayvan modelinde LIFU dönüştürücülerinin hedefleme yetenekleri üzerinde ilk testler yapmak isteyen araştırmacılar, bu protokolü, ilgilenilen bir yer üzerinde odak bölgesi konumunu hızlı bir şekilde doğrulamak için bir araç olarak kullanabilirler. Bu teknik, ABD veya MR sistemleri gibi daha karmaşık rehberlik yöntemlerine yatırım yapmadan önce, ilaç dağıtımı gibi LIFU'nun klinik uygulamalarını incelemeye başlayan laboratuvarlar tarafından da kullanılabilir. Günümüzde, US kılavuzluğundaki modaliteler, MR sistemlerine kıyasla daha umut verici ve uygun maliyetli bir yol sunmakla birlikte, ikincisi literatürde daha sık görülmektedir.
Bu prosedürde, başarılı bir BSCB kesintisi sağlamak için dikkatli bir şekilde yürütülmesi gereken birkaç kritik adım vardır. Cerrahi laminektomi sırasında omuriliğe gereksiz baskı uygulamaktan kaçınmak zorunludur. Kablonun çok fazla fiziksel manipülasyonu, BSCB'nin hasar görme olasılığını artırır. Hasar, kanama ve artmış EBD ekstravazasyonu nedeniyle ekstraksiyondan sonra kordonun içinde koyu kahverengi bir nokta olarak ortaya çıkar. Ayrıca, transdüser ile açıkta kalan omurilik arasında maksimum bağlantı sağlanmalıdır. Sonuç olarak, su konisi ve ultrason jelindeki kabarcıkların çıkarılmasına özen gösterilmelidir. Akustik dalganın tam iletimini sağlamak için su konisinin tabanı ile kordon arasında boşluk olmamalıdır. Kuyruk ven kateterizasyonu sırasında, heparinize salin, EBD veya MB solüsyonları ile birlikte yanlışlıkla hava geçirmekten kaçınılmalıdır. Hava enjeksiyonu, prosedürün tamamlanmasından önce kemirgen ölümüyle sonuçlanan pulmoner emboli olasılığını büyük ölçüde artırır28.
Bu prosedür sırasında karşılaşılabilecek yaygın bir sorun, başarılı EBD enjeksiyonunun başarısız olmasıdır. Kuyruk ven kateterizasyonunda minimum deneyime sahip kişiler için, bu adımı hayvan laminektomisi, konumlandırma veya hedeflemeden önce gerçekleştirmek zaman kazandıracaktır. EBD, sonikasyonu etkilemeden MB enjeksiyonundan önce de enjekte edilebilir. Bu protokolde önerilen turnike ve ılık su banyosundan faydalanmak kuyruk damarlarının genişlemesine ve başarı oranının artmasına yardımcı olacaktır. Ayrıca, sıçan dehidrasyonu, doğru kateter yerleştirme olasılığını azaltır. Kuyruk ven kateterizasyonundan 10-15 dakika önce intraperitoneal salin enjeksiyonu yardımcı olabilir. Kateterizasyon sırasında, kuyruğun ucunun 2 yukarısından başlamalı ve kaudalden kraniyal yöne doğru hareket edilmelidir. Ters yönde hareket etmek, potansiyel damar çökmesi veya kanama nedeniyle başarı olasılığını azaltır.
Diğer bir yaygın zorluk, sonikasyona rağmen EBD ekstravazasyonunun olmamasını içerir. Bu, sonikasyon için kullanılan parametrelerin BSCB bozulması için yetersiz olduğunu gösterebilir. Örneğin, sonikasyon frekansı, dönüştürücünün merkezi frekansından büyük ölçüde farklı bir değere ayarlanırsa, sonikasyon gücü MB'leri salmak için çok düşük olacak ve sıkı bağlantı gevşemesine neden olacaktır. Ayrıca, dönüştürücü ve kordon arasında ne kadar çok arayüz olursa (örneğin, su konisi, membran, jel, su / jeldeki hava kabarcıkları), gerçek sonikasyon yoğunluğu hedefte o kadar düşük olacaktır. Gazdan arındırılmış jel kullanmak ve koni içindeki kabarcıkları iyice çıkarmak gibi bu arayüzleri en aza indirmek, sonikasyonun tam potansiyelini iletmeye yardımcı olacaktır. Protokol ayrıca, spinal parankimde EBD ekstravazasyonu için daha fazla zaman tanımak için sonikasyon ve perfüzyon arasındaki sürenin arttırılmasını teşvik eder. BSCB bozulması geçici bir prosedür olmasına rağmen, boşluklar kapanmadan önce birkaç saat boyunca mevcuttur. Uzun bir bekleme süresi izofluran maruziyetini arttırır, ancak aynı zamanda kordonda daha fazla EBD ekstravazasyonuna neden olur. Alternatif olarak, LIFU ile sonikasyon olmamasına rağmen EBD ekstravazasyonu mevcut olabilir. Bu sorunu gidermek için, BSCB'nin kazara hasar görmesini önlemek için laminektomi sırasında dikkatli olunmalıdır. Potansiyel çözümler, laminalar ve kord arasındaki boşluk miktarını artırmak için klempleme sırasında sıçan omurgasının kaldırılmasını ve daha kısa bir laminektomiyi içerir. Kapsamlı bir PFA perfüzyonu, EBD ile zenginleştirilmiş kanı omurilik içindeki damar sisteminden çıkararak arka plan lekelenmesini de azaltır. Transkardiyal perfüzyon sırasında, PBS veya PFA sızıntısına neden olabilecek kalbin kazara yırtılmasını önlemek için özen gösterilmelidir.
Bu çalışmanın, LIFU aracılı BSCB bozulması için tek bir merkez deneyimini temsil ettiğini belirtmek önemlidir. Ayrıca, bu protokol çeşitli sonikasyon enerji parametrelerini ve MB konsantrasyonlarını test etmez veya optimize etmez. Sonuç olarak, araştırmacılar, özellikle ilk sonuçlar herhangi bir olumsuz etki yaratıyorsa, belirli araştırma ihtiyaçları için hedef lokalizasyonunu ve BSCB bozulmasını optimize etmek için bu tekniği uygularken çeşitli parametreleri ve konsantrasyonları araştırmaya teşvik edilir. Örneğin, sıcaklık değişikliği görmek istemeyen gruplar, bu kriteri karşılayan ve yeterli BSCB bozulması elde eden bir set bulana kadar çeşitli parametreleri test edebilirler. Ayrıca, bu tekniğin güvenliğini doğrulamak için ek deneyler yapılabilir. Örneğin, örneklem büyüklükleri arttırılabilir, sağkalım süresi uzatılabilir ve elektromiyografi/yürüme analizi çalışmaları yapılabilir. Daha uzun sağkalımlar için, bazı çalışmaların yüksek dozda EBD'nin bazen kronik sistemik toksisiteye neden olabileceğini gösterdiğini, bu nedenle daha düşük bir dozun ihtiyatlı olabileceğini akılda tutmak önemlidir29.
Bu prosedürün bir başka sınırlaması, laminektominin invaziv doğasıdır (ultrason kemiğe nüfuz edemediğinden, BSCB açılması için LIFU kullanan herhangi bir teknik için gereklidir). Bu prosedürün invaziv doğası, laminektominin uzunluğu sınırlandırılarak azaltılabilir. Laminektominin daha kısa ve ince olan üst torasik omurlarda yapılması, laminektomi için gereken süreyi 10 dakikanın altına indirebilir. MB'lerin kırılgan doğası ve kısa yarı ömürleri nedeniyle, bu protokol sırasında zaman sınırlıdır. MB'lerin enjeksiyonu, LIFU ile tedaviden 1-2 dakika önce gerçekleşmeli ve birden fazla LIFU tedavisi gerçekleştiriliyorsa, her sonikasyondan önce yeni MB'ler uygulanmalıdır. Birden fazla sıçan için BSCB bozulmasını içeren deneyler için, birkaç MB şişesinin hazırlanması gerekebilir. Mikro kabarcıklar pahalı olduğundan, kullanılan MB sayısını korumak için sonikasyonlar arasındaki süreyi en aza indirmek için cerrahi iş akışını değiştirmek tercih edilir.
Burada açıklanan teknik, öncelikle bir araştırma protokolü olarak kullanım içindir. Lazer hedefleme aparatı, tüm klinik ortamlarda geleneksel hedefleme yöntemlerinin yerini almayacak olsa da, diğer durumlarda yararlı olabilir. Noninvaziv ameliyatlar için, geleneksel MRI modaliteleri30'u hedeflemek için güvenilir bir şekilde kullanılabilir. Laminektomi yapılmasını içeren invaziv ameliyatlar için, bu protokolde tarif edilen lazer noktası aparatı, belirli bir bölge üzerinde sonikasyonun odak bölgesinin merkezini hızlı bir şekilde lokalize etmek için kullanılabilir (örneğin, bir tümör veya omurilik yaralanması bölgesi) ilaç dağıtımı veya immünomodülatör tedavi amacıyla gerçekleşecek herhangi bir MR rehberliğini tamamlarken.
Genel olarak, bu protokol BSCB kesintisi için etkili ve başarılı bir tekniği tanımlar ve hem gerçek zamanlı hem de işlem sonrası BSCB açılışının onaylanması için çeşitli seçenekler içerir. BSCB'nin omurilik parankimine giriş için bir bariyer olarak işlev görmesiyle, BSCB'nin bozulması, terapötiklerin verilmesini iyileştirmek için olası bir yöntemdir. Örneğin, Weber-Adrian ve ark. servikal omurgaya gen iletimine aracılık etmek için 1.114 MHz frekans ve 10 ms patlama uzunluğu ile LIFU kullandı6. Benzer şekilde, Smith ve ark. 580 kHz frekanslı, ortalama akustik tepe basınçları 0.46 MPa civarında ve 10 ms'lik bir patlama uzunluğuna sahip LIFU'nun, leptomeningeal metastazların kemirgen modelinde bir monoklonal antikor olan trastuzumab'ın omuriliğe verilmesine yardımcı olabileceğini gösterdi10. Çoğu çalışma LIFU kullanımına odaklanmıştır, HIFU yerine, LIFU'nun alttaki dokuya zarar vermekten kaçınırken BSCB'yi geçici olarak geçirgen hale getirme kabiliyeti nedeniyle. Tipik olarak, LIFU 0.125-3 W/cm2 arasındaki yoğunlukları kullanırken, HIFU 100-10.000 W/cm2 veya daha yüksek yoğunlukları kullanır31. Sonuç olarak, HIFU etkilerini esas olarak dokuyu ısıtarak uygularken, LIFU, MB'lerin birlikte uygulanmasıyla mekanik kavitasyon etkileri yoluyla çalışır. Terapötiklerin MB'lerle birlikte uygulanması, ilacın spinal parankime daha fazla ekstravazasyonuna ve ayrıca MB'leri ilaçla yükleme ve hedeflenen ilaç dağıtımı için MB'leri ultrason ile parçalama potansiyeline neden olabilir.
Bu çalışmada kullanılan sonikasyon parametreleri, MB konsantrasyonu ve dönüştürücü tipi deneysel ihtiyaçlara göre değiştirilebilir. Örneğin, lokalize hedefleme üzerinde daha fazla kontrolün gerekli olduğu deneyler için daha küçük odak bölgesine sahip bir dönüştürücü tercih edilebilirken, daha kısa sürede güçlü bozulma gerektiren deneyler için daha yüksek güce sahip bir dönüştürücü kullanılabilir. Bu protokolün sunduğu esneklik nedeniyle, klinik öncesi, klinik ve translasyonel araştırmalarda kullanım için büyük bir potansiyel vardır.
Açıklamalar
Yazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişkinin yokluğunda yürütüldüğünü beyan ederler. Amir Manbachi, BK Medical (GE Healthcare), Neurosonics Medical için ders veriyor ve danışmanlık yapıyor ve patent bekleyen bir dizi FUS teknolojisinin mucidi. Betty Tyler, NIH'den araştırma fonuna sahiptir ve Hızlandırılmış Kombinasyon Terapilerinin (öz sermaye veya opsiyonlar dahil) ortak sahibidir. Ashvattha Therapeutics Inc. ayrıca patentlerinden birini lisanslamıştır ve Peabody Pharmaceuticals'ın hissedarıdır. Nicholas Theodore, Globus Medical'den telif ücreti alır ve hisse sahibidir. Globus Medical'in danışmanıdır ve Globus Medical'in bilimsel danışma kurulunda/diğer ofisinde görev yapmıştır. Kalan yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
T32GM136577 (D.R.) tarafından desteklenmektedir; N660012024075 (N.T., N.V.T., A.M., K.K.L.); R01 HL139158-01A1 ve R01 HL071568-15 (N.V.T.); Johns Hopkins ICTR Klinik Araştırma Bursları Programı (KL2) (). BioRender.com ile oluşturulan birkaç figür.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.9% Heparinized Sodium Chloride | Baxter | FKB0953G | Flush tail vein catheter with heparinized saline to prevent clotting. |
| 100 mL Luer Lock Tip Syringe (2) | Wilburn Medical | WUSA/120 | One syringe can be used to inject PBS and one for PFA (during transcardial perfusion) |
| 1x Phosphate buffered saline (PBS) | Thermo Scientific | 10010001 | For transcardial perfusion. |
| 22 G catheter | Med Vet International | 50-209-1694 | Use to place a tail vein catheter. |
| 97% Isoflurane | Thermo Scientific Chemicals | 247-897-7 | While rat is under isoflurane, be careful not to administer too much. A high dose can euthanize the rat. |
| Betadine 7.5% | Purdue Products | 4677 | |
| Class A clear threaded glass vial | Fisherbrand | 14-955-314 | Use to store spinal cord extraction. |
| Digital balance scale | Kent Scientific | SCL-4000 | |
| Electric razor | Wahl Home Products | 79449-200 | Shave fur off skin at incision site before surgery |
| Eosin-Y with Phloxine | Epredia | 71304 | |
| Evans blue dye | MP Biomedicals | 02151108-CF | Although it is non-toxic, it will stain skin blue if direct contact occurs. |
| Fixation Plate Assembly with 0.5 mm Forceps | PSI Impactors | 7001-2 | Affix the stereotactic arm to this frame |
| Gauze | Fisherbrand | 13-761-52 | |
| Heating pad | Kent Scientific | RT-0515 | |
| Hematoxylin | Epredia | 7211 | |
| Iris Scissors with Angled Blades | ProDentUSA | 12-15315 | |
| Isoflurane induction system | Kent Scientific | SOMNO-RATKIT | |
| Laser targetting apparatus | NA | custom | CAD design file provided in supplemental section. Simply place a laser inside the apparatus created from the file. |
| Lubricating eye ointment | Systane | N/A | |
| Luer Lock 3-Way Stopcock | Sigma | SAS7521-10EA | Can use to fill water cone through inlet valve |
| Lumason microbubbles kit | Bracco | 0270-7099-16 | |
| Microscope cover glass | Fisherbrand | 12-545J | |
| Microscope slides | Fisherbrand | 12-550-15 | |
| Microtome | Epredia | 23-900-671 | |
| Mounting medium with 4',6-diamidino-2-phenylindole (DAPI) | Vector Laboratories | H-2000-2 | |
| Mylar membrane | Chemplex | 3016 | Can cut membrane to appropriate size if too large for cone |
| NeuroFUS 2.52" diameter 250 kHz transducer | Sonic Concepts | CTX-250 | Transducer system includes custom water cone and probe holder |
| NeuroFUS PRO v2.0 system | Sonic Concepts | NFS102v2 | Includes Transducer Power Output, Matching Network and associated cables |
| Offset Bone Nippers | Fine Science Tools | 16101-10 | Use to remove spinous processes and laminae for laminectomy |
| Paraffin | Polysciences | 24364-1 | Can place spinal cord sample in paraffin to slice into thin sections for histology. |
| Paraformaldehyde (4%) | Thermo Scientific | J61899-AK | For transcardial perfusion. |
| Rat Surgical Kit | Kent Scientific | INSRATKIT | Consists of tweezer #5, needle holder, McPherson-Vannas scissors, Iris scissors, ALM self-retaining retractors, Iris forceps, and blunt probe. These products should be sufficient to perform a laminectomy. |
| Razor blade | Fisherbrand | 12-640 | Use to cut spinal cord extraction to desirable length and split section down midline. |
| Rectal thermometer | Kent Scientific | RET-2 | Maintain rat temperature between 35.9–37.5 °C |
| Rubber band | Fisherbrand | 50-205-1983 | |
| Single animal vaporizer unit | Kent Scientific | SF-01 | |
| Stereotactic arm | Kopf Instruments | Model 963 | |
| Sterile absorbent pad | McKesson | 4033-CS150 | Place under rat and above heating pad and fixation plate before laminectomy |
| Ultrasound gel | Aquasonic | PLI 01-34 | Ensure gel is free of bubbles to the best of your ability. |
Referanslar
- Chopra, N., et al. Blood-spinal cord barrier: Its role in spinal disorders and emerging therapeutic strategies. NeuroSci. 3 (1), 1-27 (2021).
- Bartanusz, V., Jezova, D., Alajajian, B., Digicaylioglu, M. The blood-spinal cord barrier: morphology and clinical implications. Annals of Neurology. 70 (2), 194-206 (2011).
- Hersh, A. M., Alomari, S., Tyler, B. M. Crossing the blood-brain barrier: Advances in nanoparticle technology for drug delivery in neuro-oncology. International Journal of Molecular Sciences. 23 (8), 4153 (2022).
- Pan, W., Banks, W. A., Kastin, A. J. Permeability of the blood-brain and blood-spinal cord barriers to interferons. Journal of Neuroimmunology. 76 (1-2), 105-111 (1997).
- Bellettato, C. M., Scarpa, M. Possible strategies to cross the blood-brain barrier. Italian Journal of Pediatrics. 44, 131 (2018).
- Weber-Adrian, D., et al. Gene delivery to the spinal cord using MRI-guided focused ultrasound. Gene Therapy. 22 (7), 568-577 (2015).
- Hersh, A. M., et al. Applications of focused ultrasound for the treatment of glioblastoma: A new frontier. Cancers. 14 (19), 4920 (2022).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Cho, H., et al. Localized down-regulation of P-glycoprotein by focused ultrasound and microbubbles induced blood-brain barrier disruption in rat brain. Scientific Reports. 6, 31201 (2016).
- Smith, P., Ogrodnik, N., Satkunarajah, J., O'Reilly, M. A. Characterization of ultrasound-mediated delivery of trastuzumab to normal and pathologic spinal cord tissue. Scientific Reports. 11 (1), 4412 (2021).
- Montero, A. S., et al. Ultrasound-induced blood-spinal cord barrier opening in rabbits. Ultrasound in Medicine & Biology. 45 (9), 2417-2426 (2019).
- Fletcher, S. P., Choi, M., Ogrodnik, N., O'Reilly, M. A. A porcine model of transvertebral ultrasound and microbubble-mediated blood-spinal cord barrier opening. Theranostics. 10 (17), 7758-7774 (2020).
- Honeycutt, S. E., O'Brien, L. L. Injection of Evans blue dye to fluorescently label and image intact vasculature. BioTechniques. 70 (3), 181-185 (2021).
- Fletcher, S. P., Choi, M., Ramesh, R., O'Reilly, M. A. Focused ultrasound-induced blood-spinal cord barrier opening using short-burst phase-keying exposures in rats: A parameter study. Ultrasound in Medicine & Biology. 47 (7), 1747-1760 (2021).
- Cross, C. G., et al. Technical note: Quantification of blood-spinal cord barrier permeability after application of magnetic resonance-guided focused ultrasound in spinal cord injury. Medical Physics. 48 (8), 4395-4401 (2021).
- Hong, Y. R., et al. Ultrasound stimulation improves inflammatory resolution, neuroprotection, and functional recovery after spinal cord injury. Scientific Reports. 12 (1), 3636 (2021).
- Liao, Y. H., et al. Low-intensity focused ultrasound alleviates spasticity and increases expression of the neuronal K-Cl cotransporter in the L4-L5 sections of rats following spinal cord injury. Frontiers in Cellular Neuroscience. 16, 882127 (2022).
- Redfors, B., Shao, Y., Omerovic, E. Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Laboratory Animals. 48 (1), 6-14 (2014).
- Lillie, L. E., Temple, N. J., Florence, L. Z. Reference values for young normal Sprague-Dawley rats: weight gain, hematology and clinical chemistry. Human & Experimental Toxicology. 15 (8), 612-616 (1996).
- Lin, X. J., et al. Spinal cord lateral hemisection and asymmetric behavioral assessments in adult rats. Journal of Visualized Experiments. (157), e57126 (2020).
- Tsehay, Y., et al. Low-intensity pulsed ultrasound neuromodulation of a rodent's spinal cord suppresses motor evoked potentials. IEEE Transactions on Biomedical Engineering. , (2023).
- Payne, A. H., et al. Magnetic resonance imaging-guided focused ultrasound to increase localized blood-spinal cord barrier permeability. Neural Regeneration Research. 12 (12), 2045-2049 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. Journal of Visualized Experiments. (146), e59295 (2019).
- Sabbagh, A., et al. Opening of the blood-brain barrier using low-intensity pulsed ultrasound enhances responses to immunotherapy in preclinical glioma models. Clinical Cancer Research. 27 (15), 4325-4337 (2021).
- Dréan, A., et al. Temporary blood-brain barrier disruption by low intensity pulsed ultrasound increases carboplatin delivery and efficacy in preclinical models of glioblastoma. Journal of Neuro-Oncology. 144 (1), 33-41 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Yamamoto, H., Imai, S., Okuyama, T., Tsubura, Y. Pulmonary lesions in rats caused by intravenous injection. Acta Pathologica Japonica. 32 (5), 741-747 (1982).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Scientific Reports. 9 (1), 321 (2019).
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır