Method Article
Rottura della barriera emato-spinale utilizzando ultrasuoni focalizzati a bassa intensità in un modello di ratto
In questo articolo
Riepilogo
La rottura della barriera emato-spinale (BSCB) può essere ottenuta con successo con la somministrazione endovenosa di microbolle e l'applicazione di ultrasuoni focalizzati a bassa intensità (LIFU). Questo protocollo descrive in dettaglio l'apertura del BSCB utilizzando LIFU in un modello di roditore, inclusa la configurazione dell'apparecchiatura, l'iniezione di microbolle, la localizzazione del bersaglio e la visualizzazione dell'interruzione del BSCB.
Abstract
Gli ultrasuoni focalizzati a bassa intensità (LIFU) utilizzano pulsazioni ultrasoniche a intensità inferiori rispetto agli ultrasuoni e vengono testati come tecnologia neuromodulatoria reversibile e precisa. Sebbene l'apertura della barriera emato-encefalica (BBB) mediata da LIFU sia stata esplorata in dettaglio, ad oggi non è stata stabilita alcuna tecnica standardizzata per l'apertura della barriera emato-spinale (BSCB). Pertanto, questo protocollo presenta un metodo per l'interruzione di successo di BSCB utilizzando la sonicazione LIFU in un modello di ratto, comprese le descrizioni della preparazione animale, la somministrazione di microbolle, la selezione e la localizzazione del bersaglio, nonché la visualizzazione e la conferma dell'interruzione di BSCB. L'approccio qui riportato è particolarmente utile per i ricercatori che hanno bisogno di un metodo rapido ed economico per testare e confermare la localizzazione del bersaglio e la precisa interruzione del BSCB in un modello animale di piccola taglia con un trasduttore a ultrasuoni focalizzato, valutare l'efficacia del BSCB dei parametri di sonicazione o esplorare le applicazioni per la LIFU nel midollo spinale, come la somministrazione di farmaci. immunomodulazione e neuromodulazione. Si raccomanda di ottimizzare questo protocollo per l'uso individuale, in particolare per far progredire il futuro lavoro preclinico, clinico e traslazionale.
Introduzione
Simile alla barriera emato-encefalica (BBB), la barriera emato-midollare (BSCB) regola il movimento dei soluti, delle cellule e dei componenti plasmatici circolanti nel parenchima spinale1. Questa caratteristica protettiva è il risultato di un sistema specializzato di cellule endoteliali strettamente legate e non fenestrate che rivestono i capillari spinali2. Tipicamente, solo le molecole lipofile a basso peso con una carica positiva possono attraversare entrambe le barriere3. Nonostante gli studi suggeriscano che il BSCB abbia una permeabilità leggermente superiore rispetto al BBB, entrambe le barriere limitano la somministrazione di terapie al sistema nervoso centrale4. Sono state sviluppate diverse strategie per aumentare il trasporto di farmaci attraverso il BSCB, tra cui tecniche per aumentare la pressione osmotica nei capillari spinali, lo sviluppo di farmaci che interagiscono con i recettori della bradichinina e la creazione di nanoparticelle funzionalizzate5.
L'interruzione del BSCB può essere ottenuta anche tramite la somministrazione endovenosa di microbolle (MB) seguita da sonicazione a ultrasuoni focalizzati a bassa intensità (LIFU)6. Il campo acustico generato dal trasduttore a ultrasuoni provoca oscillazioni MB, che a loro volta esercitano sollecitazioni contro la parete endoteliale e allentano le giunzioni strette7. L'allentamento della giunzione stretta crea spazi vuoti transitori nei capillari, consentendo alle terapie di penetrare nel parenchima spinale (Figura 1). Questo processo può anche creare fenestrazioni transendoteliali, aumentare la transcitosi e sottoregolare i trasportatori a cassetta leganti l'ATP, come la glicoproteinaP 8,9. Un vantaggio chiave di questa tecnica è la capacità di ridurre al minimo gli effetti fuori bersaglio dirigendo la regione focale della sonicazione verso la posizione di interesse nel midollo spinale. Diversi studi clinici hanno studiato l'efficacia dell'apertura della BBB mediata da LIFU per il trattamento delle patologie del sistema nervoso centrale, tra cui gliomi, sclerosi laterale amiotrofica, morbo di Alzheimer e morbo di Parkinson. Sebbene l'interruzione della BSCB mediata da LIFU non sia così ampiamente caratterizzata come la rottura della BBB mediata dalla LIFU, diversi gruppi hanno riportato un'interruzione della BSCB di successo nei modelli di roditori, conigli e suini10,11,12. Nel complesso, l'interesse per la tecnica è in rapida crescita, soprattutto come strada percorribile per la somministrazione di farmaci.
In questo protocollo, viene descritta una tecnica per l'interruzione di BSCB mediata da LIFU in un modello di ratto. La procedura include descrizioni dettagliate della preparazione dell'animale, della configurazione dell'apparecchiatura LIFU, della somministrazione di MB, della localizzazione del bersaglio e dell'estrazione del midollo spinale. La conferma della localizzazione del bersaglio e dell'interruzione del BSCB viene valutata tramite lo stravaso del colorante blu Evans (EBD) nel midollo spinale. L'EBD è un composto non tossico che si lega all'albumina sierica e può essere identificato visivamente dal suo ricco colore blu e dall'autofluorescenza rossa al microscopio13.
I passaggi qui elencati offrono un'alternativa rapida ed economica ai tradizionali sistemi LIFU guidati da ultrasuoni (US) o risonanza magnetica (RM). Di conseguenza, questo metodo è utile per i ricercatori interessati a testare e confermare rapidamente le capacità di targeting e di interruzione del BSCB del loro trasduttore LIFU prima di acquisire apparecchiature e materiali aggiuntivi o perseguire applicazioni LIFU al midollo spinale, come la somministrazione di farmaci, l'immunomodulazione e la neuromodulazione.
Protocollo
Tutti gli studi sugli animali sono stati approvati e condotti in conformità con il Comitato istituzionale per la cura e l'uso degli animali della Johns Hopkins University (IACUC RA20M223). Per il presente studio sono state utilizzate solo femmine adulte di ratto Sprague-Dawley (peso medio: 250 g; età: 11 settimane).
1. Assemblaggio e configurazione di ultrasuoni focalizzati a bassa intensità
- Acquisire un sistema di trasduttori a ultrasuoni focalizzati con specifiche sufficienti per ottenere l'apertura del BSCB nei ratti. I parametri suggeriti dalla letteratura includono una frequenza centrale compresa tra 0,25-4 MHz e la capacità di produrre pressioni di picco comprese tra 0,2-2,1 MPa 10,14,15,16,17. Assicurarsi che il sistema includa l'apparecchiatura di pilotaggio/controllo, che includa almeno un generatore di onde/segnale, un convertitore/amplificatore di potenza a radiofrequenza (RF) e una rete corrispondente (Figura 2A).
NOTA: La configurazione qui descritta utilizza un trasduttore multielemento disponibile in commercio con una frequenza centrale di 250 kHz e un diametro di 64 mm (Figura 2B). - Fissare il supporto della sonda stampato in 3D e il cono d'acqua sul trasduttore (Figura 2C). Garantire una tenuta stagna tra il cono e il trasduttore.
NOTA: Un cono personalizzato e un supporto per sonda sono stati forniti con il trasduttore utilizzato in questo esperimento. Il cono e il supporto della sonda si fissano al trasduttore con viti, anch'esse fornite. - Sterilizzare una membrana in poliestere acusticamente trasparente di 50 μm di spessore e fissarla sul fondo del cono d'acqua utilizzando un elastico.
- Riempire il cono d'acqua con acqua degassata e deionizzata utilizzando i tubi di ingresso e di uscita. Fare attenzione ad evitare bolle d'aria all'interno del cono, in quanto possono interrompere l'accoppiamento acustico tra il trasduttore e il target. La membrana in poliestere deve essere leggermente gonfiata.
NOTA: Per rimuovere le bolle d'aria dal cono, guidare le bolle verso la valvola di uscita mentre si riempie il cono d'acqua attraverso la valvola di ingresso. Se sono presenti molte piccole bolle, chiudere tutte le valvole e ruotare il cono fino a quando non rimane una bolla grande. Guidare questa bolla verso la valvola di uscita e riprendere a riempire il cono. - Collegare l'apparecchiatura di pilotaggio, che include il generatore di onde e l'amplificatore di azionamento RF, al trasduttore. Il cavo del trasduttore si collegherà al lato di uscita della rete corrispondente e il generatore di segnale/amplificatore di potenza si collegherà al lato di ingresso della rete corrispondente. I cavi devono essere collegati al numero di canale corrispondente (Figura 2D-G).
NOTA: Nel sistema commerciale utilizzato in questo studio, il generatore d'onda e l'amplificatore di pilotaggio RF sono componenti dell'uscita di potenza del trasduttore (TPO) (Figura 2D). - Fissare il supporto della sonda al braccio stereotassico. Fissare il braccio stereotassico al gruppo della piastra di fissaggio. Ciò consentirà al trasduttore di essere posizionato esattamente sopra il roditore durante la sonicazione.
2. Preparazione animale e laminectomia chirurgica
- Anestetizzare il ratto con una miscela di isoflurano e aria medica in una camera a induzione collegata a un contenitore filtrante a carbone. Impostare la portata del gas a 400 ml/min e il vaporizzatore isoflurano tra l'1,5% e il 2,5% per l'induzione dell'anestesia. La quantità di tempo trascorso nella camera prima della sedazione completa è variabile, anche se in genere varia da 3 a 6 minuti.
- Registra il peso del ratto sedato ed esegui un test di pizzicamento delle dita dei piedi. Se si osservano scatti o movimenti in risposta al pizzico, riposizionare il ratto all'interno della camera di induzione per altri 1 minuto e ripetere il test di pizzicamento della punta. Ripetere l'operazione se necessario per assicurarsi che il ratto sia e rimanga completamente anestetizzato.
- Posizionare un termoforo e un tampone assorbente sterile sulla piastra di fissaggio. Posiziona il ratto sul tampone assorbente, applica un unguento per gli occhi e posiziona un termometro rettale per monitorare la temperatura corporea.
NOTA: Durante la durata della procedura chirurgica, la temperatura e la frequenza cardiaca del ratto devono essere monitorate (idealmente, la frequenza cardiaca dovrebbe essere compresa tra 330-480 bpm e la temperatura compresa tra 35,9-37,5 °C)18,19. Regolare l'isoflurano o il termoforo di conseguenza per prevenire la morte prematura. Il termoforo può essere impostato a una temperatura di circa 37 °C e deve essere acceso e spento secondo necessità per mantenere la temperatura corporea ottimale. - Palpare l'ultima costola del ratto, che è attaccata alla colonna vertebrale in corrispondenza della 13avertebra toracica (T13). Usa un rasoio elettrico per radere il pelo dalla superficie dorsale tra l'ultima costola e il collo. Pulire la pelle esposta con una garza imbevuta di iodopovidone al 10%.
- Crea un'incisione sulla linea mediana usando le forbici per iride e seziona la fascia fino a quando i processi spinosi e la lamina non sono esposti. Rimuovere l'osso con tronchesi per ossa sfalsati e forbici per iride a lama angolata fino a quando il midollo spinale non è esposto20. La lunghezza della laminectomia e dell'incisione varia in base al numero di bersagli diversi da sonicare. In questo studio, è stata eseguita una laminectomia a tre livelli utilizzando un'incisione di 3 cm.
NOTA: Evitare di toccare o esercitare pressione sul midollo spinale durante la rimozione dell'osso per evitare lesioni. Se gli arti posteriori del ratto sussultano durante la laminectomia, è stata usata troppa forza sul midollo o sulle radici nervose. - Fissare il ratto alla piastra di fissaggio bloccando i processi spinosi adiacenti alla laminectomia. Tendere leggermente il dorso per ridurre al minimo la curvatura prima di bloccare i morsetti.
3. Localizzazione del bersaglio mediante guida laser
- Regolare la posizione del trasduttore con il braccio stereotassico fino a quando non si trova esattamente sopra la laminectomia (Figura 3A). Il telaio consente il movimento sugli assi x, y e z, nonché la rotazione di 180° sul piano verticale e la rotazione di 360° sul piano orizzontale.
- Fissare l'apparecchio laser sul fondo del cono d'acqua e abbassarlo fino a quando il punto laser non è visibile. Regolare la posizione laterale del trasduttore fino a quando il punto laser non si trova al di sopra della posizione che è l'obiettivo per l'interruzione del BSCB (Figura 3B,C).
NOTA: Un file CAD (Computer-Aided Design) per l'apparecchio laser è incluso nella sezione supplementare (Figura 1 supplementare). - Rimuovere l'apparecchio laser e riempire lo spazio tra il cono e il midollo spinale con gel per ultrasuoni degassato (Figura 3D). Per ottenere il massimo accoppiamento, assicurarsi che non siano presenti bolle d'aria nel gel.
NOTA: In questo studio, il trasduttore con un cono d'acqua apposto è stato abbassato fino a trovarsi a 1 cm sopra il cavo. Poiché il cono d'acqua era lungo 30 mm, la distanza totale tra il trasduttore e il cavo era di 40 mm. Il cono d'acqua è stato posizionato a 1 cm di distanza dal midollo spinale perché la pelle, la fascia e la muscolatura del ratto su entrambi i lati dell'incisione impediscono il contatto diretto tra la punta del cono e il midollo. L'uso dei numeri sull'asse y del braccio stereotassico può essere utile per tenere traccia della distanza verticale alla quale il cono si trova a 1 cm di distanza dal cordone, soprattutto perché il gel renderà difficile la conferma visiva della distanza del cono dal cordone. - Impostare i parametri per la sonicazione sul TPO. È possibile utilizzare un intervallo di valori per ottenere un'interruzione BSCB di successo. Per ottenere la massima potenza, impostare la frequenza di sonicazione vicino alla frequenza centrale del trasduttore. I valori utilizzati in questo studio sono elencati nella Tabella 1.
NOTA: I parametri qui elencati sono stati adattati da un precedente lavoro con LIFU, con una frequenza centrale di 500 kHz, una durata del burst di tono di 500 μs, un ciclo di lavoro del 50% e tempi di sonicazione di 5 o 10 minuti per neuromodulare in modo sicuro un midollo spinale di roditore21. Sulla base di studi che hanno raggiunto con successo la rottura del BSCB, altri parametri che possono essere utilizzati sono le frequenze centrali comprese tra 500 kHz-1 MHz, pressioni di 0,2-2,1 MPa, lunghezze di burst di 10-25 ms e tempi di sonicazione di 2-5 min 6,10,11,22.
| Parametro | Valore |
| Frequenza (kHz) | 250 |
| Distanza di messa a fuoco (mm) | 40 |
| Pressione di picco acustica (MPa) | 0.47 |
| Ciclo | 40% |
| Lunghezza di scoppio (ms) | 400 |
| Periodo/i | 1 |
| Tempo di sonicazione (min) | 5 |
Tabella 1: Parametri di sonicazione utilizzati per l'interruzione del BSCB.
4. Somministrazione di microbolle
- Preparare una soluzione MB secondo le istruzioni fornite dal produttore. Evitare di introdurre aria nella soluzione.
NOTA: I MB sono fragili e si aggregano vicino alla parte superiore del flaconcino/siringa se lasciati fermi per alcuni minuti. Agitare regolarmente il flaconcino e la siringa per evitare una dispersione irregolare dei MB. I MB hanno una durata breve; Consultare la Guida del produttore per determinare la data di scadenza. - Inserire un catetere della vena caudale da 22 G e sciacquare con 0,2 mL di soluzione fisiologica eparinizzata (500 UI/mL)23. Per aumentare le possibilità di successo del cateterismo della vena caudale, immergere la coda in acqua tiepida e posizionare un laccio emostatico alla base della coda per allargare il diametro della vena.
NOTA: Il cateterismo della vena caudale può essere condotto prima della laminectomia, del posizionamento e del targeting dell'animale per risparmiare tempo di studio. - Iniettare 1 mL/kg di EBD al 3% nel catetere. Sciacquare con 0,2 mL di soluzione fisiologica eparinizzata. Le estremità e gli occhi del ratto diventeranno blu. Confermare l'esito positivo del cateterismo della vena caudale controllando il cambiamento di colore blu nella vena spinale dorsale del ratto (Figura 4).
NOTA: L'EBD può essere iniettato ben prima dell'iniezione di MB e non influenzerà la sonicazione. Inoltre, poiché la Food and Drug Administration (FDA) attualmente non ha approvato la sonicazione con i farmaci già presenti nel sistema, l'EBD può essere somministrato anche dopo la sonicazione. Ciò si tradurrà in un minore assorbimento del colorante, ma potrebbe essere più rilevante dal punto di vista clinico. - Iniettare un bolo da 0,2 mL di MB nel catetere e sciacquare con 0,2 mL di soluzione fisiologica eparinizzata. Iniziare la sonicazione 1-2 minuti dopo l'iniezione di MB. La configurazione utilizzata qui non raccoglie il feedback di sonicazione in tempo reale.
NOTA: Gli studi per l'interruzione del BSCB utilizzano in genere una concentrazione di MB più elevata di quella indicata per l'imaging diagnostico. Alcune concentrazioni di marche comuni di MB utilizzate per l'interruzione della BBB e della BSCB nei modelli di ratto includono 0,02-0,2 mL/kg e boli da 200 μL 10,15,24,25.
5. Estrazione del midollo spinale e lavorazione dei tessuti
- Dopo il completamento della sonicazione, perfondere per via transcardiaca il ratto con 100 ml di soluzione salina tamponata con fosfato freddo (PBS) fino a quando il sangue non scorre completamente limpido. Il fegato, che è di un ricco colore blu a causa del colorante, dovrebbe sfumare in un blu-brunastro chiaro26.
NOTA: Lo scopo della perfusione è quello di rimuovere il sangue in eccesso dalla vascolarizzazione del midollo spinale. Poiché l'EBD si lega all'albumina, questo rimuove anche l'EBD in eccesso. Ciò garantisce che qualsiasi EBD rilevata visivamente o attraverso la microscopia a fluorescenza nel midollo spinale provenga dallo stravaso di colorante nel parenchima spinale. - Perfusione transcardiaca con 100 mL di paraformaldeide fredda al 4% (PFA). Gli arti del ratto si contrarranno durante questa fissazione se eseguita accuratamente. Questa perfusione con PFA sopprime il ratto.
- Rimuovere il midollo spinale e metterlo in PFA al 4% a 4 °C per una notte. Sostituire il PFA con PBS il giorno successivo.
6. Visualizzazione dell'interruzione del BSCB
- Isolare una sezione di 2 cm che circonda il luogo della sonicazione usando una lama di rasoio. Dividere la sezione lungo la linea mediana con la lama e la sezione in sezioni spesse 10 μm utilizzando un microtomo. Per la visualizzazione in campo chiaro, colorare con colorazione con ematossilina-eosina (H&E).
NOTA: I campioni di midollo spinale H&E mostrati in questo studio sono stati colorati con ematossilina per 3 minuti ed eosina per 1 minutoe 27. - Per la microscopia a fluorescenza, deparaffinizzare i vetrini contenenti le sezioni del midollo spinale e la colorazione di contrasto con 25 μL di 4′,6-diamidino-2-fenilindolo (DAPI) disciolto nel mezzo di montaggio (0,5 μg/mL). Incubare a 4 °C per almeno 10 min. Evitare la luce per evitare lo sbiancamento.
NOTA: La deparaffinazione può essere sostituita utilizzando un criostato per ottenere sezioni congelate. - Utilizzare un microscopio a fluorescenza per acquisire l'immagine di tutti i vetrini. L'autofluorescenza EBD (eccitazione: 470 nm e 540 nm; emissione: 680 nm) è visibile nel canale rosso, mentre DAPI è presente nel canale blu. Utilizzare un microscopio ottico per acquisire l'immagine dei vetrini H&E.
NOTA: Sebbene questo protocollo descrivesse una procedura di non sopravvivenza, è stata eseguita anche utilizzando tecniche chirurgiche di sopravvivenza. Per la chirurgia di sopravvivenza, disinfettare la pelle prima dell'incisione con 3 applicazioni alternate di iodopovidone e somministrare buprenorfina per via sottocutanea (0,05 mg/kg) prima dell'intervento. Continuare a somministrare buprenorfina per via sottocutanea ogni 12 ore almeno 3 giorni dopo l'intervento, con giorni aggiuntivi se il ratto mostra segni di dolore. Se si verifica una lesione del midollo spinale, i ratti possono presentare ritenzione urinaria o andatura anomala. Questo si presenterà come trascinamento o movimento ritardato degli arti posteriori o vesciche palpabili e distese. Se ciò si verifica, i ratti devono essere allevati con gel d'acqua fortificato dal punto di vista nutrizionale per il cibo e l'idratazione ed estrarre manualmente la vescica due volte al giorno fino a quando lo svuotamento riflesso non viene recuperato. Se c'è una paralisi completa degli arti posteriori o un dolore intrattabile, sopprimere il ratto.
Risultati
Questo documento dimostra che l'applicazione simultanea della sonicazione LIFU e della somministrazione di MB è una tecnica efficace per l'interruzione localizzata del BSCB. L'apertura del BSCB è indicata dalla presenza di stravaso di EBD nel parenchima spinale. I cambiamenti sono evidenti sia visivamente che al microscopio a fluorescenza. La vascolarizzazione del midollo spinale è visibile dopo la laminectomia e mostra la vena spinale posteriore con più vasi più piccoli che si irradiano lateralmente (Figura 4A). L'iniezione endovenosa di EBD attraverso il catetere della vena caudale fa sì che questa vascolarizzazione venga arricchita con colorante blu (Figura 4B). Questo è un buon punto nella procedura per verificare che la laminectomia non abbia provocato la rottura di alcuna vascolarizzazione spinale, poiché ciò comporterebbe un accumulo di sangue blu sul midollo ombelicale. Dopo la sonicazione, una macchia blu dovrebbe diventare visibile sulla posizione bersaglio, indicando lo stravaso di EBD nel parenchima bianco a causa dell'interruzione del BSCB (Figura 4C). La dimensione di questo punto varia in base a una serie di fattori, tra cui la dimensione della regione focale del trasduttore e la quantità di tempo dopo la sonicazione. Per aumentare le possibilità di vedere lo stravaso EBD, si dovrebbe allungare il tempo tra la sonicazione e l'estrazione del midollo spinale.
Sebbene la perfusione di PFA non sia un passaggio necessario da eseguire prima dell'estrazione del cordone ombelicale e della successiva analisi dei tessuti, rimuove il sangue dal campione e aumenta il contrasto tra il parenchima spinale bianco e le regioni blu colorate con EBD. Tutti i ratti che hanno ricevuto la somministrazione di MB e la sonicazione LIFU mostrano un apparente stravaso di EBD nel midollo spinale, mentre i controlli negativi che hanno ricevuto MB e EBD senza sonicazione LIFU non lo fanno. Le immagini rappresentative sono mostrate nella Figura 5. I tagli sagittali attraverso i tessuti rivelano che lo stravaso EBD non è solo superficiale, ma si estende bene nel midollo stesso. Ciò è previsto, poiché la regione focale del trasduttore utilizzato in questo studio è maggiore del diametro del midollo spinale del ratto. A volte, piccole quantità di emorragia possono essere osservate nei tagli sagittali. Ciò può essere dovuto alla laminectomia o alla sonicazione a ultrasuoni. Se l'emorragia è vicina alla periferia dorsale del midollo, è più probabile che sia dovuta alla laminectomia.
Per valutare ulteriormente lo stravaso di EBD, le sezioni del midollo spinale sagittale sono state colorate con DAPI (marcatore nucleare) e visualizzate utilizzando un microscopio a fluorescenza. Tutti i cavi che hanno ricevuto la sonicazione LIFU (n = 3) hanno mostrato un'intensità significativamente maggiore di autofluorescenza EBD (p = 0,016) rispetto ai cavi che non hanno ricevuto sonicazione, con intensità simili di DAPI presenti in entrambi (Figura 6). L'analisi H&E non ha inoltre rivelato danni neuronali, emorragie o lesioni cavitarie presenti nelle posizioni sonicate, supportando la sicurezza di questa procedura. Esempi di corde danneggiate a causa di una manipolazione errata chirurgica e di una sonicazione ad alta potenza sono mostrati come confronto. L'emorragia, il danno tissutale, le lesioni della cavità e la possibile vacuolizzazione sono etichettati. Sebbene l'esempio della sonicazione ad alta potenza non mostri emorragia, anche questo è stato segnalato come un effetto dell'interruzione degli ultrasuoni.
Inoltre, l'analisi comportamentale è stata condotta su ratti che hanno ricevuto MB, EBD e LIFU sonicazione. Sebbene questo metodo non escluda completamente il danno tissutale, verifica se si sono verificati deficit motori a causa di questa procedura. I ratti sono stati registrati mentre camminavano in una gabbia per 5 minuti ogni giorno per un periodo di 5 giorni e la funzione locomotoria è stata classificata in base alla scala locomotoria Basso Beattie Bresnahan (Supplemental Video File 1). Tutti i ratti (n = 5) hanno ricevuto il punteggio più alto prima della sonicazione, della post-sonicazione e di ogni giorno del periodo di sopravvivenza (Figura 7).
Infine, gli effetti termici dei parametri di sonicazione utilizzati in questo studio sono stati misurati utilizzando due campioni di midollo spinale di ratto ex vivo e una sonda termometrica digitale con una punta fine inserita nel midollo. La temperatura dei campioni di midollo spinale è stata monitorata per 5 minuti prima, durante e dopo la sonicazione, per un totale di 15 minuti. Sono stati osservati minimi cambiamenti di temperatura. In effetti, c'è stata una variazione di ≤1,3 °C a causa della sonicazione in entrambi i campioni, diminuendo la probabilità di lesioni ipertermiche a causa della sonicazione (Figura 8).
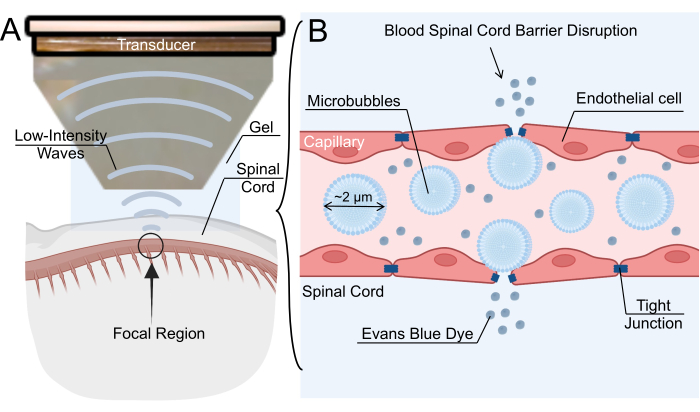
Figura 1: Meccanismo di apertura della barriera emato-midollare mediata da ultrasuoni focalizzati a bassa intensità. (A) Panoramica schematica della sonicazione a ultrasuoni focalizzati a bassa intensità (LIFU) del midollo spinale di ratto. (B) Il meccanismo per l'apertura della barriera emato-spinale (BSCB) tramite sonicazione LIFU di microbolle endovenose (MB). I MB oscillano in risposta alla LIFU, causando l'allargamento delle giunzioni strette tra le cellule endoteliali. Questa interruzione del BSCB consente lo stravaso di nanoparticelle, farmaci terapeutici o colorante blu di Evans. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Configurazione e connettività da banco a ultrasuoni focalizzati a bassa intensità. (A) Rappresentazione schematica che mostra le tipiche componenti degli ultrasuoni focalizzati. (B) Immagine panoramica della configurazione a ultrasuoni focalizzati, tra cui: 1. uscita di potenza del trasduttore (TPO), 2. rete di corrispondenza, 3. Trasduttore LIFU, 4. Lo strumento stereotassico, 5. morsetti mobili. (C) Trasduttore, compreso: 1. supporto della sonda, 2. trasduttore ad anello, 3. cono d'acqua, 4. tubo di ingresso dell'acqua, 5. tubo di uscita dell'acqua, 6. membrana fissata con un elastico. (D) Parte anteriore del TPO, tra cui: 1. custodia schermata RF, 2. pannello display frontale sensibile al tocco con menu regolabile, 3. manopola rotante per la regolazione dei parametri, 4. interruttore di uscita start/stop. (E) Retro del TPO, inclusi: 1. connettori di uscita del canale, 2. massa, 3. porta di ingresso USB per il controllo del software, 4. trigger interno, 5. connettore di uscita di sincronizzazione, 6. jack di ingresso e alimentazione dell'alimentazione, 7. interruttore di alimentazione on/off. (F) Uscita di rete corrispondente, con fili corrispondenti ai numeri di canale. (G) Ingresso XDR di rete corrispondente, con fili corrispondenti ai numeri di canale Fare clic qui per visualizzare una versione più grande di questa figura.
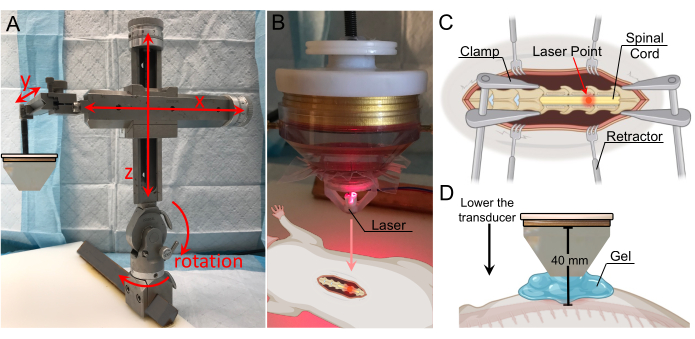
Figura 3: Localizzazione del bersaglio con guida laser . (A) Braccio stereotassico con gamma di movimento in tutti e tre gli assi e capacità di rotazione. È fissato alla piastra di fissaggio sottostante. (B) Apparecchio laser per l'identificazione della zona focale. Il laser è posizionato sulla punta del trasduttore ed è in linea con la regione focale. (C) Illustrazione che mostra il laser sul midollo spinale esposto, indicando che la regione focale del trasduttore è ora diretta in questa posizione. (D) Il trasduttore viene abbassato fino a quando la punta del cono si trova 1 cm sopra il cavo e lo spazio viene riempito con gel per garantire il massimo accoppiamento. La distanza tra il trasduttore e il midollo spinale è di 40 mm (distanza focale). Fare clic qui per visualizzare una versione più grande di questa figura.
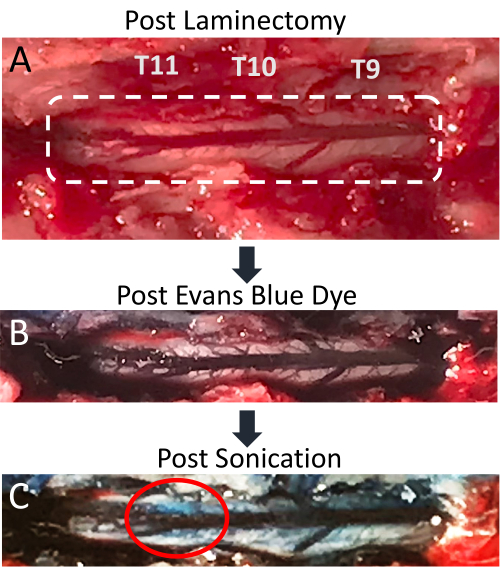
Figura 4: Stravaso del colorante blu di Evans nel midollo spinale dopo la sonicazione. (A) Immagine dell'incisione della laminectomia di ratto T9-T11, con il midollo spinale esposto e la vena dorsale posteriore chiaramente visibili. (B) Il tessuto circostante e la vascolarizzazione del midollo spinale diventano blu dopo l'iniezione endovenosa di colorante blu Evans (EBD). (C) Stravaso di EBD nel parenchima del midollo spinale nel sito di sonicazione, indicando che si è verificata un'interruzione del BSCB. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Estrazione del midollo spinale e visualizzazione dell'apertura del BSCB dopo la perfusione. (A) Midollo spinale asportato da un ratto di controllo senza trattamento LIFU. Questo ratto ha ricevuto solo MB ed EBD. La fetta medio-sagittale del cordone incorporata nella paraffina è mostrata nel riquadro e non è visibile alcuno stravaso di EBD. (B) Midollo spinale asportato dal ratto con trattamento LIFU. Questo ratto ha ricevuto anche MB ed EBD. La colonna di stravaso EBD è visibile e localizzata nella regione sonicata. La fetta sagittale centrale del cordone incorporata nella paraffina è mostrata nel riquadro, con una freccia che indica la concentrazione di EBD visibile all'interno della posizione sonica. Fare clic qui per visualizzare una versione più grande di questa figura.
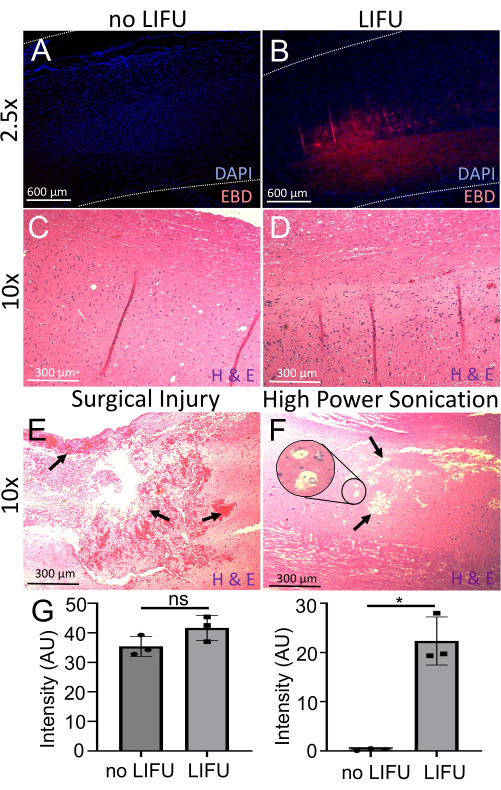
Figura 6: Rilevamento e valutazione dell'apertura del BSCB. (A) Midollo spinale colorato con DAPI (marcatore nucleare, blu). È visibile un'autofluorescenza EBD minima (rosso). Questo ratto non ha ricevuto LIFU. (B) Midollo spinale colorato con DAPI (marcatore nucleare, blu). È visibile l'autofluorescenza EBD localizzata (rossa) nella posizione del bersaglio sonicato. Questo ratto ha ricevuto LIFU e MB. (C) Il midollo spinale di un ratto senza LIFU colorato con ematossilina (colorazione dell'acido nucleico) ed eosina (colorazione proteica non specifica) (H&E). Non sono visibili danni neuronali, emorragie o lesioni della cavità. (D) Il midollo spinale di un ratto con LIFU colorato con H&E. Non sono visibili danni neuronali, emorragie o lesioni della cavità. (E) Midollo spinale di un ratto con lesione chirurgica macchiato con H&E. Le frecce indicano un'ampia emorragia e danni ai tessuti. (F) Il midollo spinale di un ratto con danni dovuti alla sonicazione ad alta potenza colorato con H&E. Le frecce indicano lesioni della cavità e l'inserto mostra una possibile vacuolizzazione. (G) Grafici a barre che mostrano l'intensità di DAPI e EBD nel midollo spinale di ratti con e senza sonicazione LIFU. C'è un'intensità di EBD significativamente maggiore nel midollo spinale LIFU rispetto al controllo negativo (p = 0,016), nonostante un'intensità DAPI simile (p > 0,05). Fare clic qui per visualizzare una versione più grande di questa figura.
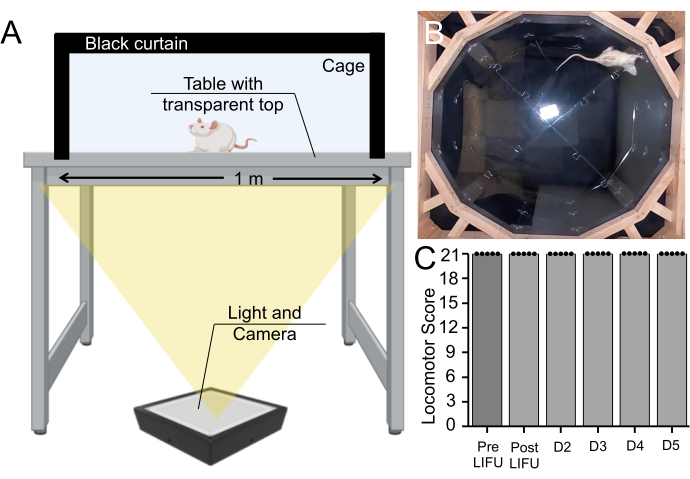
Figura 7: Saggio comportamentale pre- e post-sonicazione . (A) Configurazione dell'apparato Basso, Beattie, Bresnahan, in cui i ratti sono stati registrati mentre camminavano per 5 minuti dal basso. (B) Fermo immagine di un video registrato. Questo video è stato utilizzato per valutare la coordinazione motoria e l'andatura del ratto sulla scala Basso, Beattie, Bresnahan. (C) Boxplot (n = 5) che non mostra alcun cambiamento nei punteggi motori prima e dopo la sonicazione o durante un periodo di sopravvivenza di 5 giorni nei ratti che hanno ricevuto MB e trattamento LIFU (p > 0,05). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Analisi della temperatura utilizzando midollo spinale ex vivo . Grafico che illustra le variazioni di temperatura in due campioni di midollo spinale ex vivo per una durata di 5 minuti prima, durante e dopo la sonicazione. I parametri utilizzati per la sonicazione sono elencati nella Tabella 1. Per il campione 1, le temperature medie pre, durante e post-sonicazione sono state rispettivamente di 21,9 °C ± 0,1 °C, 22,1 °C ± 0,1 °C e 22,0 °C ± 0,1 °C. Per il campione 2, le temperature pre, durante e post-sonicazione erano rispettivamente di 21,9 °C ± 0,1 °C, 22,5 °C ± 0,3 °C e 22,4 °C ± 0,2 °C. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura 1 supplementare: File CAD dell'apparato di puntamento laser. (A) Vista dell'apparecchio laser dal basso. Qualsiasi laser può essere posizionato all'interno del foro centrale al centro. (B) Vista laterale dell'apparecchio laser. (C) Dimensioni dell'apparecchio laser, con unità in pollici. Fare clic qui per scaricare il file.
File video supplementare 1: Video di un topo che cammina nell'apparato Basso, Beattie, Bresnahan. Fare clic qui per scaricare il file.
Discussione
Qui, vengono descritte le apparecchiature e le fasi necessarie per un'interruzione efficace e mirata del BSCB utilizzando ultrasuoni focalizzati a bassa intensità (LIFU) combinati con la somministrazione di microbolle (MB). Questo protocollo è flessibile e può essere ottimizzato per l'uso individuale con trasduttori di diverse specifiche. Altre tecniche per l'interruzione del BSCB mediata da LIFU si basano sull'uso di sistemi guidati dalla risonanza magnetica (MRI) per la localizzazione del bersaglio, che è una risorsa costosa16. I vantaggi della tecnica qui presentata risiedono nella rapida conferma visiva in tempo reale dell'interruzione del BSCB e nella facilità di targeting grazie alla natura aperta della procedura. Inoltre, l'apparato laser è semplice da usare e da costruire, e un file CAD è incluso nella sezione supplementare. Di conseguenza, i ricercatori interessati a condurre test iniziali sulle capacità di targeting del loro trasduttore LIFU in un modello animale di piccole dimensioni possono utilizzare questo protocollo come strumento per confermare rapidamente il posizionamento della zona focale su una posizione di interesse. Questa tecnica può essere utilizzata anche dai laboratori che iniziano a studiare le applicazioni cliniche della LIFU, come la somministrazione di farmaci, prima di investire in modalità di guida più complesse come i sistemi ecografici o RM. Attualmente, le modalità ecoguidate presentano un percorso più promettente ed economico rispetto ai sistemi RM, sebbene questi ultimi siano più frequentemente osservati in letteratura.
Ci sono diversi passaggi critici in questa procedura che devono essere eseguiti con attenzione per garantire il successo dell'interruzione del BSCB. È imperativo evitare di esercitare una pressione non necessaria sul midollo spinale durante la laminectomia chirurgica. Un'eccessiva manipolazione fisica del cavo aumenta la probabilità di danni al BSCB. Il danno appare come una macchia marrone scuro all'interno del cordone dopo l'estrazione a causa dell'emorragia e dell'aumento dello stravaso di EBD. Inoltre, deve essere assicurato il massimo accoppiamento tra il trasduttore e il midollo spinale esposto. Di conseguenza, è necessario prestare attenzione a rimuovere le bolle dal cono d'acqua e dal gel per ultrasuoni. Non devono esserci spazi vuoti tra il fondo del cono d'acqua e il cavo per garantire la piena trasmissione dell'onda acustica. Durante il cateterismo della vena caudale, si dovrebbe evitare di far passare accidentalmente l'aria insieme alle soluzioni saline eparinizzate, EBD o MB. L'iniezione di aria aumenta notevolmente la possibilità di un'embolia polmonare che provoca la morte del roditore prima della conclusione della procedura28.
Un problema comune che può essere riscontrato durante questa procedura è il fallimento dell'iniezione EBD. Per le persone con esperienza minima nel cateterismo della vena caudale, l'esecuzione di questo passaggio prima della laminectomia, del posizionamento o del targeting degli animali farà risparmiare tempo. L'EBD può anche essere iniettato ben prima dell'iniezione di MB senza influenzare la sonicazione. L'utilizzo del laccio emostatico e del bagno di acqua calda suggeriti in questo protocollo aiuterà a dilatare le vene caudali e ad aumentare il tasso di successo. Inoltre, la disidratazione dei ratti riduce la probabilità di un corretto posizionamento del catetere. Può essere utile un'iniezione salina intraperitoneale 10-15 minuti prima del cateterismo della vena caudale. Durante il cateterismo, si dovrebbe iniziare 2 in sopra l'estremità della coda e muoversi in direzione caudale verso il cranio. Muoversi nella direzione opposta diminuisce la probabilità di successo a causa di un potenziale collasso o emorragia venosa.
Un'altra sfida comune riguarda la mancanza di stravaso EBD nonostante la sonicazione. Ciò può indicare che i parametri utilizzati per la sonicazione sono insufficienti per l'interruzione del BSCB. Ad esempio, se la frequenza di sonicazione è impostata su un valore che differisce notevolmente dalla frequenza centrale del trasduttore, la potenza di sonicazione sarà troppo bassa per oscillare MB e causare l'allentamento della giunzione stretta. Inoltre, maggiore è il numero di interfacce tra il trasduttore e il cavo (ad esempio, cono d'acqua, membrana, gel, bolle d'aria in acqua/gel), minore sarà la vera intensità di sonicazione sul bersaglio. Ridurre al minimo queste interfacce, ad esempio utilizzando gel degassizzato e rimuovendo accuratamente le bolle all'interno del cono, aiuterà a trasmettere il pieno potenziale della sonicazione. Il protocollo incoraggia anche ad aumentare il tempo tra la sonicazione e la perfusione per consentire più tempo per lo stravaso di EBD nel parenchima spinale. Sebbene l'interruzione del BSCB sia una procedura transitoria, gli spazi vuoti sono presenti per diverse ore prima della chiusura. Un lungo tempo di attesa aumenta l'esposizione all'isoflurano, ma provoca anche un maggiore stravaso di EBD nel cordone ombelicale. In alternativa, può essere presente uno stravaso di EBD nonostante l'assenza di sonicazione con LIFU. Per risolvere questo problema, è necessario prestare attenzione durante la laminectomia per evitare danni accidentali al BSCB. Le possibili soluzioni includono il sollevamento della colonna vertebrale del ratto durante il clampaggio per aumentare la quantità di spazio tra le lamine e il cordone, nonché una laminectomia più breve. Un'accurata perfusione di PFA riduce anche la colorazione di fondo rimuovendo il sangue arricchito di EBD dalla vascolarizzazione all'interno del midollo spinale. Durante la perfusione transcardica, è necessario prestare attenzione per prevenire la rottura accidentale del cuore, che può provocare la fuoriuscita di PBS o PFA.
È importante notare che questo studio rappresenta un'esperienza a centro singolo per l'interruzione della BSCB mediata da LIFU. Inoltre, questo protocollo non testa o ottimizza vari parametri di energia di sonicazione e concentrazioni di MB. Di conseguenza, i ricercatori sono incoraggiati a studiare vari parametri e concentrazioni durante l'esecuzione di questa tecnica per ottimizzare la localizzazione del bersaglio e l'interruzione del BSCB per le loro particolari esigenze di ricerca, soprattutto se i risultati iniziali producono effetti avversi. I gruppi che desiderano non vedere cambiamenti di temperatura, ad esempio, possono testare vari parametri fino a trovare un set che soddisfi questo criterio e raggiunga una sufficiente interruzione del BSCB. Inoltre, possono essere condotti ulteriori esperimenti per confermare la sicurezza di questa tecnica. Ad esempio, è possibile aumentare le dimensioni del campione, estendere il periodo di sopravvivenza e condurre studi di elettromiografia/analisi del cammino. Per una sopravvivenza più lunga, è importante tenere presente che alcuni studi dimostrano che alte dosi di EBD possono talvolta causare tossicità sistemica cronica, quindi una dose più bassa può essere prudente29.
Un'altra limitazione di questa procedura è la natura invasiva della laminectomia (che è necessaria per qualsiasi tecnica che utilizzi LIFU per l'apertura del BSCB poiché gli ultrasuoni non possono penetrare attraverso l'osso). La natura invasiva di questa procedura può essere ridotta limitando la durata della laminectomia. L'esecuzione della laminectomia nelle vertebre toraciche superiori, che sono più corte e sottili, può ridurre il tempo necessario per la laminectomia al di sotto dei 10 minuti. A causa della natura fragile dei MB, nonché della loro breve emivita, il tempo è limitato durante questo protocollo. L'iniezione di MB deve avvenire 1-2 minuti prima del trattamento con LIFU e i nuovi MB devono essere somministrati prima di ogni sonicazione se vengono eseguiti più trattamenti LIFU. Per gli esperimenti che prevedono l'interruzione di BSCB per più ratti, potrebbe essere necessario preparare diverse fiale MB. Poiché le microbolle sono costose, è preferibile modificare il flusso di lavoro chirurgico per ridurre al minimo il tempo tra le sonicazioni per risparmiare il numero di MB utilizzati.
La tecnica qui descritta è principalmente da utilizzare come protocollo di ricerca. Sebbene l'apparato di puntamento laser non sostituirà le modalità di puntamento tradizionali in tutti i contesti clinici, può essere utile in altre situazioni. Per gli interventi chirurgici non invasivi, le modalità di risonanza magnetica tradizionali possono essere utilizzate in modo affidabile per il targetingdi 30. Per gli interventi chirurgici invasivi che includono l'esecuzione di una laminectomia, l'apparato laser descritto in questo protocollo può essere utilizzato per localizzare rapidamente il centro della zona focale di sonicazione su una regione specifica (ad esempio, un tumore o un sito di lesione del midollo spinale) ai fini della somministrazione di farmaci o della terapia immunomodulatoria, integrando qualsiasi guida RM che avrebbe luogo.
Nel complesso, questo protocollo descrive una tecnica efficace e di successo per l'interruzione del BSCB e include diverse opzioni per la conferma dell'apertura del BSCB, sia in tempo reale che in post-elaborazione. Poiché il BSCB funge da barriera all'ingresso nel parenchima del midollo spinale, l'interruzione del BSCB è un possibile metodo per migliorare la somministrazione di terapie. Ad esempio, Weber-Adrian et al. hanno utilizzato LIFU con una frequenza di 1,114 MHz e una lunghezza di burst di 10 ms per mediare la consegna genica al rachide cervicale6. Allo stesso modo, Smith et al. hanno dimostrato che la LIFU con una frequenza di 580 kHz, pressioni di picco acustiche medie intorno a 0,46 MPa e una lunghezza di burst di 10 ms potrebbe aiutare nella somministrazione di un anticorpo monoclonale, trastuzumab, al midollo spinale in un modello di roditore di metastasi leptomeningee10. La maggior parte degli studi si è concentrata sull'utilizzo di LIFU, piuttosto che HIFU, a causa della capacità di LIFU di permeabilizzare transitoriamente il BSCB evitando danni al tessuto sottostante. In genere, la LIFU utilizza intensità comprese tra 0,125-3 W/cm 2, mentre la HIFU utilizza intensità comprese tra 100 e 10.000 W/cm2 o superiori31. Di conseguenza, l'HIFU esercita i suoi effetti principalmente attraverso il riscaldamento dei tessuti, mentre la LIFU, con la co-somministrazione di MB, agisce attraverso effetti di cavitazione meccanica. La co-somministrazione di terapie con MB può comportare un maggiore stravaso del farmaco nel parenchima spinale, nonché la possibilità di caricare MB con il farmaco e lisare i MB con ultrasuoni per la somministrazione mirata del farmaco.
I parametri di sonicazione, la concentrazione di MB e il tipo di trasduttore utilizzato in questo studio possono essere modificati in base alle esigenze sperimentali. Ad esempio, un trasduttore con una regione focale più piccola può essere preferibile per esperimenti in cui è necessario un maggiore controllo sul targeting localizzato, mentre un trasduttore con una potenza maggiore può essere utilizzato per esperimenti che richiedono una potente interruzione in un lasso di tempo più breve. Grazie alla flessibilità offerta da questo protocollo, esiste un grande potenziale per l'uso nella ricerca preclinica, clinica e traslazionale.
Divulgazioni
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che possa essere interpretata come un potenziale conflitto di interessi. Amir Manbachi insegna e fa consulenza per BK Medical (GE Healthcare), Neurosonics Medical ed è inventore di una serie di tecnologie FUS in attesa di brevetto. Betty Tyler ha finanziamenti per la ricerca da NIH ed è co-proprietaria di Accelerating Combination Therapies (comprese azioni o opzioni). Ashvattha Therapeutics Inc. ha anche concesso in licenza uno dei suoi brevetti ed è azionista di Peabody Pharmaceuticals. Nicholas Theodore riceve royalties e possiede azioni di Globus Medical. È consulente per Globus Medical e ha fatto parte del comitato consultivo scientifico e di altri uffici di Globus Medical. Gli altri autori non hanno alcun conflitto di interessi da rivelare.
Riconoscimenti
Con il sostegno di T32GM136577 (D.R.); N660012024075 (N.T., N.V.T., A.M., K.K.L.); R01 HL139158-01A1 e R01 HL071568-15 (N.V.T.); Programma di studiosi di ricerca clinica ICTR della Johns Hopkins (KL2) (A.M.). Diverse figure create con BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.9% Heparinized Sodium Chloride | Baxter | FKB0953G | Flush tail vein catheter with heparinized saline to prevent clotting. |
| 100 mL Luer Lock Tip Syringe (2) | Wilburn Medical | WUSA/120 | One syringe can be used to inject PBS and one for PFA (during transcardial perfusion) |
| 1x Phosphate buffered saline (PBS) | Thermo Scientific | 10010001 | For transcardial perfusion. |
| 22 G catheter | Med Vet International | 50-209-1694 | Use to place a tail vein catheter. |
| 97% Isoflurane | Thermo Scientific Chemicals | 247-897-7 | While rat is under isoflurane, be careful not to administer too much. A high dose can euthanize the rat. |
| Betadine 7.5% | Purdue Products | 4677 | |
| Class A clear threaded glass vial | Fisherbrand | 14-955-314 | Use to store spinal cord extraction. |
| Digital balance scale | Kent Scientific | SCL-4000 | |
| Electric razor | Wahl Home Products | 79449-200 | Shave fur off skin at incision site before surgery |
| Eosin-Y with Phloxine | Epredia | 71304 | |
| Evans blue dye | MP Biomedicals | 02151108-CF | Although it is non-toxic, it will stain skin blue if direct contact occurs. |
| Fixation Plate Assembly with 0.5 mm Forceps | PSI Impactors | 7001-2 | Affix the stereotactic arm to this frame |
| Gauze | Fisherbrand | 13-761-52 | |
| Heating pad | Kent Scientific | RT-0515 | |
| Hematoxylin | Epredia | 7211 | |
| Iris Scissors with Angled Blades | ProDentUSA | 12-15315 | |
| Isoflurane induction system | Kent Scientific | SOMNO-RATKIT | |
| Laser targetting apparatus | NA | custom | CAD design file provided in supplemental section. Simply place a laser inside the apparatus created from the file. |
| Lubricating eye ointment | Systane | N/A | |
| Luer Lock 3-Way Stopcock | Sigma | SAS7521-10EA | Can use to fill water cone through inlet valve |
| Lumason microbubbles kit | Bracco | 0270-7099-16 | |
| Microscope cover glass | Fisherbrand | 12-545J | |
| Microscope slides | Fisherbrand | 12-550-15 | |
| Microtome | Epredia | 23-900-671 | |
| Mounting medium with 4',6-diamidino-2-phenylindole (DAPI) | Vector Laboratories | H-2000-2 | |
| Mylar membrane | Chemplex | 3016 | Can cut membrane to appropriate size if too large for cone |
| NeuroFUS 2.52" diameter 250 kHz transducer | Sonic Concepts | CTX-250 | Transducer system includes custom water cone and probe holder |
| NeuroFUS PRO v2.0 system | Sonic Concepts | NFS102v2 | Includes Transducer Power Output, Matching Network and associated cables |
| Offset Bone Nippers | Fine Science Tools | 16101-10 | Use to remove spinous processes and laminae for laminectomy |
| Paraffin | Polysciences | 24364-1 | Can place spinal cord sample in paraffin to slice into thin sections for histology. |
| Paraformaldehyde (4%) | Thermo Scientific | J61899-AK | For transcardial perfusion. |
| Rat Surgical Kit | Kent Scientific | INSRATKIT | Consists of tweezer #5, needle holder, McPherson-Vannas scissors, Iris scissors, ALM self-retaining retractors, Iris forceps, and blunt probe. These products should be sufficient to perform a laminectomy. |
| Razor blade | Fisherbrand | 12-640 | Use to cut spinal cord extraction to desirable length and split section down midline. |
| Rectal thermometer | Kent Scientific | RET-2 | Maintain rat temperature between 35.9–37.5 °C |
| Rubber band | Fisherbrand | 50-205-1983 | |
| Single animal vaporizer unit | Kent Scientific | SF-01 | |
| Stereotactic arm | Kopf Instruments | Model 963 | |
| Sterile absorbent pad | McKesson | 4033-CS150 | Place under rat and above heating pad and fixation plate before laminectomy |
| Ultrasound gel | Aquasonic | PLI 01-34 | Ensure gel is free of bubbles to the best of your ability. |
Riferimenti
- Chopra, N., et al. Blood-spinal cord barrier: Its role in spinal disorders and emerging therapeutic strategies. NeuroSci. 3 (1), 1-27 (2021).
- Bartanusz, V., Jezova, D., Alajajian, B., Digicaylioglu, M. The blood-spinal cord barrier: morphology and clinical implications. Annals of Neurology. 70 (2), 194-206 (2011).
- Hersh, A. M., Alomari, S., Tyler, B. M. Crossing the blood-brain barrier: Advances in nanoparticle technology for drug delivery in neuro-oncology. International Journal of Molecular Sciences. 23 (8), 4153 (2022).
- Pan, W., Banks, W. A., Kastin, A. J. Permeability of the blood-brain and blood-spinal cord barriers to interferons. Journal of Neuroimmunology. 76 (1-2), 105-111 (1997).
- Bellettato, C. M., Scarpa, M. Possible strategies to cross the blood-brain barrier. Italian Journal of Pediatrics. 44, 131 (2018).
- Weber-Adrian, D., et al. Gene delivery to the spinal cord using MRI-guided focused ultrasound. Gene Therapy. 22 (7), 568-577 (2015).
- Hersh, A. M., et al. Applications of focused ultrasound for the treatment of glioblastoma: A new frontier. Cancers. 14 (19), 4920 (2022).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Cho, H., et al. Localized down-regulation of P-glycoprotein by focused ultrasound and microbubbles induced blood-brain barrier disruption in rat brain. Scientific Reports. 6, 31201 (2016).
- Smith, P., Ogrodnik, N., Satkunarajah, J., O'Reilly, M. A. Characterization of ultrasound-mediated delivery of trastuzumab to normal and pathologic spinal cord tissue. Scientific Reports. 11 (1), 4412 (2021).
- Montero, A. S., et al. Ultrasound-induced blood-spinal cord barrier opening in rabbits. Ultrasound in Medicine & Biology. 45 (9), 2417-2426 (2019).
- Fletcher, S. P., Choi, M., Ogrodnik, N., O'Reilly, M. A. A porcine model of transvertebral ultrasound and microbubble-mediated blood-spinal cord barrier opening. Theranostics. 10 (17), 7758-7774 (2020).
- Honeycutt, S. E., O'Brien, L. L. Injection of Evans blue dye to fluorescently label and image intact vasculature. BioTechniques. 70 (3), 181-185 (2021).
- Fletcher, S. P., Choi, M., Ramesh, R., O'Reilly, M. A. Focused ultrasound-induced blood-spinal cord barrier opening using short-burst phase-keying exposures in rats: A parameter study. Ultrasound in Medicine & Biology. 47 (7), 1747-1760 (2021).
- Cross, C. G., et al. Technical note: Quantification of blood-spinal cord barrier permeability after application of magnetic resonance-guided focused ultrasound in spinal cord injury. Medical Physics. 48 (8), 4395-4401 (2021).
- Hong, Y. R., et al. Ultrasound stimulation improves inflammatory resolution, neuroprotection, and functional recovery after spinal cord injury. Scientific Reports. 12 (1), 3636 (2021).
- Liao, Y. H., et al. Low-intensity focused ultrasound alleviates spasticity and increases expression of the neuronal K-Cl cotransporter in the L4-L5 sections of rats following spinal cord injury. Frontiers in Cellular Neuroscience. 16, 882127 (2022).
- Redfors, B., Shao, Y., Omerovic, E. Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Laboratory Animals. 48 (1), 6-14 (2014).
- Lillie, L. E., Temple, N. J., Florence, L. Z. Reference values for young normal Sprague-Dawley rats: weight gain, hematology and clinical chemistry. Human & Experimental Toxicology. 15 (8), 612-616 (1996).
- Lin, X. J., et al. Spinal cord lateral hemisection and asymmetric behavioral assessments in adult rats. Journal of Visualized Experiments. (157), e57126 (2020).
- Tsehay, Y., et al. Low-intensity pulsed ultrasound neuromodulation of a rodent's spinal cord suppresses motor evoked potentials. IEEE Transactions on Biomedical Engineering. , (2023).
- Payne, A. H., et al. Magnetic resonance imaging-guided focused ultrasound to increase localized blood-spinal cord barrier permeability. Neural Regeneration Research. 12 (12), 2045-2049 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. Journal of Visualized Experiments. (146), e59295 (2019).
- Sabbagh, A., et al. Opening of the blood-brain barrier using low-intensity pulsed ultrasound enhances responses to immunotherapy in preclinical glioma models. Clinical Cancer Research. 27 (15), 4325-4337 (2021).
- Dréan, A., et al. Temporary blood-brain barrier disruption by low intensity pulsed ultrasound increases carboplatin delivery and efficacy in preclinical models of glioblastoma. Journal of Neuro-Oncology. 144 (1), 33-41 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Yamamoto, H., Imai, S., Okuyama, T., Tsubura, Y. Pulmonary lesions in rats caused by intravenous injection. Acta Pathologica Japonica. 32 (5), 741-747 (1982).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Scientific Reports. 9 (1), 321 (2019).
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon