Method Article
ラットモデルにおける低強度集束超音波を用いた脊髄バリアの破壊
要約
血液脊髄関門(BSCB)の破壊は、マイクロバブルの静脈内投与と低強度焦点式超音波(LIFU)の適用により成功裏に達成できます。このプロトコルでは、げっ歯類モデルでLIFUを使用してBSCBを開く方法を詳しく説明し、機器のセットアップ、マイクロバブル注入、ターゲットの局在化、BSCB破壊の視覚化などを行います。
要約
低強度集束超音波(LIFU)は、超音波よりも低い強度で超音波脈動を使用し、可逆的で正確な神経調節技術としてテストされています。LIBUを介した血液脳関門(BBB)の開口部が詳細に調査されていますが、 血液脊髄関門(BSCB)の開口部の標準化された技術は今日まで確立されていません。したがって、このプロトコルは、動物の準備、マイクロバブル投与、ターゲットの選択と局在化、ならびにBSCB破壊の視覚化と確認の説明を含む、ラットモデルでのLIBU超音波処理を使用してBSCB破壊を成功させるための方法を提示します。ここで報告されるアプローチは、集束超音波トランスデューサーを備えた小動物モデルで標的の局在化と正確なBSCB破壊をテストおよび確認し、超音波処理パラメータのBSCBの有効性を評価し、または薬物送達などの脊髄でのLIBUの用途を探求するための迅速で費用対効果の高い方法を必要とする研究者にとって特に有用です。 免疫調節、および神経調節。このプロトコルは、特に将来の前臨床、臨床、およびトランスレーショナル研究を進めるために、個人使用に最適化することが推奨されます。
概要
血液脳関門(BBB)と同様に、血液脊髄関門(BSCB)は、循環する溶質、細胞、および血漿成分の脊髄実質への移動を調節します1。この保護的特徴は、脊髄毛細血管2を覆う、強固に結合した非有窓内皮細胞の特殊なシステムの結果である。典型的には、正電荷を有する低重量の親油性分子のみが両方の障壁を通過することができる3。BSCBはBBBよりもわずかに高い透過性を有することを示唆する研究にもかかわらず、どちらの障壁も中枢神経系への治療薬の送達を制限します4。脊髄毛細血管の浸透圧を高める技術、ブラジキニン受容体と相互作用する薬物の開発、機能性ナノ粒子の作製など、BSCB全体での薬物の輸送を増加させるためにいくつかの戦略が開発されています5。
BSCBの破壊は、マイクロバブル(MB)の静脈内投与とそれに続く低強度焦点式超音波(LIFU)超音波処理によっても達成できます6。超音波トランスデューサによって生成された音場はMB振動を引き起こし、それが次に内皮壁に応力を加え、タイトジャンクション7を緩める。タイトジャンクションの緩みにより、毛細血管に一時的なギャップが生じ、治療薬が脊椎実質に浸透します(図1)。このプロセスは、経内皮開窓を生じさせ、トランスサイトーシスを増加させ、P-糖タンパク質8,9などのATP結合カセットトランスポーターをダウンレギュレーションすることもあります。この技術の主な利点は、超音波処理の焦点領域を脊髄の関心のある場所に向けることにより、オフターゲット効果を最小限に抑えることができることです。いくつかの臨床試験では、神経膠腫、筋萎縮性側索硬化症、アルツハイマー病、パーキンソン病などの中枢神経系の病状の治療に対するLIBU媒介BBB開口部の有効性が調査されています。LIBUが媒介するBSCBの破壊は、LIBUが媒介するBBBの破壊ほど広範囲に特徴付けられていませんが、いくつかのグループは、げっ歯類、ウサギ、およびブタのモデルでBSCBの破壊が成功したと報告しています10,11,12。全体として、この技術への関心は急速に高まっており、特に薬物送達の実行可能な手段として注目されています。
このプロトコルでは、ラットモデルにおけるLIBU媒介BSCB破壊の手法が説明されています。この手順には、動物の調製、LIFU機器のセットアップ、MB投与、標的の局在化、および脊髄抽出の詳細な説明が含まれます。標的の局在とBSCB破壊の確認は、エバンス青色素(EBD)による脊髄への血管外漏出によって評価されます。EBDは血清アルブミンに結合する無毒性の化合物であり、目視では濃い青色、顕微鏡下では赤色の自家蛍光で識別できます13。
ここにリストされているステップは従来の超音波(米国)または磁気共鳴(MR)ガイド下LIFUシステムへの速く、安価な代わりを提供する。その結果、この方法は、追加の機器や材料を入手したり、薬物送達、免疫調節、神経調節などの脊髄でのLIFUアプリケーションを追求したりする前に、LIFUトランスデューサーのターゲティングおよびBSCB破壊能力を迅速にテストおよび確認することに関心のある研究者に役立ちます。
プロトコル
すべての動物実験は、ジョンズ・ホプキンス大学動物実験委員会(IACUC RA20M223)に従って承認され、実施されました。本研究では、Sprague-Dawley雌ラット(平均体重:250 g、年齢:11週間)のみを使用しました。
1.低強度集束超音波の組み立てとセットアップ
- ラットでBSCB開口を達成するのに十分な仕様の集束超音波トランスデューサーシステムを入手します。文献から推奨されるパラメータには、0.25〜4 MHzの中心周波数と、0.2〜2.1 MPa、10、14、15、16、17の間のピーク圧力を生成する能力が含まれます。システムに駆動/制御機器(少なくとも波/信号発生器、無線周波数(RF)駆動/電力増幅器、およびマッチングネットワークが含まれていることを確認します(図2A)。
注:ここで説明するセットアップでは、中心周波数250 kHz、直径64 mmの市販の多振動子型探触子を使用します(図2B)。 - 3Dプリントしたプローブホルダーとウォーターコーンをトランスデューサーに取り付けます(図2C)。コーンとトランスデューサーの間の水密シールを確保してください。
注:カスタムコーンとプローブホルダーは、この実験で使用したトランスデューサーに付属しています。コーンとプローブホルダーは、ネジでトランスデューサに固定されていますが、これも付属しています。 - 厚さ50μmの音響透過性ポリエステルメンブレンを滅菌し、輪ゴムを使用してウォーターコーンの底に貼り付けます。
- 入口と出口のチューブを使用して、脱気および脱イオン水でウォーターコーンを満たします。コーン内の気泡は、探触子とターゲットの間の音響結合を乱す可能性があるため、避けるように注意してください。ポリエステルメンブレンは少し膨らませる必要があります。
注意: コーンから気泡を取り除くには、入口バルブからコーンに水を入れながら、気泡を出口バルブに導きます。小さな気泡が多数ある場合は、すべてのバルブを閉じ、大きな気泡が1つ残るまで円錐を回転させます。この気泡を出口バルブに導き、コーンの充填を再開します。 - 波動発生器とRF駆動アンプを含む駆動機器をトランスデューサーに接続します。トランスデューサケーブルはマッチングネットワークの出力側に接続し、信号発生器/パワーアンプはマッチングネットワークの入力側に接続します。ケーブルは、対応するチャネル番号に接続する必要があります(図2D-G)。
注:この研究で使用した商用システムでは、波動発生器とRF駆動アンプはトランスデューサの電力出力(TPO)のコンポーネントです(図2D)。 - プローブホルダーを定位アームに取り付けます。定位アームを固定プレートアセンブリに取り付けます。これにより、超音波処理中にトランスデューサーをげっ歯類の上に正確に配置することができます。
2.動物の調製と外科的椎弓切除術
- イソフルランと医療用空気の混合物でラットを、木炭フィルターキャニスターに取り付けられた誘導チャンバーで麻酔します。麻酔導入のために、ガス流量を400 mL / minに設定し、イソフルラン気化器を1.5%〜2.5%に設定します。完全な鎮静の前にチャンバーで費やされる時間はさまざまですが、通常は3〜6分の範囲です。.
- 鎮静したラットの体重を記録し、つま先をつまむテストを実行します。つまみに反応してけいれんや動きが観察された場合は、ラットをさらに1分間誘導チャンバー内に戻し、つま先のつまみテストを繰り返します。ラットが完全に麻酔されていることを確認するために、必要に応じて繰り返します。.
- 加熱パッドと滅菌吸収パッドを固定プレートに置きます。ラットを吸収パッドの上に置き、眼軟膏を塗布し、直腸体温計を置いて体温を監視します。
注:外科的処置の間、ラットの体温と心拍数を監視する必要があります(理想的には、心拍数は330〜480 bpm、温度は35.9〜37.5°Cである必要があります)18,19。イソフルランまたは加熱パッドを適宜調整して、早期死亡を防ぎます。加熱パッドは37°C前後の温度に設定でき、最適な体温を維持するために必要に応じてオンとオフを切り替える必要があります。 - 第13胸椎(T13)の脊椎に付着しているラットの最後の肋骨を触診します。電気カミソリを使用して、最後の肋骨と首の間の背側表面の毛皮を剃ります。露出した皮膚を10%ヨードポビドンに浸したガーゼで拭きます。
- 虹彩はさみを使用して正中線切開を作成し、棘突起と椎弓が露出するまで筋膜を解剖します。脊髄が露出するまで、オフセットボーンニッパーと角度付きブレードアイリスハサミで骨を取り除きます20。椎弓切除術と切開の長さは、超音波処理されるさまざまなターゲットの数によって異なります。この研究では、3cmの切開を使用して3段階の椎弓切除術が行われました。
注意: 怪我を防ぐために、骨を取り除くときは脊髄に触れたり、脊髄に圧力をかけたりしないでください。椎弓切除術中にラットの後肢がけいれんする場合は、臍帯または神経根に過度の力がかかりすぎます。 - 椎弓切除術に隣接する有棘突起をクランプすることにより、ラットを固定プレートに固定します。クランプをロックする前に、背骨を少しぴんと張って湾曲を最小限に抑えます。
3. レーザー誘導によるターゲット位置推定
- トランスデューサーの位置を定位アームで調整し、椎弓切除術の真上に位置するようにします(図3A)。フレームは、x軸、y軸、z軸の動き、垂直面での180°回転、水平面での360°回転を可能にします。
- ウォーターコーンの底にレーザー装置を取り付け、レーザーポイントが見えるまで下げます。レーザーポイントがBSCB破壊のターゲットである位置より上になるまで、探触子の横方向の位置を調整します(図3B、C)。
メモ: レーザー装置のコンピューター支援設計 (CAD) ファイルは、補足セクションに含まれています (補足図 1)。 - レーザー装置を取り外し、コーンと脊髄の間の空間を脱気した超音波ゲルで満たします(図3D)。カップリングを最大にするには、ゲル内に気泡がないことを確認してください。
注:この研究では、ウォーターコーンを取り付けたトランスデューサーを、コードから1cm上に位置するまで下げました。ウォーターコーンの長さは30mmだったので、探触子からコードまでの総距離は40mmでした。ウォーターコーンを脊髄から1cm離して配置したのは、切開部の両側にあるラットの皮膚、筋膜、筋肉組織が、コーンの先端と脊髄の直接接触を妨げているからである。定位アームのy軸の数字を使用すると、特にゲルによってコーンとコードまでの距離を視覚的に確認することが困難になるため、コーンがコードから1cm離れている垂直距離を追跡するのに役立つ場合があります。 - TPOで超音波処理のパラメータを設定します。BSCBの中断を成功させるために、さまざまな値を使用できます。最大の出力を得るには、超音波処理周波数をトランスデューサーの中心周波数に近づけて設定します。この調査で使用した値を 表1に示します。
注:ここに記載されているパラメータは、げっ歯類の脊髄21を安全に神経調節するために、中心周波数500kHz、トーンバースト持続時間500μs、デューティサイクル50%、超音波処理時間5または10分で、LIFUとの以前の研究から適応されました。BSCB破壊を首尾よく達成した研究に基づいて、使用できる他のパラメータは、500 kHz〜1 MHzの中心周波数、0.2〜2.1 MPaの圧力、10〜25 msのバースト長、および2〜5分の超音波処理時間6,10,11,22です。
| パラメーター | 価値 |
| 周波数 (kHz) | 250 |
| 焦点距離(mm) | 40 |
| 音響ピーク圧力(MPa) | 0.47 |
| デューティサイクル | 40% |
| バースト長 (ミリ秒) | 400 |
| 期間 | 1 |
| 超音波処理時間(分) | 5 |
表1:BSCB破壊に使用される超音波処理パラメータ。
4. マイクロバブル投与
- 製造元の指示に従ってMB溶液を準備します。溶液に空気を入れないでください。
注:MBは壊れやすく、数分間静止させるとバイアル/シリンジの上部近くで固まります。バイアルとシリンジを定期的に振って、MBの不均一な分散を防ぎます。製造元のガイドを参照して、有効期限を確認してください。 - 22 G尾静脈カテーテルを挿入し、0.2 mLのヘパリン化生理食塩水(500 IU / mL)でフラッシュします23。尾静脈カテーテル検査が成功する可能性を高めるには、尾部を温水に浸し、尾部の付け根に止血帯を装着して静脈の直径を拡大します。
注:尾静脈カテーテル検査は、動物の椎弓切除術、ポジショニング、およびターゲティングの前に実施して、研究時間を節約できます。 - 1 mL/kg の 3% EBD をカテーテルに注入します。0.2 mLのヘパリン化生理食塩水で洗い流します。ネズミの四肢と目が青くなります。ラットの背側脊髄静脈の青色の変化をチェックして、尾静脈カテーテル検査が成功したことを確認します(図4)。
注:EBDはMB注射のかなり前に注入することができ、超音波処理に影響を与えません。さらに、食品医薬品局(FDA)は現在、すでにシステム内にある薬物による超音波処理を承認していないため、超音波処理後にEBDを投与することもできます。これにより、色素の取り込みは少なくなりますが、臨床的に関連する可能性があります。 - 0.2 mLのMBボーラスをカテーテルに注入し、0.2 mLのヘパリン化生理食塩水でフラッシュします。MBの注入の1〜2分後に超音波処理を開始します。ここで使用されるセットアップは、リアルタイムの超音波処理フィードバックを収集しません。
注:BSCB破壊の研究では、通常、画像診断で示されるよりも高濃度のMBが使用されます。ラットモデルでBBBおよびBSCB破壊に使用される一般的なMBブランドの濃度には、0.02〜0.2 mL / kgおよび200μLのボーラスが含まれます10、15、24、25。
5.脊髄抽出と組織処理
- 超音波処理の完了後、血液が完全に透明になるまで、ラットに100mLの冷たいリン酸緩衝生理食塩水(PBS)を経心灌流します。染料のために濃い青色である肝臓は、淡い茶色がかった青色に退色するはずです26。
注:灌流の目的は、脊髄の血管系から余分な血液を取り除くことです。EBDはアルブミンに結合するため、過剰なEBDも除去されます。これにより、脊髄で目視または蛍光顕微鏡で検出されるEBDは、脊髄実質への色素の血管外漏出によるものであることが保証されます。 - 100 mLの冷たい4%パラホルムアルデヒド(PFA)を経心灌流します。.ラットの手足は、この固定中に完全に行われると痙攣します。このPFAの灌流はラットを安楽死させます。
- 脊髄を切除し、4%PFAに4°Cで一晩浸します。翌日、PFAをPBSに交換します。
6. BSCBディスラプションの可視化
- かみそりの刃を使用して超音波処理の場所を囲む2cmのセクションを分離します。切片をブレードで正中線に沿って分割し、ミクロトームを使用して切片を厚さ10μmの切片に分割します。明視野の可視化には、ヘマトキシリン-エオシン(H&E)染色で染色します。
注:この研究で示されたH&E脊髄サンプルは、ヘマトキシリンで3分間、エオシンで1分間染色されました27。 - 蛍光顕微鏡では、脊髄切片を含むスライドを脱パラフィンし、封入剤(0.5 μg/mL)に溶解した25 μLの4',6-ジアミジノ-2-フェニルインドール(DAPI)で対比染色します。4°Cで10分以上インキュベートします。漂白を防ぐため、光を避けてください。
注:脱パラフィン処理は、凍結切片を得るためにクライオスタットを使用することで置き換えることができます。 - 蛍光顕微鏡を使用して、すべてのスライドを画像化します。EBD自家蛍光(励起:470 nmおよび540 nm、発光:680 nm)は赤チャンネルに、DAPIは青チャンネルに存在します。光学顕微鏡を使用してH&Eスライドを画像化します。
注:このプロトコルは非生存手順を説明していますが、生存手術技術を使用しても行われました。サバイバル手術では、切開前にヨードポビドンを3回交互に塗布して皮膚を消毒し、手術前にブプレノルフィンを皮下投与(0.05mg/kg)します。術後少なくとも3日間は12時間ごとに皮下ブプレノルフィンを提供し続け、ラットに痛みの兆候が見られる場合はさらに数日かかります。.脊髄損傷が発生すると、ラットは尿閉や異常な歩行を示すことがあります。これは、後肢の引きずったり、動きが遅れたり、触知できる膀胱が膨らんだりします。これが発生した場合は、餌と水分補給のために栄養を強化した水ジェルを飼いネズミに与え、反射排尿が回復するまで1日2回手動で膀胱を搾乳します。後肢の完全な麻痺または難治性の痛みがある場合は、ラットを安楽死させます。
結果
この論文は、LIFU超音波処理とMB投与の同時適用が、局所的なBSCB破壊の効果的な技術であることを示しています。BSCBの開口部は、脊髄実質へのEBD血管外漏出の存在によって示されます。この変化は、目視でも蛍光顕微鏡でも明らかです。脊髄血管系は椎弓切除術後に見え、複数の小さな血管が横方向に放射状に広がる後部脊髄静脈を示しています(図4A)。尾静脈カテーテルからEBDを静脈内注射すると、この血管系が青色色素で強化されます(図4B)。これは、椎弓切除術が脊髄血管系の破裂をもたらさなかったことを確認する手順の良いポイントです。超音波処理後、青色の斑点が標的位置に見えるようになり、BSCB破壊による白色実質へのEBDの血管外漏出を示します(図4C)。このスポットのサイズは、トランスデューサーの焦点領域のサイズや超音波処理後の時間など、多くの要因によって異なります。EBDの血管外漏出が見られる可能性を高めるには、超音波処理と脊髄抜歯の間の時間を長くする必要があります。
PFA灌流は、臍帯抜去およびその後の組織分析の前に実施する必須ステップではありませんが、サンプルから血液を除去し、白い脊椎実質と青色のEBD染色領域の間のコントラストを高めます。MB投与およびLIBU超音波処理を受けたすべてのラットは、脊髄へのEBDの明らかな血管外漏出を示したが、LIBU超音波処理を行わなかったMBおよびEBDを受けた陰性対照群は示さなかった。代表的な画像を 図5に示します。組織を切断する矢状は、EBDの血管外漏出が表面的であるだけでなく、臍帯自体にまで広がっていることを示しています。この研究で使用したトランスデューサーの焦点領域はラットの脊髄の直径よりも大きいため、これは予想されます。時々、矢状状の切り傷に少量の出血が見られることがあります。これは、椎弓切除術または超音波超音波処理が原因である可能性があります。出血が臍帯の背側周辺に近い場合は、椎弓切除術が原因である可能性が高くなります。
EBDの血管外漏出をさらに評価するために、矢状脊髄切片をDAPI(核マーカー)で染色し、蛍光顕微鏡を使用して画像化しました。LIBU超音波処理を受けたすべてのコード(n = 3)は、超音波処理を受けなかったコードよりも有意に高いEBD自家蛍光強度(p = 0.016)を示し、DAPIの強度は両方に等しく存在しました(図6)。H&E分析ではさらに、超音波処理された場所にニューロンの損傷、出血、または空洞病変は存在しないことが明らかになり、この手順の安全性が裏付けられました。外科的誤操作および高出力超音波処理による損傷した臍帯の例が比較として示されている。出血、組織損傷、空洞病変、および空胞化の可能性がラベル付けされます。高出力超音波処理の例では出血は見られませんが、これも超音波破壊の影響として報告されています。
さらに、MB、EBD、およびLIBU超音波処理を受けたラットで行動分析を実施しました。この方法は組織の損傷を完全に排除するわけではありませんが、この手順によって運動障害が発生したかどうかをテストします。ラットを5日間にわたって毎日5分間ケージの中を歩く様子を記録し、Basso Beattie Bresnahanの運動器スケールに基づいて運動機能を等級付けした(補足ビデオファイル1)。すべてのラット(n = 5)は、超音波処理前、超音波処理後、および生存期間の毎日で最高のスコアを受け取りました(図7)。
最後に、この研究で使用された超音波処理パラメータの熱的影響は、2つの ex vivo ラット脊髄サンプルと、細い先端をコードに挿入したデジタル体温計プローブを使用して測定されました。 脊髄サンプルの温度は、超音波処理の前、最中、および超音波処理後の5分間、合計15分間追跡されました。温度変化は最小限にとどまりました。実際、両方のサンプルで超音波処理による≤1.3°Cの変化があり、超音波処理の結果としての高温損傷の可能性が減少しました(図8)。
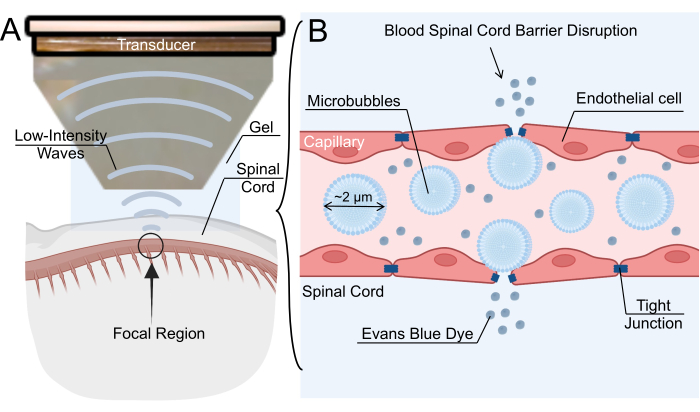
図1:低強度集束超音波媒介血液脊髄バリア開口メカニズム 。 (A)ラット脊髄の低強度焦点式超音波(LIFU)超音波処理の概略図。(B)静脈内マイクロバブル(MB)のLIBU超音波処理による血液脊髄関門(BSCB)の開口メカニズム。MBはLIFUに応答して振動し、内皮細胞間のタイトジャンクションを広げます。このBSCBの破壊により、ナノ粒子、治療薬、またはエバンスブルー色素の血管外漏出が可能になります。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2:低強度集束超音波のベンチトップのセットアップと接続。 (a)典型的な集束超音波成分を示す概略図。(B)以下を含む集束超音波セットアップの概要画像:1.トランスデューサ出力(TPO)、2.マッチングネットワーク、3.LIFEUのトランスデューサー、4。脳定位固定装置、5.移動式クランプ。(C)トランスデューサー、以下を含む:1.プローブホルダー、2.リングトランスデューサー、3.ウォーターコーン、4.ウォーターインレットチューブ、5.ウォーターアウトレットチューブ、6.輪ゴムで固定されたメンブレン。(D)TPOの前面、1.RFシールドエンクロージャ、2.調整可能なメニューを備えたタッチセンシティブフロントディスプレイパネル、3.パラメータ調整用の回転ノブ、4.スタート/ストップ出力スイッチ。(E)TPOの背面には、1.チャネル出力コネクタ、2.アース、3.ソフトウェア制御用USB入力ポート、4.内部トリガー、5.同期出力コネクタ、6.電源入力ジャックと電源、7.オン/オフ電源スイッチが含まれます。(F)ネットワーク出力を一致させ、配線をチャネル番号に一致させます。(G)ネットワークXDR入力を一致させ、配線をチャネル番号に一致させる この 図の拡大版を表示するには、ここをクリックしてください。
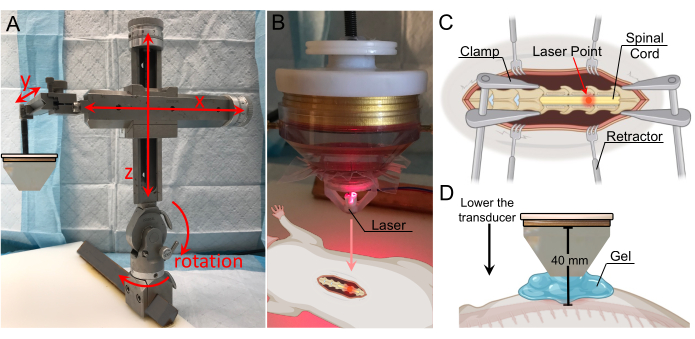
図3:レーザー誘導によるターゲットの位置特定 。 (A)3軸すべての可動域と回転機能を備えた定位アーム。下の固定板に貼付します。(b)焦点領域を識別するためのレーザー装置。レーザーはトランスデューサの先端に配置され、焦点領域と一致します。(C)露出した脊髄上のレーザーを示す図で、トランスデューサの焦点領域が現在この場所に向けられていることを示す。(D)コーンの先端がコードから1 cm上に位置するまでトランスデューサーを下げ、ギャップをゲルで埋めて最大の結合を確保します。トランスデューサーから脊髄までの距離は40mm(焦点距離)です。 この図の拡大版をご覧になるには、ここをクリックしてください。
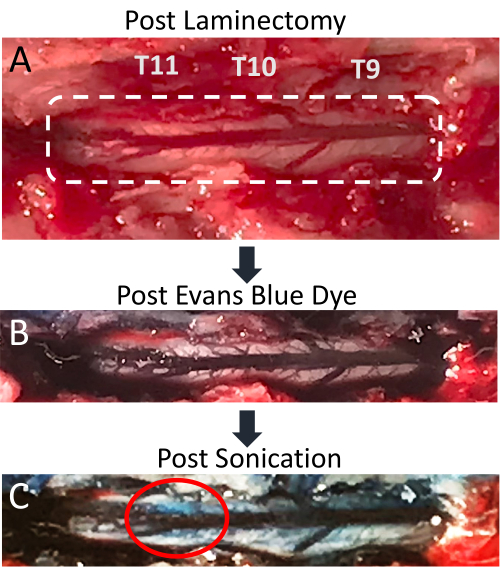
図4:超音波処理後の脊髄におけるEvans青色染料の血管外漏出 。 (A)T9-T11ラット椎弓切除術切開部の写真で、露出した脊髄と後背静脈がはっきりと見えます。(B)エバンスブルー色素(EBD)の静脈内注射後、周囲の組織と脊髄血管系が青色になります。(C)超音波処理部位の脊髄実質へのEBD血管外漏出、BSCB破壊が発生したことを示す。 この図の拡大版をご覧になるには、ここをクリックしてください。

図5:灌流後のBSCB開口部の脊髄抽出と可視化。 (A)LIFU処理を行わずに対照ラットから脊髄を切除した。このラットはMBとEBDのみを受けました。パラフィンに埋め込まれた臍帯の矢状中央部スライスが挿入図に示されており、EBDの血管外漏出は見られません。(B)LIFU処理によるラットの脊髄切除。このラットはMBとEBDも受けました。EBDの血管外漏出の列は目に見え、超音波処理された領域に局在しています。パラフィンに埋め込まれたコードの矢状中央スライスが挿入図に示され、超音波処理された場所の内側に見えるEBD濃度を指す矢印があります。 この図の拡大版をご覧になるには、ここをクリックしてください。
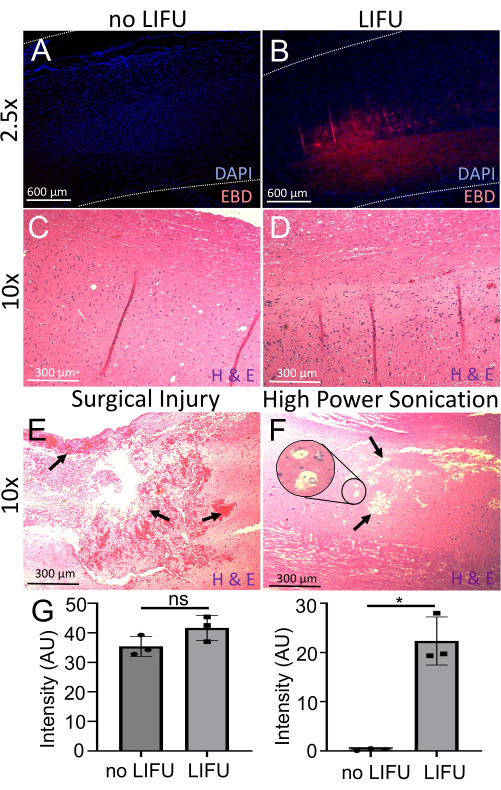
図6:BSCB開口部の検出と評価。 (A)DAPI(核マーカー、青)で染色された脊髄。最小限のEBD自家蛍光(赤)が見られます。このラットはLIFUを受け取らなかった。(B)DAPI(核マーカー、青色)で染色された脊髄。超音波処理された標的位置での局所的なEBD自家蛍光(赤)が見える。(C)ヘマトキシリン(核酸染色)およびエオシン(非特異的タンパク質染色)で染色されたLIFUのないラットの脊髄(H&E)。神経細胞の損傷、出血、または空洞病変は見られません。(D)H&Eで染色されたLIFUラットの脊髄。 神経細胞の損傷、出血、または空洞病変は見られません。(E)H&Eで染色された外科的損傷を受けたラットの脊髄。 矢印は、十分な出血と組織損傷を示しています。(F)H&Eで染色された高出力超音波処理による損傷を受けたラットの脊髄。 矢印は空洞病変を指し、挿入図は空胞化の可能性を示しています。(G)LIBU超音波処理の有無にかかわらず、ラットの脊髄におけるDAPIおよびEBDの強度を示す棒グラフ。同様のDAPI強度(p > 0.05)にもかかわらず、ネガティブコントロール(p = 0.016)と比較して、LIFU脊髄のEBD強度が有意に高くなっています。この図の拡大版をご覧になるには、ここをクリックしてください。
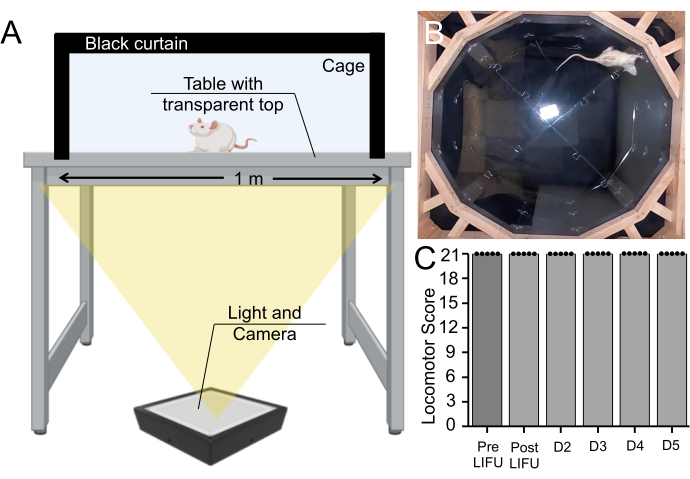
図7:超音波処理前および超音波処理後の行動アッセイ。 (A)バッソ、ビーティー、ブレスナハンの装置セットアップで、ラットが下から5分間歩く様子が記録された。(B)録画した動画の静止画。このビデオは、ラットの運動協調と歩行をバッソ、ビーティー、ブレスナハンスケールで評価するために使用されました。(C)箱ひげ図(n = 5)は、MBおよびLIBU治療を受けたラットにおいて、超音波処理前、超音波処理後、または5日間の生存期間中に運動スコアに変化がないことを示す(p > 0.05)。この図の拡大版をご覧になるには、ここをクリックしてください。

図8: ex vivo 脊髄を用いた体温分析。 超音波処理前、超音波処理中、超音波処理後の5分間の2つの ex vivo 脊髄サンプルの温度変化を示すグラフ。超音波処理に使用されるパラメータを 表1に示します。サンプル1の場合、超音波処理前、超音波処理中、超音波処理後の平均温度は、それぞれ21.9°C±0.1°C、22.1°C±0.1°C、および22.0°C±0.1°Cでした。サンプル2の場合、超音波処理前、超音波処理中、超音波処理後の温度は、それぞれ21.9°C±0.1°C、22.5°C±0.3°C、および22.4°C±0.2°Cであった。 この図の拡大版をご覧になるには、ここをクリックしてください。
補足図1:レーザー照準装置のCADファイル。 (A)レーザー装置を下から見た図。中央の穴には、どんなレーザーでも配置できます。(B)レーザ装置の側面図。(C)レーザー装置の寸法(単位はインチ)。 このファイルをダウンロードするには、ここをクリックしてください。
補足ビデオファイル1:バッソ、ビーティー、ブレスナハン装置の中を歩くネズミのビデオ。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここでは、マイクロバブル(MB)投与と組み合わせた低強度焦点式超音波(LIFU)を使用して、効果的で標的を絞ったBSCB破壊に必要な機器および手順について説明します。このプロトコルは柔軟性があり、さまざまな仕様のトランスデューサでの個々の使用に最適化できます。LIBU媒介性BSCB破壊のための他の技術は、高価なリソースである標的位置特定のための磁気共鳴画像法(MRI)ガイド下システムの使用に依存している16。ここで紹介する技術の利点は、BSCBの破壊をリアルタイムで視覚的に確認できることと、手順がオープンであることによるターゲティングの容易さにあります。さらに、レーザー装置は使いやすく、構築も簡単で、補足セクションにはCADファイルが含まれています。その結果、小動物モデルでLIFUトランスデューサのターゲティング能力に関する初期テストを実施することに関心のある研究者は、このプロトコルをツールとして使用して、関心のある場所上の焦点ゾーンの位置をすばやく確認できます。この手法は、USシステムやMRシステムなどのより複雑なガイダンスモダリティに投資する前に、薬物送達などのLIFUの臨床応用を研究し始めるラボでも使用できます。現在、米国主導のモダリティは、MRシステムと比較してより有望で費用対効果の高い経路を示していますが、後者の方が文献でより頻繁に見られます。
この手順には、BSCBの中断を成功させるために慎重に実行する必要があるいくつかの重要なステップがあります。外科的椎弓切除術中に脊髄に不必要な圧力をかけないようにすることが不可欠です。コードを物理的に操作しすぎると、BSCBが損傷する可能性が高くなります。損傷は、出血とEBDの血管外漏出の増加により、抜歯後の臍帯の内側に暗褐色の斑点として現れます。さらに、トランスデューサーと露出した脊髄の間で最大の結合を確保する必要があります。そのため、ウォーターコーンや超音波ゲルから気泡を取り除くように注意する必要があります。音波を完全に伝達するために、ウォーターコーンの底とコードの間に隙間があってはなりません。尾静脈カテーテル検査中は、ヘパリン処理した生理食塩水、EBD、またはMB溶液と一緒に誤って空気を通過させないようにする必要があります。空気の注入は、処置の終了前にげっ歯類の死をもたらす肺塞栓症の可能性を大幅に高めます28。
この手順で発生する可能性のある一般的な問題は、EBD 注入が成功しないことです。尾静脈カテーテル法の経験がほとんどない人の場合、動物の椎弓切除術、ポジショニング、またはターゲティングの前にこのステップを実行すると、時間を節約できます。EBDは、超音波処理に影響を与えることなく、MB注射のかなり前に注入することもできます。このプロトコルで提案されている止血帯と温水浴を利用すると、尾静脈を拡張し、成功率を高めるのに役立ちます。さらに、ラットの脱水症状は、正しいカテーテル留置の可能性を低下させます。尾静脈カテーテル法の10〜15分前に腹腔内生理食塩水を注射すると役立つ場合があります。.カテーテル挿入中は、尾端から2インチ上から開始し、尾側から頭蓋方向に移動する必要があります。反対方向に動くと、静脈の虚脱や出血の可能性により、成功の可能性が低くなります。
別の一般的な課題は、超音波処理にもかかわらずEBDの血管外漏出の欠如です。これは、超音波処理に使用されているパラメータがBSCB破壊には不十分であることを示している可能性があります。例えば、超音波処理周波数がトランスデューサの中心周波数と大きく異なる値に設定されている場合、超音波処理電力が低すぎてMBを発振させ、タイトジャンクションの緩みを引き起こします。さらに、トランスデューサーとコードの間の界面が多いほど(例えば、水円錐、膜、ゲル、水/ゲル中の気泡)、ターゲットでの真の超音波処理強度は低くなります。脱気したゲルを使用し、コーン内の気泡を完全に除去するなど、これらの界面を最小限に抑えることは、超音波処理の可能性を最大限に伝達するのに役立ちます。プロトコルはまた、脊髄実質へのEBDの血管外漏出のためのより多くの時間を可能にするために、超音波処理と灌流の間の時間を増やすことを奨励しています。BSCBの中断は一時的な手順ですが、ギャップは閉じる前に数時間存在します。待ち時間が長いと、イソフルランへの曝露が増加しますが、臍帯のEBD血管外漏出も大きくなります。あるいは、LIBUによる超音波処理がないにもかかわらず、EBDの血管外漏出が存在する可能性があります。この問題をトラブルシューティングするには、椎弓切除術中にBSCBへの偶発的な損傷を防ぐために注意を払う必要があります。考えられる解決策としては、クランプ中にラットの脊椎を持ち上げて椎弓と臍帯の間のスペースを増やすことや、椎弓切除術を短くすることなどが挙げられます。また、徹底的なPFA灌流は、脊髄内の血管系からEBDに富む血液を除去することにより、バックグラウンド染色を減少させます。経心灌流中は、PBSまたはPFAの漏出につながる可能性のある心臓の偶発的な破裂を防ぐように注意する必要があります。
この研究は、LIFUが媒介するBSCB破壊の単一の施設の経験を表していることに注意することが重要です。さらに、このプロトコルは、さまざまな超音波処理エネルギーパラメータおよびMB濃度をテストまたは最適化しません。その結果、研究者は、特に最初の結果が悪影響をもたらす場合、特定の研究ニーズに合わせてターゲットの局在化とBSCBの破壊を最適化するために、この技術を実行する際にさまざまなパラメーターと濃度を調査することが奨励されます。たとえば、温度変化を望まないグループは、この基準を満たし、十分なBSCB破壊を達成するセットが見つかるまで、さまざまなパラメータをテストできます。さらに、この技術の安全性を確認するために、追加の実験を行うことができます。例えば、サンプルサイズを大きくしたり、生存期間を延ばしたり、筋電図や歩行分析の研究を行ったりすることができます。より長い生存のためには、いくつかの研究が高用量のEBDが慢性的な全身毒性を引き起こす可能性があることを示しているため、低用量が賢明である可能性があることを心に留めておくことが重要です29。
この手順の別の制限は、椎弓切除術の侵襲的な性質です(超音波が骨を貫通できないため、BSCB開口部にLIBUを使用する技術に必要です)。この手順の侵襲的な性質は、椎弓切除術の長さを制限することによって減らすことができます。短くて薄い上部胸椎に椎弓切除術を行うことで、椎弓切除術に必要な時間を10分未満に短縮できます。MBは壊れやすく、半減期も短いため、このプロトコルでは時間が限られています。MBの注射は、LIBUによる治療の1〜2分前に行う必要があり、複数のLIBU処理が行われている場合は、すべての超音波処理の前に新しいMBを投与する必要があります。複数のラットのBSCB破壊を含む実験では、数MBバイアルを準備する必要がある場合があります。マイクロバブルは高価であるため、超音波処理の間隔を最小限にするように外科ワークフローを変更することは、使用されるMB数を節約するために好ましい。
ここで説明する手法は、主に研究プロトコルとして使用するためのものです。レーザー照準装置は、すべての臨床現場において従来の照準モダリティに取って代わるものではないが、他の状況では有用であり得る。非侵襲的手術の場合、従来のMRIモダリティを使用して30をターゲットにすることができます。実施される椎弓切除術を含む侵襲的手術の場合、このプロトコルに記載されるレーザーポイント装置は、薬物送達または免疫調節療法の目的で、特定の領域(例えば、腫瘍または脊髄損傷部位)にわたる超音波処理の焦点ゾーンの中心を迅速に局在化するために使用され得る。
全体として、このプロトコルは、BSCB破壊のための効果的で成功した技術を説明し、リアルタイムと後処理の両方でBSCBの開口部を確認するためのいくつかのオプションが含まれています。BSCBは脊髄実質への侵入障壁として機能しているため、BSCBの破壊は治療薬の送達を改善するための可能な方法です。例えば、Weber-Adrianらは、頸椎への遺伝子送達を媒介するために、周波数1.114MHz、バースト長10msのLIFUを用いた6。同様に、Smithらは、周波数が580kHz、平均音響ピーク圧力が約0.46MPa、バースト長が10msのLIFUが、髄膜転移のげっ歯類モデルにおいて、モノクローナル抗体であるトラスツズマブの脊髄への送達に役立つことを示しました10。 ほとんどの研究は、LIBUの利用に焦点を当てています。 HIFUではなく、下にある組織への損傷を回避しながらBSCBを一時的に透過させるLIBUの能力によるものです。通常、LIFUは0.125〜3 W / cm 2の強度を使用しますが、HIFUは100〜10,000 W / cm2以上の強度を使用します31。その結果、HIFUは主に組織の加熱によってその効果を発揮しますが、LIVUはMBの同時投与により、機械的キャビテーション効果によって機能します。MBと治療薬の同時投与は、脊髄実質への薬物の血管外漏出の増加をもたらすだけでなく、MBに薬物をロードし、標的薬物送達のために超音波でMBを溶解する可能性があります。
この研究で使用される超音波処理パラメータ、MB濃度、およびトランスデューサーの種類は、実験の必要性に基づいて変更できます。例えば、局所的なターゲティングよりも高度な制御が必要な実験には、焦点領域が小さいトランスデューサが適しており、より短い時間で強力な破壊を必要とする実験には、より高い出力のトランスデューサを使用することができます。このプロトコルが提供する柔軟性により、前臨床、臨床、およびトランスレーショナル研究での使用に大きな可能性があります。
開示事項
著者らは、この研究は、潜在的な利益相反と解釈される可能性のある商業的または金銭的関係がない状態で実施されたと宣言しています。Amir Manbachiは、BK Medical(GE Healthcare)、Neurosonics Medicalで教鞭を執り、コンサルティングを行っており、特許出願中の多くのFUS技術の発明者でもあります。ベティ・タイラーはNIHから研究資金を受けており、Accelerating Combination Therapies(エクイティまたはオプションを含む)の共同所有者です。Ashvattha Therapeutics Inc.は、彼女の特許の1つをライセンス供与しており、Peabody Pharmaceuticalsの株主でもあります。Nicholas Theodore は Globus Medical からロイヤリティを受け取り、Globus Medical の株式を所有しています。彼はGlobus Medicalのコンサルタントであり、Globus Medicalの科学諮問委員会やその他のオフィスに所属しています。残りの著者には、開示すべき利益相反はありません。
謝辞
T32GM136577(DR)によってサポートされています。N660012024075(N.T.、N.V.T.、A.M.、K.K.L.);R01 HL139158-01A1 および R01 HL071568-15 (N.V.T.);ジョンズホプキンスICTR臨床研究奨学生プログラム(KL2)(午前)。BioRender.com で作成されたいくつかのフィギュア。
資料
| Name | Company | Catalog Number | Comments |
| 0.9% Heparinized Sodium Chloride | Baxter | FKB0953G | Flush tail vein catheter with heparinized saline to prevent clotting. |
| 100 mL Luer Lock Tip Syringe (2) | Wilburn Medical | WUSA/120 | One syringe can be used to inject PBS and one for PFA (during transcardial perfusion) |
| 1x Phosphate buffered saline (PBS) | Thermo Scientific | 10010001 | For transcardial perfusion. |
| 22 G catheter | Med Vet International | 50-209-1694 | Use to place a tail vein catheter. |
| 97% Isoflurane | Thermo Scientific Chemicals | 247-897-7 | While rat is under isoflurane, be careful not to administer too much. A high dose can euthanize the rat. |
| Betadine 7.5% | Purdue Products | 4677 | |
| Class A clear threaded glass vial | Fisherbrand | 14-955-314 | Use to store spinal cord extraction. |
| Digital balance scale | Kent Scientific | SCL-4000 | |
| Electric razor | Wahl Home Products | 79449-200 | Shave fur off skin at incision site before surgery |
| Eosin-Y with Phloxine | Epredia | 71304 | |
| Evans blue dye | MP Biomedicals | 02151108-CF | Although it is non-toxic, it will stain skin blue if direct contact occurs. |
| Fixation Plate Assembly with 0.5 mm Forceps | PSI Impactors | 7001-2 | Affix the stereotactic arm to this frame |
| Gauze | Fisherbrand | 13-761-52 | |
| Heating pad | Kent Scientific | RT-0515 | |
| Hematoxylin | Epredia | 7211 | |
| Iris Scissors with Angled Blades | ProDentUSA | 12-15315 | |
| Isoflurane induction system | Kent Scientific | SOMNO-RATKIT | |
| Laser targetting apparatus | NA | custom | CAD design file provided in supplemental section. Simply place a laser inside the apparatus created from the file. |
| Lubricating eye ointment | Systane | N/A | |
| Luer Lock 3-Way Stopcock | Sigma | SAS7521-10EA | Can use to fill water cone through inlet valve |
| Lumason microbubbles kit | Bracco | 0270-7099-16 | |
| Microscope cover glass | Fisherbrand | 12-545J | |
| Microscope slides | Fisherbrand | 12-550-15 | |
| Microtome | Epredia | 23-900-671 | |
| Mounting medium with 4',6-diamidino-2-phenylindole (DAPI) | Vector Laboratories | H-2000-2 | |
| Mylar membrane | Chemplex | 3016 | Can cut membrane to appropriate size if too large for cone |
| NeuroFUS 2.52" diameter 250 kHz transducer | Sonic Concepts | CTX-250 | Transducer system includes custom water cone and probe holder |
| NeuroFUS PRO v2.0 system | Sonic Concepts | NFS102v2 | Includes Transducer Power Output, Matching Network and associated cables |
| Offset Bone Nippers | Fine Science Tools | 16101-10 | Use to remove spinous processes and laminae for laminectomy |
| Paraffin | Polysciences | 24364-1 | Can place spinal cord sample in paraffin to slice into thin sections for histology. |
| Paraformaldehyde (4%) | Thermo Scientific | J61899-AK | For transcardial perfusion. |
| Rat Surgical Kit | Kent Scientific | INSRATKIT | Consists of tweezer #5, needle holder, McPherson-Vannas scissors, Iris scissors, ALM self-retaining retractors, Iris forceps, and blunt probe. These products should be sufficient to perform a laminectomy. |
| Razor blade | Fisherbrand | 12-640 | Use to cut spinal cord extraction to desirable length and split section down midline. |
| Rectal thermometer | Kent Scientific | RET-2 | Maintain rat temperature between 35.9–37.5 °C |
| Rubber band | Fisherbrand | 50-205-1983 | |
| Single animal vaporizer unit | Kent Scientific | SF-01 | |
| Stereotactic arm | Kopf Instruments | Model 963 | |
| Sterile absorbent pad | McKesson | 4033-CS150 | Place under rat and above heating pad and fixation plate before laminectomy |
| Ultrasound gel | Aquasonic | PLI 01-34 | Ensure gel is free of bubbles to the best of your ability. |
参考文献
- Chopra, N., et al. Blood-spinal cord barrier: Its role in spinal disorders and emerging therapeutic strategies. NeuroSci. 3 (1), 1-27 (2021).
- Bartanusz, V., Jezova, D., Alajajian, B., Digicaylioglu, M. The blood-spinal cord barrier: morphology and clinical implications. Annals of Neurology. 70 (2), 194-206 (2011).
- Hersh, A. M., Alomari, S., Tyler, B. M. Crossing the blood-brain barrier: Advances in nanoparticle technology for drug delivery in neuro-oncology. International Journal of Molecular Sciences. 23 (8), 4153 (2022).
- Pan, W., Banks, W. A., Kastin, A. J. Permeability of the blood-brain and blood-spinal cord barriers to interferons. Journal of Neuroimmunology. 76 (1-2), 105-111 (1997).
- Bellettato, C. M., Scarpa, M. Possible strategies to cross the blood-brain barrier. Italian Journal of Pediatrics. 44, 131 (2018).
- Weber-Adrian, D., et al. Gene delivery to the spinal cord using MRI-guided focused ultrasound. Gene Therapy. 22 (7), 568-577 (2015).
- Hersh, A. M., et al. Applications of focused ultrasound for the treatment of glioblastoma: A new frontier. Cancers. 14 (19), 4920 (2022).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Cho, H., et al. Localized down-regulation of P-glycoprotein by focused ultrasound and microbubbles induced blood-brain barrier disruption in rat brain. Scientific Reports. 6, 31201 (2016).
- Smith, P., Ogrodnik, N., Satkunarajah, J., O'Reilly, M. A. Characterization of ultrasound-mediated delivery of trastuzumab to normal and pathologic spinal cord tissue. Scientific Reports. 11 (1), 4412 (2021).
- Montero, A. S., et al. Ultrasound-induced blood-spinal cord barrier opening in rabbits. Ultrasound in Medicine & Biology. 45 (9), 2417-2426 (2019).
- Fletcher, S. P., Choi, M., Ogrodnik, N., O'Reilly, M. A. A porcine model of transvertebral ultrasound and microbubble-mediated blood-spinal cord barrier opening. Theranostics. 10 (17), 7758-7774 (2020).
- Honeycutt, S. E., O'Brien, L. L. Injection of Evans blue dye to fluorescently label and image intact vasculature. BioTechniques. 70 (3), 181-185 (2021).
- Fletcher, S. P., Choi, M., Ramesh, R., O'Reilly, M. A. Focused ultrasound-induced blood-spinal cord barrier opening using short-burst phase-keying exposures in rats: A parameter study. Ultrasound in Medicine & Biology. 47 (7), 1747-1760 (2021).
- Cross, C. G., et al. Technical note: Quantification of blood-spinal cord barrier permeability after application of magnetic resonance-guided focused ultrasound in spinal cord injury. Medical Physics. 48 (8), 4395-4401 (2021).
- Hong, Y. R., et al. Ultrasound stimulation improves inflammatory resolution, neuroprotection, and functional recovery after spinal cord injury. Scientific Reports. 12 (1), 3636 (2021).
- Liao, Y. H., et al. Low-intensity focused ultrasound alleviates spasticity and increases expression of the neuronal K-Cl cotransporter in the L4-L5 sections of rats following spinal cord injury. Frontiers in Cellular Neuroscience. 16, 882127 (2022).
- Redfors, B., Shao, Y., Omerovic, E. Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Laboratory Animals. 48 (1), 6-14 (2014).
- Lillie, L. E., Temple, N. J., Florence, L. Z. Reference values for young normal Sprague-Dawley rats: weight gain, hematology and clinical chemistry. Human & Experimental Toxicology. 15 (8), 612-616 (1996).
- Lin, X. J., et al. Spinal cord lateral hemisection and asymmetric behavioral assessments in adult rats. Journal of Visualized Experiments. (157), e57126 (2020).
- Tsehay, Y., et al. Low-intensity pulsed ultrasound neuromodulation of a rodent's spinal cord suppresses motor evoked potentials. IEEE Transactions on Biomedical Engineering. , (2023).
- Payne, A. H., et al. Magnetic resonance imaging-guided focused ultrasound to increase localized blood-spinal cord barrier permeability. Neural Regeneration Research. 12 (12), 2045-2049 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. Journal of Visualized Experiments. (146), e59295 (2019).
- Sabbagh, A., et al. Opening of the blood-brain barrier using low-intensity pulsed ultrasound enhances responses to immunotherapy in preclinical glioma models. Clinical Cancer Research. 27 (15), 4325-4337 (2021).
- Dréan, A., et al. Temporary blood-brain barrier disruption by low intensity pulsed ultrasound increases carboplatin delivery and efficacy in preclinical models of glioblastoma. Journal of Neuro-Oncology. 144 (1), 33-41 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Yamamoto, H., Imai, S., Okuyama, T., Tsubura, Y. Pulmonary lesions in rats caused by intravenous injection. Acta Pathologica Japonica. 32 (5), 741-747 (1982).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Scientific Reports. 9 (1), 321 (2019).
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved