Method Article
نماذج الماوس المهندسة بالجينوم الجسدي باستخدام الحقن المجهري في الجسم الحي والتثقيب الكهربائي
In This Article
Summary
يصف هذا البروتوكول الحقن المجهري والتثقيب الكهربائي في الجسم الحي لتحرير الجينوم بوساطة كريسبر المقيدة إقليميا في قناة بيض الفأر.
Abstract
قدمت نماذج الفئران المعدلة وراثيا (G-GEMMs) نظرة ثاقبة قيمة حول وظيفة الجينات في الجسم الحي في التطور والتوازن والمرض. ومع ذلك ، فإن الوقت والتكلفة المرتبطة بإنشاء المستعمرة وصيانتها مرتفعان. سمحت التطورات الحديثة في تحرير الجينوم بوساطة كريسبر بتوليد GEMMs الجسدية (S-GEMMs) من خلال الاستهداف المباشر للخلية / الأنسجة / العضو محل الاهتمام.
تعتبر قناة البيض ، أو قناة فالوب في البشر ، نسيج المنشأ لسرطان المبيض الأكثر شيوعا ، سرطان المبيض المصلي عالي الدرجة (HGSCs). تبدأ HGSCs في منطقة قناة فالوب البعيدة عن الرحم ، وتقع بجوار المبيض ، ولكن ليس قناة فالوب القريبة. ومع ذلك ، فإن نماذج الماوس التقليدية من HGSC تستهدف قناة البيض بأكملها ، وبالتالي لا تلخص الحالة البشرية. نقدم طريقة للحقن المجهري لمحلول الحمض النووي أو الحمض النووي الريبي أو البروتين النووي الريبي (RNP) في تجويف قناة البيض والتثقيب الكهربائي في الجسم الحي لاستهداف الخلايا الظهارية المخاطية في المناطق المحظورة على طول قناة البيض. هناك العديد من المزايا لهذه الطريقة لنمذجة السرطان ، مثل 1) قدرة عالية على التكيف في استهداف المنطقة / الأنسجة / العضو ومنطقة التثقيب الكهربائي ، 2) مرونة عالية في أنواع الخلايا المستهدفة (المرونة الخلوية) عند استخدامها مع محفزات محددة لتعبير Cas9 ، 3) مرونة عالية في عدد الخلايا الكهربائية (تردد منخفض نسبيا) ، 4) لا يلزم وجود خط فأر محدد (نمذجة الأمراض ذات الكفاءة المناعية) ، 5) مرونة عالية في تركيبة الطفرات الجينية ، و 6) إمكانية تتبع الخلايا الكهربائية عند استخدامها مع خط مراسل Cre. وبالتالي ، فإن هذه الطريقة الفعالة من حيث التكلفة تلخص بدء الإصابة بالسرطان البشري.
Introduction
قناة فالوب ، التي تسمى قناة البيض في الفئران ، هي بنية أنبوبية تربط الرحم بالمبيض. يلعب دورا أساسيا في تكاثر الثدييات ، حيث يوفر البيئة للتخصيب الداخلي وتطوير ما قبل الزرع1،2. على الرغم من أهميته ، لا يعرف سوى القليل عن وظيفته وتوازنه ، ويرجع ذلك جزئيا إلى تطوير تقنيات الإخصاب في المختبر للتحايل على أي مشكلة تتعلق بالعقم تتعلق بهذا العضو3. ومع ذلك ، فقد تم الاعتراف بأن الآفات السابقة للتسرطن لسرطان المبيض المصلي عالي الدرجة (HGSC) ، وهو نمط نسيجي عدواني لسرطان المبيض يمثل حوالي 75٪ من سرطان المبيض و 85٪ من الوفيات ذات الصلة4 ، تقتصر على ظهارة قناة فالوب البعيدة5،6،7،8. يشير هذا إلى أنه ليست كل الخلايا في أجسامنا معرضة بنفس القدر للإهانات المسرطنة ، بل فقط الخلايا الفريدة / الحساسة في كل نسيج / عضو تصبح خلية المنشأ في السرطان - تسمى الطينة الخلوية9. على هذا المنوال ، تبين أن الخلايا الظهارية لقناة فالوب البعيدة ، الواقعة بجوار المبيض ، تختلف عن بقية الأنبوب10,11. وبالتالي ، فإن نماذج الفئران التقليدية ل HGSC ، التي تستهدف جميع الخلايا في قناة البيض ، لا تلخص الحالة البشرية. في دراسة حديثة ، استخدمنا مزيجا من تحرير الجينوم بوساطة كريسبر ، والتثقيب الكهربائي لقناة البيض في الجسم الحي ، وتتبع النسب القائم على Cre لتحفيز HGSC بنجاح عن طريق تحور أربعة جينات مثبطة للورم في قناة البيض البعيدةللفأر 12,13. تقدم هذه المخطوطة بروتوكولا خطوة بخطوة يصف هذا الإجراء من الحقن المجهري والتثقيب الكهربائي في الجسم الحي لاستهداف ظهارة الغشاء المخاطي لقناة البيض.
هذه الطريقة لها العديد من المزايا. يمكن تكييفه لاستهداف الأنسجة / الأعضاء الأخرى ، بما في ذلك حمة الأعضاء14. على الرغم من أنه يمكن استخدام مناهج توصيل الجينات الأخرى في الجسم الحي مثل أنظمة الفيروسات العدسية والفيروسات الغدية لتحقيق استهداف مماثل للأنسجة / الأعضاء ، إلا أن منطقة الاستهداف يمكن تعديلها بسهولة أكبر باستخدام أحجام مختلفة من الأقطاب الكهربائية من نوع الملقط للتوصيل القائم على التثقيب الكهربائي. اعتمادا على تركيز الحمض النووي / الحمض النووي الريبي / البروتينات النووية الريبية (RNPs) ، ومعلمات التثقيب الكهربائي ، وحجم الأقطاب الكهربائية ، يمكن تغيير عدد الخلايا الكهربية. علاوة على ذلك ، يمكن استهداف أنواع معينة من الخلايا عند استخدامها مع المحفزات لتعبير Cas9 ، دون الحاجة المطلقة لنماذج الفئران المعدلة وراثيا Germline (G-GEMMs). بالإضافة إلى ذلك ، على عكس أنظمة التوصيل الفيروسي ، يسمح التثقيب الكهربائي بتوصيل بلازميد متعدد إلى خلايا مفردة وقيود أقل في حجم الحمض النووي15. يمكن أيضا إجراء الفحص في الجسم الحي للطفرات الجينية بسهولة نسبية بسبب هذه المرونة العالية. علاوة على ذلك ، يمكن تتبع الخلايا الكهربائية أو تتبعها عند استخدام هذه الطريقة مع خطوط مراسل Cre مثل Tdtomato أو Confetti16,17.
Protocol
تم إيواء الحيوانات في أقفاص عزل دقيقة ثابتة مع قمم مرشحة ، تقع في غرفة مخصصة تحتوي على خزانة للسلامة البيولوجية من النوع الثاني. تم تنفيذ جميع الأعمال الحيوانية وفقا للإرشادات المؤسسية وتمت الموافقة عليها من قبل لجنة رعاية الحيوان بكلية الطب والعلوم الصحية بجامعة ماكجيل (AUP # 7843).
1. إعداد إبرة الحقن المجهري
- اسحب أنبوبا شعريا زجاجيا إلى نقطة حادة باستخدام مجتذب ماصة صغيرة مع البرنامج التالي: P = 500 ، الحرارة = 576 ، PULL = 50 ، VEL = 80 ، DEL = 70.
- باستخدام زوج من ملقط الطرف متناهي الصغر المدبب ، قم بقص الطرف المدبب للأنبوب الشعري المسحوب تحت مجهر تشريح لإنشاء فتحة ، كما هو موضح في الشكل 1 أ ، ب. تأكد من أن الفتحة ليست كبيرة جدا ، لأن هذا سيؤدي إلى إتلاف قناة البيض ومنع الحقن البطيء.
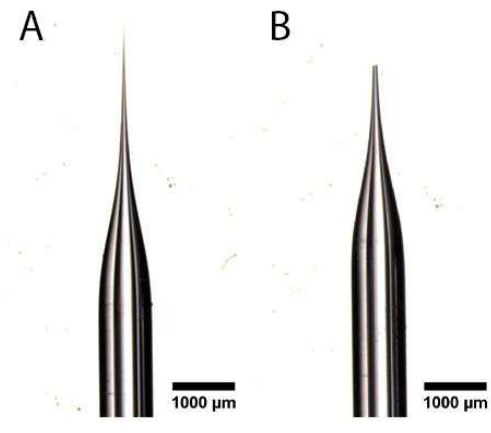
الشكل 1: تحضير إبرة الحقن المجهري. (أ ، ب) أنبوب شعري مسحوب بطرف مدبب (أ) تم قصه لإنشاء فتحة (ب). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تحضير المخدر للحقن داخل الصفاق
- تحضير avertin المصفى والمخفف في يوم الجراحة. يتم تحضير محلول مخزون Avertin (2،2،2-tribromoethanol) بتركيز 1.6 جم / مل في كحول ثلاثي الأميل عن طريق التحريك القوي وتخزينه في الظلام.
- قم بتخفيف محلول مخزون الأفرتين بمحلول ملحي متساوي التوتر بنسبة 1.25٪ v / v إلى تركيز نهائي قدره 20 مجم / مل داخل غطاء الدخان. دوامة الفرتين المخفف وتصفية من خلال مرشح معقم 0.22 ميكرومتر. ابق في الظلام.
3. تجهيز منطقة الجراحة
- يجب أن تكون منطقة الجراحة بيئة معقمة مخصصة ، ويفضل أن تكون مقعدا نظيفا أو خزانة للسلامة البيولوجية. رتب معدات الجراحة المعقمة ، والمجهر ، والمعالج الدقيق ، والكهربائي حسب الحاجة. مثال على ذلك موضح في الشكل 2.
- قم بتسخين وسادة / قرص التدفئة وضعه تحت قفص نظيف ومجهز بالكامل. سيتم استخدام هذا القفص لإيواء الفئران بعد الجراحة.
- صب محلول ملحي معقم 1x فوسفات (PBS) في طبق بتري معقم. استخدم مقصا نظيفا لتقطيع الورق الماص إلى مربعات ، بأبعاد تقريبية تبلغ 1 سم × 1 سم. قم بإسقاط هذه القطع من الورق الماص في 1x PBS لنقعها.
4. تحضير المحلول والإبرة للحقن
- تحضير محلول الحقن في يوم الجراحة. امزج الحمض النووي / الحمض النووي الريبي / RNPs مع التريبان الأزرق المصفى إلى تركيز نهائي لا يقل عن 200 نانوغرام / ميكرولتر لكل منهما و 5٪ على التوالي. يحفظ في درجة حرارة الغرفة قبل الحقن.
ملاحظة: استخدم حقنة سعة 1 مل لامتصاص 100٪ تريبان بلو وقم بالتصفية من خلال مرشح معقم 0.22 ميكرومتر قبل الاستخدام. - قم بتوصيل الإبرة الشعرية المسحوبة ، والتي تسمى من الآن فصاعدا إبرة الحقن المجهري ، بالمناور الدقيق المثبت بالمشبك بواسطة حامل مغناطيسي (الإعداد موضح في الشكل 2 ب).
- ماصة 2 ميكرولتر من محلول الحقن على طبق بتري معقم. أثناء المراقبة تحت المجهر ، خذ ببطء 1-2 ميكرولتر من هذا المحلول في إبرة الحقن المجهري باستخدام حقنة ضغط الهواء المتصلة بالمعالج الدقيق. تجنب الفقاعات / امتصاص الفقاعات في إبرة الحقن المجهري.

الشكل 2: إعداد منطقة الجراحة. (أ) إعداد منطقة الجراحة داخل مقعد نظيف. (ب) مجهر التشريح وإعداد المناور الدقيق للفرد الذي يستخدم اليد اليمنى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تعريض الجهاز التناسلي للأنثى
- تخدير أنثى فأر تبلغ من العمر 6-8 أسابيع عن طريق إعطاء أفيرتين مصفى ومخفف (مخدر) داخل الصفاق بجرعة 0.25-0.5 مجم / جم. بعد ذلك، يتم تطبيق كاربروفين (مسكن وقائي) تحت الجلد بجرعة 5 ملغ/ كغ.
ملاحظة: البدائل الأخرى التي يمكن استخدامها كمخدر هي إيزوفلوران أو الكيتامين / زيلازين. - ضع الورق الماص على لمادة/قرص نظيف وساخن. بعد ذلك ، ضع الماوس المخدر على هذه الورقة الماصة الساخنة بحيث يكون الجانب الظهري متجها لأعلى. ضع مادة تشحيم العين على كل عين لمنع الجفاف أثناء الجراحة.
ملاحظة: تأكد من أن وسادة / قرص التسخين دافئ قليلا عند لمسه عن طريق الاختبار بظهر اليد. - اختبار للتوقف المخدر العميق عن طريق الضغط على إصبع الفأر المخدر مع زوج من الملقط. قم بإزالة الفراء الظهري حول موقع الشق المحتمل (الموقع الموضح في الشكل 3 أ) وامسح الجلد العاري بمطهر.
- استخدم زوجا من الملقط الحاد المستقيم لقرص الجلد العاري وإنشاء شق بطول 1 سم على طول خط الوسط في الجسم باستخدام مقص حاد معقم. نظف المنطقة المحيطة بالشق بمطهر.
- اضغط وامسك جانبا واحدا من موقع القطع باستخدام زوج من ملقط Adson المعقم. ثم ، باستخدام زوج من الملقط المسنن المنحني المعقم ، افصل الجلد برفق عن جدار الجسم ، بدءا من شق خط الوسط والتحرك بشكل جانبي.
- حدد موقع وسادة الدهون أسفل الكلى. باستخدام زوج من الملقط الحاد المستقيم المعقم ، اضغط على جدار الجسم مباشرة فوق وسادة الدهون. قم بإنشاء شق صغير في جدار الجسم باستخدام مقص تشريح معقم حاد مدبب ، مع الحرص على تجنب الأوعية الدموية.
- بينما لا تزال تقرص جدار الجسم بملقط غير حاد مستقيم ، أدخل زوجا من الملقط المنحني الحاد المعقم في الشق وقم بتوسيع الشق الناتج في جدار الجسم.
- أمسك وسادة الدهون المرئية بالملقط المنحني الحاد واسحبها من الحفرة لكشف المبيض وقناة البيض والرحم.
- للحفاظ على الجهاز التناسلي مكشوفا ، قم بتثبيت وسادة الدهون بمشبك البلدغ المعقم ، كما هو موضح في الشكل 3 ب.
6. في حقن قناة البيض في الجسم الحي والتثقيب الكهربائي
- ضع بعناية الورق الماص المسخن والماوس المخدر مع كشف الجهاز التناسلي على مرحلة المجهر التشريحي ، بحيث يمكن ملاحظة المسالك. يظهر مثال على المنظر كما لوحظ تحت المجهر في الشكل 3B.
- اضبط المعالج الدقيق بحيث يمكن أيضا ملاحظة إبرة الحقن بالمحلول تحت المجهر.
- باستخدام زوج من ملقط طرف متناهي الصغر مدبب معقم ، أمسك منطقة قناة البيض المراد حقنها بثبات. يجب أن تكون المنطقة المراد حقنها متماشية مع اتجاه إبرة الحقن المجهري.
ملاحظة: استخدم مشبك البلدغ الذي يثبت وسادة الدهون والجهاز التناسلي لتدوير / تحريك القناة برفق إلى الوضع الأمثل ، إذا لزم الأمر. - اضبط المعالج الدقيق لثقب قناة البيض بإبرة الحقن المجهري ، مع تغذية قناة البيض في نفس الوقت على الإبرة باستخدام ملقط طرف متناهي الصغر مدبب. حرك إبرة الحقن المجهري برفق للتأكد من إدخالها في قناة البيض.
ملاحظة: أدخل إبرة الحقن المجهري في قطعة مستقيمة بدلا من نقطة تحول قناة البيض الملفوفة لمنع الثقوب المتعددة وتسرب محلول الحقن. - حقن ببطء ما يصل إلى 1 ميكرولتر من المحلول في قناة البيض ، مع مراقبة حركة المحلول الأزرق وتوسيع تجويف قناة البيض تحت المجهر. احرص على عدم إدخال أي فقاعات في التجويف. يتم عرض الصور التمثيلية لقنوات البيض المحقونة بأزرق تريبان بنسبة 100٪ في الشكل 3C ، D.
- إزالة الإبرة من قناة البيض. قم بتغطية المنطقة المراد استهدافها بقطعة من الورق الماص المنقوع مسبقا في 1x PBS المعقم (من الخطوة 3.3).
- أمسك الورق المنقوع مسبقا والمنطقة / المنطقة المراد استهدافها بزوج من ملاقط الأقطاب الكهربائية (1 مم أو 3 مم أو 5 مم ، حسب حجم المنطقة المراد استهدافها) واسحبها بعيدا عن الجسم ، قبل التفريغ الكهربائي باستخدام هذه الإعدادات على مولد النبضات / التثقيب الكهربائي: 30 فولت ، ثلاث نبضات ، فاصل زمني 1 ثانية ، طول النبض 50 مللي ثانية ، أحادي القطب.
ملاحظة: يجب ضبط المسافة بين الأقطاب الكهربائية بحيث يمكن للأقطاب الكهربائية تثبيتها على المنطقة المستهدفة دون تشويه قناة البيض. المسافة الموصى بها حوالي 1 مم. - بعد التثقيب الكهربائي ، قم بإزالة الورق الماص وضع الماوس (مع وجود الورق الماص الساخن تحته) مرة أخرى على وسادة حرارية. قم بفك مشبك البلدغ وادفع الجهاز التناسلي المكشوف بعناية تحت جدار الجسم. كرر القسم 5 لفضح الجهاز التناسلي على الجانب الآخر.
ملاحظة: التثقيب الكهربائي ناجح بغض النظر عن مرحلة شهوة الماوس طالما أن التجويف مملوء بالمحلول. - قم بتغطية القناة المكشوفة بورق ماص منقوع مسبقا في 1x PBS معقم لمنعه من الجفاف ، ثم قم بإعداد إبرة الحقن المجهري للحقن الثاني بتكرار الخطوتين 4.2 و 4.3.
ملاحظة: استبدل إبرة الحقن المجهري حسب الحاجة. منع جفاف الأنسجة المكشوفة عن طريق تطبيق معقم 1x PBS عند الحاجة. - كرر الخطوات المذكورة أعلاه لحقن قناة البيض والكهرباء على الجانب المقابل.
ملاحظة: أعد وضع مزلق العين حسب الحاجة أثناء الجراحة وبعدها. - بعد أن يتم تكريب قناتي البيض ووضعهما مرة أخرى تحت جدار الجسم ، قم بخياطة أو تدبيس موقع الشق الظهري. للخياطة ، استخدم مرقئا للإمساك بإبرة الغرز المضفرة بالحرير (3/8 دائرة ؛ المقياس: 5-0 ؛ حجم الإبرة: 18 مم ؛ طول الخيط: 75 سم). اضغط على جانب واحد من موقع القطع وامسك به باستخدام زوج من الملقط المسنن المنحني المعقم ، ثم استخدم المرقئ لمعالجة الخيط لإغلاق الجرح.
- حرك الماوس إلى قفص نظيف يتم وضعه أعلى لوحة / قرص ساخن (من الخطوة 3.2) ومراقبته حتى يصبح الماوس نشطا.
- تطبيق 5 ملغ/ كغ كاربروفين تحت الجلد كل 24 ساعة لمدة 3 أيام قادمة والمراقبة خلال الأيام ال 10 القادمة.
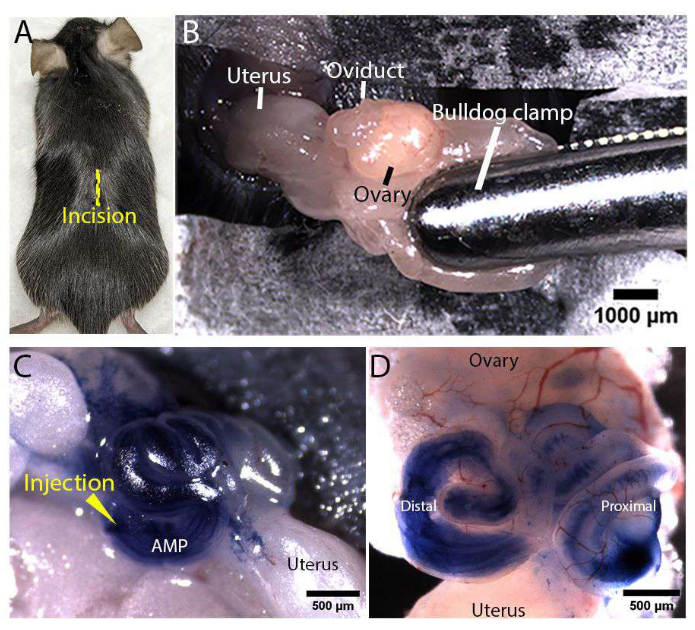
الشكل 3: التعرض للجهاز التناسلي الأنثوي والحقن المجهري . (أ) موقع شق خط الوسط (كما هو موضح كخط أصفر) على الجانب الظهري لفأر Rosa-LSLtdTomato . ب: التعرض للجهاز التناسلي للأنثى. تم تثبيت وسادة الدهون باستخدام مشبك البلدغ المعقم لتثبيت القناة وإبقائها مكشوفة. (ج، د) صور تمثيلية لحقن قناة البيض في الجسم الحي . تم إدخال إبرة حقن مجهرية في الأمبولة البعيدة (المسمى AMP) ، وتم حقن التريبان الأزرق المصفى بنسبة 100٪ في تجويف قناة البيض أثناء تعرض القناة (C). صورة تمثيلية لقناة البيض المشرحة ، مما يدل على أن محلول التريبان الأزرق المحقون يوزع في جميع أنحاء تجويف قناة البيض البعيدة والقريبة (D). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
يصور الشكل 1 والشكل 2 إعداد إبرة الحقن المجهري وإعداد منطقة الجراحة ، على التوالي ، للحقن المجهري في الجسم الحي والتثقيب الكهربائي لقناة البيض الفأر. أثناء الجراحة ، تم الكشف عن الجهاز التناسلي للأنثى من خلال شقوق تم إجراؤها في الجلد الظهري (الشكل 3 أ) وجدار الجسم لفأر Rosa-LSLtdTomato (Gt (ROSA) 26Sortm14 (CAG-tdTomato) Hze / J) 17. تم تثبيت مشبك البلدغ على وسادة الدهون فوق القناة لإبقائها مكشوفة ومثبتة (الشكل 3 ب). تم حقن محلول الحقن الذي يحتوي على بلازميدات PCS2 CreNLS18 بتركيز 400 نانوغرام / ميكرولتر في الأمبولة (المسمى AMP) لقناة البيض الملفوفة وسمح له بالانتشار في جميع أنحاء تجويف قناة البيض (الشكل 3C ، D). على الرغم من استخدام بلازميدات PCS2 CreNLS لتوليد نتائج تمثيلية في هذه المخطوطة ، يمكن استخدام الطريقة الموصوفة مع DNA / RNA / RNPs القابلة للتبديل بسهولة في محلول الحقن لتحرير الجينات بوساطة CRISPR / Cas في قناة البيض الفأر. بعد ذلك ، تم وضع أقطاب كهربائية من نوع الملقط 1 مم أو 3 مم ، بحيث كانت قناة البيض البعيدة بين الأقطاب الكهربائية للتوصيل القائم على التثقيب الكهربائي.
تم حصاد قنوات البيض بعد 4 أيام من الجراحة وتمديدها عن طريق إزالة mesosalpinx لتصور خصوصية التثقيب الكهربائي. باستخدام أقطاب كهربائية من نوع الملقط 1 مم أو 3 مم ، اقتصرت المنطقة المستهدفة ، الموسومة ب TdTomato ، على ظهارة قناة البيض البعيدة (الشكل 4 أ ، د). تم التحكم في حجم هذه المنطقة المستهدفة بشكل أكبر باستخدام أقطاب كهربائية بأحجام مختلفة. باستخدام أقطاب كهربائية من نوع الملقط 3 مم ، استهدفنا مساحة أكبر بكثير من AMP (الشكل 4B ، C) ، مقارنة باستهداف الطرف البعيد فقط ، INF (الشكل 4E ، F) ، باستخدام أقطاب كهربائية من نوع الملقط 1 مم. تم تثبيت قنوات البيض المحصودة هذه ، ومعالجتها بتدرج السكروز ، وتقسيمها باستخدام cryostat لإجراء تحليلات مفصلة. تم تلطيخ المقاطع باستخدام Hoescht 33342 و Phalloidin لتلطيخ النوى والهيكل الخلوي على التوالي ، ثم تم تصويرها باستخدام مجهر متحد البؤر لمسح النقاط. في المنطقة المستهدفة ، تم توزيع الخلايا الكهربائية ، التي تم تمييزها بواسطة TdTomato ، بشكل عشوائي بين الخلايا غير المكهربة (TdTomato-ve) (الشكل 4G). بالإضافة إلى ذلك ، اقتصرت الخلايا الكهربائية على ظهارة الغشاء المخاطي ولم يتم العثور عليها في الطبقة اللحمية أو العضلية الأساسية (الشكل 4G ، H). أخيرا ، لتأكيد تحرير الجينات بوساطة CRISPR-Cas ، يمكن عزل خلايا TdTomato + ve عن طريق فرز الخلايا المنشط بالفلورة (FACS) لعزل الحمض النووي وتسلسل MiSeq12.
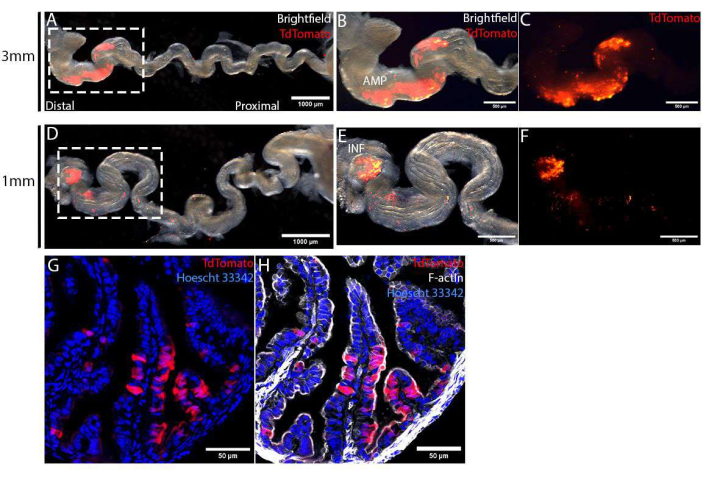
الشكل 4: التحقق من نجاح الحقن في الجسم الحي والتثقيب الكهربائي للخلايا الظهارية لقناة البيض ، بعد 4 أيام من الجراحة. (أ-ج) التثقيب الكهربائي باستخدام أقطاب كهربائية من نوع الملقط بحجم 3 مم. تم فك قناة البيض عن طريق إزالة mesosalpinx للحصول على تصور أفضل لخصوصية التثقيب الكهربائي (A). اقتصرت منطقة التثقيب الكهربائي ، التي تم تحديدها بواسطة تعبير TdTomato ، على قناة البيض البعيدة ، المسماة AMP (B ، C). (مد-واو) التثقيب الكهربائي باستخدام أقطاب كهربائية من نوع الملقط بحجم 1 مم. تم فك قناة البيض عن طريق إزالة mesosalpinx للحصول على تصور أفضل لخصوصية التثقيب الكهربائي (D). اقتصرت منطقة التثقيب الكهربائي على infundibulum (المسمى INF) ، الطرف البعيد لقناة البيض (E ، F). (ز ، ح) القسم المستعرض لقناة البيض البعيدة بعد 4 أيام من التثقيب الكهربائي باستخدام بلازميدات PCS2 CreNLS. اقتصرت الخلايا المكهربة الموسومة ب TdTomato (G) على الطبقة الأحادية الظهارية (H). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الخطوات الحاسمة في هذا البروتوكول التفصيلي هي الحقن الدقيق لمحلول DNA / RNA / RNP في تجويف قناة البيض والتحكم في قوة التثقيب الكهربائي والمنطقة. قد يتسبب تسرب محلول DNA / RNA / RNP أثناء الحقن المجهري في نقل المناطق / الخلايا غير المرغوب فيها. من أجل التثقيب الكهربائي المتسق والفعال ، يفضل ملء تجويف قناة البيض بالمحلول (الشكل 3C ، D). وذلك لأن منطقة التثقيب الكهربائي يتم التحكم فيها بشكل أساسي من خلال حجم القطب ووضعه. يقلل التثقيب الكهربائي الضعيف من عدد الخلايا الكهربائية ، وقد يتسبب التثقيب الكهربائي القاسي في التثقيب الكهربائي للخلايا غير المرغوب فيها أو تعطيل بنية الأنسجة. يمكن تغيير عدد الخلايا الكهربائية عن طريق ضبط تركيز محلول DNA / RNA / RNP أو معلمات التثقيب الكهربائي. ومع ذلك ، نظرا لأن الفولتية العالية / إنتاج الحرارة أثناء التثقيب الكهربائي يمكن أن تلحق الضرر بالأنسجة ، يجب اختبار هذه المعلمات قبل استخدامها على الفئران الحية / المخدرة. أخيرا ، نظرا للطبيعة الصعبة لهذا الإجراء ، يوصى بممارسة التعرض للمسالك والحقن المجهري على الفئران الميتة قبل إجراء هذه الجراحة على الفئران الحية / المخدرة.
من المسلم به أن جينات متعددة تشارك في بدء السرطان ، وبالتالي ، فإن تلخيص هذا الحدث يتطلب تعديلا متعدد الأليل لعدة جينات. بالإضافة إلى ذلك ، من المعروف أيضا أنه ليست كل الخلايا معرضة بنفس القدر للطفرات السرطانية9. لذلك ، تتطلب نمذجة السرطان خطوط فأر كري محددة لتحقيق تحكم صارم في الإهانات السرطانية. ومع ذلك ، فإن توافرها وخصوصيتها يسبب تحديات مختلفة ، بما في ذلك الآثار في الأنسجة غير المستهدفة والفتك19. علاوة على ذلك ، تتحمل G-GEMMs التقليدية تكاليف عالية للصيانة وتتطلب وقتا لتوليد خط الماوس. لقد سمح لنا تطوير تقنية تحرير الجينوم CRISPR / Cas9 وتحسين توصيل الجينات إلى خلايا جسدية محددة بالتغلب على هذه المشكلات. في هذا البروتوكول ، نقدم طريقة توصيل DNA / RNA / RNP لمعالجة الجينوم الجسدي التي يمكن استخدامها لنمذجة السرطان ، دون الحاجة المطلقة لخطوط فأر محددة12. عن طريق حقن محاليل DNA / RNA / RNP في التجويف واستخدام أحجام مختلفة من الأقطاب الكهربائية من نوع الملقط للتوصيل القائم على التثقيب الكهربائي ، يتم استهداف المناطق المحظورة من ظهارة الغشاء المخاطي لقناة البيض (الشكل 4A-F). هذا مفيد بشكل خاص في نمذجة بدء HGSCs التي تنشأ من النهاية البعيدة لقناة فالوب.
الحقن المجهري المقدم وطريقة التثقيب الكهربائي في الجسم الحي متعددة الاستخدامات للغاية لاستهداف الأنسجة / الأعضاء ذات التجويف. حمة الجهاز قابلة للاستهداف أيضا باستخدام هذه الطريقة14. يمكن أيضا استخدام طرق التوصيل الفيروسي ، مثل أنظمة الفيروسات العدسية والفيروسات الغدية ، لأغراض مماثلة. ومع ذلك ، فإن مزايا التثقيب الكهربائي على طرق التوصيل الفيروسي هي: 1) توصيل البلازميد المتعدد إلى خلايا مفردة ، 2) لا توجد قيود على حجم الإدراج15 ، و 3) سهولة التحكم في المنطقة وتوقيت التسليم. بالإضافة إلى ذلك ، يمكن تحسين خصوصية الاستهداف باستخدام مروجين محددين للنسب. هذا صعب في بعض الأحيان في الأنظمة الفيروسية بسبب الحد الأقصى للتغليف الفيروسي.
كما هي طبيعة التثقيب الكهربائي ، تتخلل الخلايا الظهارية الكهربية بشكل عشوائي خلايا صحية غير محررة (الشكل 4G). ومع ذلك ، فإن هذه الفسيفساء في الخلايا المعدلة وراثيا وغير المعدلة يمكن أن تكون مفيدة لدراسة بدء السرطان ، لأنها تلخص الطبيعة المتقطعة لبدء السرطان المبكر داخل بيئة دقيقة مناعية. يمكن ضبط تردد الخلايا الكهربائية عن طريق تغيير تركيزات محلول DNA / RNNA / RNP و / أو معلمات التثقيب الكهربائي. باستخدام تحرير الجينات بوساطة CRISPR-Cas بالاقتران مع البروتوكول المقدم ، من السهل فحص جينات متعددة وتوليد أنماط غير متجانسة من الطفرات / التوليفات الأليلية في الجينات المستهدفة. هذا مفيد بشكل خاص في نمذجة السرطانات التي تظهر مع عدد كبير من التغيرات الجينومية مثل HGSCs20,21. علاوة على ذلك ، من خلال تسلسل الجينات المستهدفة أثناء تطور السرطان ، من الممكن متابعة التطور النسيلي في الجسم الحي للأورام والنقائل في الفئران ذات الكفاءة المناعية12.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يشكر المؤلفون كاتي تنغ والدكتور ماثيو جيه فورد على توفير البلازميدات المستخدمة لتوليد نتائج تمثيلية وتحسين البروتوكول. تم دعم KH من قبل Fonds de recherche du Québec - منحة الدكتوراه (FRQS) ، ومؤسسة Donnor ، وزمالة Delta Kappa Gamma World ، ومركز البحوث في الإنجاب والتنمية (CRRD) ، وهيو إي بيرك ، ورولاند ومارسيل جوسلين ، وطلاب الدراسات العليا ألكسندر ماكفي.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter unit | LifeGene | SF0.22PES | |
| 1 mL syringe | Terumo Medical Corportation | SS-01T | |
| 1 mm tweezer-type electrodes | BEX CO., LTD | LF650P1 | |
| 3 mm tweezer-type electrodes | BEX CO., LTD | LF650P3 | |
| 30G x 1/2 Needle | BD | 305106 | Needle is attached to the 1 mL syringe when using injectable anesthetic or analgesic. |
| Adson forceps | Fisher Scientific | 10-000-451 | |
| Air-pressured syringe | BD | B302995 | Attached to the micromanipulator; as shown in Figure 2B |
| Analgesic | - | - | Carprofen, dose: 5mg/kg. |
| Antiseptic | Cardinal Health | OMEL0000017 | Baxedin: 2% chlorhexidine in 70% isopropyl alcohol |
| Avertin (2,2,2-tribromoethanol) - Anesthetic | Sigma Aldrich | T48402-25G | |
| Clamp mount micromanipulator | AD Instruments | MM-33 | |
| Curved serrated forceps | Fisher Scientific | NC0696845 | |
| Dissecting microscope | Zeiss | SteREO Discovery.V8 | Apochromat S, 0.63X, FWD 107mm. Attached KL 200 LED for top light, labelled as light source in Figure 2B. |
| Eye lubricant | Alcon | - | Systane ointment (Lubricant eye ointment) |
| Glass capillary needles | Sutter Instrument Co. | B100–50-10 | Outside diameter: 1 mm, inside diameter: 0.5 mm, length: 10 cm |
| Hartman hemostats | Fisher Scientific | 50-822-711 | |
| Heating pad/disc | - | - | SnuggleSafe Pet Bed Microwave Heating Pad was used in this protocol. Microwave for 2-5min, and test with back of gloved hand. |
| Magnetic Mount for micromanipulator | AD Instruments | MB-B | Used to keep the clamp mount micromanipulator stable and upright during injection. |
| Micro bulldog clamp | Fisher Scientific | 50-822-230 | 3 cm |
| Micropipette puller | Sutter Instrument Co. | P-97 | P-97 Flaming/Brown type micropipette puller. Program used: P = 500, Heat = 576, PULL = 50, VEL = 80, DEL = 70 |
| Petri dish | Fisher Scientific | 263991 | Autoclaved/sterile glass petridishes can also be used. |
| Phosphate Buffered Saline (PBS) | Bio Basic Inc. | PD8117 | 10X PBS was diluted to 1X with DI water. Autoclave before use. |
| Pulse generator/Electroporator | BEX CO., LTD | CUY21 EDIT II | Electroporation settings: 30 V, 3 pulses, 1 s interval, P. length = 50 ms, unipolar |
| Rosa-LSLtdTomato mice | The Jackson Laboratory | 7914 | Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J |
| Sharp-blunt dissection scissors | Fisher Scientific | 28251 | |
| Sharp-pointed dissecting scissors | Fisher Scientific | SDI130 | |
| Shaver | - | - | Hair removal cream can also be used. |
| Silk braided sutures | Ethicon | 682G | 3/8 circle, gauge: 5-0, needle size: 18 mm, thread length: 75 cm. Staples can also be used. |
| Tapered ultrafine tip forceps | Fisher Scientific | 12-000-122 | |
| Thin absorbent paper | Kimberly-Clark Professional | 34120 | Kimwipes |
| Trypan blue | STEMCELL Technologies | 7050 | Filtered using 0.22 µm sterile filter before use for microinjection. |
References
- Avilés, M., Coy, P., Rizos, D. The oviduct: A key organ for the success of early reproductive events. Animal Frontiers. 5 (1), 25-31 (2015).
- Li, S., Winuthayanon, W. Oviduct: roles in fertilization and early embryo development. The Journal of Endocrinology. 232 (1), R1-R26 (2017).
- Briceag, I., et al. Fallopian tubes--literature review of anatomy and etiology in female infertility. Journal of Medicine and Life. 8 (2), 129-131 (2015).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Labidi-Galy, S. I., et al. High grade serous ovarian carcinomas originate in the fallopian tube. Nature Communications. 8 (1), 1093(2017).
- Shaw, P. A., Rouzbahman, M., Pizer, E. S., Pintilie, M., Begley, H. Candidate serous cancer precursors in fallopian tube epithelium of BRCA1/2 mutation carriers. Modern Pathology. 22 (9), 1133-1138 (2009).
- Soong, T. R., et al. Evidence for lineage continuity between early serous proliferations (ESPs) in the Fallopian tube and disseminated high-grade serous carcinomas. The Journal of Pathology. 246 (3), 344-351 (2018).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. The Journal of Pathology. 211 (1), 26-35 (2007).
- Puisieux, A., Pommier, R. M., Morel, A. P., Lavial, F. Cellular pliancy and the multistep process of tumorigenesis. Cancer Cell. 33 (2), 164-172 (2018).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677(2021).
- Teng, K., et al. Modeling high-grade serous ovarian carcinoma using a combination of in vivo fallopian tube electroporation and CRISPR-Cas9-mediated genome editing. Cancer Research. 81 (20), 5147-5160 (2021).
- Ford, M. J., Yamanaka, Y. Reprogramming mouse oviduct epithelial cells using in vivo electroporation and CRISPR/Cas9-mediated genetic manipulation. Methods in Molecular Biology. 2429, 367-377 (2022).
- Maresch, R., et al. Multiplexed pancreatic genome engineering and cancer induction by transfection-based CRISPR/Cas9 delivery in mice. Nature Communications. 7, 10770(2016).
- Braun, C. J., Adames, A. C., Saur, D., Rad, R. Tutorial: design and execution of CRISPR in vivo screens. Nature Protocols. 17 (9), 1903-1925 (2022).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Chazaud, C., Yamanaka, Y., Pawson, T., Rossant, J. Early lineage segregation between epiblast and primitive endoderm in mouse blastocysts through the Grb2-MAPK pathway. Developmental Cell. 10 (5), 615-624 (2006).
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature Reviews. Cancer. 10 (7), 470-480 (2010).
- Kroeger Jr, P. T., Drapkin, R. Pathogenesis and heterogeneity of ovarian cancer. Current Opinion in Obstetrics & Gynecology. 29 (1), 26-34 (2017).
- Cancer Genome Atlas Research Network. Integrated genomic analyses of ovarian carcinoma. Nature. 474 (7353), 609-615 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved