Method Article
Modèles murins génétiquement modifiés par génome somatique utilisant la microinjection et l’électroporation in vivo
Dans cet article
Résumé
Ce protocole décrit la microinjection et l’électroporation in vivo pour l’édition du génome médiée par CRISPR restreinte régionalement dans l’oviducte de souris.
Résumé
Les modèles murins génétiquement modifiés de la lignée germinale (G-GEMM) ont fourni des informations précieuses sur la fonction des gènes in vivo dans le développement, l’homéostasie et la maladie. Cependant, le temps et les coûts associés à la création et à l’entretien des colonies sont élevés. Les progrès récents dans l’édition du génome médiée par CRISPR ont permis la génération de GEMM somatiques (S-GEMM) en ciblant directement la cellule/tissu/organe d’intérêt.
L’oviducte, ou trompe de Fallope chez l’homme, est considéré comme le tissu d’origine du cancer de l’ovaire le plus courant, les carcinomes séreux de l’ovaire de haut grade (HGSC). Les HGSC prennent naissance dans la région de la trompe de Fallope distale à l’utérus, située à côté de l’ovaire, mais pas dans la trompe de Fallope proximale. Cependant, les modèles murins traditionnels de HGSC ciblent l’ensemble de l’oviducte et ne récapitulent donc pas la condition humaine. Nous présentons une méthode de microinjection de solution d’ADN, d’ARN ou de ribonucléoprotéine (RNP) dans la lumière de l’oviducte et d’électroporation in vivo pour cibler les cellules épithéliales muqueuses dans des régions restreintes le long de l’oviducte. Cette méthode présente plusieurs avantages pour la modélisation du cancer, tels que 1) une grande adaptabilité dans le ciblage de la zone/tissus/organe et de la région d’électroporation, 2) une grande flexibilité dans les types cellulaires ciblés (pliance cellulaire) lorsqu’elle est utilisée en combinaison avec des promoteurs spécifiques pour l’expression de Cas9, 3) une grande flexibilité dans le nombre de cellules électroporées (fréquence relativement faible), 4) aucune lignée de souris spécifique n’est requise (modélisation immunocompétente de la maladie), 5) une grande flexibilité dans la combinaison de mutations génétiques et 6) la possibilité de suivre les cellules électroporées lorsqu’elles sont utilisées en combinaison avec une lignée rapporteur Cre. Ainsi, cette méthode rentable récapitule l’initiation du cancer humain.
Introduction
La trompe de Fallope, appelée oviducte chez la souris, est une structure tubulaire qui relie l’utérus à l’ovaire. Il joue un rôle essentiel dans la reproduction des mammifères, fournissant un environnement propice à la fécondation interne et au développement préimplantatoire 1,2. Malgré son importance, on sait peu de choses sur sa fonction et son homéostasie, en partie grâce au développement de techniques de fécondation in vitro contournant tout problème d’infertilité lié à cet organe3. Cependant, il a été reconnu que les lésions précancéreuses du carcinome séreux de l’ovaire de haut grade (HGSC), un histotype agressif du cancer de l’ovaire qui représente environ 75% des carcinomes ovariens et 85% des décès connexes4, sont limitées à l’épithélium distal des trompes de Fallope 5,6,7,8 . Cela indique que toutes les cellules de notre corps ne sont pas également sensibles aux agressions oncogéniques, mais que seules les cellules uniques / sensibles de chaque tissu / organe deviennent la cellule d’origine du cancer - appelée pliance cellulaire9. Dans le même ordre d’idées, il a été démontré que les cellules épithéliales de la trompe de Fallope distale, situées à côté de l’ovaire, sont distinctes du reste de la trompe10,11. Ainsi, les modèles murins traditionnels de HGSC, qui ciblent toutes les cellules de l’oviducte, ne récapitulent pas la condition humaine. Dans une étude récente, nous avons utilisé une combinaison d’édition du génome médiée par CRISPR, d’électroporation in vivo de l’oviducte et de traçage de lignée basé sur Cre pour induire avec succès HGSC en mutant quatre gènes suppresseurs de tumeurs dans l’oviducte distalde souris 12,13. Ce manuscrit présente un protocole étape par étape décrivant cette procédure de microinjection et d’électroporation in vivo pour cibler l’épithélium muqueux oviducte de souris.
Cette méthode présente plusieurs avantages. Il peut être adapté pour cibler d’autres tissus/organes, y compris le parenchymed’organe 14. Bien que d’autres approches d’administration de gènes in vivo telles que les systèmes lentiviraux et adénoviraux puissent être utilisées pour obtenir un ciblage similaire spécifique aux tissus / organes, la zone de ciblage est plus facilement ajustée à l’aide de différentes tailles d’électrodes de type pince à épiler pour une administration basée sur l’électroporation. Selon la concentration d’ADN/ARN/ribonucléoprotéines (RNP), les paramètres d’électroporation et la taille des électrodes, le nombre de cellules électroporées peut être modifié. De plus, des types de cellules spécifiques peuvent être ciblés lorsqu’ils sont utilisés en combinaison avec des promoteurs pour l’expression de Cas9, sans avoir besoin absolu de modèles murins génétiquement modifiés par la lignée germinale (G-GEMM). De plus, contrairement aux systèmes d’administration virale, l’électroporation permet une livraison plasmidique multiple dans des cellules uniques et moins de contrainte dans la taille de l’ADNinséré 15. Le criblage in vivo des mutations génétiques peut également être effectué avec une relative facilité en raison de cette grande flexibilité. De plus, les cellules électroporées peuvent être suivies ou tracées lorsque cette méthode est utilisée en combinaison avec des lignes rapporteures Cre telles que Tdtomato ou Confetti16,17.
Protocole
Les animaux ont été logés dans des cages de micro-isolement statiques avec des filtres, situées dans une pièce dédiée contenant une armoire de biosécurité de type II. Tous les travaux sur les animaux ont été effectués conformément aux lignes directrices de l’établissement et ont été approuvés par le Comité de soins aux animaux de la Faculté de médecine et des sciences de la santé de l’Université McGill (AUP #7843).
1. Préparation de l’aiguille de micro-injection
- Tirez un tube capillaire en verre dans une pointe tranchante à l’aide d’un extracteur de micropipette avec le programme suivant: P = 500, Heat = 576, PULL = 50, VEL = 80, DEL = 70.
- À l’aide d’une paire de pinces à pointe ultrafine effilée, coupez l’extrémité pointue du tube capillaire tiré sous un microscope à dissection pour créer une ouverture, comme illustré à la figure 1A,B. Assurez-vous que l’ouverture n’est pas trop grande, car cela endommagerait l’oviducte et empêcherait une injection lente.
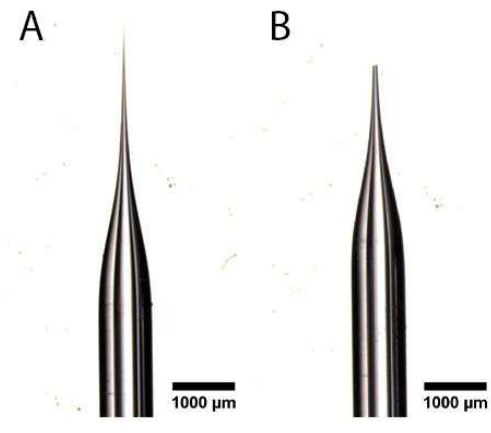
Figure 1 : Préparation de l’aiguille de micro-injection. (A,B) Tube capillaire tiré avec une extrémité pointue (A) qui a été coupé pour créer une ouverture (B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Préparation de l’anesthésique pour l’injection intrapéritonéale
- Préparez de l’avertin filtré et dilué le jour de la chirurgie. La solution mère d’Avertin (2,2,2-tribromoéthanol) est préparée à une concentration de 1,6 g/mL dans de l’alcool tert-amylique sous agitation vigoureuse et conservée à l’obscurité.
- Diluer la solution mère d’avertin avec une solution saline isotonique à 1,25 % v/v jusqu’à une concentration finale de 20 mg/mL à l’intérieur d’une hotte. Vortex l’avertin dilué et filtrer à travers un filtre stérile de 0,22 μm. Restez dans l’obscurité.
3. Préparation de la zone chirurgicale
- La zone de chirurgie devrait être un environnement stérile dédié, de préférence un banc propre ou une armoire de biosécurité. Disposez l’équipement de chirurgie stérile, le microscope, le micromanipulateur et l’électroporateur au besoin. La figure 2 en donne un exemple.
- Chauffez le coussin/disque chauffant et placez-le sous une cage propre et entièrement équipée. Cette cage sera utilisée pour loger les souris après la chirurgie.
- Versez une solution saline tamponnée au phosphate (PBS) stérile 1x dans une boîte de Pétri stérile. Utilisez une paire de ciseaux propres pour couper le papier absorbant en carrés, avec des dimensions approximatives de 1 cm x 1 cm. Déposez ces morceaux de papier absorbant dans le 1x PBS pour les faire tremper.
4. Préparation de la solution et de l’aiguille pour injection
- Préparez la solution injectable le jour de la chirurgie. Mélanger l’ADN/ARN/RNP avec du bleu de trypan filtré jusqu’à une concentration finale minimale de 200 ng/μL chacun et 5 %, respectivement. Conserver à température ambiante avant l’injection.
REMARQUE: Utilisez une seringue de 1 mL pour absorber 100% de bleu trypan et filtrez à travers un filtre stérile de 0,22 μm avant utilisation. - Fixez l’aiguille capillaire tirée, ci-après appelée aiguille de microinjection, au micromanipulateur à montage de pince stabilisé par un support magnétique (configuration illustrée à la figure 2B).
- Pipeter 2 μL de la solution injectable sur une boîte de Petri stérile. Tout en observant au microscope, aspirez lentement 1 à 2 μL de cette solution dans l’aiguille de micro-injection à l’aide de la seringue sous pression d’air fixée au micromanipulateur. Évitez les bulles / prendre des bulles dans l’aiguille de micro-injection.

Figure 2 : Préparation de la zone chirurgicale. (A) Configuration de la zone chirurgicale à l’intérieur d’un banc propre. (B) Microscope à dissection et micromanipulateur pour un droitier. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Exposition de l’appareil reproducteur féminin
- Anesthésier une souris femelle âgée de 6 à 8 semaines en administrant de l’avertin (anesthésique) filtré et dilué par voie intrapéritonéale à une dose de 0,25 à 0,5 mg / g. Ensuite, administrer du carprofène (analgésique préventif) par voie sous-cutanée à une dose de 5 mg / kg.
NOTE: D’autres alternatives qui peuvent être utilisées comme anesthésique sont l’isoflurane ou la kétamine / xylazine. - Placez le papier absorbant sur un tampon/disque propre et chauffant. Ensuite, placez la souris anesthésiée sur ce papier absorbant chauffé avec la face dorsale vers le haut. Appliquez du lubrifiant pour les yeux sur chaque œil pour éviter le dessèchement pendant la chirurgie.
REMARQUE: Vérifiez que le coussin chauffant / disque est légèrement chaud au toucher en testant avec le dos de la main. - Testez l’arrêt anesthésique profond en pinçant l’orteil de la souris anesthésiée avec une paire de pinces. Retirez la fourrure dorsale autour du site d’incision potentiel (emplacement illustré à la figure 3A) et essuyez la peau nue avec un antiseptique.
- Utilisez une paire de pinces émoussées droites pour pincer la peau nue et créer une incision de 1 cm de long le long de la ligne médiane du corps à l’aide d’une paire de ciseaux émoussés stériles et tranchants. Nettoyez la zone autour de l’incision avec un antiseptique.
- Pincez et maintenez un côté du site de coupe à l’aide d’une paire de pinces Adson stériles. Ensuite, à l’aide d’une paire de pinces dentelées incurvées stériles, séparez doucement la peau de la paroi du corps, en commençant par l’incision médiane et en vous déplaçant latéralement.
- Localisez le coussinet adipeux sous le rein. À l’aide d’une paire de pinces émoussées droites stériles, pincez la paroi du corps directement au-dessus du coussinet adipeux. Créez une petite incision dans la paroi du corps à l’aide d’une paire de ciseaux stériles à dissection pointue et pointue, en prenant soin d’éviter les vaisseaux sanguins.
- Tout en pinçant la paroi du corps avec une pince émoussée droite, insérez une paire de pinces incurvées émoussées stériles dans l’incision et élargissez l’incision créée dans la paroi du corps.
- Saisissez le coussinet graisseux visible avec la pince incurvée émoussée et sortez-le du trou pour exposer l’ovaire, l’oviducte et l’utérus.
- Pour garder l’appareil reproducteur exposé, serrez le coussinet graisseux avec une pince stérile bulldog, comme le montre la figure 3B.
6. Injection oviducte in vivo et électroporation
- Placez soigneusement le papier absorbant chauffé et la souris anesthésiée avec l’appareil reproducteur exposé sur la scène d’un microscope à dissection, de sorte que le tractus puisse être observé. Un exemple de la vue observée au microscope est présenté à la figure 3B.
- Ajustez le micromanipulateur de sorte que l’aiguille d’injection avec la solution puisse également être observée au microscope.
- À l’aide d’une paire de pinces stériles à pointe conique ultrafine, maintenez stable la région de l’oviducte à injecter. La région à injecter doit être alignée sur la direction de l’aiguille de micro-injection.
REMARQUE: Utilisez la pince bulldog ancrant le coussinet adipeux et l’appareil reproducteur pour tourner / déplacer doucement le tractus dans une position optimale, si nécessaire. - Ajustez le micromanipulateur pour percer l’oviducte avec l’aiguille de micro-injection, tout en alimentant simultanément l’oviducte sur l’aiguille à l’aide de la pince à pointe ultrafine conique. Déplacez doucement l’aiguille de micro-injection pour confirmer qu’elle a bien été insérée dans l’oviducte.
NOTE: Insérez l’aiguille de micro-injection dans un segment droit plutôt que dans un point de retournement de l’oviducte enroulé pour éviter les perforations multiples et les fuites de la solution injectable. - Injectez lentement jusqu’à 1 μL de solution dans l’oviducte, tout en observant le mouvement de la solution bleue et l’expansion de la lumière oviducte au microscope. Veillez à ne pas introduire de bulles dans la lumière. Des images représentatives d’oviductes injectés avec 100% de bleu de trypan sont montrées à la figure 3C,D.
- Retirez l’aiguille de l’oviducte. Couvrir la zone à cibler avec un morceau de papier absorbant prétrempé dans 1x PBS stérile (à partir de l’étape 3.3).
- Saisir le papier prétrempé et la zone/région à cibler à l’aide d’une pince à épiler (1 mm, 3 mm ou 5 mm, selon la taille de la région à cibler) et éloigner du corps, avant d’électroporer en utilisant ces réglages sur le générateur/électroporateur d’impulsions : 30 V, trois impulsions, intervalle de 1 s, Longueur d’impulsion de 50 ms, unipolaire.
REMARQUE: La distance entre les électrodes doit être réglée de manière à ce que les électrodes puissent se fixer sur la région ciblée sans déformer l’oviducte. La distance recommandée est d’environ 1 mm. - Après l’électroporation, retirez le papier absorbant et replacez la souris (avec le papier absorbant chauffé en dessous) sur un coussin chauffant. Détachez la pince du bouledogue et repoussez soigneusement l’appareil reproducteur exposé sous la paroi du corps. Répétez la section 5 pour exposer l’appareil reproducteur de l’autre côté.
REMARQUE: L’électroporation est réussie quel que soit le stade œstral de la souris tant que la lumière est remplie de la solution. - Couvrir le tractus exposé avec du papier absorbant prétrempé dans du PBS 1x stérile pour l’empêcher de se dessécher, puis préparer l’aiguille de micro-injection pour la deuxième injection en répétant les étapes 4.2 et 4.3.
REMARQUE: Remplacez l’aiguille de microinjection au besoin. Prévenir le dessèchement des tissus exposés en appliquant 1x PBS stérile si nécessaire. - Répétez les étapes ci-dessus pour injecter et électroporer l’oviducte du côté opposé.
REMARQUE: Réappliquez le lubrifiant pour les yeux au besoin pendant et après la chirurgie. - Une fois que les deux oviductes ont été électropolisés et replacés sous la paroi du corps, suturer ou agrafer le site d’incision dorsale. Pour la suture, utilisez un hémostatique pour saisir l’aiguille des sutures tressées en soie (cercle 3/8; calibre: 5-0; taille de l’aiguille: 18 mm; longueur du fil: 75 cm). Pincez et maintenez un côté du site de coupe à l’aide d’une paire de pinces dentelées incurvées stériles, puis utilisez l’hémostatique pour manipuler la suture afin de fermer la plaie.
- Déplacez la souris dans une cage propre placée sur un tampon/disque chauffant (à partir de l’étape 3.2) et surveillez jusqu’à ce que la souris soit active.
- Administrer 5 mg/kg de carprofène par voie sous-cutanée toutes les 24 heures pendant les 3 prochains jours et surveiller au cours des 10 prochains jours.
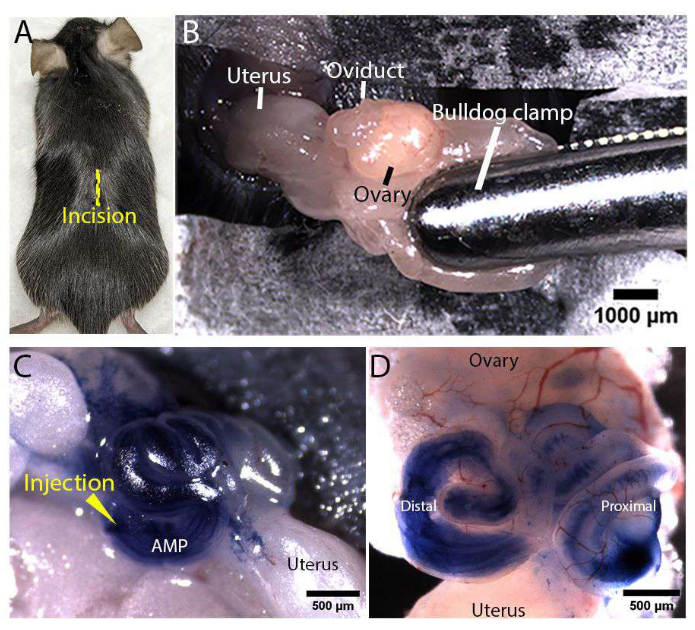
Figure 3 : Exposition de l’appareil reproducteur féminin et micro-injection. (A) Emplacement de l’incision médiane (représentée par une ligne jaune) sur la face dorsale d’une souris Rosa-LSLtdTomato. (B) Exposition de l’appareil reproducteur féminin. Le coussinet graisseux a été serré à l’aide d’une pince de bouledogue stérile pour ancrer le tractus et le maintenir exposé. (C, D) Images représentatives de l’injection oviducte in vivo. Une aiguille de micro-injection a été insérée dans l’ampoule distale (marquée AMP) et filtrée à 100% de bleu de trypan a été injectée dans la lumière oviducte pendant que le tractus était exposé (C). Image représentative d’un oviducte disséqué, démontrant que la solution injectée de bleu de trypan se distribue dans toute la lumière distale et proximale de l’oviducte (D). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
La figure 1 et la figure 2 représentent respectivement la préparation de l’aiguille de microinjection et la configuration de la zone chirurgicale pour la microinjection in vivo et l’électroporation de l’oviducte de souris. Au cours de la chirurgie, l’appareil reproducteur féminin a été exposé par des incisions pratiquées dans la peau dorsale (figure 3A) et la paroi corporelle d’une souris Rosa-LSLtdTomato (Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J)17 anesthésiée. Une pince de bouledogue a été fixée sur le coussinet adipeux au-dessus du tractus pour le maintenir exposé et ancré (figure 3B). Une solution injectable contenant des plasmides PCS2 CreNLS18 à une concentration de 400 ng/μL a été injectée dans l’ampoule (AMP marquée) de l’oviducte enroulé et laissée se disperser dans toute la lumière de l’oviducte (figure 3C,D). Bien que les plasmides PCS2 CreNLS aient été utilisés pour générer des résultats représentatifs dans ce manuscrit, la méthode décrite peut être utilisée avec de l’ADN / ARN / RNP facilement interchangeables dans la solution d’injection pour l’édition de gènes médiée par CRISPR / Cas-médiée dans l’oviducte de souris. Ensuite, des électrodes de type pince de 1 mm ou 3 mm ont été positionnées, de sorte que l’oviducte distal se trouvait entre les électrodes pour une livraison basée sur l’électroporation.
Les oviductes ont été récoltés 4 jours après la chirurgie et étirés en retirant le mésosallex pour visualiser la spécificité de l’électroporation. À l’aide d’électrodes de type pince à épiler de 1 mm ou 3 mm, la zone ciblée, marquée avec TdTomato, a été limitée à l’épithélium distal de l’oviducte (figure 4A,D). La taille de cette zone ciblée a ensuite été contrôlée à l’aide d’électrodes de différentes tailles. À l’aide d’électrodes de type pince à épiler de 3 mm, nous avons ciblé une zone beaucoup plus grande de l’AMP (Figure 4B,C), par rapport à la pointe la plus distale, l’INF (Figure 4E,F), en utilisant des électrodes de type pince à épiler de 1 mm. Ces oviductes récoltés ont été fixés, traités avec un gradient de saccharose et sectionnés à l’aide d’un cryostat pour des analyses détaillées. Les coupes ont été contre-colorées avec Hoescht 33342 et Phalloïdine pour colorer respectivement les noyaux et le cytosquelette, puis elles ont été imagées à l’aide d’un microscope confocal à balayage ponctuel. Dans la région ciblée, des cellules électroporées, marquées par TdTomato, ont été distribuées au hasard parmi des cellules non électroporées (TdTomato-ve) (Figure 4G). De plus, les cellules électroporées étaient limitées à l’épithélium muqueux et ne se trouvaient pas dans la couche stromale ou musculaire sous-jacente (Figure 4G,H). Enfin, pour confirmer l’édition de gènes médiée par CRISPR-Cas, les cellules TdTomato+ve peuvent être isolées par tri cellulaire activé par fluorescence (FACS) pour l’isolement de l’ADN et le séquençage MiSeq12.
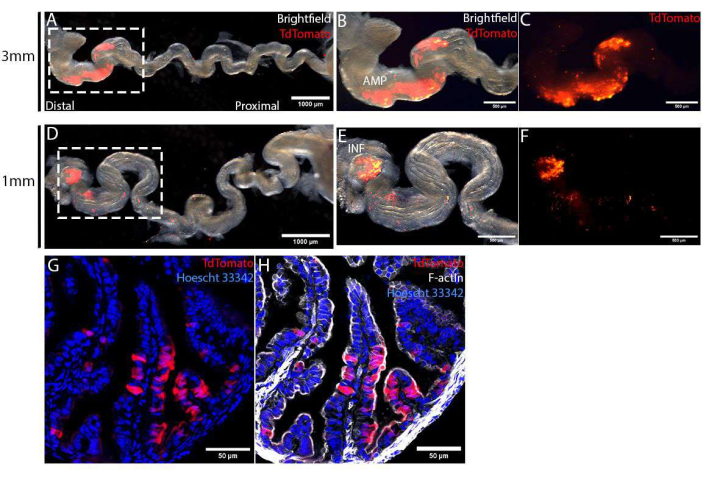
Figure 4 : Validation de l’injection in vivo réussie et de l’électroporation des cellules épithéliales de l’oviducte, 4 jours après la chirurgie. (A-C) Électroporation à l’aide d’électrodes de type pince de 3 mm. L’oviducte a été déroulé en retirant le mésosalpix pour une meilleure visualisation de la spécificité d’électroporation (A). La zone d’électroporation, identifiée par l’expression de TdTomato, était limitée à l’oviducte distal, marqué AMP (B,C). (D-F) Électroporation à l’aide d’électrodes de type pince à épiler de taille 1 mm. L’oviducte a été déroulé en retirant le mésosalpin pour une meilleure visualisation de la spécificité d’électroporation (D). La zone d’électroporation était limitée à l’infundibulum (marqué INF), l’extrémité la plus distale de l’oviducte (E,F). (G,H) Coupe transversale de l’oviducte distal 4 jours après l’électroporation avec des plasmides PCS2 CreNLS. Les cellules électroporées marquées avec TdTomato (G) ont été limitées à la monocouche épithéliale (H). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les étapes cruciales de ce protocole détaillé sont la microinjection de solution d’ADN/ARN/PNR dans la lumière oviducte et le contrôle de la force et de la surface d’électroporation. Une fuite de solution d’ADN/ARN/RNP pendant la microinjection peut provoquer la transfection de zones/cellules indésirables. Pour une électroporation constante et efficace, il est préférable de remplir la lumière oviducte avec la solution (Figure 3C,D). En effet, la zone d’électroporation est principalement contrôlée par la taille et le placement des électrodes. Une électroporation faible réduit le nombre de cellules électroporées, et une électroporation brutale peut provoquer l’électroporation de cellules indésirables ou perturber la structure des tissus. Le nombre de cellules électroporées peut être modifié en ajustant la concentration de la solution ADN/ARN/RNP ou les paramètres d’électroporation. Cependant, étant donné que des tensions élevées / production de chaleur pendant l’électroporation pourraient endommager le tissu, ces paramètres doivent être testés avant d’être utilisés sur des souris vivantes / anesthésiées. Enfin, en raison de la nature exigeante de cette procédure, il est recommandé de pratiquer l’exposition des voies et la micro-injection sur des souris mortes avant d’effectuer cette chirurgie sur des souris vivantes / anesthésiées.
Il est reconnu que plusieurs gènes sont impliqués dans l’initiation du cancer, ainsi, la récapitulation de cet événement nécessite une modification multi-allélique de plusieurs gènes. De plus, on sait également que toutes les cellules ne sont pas également sensibles aux mutations oncogènes9. La modélisation du cancer nécessite donc des lignées de souris Cre spécifiques pour obtenir un contrôle étroit des agressions oncogènes. Cependant, leur disponibilité et leur spécificité posent divers défis, notamment des effets sur les tissus non ciblés et la létalité19. De plus, les G-GEMM traditionnels entraînent des coûts de maintenance élevés et nécessitent du temps pour la génération de lignées de souris. Le développement de la technologie d’édition du génome CRISPR / Cas9 et l’amélioration de la livraison de gènes dans des cellules somatiques spécifiques nous ont permis de surmonter ces problèmes. Dans ce protocole, nous présentons une méthode d’administration ADN/ARN/RNP pour la manipulation du génome somatique qui peut être utilisée pour la modélisation du cancer, sans le besoin absolu de lignées de souris spécifiques12. En injectant des solutions d’ADN/ARN/PNR dans la lumière et en utilisant différentes tailles d’électrodes de type pince à épiler pour l’administration basée sur l’électroporation, les zones restreintes de l’épithélium muqueux oviducte de souris sont ciblées (Figure 4A-F). Ceci est particulièrement utile pour modéliser l’initiation des HGSC qui proviennent de l’extrémité distale de la trompe de Fallope.
La méthode de micro-injection et d’électroporation in vivo présentée est très polyvalente pour cibler les tissus/organes avec une lumière. Le parenchyme d’organe peut également être ciblé à l’aide de cette méthode14. Les approches d’administration virale, comme les systèmes lentiviral et adénoviral, peuvent également être utilisées à des fins similaires. Cependant, les avantages de l’électroporation par rapport aux approches d’administration virale sont: 1) l’administration de plasmides multiples dans des cellules individuelles, 2) aucune restriction sur la taille de l’insert15 et 3) un contrôle facile de la zone et du moment de l’accouchement. En outre, la spécificité du ciblage peut être améliorée en utilisant des promoteurs spécifiques à la lignée. Ceci est parfois difficile dans les systèmes viraux en raison de la limite sur l’emballage viral.
Comme c’est la nature de l’électroporation, les cellules épithéliales électroporées sont entrecoupées au hasard de cellules saines non éditées (Figure 4G). Cependant, ce mosaïcisme dans les cellules génétiquement modifiées et non modifiées pourrait être avantageux pour étudier l’initiation du cancer, car il récapitule la nature sporadique de l’initiation précoce du cancer dans un microenvironnement immunocompétent. La fréquence des cellules électroporées peut être ajustée en faisant varier les concentrations de solution ADN/ARN/RNP et/ou les paramètres d’électroporation. En utilisant l’édition de gènes médiée par CRISPR-Cas en combinaison avec le protocole présenté, il est facile de cribler plusieurs gènes et de générer des modèles hétérogènes de mutations / combinaisons alléliques dans des gènes ciblés; ceci est particulièrement utile dans la modélisation des cancers qui présentent un nombre considérable d’altérations génomiques comme HGSC20,21. De plus, en séquençant des gènes ciblés au cours de la progression du cancer, il est possible de suivre l’évolution clonale in vivo des tumeurs et des métastases chez des souris immunocompétentes12.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient Katie Teng et le Dr Matthew J. Ford d’avoir fourni des plasmides utilisés pour générer des résultats représentatifs et optimiser le protocole. K.H. a bénéficié d’une subvention de doctorat du Fonds de recherche du Québec - Santé (FRQS), de la Fondation Donnor, de la bourse Delta Kappa Gamma World, du Centre de recherche en reproduction et développement (CRRD), de Hugh E. Burke, Rolande & Marcel Gosselin et de bourses d’études supérieures Alexander McFee.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter unit | LifeGene | SF0.22PES | |
| 1 mL syringe | Terumo Medical Corportation | SS-01T | |
| 1 mm tweezer-type electrodes | BEX CO., LTD | LF650P1 | |
| 3 mm tweezer-type electrodes | BEX CO., LTD | LF650P3 | |
| 30G x 1/2 Needle | BD | 305106 | Needle is attached to the 1 mL syringe when using injectable anesthetic or analgesic. |
| Adson forceps | Fisher Scientific | 10-000-451 | |
| Air-pressured syringe | BD | B302995 | Attached to the micromanipulator; as shown in Figure 2B |
| Analgesic | - | - | Carprofen, dose: 5mg/kg. |
| Antiseptic | Cardinal Health | OMEL0000017 | Baxedin: 2% chlorhexidine in 70% isopropyl alcohol |
| Avertin (2,2,2-tribromoethanol) - Anesthetic | Sigma Aldrich | T48402-25G | |
| Clamp mount micromanipulator | AD Instruments | MM-33 | |
| Curved serrated forceps | Fisher Scientific | NC0696845 | |
| Dissecting microscope | Zeiss | SteREO Discovery.V8 | Apochromat S, 0.63X, FWD 107mm. Attached KL 200 LED for top light, labelled as light source in Figure 2B. |
| Eye lubricant | Alcon | - | Systane ointment (Lubricant eye ointment) |
| Glass capillary needles | Sutter Instrument Co. | B100–50-10 | Outside diameter: 1 mm, inside diameter: 0.5 mm, length: 10 cm |
| Hartman hemostats | Fisher Scientific | 50-822-711 | |
| Heating pad/disc | - | - | SnuggleSafe Pet Bed Microwave Heating Pad was used in this protocol. Microwave for 2-5min, and test with back of gloved hand. |
| Magnetic Mount for micromanipulator | AD Instruments | MB-B | Used to keep the clamp mount micromanipulator stable and upright during injection. |
| Micro bulldog clamp | Fisher Scientific | 50-822-230 | 3 cm |
| Micropipette puller | Sutter Instrument Co. | P-97 | P-97 Flaming/Brown type micropipette puller. Program used: P = 500, Heat = 576, PULL = 50, VEL = 80, DEL = 70 |
| Petri dish | Fisher Scientific | 263991 | Autoclaved/sterile glass petridishes can also be used. |
| Phosphate Buffered Saline (PBS) | Bio Basic Inc. | PD8117 | 10X PBS was diluted to 1X with DI water. Autoclave before use. |
| Pulse generator/Electroporator | BEX CO., LTD | CUY21 EDIT II | Electroporation settings: 30 V, 3 pulses, 1 s interval, P. length = 50 ms, unipolar |
| Rosa-LSLtdTomato mice | The Jackson Laboratory | 7914 | Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J |
| Sharp-blunt dissection scissors | Fisher Scientific | 28251 | |
| Sharp-pointed dissecting scissors | Fisher Scientific | SDI130 | |
| Shaver | - | - | Hair removal cream can also be used. |
| Silk braided sutures | Ethicon | 682G | 3/8 circle, gauge: 5-0, needle size: 18 mm, thread length: 75 cm. Staples can also be used. |
| Tapered ultrafine tip forceps | Fisher Scientific | 12-000-122 | |
| Thin absorbent paper | Kimberly-Clark Professional | 34120 | Kimwipes |
| Trypan blue | STEMCELL Technologies | 7050 | Filtered using 0.22 µm sterile filter before use for microinjection. |
Références
- Avilés, M., Coy, P., Rizos, D. The oviduct: A key organ for the success of early reproductive events. Animal Frontiers. 5 (1), 25-31 (2015).
- Li, S., Winuthayanon, W. Oviduct: roles in fertilization and early embryo development. The Journal of Endocrinology. 232 (1), R1-R26 (2017).
- Briceag, I., et al. Fallopian tubes--literature review of anatomy and etiology in female infertility. Journal of Medicine and Life. 8 (2), 129-131 (2015).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Labidi-Galy, S. I., et al. High grade serous ovarian carcinomas originate in the fallopian tube. Nature Communications. 8 (1), 1093 (2017).
- Shaw, P. A., Rouzbahman, M., Pizer, E. S., Pintilie, M., Begley, H. Candidate serous cancer precursors in fallopian tube epithelium of BRCA1/2 mutation carriers. Modern Pathology. 22 (9), 1133-1138 (2009).
- Soong, T. R., et al. Evidence for lineage continuity between early serous proliferations (ESPs) in the Fallopian tube and disseminated high-grade serous carcinomas. The Journal of Pathology. 246 (3), 344-351 (2018).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. The Journal of Pathology. 211 (1), 26-35 (2007).
- Puisieux, A., Pommier, R. M., Morel, A. P., Lavial, F. Cellular pliancy and the multistep process of tumorigenesis. Cancer Cell. 33 (2), 164-172 (2018).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677 (2021).
- Teng, K., et al. Modeling high-grade serous ovarian carcinoma using a combination of in vivo fallopian tube electroporation and CRISPR-Cas9-mediated genome editing. Cancer Research. 81 (20), 5147-5160 (2021).
- Ford, M. J., Yamanaka, Y. Reprogramming mouse oviduct epithelial cells using in vivo electroporation and CRISPR/Cas9-mediated genetic manipulation. Methods in Molecular Biology. 2429, 367-377 (2022).
- Maresch, R., et al. Multiplexed pancreatic genome engineering and cancer induction by transfection-based CRISPR/Cas9 delivery in mice. Nature Communications. 7, 10770 (2016).
- Braun, C. J., Adames, A. C., Saur, D., Rad, R. Tutorial: design and execution of CRISPR in vivo screens. Nature Protocols. 17 (9), 1903-1925 (2022).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Chazaud, C., Yamanaka, Y., Pawson, T., Rossant, J. Early lineage segregation between epiblast and primitive endoderm in mouse blastocysts through the Grb2-MAPK pathway. Developmental Cell. 10 (5), 615-624 (2006).
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature Reviews. Cancer. 10 (7), 470-480 (2010).
- Kroeger Jr, P. T., Drapkin, R. Pathogenesis and heterogeneity of ovarian cancer. Current Opinion in Obstetrics & Gynecology. 29 (1), 26-34 (2017).
- Cancer Genome Atlas Research Network. Integrated genomic analyses of ovarian carcinoma. Nature. 474 (7353), 609-615 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon