Method Article
Соматические геномно-инженерные модели мышей с использованием микроинъекций и электропорации in vivo
В этой статье
Резюме
Этот протокол описывает микроинъекцию и электропорацию in vivo для регионально ограниченного CRISPR-опосредованного редактирования генома в яйцеводе мыши.
Аннотация
Генно-инженерные модели мышей зародышевой линии (G-GEMM) предоставили ценную информацию о функции генов in vivo в развитии, гомеостазе и болезнях. Тем не менее, время и затраты, связанные с созданием и обслуживанием колонии, высоки. Недавние достижения в области CRISPR-опосредованного редактирования генома позволили генерировать соматические ГЭММ (S-ГЭММ) путем прямого нацеливания на интересующую клетку/ткань/орган.
Яйцевод, или фаллопиева труба у людей, считается тканью происхождения наиболее распространенного рака яичников, серозных карцином яичников высокой степени злокачественности (HGSC). HGSC инициируются в области фаллопиевой трубы дистальнее матки, расположенной рядом с яичником, но не проксимальным отделом фаллопиевой трубы. Тем не менее, традиционные мышиные модели HGSC нацелены на весь яйцевод и, таким образом, не повторяют состояние человека. Мы представляем метод микроинъекции раствора ДНК, РНК или рибонуклеопротеина (РНП) в просвет яйцевода и электропорации in vivo для нацеливания на эпителиальные клетки слизистой оболочки в ограниченных областях вдоль яйцевода. Существует несколько преимуществ этого метода для моделирования рака, таких как: 1) высокая адаптивность в нацеливании на область/ткань/орган и область электропорации, 2) высокая гибкость в целевых типах клеток (клеточная гибкость) при использовании в сочетании со специфическими промоторами для экспрессии Cas9, 3) высокая гибкость в количестве электропорированных клеток (относительно низкая частота), 4) не требуется специфическая линия мыши (иммунокомпетентное моделирование заболевания), 5) высокая гибкость в комбинации генных мутаций и 6) возможность отслеживания электропорированных клеток при использовании в комбинации с репортерной линией Cre. Таким образом, этот экономически эффективный метод повторяет инициацию рака человека.
Введение
Фаллопиева труба, называемая у мышей яйцеводом, представляет собой трубчатую структуру, которая соединяет матку с яичником. Он играет важную роль в размножении млекопитающих, обеспечивая среду для внутреннего оплодотворения и предимплантационного развития 1,2. Несмотря на его важность, мало что известно о его функции и гомеостазе, отчасти из-за развития методов экстракорпорального оплодотворения, позволяющих обойти любую проблему бесплодия, связанную с этим органом3. Тем не менее, было признано, что предраковые поражения серозной карциномы яичников высокой степени злокачественности (HGSC), агрессивного гистотипа рака яичников, на долю которого приходится около 75% карцином яичников и 85% связанных с ними смертей4, ограничены дистальным эпителием фаллопиевых труб 5,6,7,8 . Это указывает на то, что не все клетки в нашем организме одинаково восприимчивы к онкогенным воздействиям, а только уникальные/восприимчивые клетки в каждой ткани/органе становятся клетками происхождения рака, называемыми клеточной податливостью9. Таким образом, было показано, что эпителиальные клетки дистального отдела маточной трубы, расположенные рядом с яичником, отличаются от остальной части трубы10,11. Таким образом, традиционные мышиные модели HGSC, которые нацелены на все клетки яйцевода, не повторяют состояние человека. В недавнем исследовании мы использовали комбинацию CRISPR-опосредованного редактирования генома, электропорации яйцевода in vivo и отслеживания линий на основе Cre, чтобы успешно индуцировать HGSC путем мутации четырех генов-супрессоров опухолей в дистальном яйцеводемыши 12,13. В этой рукописи представлен пошаговый протокол, описывающий эту процедуру микроинъекции и электропорации in vivo для воздействия на эпителий слизистой оболочки яйцевода мыши.
Этот метод имеет ряд преимуществ. Он может быть адаптирован для воздействия на другие ткани/органы, включая паренхимуоргана 14. Хотя другие подходы к доставке генов in vivo, такие как лентивирусные и аденовирусные системы, могут быть использованы для достижения аналогичного тканеспецифического / органоспецифического нацеливания, область нацеливания легче регулировать с использованием различных размеров электродов пинцетного типа для доставки на основе электропорации. В зависимости от концентрации ДНК/РНК/рибонуклеопротеинов (РНП), параметров электропорации и размера электродов количество электропорированных клеток может быть изменено. Кроме того, конкретные типы клеток могут быть нацелены при использовании в сочетании с промоторами для экспрессии Cas9 без абсолютной необходимости в генетически модифицированных моделях мышей Germline (G-GEMM). Кроме того, в отличие от систем доставки вирусов, электропорация позволяет многократно доставлять плазмиды в отдельные клетки и меньше ограничивать размер вставной ДНК15. Скрининг генных мутаций in vivo также может быть выполнен с относительной легкостью из-за этой высокой гибкости. Кроме того, электропорированные ячейки могут быть отслежены или прослежены, когда этот метод используется в сочетании с репортерными линиями Cre, такими как Tdtomato или Confetti16,17.
протокол
Животные были размещены в статических микроизоляционных клетках с фильтрующими крышками, расположенных в специальном помещении, содержащем шкаф биобезопасности типа II. Все работы с животными были выполнены в соответствии с институциональными руководящими принципами и были одобрены Комитетом по уходу за животными факультета медицины и медицинских наук Университета Макгилла (AUP #7843).
1. Подготовка иглы для микроинъекций
- Втяните стеклянную капиллярную трубку в острую точку с помощью микропипетки-съемника со следующей программой: P = 500, Heat = 576, PULL = 50, VEL = 80, DEL = 70.
- Используя пару конических щипцов с ультратонким наконечником, отрежьте заостренный конец вытянутой капиллярной трубки под рассекающим микроскопом, чтобы создать отверстие, как показано на рисунке 1A, B. Следите за тем, чтобы отверстие не было слишком большим, так как это повредит яйцевод и предотвратит медленную инъекцию.
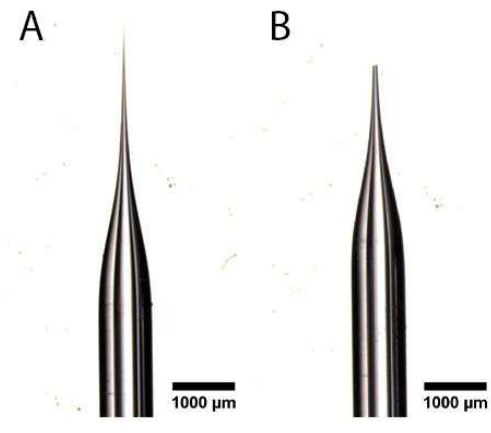
Рисунок 1: Подготовка иглы для микроинъекций. (А, Б) Вытянутая капиллярная трубка с заостренным концом (А), которая была обрезана для создания отверстия (В). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Подготовка анестетика для внутрибрюшинной инъекции
- Готовят процеженный, разведенный авертин в день операции. Исходный раствор авертина (2,2,2-трибромэтанола) готовят в концентрации 1,6 г/мл в трет-амиловом спирте путем интенсивного перемешивания и хранят в темноте.
- Разбавьте исходный раствор авертина 1,25% изотоническим раствором до конечной концентрации 20 мг/мл внутри вытяжного шкафа. Встряхните разбавленный авертин и пропустите через стерильный фильтр 0,22 мкм. Хранить в темноте.
3. Подготовка операционного участка
- Операционная зона должна быть выделена стерильной средой, предпочтительно чистой скамьей или шкафом биобезопасности. При необходимости расставьте стерильное хирургическое оборудование, микроскоп, микроманипулятор и электропоратор. Пример этого показан на рисунке 2.
- Нагрейте грелку/диск и поместите ее под чистую, полностью оборудованную клетку. Эта клетка будет использоваться для размещения мышей после операции.
- Налейте стерильный 1x фосфатный буферный физиологический раствор (PBS) в стерильную чашку Петри. Чистыми ножницами разрежьте впитывающую бумагу на квадраты с приблизительными размерами 1 см х 1 см. Бросьте эти кусочки впитывающей бумаги в 1x PBS, чтобы они замочились.
4. Приготовление раствора и иглы для инъекции
- Приготовьте раствор для инъекций в день операции. Смешайте ДНК/РНК/РНП с отфильтрованным трипановым синим до минимальной конечной концентрации 200 нг/мкл каждый и 5% соответственно. Перед инъекцией хранить при комнатной температуре.
ПРИМЕЧАНИЕ: Используйте шприц объемом 1 мл, чтобы набрать 100% трипановый синий и отфильтровать через стерильный фильтр 0.22 мкм перед использованием. - Прикрепите вытянутую капиллярную иглу, далее называемую иглой для микроинъекций, к микроманипулятору с зажимным креплением, стабилизированному магнитным креплением (настройка показана на рисунке 2B).
- Пипеткой 2 мкл раствора для инъекций на стерильную чашку Петри. Во время наблюдения под микроскопом медленно наберите 1-2 мкл этого раствора в иглу для микроинъекций с помощью шприца под давлением воздуха, прикрепленного к микроманипулятору. Избегайте образования пузырьков / попадания пузырьков в иглу для микроинъекций.

Рисунок 2: Подготовка операционной зоны. (A) Установка операционной зоны внутри чистой скамьи. (B) Диссекционный микроскоп и микроманипулятор для правши. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Обнажение женских половых путей
- Анестезировать 6-8-недельную самку мыши, вводя фильтрованный, разбавленный авертин (анестетик) внутрибрюшинно в дозе 0,25-0,5 мг / г. После этого вводят карпрофен (упреждающий анальгетик) подкожно в дозе 5 мг / кг.
ПРИМЕЧАНИЕ: Другими альтернативами, которые можно использовать в качестве анестетика, являются изофлуран или кетамин / ксилазин. - Положите впитывающую бумагу на чистую прокладку/диск с подогревом. Затем поместите анестезированную мышь на эту нагретую впитывающую бумагу тыльной стороной вверх. Нанесите смазку для глаз на каждый глаз, чтобы предотвратить высыхание во время операции.
ПРИМЕЧАНИЕ: Убедитесь, что грелка/диск слегка теплые на ощупь, проверив тыльной стороной ладони. - Проверьте остановку глубокого анестетика, ущипнув палец мыши под наркозом парой щипцов. Удалите дорсальный мех вокруг предполагаемого места разреза (место показано на рисунке 3A) и протрите голую кожу антисептиком.
- Используйте пару прямых тупых щипцов, чтобы ущипнуть голую кожу, и сделайте разрез длиной 1 см вдоль средней линии тела с помощью стерильных острых тупых ножниц. Очистите область вокруг разреза антисептиком.
- Зажмите и удерживайте одну сторону места разреза с помощью пары стерильных щипцов Адсона. Затем, используя пару стерильных изогнутых зубчатых щипцов, аккуратно отделите кожу от стенки тела, начиная со среднего разреза и двигаясь в боковом направлении.
- Найдите жировую подушку ниже почки. Используя пару стерильных прямых тупых щипцов, зажмите стенку тела прямо над жировой подушкой. Сделайте небольшой разрез в стенке тела с помощью стерильных ножниц для рассечения с острыми концами, стараясь избегать кровеносных сосудов.
- Продолжая зажимать стенку тела прямыми тупыми щипцами, вставьте в разрез пару стерильных тупых изогнутых щипцов и расширьте разрез, созданный в стенке тела.
- Возьмите видимую жировую подушку тупыми изогнутыми щипцами и вытащите ее из отверстия, чтобы обнажить яичник, яйцевод и матку.
- Чтобы репродуктивный тракт оставался открытым, зажмите жировую подушку стерильным бульдожьим зажимом, как показано на рисунке 3B.
6. Инъекции яйцевода in vivo и электропорация
- Осторожно поместите нагретую абсорбирующую бумагу и анестезированную мышь с обнаженным репродуктивным трактом на столик препарирующего микроскопа, чтобы можно было наблюдать за трактом. Пример вида, наблюдаемого под микроскопом, показан на рисунке 3B.
- Отрегулируйте микроманипулятор так, чтобы инъекционная игла с раствором также могла наблюдаться под микроскопом.
- Используя пару стерильных конических щипцов с ультратонкими наконечниками, удерживайте область яйцевода, которая должна быть введена, устойчиво. Область, подлежащая инъекции, должна соответствовать направлению иглы для микроинъекции.
ПРИМЕЧАНИЕ: Используйте бульдожий зажим, закрепляющий жировую подушку и репродуктивный тракт, чтобы аккуратно повернуть / переместить тракт в оптимальное положение, если это необходимо. - Отрегулируйте микроманипулятор так, чтобы проколоть яйцевод иглой для микроинъекций, одновременно подавая яйцевод на иглу с помощью конических щипцов с ультратонким наконечником. Осторожно переместите иглу для микроинъекций, чтобы убедиться, что она была введена в яйцевод.
ПРИМЕЧАНИЕ: Вставьте иглу для микроинъекций в прямой сегмент, а не в точку поворота свернутого яйцевода, чтобы предотвратить множественные проколы и утечку инъекционного раствора. - Медленно вводят до 1 мкл раствора в яйцевод, наблюдая при этом за движением синего раствора и расширением просвета яйцевода под микроскопом. Следите за тем, чтобы в просвет не попадали пузырьки. Репрезентативные изображения яйцеводов, инъецированных 100% трипановым синим, показаны на рисунке 3C, D.
- Извлеките иглу из яйцевода. Накройте область, на которую будет нацелена, куском впитывающей бумаги, предварительно пропитанной стерильным 1x PBS (из шага 3.3).
- Возьмитесь за предварительно пропитанную бумагу и область/область, на которую нужно нацелиться, с помощью пинцета электродов (1 мм, 3 мм или 5 мм, в зависимости от размера области, на которую нужно нацелиться) и оттяните от тела перед электропорированием, используя следующие настройки на генераторе импульсов/электропораторе: 30 В, три импульса, интервал 1 с, Длительность импульса 50 мс, униполярная.
ПРИМЕЧАНИЕ: Расстояние между электродами должно быть установлено таким образом, чтобы электроды могли зажиматься в целевой области, не деформируя яйцевод. Рекомендуемое расстояние составляет около 1 мм. - После электропорации удалите впитывающую бумагу и поместите мышь (с нагретой впитывающей бумагой под ней) обратно на грелку. Разжмите бульдожий зажим и осторожно протолкните оголенный репродуктивный тракт обратно под стенку тела. Повторите секцию 5, чтобы обнажить репродуктивный тракт с другой стороны.
ПРИМЕЧАНИЕ: Электропорация успешна независимо от стадии эстрады мыши, если просвет заполнен раствором. - Накройте открытый тракт абсорбирующей бумагой, предварительно пропитанной стерильным 1x PBS, чтобы предотвратить его высыхание, затем подготовьте иглу для микроинъекций ко второй инъекции, повторив шаги 4.2 и 4.3.
ПРИМЕЧАНИЕ: При необходимости замените иглу для микроинъекций. Предотвратите высыхание открытых тканей, применяя стерильный 1x PBS, когда это необходимо. - Повторите шаги, описанные выше, чтобы ввести и электропорировать яйцевод с противоположной стороны.
ПРИМЕЧАНИЕ: Повторно наносите смазку для глаз по мере необходимости во время и после операции. - После того, как оба яйцевода были электропорированы и помещены обратно под стенку тела, зашить или скрепить спинным местом разреза. Для наложения швов используйте гемостат, чтобы захватить иглу шелковых плетеных швов (круг 3/8; калибр: 5-0; размер иглы: 18 мм; длина нити: 75 см). Зажмите и удерживайте одну сторону места разреза с помощью пары стерильных изогнутых зубчатых щипцов, затем используйте гемостат, чтобы манипулировать швом, чтобы закрыть рану.
- Переместите мышь в чистую клетку, которая помещается поверх нагревательной подушечки/диска (из шага 3.2), и наблюдайте до тех пор, пока мышь не станет активной.
- Вводите 5 мг / кг карпрофена подкожно каждые 24 часа в течение следующих 3 дней и контролируйте в течение следующих 10 дней.
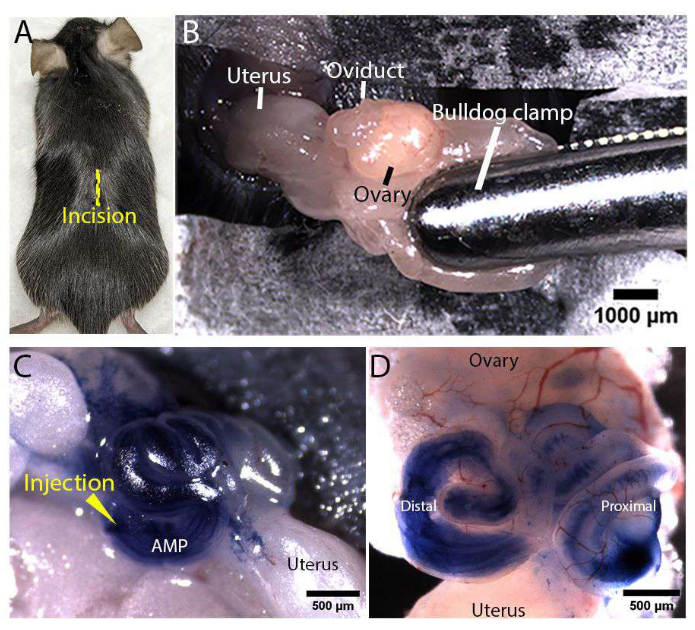
Рисунок 3: Воздействие на женский репродуктивный тракт и микроинъекции . (A) Расположение разреза по средней линии (показано желтой линией) на дорсальной стороне мыши Rosa-LSLtdTomato. (B) Воздействие на женский репродуктивный тракт. Жировая подушка была зажата с помощью стерильного бульдожьего зажима, чтобы закрепить тракт и держать его открытым. (С,Д) Репрезентативные изображения инъекций яйцевода in vivo . Иглу для микроинъекций вводили в дистальную ампулу (помеченную АМФ), и отфильтрованный 100% трипановый синий вводили в просвет яйцевода, в то время как тракт был открыт (С). Репрезентативное изображение рассеченного яйцевода, демонстрирующее, что введенный раствор трипанового синего распределяется по всему дистальному и проксимальному просвету яйцевода (D). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
На рисунках 1 и 2 изображена подготовка иглы для микроинъекций и настройка хирургической зоны, соответственно, для микроинъекции in vivo и электропорации яйцевода мыши. Во время операции женский репродуктивный тракт был обнажен через разрезы, сделанные на дорсальной коже (рис. 3A) и стенке тела анестезированной мыши Rosa-LSLtdTomato (Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J)17. Бульдожий зажим был закреплен на жировой подушке над трактом, чтобы держать ее открытой и закрепленной (рис. 3B). Инъекционный раствор, содержащий плазмиды PCS2 CreNLS18 в концентрации 400 нг/мкл, вводили в ампулу (меченую АМФ) свернутого яйцевода и позволяли рассеиваться по всему просвету яйцевода (рис. 3C, D). Хотя плазмиды PCS2 CreNLS были использованы для получения репрезентативных результатов в этой рукописи, описанный метод может быть использован с легко взаимозаменяемыми ДНК/РНК/РНК в растворе для инъекционного раствора для CRISPR/Cas-опосредованного редактирования генов в яйцеводе мыши. Затем были размещены электроды пинцетного типа толщиной 1 мм или 3 мм таким образом, чтобы дистальный яйцевод находился между электродами для доставки на основе электропорации.
Яйцеводы собирали через 4 дня после операции и растягивали путем удаления мезосальпинкса для визуализации специфичности электропорации. Используя 1 мм или 3 мм электроды пинцетного типа, целевая область, помеченная TdTomato, была ограничена дистальным эпителием яйцевода (рис. 4A, D). Размер этой целевой области дополнительно контролировался с помощью электродов разных размеров. Используя 3-миллиметровые пинцетные электроды, мы нацелились на гораздо большую площадь АМФ (рис. 4B, C) по сравнению с нацеливанием только на самый дистальный кончик, INF (рис. 4E, F), используя 1 мм электроды пинцетного типа. Эти собранные яйцеводы фиксировали, обрабатывали градиентом сахарозы и разрезали с помощью криостата для детального анализа. Срезы были контрокрашены Hoescht 33342 и фаллоидином для окрашивания ядер и цитоскелета соответственно, затем их визуализировали с помощью точечного сканирующего конфокального микроскопа. В целевой области электропорированные клетки, отмеченные TdTomato, были случайным образом распределены между неэлектропорированными (TdTomato-ve) клетками (рис. 4G). Кроме того, электропорированные клетки были ограничены эпителием слизистой оболочки и не обнаруживались в нижележащем стромальном или мышечном слое (рис. 4G, H). Наконец, чтобы подтвердить CRISPR-Cas-опосредованное редактирование генов, клетки TdTomato+ve могут быть выделены с помощью флуоресцентно-активированной сортировки клеток (FACS) для выделения ДНК и секвенирования MiSeq12.
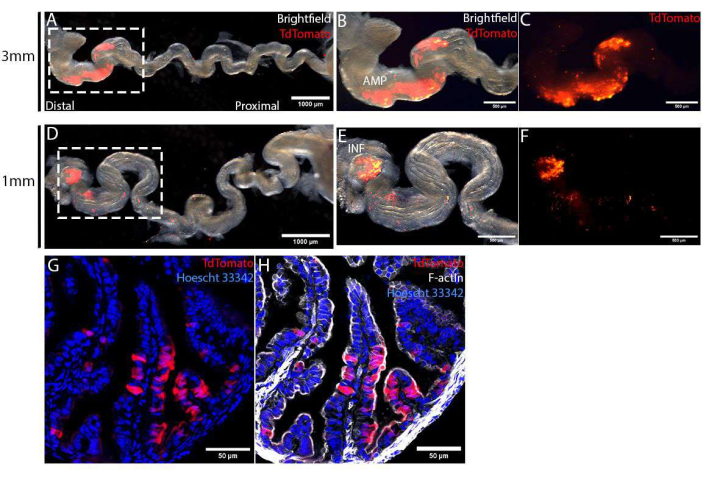
Рисунок 4: Валидация успешных инъекций in vivo и электропорации эпителиальных клеток яйцевода через 4 дня после операции. (А-С) Электропорация с использованием пинцетных электродов размером 3 мм. Яйцевод разматывали путем удаления мезосальпинкса для лучшей визуализации специфичности электропорации (А). Область электропорации, идентифицированная экспрессией TdTomato, была ограничена дистальным яйцеводом, меченным AMP (B, C). (Д-Ж) Электропорация с использованием пинцетных электродов размером 1 мм. Яйцевод разматывали путем удаления мезосальпинкса для лучшей визуализации электропорационной специфичности (D). Область электропорации была ограничена инфундибулумом (обозначенным INF), самым дистальным концом яйцевода (E, F). (Г,Г) Поперечный срез дистального яйцевода через 4 дня после электропорации плазмидами PCS2 CreNLS. Электропорированные клетки, меченные TdTomato (G), были ограничены эпителиальным монослоем (H). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Важнейшими шагами в этом подробном протоколе являются микроинъекция раствора ДНК/РНК/РНП в просвет яйцевода и контроль силы и площади электропорации. Утечка раствора ДНК/РНК/РНП во время микроинъекции может вызвать трансфекцию нежелательных участков/клеток. Для последовательной и эффективной электропорации предпочтительно заполнять раствором просвет яйцевода (рис. 3C, D). Это связано с тем, что область электропорации в основном контролируется размером и размещением электродов. Слабая электропорация уменьшает количество электропорированных клеток, а жесткая электропорация может вызвать электропорацию нежелательных клеток или нарушить структуру ткани. Количество электропорированных клеток можно варьировать, регулируя концентрацию раствора ДНК/РНК/РНП или параметры электропорации. Однако, поскольку высокое напряжение / тепловыделение во время электропорации может повредить ткань, эти параметры следует проверить перед использованием на живых/анестезированных мышах. Наконец, из-за сложного характера этой процедуры рекомендуется практиковать воздействие на тракт и микроинъекции на мертвых мышах перед выполнением этой операции на живых / анестезированных мышах.
Признано, что несколько генов участвуют в инициации рака, поэтому повторение этого события требует мультиаллельной модификации нескольких генов. Кроме того, известно также, что не все клетки одинаково восприимчивы к онкогенным мутациям9. Таким образом, моделирование рака требует определенных линий мышей Cre для достижения жесткого контроля онкогенных повреждений. Однако их доступность и специфичность вызывают различные проблемы, включая воздействие на нецелевые ткани и летальность19. Кроме того, традиционные G-GEMM несут высокие затраты на техническое обслуживание и требуют времени для генерации мышиной линии. Разработка технологии редактирования генома CRISPR/Cas9 и улучшение доставки генов в специфические соматические клетки позволили нам преодолеть эти проблемы. В этом протоколе мы представляем метод доставки ДНК/РНК/РНП для манипуляций с соматическим геномом, который может быть использован для моделирования рака без абсолютной необходимости в конкретных линиях мыши12. Путем инъекции растворов ДНК/РНК/РНК в просвет и использования электродов типа пинцета разного размера для доставки на основе электропорации нацелены на ограниченные участки эпителия слизистой оболочки яйцевода мыши (рис. 4A-F). Это особенно полезно при моделировании инициации HGSC, которые происходят из дистального конца фаллопиевой трубы.
Представленный метод микроинъекций и электропорации in vivo очень универсален для нацеливания просвета на ткани/органы. Паренхима органа также подвержена нацеливанию с помощью этого метода14. Подходы к доставке вирусов, такие как лентивирусная и аденовирусная системы, также могут использоваться для аналогичных целей. Однако преимущества электропорации по сравнению с подходами к вирусной доставке заключаются в следующем: 1) многократная доставка плазмиды в отдельные клетки, 2) отсутствие ограничений на размер вставки15 и 3) простой контроль площади и времени доставки. Кроме того, специфичность таргетинга может быть улучшена за счет использования промоутеров, специфичных для линии. Иногда это затруднительно в вирусных системах из-за ограничения на вирусную упаковку.
Как и природа электропорации, электропорированные эпителиальные клетки случайным образом перемежаются со здоровыми, неотредактированными клетками (рис. 4G). Тем не менее, этот мозаицизм в генетически модифицированных и немодифицированных клетках может быть полезен для изучения инициации рака, поскольку он повторяет спорадический характер ранней инициации рака в иммунокомпетентном микроокружении. Частоту электропорированных клеток можно регулировать, изменяя концентрацию раствора ДНК/РНК/РНП и/или параметры электропорации. Используя CRISPR-Cas-опосредованное редактирование генов в сочетании с представленным протоколом, легко проводить скрининг нескольких генов и генерировать гетерогенные паттерны мутаций/аллельных комбинаций в целевых генах; это особенно полезно при моделировании рака, который проявляется значительным количеством геномных изменений, таких как HGSCs20,21. Кроме того, секвенируя гены-мишени во время прогрессирования рака, можно проследить клональную эволюцию опухолей и метастазов in vivo у иммунокомпетентных мышей12.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Авторы благодарят Кэти Тенг и доктора Мэтью Форда за предоставление плазмид, используемых для получения репрезентативных результатов и оптимизации протокола. К.Х. был поддержан докторским грантом Fonds de recherche du Québec - Santé (FRQS), Фондом Доннора, Всемирной стипендией Delta Kappa Gamma, Центром исследований в области репродукции и развития (CRRD), аспирантами Хью Э. Берка, Роланда и Марселя Госселина и Александра Макфи.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter unit | LifeGene | SF0.22PES | |
| 1 mL syringe | Terumo Medical Corportation | SS-01T | |
| 1 mm tweezer-type electrodes | BEX CO., LTD | LF650P1 | |
| 3 mm tweezer-type electrodes | BEX CO., LTD | LF650P3 | |
| 30G x 1/2 Needle | BD | 305106 | Needle is attached to the 1 mL syringe when using injectable anesthetic or analgesic. |
| Adson forceps | Fisher Scientific | 10-000-451 | |
| Air-pressured syringe | BD | B302995 | Attached to the micromanipulator; as shown in Figure 2B |
| Analgesic | - | - | Carprofen, dose: 5mg/kg. |
| Antiseptic | Cardinal Health | OMEL0000017 | Baxedin: 2% chlorhexidine in 70% isopropyl alcohol |
| Avertin (2,2,2-tribromoethanol) - Anesthetic | Sigma Aldrich | T48402-25G | |
| Clamp mount micromanipulator | AD Instruments | MM-33 | |
| Curved serrated forceps | Fisher Scientific | NC0696845 | |
| Dissecting microscope | Zeiss | SteREO Discovery.V8 | Apochromat S, 0.63X, FWD 107mm. Attached KL 200 LED for top light, labelled as light source in Figure 2B. |
| Eye lubricant | Alcon | - | Systane ointment (Lubricant eye ointment) |
| Glass capillary needles | Sutter Instrument Co. | B100–50-10 | Outside diameter: 1 mm, inside diameter: 0.5 mm, length: 10 cm |
| Hartman hemostats | Fisher Scientific | 50-822-711 | |
| Heating pad/disc | - | - | SnuggleSafe Pet Bed Microwave Heating Pad was used in this protocol. Microwave for 2-5min, and test with back of gloved hand. |
| Magnetic Mount for micromanipulator | AD Instruments | MB-B | Used to keep the clamp mount micromanipulator stable and upright during injection. |
| Micro bulldog clamp | Fisher Scientific | 50-822-230 | 3 cm |
| Micropipette puller | Sutter Instrument Co. | P-97 | P-97 Flaming/Brown type micropipette puller. Program used: P = 500, Heat = 576, PULL = 50, VEL = 80, DEL = 70 |
| Petri dish | Fisher Scientific | 263991 | Autoclaved/sterile glass petridishes can also be used. |
| Phosphate Buffered Saline (PBS) | Bio Basic Inc. | PD8117 | 10X PBS was diluted to 1X with DI water. Autoclave before use. |
| Pulse generator/Electroporator | BEX CO., LTD | CUY21 EDIT II | Electroporation settings: 30 V, 3 pulses, 1 s interval, P. length = 50 ms, unipolar |
| Rosa-LSLtdTomato mice | The Jackson Laboratory | 7914 | Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J |
| Sharp-blunt dissection scissors | Fisher Scientific | 28251 | |
| Sharp-pointed dissecting scissors | Fisher Scientific | SDI130 | |
| Shaver | - | - | Hair removal cream can also be used. |
| Silk braided sutures | Ethicon | 682G | 3/8 circle, gauge: 5-0, needle size: 18 mm, thread length: 75 cm. Staples can also be used. |
| Tapered ultrafine tip forceps | Fisher Scientific | 12-000-122 | |
| Thin absorbent paper | Kimberly-Clark Professional | 34120 | Kimwipes |
| Trypan blue | STEMCELL Technologies | 7050 | Filtered using 0.22 µm sterile filter before use for microinjection. |
Ссылки
- Avilés, M., Coy, P., Rizos, D. The oviduct: A key organ for the success of early reproductive events. Animal Frontiers. 5 (1), 25-31 (2015).
- Li, S., Winuthayanon, W. Oviduct: roles in fertilization and early embryo development. The Journal of Endocrinology. 232 (1), R1-R26 (2017).
- Briceag, I., et al. Fallopian tubes--literature review of anatomy and etiology in female infertility. Journal of Medicine and Life. 8 (2), 129-131 (2015).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Labidi-Galy, S. I., et al. High grade serous ovarian carcinomas originate in the fallopian tube. Nature Communications. 8 (1), 1093(2017).
- Shaw, P. A., Rouzbahman, M., Pizer, E. S., Pintilie, M., Begley, H. Candidate serous cancer precursors in fallopian tube epithelium of BRCA1/2 mutation carriers. Modern Pathology. 22 (9), 1133-1138 (2009).
- Soong, T. R., et al. Evidence for lineage continuity between early serous proliferations (ESPs) in the Fallopian tube and disseminated high-grade serous carcinomas. The Journal of Pathology. 246 (3), 344-351 (2018).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. The Journal of Pathology. 211 (1), 26-35 (2007).
- Puisieux, A., Pommier, R. M., Morel, A. P., Lavial, F. Cellular pliancy and the multistep process of tumorigenesis. Cancer Cell. 33 (2), 164-172 (2018).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677(2021).
- Teng, K., et al. Modeling high-grade serous ovarian carcinoma using a combination of in vivo fallopian tube electroporation and CRISPR-Cas9-mediated genome editing. Cancer Research. 81 (20), 5147-5160 (2021).
- Ford, M. J., Yamanaka, Y. Reprogramming mouse oviduct epithelial cells using in vivo electroporation and CRISPR/Cas9-mediated genetic manipulation. Methods in Molecular Biology. 2429, 367-377 (2022).
- Maresch, R., et al. Multiplexed pancreatic genome engineering and cancer induction by transfection-based CRISPR/Cas9 delivery in mice. Nature Communications. 7, 10770(2016).
- Braun, C. J., Adames, A. C., Saur, D., Rad, R. Tutorial: design and execution of CRISPR in vivo screens. Nature Protocols. 17 (9), 1903-1925 (2022).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Chazaud, C., Yamanaka, Y., Pawson, T., Rossant, J. Early lineage segregation between epiblast and primitive endoderm in mouse blastocysts through the Grb2-MAPK pathway. Developmental Cell. 10 (5), 615-624 (2006).
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature Reviews. Cancer. 10 (7), 470-480 (2010).
- Kroeger Jr, P. T., Drapkin, R. Pathogenesis and heterogeneity of ovarian cancer. Current Opinion in Obstetrics & Gynecology. 29 (1), 26-34 (2017).
- Cancer Genome Atlas Research Network. Integrated genomic analyses of ovarian carcinoma. Nature. 474 (7353), 609-615 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены