Method Article
in vivoマイクロインジェクションとエレクトロポレーションを用いた体細胞ゲノム改変マウスモデル
要約
このプロトコルでは、マウス卵管における局所的に制限されたCRISPRを介したゲノム編集のためのマイクロインジェクションと in vivo エレクトロポレーションについて説明します。
要約
生殖細胞系列遺伝子改変マウスモデル(G-GEMM)は、発生、恒常性、および疾患における in vivo 遺伝子機能に関する貴重な洞察を提供してきました。ただし、コロニーの作成と維持に関連する時間とコストは高くなります。CRISPRを介したゲノム編集の最近の進歩により、目的の細胞/組織/臓器を直接標的とすることで、体細胞GEMM(S-GEMM)の生成が可能になりました。
卵管、またはヒトの卵管は、最も一般的な卵巣癌、高悪性度漿液性卵巣癌(HGSC)の起源組織と考えられています。HGSCは、卵巣に隣接して位置する子宮の遠位にある卵管の領域で始まりますが、近位卵管には発生しません。しかし、HGSCの従来のマウスモデルは卵管全体を標的としているため、ヒトの状態を再現することはできません。DNA、RNA、またはリボ核タンパク質(RNP)溶液を卵管内腔にマイクロインジェクションし、卵管に沿った制限領域の粘膜上皮細胞を標的とする in vivo エレクトロポレーションの方法を紹介します。がんモデリングには、1)エレクトロポレーションの領域/組織/臓器および領域を標的とする高い適応性、2)Cas9発現のための特異的プロモーターと組み合わせて使用 した場合の標的細胞型における高い柔軟性(細胞増殖性)、3)エレクトロポレーションされた細胞数の高い柔軟性(比較的低頻度)、など、いくつかの利点があります。 4)特定のマウス株が不要であること(免疫適格疾患モデリング)、5)遺伝子変異の組み合わせにおける高い柔軟性、および6)Creレポーター株と組み合わせて使用 した場合、エレクトロポレーション細胞を追跡する可能性。したがって、この費用効果の高い方法は、ヒトの癌発生を要約する。
概要
マウスでは卵管と呼ばれる卵管は、子宮と卵巣をつなぐ管状構造です。哺乳類の生殖に不可欠な役割を果たし、内部受精と着床前の発達のための環境を提供します1,2。その重要性にもかかわらず、その機能と恒常性についてはほとんど知られていませんが、部分的には、この臓器に関連する不妊の問題を回避する体外受精技術の開発によるものです3。しかし、卵巣癌の約75%、関連死亡の85%を占める侵攻性の卵巣癌の組織型である高悪性度漿液性卵巣癌(HGSC)の前癌病変4は、遠位卵管上皮に限定されることが認識されています5,6,7,8 .これは、私たちの体のすべての細胞が発癌性の傷害に等しく敏感であるわけではなく、各組織/臓器のユニークで感受性のある細胞だけが癌の起源細胞になることを示しています—細胞柔軟性9と呼ばれます。これらの線に沿って、卵巣に隣接して位置する遠位卵管の上皮細胞は、管の他の部分とは異なることが示されている10,11。したがって、卵管内のすべての細胞を標的とするHGSCの従来のマウスモデルは、ヒトの状態を再現していません。最近の研究では、CRISPRを介したゲノム編集、in vivo卵管エレクトロポレーション、およびCreベースの系統追跡を組み合わせて使用し、遠位マウス卵管の4つの腫瘍抑制遺伝子を変異させることによってHGSCを誘導することに成功しました12,13。この原稿は、マウス卵管粘膜上皮を標的とするためのマイクロインジェクションとin vivoエレクトロポレーションのこの手順を説明する段階的なプロトコルを示しています。
この方法にはいくつかの利点があります。臓器実質14を含む他の組織/臓器を標的とするように適応させることができます。レンチウイルス系やアデノウイルス系などの他のin vivo遺伝子送達アプローチを使用して、同様の組織/臓器特異的ターゲティングを実現できますが、エレクトロポレーションベースの送達には、さまざまなサイズのピンセットタイプの電極を使用して、ターゲティングの領域をより簡単に調整できます。DNA/RNA/リボ核タンパク質(RNP)の濃度、エレクトロポレーションパラメータ、電極のサイズに応じて、エレクトロポレーションされた細胞の数を変えることができます。さらに、Cas9発現のためのプロモーターと組み合わせて使用 すると、生殖細胞系列遺伝子改変マウスモデル(G-GEMM)を絶対的に必要とすることなく、特定の細胞型を標的にすることができます。さらに、ウイルス送達システムとは異なり、エレクトロポレーションは単一細胞への複数のプラスミド送達を可能にし、インサートDNAサイズ15の制約が少なくなります。遺伝子変異のin vivoスクリーニングも、この高い柔軟性のために比較的容易に実施することができる。さらに、エレクトロポレーションされた細胞は、この方法をTdtomatorまたはConfetti16,17などのCreレポーターラインと組み合わせて使用 すると追跡または追跡できます。
プロトコル
動物は、タイプIIバイオセーフティキャビネットを含む専用室に配置された、フィルタートップ付きの静的マイクロアイソレーションケージに収容されました。すべての動物の作業は、機関のガイドラインに従って行われ、マギル大学の医学健康科学部の動物管理委員会(AUP#7843)によって承認されました。
1.マイクロインジェクション針の準備
- 次のプログラムでマイクロピペットプーラーを使用して、ガラスキャピラリーチューブを鋭いポイントに引き込みます:P = 500、Heat = 576、PULL = 50、VEL = 80、DEL = 70。
- 一対のテーパー超極細先端鉗子を使用して、図1A、Bに示すように、抜剖顕微鏡の下で引っ張られた毛細管の尖った端を切り取り、開口部を作成します。これは卵管を損傷し、遅い注射を防ぐので、開口部が大きすぎないことを確認してください。
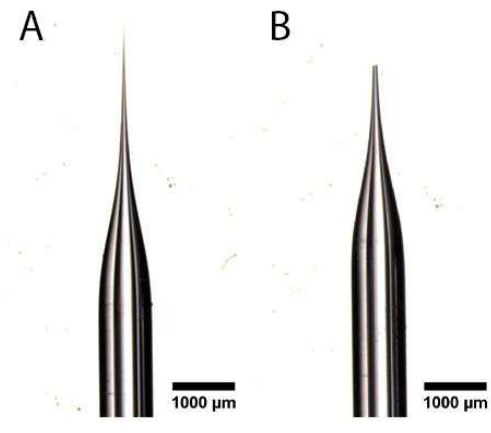
図1:マイクロインジェクション針の準備。 (A、B)尖った端(A)で毛細管を引っ張って切り取り、開口部(B)を作成しました。この図の拡大版を表示するには、ここをクリックしてください。
2.腹腔内注射のための麻酔薬の準備
- 手術当日に濾過、希釈アベルチンを調製する。アベルチン(2,2,2-トリブロモエタノール)原液をtert-アミルアルコール中に1.6 g/mLの濃度で激しく攪拌して調製し、暗所で保存します。
- アベルチンストック溶液を1.25%v/v等張生理食塩水で希釈し、ドラフト内で最終濃度20 mg/mLにします。希釈したアベルチンをボルテックスし、0.22 μmの滅菌フィルターでろ過します。暗闇の中で保管してください。
3.手術領域の準備
- 手術エリアは、専用の無菌環境、できればクリーンベンチまたはバイオセーフティキャビネットである必要があります。必要に応じて、滅菌手術機器、顕微鏡、マイクロマニピュレーター、エレクトロポレーターを配置します。この例を 図 2 に示します。
- 加熱パッド/ディスクを加熱し、清潔で設備の整ったケージの下に置きます。このケージは、手術後のマウスを収容するために使用されます。
- 滅菌した1xリン酸緩衝生理食塩水(PBS)を滅菌ペトリ皿に注ぎます。きれいなはさみを使用して、吸収紙をおおよそ1 cm x 1 cmの正方形にカットします。これらの吸収紙を1x PBSに落とし、浸します。
4.注射用溶液と針の準備
- 手術当日に注射液を調製してください。DNA/RNA/RNPをろ過したトリパンブルーと混合して、それぞれ200 ng/μLおよび5%の最小最終濃度にします。注射前に室温で保管してください。
注意: 1 mLシリンジを使用して100%トリパンブルーを取り込み、使用前に0.22μmの滅菌フィルターでろ過してください。 - 引っ張ったキャピラリーニードル(以下、マイクロインジェクションニードルと呼びます)を、磁気マウントで安定化されたクランプマウントマイクロマニピュレーターに取り付けます( 図2Bに示すセットアップ)。
- 2 μLの注射液を滅菌ペトリ皿にピペットで入れます。顕微鏡で観察しながら、マイクロマニピュレーターに取り付けられた空気圧シリンジを使用して、この溶液の1〜2μLをマイクロインジェクション針にゆっくりと取ります。気泡を避けたり、マイクロインジェクション針に気泡を取り込んだりしないでください。

図2:手術領域の準備 。 (A)クリーンベンチ内の手術エリアのセットアップ。(B)右利きの人のための解剖顕微鏡とマイクロマニピュレーターのセットアップ。 この図の拡大版を表示するには、ここをクリックしてください。
5.女性の生殖管を露出させる
- ろ過、希釈されたアベルチン(麻酔薬)を0.25〜0.5 mg / gの用量で腹腔内投与することにより、6〜8週齢の雌マウスに麻酔をかけます。.これに続いて、カルプロフェン(先制鎮痛薬)を5 mg / kgの用量で皮下投与します。.
注:麻酔薬として使用できる他の代替品は、イソフルランまたはケタミン/キシラジンです。 - 吸収紙を清潔で加熱されたパッド/ディスクに置きます。次に、麻酔をかけたマウスをこの加熱吸収紙の上に、背側を上に向けて置きます。手術中の乾燥を防ぐために、各目に目の潤滑剤を塗布します。
注意: 手の甲でテストして、加熱パッド/ディスクが触るとわずかに暖かいことを確認します。 - 麻酔をかけたマウスのつま先を一対の鉗子でつまんで、深部麻酔停止をテストします。将来の切開部位( 図3Aに示す場所)の周りの背側の毛皮を取り除き、消毒剤で素肌を拭きます。
- まっすぐな鈍い鉗子のペアを使用して素肌をつまみ、滅菌された鋭い鈍いはさみを使用して体の正中線に沿って長さ1 cmの切開を作成します。切開部周辺を消毒剤できれいにします。
- 滅菌Adson鉗子のペアを使用して、切断部位の片側をつまんで保持します。次に、一対の滅菌湾曲した鋸歯状の鉗子を使用して、正中線の切開から始めて横方向に移動して、皮膚を体壁から穏やかに分離します。
- 腎臓の下の脂肪パッドを見つけます。一対の滅菌ストレート鈍い鉗子を使用して、脂肪パッドの真上の体壁をつまむ。血管を避けるように注意しながら、滅菌された鋭く尖った解剖ハサミを使用して体壁に小さな切開を作成します。
- まっすぐな鈍い鉗子で体壁をつまんだまま、一対の滅菌鈍い湾曲した鉗子を切開部に挿入し、体壁に作成された切開部を広げます。
- 鈍い湾曲した鉗子で目に見える脂肪パッドをつかみ、穴から引き出して卵巣、卵管、子宮を露出させます。
- 生殖管を露出させておくには、 図3Bに示すように、滅菌ブルドッグクランプで脂肪パッドをクランプします。
6. 生体内 卵管注射とエレクトロポレーション
- 加熱した吸収紙と麻酔したマウスを、解剖顕微鏡のステージ上に生殖管を露出させて、管を観察できるように注意深く置きます。顕微鏡下で観察したビューの一例を 図3Bに示す。
- 溶液の入った注射針も顕微鏡で観察できるようにマイクロマニピュレーターを調整します。
- 一対の滅菌テーパー超極細先端鉗子を使用して、注入される卵管の領域を安定して保持する。注入される領域は、マイクロインジェクション針の方向と一致しなければならない。
注意: ブルドッグクランプを使用して、脂肪パッドと生殖管を固定し、必要に応じて管を最適な位置にそっと回転/移動します。 - マイクロマニピュレーターを調整して、マイクロインジェクション針で卵管を穿刺すると同時に、テーパー状の極細先端鉗子を使用して卵管を針に送ります。マイクロインジェクションの針をそっと動かして、卵管に挿入されたことを確認します。
注意: マイクロインジェクション針をコイル状の卵管のターニングポイントではなく、まっすぐなセグメントに挿入して、複数の穿刺や注射液の漏れを防ぎます。 - 顕微鏡で青色溶液の動きと卵管内腔の拡大を観察しながら、卵管に最大1 μLの溶液をゆっくりと注入します。内腔に気泡が入らないように注意してください。100%トリパンブルーを注入した卵管の代表的な画像を 図3C、Dに示します。
- 卵管から針を外します。標的とする領域を、滅菌済みの1x PBSにあらかじめ浸した吸収紙で覆います(ステップ3.3から)。
- あらかじめ浸した紙とターゲットとする領域/領域を電極ピンセット(ターゲットとする領域のサイズに応じて1 mm、3 mm、または5 mm)でつかみ、体から引き離してから、パルス発生器/エレクトロポレーターで次の設定を使用してエレクトロポレーションします。 30 V、3パルス、1秒間隔、 50msのパルス長、ユニポーラ。
注意: 電極間の距離は、電極が卵管を変形させることなくターゲット領域にクランプできるように設定する必要があります。推奨距離は約1mmです。 - エレクトロポレーション後、吸収紙をはがし、マウスを(加熱した吸収紙を下にして)ヒートパッドに戻します。ブルドッグクランプを外し、露出した生殖管を体壁の下に慎重に押し戻します。セクション5を繰り返して、反対側の生殖管を露出させます。
注:エレクトロポレーションは、マウスの発情期に関係なく、内腔が溶液で満たされている限り成功します。 - 露出した管を滅菌1x PBSにあらかじめ浸した吸収紙で覆い、乾燥を防ぎ、手順4.2と4.3を繰り返して2回目の注射用のマイクロインジェクション針を準備します。
注意: 必要に応じてマイクロインジェクションニードルを交換します。必要に応じて滅菌1x PBSを適用することにより、露出した組織の乾燥を防ぎます。 - 上記の手順を繰り返して、反対側の卵管を注入して電気移植します。
注意: 手術中および手術後に、必要に応じて目の潤滑剤を再塗布してください。 - 両方の卵管をエレクトロポレーションして体壁の下に戻した後、背側切開部位を縫合またはステープルで留めます。縫合には、止血材を使用して絹編組縫合糸の針をつかみます(3/8円、ゲージ:5-0、針サイズ:18 mm、糸の長さ:75 cm)。一対の滅菌湾曲した鋸歯状の鉗子を使用して切断部位の片側をつまんで保持し、次に止血剤を使用して縫合糸を操作して創傷を閉じます。
- 加熱されたパッド/ディスクの上に置かれたきれいなケージにマウスを移動し(手順3.2から)、マウスがアクティブになるまで監視します。
- 次の3日間、24時間ごとに5 mg / kgのカルプロフェンを皮下投与し、次の10日間監視します。.
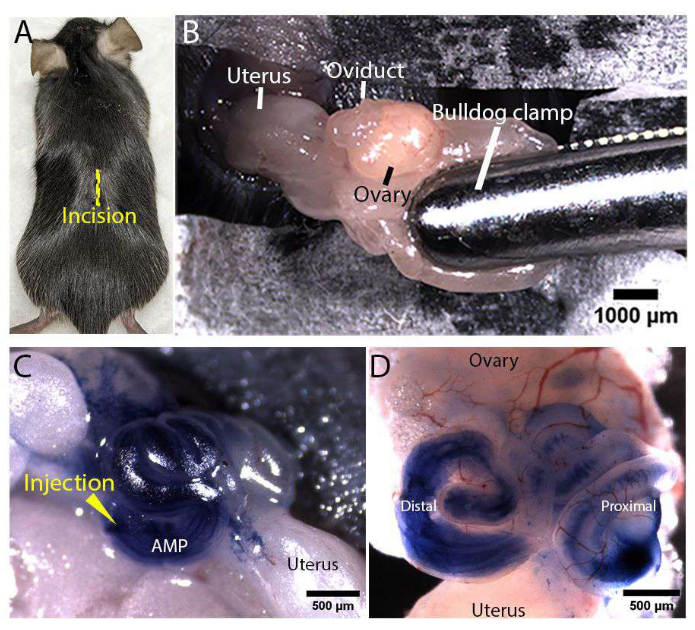
図3:女性の生殖管曝露とマイクロインジェクション。 (A)Rosa-LSLtdTomatoマウスの背側の正中線切開の位置(黄色の線で表示)。(B)女性の生殖管への曝露。脂肪パッドは、滅菌ブルドッグクランプを使用してクランプされ、管を固定し、露出したままにしました。(C,D) 生体内 卵管注射の代表的な画像。マイクロインジェクション針を遠位膨大部(AMPと表示)に挿入し、ろ過した100%トリパンブルーを管内に注入しました(C)。解剖された卵管の代表的な画像は、注入されたトリパンブルー溶液が遠位および近位卵管内腔全体に分布することを実証する(D)。 この図の拡大版を表示するには、ここをクリックしてください。
結果
図1と図2は、マウス卵管のin vivoマイクロインジェクションとエレクトロポレーションのためのマイクロインジェクション針の準備と手術領域のセットアップをそれぞれ示しています。手術中、麻酔をかけたRosa-LSLtdTomato(Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J)17マウスの背部皮膚(図3A)と体壁に切開して雌の生殖管を露出させた。ブルドッグクランプをトラクトの上の脂肪パッドに固定して、露出させて固定しました(図3B)。PCS2 CreNLSプラスミド18を400 ng/μL濃度で含む注射液をコイル状の卵管の膨大部(AMPと表示)に注入し、卵管内腔全体に分散させました(図3C、D)。PCS2 CreNLSプラスミドは、この原稿の代表的な結果を得るために使用されましたが、記載された方法は、マウス卵管におけるCRISPR/Cas媒介遺伝子編集のための注射溶液中の容易に交換可能なDNA/RNA/RNPとともに使用できます。次に、1mmまたは3mmのピンセットタイプの電極を配置し、遠位卵管がエレクトロポレーションベースの送達のために電極の間にくるようにした。
手術の4日後に卵管を採取し、中腹腔を切除して伸ばし、エレクトロポレーション特異性を可視化した。1 mmまたは3 mmのピンセットタイプの電極を使用して、TdTomatoでラベル付けされた標的領域は、遠位卵管上皮に限定されました(図4A、D)。このターゲット領域のサイズは、さまざまなサイズの電極を使用してさらに制御されました。3 mmピンセットタイプの電極を使用して、1 mmピンセットタイプの電極を使用して、最も遠位の先端であるINF(図4E、F)のみをターゲットにした場合と比較して、AMPのはるかに広い領域をターゲットにしました(図4B、C)。これらの採取した卵管を固定し、スクロース勾配で処理し、詳細な分析のためにクライオスタットを使用して切片化しました。切片をHoescht 33342およびファロイジンで対比染色して核および細胞骨格をそれぞれ染色し、次いでそれらを点走査型共焦点顕微鏡を用いて画像化した。標的領域において、TdTomatoによってマークされたエレクトロポレーション細胞は、非エレクトロポレーション(TdTomato-ve)細胞間でランダムに分布した(図4G)。さらに、エレクトロポレーションされた細胞は粘膜上皮に限定され、下にある間質層または筋肉層には見られませんでした(図4G、H)。最後に、CRISPR-Casを介した遺伝子編集を確認するために、TdTomato+ve細胞を蛍光活性化セルソーティング(FACS)によって単離し、DNA単離およびMiSeqシーケンシングを行うことができます12。
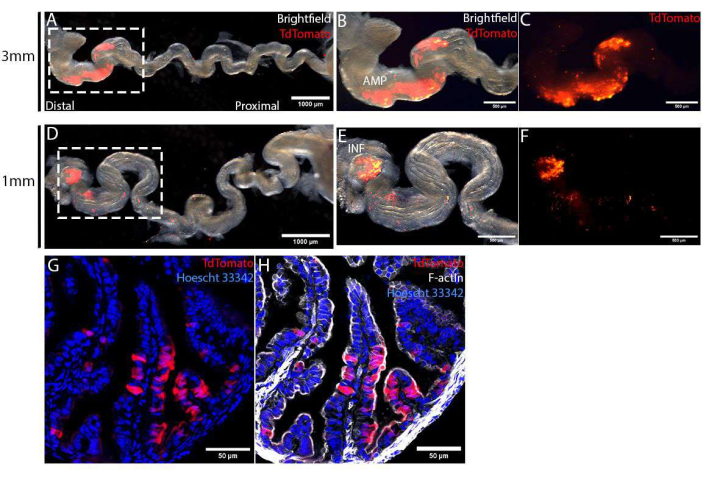
図4:術後4日目の卵管上皮細胞のin vivo注射およびエレクトロポレーションの成功の検証。 (A-C)3mmサイズのピンセット型電極を用いたエレクトロポレーション。卵管は、エレクトロポレーション特異性のより良い視覚化のために中サルピンスを除去することによってほどかれた(A)。TdTomato発現によって同定されたエレクトロポレーション領域は、AMP(B、C)とラベル付けされた遠位卵管に限定されていました。(D-F)1mmサイズのピンセット型電極を用いたエレクトロポレーション。卵管は、エレクトロポレーション特異性(D)のより良い視覚化のために中卵路を除去することによってほどかれた。エレクトロポレーション領域は、卵管の最遠位端(E、F)である眼底(INFと表示)に限定されていました。(G,H)PCS2 CreNLSプラスミドによるエレクトロポレーションの4日後の遠位卵管の横断切片。TdTomato(G)で標識されたエレクトロポレーション細胞は、上皮単層(H)に限定された。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この詳細なプロトコルの重要なステップは、卵管内腔へのDNA/RNA/RNP溶液のマイクロインジェクションと、エレクトロポレーションの強度と面積の制御です。マイクロインジェクション中のDNA/RNA/RNP溶液の漏れは、望ましくない領域/細胞のトランスフェクションを引き起こす可能性があります。一貫性のある効率的なエレクトロポレーションのために、卵管内腔を溶液で満たすことが好ましい(図3C、D)。これは、エレクトロポレーションの領域が主に電極のサイズと配置によって制御されるためです。弱いエレクトロポレーションはエレクトロポレーションされた細胞の数を減少させ、過酷なエレクトロポレーションは望ましくない細胞のエレクトロポレーションを引き起こしたり、組織構造を破壊したりする可能性があります。エレクトロポレーション細胞の数は、DNA/RNA/RNP溶液濃度またはエレクトロポレーションパラメータを調整することによって変化させることができる。ただし、エレクトロポレーション中の高電圧/熱生成は組織に損傷を与える可能性があるため、これらのパラメーターは、生きた/麻酔されたマウスで使用する前にテストする必要があります。最後に、この手順の厳しい性質のため、生きている/麻酔をかけたマウスでこの手術を行う前に、死んだマウスに管曝露とマイクロインジェクションを練習することをお勧めします。
複数の遺伝子が癌の発生に関与していることが認識されているため、このイベントを再現するには、いくつかの遺伝子の多対立遺伝子修飾が必要です。さらに、すべての細胞が発癌性変異に等しく感受性があるとは限らないことも知られています9。したがって、がんモデリングでは、発癌性傷害の厳密な制御を達成するために、特定のCreマウス系統が必要です。しかし、それらの利用可能性と特異性は、非標的組織への影響や致死性など、さまざまな課題を引き起こします19。さらに、従来のG-GEMMはメンテナンスコストが高く、マウスラインの生成に時間がかかります。CRISPR/Cas9ゲノム編集技術の開発と特定の体細胞への遺伝子導入の改善により、これらの課題を克服することができました。このプロトコルでは、特定のマウス株を絶対的に必要とせずに、がんモデリングに使用できる体細胞ゲノム操作のためのDNA/RNA/RNP送達法を提示します12。DNA/RNA/RNP溶液を内腔に注入し、エレクトロポレーションベースの送達に異なるサイズのピンセット型電極を使用することにより、マウス卵管粘膜上皮の制限領域が標的化されます(図4A-F)。これは、卵管の遠位端に由来するHGSCの開始をモデル化する際に特に有用である。
提示されたマイクロインジェクションおよび in vivo エレクトロポレーション法は、管腔を有する組織/臓器を標的とするために非常に汎用性が高い。臓器実質もこの方法を用いて標的化可能である14。レンチウイルス系やアデノウイルス系などのウイルス送達アプローチも同様の目的に使用できます。ただし、ウイルス送達アプローチに対するエレクトロポレーションの利点は、1)単一細胞への複数のプラスミド送達、2)インサートサイズ15に制限がないこと、3)送達の面積とタイミングの制御が容易であることです。さらに、ターゲティング特異性は、系統特異的プロモーターを使用することによって改善され得る。これは、ウイルスパッケージングの制限により、ウイルスシステムでは困難な場合があります。
エレクトロポレーションの性質と同様に、エレクトロポレーションされた上皮細胞には、健康な未編集の細胞がランダムに点在しています(図4G)。しかし、遺伝子組み換え細胞と非改変細胞におけるこのモザイクは、免疫適格微小環境内での早期がん発生の散発的な性質を再現するため、癌発生を研究するのに有利である可能性があります。エレクトロポレーション細胞の頻度は、DNA/RNA/RNP溶液濃度および/またはエレクトロポレーションパラメータを変化させることによって調整することができる。CRISPR-Casを介した遺伝子編集を提示されたプロトコルと組み合わせて使用 すると、複数の遺伝子をスクリーニングし、標的遺伝子の突然変異/対立遺伝子の組み合わせの不均一なパターンを生成することが容易になります。これは、HGSCのようなかなりの数のゲノム変化を示す癌のモデリングに特に有用です20,21。また、癌進行中の標的遺伝子を配列決定することにより、免疫担当マウスにおける腫瘍および転移のin vivoクローン進化を追跡することができる12。
開示事項
著者は開示するものは何もありません。
謝辞
著者らは、代表的な結果の生成とプロトコルの最適化に使用されるプラスミドを提供してくれたKatie TengとMatthew J. Ford博士に感謝しています。K.H.は、Fonds de recherche du Québec - Santé(FRQS)博士課程助成金、Donnor Foundation、Delta Kappa Gamma World Fellowship、Center for Research in Reproductive and Development(CRRD)、Hugh E. Burke、Rolande & Marcel Gosselin、Alexander McFee大学院生の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter unit | LifeGene | SF0.22PES | |
| 1 mL syringe | Terumo Medical Corportation | SS-01T | |
| 1 mm tweezer-type electrodes | BEX CO., LTD | LF650P1 | |
| 3 mm tweezer-type electrodes | BEX CO., LTD | LF650P3 | |
| 30G x 1/2 Needle | BD | 305106 | Needle is attached to the 1 mL syringe when using injectable anesthetic or analgesic. |
| Adson forceps | Fisher Scientific | 10-000-451 | |
| Air-pressured syringe | BD | B302995 | Attached to the micromanipulator; as shown in Figure 2B |
| Analgesic | - | - | Carprofen, dose: 5mg/kg. |
| Antiseptic | Cardinal Health | OMEL0000017 | Baxedin: 2% chlorhexidine in 70% isopropyl alcohol |
| Avertin (2,2,2-tribromoethanol) - Anesthetic | Sigma Aldrich | T48402-25G | |
| Clamp mount micromanipulator | AD Instruments | MM-33 | |
| Curved serrated forceps | Fisher Scientific | NC0696845 | |
| Dissecting microscope | Zeiss | SteREO Discovery.V8 | Apochromat S, 0.63X, FWD 107mm. Attached KL 200 LED for top light, labelled as light source in Figure 2B. |
| Eye lubricant | Alcon | - | Systane ointment (Lubricant eye ointment) |
| Glass capillary needles | Sutter Instrument Co. | B100–50-10 | Outside diameter: 1 mm, inside diameter: 0.5 mm, length: 10 cm |
| Hartman hemostats | Fisher Scientific | 50-822-711 | |
| Heating pad/disc | - | - | SnuggleSafe Pet Bed Microwave Heating Pad was used in this protocol. Microwave for 2-5min, and test with back of gloved hand. |
| Magnetic Mount for micromanipulator | AD Instruments | MB-B | Used to keep the clamp mount micromanipulator stable and upright during injection. |
| Micro bulldog clamp | Fisher Scientific | 50-822-230 | 3 cm |
| Micropipette puller | Sutter Instrument Co. | P-97 | P-97 Flaming/Brown type micropipette puller. Program used: P = 500, Heat = 576, PULL = 50, VEL = 80, DEL = 70 |
| Petri dish | Fisher Scientific | 263991 | Autoclaved/sterile glass petridishes can also be used. |
| Phosphate Buffered Saline (PBS) | Bio Basic Inc. | PD8117 | 10X PBS was diluted to 1X with DI water. Autoclave before use. |
| Pulse generator/Electroporator | BEX CO., LTD | CUY21 EDIT II | Electroporation settings: 30 V, 3 pulses, 1 s interval, P. length = 50 ms, unipolar |
| Rosa-LSLtdTomato mice | The Jackson Laboratory | 7914 | Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J |
| Sharp-blunt dissection scissors | Fisher Scientific | 28251 | |
| Sharp-pointed dissecting scissors | Fisher Scientific | SDI130 | |
| Shaver | - | - | Hair removal cream can also be used. |
| Silk braided sutures | Ethicon | 682G | 3/8 circle, gauge: 5-0, needle size: 18 mm, thread length: 75 cm. Staples can also be used. |
| Tapered ultrafine tip forceps | Fisher Scientific | 12-000-122 | |
| Thin absorbent paper | Kimberly-Clark Professional | 34120 | Kimwipes |
| Trypan blue | STEMCELL Technologies | 7050 | Filtered using 0.22 µm sterile filter before use for microinjection. |
参考文献
- Avilés, M., Coy, P., Rizos, D. The oviduct: A key organ for the success of early reproductive events. Animal Frontiers. 5 (1), 25-31 (2015).
- Li, S., Winuthayanon, W. Oviduct: roles in fertilization and early embryo development. The Journal of Endocrinology. 232 (1), R1-R26 (2017).
- Briceag, I., et al. Fallopian tubes--literature review of anatomy and etiology in female infertility. Journal of Medicine and Life. 8 (2), 129-131 (2015).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Labidi-Galy, S. I., et al. High grade serous ovarian carcinomas originate in the fallopian tube. Nature Communications. 8 (1), 1093(2017).
- Shaw, P. A., Rouzbahman, M., Pizer, E. S., Pintilie, M., Begley, H. Candidate serous cancer precursors in fallopian tube epithelium of BRCA1/2 mutation carriers. Modern Pathology. 22 (9), 1133-1138 (2009).
- Soong, T. R., et al. Evidence for lineage continuity between early serous proliferations (ESPs) in the Fallopian tube and disseminated high-grade serous carcinomas. The Journal of Pathology. 246 (3), 344-351 (2018).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. The Journal of Pathology. 211 (1), 26-35 (2007).
- Puisieux, A., Pommier, R. M., Morel, A. P., Lavial, F. Cellular pliancy and the multistep process of tumorigenesis. Cancer Cell. 33 (2), 164-172 (2018).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677(2021).
- Teng, K., et al. Modeling high-grade serous ovarian carcinoma using a combination of in vivo fallopian tube electroporation and CRISPR-Cas9-mediated genome editing. Cancer Research. 81 (20), 5147-5160 (2021).
- Ford, M. J., Yamanaka, Y. Reprogramming mouse oviduct epithelial cells using in vivo electroporation and CRISPR/Cas9-mediated genetic manipulation. Methods in Molecular Biology. 2429, 367-377 (2022).
- Maresch, R., et al. Multiplexed pancreatic genome engineering and cancer induction by transfection-based CRISPR/Cas9 delivery in mice. Nature Communications. 7, 10770(2016).
- Braun, C. J., Adames, A. C., Saur, D., Rad, R. Tutorial: design and execution of CRISPR in vivo screens. Nature Protocols. 17 (9), 1903-1925 (2022).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Chazaud, C., Yamanaka, Y., Pawson, T., Rossant, J. Early lineage segregation between epiblast and primitive endoderm in mouse blastocysts through the Grb2-MAPK pathway. Developmental Cell. 10 (5), 615-624 (2006).
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature Reviews. Cancer. 10 (7), 470-480 (2010).
- Kroeger Jr, P. T., Drapkin, R. Pathogenesis and heterogeneity of ovarian cancer. Current Opinion in Obstetrics & Gynecology. 29 (1), 26-34 (2017).
- Cancer Genome Atlas Research Network. Integrated genomic analyses of ovarian carcinoma. Nature. 474 (7353), 609-615 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved