Method Article
In Vivo Mikroenjeksiyon ve Elektroporasyon Kullanan Somatik Genom Mühendisliği Fare Modelleri
Bu Makalede
Özet
Bu protokol, fare yumurtalık kanalında bölgesel olarak kısıtlanmış CRISPR aracılı genom düzenlemesi için mikroenjeksiyon ve in vivo elektroporasyonu tanımlar.
Özet
Germline genetiği değiştirilmiş fare modelleri (G-GEMM'ler), gelişim, homeostaz ve hastalıkta in vivo gen fonksiyonu hakkında değerli bilgiler sağlamıştır. Bununla birlikte, koloni oluşturma ve bakımı ile ilgili zaman ve maliyet yüksektir. CRISPR aracılı genom düzenlemesindeki son gelişmeler, ilgilenilen hücreyi / dokuyu / organı doğrudan hedefleyerek somatik GEMM'lerin (S-GEMM'ler) üretilmesine izin vermiştir.
İnsanlarda yumurta kanalı veya fallop tüpü, en yaygın yumurtalık kanseri, yüksek dereceli seröz yumurtalık karsinomlarının (HGSC'ler) menşe dokusu olarak kabul edilir. HGSC'ler, yumurtalığa bitişik olarak bulunan uterusa distal fallop tüpü bölgesinde başlar, ancak proksimal fallop tüpü değildir. Bununla birlikte, HGSC'nin geleneksel fare modelleri tüm yumurta kanalını hedefler ve bu nedenle insan durumunu özetlemez. Bu çalışmada, yumurta kanalı boyunca kısıtlı bölgelerdeki mukozal epitel hücrelerini hedeflemek için yumurta kanalı lümenine DNA, RNA veya ribonükleoprotein (RNP) çözeltisi mikroenjeksiyonu ve in vivo elektroporasyon yöntemi sunulmaktadır. Kanser modellemesi için bu yöntemin çeşitli avantajları vardır, örneğin 1) elektroporasyon alanını / dokusunu / organını ve bölgesini hedeflemede yüksek adaptasyon, 2) Cas9 ekspresyonu için spesifik promotörlerle birlikte kullanıldığında hedeflenen hücre tiplerinde yüksek esneklik (hücresel esneklik), 3) elektropora hücrelerin sayısında yüksek esneklik (nispeten düşük frekans), 4) spesifik bir fare çizgisi gerekmez (immünokompetan hastalık modellemesi), 5) gen mutasyonu kombinasyonunda yüksek esneklik ve 6) bir Cre muhabir hattı ile kombinasyon halinde kullanıldığında elektropora hücreleri izleme olasılığı. Böylece, bu uygun maliyetli yöntem insan kanseri başlangıcını özetler.
Giriş
Farelerde yumurta kanalı olarak adlandırılan fallop tüpü, uterusu yumurtalıklara bağlayan boru şeklinde bir yapıdır. Memeli üremesinde önemli bir rol oynar, iç döllenme ve preimplantasyon gelişimi için ortam sağlar 1,2. Önemine rağmen, kısmen bu organla ilgili herhangi bir infertilite sorununu aşan in vitro fertilizasyon tekniklerinin gelişmesi nedeniyle işlevi ve homeostazı hakkında çok az şey bilinmektedir3. Bununla birlikte, over karsinomlarının yaklaşık %75'ini ve buna bağlı ölümlerin %85'ini oluşturan agresif bir over kanseri histotipi olan yüksek dereceli seröz over karsinomunun (HGSC) prekanseröz lezyonlarınındistal fallop tüpü epiteli ile sınırlı olduğu kabul edilmiştir 5,6,7,8 . Bu, vücudumuzdaki tüm hücrelerin onkojenik hakaretlere eşit derecede duyarlı olmadığını, bunun yerine her doku / organdaki yalnızca benzersiz / duyarlı hücrelerin kanserde menşe hücre haline geldiğini gösterir - hücresel esneklik9 olarak adlandırılır. Bu doğrultuda, yumurtalığa bitişik olarak bulunan distal fallop tüpünün epitel hücrelerinin, tüpün geri kalanından farklı olduğu gösterilmiştir10,11. Bu nedenle, yumurta kanalındaki tüm hücreleri hedef alan geleneksel HGSC fare modelleri, insan durumunu özetlemez. Yakın tarihli bir çalışmada, distal fare yumurtalık kanalı12,13'teki dört tümör baskılayıcı geni mutasyona uğratarak HGSC'yi başarılı bir şekilde indüklemek için CRISPR aracılı genom düzenleme, in vivo oviduct elektroporasyonu ve Cre tabanlı soy izlemenin bir kombinasyonunu kullandık. Bu yazıda, fare oviduct mukozal epitelini hedef alan bu mikroenjeksiyon ve in vivo elektroporasyon prosedürünü açıklayan adım adım bir protokol sunulmaktadır.
Bu yöntemin birkaç avantajı vardır. Organ parankimleri14 dahil olmak üzere diğer dokuları / organları hedeflemek için uyarlanabilir. Benzer doku / organa özgü hedefleme elde etmek için lentiviral ve adenoviral sistemler gibi diğer in vivo gen dağıtım yaklaşımları kullanılabilse de, hedefleme alanı, elektroporasyon tabanlı dağıtım için farklı boyutlarda cımbız tipi elektrotlar kullanılarak daha kolay ayarlanır. DNA / RNA / ribonükleoproteinlerin (RNP'ler) konsantrasyonuna, elektroporasyon parametrelerine ve elektrotların boyutuna bağlı olarak, elektropora hücrelerin sayısı değiştirilebilir. Ayrıca, Germline genetiği değiştirilmiş fare modellerine (G-GEMM'ler) mutlak ihtiyaç duymadan, Cas9 ekspresyonu için promotorlarla birlikte kullanıldığında spesifik hücre tipleri hedeflenebilir. Ek olarak, viral dağıtım sistemlerinden farklı olarak, elektroporasyon, tek hücrelere çoklu plazmid verilmesine ve insert DNA boyutu15'te daha az kısıtlamaya izin verir. Gen mutasyonlarının in vivo taraması, bu yüksek esneklik nedeniyle göreceli olarak kolaylıkla da yapılabilir. Ayrıca, elektroporate hücreler, bu yöntem Tdtomato veya Confetti16,17 gibi Cre muhabir hatlarıyla birlikte kullanıldığında izlenebilir veya izlenebilir.
Protokol
Hayvanlar, tip II biyogüvenlik kabini içeren özel bir odada bulunan filtre üstlü statik mikroizolasyon kafeslerine yerleştirildi. Tüm hayvan çalışmaları kurumsal yönergelere uygun olarak gerçekleştirildi ve McGill Üniversitesi Tıp ve Sağlık Bilimleri Fakültesi Hayvan Bakım Komitesi (AUP #7843) tarafından onaylandı.
1. Mikroenjeksiyon iğne hazırlama
- Aşağıdaki programa sahip bir mikropipet çektirici kullanarak bir cam kılcal boruyu keskin bir noktaya çekin: P = 500, Isı = 576, PULL = 50, VEL = 80, DEL = 70.
- Bir çift konik ultra ince uçlu forseps kullanarak, Şekil 1A, B'de gösterildiği gibi bir açıklık oluşturmak için diseksiyon mikroskobu altında çekilen kılcal tüpün sivri ucunu kırpın. Açıklığın çok büyük olmadığından emin olun, çünkü bu yumurta kanalına zarar verir ve yavaş enjeksiyonu önler.
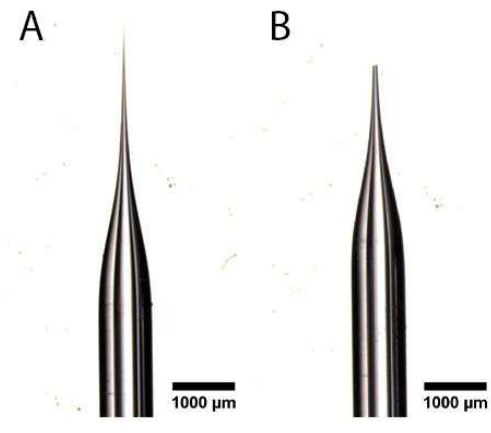
Resim 1: Mikroenjeksiyon iğnesi hazırlama. (A,B) Bir açıklık (B) oluşturmak için kesilen sivri uçlu (A) çekilmiş kılcal boru. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
2. İntraperitoneal enjeksiyon için anestezinin hazırlanması
- Ameliyat gününde filtrelenmiş, seyreltilmiş avertin hazırlayın. Avertin (2,2,2-tribromoetanol) stok çözeltisi, tert-amil alkol içinde 1,6 g/mL konsantrasyonda kuvvetli bir şekilde karıştırılarak hazırlanır ve karanlıkta saklanır.
- Avertin stok çözeltisini% 1.25 v / v izotonik salin ile bir duman davlumbaz içinde 20 mg / mL'lik bir nihai konsantrasyona kadar seyreltin. Seyreltilmiş vertiği vorteks edin ve 0,22 μm steril bir filtreden geçirin. Karanlıkta kalın.
3. Ameliyat alanının hazırlanması
- Ameliyat alanı özel steril bir ortam, tercihen temiz bir tezgah veya biyogüvenlik kabini olmalıdır. Steril cerrahi ekipmanı, mikroskop, mikromanipülatör ve elektroporatörü gerektiği gibi düzenleyin. Bunun bir örneği Şekil 2'de gösterilmiştir.
- Isıtma yastığını/diskini ısıtın ve temiz, tam donanımlı bir kafesin altına yerleştirin. Bu kafes, ameliyattan sonra fareleri barındırmak için kullanılacaktır.
- Steril bir petri kabına steril 1x fosfat tamponlu salin (PBS) dökün. Emici kağıdı yaklaşık 1 cm x 1 cm boyutlarında kareler halinde kesmek için bir çift temiz makas kullanın. Bu emici kağıt parçalarını ıslatmak için 1x PBS'ye bırakın.
4. Enjeksiyon için çözelti ve iğnenin hazırlanması
- Enjeksiyon solüsyonunu ameliyat günü hazırlayın. DNA / RNA / RNP'leri filtrelenmiş tripan mavisi ile her biri 200 ng / μL ve sırasıyla% 5'lik minimum nihai konsantrasyona kadar karıştırın. Enjeksiyondan önce oda sıcaklığında saklayın.
NOT: Kullanmadan önce %100 tripan mavisi almak için 1 mL şırınga kullanın ve 0,22 μm steril filtreden süzün. - Bundan böyle mikroenjeksiyon iğnesi olarak adlandırılan çekilmiş kılcal iğneyi, manyetik bir montaj ile stabilize edilmiş kelepçe montaj mikromanipülatörüne takın (kurulum Şekil 2B'de gösterilmiştir).
- Enjeksiyon çözeltisinin 2 μL'lik pipetini steril bir Petri kabına yerleştirin. Mikroskop altında gözlemlerken, mikromanipülatöre bağlı hava basınçlı şırıngayı kullanarak bu çözeltinin 1-2 μL'sini yavaşça mikroenjeksiyon iğnesine alın. Kabarcıklardan kaçının / mikroenjeksiyon iğnesine kabarcıklar alın.

Şekil 2: Ameliyat alanı hazırlığı . (A) Temiz bir tezgah içinde ameliyat alanı kurulumu. (B) Sağ elini kullanan bir birey için diseksiyon mikroskobu ve mikromanipülatör kurulumu. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
5. Kadın üreme sisteminin açığa çıkarılması
- 6-8 haftalık bir dişi fareye, filtrelenmiş, seyreltilmiş avertin (anestezik) intraperitoneal olarak 0.25-0.5 mg / g dozunda anestezi uygulayın. Bunu takiben, karprofen (preemptif analjezik) deri altından 5 mg / kg'lık bir dozda uygulayın.
NOT: Anestezik olarak kullanılabilecek diğer alternatifler izofluran veya ketamin / ksilazindir. - Emici kağıdı temiz, ısıtılmış bir ped/disk üzerine yerleştirin. Ardından, anestezi uygulanmış fareyi sırt tarafı yukarı bakacak şekilde bu ısıtılmış emici kağıda yerleştirin. Ameliyat sırasında kurumayı önlemek için her göze göz kayganlaştırıcısı uygulayın.
NOT: Elinizin arkasıyla test ederek ısıtma yastığının/diskinin hafifçe dokunulacak kadar sıcak olduğunu onaylayın. - Anestezi uygulanan farenin ayak parmağını bir çift forseps ile sıkıştırarak derin anestezik arrest için test edin. Prospektif insizyon yerinin etrafındaki sırt kürkünü çıkarın ( Şekil 3A'da gösterilen yer) ve çıplak cildi antiseptik ile silin.
- Çıplak cildi sıkıştırmak için bir çift düz künt forseps kullanın ve bir çift steril keskin künt makas kullanarak vücut orta çizgisi boyunca 1 cm uzunluğunda bir kesi oluşturun. Kesi etrafındaki alanı antiseptik ile temizleyin.
- Bir çift steril Adson forseps kullanarak kesim bölgesinin bir tarafını sıkıştırın ve tutun. Daha sonra, bir çift steril kavisli tırtıklı forseps kullanarak, cildi orta hat insizyonundan başlayarak ve yanal olarak hareket ederek vücut duvarından yavaşça ayırın.
- Yağ yastığını böbreğin altına yerleştirin. Bir çift steril düz künt forseps kullanarak, vücut duvarını doğrudan yağ yastığının üzerine sıkıştırın. Kan damarlarından kaçınmaya özen göstererek, bir çift steril keskin sivri uçlu diseksiyon makası kullanarak vücut duvarında küçük bir kesi oluşturun.
- Vücut duvarını düz künt forsepslerle sıkıştırırken, insizyona bir çift steril künt kavisli forseps yerleştirin ve vücut duvarında oluşturulan kesiyi genişletin.
- Görünür yağ yastığını künt kavisli forseps ile tutun ve yumurtalık, yumurta kanalı ve uterusu ortaya çıkarmak için delikten dışarı çekin.
- Üreme sistemini açıkta tutmak için, yağ yastığını Şekil 3B'de gösterildiği gibi steril bir bulldog kelepçesi ile kelepçeleyin.
6. In vivo yumurta kanalı enjeksiyonu ve elektroporasyonu
- Isıtılmış emici kağıdı ve anestezi uygulanmış fareyi, diseksiyon mikroskobu sahnesine maruz kalan üreme sistemi ile dikkatlice yerleştirin, böylece yol gözlemlenebilir. Mikroskop altında gözlemlenen görünümün bir örneği Şekil 3B'de gösterilmiştir.
- Mikromanipülatörü ayarlayın, böylece çözelti içeren enjeksiyon iğnesi mikroskop altında da gözlemlenebilir.
- Bir çift steril konik ultra ince uç forseps kullanarak, enjekte edilecek yumurta kanalı bölgesini sabit tutun. Enjekte edilecek bölge mikroenjeksiyon iğnesinin yönüne uygun olmalıdır.
NOT: Gerekirse, yolu yavaşça en uygun konuma getirmek / hareket ettirmek için yağ yastığını ve üreme sistemini sabitleyen bulldog kelepçesini kullanın. - Mikromanipülatörü mikroenjeksiyon iğnesiyle yumurta kanalını delecek şekilde ayarlayın, aynı anda konik ultra ince uç forsepslerini kullanarak yumurta kanalını iğneye besleyin. Yumurtalık kanalına yerleştirildiğini doğrulamak için mikroenjeksiyon iğnesini yavaşça hareket ettirin.
NOT: Birden fazla delinmeyi ve enjeksiyon çözeltisinin sızmasını önlemek için mikroenjeksiyon iğnesini sarmal yumurta kanalının dönüm noktası yerine düz bir segmente yerleştirin. - Mavi çözeltinin hareketini ve mikroskop altında yumurta kanalı lümeninin genişlemesini gözlemlerken, yumurta kanalına yavaşça 1 μL'ye kadar çözelti enjekte edin. Lümenin içine herhangi bir kabarcık sokmamaya dikkat edin. %100 tripan mavisi enjekte edilen yumurta kanallarının temsili görüntüleri Şekil 3C,D'de gösterilmiştir.
- İğneyi yumurta kanalından çıkarın. Hedeflenecek alanı, steril 1x PBS'ye batırılmış bir parça emici kağıtla örtün (adım 3.3'ten itibaren).
- Önceden ıslatılmış kağıdı ve hedeflenecek alanı/bölgeyi bir çift elektrot cımbızıyla (hedeflenecek bölgenin boyutuna bağlı olarak 1 mm, 3 mm veya 5 mm) kavrayın ve darbe jeneratörü/elektroporatör üzerindeki bu ayarları kullanarak elektroporasyon yapmadan önce gövdeden çekin: 30 V, üç darbe, 1 s aralık, 50 ms darbe uzunluğu, tek kutuplu.
NOT: Elektrotlar arasındaki mesafe, elektrotların yumurta kanalını deforme etmeden hedeflenen bölgeye kenetlenebileceği şekilde ayarlanmalıdır. Önerilen mesafe yaklaşık 1 mm'dir. - Elektroporasyondan sonra, emici kağıdı çıkarın ve fareyi (ısıtılmış emici kağıt altındayken) tekrar bir ısı yastığına yerleştirin. Bulldog kelepçesini açın ve açıkta kalan üreme sistemini vücut duvarının altına dikkatlice geri itin. Diğer taraftaki üreme sistemini ortaya çıkarmak için bölüm 5'i tekrarlayın.
NOT: Elektroporasyon, lümen çözelti ile doldurulduğu sürece fare östrus aşamasından bağımsız olarak başarılıdır. - Açıkta kalan kanalı, kurumasını önlemek için steril 1x PBS'ye batırılmış emici kağıtla örtün, ardından 4.2 ve 4.3 adımlarını tekrarlayarak mikroenjeksiyon iğnesini ikinci enjeksiyon için hazırlayın.
NOT: Mikroenjeksiyon iğnesini gerektiği gibi değiştirin. Gerektiğinde steril 1x PBS uygulayarak maruz kalan dokunun kurumasını önleyin. - Yumurta kanalını karşı tarafa enjekte etmek ve elektroporat etmek için yukarıdaki adımları tekrarlayın.
NOT: Göz kayganlaştırıcısını ameliyat sırasında ve sonrasında gerektiği gibi tekrar uygulayın. - Her iki yumurta kanalı da elektroporate edildikten ve vücut duvarının altına geri yerleştirildikten sonra, dorsal insizyon bölgesini dikiş veya zımbalayın. Dikiş için, ipek örgülü dikişlerin iğnesini kavramak için bir hemostat kullanın (3/8 daire; ölçer: 5-0; iğne boyutu: 18 mm; iplik uzunluğu: 75 cm). Bir çift steril kavisli tırtıklı forseps kullanarak kesim bölgesinin bir tarafını sıkıştırın ve tutun, ardından yarayı kapatmak için dikişi manipüle etmek için hemostatı kullanın.
- Fareyi ısıtılmış bir pedin/diskin üzerine yerleştirilmiş temiz bir kafese taşıyın (adım 3.2'den itibaren) ve fare etkin olana kadar izleyin.
- Sonraki 3 gün boyunca her 24 saatte bir deri altından 5 mg / kg karprofen uygulayın ve sonraki 10 gün boyunca izleyin.
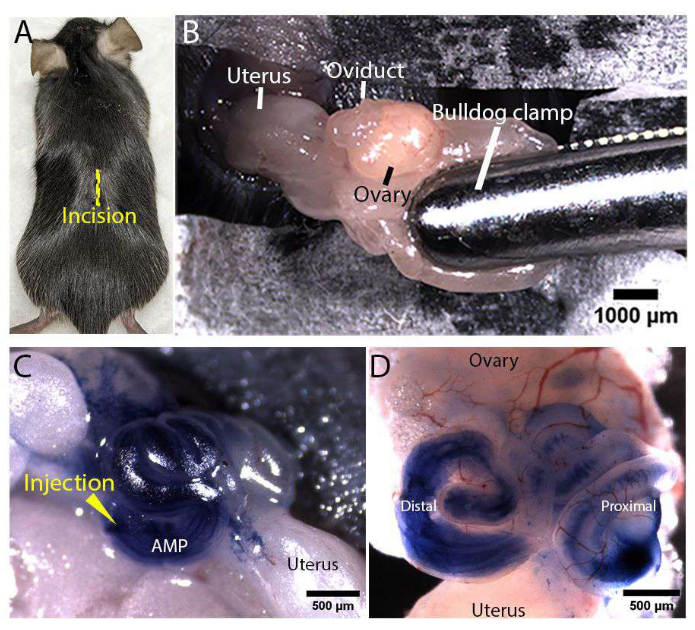
Şekil 3: Kadın üreme sistemine maruz kalma ve mikroenjeksiyon. (A) Rosa-LSLtdDomates faresinin dorsal tarafındaki orta hat insizyonunun yeri (sarı çizgi olarak gösterilir). (B) Kadın üreme sistemine maruz kalma. Yağ yastığı, yolu sabitlemek ve açıkta tutmak için steril bir bulldog kelepçesi kullanılarak kelepçelendi. (C,D) İn vivo yumurta kanalı enjeksiyonunun temsili görüntüleri. Distal ampulla (AMP etiketli) içine bir mikroenjeksiyon iğnesi yerleştirildi ve sistem açıkta kalırken yumurta kanalı lümenine filtrelenmiş% 100 tripan mavisi enjekte edildi (C). Disseke edilmiş bir yumurta kanalının temsili görüntüsü, enjekte edilen tripan mavisi çözeltisinin distal ve proksimal oviduct lümeni (D) boyunca dağıldığını göstermektedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Sonuçlar
Şekil 1 ve Şekil 2, fare yumurtalık kanalının in vivo mikroenjeksiyonu ve elektroporasyonu için sırasıyla mikroenjeksiyon iğnesi hazırlığı ve cerrahi alan kurulumunu göstermektedir. Ameliyat sırasında anestezi uygulanan Rosa-LSLtdDomates (Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J)17 farenin sırt derisinde (Şekil 3A) ve vücut duvarında yapılan kesilerle kadın üreme sistemi açığa çıkarıldı. Bir bulldog kelepçesi, açıkta ve sabitlenmiş halde tutmak için kanalın üzerindeki yağ yastığına kelepçelendi (Şekil 3B). 400 ng/μL konsantrasyonda PCS2 CreNLS plazmidleri18 içeren enjeksiyon çözeltisi, sarmal yumurta kanalının ampullasına (AMP etiketli) enjekte edildi ve yumurta kanalı lümeni boyunca dağılmasına izin verildi (Şekil 3C, D). Bu makalede temsili sonuçlar üretmek için PCS2 CreNLS plazmidleri kullanılmasına rağmen, tarif edilen yöntem, fare yumurtalık kanalında CRISPR / Cas aracılı gen düzenlemesi için enjeksiyon çözeltisinde kolayca değiştirilebilir DNA / RNA / RNP'lerle kullanılabilir. Daha sonra, 1 mm veya 3 mm cımbız tipi elektrotlar, distal yumurta kanalı elektroporasyon bazlı dağıtım için elektrotlar arasında olacak şekilde konumlandırıldı.
Yumurtalıklar ameliyattan 4 gün sonra toplandı ve elektroporasyon özgüllüğünü görselleştirmek için mezosalpinks çıkarılarak gerildi. 1 mm veya 3 mm cımbız tipi elektrotlar kullanılarak, TdDomates ile etiketlenmiş hedeflenen alan distal oviduct epiteli ile sınırlandırılmıştır (Şekil 4A,D). Bu hedeflenen alanın boyutu, farklı boyutlardaki elektrotlar kullanılarak daha da kontrol edildi. 3 mm cımbız tipi elektrotlar kullanarak, 1 mm cımbız tipi elektrotlar kullanarak yalnızca en distal uç olan INF'yi (Şekil 4E, F) hedeflemeye kıyasla, AMP'nin çok daha geniş bir alanını (Şekil 4B, C) hedefledik. Bu hasat edilen yumurta kanalları sabitlendi, bir sakkaroz gradyanı ile muamele edildi ve ayrıntılı analizler için bir kriyostat kullanılarak bölümlere ayrıldı. Kesitler sırasıyla Hoescht 33342 ve Phalloidin ile çekirdekleri ve hücre iskeletini boyamak için boyandı, daha sonra nokta taramalı bir konfokal mikroskop kullanılarak görüntülendi. Hedeflenen bölgede, TdDomates ile işaretlenmiş elektropore hücreler, elektropore olmayan (TdTomato-ve) hücreler arasında rastgele dağıtıldı (Şekil 4G). Ek olarak, elektropora hücreler mukozal epitel ile sınırlıydı ve altta yatan stromal veya kas tabakasında bulunamadı (Şekil 4G, H). Son olarak, CRISPR-Cas aracılı gen düzenlemesini doğrulamak için, TdTomato+ve hücreleri, DNA izolasyonu ve MiSeq dizilimi12 için floresan ile aktive edilmiş hücre sıralama (FACS) ile izole edilebilir.
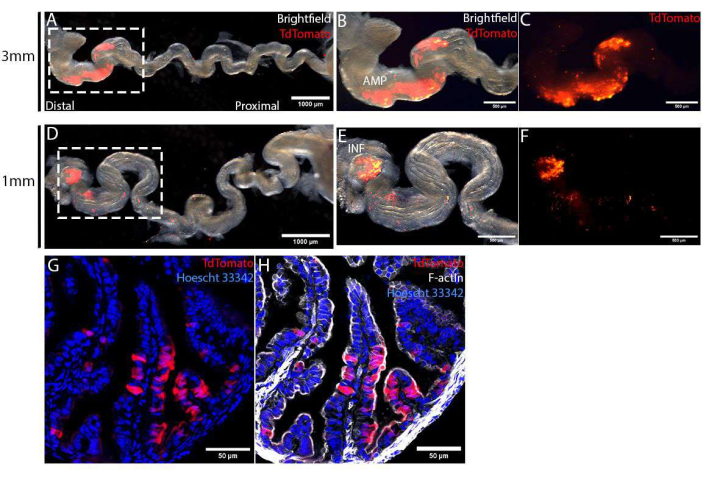
Şekil 4: Ameliyattan 4 gün sonra yumurtalık epitel hücrelerinin başarılı in vivo enjeksiyon ve elektroporasyonunun doğrulanması. (A-C) 3 mm boyutlu cımbız tipi elektrotlar kullanılarak elektroporasyon. Elektroporasyon özgüllüğünün (A) daha iyi görselleştirilmesi için mezosalpinks çıkarılarak yumurta kanalı açıldı. TdDomates ekspresyonu ile tanımlanan elektroporasyon alanı, AMP (B, C) etiketli distal oviduct ile sınırlıydı. (D-F) 1 mm boyutlu cımbız tipi elektrotlar kullanılarak elektroporasyon. Elektroporasyon özgüllüğünün (D) daha iyi görselleştirilmesi için mezosalpinks çıkarılarak yumurta kanalı açıldı. Elektroporasyon alanı, yumurta kanalının en distal ucu olan infundibulum (INF etiketli) ile sınırlıydı (E, F). (G,H) PCS2 CreNLS plazmidleri ile elektroporasyondan 4 gün sonra distal oviductun enine kesiti. Tddomates (G) ile etiketlenmiş elektropora hücreler epitel monokatmanı (H) ile sınırlandırıldı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Bu ayrıntılı protokoldeki önemli adımlar, DNA / RNA / RNP çözeltisinin yumurta kanalı lümenine mikroenjeksiyonu ve elektroporasyon kuvvetinin ve alanının kontrolüdür. Mikroenjeksiyon sırasında DNA/RNA/RNP solüsyonu sızıntısı istenmeyen bölgelerin/hücrelerin transfeksiyonuna neden olabilir. Tutarlı ve verimli elektroporasyon için, yumurta kanalı lümeninin çözelti ile doldurulması tercih edilir (Şekil 3C, D). Bunun nedeni, elektroporasyon alanının esas olarak elektrot boyutu ve yerleşimi ile kontrol edilmesidir. Zayıf elektroporasyon, elektropore hücrelerin sayısını azaltır ve sert elektroporasyon, istenmeyen hücrelerin elektroporasyonuna neden olabilir veya doku yapısını bozabilir. Elektropora hücrelerin sayısı, DNA / RNA / RNP çözelti konsantrasyonu veya elektroporasyon parametreleri ayarlanarak değiştirilebilir. Bununla birlikte, elektroporasyon sırasında yüksek voltajlar / ısı üretimi dokuya zarar verebileceğinden, bu parametreler canlı / anestezi altındaki farelerde kullanılmadan önce test edilmelidir. Son olarak, bu prosedürün zorlu doğası nedeniyle, bu ameliyatı canlı / anestezi uygulanmış farelere yapmadan önce ölü fareler üzerinde trakta maruz kalma ve mikroenjeksiyon uygulanması önerilir.
Kanser başlangıcında birden fazla genin rol oynadığı kabul edilmektedir, bu nedenle bu olayı özetlemek, birkaç genin çoklu allelik modifikasyonunu gerektirir. Ek olarak, tüm hücrelerin onkojenik mutasyonlara eşit derecede duyarlı olmadığı da bilinmektedir9. Bu nedenle kanser modellemesi, onkojenik hakaretlerin sıkı kontrolünü sağlamak için belirli Cre fare hatları gerektirir. Bununla birlikte, kullanılabilirlikleri ve özgüllükleri, hedeflenmemiş dokulardaki etkiler ve ölümcüllük19 dahil olmak üzere çeşitli zorluklara neden olmaktadır. Ayrıca, geleneksel G-GEMM'ler bakım için yüksek maliyetlere neden olur ve fare hattı oluşturma için zaman gerektirir. CRISPR / Cas9 genom düzenleme teknolojisinin geliştirilmesi ve spesifik somatik hücrelere gen iletiminin iyileştirilmesi, bu sorunların üstesinden gelmemizi sağlamıştır. Bu protokolde, belirli fare hatlarına mutlak ihtiyaç duymadan, kanser modellemesi için kullanılabilecek somatik genom manipülasyonu için bir DNA / RNA / RNP dağıtım yöntemi sunuyoruz12. Lümen içine DNA/RNA/RNP solüsyonları enjekte edilerek ve elektroporasyon bazlı doğum için farklı boyutlarda cımbız tipi elektrotlar kullanılarak, fare yumurtalık kanalı mukozal epitelinin kısıtlı alanları hedeflenmiştir (Şekil 4A-F). Bu, fallop tüpünün distal ucundan kaynaklanan HGSC'lerin başlatılmasının modellenmesinde özellikle yararlıdır.
Sunulan mikroenjeksiyon ve in vivo elektroporasyon yöntemi, lümen ile dokuları / organları hedeflemek için çok yönlüdür. Organ parankiminin de bu yöntem kullanılarak hedeflenebilirolması 14. Lentiviral ve adenoviral sistemler gibi viral dağıtım yaklaşımları da benzer amaçlar için kullanılabilir. Bununla birlikte, elektroporasyonun viral dağıtım yaklaşımlarına göre avantajları şunlardır: 1) tek hücrelere çoklu plazmid verilmesi, 2) kesici uç boyutu15 üzerinde herhangi bir kısıtlama olmaması ve 3) alanın ve teslimat zamanlamasının kolay kontrolü. Ayrıca, kökene özgü destekleyiciler kullanılarak hedefleme özgüllüğü geliştirilebilir. Bu, viral ambalajlamadaki sınır nedeniyle viral sistemlerde bazen zordur.
Elektroporasyonun doğası gibi, elektroporasyonlu epitel hücreleri sağlıklı, düzenlenmemiş hücrelerle rastgele serpiştirilir (Şekil 4G). Bununla birlikte, genetiği değiştirilmiş ve değiştirilmemiş hücrelerdeki bu mozaisizm, immünokompetan bir mikro ortamda erken kanser başlangıcının sporadik doğasını özetlediği için kanser başlangıcını incelemek için avantajlı olabilir. Elektropora hücrelerin frekansı, DNA / RNA / RNP çözelti konsantrasyonları ve / veya elektroporasyon parametreleri değiştirilerek ayarlanabilir. Sunulan protokolle birlikte CRISPR-Cas aracılı gen düzenlemesini kullanarak, birden fazla geni taramak ve hedeflenen genlerde heterojen mutasyon / allelik kombinasyon kalıpları oluşturmak kolaydır; Bu, HGSC20,21 gibi önemli sayıda genomik değişiklikle ortaya çıkan kanserlerin modellenmesinde özellikle yararlıdır. Ayrıca, kanser progresyonu sırasında hedeflenen genleri sıralayarak, immünkompetan farelerde tümörlerin ve metastazların in vivo klonal evrimini takip etmek mümkündür12.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Yazarlar, Katie Teng ve Dr. Matthew J. Ford'a temsili sonuçlar ve protokol optimizasyonu üretmek için kullanılan plazmidleri sağladıkları için teşekkür eder. K.H., Fonds de recherche du Québec - Santé (FRQS) doktora bursu, Donnor Vakfı, Delta Kappa Gama Dünyası Bursu, Üreme ve Geliştirme Araştırma Merkezi (CRRD), Hugh E. Burke, Rolande & Marcel Gosselin ve Alexander McFee lisansüstü öğrencilikleri tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter unit | LifeGene | SF0.22PES | |
| 1 mL syringe | Terumo Medical Corportation | SS-01T | |
| 1 mm tweezer-type electrodes | BEX CO., LTD | LF650P1 | |
| 3 mm tweezer-type electrodes | BEX CO., LTD | LF650P3 | |
| 30G x 1/2 Needle | BD | 305106 | Needle is attached to the 1 mL syringe when using injectable anesthetic or analgesic. |
| Adson forceps | Fisher Scientific | 10-000-451 | |
| Air-pressured syringe | BD | B302995 | Attached to the micromanipulator; as shown in Figure 2B |
| Analgesic | - | - | Carprofen, dose: 5mg/kg. |
| Antiseptic | Cardinal Health | OMEL0000017 | Baxedin: 2% chlorhexidine in 70% isopropyl alcohol |
| Avertin (2,2,2-tribromoethanol) - Anesthetic | Sigma Aldrich | T48402-25G | |
| Clamp mount micromanipulator | AD Instruments | MM-33 | |
| Curved serrated forceps | Fisher Scientific | NC0696845 | |
| Dissecting microscope | Zeiss | SteREO Discovery.V8 | Apochromat S, 0.63X, FWD 107mm. Attached KL 200 LED for top light, labelled as light source in Figure 2B. |
| Eye lubricant | Alcon | - | Systane ointment (Lubricant eye ointment) |
| Glass capillary needles | Sutter Instrument Co. | B100–50-10 | Outside diameter: 1 mm, inside diameter: 0.5 mm, length: 10 cm |
| Hartman hemostats | Fisher Scientific | 50-822-711 | |
| Heating pad/disc | - | - | SnuggleSafe Pet Bed Microwave Heating Pad was used in this protocol. Microwave for 2-5min, and test with back of gloved hand. |
| Magnetic Mount for micromanipulator | AD Instruments | MB-B | Used to keep the clamp mount micromanipulator stable and upright during injection. |
| Micro bulldog clamp | Fisher Scientific | 50-822-230 | 3 cm |
| Micropipette puller | Sutter Instrument Co. | P-97 | P-97 Flaming/Brown type micropipette puller. Program used: P = 500, Heat = 576, PULL = 50, VEL = 80, DEL = 70 |
| Petri dish | Fisher Scientific | 263991 | Autoclaved/sterile glass petridishes can also be used. |
| Phosphate Buffered Saline (PBS) | Bio Basic Inc. | PD8117 | 10X PBS was diluted to 1X with DI water. Autoclave before use. |
| Pulse generator/Electroporator | BEX CO., LTD | CUY21 EDIT II | Electroporation settings: 30 V, 3 pulses, 1 s interval, P. length = 50 ms, unipolar |
| Rosa-LSLtdTomato mice | The Jackson Laboratory | 7914 | Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J |
| Sharp-blunt dissection scissors | Fisher Scientific | 28251 | |
| Sharp-pointed dissecting scissors | Fisher Scientific | SDI130 | |
| Shaver | - | - | Hair removal cream can also be used. |
| Silk braided sutures | Ethicon | 682G | 3/8 circle, gauge: 5-0, needle size: 18 mm, thread length: 75 cm. Staples can also be used. |
| Tapered ultrafine tip forceps | Fisher Scientific | 12-000-122 | |
| Thin absorbent paper | Kimberly-Clark Professional | 34120 | Kimwipes |
| Trypan blue | STEMCELL Technologies | 7050 | Filtered using 0.22 µm sterile filter before use for microinjection. |
Referanslar
- Avilés, M., Coy, P., Rizos, D. The oviduct: A key organ for the success of early reproductive events. Animal Frontiers. 5 (1), 25-31 (2015).
- Li, S., Winuthayanon, W. Oviduct: roles in fertilization and early embryo development. The Journal of Endocrinology. 232 (1), R1-R26 (2017).
- Briceag, I., et al. Fallopian tubes--literature review of anatomy and etiology in female infertility. Journal of Medicine and Life. 8 (2), 129-131 (2015).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Labidi-Galy, S. I., et al. High grade serous ovarian carcinomas originate in the fallopian tube. Nature Communications. 8 (1), 1093 (2017).
- Shaw, P. A., Rouzbahman, M., Pizer, E. S., Pintilie, M., Begley, H. Candidate serous cancer precursors in fallopian tube epithelium of BRCA1/2 mutation carriers. Modern Pathology. 22 (9), 1133-1138 (2009).
- Soong, T. R., et al. Evidence for lineage continuity between early serous proliferations (ESPs) in the Fallopian tube and disseminated high-grade serous carcinomas. The Journal of Pathology. 246 (3), 344-351 (2018).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. The Journal of Pathology. 211 (1), 26-35 (2007).
- Puisieux, A., Pommier, R. M., Morel, A. P., Lavial, F. Cellular pliancy and the multistep process of tumorigenesis. Cancer Cell. 33 (2), 164-172 (2018).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677 (2021).
- Teng, K., et al. Modeling high-grade serous ovarian carcinoma using a combination of in vivo fallopian tube electroporation and CRISPR-Cas9-mediated genome editing. Cancer Research. 81 (20), 5147-5160 (2021).
- Ford, M. J., Yamanaka, Y. Reprogramming mouse oviduct epithelial cells using in vivo electroporation and CRISPR/Cas9-mediated genetic manipulation. Methods in Molecular Biology. 2429, 367-377 (2022).
- Maresch, R., et al. Multiplexed pancreatic genome engineering and cancer induction by transfection-based CRISPR/Cas9 delivery in mice. Nature Communications. 7, 10770 (2016).
- Braun, C. J., Adames, A. C., Saur, D., Rad, R. Tutorial: design and execution of CRISPR in vivo screens. Nature Protocols. 17 (9), 1903-1925 (2022).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Chazaud, C., Yamanaka, Y., Pawson, T., Rossant, J. Early lineage segregation between epiblast and primitive endoderm in mouse blastocysts through the Grb2-MAPK pathway. Developmental Cell. 10 (5), 615-624 (2006).
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature Reviews. Cancer. 10 (7), 470-480 (2010).
- Kroeger Jr, P. T., Drapkin, R. Pathogenesis and heterogeneity of ovarian cancer. Current Opinion in Obstetrics & Gynecology. 29 (1), 26-34 (2017).
- Cancer Genome Atlas Research Network. Integrated genomic analyses of ovarian carcinoma. Nature. 474 (7353), 609-615 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır