Method Article
מודלים של עכברים מהונדסים בגנום סומטי המשתמשים במיקרו-הזרקה ובאלקטרופורציה של Vivo
In This Article
Summary
פרוטוקול זה מתאר מיקרו-הזרקה ואלקטרופורציה in vivo לעריכת גנום בתיווך קריספר מוגבלת אזורית באובידוקט העכבר.
Abstract
מודלים של עכברים מהונדסים גנטית (G-GEMM) סיפקו תובנה רבת ערך לגבי תפקוד הגן in vivo בהתפתחות, הומאוסטזיס ומחלות. עם זאת, הזמן והעלות הכרוכים בהקמת המושבה ותחזוקתה גבוהים. ההתקדמות האחרונה בעריכת גנום בתיווך קריספר אפשרה יצירת GEMMs סומטיים (S-GEMMs) על ידי התמקדות ישירה בתא/רקמה/איבר המעניין.
האובידוקט, או החצוצרה בבני אדם, נחשבת לרקמת המקור של סרטן השחלות הנפוץ ביותר, קרצינומה שחלתית סרוטית בדרגה גבוהה (HGSCs). HGSCs מתחילים באזור החצוצרה הדיסטלית לרחם, הממוקמת בסמוך לשחלה, אך לא בחצוצרה הפרוקסימלית. עם זאת, מודלים עכבריים מסורתיים של HGSC מכוונים את האובידוקט כולו, ולכן אינם משחזרים את המצב האנושי. אנו מציגים שיטה של מיקרו-הזרקה של תמיסת DNA, RNA או ריבונוקלאו פרוטאין (RNP) לתוך לומן האובידוקט ואלקטרופורציה in vivo כדי להתמקד בתאי אפיתל ריריים באזורים מוגבלים לאורך האובידוקט. ישנם מספר יתרונות של שיטה זו למידול סרטן, כגון: 1) יכולת הסתגלות גבוהה במיקוד האזור/רקמה/איבר ואזור האלקטרופורציה, 2) גמישות גבוהה בסוגי תאים ממוקדים (גמישות תאית) כאשר משתמשים בשילוב עם מקדמים ספציפיים לביטוי Cas9, 3) גמישות גבוהה במספר התאים המתחשמלים (תדר נמוך יחסית), 4) אין צורך בקו עכבר ספציפי (מידול מחלות חיסוניות), 5) גמישות גבוהה בשילוב מוטציות גנטיות, ו -6) אפשרות לעקוב אחר תאים מחושמלים כאשר משתמשים בשילוב עם קו כתב Cre. לפיכך, שיטה חסכונית זו משחזרת את התחלת הסרטן האנושי.
Introduction
החצוצרה, הנקראת אובידוקט בעכברים, היא מבנה צינורי המחבר את הרחם לשחלה. הוא ממלא תפקיד חיוני ברבייה של יונקים, ומספק את הסביבה להפריה פנימית ולהתפתחות טרום השרשה 1,2. למרות חשיבותו, מעט ידוע על תפקודו והומאוסטזיס, בין היתר בשל פיתוח טכניקות הפריה חוץ גופית העוקפות כל בעיית פוריות הקשורה לאיבר זה3. עם זאת, הוכר כי נגעים טרום סרטניים של קרצינומה שחלתית סרוסית בדרגה גבוהה (HGSC), היסטוטיפ אגרסיבי של סרטן השחלות המהווה כ -75% מקרצינומה בשחלות ו -85% ממקרי המוות הקשורים4, מוגבלים לאפיתל החצוצרה הדיסטלית 5,6,7,8 . זה מצביע על כך שלא כל התאים בגופנו רגישים באותה מידה לעלבונות אונקוגניים, אלא רק תאים ייחודיים/רגישים בכל רקמה/איבר הופכים לתא המקור בסרטן – מה שנקרא גמישות תאית9. לאורך קווים אלה, הוכח כי תאי האפיתל של החצוצרה הדיסטלית, הממוקמת בסמוך לשחלה, נבדלים משאר הצינור10,11. לפיכך, מודלים עכבריים מסורתיים של HGSC, המכוונים לכל התאים באובידוקט, אינם משחזרים את המצב האנושי. במחקר שנערך לאחרונה, השתמשנו בשילוב של עריכת גנום בתיווך קריספר, אלקטרופורציה של אובידוקט in vivo ומעקב אחר שושלת מבוססת Cre כדי לגרום בהצלחה ל- HGSC על ידי מוטציה של ארבעה גנים מדכאי גידול באובידוקט 12,13 של עכבר דיסטלי. כתב יד זה מציג פרוטוקול שלב אחר שלב המתאר הליך זה של מיקרו-הזרקה ואלקטרופורציה in vivo כדי להתמקד באפיתל הרירית של העכבר oviduct.
לשיטה זו מספר יתרונות. ניתן להתאים אותו לרקמות / איברים אחרים, כולל פרנכימה של איברים14. למרות שניתן להשתמש בגישות אחרות להעברת גנים in vivo כמו מערכות לנטי-ויראליות ואדנו-ויראליות כדי להשיג מיקוד ספציפי דומה לרקמות/איברים, אזור המיקוד מותאם בקלות רבה יותר באמצעות גדלים שונים של אלקטרודות מסוג טוויטר להעברה מבוססת אלקטרופורציה. בהתאם לריכוז ה-DNA/RNA/ריבונוקלאו פרוטאינים (RNPs), פרמטרי אלקטרופורציה וגודל האלקטרודות, ניתן לשנות את מספר התאים המתחשמלים. יתר על כן, ניתן לכוון לסוגי תאים ספציפיים כאשר משתמשים בהם בשילוב עם פרומוטורים לביטוי Cas9, ללא צורך מוחלט במודלים של עכברים מהונדסים גנטית (G-GEMM). בנוסף, בניגוד למערכות העברת נגיפים, אלקטרופורציה מאפשרת העברת פלסמיד מרובה לתאים בודדים ופחות אילוץ בהחדרת גודלDNA 15. בדיקות סקר In vivo של מוטציות גנטיות יכולות להתבצע בקלות יחסית גם בשל גמישות גבוהה זו. יתר על כן, תאים electroporated ניתן לעקוב או לעקוב כאשר שיטה זו משמשת בשילוב עם שורות כתב Cre כגון Tdtomato או קונפטי16,17.
Protocol
בעלי החיים שוכנו בכלובי מיקרו-בידוד סטטיים עם משטחי פילטר, הממוקמים בחדר ייעודי המכיל ארון בטיחות ביולוגית מסוג II. כל עבודת בעלי החיים בוצעה בהתאם להנחיות המוסדיות ואושרה על ידי ועדת הטיפול בבעלי חיים של הפקולטה לרפואה ומדעי הבריאות באוניברסיטת מקגיל (AUP #7843).
1. הכנת מחט מיקרו-הזרקה
- משוך צינור נימי זכוכית לנקודה חדה באמצעות מושך מיקרופיפטה עם התוכנית הבאה: P = 500, חום = 576, PULL = 50, VEL = 80, DEL = 70.
- באמצעות זוג מלקחיים מחודדים בעלי קצה דק במיוחד, חתכו את הקצה המחודד של צינור הנימים המשוך תחת מיקרוסקופ מנתח כדי ליצור פתח, כפי שמוצג באיור 1A,B. ודא כי הפתח אינו גדול מדי, שכן זה יפגע oviduct ולמנוע הזרקה איטית.
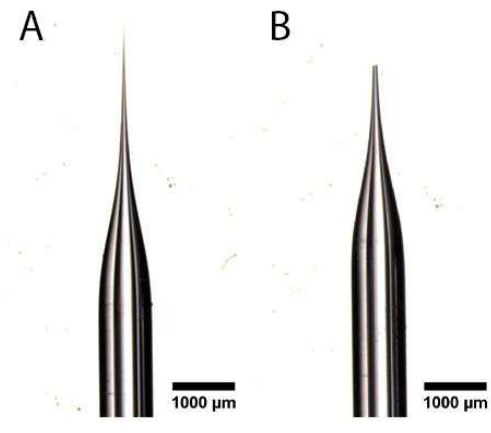
איור 1: הכנת מחט מיקרו-הזרקה. (A,B) צינור נימי משוך עם קצה מחודד (A) שנחתך כדי ליצור פתח (B). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. הכנת חומר ההרדמה להזרקה תוך צפקית
- הכינו אברטין מסונן ומדולל ביום הניתוח. תמיסת מלאי אברטין (2,2,2-tribromoethanol) מוכנה בריכוז של 1.6 גרם/מ"ל באלכוהול טרט-עמיל על ידי ערבוב נמרץ ומאוחסנת בחושך.
- יש לדלל את תמיסת ציר האברטין במי מלח איזוטוניים V/V 1.25% לריכוז סופי של 20 מ"ג/מ"ל בתוך מכסה אדים. מערבלים את הסוורטין המדולל ומסננים דרך מסנן סטרילי של 0.22 מיקרומטר. שמור בחושך.
3. הכנת אזור הניתוח
- אזור הניתוח צריך להיות סביבה סטרילית ייעודית, רצוי ספסל נקי או ארון בטיחות ביולוגי. סדרו את ציוד הניתוח הסטרילי, המיקרוסקופ, המיקרומניפולטור והאלקטרופורטור לפי הצורך. דוגמה לכך מוצגת באיור 2.
- חממו את כרית החימום/דיסק והניחו אותו מתחת לכלוב נקי ומאובזר. כלוב זה ישמש למגורי העכברים לאחר הניתוח.
- יוצקים מלח סטרילי 1x פוספט חוצץ (PBS) לתוך צלחת פטרי סטרילית. השתמש בזוג מספריים נקיים כדי לחתוך נייר סופג לריבועים, עם מידות משוערות של 1 ס"מ x 1 ס"מ. זרקו את פיסות הנייר הסופג האלה לתוך PBS 1x כדי להשרות אותן.
4. הכנת התמיסה והמחט להזרקה
- הכינו את תמיסת ההזרקה ביום הניתוח. ערבבו את הדנ"א/רנ"א/רנ"א עם טריפאן כחול מסונן לריכוז סופי מינימלי של 200 ננוגרם/מיקרוליטר כל אחד ו-5%, בהתאמה. יש לאחסן בטמפרטורת החדר לפני ההזרקה.
הערה: השתמש מזרק 1 מ"ל כדי לקחת 100% טריפאן כחול ולסנן דרך מסנן סטרילי 0.22 מיקרומטר לפני השימוש. - חברו את המחט הנימית המושכת, שנקראת מעתה מחט מיקרו-הזרקה, למיקרומניפולטור של תושבת המהדק המיוצב על-ידי תושבת מגנטית (ההתקנה מוצגת באיור 2B).
- פיפטה 2 μL של תמיסת ההזרקה על צלחת פטרי סטרילית. תוך כדי התבוננות מתחת למיקרוסקופ, לאט לאט לקחת 1-2 μL של פתרון זה לתוך מחט microinjection באמצעות מזרק לחץ אוויר מחובר micromanipulator. הימנעו מבועות/לקיחת בועות לתוך מחט המיקרו-הזרקה.

איור 2: הכנת אזור ניתוח. (A) הגדרת אזור ניתוח בתוך ספסל נקי. (B) מערך מיקרוסקופ דיסקציה ומיקרומניפולטור לאדם ימני. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. חשיפת מערכת הרבייה הנשית
- יש להרדים עכברה בת 6-8 שבועות על ידי מתן חומר הרדמה מסונן ומדולל תוך צפקי במינון של 0.25-0.5 מ"ג/גרם. לאחר מכן, לתת carprofen (משכך כאבים מונע) תת עורית במינון של 5 מ"ג / ק"ג.
הערה: חלופות אחרות שניתן להשתמש בהן כהרדמה הן איזופלורן או קטמין/קסילזין. - הניחו נייר סופג על פד/דיסק נקי ומחומם. לאחר מכן, הניחו את העכבר המרדים על נייר סופג מחומם זה כאשר הצד הגבי פונה כלפי מעלה. יש למרוח חומר סיכה לעיניים על כל עין כדי למנוע התייבשות במהלך הניתוח.
הערה: ודא שכרית החימום/דיסק החימום חמים מעט למגע על-ידי בדיקה בגב היד. - בדוק דום הרדמה עמוקה על ידי צביטת הבוהן של העכבר המרדים עם זוג מלקחיים. הסירו את הפרווה הגבית סביב אתר החתך הפוטנציאלי (המיקום שמוצג באיור 3A) ונגבו את העור החשוף בחומר חיטוי.
- השתמשו בזוג מלקחיים ישרים וקהים כדי לצבוט את העור החשוף וליצור חתך באורך 1 ס"מ לאורך קו האמצע של הגוף באמצעות זוג מספריים קהים חדים וסטריליים. נקו את האזור סביב החתך בחומר חיטוי.
- צבטו והחזיקו צד אחד של אתר החיתוך באמצעות זוג מלקחיים סטריליים של אדסון. לאחר מכן, באמצעות זוג מלקחיים משוננות מעוקלות סטריליות, מפרידים בעדינות את העור מדופן הגוף, מתחילים בחתך קו האמצע ונעים לרוחב.
- אתר את כרית השומן מתחת לכליה. בעזרת זוג מלקחיים סטריליים ישרים וקהים, צבטו את דופן הגוף ישירות מעל כרית השומן. יוצרים חתך קטן בדופן הגוף באמצעות זוג מספריים סטריליים מחודדים ומחודדים, תוך הקפדה על הימנעות מכלי דם.
- תוך כדי צביטת דופן הגוף במלקחיים ישרים וקהים, מחדירים לתוך החתך זוג מלקחיים מעוקלים קהים סטריליים ומרחיבים את החתך שנוצר בדופן הגוף.
- תפוס את כרית השומן הנראית לעין עם המלקחיים המעוקלים הקהים ומשוך אותה מהחור כדי לחשוף את השחלה, האובידוקט והרחם.
- כדי לשמור על מערכת הרבייה חשופה, הדקו את כרית השומן עם מהדק בולדוג סטרילי, כפי שמוצג באיור 3B.
6. הזרקת אובידוקט In vivo ואלקטרופורציה
- מניחים בזהירות את נייר הספיגה המחומם ואת העכבר המורדם עם מערכת הרבייה חשופה על הבמה של מיקרוסקופ ניתוח, כך שניתן יהיה לצפות בדרכי העיכול. דוגמה לתצוגה כפי שהיא נצפית במיקרוסקופ מוצגת באיור 3B.
- התאם את המיקרומניפולטור כך שמחט ההזרקה עם תמיסה ניתן לראות גם מתחת למיקרוסקופ.
- בעזרת זוג מלקחיים מחודדים וסטריליים בעלי קצה דק במיוחד, החזיקו את אזור האובידוקט אותו יש להזריק יציב. האזור שיש להזריק חייב להיות בקו אחד עם כיוון מחט המיקרו-הזרקה.
הערה: השתמש במהדק הבולדוג המעגן את כרית השומן ואת מערכת הרבייה כדי לסובב/להזיז בעדינות את המערכת למצב אופטימלי, במידת הצורך. - כוונן את המיקרומניפולטור כדי לנקב את האובידוקט עם מחט המיקרו-הזרקה, תוך הזנת האובידוקט על המחט באמצעות מלקחיים מחודדים בעלי קצה דק במיוחד. הזז בעדינות את מחט המיקרו-הזרקה כדי לאשר שהיא הוכנסה לתוך האובידוקט.
הערה: הכנס את מחט המיקרו-הזרקה למקטע ישר במקום לנקודת מפנה של האובידוקט המפותל כדי למנוע נקבים מרובים ודליפה של תמיסת ההזרקה. - להזריק לאט עד 1 μL של תמיסה לתוך oviduct, תוך התבוננות התנועה של הפתרון הכחול והרחבת לומן oviduct מתחת למיקרוסקופ. היזהר לא להכניס בועות לתוך לומן. תמונות מייצגות של אובידוקט עם 100% טריפאן כחול מוצגות באיור 3C,D.
- הסר את המחט מן oviduct. כסו את האזור הממוקד בפיסת נייר סופג ספוגה ב-PBS סטרילי 1x (משלב 3.3).
- אחזו בנייר המושרה מראש ובאזור/אזור שיש לכוון אליו באמצעות זוג פינצטות אלקטרודות (1 מ"מ, 3 מ"מ או 5 מ"מ, תלוי בגודל האזור שיש לכוון) והתרחקו מהגוף, לפני שאתם מתחשמלים באמצעות ההגדרות הבאות במחולל הדופק/אלקטרופורטור: 30 וולט, שלוש פעימות, מרווח של שנייה אחת, אורך פולס של 50 אלפיות השנייה, חד קוטבי.
הערה: יש להגדיר את המרחק בין האלקטרודות כך שהאלקטרודות יוכלו להיצמד לאזור היעד מבלי לעוות את האובידוקט. המרחק המומלץ הוא סביב 1 מ"מ. - לאחר ההתחשמלות, הסר את נייר הספגה והנח את העכבר (עם נייר הבליגה המחומם מתחת) בחזרה על כרית חום. שחררו את מהדק הבולדוג ודחפו בזהירות את מערכת הרבייה החשופה חזרה מתחת לדופן הגוף. חזור על סעיף 5 כדי לחשוף את מערכת הרבייה בצד השני.
הערה: אלקטרופורציה מוצלחת ללא קשר לשלב הייחום של העכבר כל עוד הלומן מלא בתמיסה. - כסו את מערכת העיכול החשופה בנייר סופג שהושרה ב-PBS סטרילי 1x כדי למנוע ממנה להתייבש, ולאחר מכן הכינו את מחט המיקרו-הזרקה להזרקה השנייה על ידי חזרה על שלבים 4.2 ו-4.3.
הערה: החלף את מחט המיקרו-הזרקה לפי הצורך. יש למנוע התייבשות של הרקמה החשופה על ידי מריחת PBS סטרילית 1x בעת הצורך. - חזור על השלבים לעיל כדי להזריק ולחשמל את האובידוקט בצד הנגדי.
הערה: יש למרוח מחדש את חומר סיכה לעיניים לפי הצורך במהלך הניתוח ולאחריו. - לאחר ששתי האובידוקט התחשמלו והונחו בחזרה מתחת לדופן הגוף, תפרו או הדקו את אתר החתך הגבי. לתפירה, השתמש בהמוסטאט כדי לתפוס את המחט של התפרים קלועי המשי (3/8 עיגול; מד: 5-0; גודל מחט: 18 מ"מ; אורך חוט: 75 ס"מ). צבטו והחזיקו צד אחד של אתר החיתוך באמצעות זוג מלקחיים משוננות מעוקלות סטריליות, ולאחר מכן השתמשו בהמוסטאט כדי לתפעל את התפר כדי לסגור את הפצע.
- העבר את העכבר לכלוב נקי המונח על גבי פד/דיסק מחומם (משלב 3.2) ועקוב עד שהעכבר פעיל.
- יש לתת 5 מ"ג/ק"ג קרפרופן תת עורית כל 24 שעות במשך 3 הימים הבאים ולפקח במהלך 10 הימים הבאים.
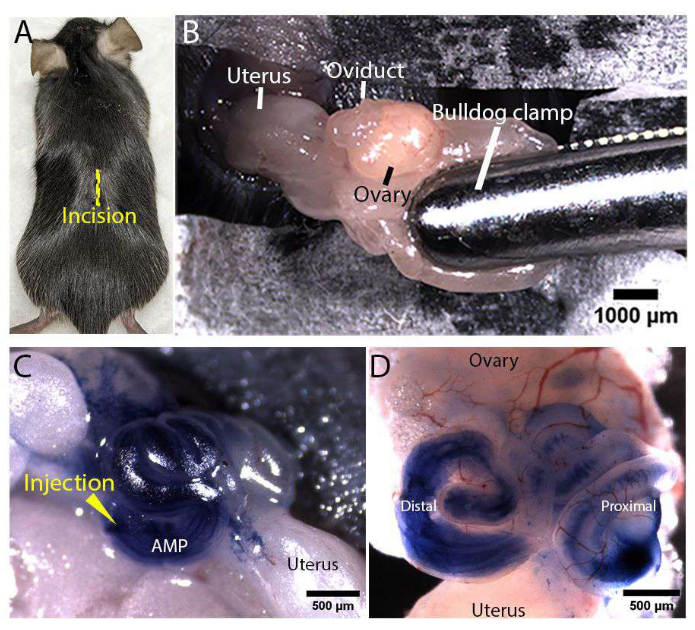
איור 3: חשיפה נשית לדרכי הרבייה ומיקרו-הזרקה . (A) מיקום חתך קו האמצע (מוצג כקו צהוב) בצד הגבי של עכבר Rosa-LSLtdTomato. (B) חשיפה נשית לדרכי הרבייה. כרית השומן הודקה באמצעות מהדק בולדוג סטרילי כדי לעגן את המערכת ולשמור אותה חשופה. (ג,ד) תמונות מייצגות של הזרקת אובידוקט in vivo . מחט מיקרו-הזרקה הוחדרה לאמפולה הדיסטלית (שכותרתה AMP), ו-100% טריפאן כחול מסונן הוזרק לתוך לומן האובידוקט בזמן שדרכי העיכול היו חשופות (C). תמונה מייצגת של אובידוקט מנותח, המדגימה כי תמיסת טריפאן כחול מוזרק מתפשטת ברחבי לומן האובידוקט הדיסטלי והפרוקסימלי (D). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
איור 1 ואיור 2 מתארים את הכנת מחט המיקרו-הזרקה ואת הגדרת אזור הניתוח, בהתאמה, עבור מיקרו-הזרקה in vivo ואלקטרופורציה של האובידוקט של העכבר. במהלך הניתוח, מערכת הרבייה הנשית נחשפה דרך חתכים שבוצעו בעור הגבי (איור 3A) ובדופן הגוף של עכבר Rosa-LSLtdTomato מורדם (Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J)17. מהדק בולדוג הודק על כרית השומן שמעל מערכת העיכול כדי לשמור עליה חשופה ומעוגנת (איור 3B). תמיסת הזרקה המכילה פלסמידים PCS2 CreNLS18 בריכוז של 400 ננוגרם/מיקרוליטר הוזרקה לאמפולה (המסומנת AMP) של האובידוקט המפותל והורשתה להתפזר לאורך לומן האובידוקט (איור 3C,D). למרות שפלסמידים מסוג PCS2 CreNLS שימשו ליצירת תוצאות מייצגות בכתב יד זה, ניתן להשתמש בשיטה המתוארת עם DNA/RNA/RNPs הניתנים להחלפה בקלות בתמיסת ההזרקה לעריכת גנים בתיווך CRISPR/Cas באובידוקט העכבר. לאחר מכן, הונחו אלקטרודות מסוג פינצטה בקוטר 1 מ"מ או 3 מ"מ, כך שהאובידוקט הדיסטלי היה בין האלקטרודות לצורך העברה מבוססת אלקטרופורציה.
האובידוקט נקטף 4 ימים לאחר הניתוח ונמתח על ידי הסרת המזוסאלפינקס כדי להמחיש ספציפיות אלקטרופורציה. באמצעות אלקטרודות מסוג טוויטר בקוטר 1 מ"מ או 3 מ"מ, אזור המטרה, שסומן ב-TdTomato, הוגבל לאפיתל האובידוקט הדיסטלי (איור 4A,D). גודלו של אזור מטרה זה נשלט עוד יותר על ידי שימוש באלקטרודות בגדלים שונים. באמצעות שימוש באלקטרודות מסוג טוויטר 3 מ"מ, כיוונו לאזור גדול בהרבה של AMP (איור 4B,C), בהשוואה למיקוד רק בקצה הדיסטלי ביותר, INF (איור 4E,F), באמצעות אלקטרודות מסוג טוויטר 1 מ"מ. האובידוקט שנקטף תוקן, טופל בשיפוע סוכרוז וחולק באמצעות קריוסטט לצורך ניתוחים מפורטים. הקטעים הוכתמו ב-Hoescht 33342 וב-Phalloidin כדי להכתים את הגרעינים ואת השלד הציטו-שלד בהתאמה, ואז הם צולמו באמצעות מיקרוסקופ קונפוקלי סורק נקודתית. באזור היעד, תאים מחושמלים, המסומנים על-ידי TdTomato, חולקו באופן אקראי בין תאים שאינם מחושמלים (TdTomato-ve) (איור 4G). נוסף על כך, תאים מחושמלים הוגבלו לאפיתל הרירית ולא נמצאו בשכבת הסטרומה או השריר הבסיסית (איור 4G,H). לבסוף, כדי לאשר עריכת גנים בתיווך CRISPR-Cas, ניתן לבודד תאי TdTomato+ve על ידי מיון תאים המופעלים על ידי פלואורסצנטיות (FACS) לבידוד DNA וריצוף MiSeq12.
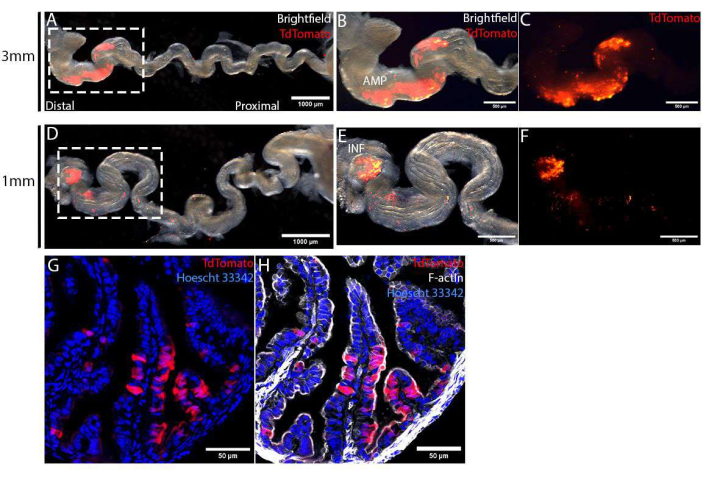
איור 4: תיקוף הזרקה מוצלחת in vivo ואלקטרופורציה של תאי אפיתל אובידוקט, 4 ימים לאחר הניתוח. (A-C) אלקטרופורציה באמצעות אלקטרודות מסוג טוויטר בגודל 3 מ"מ. האובידוקט שוחרר על ידי הסרת המזוסאלפינקס להדמיה טובה יותר של ספציפיות אלקטרופורציה (A). אזור האלקטרופורציה, שזוהה על ידי ביטוי TdTomato, הוגבל לאובידוקט הדיסטלי, שכותרתו AMP (B,C). (ד-ו) אלקטרופורציה באמצעות אלקטרודות מסוג טוויטר בגודל 1 מ"מ. האובידוקט שוחרר על ידי הסרת המזוסאלפינקס להדמיה טובה יותר של ספציפיות אלקטרופורציה (D). אזור האלקטרופורציה הוגבל לאינפונדיבולום (המסומן INF), הקצה הדיסטלי ביותר של האובידוקט (E,F). (ז,ח) חתך רוחבי של האובידוקט הדיסטלי 4 ימים לאחר אלקטרופורציה עם פלסמידים PCS2 CreNLS. תאים מחושמלים שסומנו ב-TdTomato (G) הוגבלו לחד-שכבה אפיתל (H). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
שלבים מכריעים בפרוטוקול מפורט זה הם מיקרו-הזרקה של תמיסת DNA/RNA/RNP לתוך לומן האובידוקט ובקרה על חוזק ושטח האלקטרופורציה. דליפת תמיסת DNA/RNA/RNP במהלך מיקרו-הזרקה עלולה לגרום לטרנספקציה של אזורים/תאים לא רצויים. להתחשמלות עקבית ויעילה, עדיף למלא את לומן האובידוקט בתמיסה (איור 3C,D). הסיבה לכך היא שאזור האלקטרופורציה נשלט בעיקר על ידי גודל האלקטרודה ומיקומה. אלקטרופורציה חלשה מפחיתה את מספר התאים המתחשמלים, ואלקטרופורציה קשה עלולה לגרום להתחשמלות של תאים לא רצויים או לשבש את מבנה הרקמה. ניתן לשנות את מספר התאים המחושמלים על ידי התאמת ריכוז תמיסת DNA/RNA/RNP או פרמטרים של אלקטרופורציה. עם זאת, מכיוון שמתח גבוה/ייצור חום במהלך אלקטרופורציה עלול לפגוע ברקמה, יש לבדוק פרמטרים אלה לפני השימוש בעכברים חיים/מורדמים. לבסוף, בשל אופיו התובעני של הליך זה, מומלץ לתרגל חשיפה למערכת העיכול ומיקרו-הזרקה בעכברים מתים לפני ביצוע ניתוח זה בעכברים חיים/מורדמים.
ידוע כי גנים מרובים מעורבים בהתחלת סרטן, ולכן, שחזור אירוע זה דורש שינוי רב אללי של מספר גנים. בנוסף, ידוע גם כי לא כל התאים רגישים באותה מידה למוטציות אונקוגניות9. מודלים של סרטן, אם כן, דורשים קווי עכבר Cre ספציפיים כדי להשיג שליטה הדוקה על עלבונות אונקוגניים. עם זאת, זמינותם וסגולותם גורמת לאתגרים שונים, כולל השפעות ברקמות לא ממוקדות וקטלניות19. יתר על כן, G-GEMM מסורתיים כרוכים בעלויות תחזוקה גבוהות ודורשים זמן ליצירת קווי עכבר. הפיתוח של טכנולוגיית עריכת גנום CRISPR/Cas9 ושיפור העברת הגנים לתאים סומטיים ספציפיים אפשרו לנו להתגבר על בעיות אלה. בפרוטוקול זה, אנו מציגים שיטת העברת DNA/RNA/RNP למניפולציה של גנום סומטי שניתן להשתמש בה למידול סרטן, ללא צורך מוחלט בקווי עכבר ספציפיים12. על-ידי הזרקת תמיסות DNA/RNA/RNP לתוך הלומן ושימוש בגדלים שונים של אלקטרודות מסוג טוויטר להעברה מבוססת אלקטרופורציה, אזורים מוגבלים באפיתל הרירית של העכבר ממוקדים (איור 4A-F). זה שימושי במיוחד במידול ייזום של HGSCs שמקורם בקצה הדיסטלי של החצוצרה.
שיטת המיקרו-הזרקה ואלקטרופורציה in vivo המוצגת היא רב-תכליתית ביותר למיקוד רקמות/איברים באמצעות לומן. פרנכימה של איברים ניתנת למיקוד גם בשיטה זו14. גישות להעברת נגיפים, כמו מערכות לנטי-ויראליות ואדנו-ויראליות, יכולות לשמש גם למטרות דומות. עם זאת, היתרונות של אלקטרופורציה על פני גישות משלוח ויראלי הם: 1) העברת פלסמיד מרובים לתאים בודדים, 2) אין הגבלה על גודל הכנס15, ו -3) שליטה קלה על האזור ועיתוי המסירה. בנוסף, ניתן לשפר את ספציפיות המיקוד באמצעות מקדמים ספציפיים לשושלת. זה לפעמים קשה במערכות ויראליות בגלל המגבלה על אריזות ויראליות.
כטבעה של אלקטרופורציה, תאי אפיתל מחושמלים משולבים באופן אקראי עם תאים בריאים ולא ערוכים (איור 4G). עם זאת, פסיפס זה בתאים מהונדסים גנטית ולא מהונדסים יכול להיות יתרון לחקר התחלת סרטן, מכיוון שהוא משחזר את האופי הספורדי של התחלת סרטן מוקדמת בתוך מיקרו-סביבה חיסונית. ניתן להתאים את התדירות של תאים אלקטרופורטיים על ידי שינוי ריכוזי תמיסת DNA/RNA/RNP ו / או פרמטרים אלקטרופורציה. באמצעות עריכת גנים בתיווך CRISPR-Cas בשילוב עם הפרוטוקול המוצג, קל לסנן גנים מרובים וליצור דפוסים הטרוגניים של מוטציות/שילובים אלליים בגנים ממוקדים; זה שימושי במיוחד במידול סוגי סרטן המציגים מספר ניכר של שינויים גנומיים כמו HGSCs20,21. יתר על כן, על ידי ריצוף גנים ממוקדים במהלך התקדמות הסרטן, ניתן לעקוב אחר האבולוציה השבטית in vivo של גידולים וגרורות בעכברים חיסוניים12.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מודים לקייטי טנג ולד"ר מתיו ג'יי פורד על אספקת פלסמידים המשמשים ליצירת תוצאות מייצגות ואופטימיזציה של פרוטוקולים. K.H. נתמך על ידי Fonds de recherche du Québec - Santé (FRQS) מענק דוקטורט, קרן דונור, דלתא Kappa Gamma World Fellowship, המרכז לחקר רבייה ופיתוח (CRRD), יו א 'בורק, רולאנד ומרסל גוסלין, ואלכסנדר McFee סטודנטים לתואר שני.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter unit | LifeGene | SF0.22PES | |
| 1 mL syringe | Terumo Medical Corportation | SS-01T | |
| 1 mm tweezer-type electrodes | BEX CO., LTD | LF650P1 | |
| 3 mm tweezer-type electrodes | BEX CO., LTD | LF650P3 | |
| 30G x 1/2 Needle | BD | 305106 | Needle is attached to the 1 mL syringe when using injectable anesthetic or analgesic. |
| Adson forceps | Fisher Scientific | 10-000-451 | |
| Air-pressured syringe | BD | B302995 | Attached to the micromanipulator; as shown in Figure 2B |
| Analgesic | - | - | Carprofen, dose: 5mg/kg. |
| Antiseptic | Cardinal Health | OMEL0000017 | Baxedin: 2% chlorhexidine in 70% isopropyl alcohol |
| Avertin (2,2,2-tribromoethanol) - Anesthetic | Sigma Aldrich | T48402-25G | |
| Clamp mount micromanipulator | AD Instruments | MM-33 | |
| Curved serrated forceps | Fisher Scientific | NC0696845 | |
| Dissecting microscope | Zeiss | SteREO Discovery.V8 | Apochromat S, 0.63X, FWD 107mm. Attached KL 200 LED for top light, labelled as light source in Figure 2B. |
| Eye lubricant | Alcon | - | Systane ointment (Lubricant eye ointment) |
| Glass capillary needles | Sutter Instrument Co. | B100–50-10 | Outside diameter: 1 mm, inside diameter: 0.5 mm, length: 10 cm |
| Hartman hemostats | Fisher Scientific | 50-822-711 | |
| Heating pad/disc | - | - | SnuggleSafe Pet Bed Microwave Heating Pad was used in this protocol. Microwave for 2-5min, and test with back of gloved hand. |
| Magnetic Mount for micromanipulator | AD Instruments | MB-B | Used to keep the clamp mount micromanipulator stable and upright during injection. |
| Micro bulldog clamp | Fisher Scientific | 50-822-230 | 3 cm |
| Micropipette puller | Sutter Instrument Co. | P-97 | P-97 Flaming/Brown type micropipette puller. Program used: P = 500, Heat = 576, PULL = 50, VEL = 80, DEL = 70 |
| Petri dish | Fisher Scientific | 263991 | Autoclaved/sterile glass petridishes can also be used. |
| Phosphate Buffered Saline (PBS) | Bio Basic Inc. | PD8117 | 10X PBS was diluted to 1X with DI water. Autoclave before use. |
| Pulse generator/Electroporator | BEX CO., LTD | CUY21 EDIT II | Electroporation settings: 30 V, 3 pulses, 1 s interval, P. length = 50 ms, unipolar |
| Rosa-LSLtdTomato mice | The Jackson Laboratory | 7914 | Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J |
| Sharp-blunt dissection scissors | Fisher Scientific | 28251 | |
| Sharp-pointed dissecting scissors | Fisher Scientific | SDI130 | |
| Shaver | - | - | Hair removal cream can also be used. |
| Silk braided sutures | Ethicon | 682G | 3/8 circle, gauge: 5-0, needle size: 18 mm, thread length: 75 cm. Staples can also be used. |
| Tapered ultrafine tip forceps | Fisher Scientific | 12-000-122 | |
| Thin absorbent paper | Kimberly-Clark Professional | 34120 | Kimwipes |
| Trypan blue | STEMCELL Technologies | 7050 | Filtered using 0.22 µm sterile filter before use for microinjection. |
References
- Avilés, M., Coy, P., Rizos, D. The oviduct: A key organ for the success of early reproductive events. Animal Frontiers. 5 (1), 25-31 (2015).
- Li, S., Winuthayanon, W. Oviduct: roles in fertilization and early embryo development. The Journal of Endocrinology. 232 (1), R1-R26 (2017).
- Briceag, I., et al. Fallopian tubes--literature review of anatomy and etiology in female infertility. Journal of Medicine and Life. 8 (2), 129-131 (2015).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Labidi-Galy, S. I., et al. High grade serous ovarian carcinomas originate in the fallopian tube. Nature Communications. 8 (1), 1093(2017).
- Shaw, P. A., Rouzbahman, M., Pizer, E. S., Pintilie, M., Begley, H. Candidate serous cancer precursors in fallopian tube epithelium of BRCA1/2 mutation carriers. Modern Pathology. 22 (9), 1133-1138 (2009).
- Soong, T. R., et al. Evidence for lineage continuity between early serous proliferations (ESPs) in the Fallopian tube and disseminated high-grade serous carcinomas. The Journal of Pathology. 246 (3), 344-351 (2018).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. The Journal of Pathology. 211 (1), 26-35 (2007).
- Puisieux, A., Pommier, R. M., Morel, A. P., Lavial, F. Cellular pliancy and the multistep process of tumorigenesis. Cancer Cell. 33 (2), 164-172 (2018).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677(2021).
- Teng, K., et al. Modeling high-grade serous ovarian carcinoma using a combination of in vivo fallopian tube electroporation and CRISPR-Cas9-mediated genome editing. Cancer Research. 81 (20), 5147-5160 (2021).
- Ford, M. J., Yamanaka, Y. Reprogramming mouse oviduct epithelial cells using in vivo electroporation and CRISPR/Cas9-mediated genetic manipulation. Methods in Molecular Biology. 2429, 367-377 (2022).
- Maresch, R., et al. Multiplexed pancreatic genome engineering and cancer induction by transfection-based CRISPR/Cas9 delivery in mice. Nature Communications. 7, 10770(2016).
- Braun, C. J., Adames, A. C., Saur, D., Rad, R. Tutorial: design and execution of CRISPR in vivo screens. Nature Protocols. 17 (9), 1903-1925 (2022).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Chazaud, C., Yamanaka, Y., Pawson, T., Rossant, J. Early lineage segregation between epiblast and primitive endoderm in mouse blastocysts through the Grb2-MAPK pathway. Developmental Cell. 10 (5), 615-624 (2006).
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature Reviews. Cancer. 10 (7), 470-480 (2010).
- Kroeger Jr, P. T., Drapkin, R. Pathogenesis and heterogeneity of ovarian cancer. Current Opinion in Obstetrics & Gynecology. 29 (1), 26-34 (2017).
- Cancer Genome Atlas Research Network. Integrated genomic analyses of ovarian carcinoma. Nature. 474 (7353), 609-615 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved