Method Article
생체 내 미세주입 및 전기천공을 사용한 체세포 게놈 공학 마우스 모델
요약
이 프로토콜은 마우스 난관에서 국소적으로 제한된 CRISPR 매개 게놈 편집을 위한 미세주입 및 생체 내 전기천공을 설명합니다.
초록
생식계열 유전자 조작 마우스 모델(G-GEMM)은 발달, 항상성 및 질병에서 생체 내 유전자 기능에 대한 귀중한 통찰력을 제공했습니다. 그러나 식민지 생성 및 유지 관리와 관련된 시간과 비용이 높습니다. CRISPR 매개 게놈 편집의 최근 발전으로 관심 세포/조직/기관을 직접 표적으로 하여 체세포 GEMM(S-GEMM)을 생성할 수 있게 되었습니다.
인간의 난관 또는 나팔관은 가장 흔한 난소암인 고급 장액성 난소암(HGSC)의 기원 조직으로 간주됩니다. HGSC는 난소에 인접한 자궁 원위 나팔관 영역에서 시작되지만 근위 나팔관은 아닙니다. 그러나 HGSC의 전통적인 마우스 모델은 전체 난관을 표적으로 삼기 때문에 인간의 상태를 요약하지 않습니다. 우리는 DNA, RNA 또는 리보핵단백질(RNP) 용액을 난관 내강에 미세주입하고 생체 내 전기천공하여 난관을 따라 제한된 영역의 점막 상피 세포를 표적으로 하는 방법을 제시합니다. 암 모델링을 위한 이 방법의 몇 가지 장점에는 1) 전기천공 영역/조직/기관 및 영역을 표적화하는 데 있어 높은 적응성, 2) Cas9 발현을 위한 특정 프로모터와 함께 사용할 때 표적 세포 유형(세포 유연성)의 높은 유연성, 3) 전기천공된 세포 수의 높은 유연성(상대적으로 낮은 빈도), 4) 특정 마우스 라인이 필요하지 않음(면역적격 질병 모델링), 5) 유전자 돌연변이 조합의 높은 유연성, 6) Cre 리포터 라인과 함께 사용할 경우 전기천공된 세포를 추적할 수 있는 가능성. 따라서, 이 비용 효율적인 방법은 인간의 암 개시를 요약한다.
서문
생쥐의 난관이라고 하는 나팔관은 자궁과 난소를 연결하는 관형 구조입니다. 포유류의 번식에 필수적인 역할을 하며, 내부 수정과 착상 전 발달을 위한 환경을 제공한다 1,2. 그 중요성에도 불구하고, 그 기능과 항상성에 대해서는 알려진 바가 거의 없는데, 이는 부분적으로는 이 기관과 관련된 불임 문제를 우회하는 체외 수정 기술의 발전 때문이다3. 그러나, 난소암의 약 75%와 관련 사망의 85%를 차지하는 난소암의 공격적인 조직형인 고급 장액성 난소암(HGSC)의 전암성 병변4은 원위 나팔관 상피(dismalian fallopian epithelium)로 제한된다 5,6,7,8 . 이것은 우리 몸의 모든 세포가 발암성 손상에 똑같이 취약한 것은 아니며, 오히려 각 조직/기관의 고유하고 감수성이 있는 세포만이 암의 기원 세포가 된다는 것을 나타낸다9. 이러한 맥락을 따라, 난소에 인접한 원위 나팔관의 상피 세포는 관의 나머지 부분과 구별되는 것으로 나타났다10,11. 따라서 난관의 모든 세포를 표적으로 하는 HGSC의 전통적인 마우스 모델은 인간의 상태를 요약하지 않습니다. 최근 연구에서 우리는 CRISPR 매개 게놈 편집, 생체 내 난관 전기천공 및 Cre 기반 계통 추적의 조합을 사용하여 원위 마우스 난관12,13에서 4개의 종양 억제 유전자를 돌연변이시켜 HGSC를 성공적으로 유도했습니다. 이 원고는 마우스 난관 점막 상피를 표적으로 하기 위한 미세주입 및 생체 내 전기천공 절차를 설명하는 단계별 프로토콜을 제시합니다.
이 방법에는 몇 가지 장점이 있습니다. 장기 실질(organ parenchyma)을 포함한 다른 조직/기관을 표적으로 삼도록 조정할 수 있다14. 렌티바이러스 및 아데노바이러스 시스템과 같은 다른 생체 내 유전자 전달 접근법을 사용하여 유사한 조직/장기 특이적 표적화를 달성할 수 있지만, 표적화 영역은 전기천공 기반 전달을 위해 다양한 크기의 핀셋 유형 전극을 사용하여 보다 쉽게 조정할 수 있습니다. DNA/RNA/리보핵단백질(RNP)의 농도, 전기천공 매개변수 및 전극 크기에 따라 전기천공된 세포의 수가 변경될 수 있습니다. 또한, 생식계열 유전자 조작 마우스 모델(G-GEMM)에 대한 절대적인 필요 없이 Cas9 발현을 위한 프로모터와 함께 사용할 경우 특정 세포 유형을 표적으로 삼을 수 있습니다. 또한, 바이러스 전달 시스템과는 달리, 전기천공법은 단일 세포로의 다중 플라스미드 전달을 허용하고 삽입 DNA 크기15의 제약을 덜어준다. 유전자 돌연변이의 생체 내 스크리닝은 이러한 높은 유연성으로 인해 비교적 쉽게 수행할 수 있습니다. 또한, 전기천공된 세포는 이 방법이 Tdtomato 또는 Confetti16,17과 같은 Cre 리포터 라인과 조합되어 사용될 때 추적 또는 추적될 수 있다.
프로토콜
동물들은 필터 탑이 있는 정적 미세 격리 케이지에 수용되었으며, 유형 II 생물 안전 캐비닛이 있는 전용 방에 위치했습니다. 모든 동물 작업은 기관 지침에 따라 수행되었으며 McGill University의 의학 및 건강 과학 학부 동물 관리 위원회(AUP #7843)의 승인을 받았습니다.
1. 미세 주입 바늘 준비
- P = 500, Heat = 576, PULL = 50, VEL = 80, DEL = 70 프로그램과 함께 마이크로 피펫 풀러를 사용하여 유리 모세관을 날카로운 지점으로 당깁니다.
- 한 쌍의 테이퍼 형 초 미세 팁 집게를 사용하여 그림 1A, B와 같이 해부 현미경으로 당겨진 모세관의 뾰족한 끝을 잘라내어 개구부를 만듭니다. 개구부가 너무 크지 않은지 확인하십시오., 이것은 난관을 손상시키고 느린 주입을 방해합니다.
그림 1: 미세주입 바늘 준비 . (A,B) 끝이 뾰족한 모세관(A)을 당겨 구멍을 뚫고 (B)를 만듭니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 복강 주사를 위한 마취제 준비
- 수술 당일 여과되고 희석 된 아베르틴을 준비하십시오. Avertin (2,2,2-tribromoethanol) 원액은 격렬한 교반에 의해 tert-amyl 알코올에 1.6g / mL의 농도로 제조되고 암실에 보관됩니다.
- 아베르틴 원액을 1.25% v/v 등장 식염수로 흄 후드 내부의 최종 농도 20mg/mL로 희석합니다. 희석된 아베르틴을 와동시키고 0.22μm 멸균 필터를 통해 여과합니다. 어둠 속에 보관하십시오.
3. 수술 부위 준비
- 수술 부위는 전용 멸균 환경이어야 하며, 가급적이면 깨끗한 벤치 또는 생물 안전 캐비닛이어야 합니다. 필요에 따라 멸균 수술 장비, 현미경, 미세 조작기 및 전기 처리기를 배치합니다. 이에 대한 예가 그림 2에 나와 있습니다.
- 가열 패드/디스크를 가열하고 깨끗하고 완비된 케이지 아래에 놓습니다. 이 케이지는 수술 후 생쥐를 수용하는 데 사용됩니다.
- 멸균 1x 인산염 완충 식염수(PBS)를 멸균 페트리 접시에 붓습니다. 깨끗한 가위를 사용하여 흡수성 종이를 대략 1cm x 1cm 크기의 정사각형으로 자릅니다. 이 흡수성 종이 조각을 1x PBS에 떨어뜨려 담그십시오.
4. 주사용 용액 및 바늘 준비
- 수술 당일 주사액을 준비하십시오. DNA/RNA/RNP를 여과된 트리판 블루와 각각 최소 최종 농도 200ng/μL 및 5%로 혼합합니다. 주입하기 전에 실온에서 보관하십시오.
알림: 사용하기 전에 1mL 주사기를 사용하여 100% 트리판 블루를 흡수하고 0.22μm 멸균 필터를 통해 걸러냅니다. - 당겨진 모세관 바늘(이하 미세주입 바늘이라고 함)을 클램프 마그네틱 마운트로 안정화된 마운트 미세 매니퓰레이터에 부착합니다( 그림 2B에 표시된 설정).
- 주입 용액 2 μL를 멸균 페트리 접시에 피펫팅합니다. 현미경으로 관찰하면서 미세 조작기에 부착된 공기 압력 주사기를 사용하여 이 용액 1-2μL를 미세 주입 바늘에 천천히 흡수합니다. 기포를 피하거나 미세 주입 바늘에 기포를 흡수하십시오.

그림 2: 수술 부위 준비. (A) 클린 벤치 내부에 수술 부위를 설정합니다. (B) 오른손잡이를 위한 해부 현미경 및 미세 조작기 설정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 여성 생식 기관 노출
- 여과되고 희석된 아베르틴(마취제)을 0.25-0.5 mg/g의 용량으로 복강 내 투여하여 6-8주 된 암컷 마우스를 마취합니다. 그 후, 카르프로펜(선제적 진통제)을 5mg/kg의 용량으로 피하 투여한다.
참고: 마취제로 사용할 수 있는 다른 대안으로는 이소플루란 또는 케타민/자일라진이 있습니다. - 깨끗하고 가열된 패드/디스크에 흡수성 종이를 놓습니다. 그런 다음 마취된 마우스를 이 가열된 흡수성 종이 위에 등쪽이 위를 향하도록 놓습니다. 수술 중 건조를 방지하기 위해 각 눈에 눈 윤활제를 바르십시오.
알림: 손등으로 테스트하여 가열 패드/디스크를 만졌을 때 약간 따뜻한지 확인합니다. - 한 쌍의 집게로 마취된 마우스의 발가락을 꼬집어 심부 마취 정지를 테스트합니다. 장래 절개 부위 주변의 등털을 제거하고( 그림 3A에 표시된 위치) 맨살을 방부제로 닦습니다.
- 한 쌍의 직선 무딘 집게를 사용하여 맨살을 꼬집고 멸균 된 날카로운 무딘 가위를 사용하여 신체 정중선을 따라 1cm 길이의 절개를 만듭니다. 방부제로 절개 부위를 청소하십시오.
- 한 쌍의 멸균 Adson 집게를 사용하여 절단 부위의 한쪽을 꼬집고 잡습니다. 그런 다음 한 쌍의 멸균 곡선 톱니 모양의 집게를 사용하여 정중선 절개에서 시작하여 측면으로 움직여 체벽에서 피부를 부드럽게 분리합니다.
- 신장 아래의 지방 패드를 찾습니다. 한 쌍의 멸균 직선 무딘 집게를 사용하여 지방 패드 바로 위의 신체 벽을 꼬집습니다. 혈관을 피하도록주의하면서 멸균 된 날카로운 해부 가위를 사용하여 체벽에 작은 절개를 만듭니다.
- 똑 바른 뭉툭한 집게로 체벽을 꼬집으면서 한 쌍의 멸균 무딘 곡선 집게를 절개 부위에 삽입하고 체벽에 생성 된 절개를 넓힌다.
- 뭉툭한 구부러진 집게로 보이는 지방 패드를 잡고 구멍에서 당겨 난소, 난관 및 자궁을 노출시킵니다.
- 생식 기관을 노출된 상태로 유지하려면 그림 3B와 같이 멸균 불독 클램프로 지방 패드를 고정하십시오.
6. 생체 내 난관 주입 및 전기천공
- 가열된 흡수지와 마취된 마우스를 생식관이 노출된 상태로 조심스럽게 놓습니다.tage 해부 현미경, 관을 관찰할 수 있도록 합니다. 현미경으로 관찰한 보기의 예가 도 3B에 나와 있습니다.
- 용액이 있는 주사 바늘도 현미경으로 관찰할 수 있도록 미세 조작기를 조정합니다.
- 한 쌍의 멸균 테이퍼 형 초 미세 팁 집게를 사용하여 주입 할 난관 부위를 일정하게 유지합니다. 주입할 부위는 미세주입 바늘의 방향과 일치해야 합니다.
알림: 불독 cl 사용amp 지방 패드와 생식 기관을 고정하여 필요한 경우 해당 기관을 최적의 위치로 부드럽게 돌리거나 이동합니다. - 미세 매니퓰레이터를 조정하여 미세 주입 바늘로 난관을 뚫는 동시에 테이퍼 형 초 미세 팁 집게를 사용하여 난관을 바늘에 공급합니다. 미세 주입 바늘을 부드럽게 움직여 난관에 삽입되었는지 확인합니다.
알림: 미세 주입 바늘을 코일 난관의 전환점이 아닌 직선 세그먼트에 삽입하여 주사액의 다중 구멍 및 누출을 방지합니다. - 현미경으로 파란색 용액의 움직임과 난관 내강의 확장을 관찰하면서 최대 1μL의 용액을 난관에 천천히 주입합니다. 루멘에 기포가 들어가지 않도록 주의하십시오. 100% 트리판 블루가 주입된 난관의 대표 이미지는 그림 3C, D에 나와 있습니다.
- 난관에서 바늘을 제거하십시오. 멸균된 1x PBS에 미리 담근 흡수성 종이로 표적 부위를 덮습니다(3.3단계부터).
- 한 쌍의 전극 핀셋(대상 영역의 크기에 따라 1mm, 3mm 또는 5mm)으로 미리 담근 종이와 대상으로 할 영역/영역을 잡고 펄스 발생기/전기천공기에서 다음 설정을 사용하여 전기천공하기 전에 신체에서 당겨집니다. 30V, 3펄스, 1초 간격, 50ms 펄스 길이, 단극.
알림: 전극 사이의 거리는 전극이 cl 수 있도록 설정되어야 합니다.amp난관을 변형시키지 않고 대상 영역에 고정됩니다. 권장 거리는 약 1mm입니다. - 전기천공 후 흡수지를 제거하고 마우스(가열된 흡수지가 아래에 있음)를 열 패드에 다시 놓습니다. 불독 클램프를 풀고 노출된 생식 기관을 체벽 아래로 조심스럽게 밀어 넣습니다. 섹션 5를 반복하여 반대쪽의 생식 기관을 노출시킵니다.
알림: Electroporation은 마우스 발정에 관계없이 성공적입니다.tage 내강이 용액으로 채워져 있는 한. - 노출된 관로를 멸균된 1x PBS에 미리 담근 흡수지로 덮어 건조를 방지한 다음 4.2단계와 4.3단계를 반복하여 두 번째 주입을 위한 미세 주입 바늘을 준비합니다.
알림: 필요에 따라 미세 주입 바늘을 교체하십시오. 필요한 경우 멸균된 1x PBS를 적용하여 노출된 조직의 건조를 방지합니다. - 위의 단계를 반복하여 반대쪽에 난관을 주입하고 전기를 주입합니다.
알림: 수술 중과 수술 후에 필요에 따라 눈 윤활제를 다시 바르십시오. - 두 난관을 모두 전기천공하여 체벽 아래에 다시 놓은 후 등쪽 절개 부위를 봉합하거나 스테이플링합니다. 봉합을 위해 지혈제를 사용하여 실크 꼰 봉합사의 바늘을 잡습니다 (3/8 원, 게이지 : 5-0, 바늘 크기 : 18mm, 실 길이 : 75cm). 한 쌍의 멸균 곡선 톱니 모양의 집게를 사용하여 절단 부위의 한쪽을 꼬집고 누른 다음 지혈제를 사용하여 봉합사를 조작하여 상처를 봉합합니다.
- 가열된 패드/디스크 위에 놓인 깨끗한 케이지로 마우스를 옮기고(3.2단계부터) 마우스가 활성화될 때까지 모니터링합니다.
- 다음 3일 동안 24시간마다 5mg/kg 카르프로펜을 피하 투여하고 다음 10일 동안 모니터링합니다.
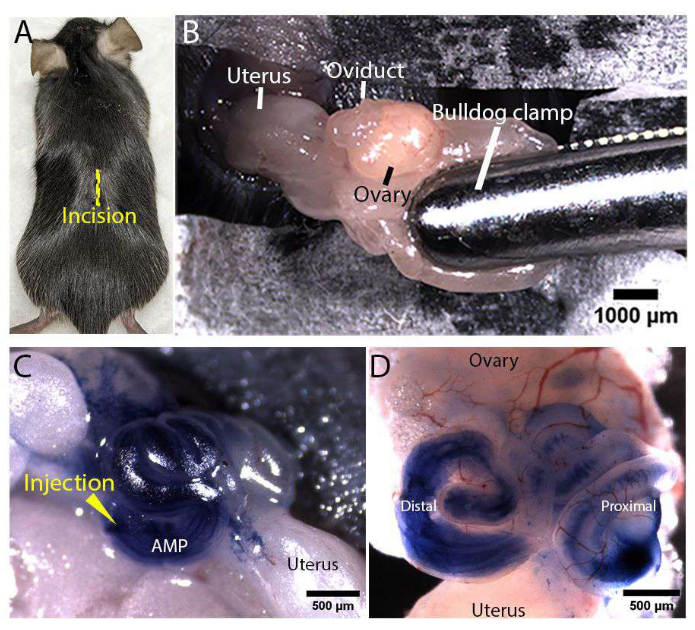
그림 3: 여성 생식 기관 노출 및 미세 주입. (A) Rosa-LSLtdTomato 마우스의 등쪽에 있는 정중선 절개 위치(노란색 선으로 표시됨). (B) 여성 생식 기관 노출. 지방 패드는 멸균 불독 클램프를 사용하여 고정되어 관로를 고정하고 노출된 상태로 유지했습니다. (씨, 디) 생체 내 난관 주사의 대표 이미지. 미세 주사 바늘을 원위 팽대부(AMP로 표시됨)에 삽입하고 관이 노출된 상태에서 여과된 100% 트리판 블루를 난관 내강에 주입했습니다(C). 주입된 트리판 블루 용액이 원위 및 근위 난관 내강(D) 전체에 분포함을 보여주는 절개된 난관의 대표 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
도 1 및 도 2는 각각 마우스 난관의 생체 내 미세주입 및 전기천공을 위한 미세주입 바늘 준비 및 수술 영역 설정을 나타낸 것이다. 수술 중 마취된 Rosa-LSLtdTomato(Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J)17 마우스의 등쪽 피부(그림 3A)와 체벽을 절개하여 여성 생식관을 노출시켰습니다. 불독 클램프는 관 위의 지방 패드에 고정되어 노출되고 고정된 상태를 유지했습니다(그림 3B). 400ng/μL 농도의 PCS2 CreNLS 플라스미드18을 포함하는 주사 용액을 코일형 난관의 팽대부(AMP로 표시됨)에 주입하고 난관 내강 전체에 분산되도록 했습니다(그림 3C,D). 이 원고에서 대표적인 결과를 생성하기 위해 PCS2 CreNLS 플라스미드를 사용했지만, 설명된 방법은 마우스 난관에서 CRISPR/Cas-매개 유전자 편집을 위해 주입 용액에서 쉽게 상호 교환 가능한 DNA/RNA/RNP와 함께 사용할 수 있습니다. 그런 다음 1mm 또는 3mm 핀셋 유형 전극을 배치하여 원위 난관이 전기 천공 기반 전달을 위해 전극 사이에 있도록 했습니다.
수술 후 4일 후에 난관을 채취하고 전기천공 특이성을 시각화하기 위해 중생핀크스를 제거하여 스트레칭했습니다. 1mm 또는 3mm 핀셋 유형 전극을 사용하여 TdTomato로 표시된 표적 영역을 원위 난관 상피로 제한했습니다(그림 4A,D). 이 표적 영역의 크기는 다양한 크기의 전극을 사용하여 추가로 제어되었습니다. 3mm 핀셋 유형 전극을 사용하여 AMP의 훨씬 더 넓은 영역을 대상으로 했습니다(그림 4B, C), 1mm 핀셋 유형 전극을 사용하여 가장 말단의 끝인 INF(그림 4E,F)만 대상으로 하는 것과 비교됩니다. 이렇게 수확된 난관을 고정하고 자당 구배로 처리하고 자세한 분석을 위해 저온 유지 장치를 사용하여 절개했습니다. 절편을 Hoescht 33342 및 Phalloidin으로 대조 염색하여 핵과 세포 골격을 각각 염색한 다음 포인트 주사 컨포칼 현미경을 사용하여 이미지화했습니다. 표적 영역에서 TdTomato로 표시된 전기천공된 세포는 전기천공되지 않은(TdTomato-ve) 세포 사이에 무작위로 분포되었습니다(그림 4G). 또한, 전기천공된 세포는 점막 상피에 국한되어 있으며 밑에 있는 기질 또는 근육층에서는 발견되지 않았습니다(그림 4G,H). 마지막으로, CRISPR-Cas-mediated 유전자 편집을 확인하기 위해, DNA 분리 및 MiSeq 염기서열 분석을 위한 형광 활성화 세포 분류(Fluorescence-activated cell sorting, FACS)를 통해 TdTomato+ve 세포를 분리할 수 있다12.
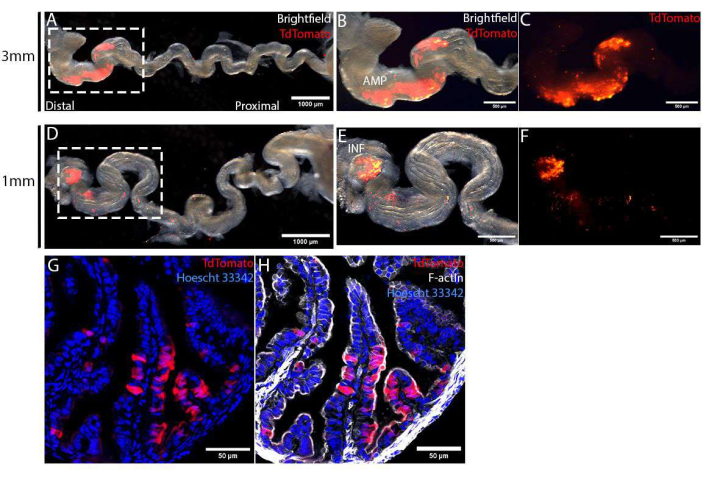
그림 4: 수술 후 4일 후 난관 상피 세포의 성공적인 생체 내 주입 및 전기천공의 검증. (A-C) 3mm 크기의 핀셋 타입 전극을 사용한 전기천공법. 전기천공 특이성(A)의 더 나은 시각화를 위해 중생핀크스를 제거하여 난관을 풀었습니다. TdTomato 발현으로 식별되는 전기천공 영역은 AMP(B,C)로 표시된 원위 난관으로 제한되었습니다. (D-F) 1mm 크기의 핀셋 타입 전극을 사용한 전기 천공. electroporation 특이성(D)의 더 나은 시각화를 위해 mesosalpinx를 제거하여 난관을 풀었습니다. 전기천공 영역은 난관(E,F)의 가장 말단부인 infundibulum(INF로 표시됨)으로 제한되었습니다. (지, H) PCS2 CreNLS 플라스미드로 전기천공한 후 4일 동안 원위 난관의 횡단면. TdTomato(G)로 표지된 전기천공된 세포는 상피 단층(H)으로 제한되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 세부 프로토콜의 중요한 단계는 DNA/RNA/RNP 용액을 난관 내강에 미세주입하고 전기천공 강도 및 면적을 제어하는 것입니다. 미세주입 중 DNA/RNA/RNP 용액 누출은 원하지 않는 영역/세포의 형질감염을 유발할 수 있습니다. 일관되고 효율적인 전기 천공을 위해 난관 내강을 용액으로 채우는 것이 바람직합니다(그림 3C,D). 이는 전기천공 영역이 주로 전극 크기와 배치에 의해 제어되기 때문입니다. 약한 전기천공은 전기천공된 세포의 수를 감소시키고, 거친 전기천공은 원하지 않는 세포의 전기천공을 유발하거나 조직 구조를 파괴할 수 있습니다. 전기천공된 세포의 수는 DNA/RNA/RNP 용액 농도 또는 전기천공 파라미터를 조정하여 변경할 수 있습니다. 그러나 전기천공 중 고전압/열 생성은 조직을 손상시킬 수 있으므로 이러한 매개변수는 살아있는/마취된 마우스에 사용하기 전에 테스트해야 합니다. 마지막으로, 이 절차의 까다로운 특성으로 인해 살아있는/마취된 마우스에서 이 수술을 수행하기 전에 죽은 마우스에 대한 관 노출 및 미세 주입을 연습하는 것이 좋습니다.
여러 유전자가 암 개시에 관여하는 것으로 인식되므로, 이 사건을 요약하려면 여러 유전자의 다중 대립유전자 변형이 필요합니다. 또한, 모든 세포가 발암성 돌연변이에 똑같이 취약한 것은 아니라는 것도 알려져 있다9. 따라서 암 모델링은 발암성 모욕을 엄격하게 제어하기 위해 특정 Cre 마우스 라인이 필요합니다. 그러나 이들의 가용성과 특이성은 비표적 조직에서의 영향 및 치사율을 포함하여 다양한 문제를 야기한다19. 또한 기존 G-GEMM은 유지 관리 비용이 많이 들고 마우스 라인 생성에 시간이 필요합니다. CRISPR/Cas9 게놈 편집 기술의 개발과 특정 체세포로의 유전자 전달 개선으로 이러한 문제를 극복할 수 있었습니다. 이 프로토콜에서 우리는 특정 마우스 라인12에 대한 절대적인 필요 없이 암 모델링에 사용할 수 있는 체세포 게놈 조작을 위한 DNA/RNA/RNP 전달 방법을 제시합니다. DNA/RNA/RNP 용액을 내강에 주입하고 전기천공 기반 전달을 위해 다양한 크기의 핀셋 유형 전극을 사용하여 마우스 난관 점막 상피의 제한된 영역을 표적으로 합니다(그림 4A-F). 이것은 나팔관의 말단부에서 유래하는 HGSC의 개시를 모델링하는 데 특히 유용합니다.
제시된 미세주입 및 생체 내 전기천공 방법은 루멘이 있는 조직/기관을 표적으로 삼는 데 매우 다재다능합니다. 장기 실질(organ parenchyma)도 이 방법을 사용하여 표적화할 수 있다14. 렌티바이러스 및 아데노바이러스 시스템과 같은 바이러스 전달 접근법도 유사한 목적으로 사용될 수 있습니다. 그러나, 바이러스 전달 접근법에 비해 전기천공법의 장점은 1) 단일 세포로의 다중 플라스미드 전달, 2) 삽입 크기15에 대한 제한 없음, 3) 전달 영역 및 타이밍의 쉬운 제어입니다. 또한, 표적화 특이성은 계통 특이적 프로모터를 사용함으로써 개선될 수 있다. 이것은 바이러스 포장의 한계로 인해 바이러스 시스템에서 때때로 어렵습니다.
전기천공법의 특성과 마찬가지로, 전기천공된 상피 세포는 편집되지 않은 건강한 세포와 무작위로 산재되어 있습니다(그림 4G). 그러나 유전자 변형 및 변형되지 않은 세포에서의 이러한 모자이크주의는 면역 적격 미세 환경 내에서 초기 암 개시의 산발적 특성을 요약하기 때문에 암 개시를 연구하는 데 유리할 수 있습니다. 전기천공된 세포의 주파수는 DNA/RNA/RNP 용액 농도 및/또는 전기천공 파라미터를 변화시켜 조정할 수 있습니다. 제시된 프로토콜과 함께 CRISPR-Cas-매개 유전자 편집을 사용하면 여러 유전자를 쉽게 스크리닝하고 표적 유전자에서 이질적인 돌연변이/대립유전자 조합 패턴을 생성할 수 있습니다. 이것은 HGSC20,21과 같이 상당한 수의 게놈 변형이 나타나는 암을 모델링하는 데 특히 유용합니다. 또한, 암 진행 동안 표적 유전자를 시퀀싱함으로써, 면역적격 마우스에서 종양 및 전이의 생체내 클론 진화를 추적할 수 있다12.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 대표적인 결과와 프로토콜 최적화를 생성하는 데 사용되는 플라스미드를 제공한 Katie Teng과 Matthew J. Ford 박사에게 감사를 표합니다. K.H.는 Fonds de recherche du Québec - Santé (FRQS) 박사 학위, Donnor Foundation, Delta Kappa Gamma World Fellowship, CRRD (Center for Research in Reproduction and Development), Hugh E. Burke, Rolande & Marcel Gosselin 및 Alexander McFee 대학원생의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter unit | LifeGene | SF0.22PES | |
| 1 mL syringe | Terumo Medical Corportation | SS-01T | |
| 1 mm tweezer-type electrodes | BEX CO., LTD | LF650P1 | |
| 3 mm tweezer-type electrodes | BEX CO., LTD | LF650P3 | |
| 30G x 1/2 Needle | BD | 305106 | Needle is attached to the 1 mL syringe when using injectable anesthetic or analgesic. |
| Adson forceps | Fisher Scientific | 10-000-451 | |
| Air-pressured syringe | BD | B302995 | Attached to the micromanipulator; as shown in Figure 2B |
| Analgesic | - | - | Carprofen, dose: 5mg/kg. |
| Antiseptic | Cardinal Health | OMEL0000017 | Baxedin: 2% chlorhexidine in 70% isopropyl alcohol |
| Avertin (2,2,2-tribromoethanol) - Anesthetic | Sigma Aldrich | T48402-25G | |
| Clamp mount micromanipulator | AD Instruments | MM-33 | |
| Curved serrated forceps | Fisher Scientific | NC0696845 | |
| Dissecting microscope | Zeiss | SteREO Discovery.V8 | Apochromat S, 0.63X, FWD 107mm. Attached KL 200 LED for top light, labelled as light source in Figure 2B. |
| Eye lubricant | Alcon | - | Systane ointment (Lubricant eye ointment) |
| Glass capillary needles | Sutter Instrument Co. | B100–50-10 | Outside diameter: 1 mm, inside diameter: 0.5 mm, length: 10 cm |
| Hartman hemostats | Fisher Scientific | 50-822-711 | |
| Heating pad/disc | - | - | SnuggleSafe Pet Bed Microwave Heating Pad was used in this protocol. Microwave for 2-5min, and test with back of gloved hand. |
| Magnetic Mount for micromanipulator | AD Instruments | MB-B | Used to keep the clamp mount micromanipulator stable and upright during injection. |
| Micro bulldog clamp | Fisher Scientific | 50-822-230 | 3 cm |
| Micropipette puller | Sutter Instrument Co. | P-97 | P-97 Flaming/Brown type micropipette puller. Program used: P = 500, Heat = 576, PULL = 50, VEL = 80, DEL = 70 |
| Petri dish | Fisher Scientific | 263991 | Autoclaved/sterile glass petridishes can also be used. |
| Phosphate Buffered Saline (PBS) | Bio Basic Inc. | PD8117 | 10X PBS was diluted to 1X with DI water. Autoclave before use. |
| Pulse generator/Electroporator | BEX CO., LTD | CUY21 EDIT II | Electroporation settings: 30 V, 3 pulses, 1 s interval, P. length = 50 ms, unipolar |
| Rosa-LSLtdTomato mice | The Jackson Laboratory | 7914 | Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J |
| Sharp-blunt dissection scissors | Fisher Scientific | 28251 | |
| Sharp-pointed dissecting scissors | Fisher Scientific | SDI130 | |
| Shaver | - | - | Hair removal cream can also be used. |
| Silk braided sutures | Ethicon | 682G | 3/8 circle, gauge: 5-0, needle size: 18 mm, thread length: 75 cm. Staples can also be used. |
| Tapered ultrafine tip forceps | Fisher Scientific | 12-000-122 | |
| Thin absorbent paper | Kimberly-Clark Professional | 34120 | Kimwipes |
| Trypan blue | STEMCELL Technologies | 7050 | Filtered using 0.22 µm sterile filter before use for microinjection. |
참고문헌
- Avilés, M., Coy, P., Rizos, D. The oviduct: A key organ for the success of early reproductive events. Animal Frontiers. 5 (1), 25-31 (2015).
- Li, S., Winuthayanon, W. Oviduct: roles in fertilization and early embryo development. The Journal of Endocrinology. 232 (1), R1-R26 (2017).
- Briceag, I., et al. Fallopian tubes--literature review of anatomy and etiology in female infertility. Journal of Medicine and Life. 8 (2), 129-131 (2015).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Labidi-Galy, S. I., et al. High grade serous ovarian carcinomas originate in the fallopian tube. Nature Communications. 8 (1), 1093 (2017).
- Shaw, P. A., Rouzbahman, M., Pizer, E. S., Pintilie, M., Begley, H. Candidate serous cancer precursors in fallopian tube epithelium of BRCA1/2 mutation carriers. Modern Pathology. 22 (9), 1133-1138 (2009).
- Soong, T. R., et al. Evidence for lineage continuity between early serous proliferations (ESPs) in the Fallopian tube and disseminated high-grade serous carcinomas. The Journal of Pathology. 246 (3), 344-351 (2018).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. The Journal of Pathology. 211 (1), 26-35 (2007).
- Puisieux, A., Pommier, R. M., Morel, A. P., Lavial, F. Cellular pliancy and the multistep process of tumorigenesis. Cancer Cell. 33 (2), 164-172 (2018).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677 (2021).
- Teng, K., et al. Modeling high-grade serous ovarian carcinoma using a combination of in vivo fallopian tube electroporation and CRISPR-Cas9-mediated genome editing. Cancer Research. 81 (20), 5147-5160 (2021).
- Ford, M. J., Yamanaka, Y. Reprogramming mouse oviduct epithelial cells using in vivo electroporation and CRISPR/Cas9-mediated genetic manipulation. Methods in Molecular Biology. 2429, 367-377 (2022).
- Maresch, R., et al. Multiplexed pancreatic genome engineering and cancer induction by transfection-based CRISPR/Cas9 delivery in mice. Nature Communications. 7, 10770 (2016).
- Braun, C. J., Adames, A. C., Saur, D., Rad, R. Tutorial: design and execution of CRISPR in vivo screens. Nature Protocols. 17 (9), 1903-1925 (2022).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Chazaud, C., Yamanaka, Y., Pawson, T., Rossant, J. Early lineage segregation between epiblast and primitive endoderm in mouse blastocysts through the Grb2-MAPK pathway. Developmental Cell. 10 (5), 615-624 (2006).
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature Reviews. Cancer. 10 (7), 470-480 (2010).
- Kroeger Jr, P. T., Drapkin, R. Pathogenesis and heterogeneity of ovarian cancer. Current Opinion in Obstetrics & Gynecology. 29 (1), 26-34 (2017).
- Cancer Genome Atlas Research Network. Integrated genomic analyses of ovarian carcinoma. Nature. 474 (7353), 609-615 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유