Method Article
تجديد قشور الزرد في ثقافة المقاييس توتو وخارج الجسم الحي
In This Article
Summary
يصف هذا البروتوكول حصاد وتصور قشور الزرد أثناء التجديد في الجسم الحي . بالإضافة إلى ذلك ، يتم تقديم ثقافة خارج الجسم الحي لهذه المقاييس لمدة تصل إلى 7 أيام بعد الحصاد.
Abstract
غالبا ما تكون أمراض الهيكل العظمي معقدة في مسبباتها وتؤثر على ملايين الأشخاص في جميع أنحاء العالم. بسبب شيخوخة السكان ، هناك حاجة إلى علاجات جديدة يمكن أن تخفف العبء على أنظمة الرعاية الصحية. نظرا لأن هذه الأمراض معقدة ، فمن الصعب والمكلف نمذجة الفيزيولوجيا المرضية للعظام بدقة في بيئة معملية. يتمثل التحدي الذي يواجه هذا المجال في إنشاء منصة فعالة من حيث التكلفة وذات صلة بيولوجية لنمذجة أمراض العظام التي يمكن استخدامها لاختبار المركبات العلاجية المحتملة. يجب أن تسمح هذه المنصة بشكل مثالي بالتصور الديناميكي لسلوكيات الخلايا لبانيات العظم التي تبني العظام والخلايا الآكلة للعظام التي تعمل في بيئة المصفوفة المعدنية. يتم استخدام أسماك الزرد بشكل متزايد كنماذج بسبب توفر الأدوات الوراثية ، بما في ذلك خطوط المراسل المعدلة وراثيا ، وحقيقة أن بعض الأنسجة الهيكلية (بما في ذلك القشور) تظل شفافة حتى مرحلة البلوغ ، مما يسمح بخيارات التصوير الديناميكية. نظرا لأن قشور الزرد تحتوي على بانيات عظمية وناقضات عظمية وفيرة للغاية ، فإنها توفر موردا يسهل الوصول إليه ومتاحا بكثرة لوحدات العظام المستقلة. علاوة على ذلك ، بمجرد إزالتها ، تتجدد قشور الزرد البالغة بالكامل ، مما يوفر طريقة لدراسة النمو الزماني المكاني للأنسجة المعدنية في الجسم الحي. هنا ، نقوم بتفصيل بروتوكولات الحصاد وتتبع تجديد المقاييس. أخيرا ، يتم أيضا تقديم بروتوكول للاستزراع المستقر للحراشف خارج الجسم الحي لمدة أسبوع وبعد استجابة الشفاء بعد التلف المتحكم فيه للمصفوفة المعدنية للمقياس بمرور الوقت.
Introduction
العظام هي نسيج ضام صلب يشكل جزءا رئيسيا من الهيكل العظمي ، مما يتيح الحركة ويعمل كاحتياطي معدني في الجسم. من أجل الحفاظ على صحة العظام ، يعد التوازن الرائع بين تكوين العظام وتدهورها أمرا ضروريا من خلال النشاط المزدوج لبانيات العظم (التي هي الابتنائية) والخلايا الآكلة للعظم (التي تمتص العظام). يتعطل هذا التوازن بسبب الشيخوخة أو عدم التوازن الهرموني ، مما يؤدي غالبا إلى أمراض هشاشة العظام مثل هشاشة العظام1. على الرغم من الموافقة على الأدوية الموجودة لاستهداف أمراض هشاشة العظام ، إلا أن العديد منها له آثار جانبية. لذلك ، هناك حاجة إلى علاجات جديدة1. وبالتالي ، لا تزال هناك حاجة إلى مصادر وفيرة من الأنسجة العظمية ذات الصلة بيولوجيا والتي يمكن استخدامها لاختبار المركبات العلاجية المحتملة.
تقليديا ، تم استخدام نماذج القوارض وأنظمة زراعة الخلايا لدراسة بيولوجيا العظام. ومع ذلك ، أصبحت أسماك الزرد بشكل متزايد نموذجا آخر للاختيار. على الرغم من أنه ليس نظاما للثدييات ، إلا أن الزرد يوفر مزايا معينة لأبحاث العظام على القوارض. وتشمل هذه خصوبتها وشفافية اليرقات. حتى في مرحلة البلوغ ، تظل بعض الأنسجة الهيكلية ، بما في ذلك المقاييس والزعانف ، شفافة ، مما يسمح بالتصوير عالي الدقة في الجسم الحي وزيادة توافر طفرات الهيكل العظمي 2,3. كل من زعانف وقشور الزرد قادرة على التجديد الكامل بعد الإزالة. تمت دراسة تجديد الهيكل العظمي وإصلاح الإصابات لزعانف الزرد على نطاق واسع 4,5 ، في حين أن قشور الزرد هي نموذج عظمي أحدث في الحقل ولكنها توفر مزايا للاستزراع خارج الجسم الحي 6.
القشور وفيرة للغاية ، مع ما لا يقل عن 300 مقياس على كل سمكة تعمل كغطاء واقي للأسماك. كل مقياس عبارة عن صفيحة معدنية صغيرة تتكون من بانيات عظمية مكونة للعظام وناقضات عظمية ممتصة للعظام لمصفوفة هيكلية غنية بالكولاجين7. تتطلب عملية التعظم لكل من قشور الزرد والعظام البشرية تمايز الخلايا الجذعية الوسيطة إلى بانيات عظمية لتشكيل المصفوفة المعدنية. توفر قشور الزرد ميزة كبيرة لأبحاث الهيكل العظمي بقدرتها التجديدية القوية التي يمكن استخدامها لدراسة تجديد العظام وإصلاحها. ومع ذلك ، على الرغم من وجود كل من بانيات العظم والخلايا الآكلة للعظم ، تفتقر قشور الزرد إلى الخلايا العظمية المهمة لإعادة تشكيل العظام البشرية والإحساس الميكانيكي. يعني الموقع السطحي للموازين أنه يمكن إزالتها بسهولة باستخدام زوج من الملقط. عند إزالة المقياس ، تحدث سلسلة من الأحداث ، ويبدأ تجديد المقياس 8,9. هناك العديد من خيارات التلوين والتصوير المتاحة لتصور نشاط بانيات العظم والخلايا الآكلة للعظم وتمعدن الحراشف، كما هو موضح في الشكل 1. بالإضافة إلى ذلك ، فإن توفر العديد من خطوط المراسل الفلورية المعدلة وراثيا ذات الصلة من الزرد يعني أنه يمكن للمرء تصور ديناميكيات الخلية أثناء التجديد7،10،11. تسمح هذه العملية للمرء باكتساب المزيد من الفهم لتكوين عظام دي نوفو من خلال مراقبة الأنماط المبكرة لتجديد القشور على جانب السمكة لدراسة التشكل والنشاط الخلوي والملامح الجينية لهذه المقاييس المجددة. تم تمييز بيولوجيا تكوين المقياس وتجديده بشكل جيد. الأهم من ذلك ، يمكن أن تظهر المقاييس قدرة تنبؤية جيدة للمركبات ذات الصلة علاجيا12 ويؤدي علاج الأسماك بالجلوكوكورتيكويد إلى مقياس يتجدد لإظهار الأنماط الظاهرية لهشاشة العظام13. يظهر نسخ المقاييس المتجددة أن الجينات التي يتم تنشيطها في تجديد النطاق يتم إثراؤها لتلك المرتبطة بأمراض الهيكل العظمي البشري ، مما يدل على أهميتها كنظام نموذجي 6,14.
أخيرا ، يمكن استزراع هذه المقاييس خارج الجسم الحي لمدة تصل إلى 7 أيام. بالمقارنة مع مزارع خط الخلية التي تتكون عادة من نوع خلية واحدة ، توفر ثقافة خارج الجسم الحي فرصا لدراسة العظام في المختبر داخل بيئتها الطبيعية التي تحتوي على كل من بانيات العظم والخلايا الآكلة للعظم مع مصفوفتها الطبيعية خارج الخلية8،12،15،16.
تسمح لنا ثقافة المقياس أيضا بإجراء فحص المخدرات لأهداف ابتنائية عظمية جديدة. تعني وفرة القشور على الأسماك أنه يمكن للمرء أن يملأ لوحين على الأقل من الصفيحة المكونة من 96 بئرا من سمكة واحدة فقط ، مما يسمح بالغربلة المركبة في شكل متعدد الآبار حيث يحتوي كل بئر على مقياس واحد جنبا إلى جنب مع مكانته الطبيعية للخلايا. بالإضافة إلى ذلك ، نظرا لأن المقاييس رقيقة ، يمكن التنبؤ بامتصاص الدواء12. باختصار ، تتمتع قشور الزرد elasmoid بإمكانات كبيرة في أبحاث الهيكل العظمي ويمكن أن تساعدنا في اكتساب المزيد من التبصر في الأحداث الخلوية أثناء تكوين العظام وإصلاحها. هنا ، نصف بروتوكولات حصاد المقاييس لمتابعة التجديد في الجسم الحي وزراعة المقاييس خارج الجسم الحي.
Protocol
الوحدة العلمية الحيوانية بالجامعة (ASU) هي المسؤولة عن رعاية أسماك الزرد بتوجيه من إرشادات تربية أسماك الزرد. تمت الموافقة على جميع الإجراءات ، بما في ذلك الحصاد على نطاق واسع ، وتلطيخ العظام الحية ، والتصوير الحي ، وتنفيذها بموجب ترخيص مشروع وزارة الداخلية في المملكة المتحدة (PP4700996). بالنسبة لهذه المخطوطة ، تم استخدام الزرد المعدل وراثيا للشباب من خط sp7: mCherry [Tg (osterix: mCherry-NTR) pd46]17. وشملت الأسماك كلا من الذكور والإناث من عمر 4 أشهر.
1. تجديد مقياس في الجسم الحي
- قبل البدء في تجربة تجديد المقياس ، انقل أسماك الزرد من خزاناتها الرئيسية إلى خزانات فردية (انظر جدول المواد) وارجع إلى هذه الخزانات الفردية بعد التصوير طوال التجربة ، كما هو موضح في الشكل 2. هذا للتأكد من أن جميع موازين التجديد هي تلك التي يتم حصادها للتجربة ؛ يمكن أن يؤدي السكن الجماعي إلى فقدان متقطع للقشور بسبب الإصابات التي تسببها الأسماك الأخرى.
ملاحظة: يتم وضع الأسماك بشكل فردي لتجنب القتال وفقدان القشور اللاحقة بين الأسماك. - سجل المعلومات لكل سمكة تجربة (أي النمط الجيني والعمر والجنس) وفقا لتصميم التجربة. استخدم كاميرا (تعمل كاميرات الهواتف الذكية بشكل جيد) لالتقاط صورة لكل سمكة بجوار المسطرة لتسجيل حجم / طول السمكة وحالتها الصحية.
- في يوم التجربة ، قم بتخدير الزرد باستخدام 0.05٪ (v / v) سلفونات الميثان tricaine (MS222 ، انظر جدول المواد) عن طريق الغمر ، ثم ضعه على طبق بتري بمنديل رطب لتجنب حركة الأسماك أثناء التصوير أو الحصاد.
- ضع السمكة على جانبها (عادة ما يتم استخدام الجناح الأيسر هنا من أجل الاتساق). إجراء تصوير الجناح باستخدام مجهر مجسم مع تكبير مناسب (عادة ، تم استخدام 2x و 4x و / أو 6.3x و 8x للدراسة الحالية لالتقاط كل من منطقة التجديد الإجمالية ومنطقة التكبير للمراقبة التفصيلية).
ملاحظة: تعتمد النقاط الزمنية لتصوير الجناح على الغرض التجريبي واختيار المراسلين المحورين وراثيا. على سبيل المثال ، لتتبع بانيات العظم أثناء تجديد المقياس ، فإن النقاط الزمنية المقترحة هي اليوم 0 (وراثي) ، يومين بعد الحصاد (dph) ، 4 dph ، 7 dph ، 10 dph ، 14 dph ، 21 dph. لتقليل الآثار الناتجة عن التخدير المتكرر ، حافظ على النقاط الزمنية للتصوير إلى أقل عدد مطلوب للتجربة. - موازين الحصاد باستخدام ملاقط دقيقة وملقط تحت المجهر المجسم. انقل المقاييس المحصودة إلى أنابيب تجميع لتلطيخ القشور لاحقا.
ملاحظة: يعتمد الحد الأقصى لعدد المقاييس التي يمكن حصادها على الموافقات الأخلاقية المحلية المعمول بها. عادة ما نحصد حوالي 20 إلى 30 مقياسا ونجمعها في أنابيب تجميع فردية لتلطيخ القشور لاحقا ، مثل ALP ، von Kossa14. - اجمع القشور في أنبوب تجميع سعة 1.5 مل أو 2 مل. هذا يعتمد على تقنية التلوين المستخدمة.
- بالنسبة لكل من تلطيخ ALP و von Kossa ، انقل المقاييس إلى أنابيب تجميع تحتوي على ماء منزوع الأيونات ، بينما بالنسبة لتلطيخ TRAP أو الكيمياء الهيستولوجية المناعية ، انقل المقاييس إلى أنابيب تجميع تحتوي على 4٪ PFA (محلول تثبيت).
- اختياري: قبل نقل الموازين إلى أنابيب، التقط صورا للموازين الفردية التي تم حصادها إذا لزم الأمر.
ملاحظة: النقاط الزمنية المقترحة للحصاد على نطاق واسع هي اليوم 0 (وراثي) واليوم 10 واليوم 21 (المقاييس المجددة).
2. تلطيخ العظام الحية
ملاحظة: يمكن إجراء تلطيخ الهيكل العظمي الحي إما عندما لا تكون الأسماك التجريبية معدلة وراثيا للمراسلين الفلوريين أو عند حمل مراسلين معدلين وراثيا أحادي اللون. يمكن استخدام تلطيخ الحية لاستكمال الجينات المحورة. على سبيل المثال ، يمكن للمرء استخدام مراسل بانيست العظم مثل SP7 / OSX بلون واحد (على سبيل المثال ، GFP) ، ثم صبغ العظام باللون الأحمر مع أحمر Alizarin (AR). يمكن استخدام AR و calcein green لنفس الأسماك معا ؛ في هذا السيناريو ، يتم استخدام AR لتسمية العظم الأصلي أو الوراثي عن طريق الارتباط بالمصفوفة المعدنية للعظام المسنة ، ويرتبط الكالسيين بأيونات الكالسيوم الموجودة بكثرة في العظام المشكلة حديثا. على سبيل المثال ، عند تلطيخ مقياس وراثي ، يمكن تصور AR ، ولكن قد يكون الكالسيين الأخضر غائبا أو ضئيلا لأن المقاييس الجينية لها مستويات منخفضة من تكوين العظام الجديدة.
- أداء الحية Alizarin الأحمر (AR) تلطيخ.
- قم بإعداد زجاجة من محلول تلطيخ 2x AR عن طريق خلط محلول أليزارين 0.5٪ (وزن / حجم) (10 مل) مع 10 مل من مخزون 1 متر HEPES (التركيز النهائي ، 10 مللي مول) (انظر جدول المواد).
- قم بتعبئة ما يصل إلى 1 لتر بمحلول 1x Danieau (انظر جدول المواد). يجب أن يبقى المحلول في الظلام أو ملفوفا بورق.
- في يوم التجربة ، أحضر 500 مل من محلول 2x AR إلى منشأة الزرد ، وأضف 500 مل من ماء النظام (من الحوض) لصنع 1x محلول AR يعمل.
- انقل الأسماك من أحواضها إلى محلول تلطيخ AR يعمل 1x واتركه لمدة 15-20 دقيقة. اغسل البقعة الزائدة على السمك لمدة 15 دقيقة "بالغسيل" في ماء النظام.
- أداء تلطيخ كالسيين الأخضر الحية.
- قم بإعداد زجاجة من محلول تلطيخ 2x Calcein Green بإضافة 45 مجم من مسحوق الكالسيين إلى 900 مل من محلول 1x Danieau (انظر جدول المواد). استخدم محرك مغناطيسي للسماح للمسحوق بالذوبان تماما.
- اضبط الرقم الهيدروجيني على 8. هذا هو حل 2x مخزون Calcein Green. يمكن تخزين المحلول في الظلام / ملفوف بورق لمدة تصل إلى 1 شهر.
- في يوم التجربة ، أحضر 500 مل من محلول 2x Calcein Green إلى منشأة الزرد ، وأضف 500 مل من ماء النظام لصنع 1x محلول Calcein Green يعمل. يوصى باستخدام محلول تلطيخ الكالسيين الطازج.
- نقل الأسماك من حوضها إلى 1x عامل محلول تلطيخ Calcein Green واتركها لمدة 1-2 ساعة. اعتمادا على حجم الأسماك ، قد تكون هناك حاجة إلى وقت تلطيخ أطول.
- اغسل البقعة الزائدة على السمك لمدة 15 دقيقة "بالغسيل" في ماء النظام.
ملاحظة: تخيل السمك الملون باللون الأخضر Calcein في أسرع وقت ممكن حيث ستتلاشى هذه البقعة في غضون ساعات قليلة.
3. تلطيخ الفوسفاتيز القلوي (ALP) على المقاييس بعد الحصاد
- تحضير محلول تلطيخ ALP عن طريق خلط 100 mM Tris (درجة الحموضة 9.5 مع حمض الهيدروكلوريك) مع 100 mM NaCl و 50 mM MgCl2.
- استخدم حل مخزون NBT / BCIP المتاح تجاريا (انظر جدول المواد).
- انقل المقاييس إلى أنابيب تحتوي على ماء منزوع الأيونات.
- شطف المقاييس في محلول تلطيخ ALP لمدة 5 دقائق.
- وفي الوقت نفسه ، قم بإعداد محلول تلطيخ عملي عن طريق إضافة 200 ميكرولتر من محلول NBT / BCIP إلى 10 مل من محلول تلطيخ ALP. هذا يحتاج إلى إعداد طازج في وقت تلطيخ.
- تلطيخ المقاييس بمحلول تلطيخ ALP العامل لمدة 15 دقيقة.
- أوقف التفاعل عن طريق شطف المقاييس بالماء منزوع الأيونات.
4. تلطيخ فون كوسا على المقاييس بعد الحصاد
- تحضير محلول نترات الفضة 5٪ (وزن / حجم).
- تحضير 5٪ (وزن / حجم) محلول ثيوسلفات الصوديوم.
- نقل القشور المحصودة إلى أنابيب تحتوي على ماء منزوع الأيونات.
- احتضان المقاييس في محلول نترات الفضة لمدة 40 دقيقة تحت ضوء قوي.
ملاحظة: ارتد معدات الوقاية الشخصية (PPE) لأن نترات الفضة تترك بقعة يصعب إزالتها. - اغسل المقاييس مرتين لمدة 5 دقائق بالماء منزوع الأيونات.
ملاحظة: يجب جمع نفايات نترات الفضة والتخلص منها وفقا للإرشادات المحلية. - احتضان المقاييس في ثيوسلفات الصوديوم لمدة 5 دقائق.
- اغسل المقاييس مرتين لمدة 5 دقائق بالماء منزوع الأيونات.
5. تلطيخ TRAP اللوني
ملاحظة: للاطلاع على الإجراء التفصيلي، يرجى الرجوع إلى العملالمنشور سابقا 18.
- تحضير حلول تلطيخ.
- تحضير 10 ملغ / مل محلول فوسفات النفثول AS-MX.
- تزن 5 ملغ من فوسفات النفثول AS-MX (انظر جدول المواد).
- في غطاء الدخان ، قم بإعداد أنبوب يحتوي على 0.5 مل من N ، N'-dimethylformamide وقم بإذابة 5 مجم من فوسفات Naphthol AS-MX في 0.5 مل من N ، N'-dimethylformamide لعمل محلول مخزون 10 مجم / مل من فوسفات Naphthol AS-MX (رج برفق).
- قم بإعداد 1.6 مللي متر من محلول مخزون Fast Red Violet LB في طرطرات الصوديوم 50 مللي مول.
- تحضير 50 مل من 0.1 M أسيتات الصوديوم عند الرقم الهيدروجيني 5 (أضف 0.41015 جم من أسيتات الصوديوم في 50 مل من الماء منزوع الأيونات واضبط الرقم الهيدروجيني إلى 5 مع حمض الخليك 100٪).
- قم بإذابة 0.575 جم من ثنائي هيدرات الصوديوم L-tartrate dibasic (انظر جدول المواد) في 50 مل من محلول أسيتات الصوديوم 0.1 متر (الرقم الهيدروجيني = 5).
- أضف 30 ملغ من ملح LB البنفسجي الأحمر السريع.
- تحضير PBS-0.1Tx (حل 500 ميكرولتر من Triton-X في 500 مل من PBS).
- تحضير PBS-0.1Tw (حل 500 ميكرولتر من Tween-20 في 500 مل من PBS).
- تحضير 10 ملغ / مل محلول فوسفات النفثول AS-MX.
- قم بإعداد حل TRAP يعمل.
- امزج كلا محلولي المخزون معا في غطاء الدخان (0.5 مل من محلول فوسفات Naphthol AS-MX 10 مجم / مل و 50 مل من محلول مخزون 1.6 mM Fast Red Violet LB في طرطرات الصوديوم 50 mM).
ملاحظة: يمكن الآن استخدام حل العمل خارج غطاء الدخان. يمكن تخزينه في الثلاجة (ملفوفة بورق) لمدة تصل إلى شهر. تخزينها في حاويات منفصلة من الأجسام المضادة أو غيرها من الكواشف الحساسة للمثبتات. الابتعاد عن الضوء قدر الإمكان. - اختياري: تحضير محلول التبييض (على العينات المثبتة بعد التثبيت التي كانت ملطخة ب TRAP) في PBS و 0.1٪ Tween-20 (PBS-0.1٪ Tw).
- قم بإعداد مزيج تركيز نهائي من 0.5٪ هيدروكسيد البوتاسيوم (KOH) (من محلول مخزون 10٪ (وزن / حجم)) و 3٪ بيروكسيد الهيدروجين (H2O2) (محلول مخزون 33٪ ، مخزن في الثلاجة).
- امزج كلا محلولي المخزون معا في غطاء الدخان (0.5 مل من محلول فوسفات Naphthol AS-MX 10 مجم / مل و 50 مل من محلول مخزون 1.6 mM Fast Red Violet LB في طرطرات الصوديوم 50 mM).
- إجراء تثبيت العينة.
- قم بإصلاح الموازين بنسبة 4٪ PFA في 1x PBS هزاز أو تدوير لمدة 40 دقيقة في درجة حرارة الغرفة (RT).
- قم بإزالة 4٪ PFA واغسله باستخدام PBS-0.1Tx 3 مرات على الأقل لمدة 5 دقائق لكل غسلة.
- انتقل مباشرة إلى تلطيخ TRAP (أفضل نهج) أو خزنه في PBS-0.1 Tx طوال الليل.
- أداء تلطيخ TRAP من المقاييس.
- قم بإزالة محلول PBS-0.1 Tx وأضف حل عمل TRAP اللوني (الخطوة 5.2.1) لتغطية العينات بالكامل (أي 1 مل في أنبوب طرد مركزي دقيق سعة 1.5 مل).
- احتضان لمدة 1-2 ساعات في RT ، هزاز في الظلام.
- قم بإزالة محلول التلوين واغسله 3 مرات على الأقل باستخدام PBS-0.1 Tw لمدة 5 دقائق لكل غسلة.
- بعد إصلاح العينات في 4٪ PFA لمدة 30 دقيقة في RT ، هزاز بلطف في الظلام.
- قم بإزالة محلول PFA عن طريق الغسيل 3 مرات باستخدام PBS-0.1 Tw لمدة 5 دقائق لكل خطوة.
ملاحظة: يمكن تخزين العينات (في محاليل التخزين / تركيبها على شرائح المجهر) عند 4 درجات مئوية في الظلام إلى أجل غير مسمى.
6. تصاعد المقاييس الملونة
- تحضير وسط التركيب بإضافة 2.4 غرام بلورات Mowiol 4-88 إلى 6 غرام من الجلسرين (انظر جدول المواد). يمكن استخدام أي وسائط تركيب مفضلة.
- أضف 6 مل من الماء منزوع الأيونات واتركه على محرك مغناطيسي لمدة ساعة.
- أضف 12 مل من 0.2 متر تريس (درجة الحموضة 8.5) واحتضانها عند حوالي 53 درجة مئوية حتى تذوب بلورات Mowiol تماما.
- توضيح الحل عن طريق الطرد المركزي عند 2000 × جم لمدة 20 دقيقة في درجة حرارة الغرفة.
- انقل الحل إلى حاوية تخزين. يمكن الاحتفاظ بوسط التركيب في الثلاجة لمدة 12 شهرا تقريبا. حل Mowiol المذاب مستقر لمدة تصل إلى 1 شهر.
- قم بتركيب المقاييس على شريحة مجهرية في تركيب الوسط ، وقم بتغطيتها بغطاء وعرضها تحت المجهر.
7. ثقافة المقاييس خارج الجسم الحي
ملاحظة: هذه الخطوة مقتبسة من de Vrieze et al.12.
- قبل حصاد المقاييس في بيئة معقمة ، تحضير وسط العظمولوحة الثقافة.
- وسط الاستزراع العظمي (OCM): في أنبوب طرد مركزي معقم ، اصنع 15 مل OCM في وسط زراعة الخلايا القياسي (جلوكوز عالي ، بدون جلوتامين ، بدون فينول أحمر) بتركيزات نهائية من مصل ربلة الساق البقري 1٪ ، 1٪ (200 مللي متر ثنائي ببتيد L-alanyl-L-glutamine في 0.85٪ كلوريد الصوديوم) ، محلول مضاد حيوي / مضاد حيوي 1٪ (100x) ، 4 mM CaCl2 ، 10 mM β-Glycerophosphate ، 1 nM بيروفات الصوديوم و 1٪ أمفوتريسين B (اختياري) (انظر جدول المواد).
- صب OCM في خزان كاشف معقم ، وباستخدام ماصة متعددة القنوات ، أضف 100 ميكرولتر إلى كل بئر من لوحة 96 بئرا.
- أغلق اللوحة المكونة من 96 بئرا وقم بتخزين اللوحة. يمكن تخزين OCM في الثلاجة لفترة قصيرة (بين عشية وضحاها إلى 1 أسبوع) وحفظها عند 28 درجة مئوية قبل الاستخدام.
- أداء الحصاد على نطاق واسع وغسل PBS.
- احصد القشور باستخدام ملاقط / ملقط معقم وقم بإيداعها في طبق بتري يحتوي على محلول PBS معقم.
- أداء إعداد لوحة.
- انقل كل مقياس من طبق بتري إلى كل بئر على طبق 96 بئرا مع 100 ميكرولتر من OCM (دافئ إلى 28 درجة مئوية) باستخدام ملقط معقم.
- بمجرد نقل جميع المقاييس إلى اللوحة ، أحضر اللوحة تحت المجهر المجسم. استخدام طرف ماصة ناعم ومعقم لتحريك كل ميزان برفق إلى قاع البئر وإبقائه بعيدا عن جانب الآبار لتجنب انعكاس الضوء أثناء التقاط الصورة.
ملاحظة: هذه الخطوة مطلوبة فقط في حالة إجراء التصوير المباشر. - انقل اللوحة بعناية إلى الحاضنة أو نظام التصوير المباشر (LIS ، انظر جدول المواد) (مضبوط على 28 درجة مئوية ، 5٪ CO2) ، حيث يمكن زراعة المقاييس لمدة تصل إلى 7 أيام.
- تحديث OCM (اختياري).
- قم بتسخين OCM المخزن في الثلاجة إلى 28 درجة مئوية.
- انقل بعناية لوحة 96 بئرا إلى بيئة معقمة. باستخدام ماصة متعددة القنوات ، نضح 50 ميكرولتر من كل بئر. لهذا ، اضغط على الأطراف على الجدران ولا تغمسها حتى القاع لتجنب شفط / تحريك / إزالة القشور. استخدم نصائح جديدة لظروف مختلفة.
- صب OCM في خزان كاشف معقم ، وباستخدام ماصة متعددة القنوات أضف 60 ميكرولتر من OCM إلى كل بئر.
- ضع اللوحة تحت المجهر المجسم وتحقق من وجود قشور في غير محلها (قريبة جدا من الجدران أو عائمة أو في وضع رأسي داخل الوسائط). أعد وضعها بطرف ماصة ناعم ومعقم إذا لزم الأمر.
- ضع اللوحة مرة أخرى في الحاضنة / LIS.
ملاحظة: لا تقم بتحديث الوسط إذا كانت التجربة تتضمن إيقاع الساعة البيولوجية (CR) ، لأن صدمة المصل يمكن أن تؤثر على الساعة البيولوجية. لاحظ إذا كانت دراسة CR تلاحظ أن ظروف الإضاءة تعيد ضبط الساعة أيضا.
- إجراء تلطيخ وتصوير مقياس ما بعد الثقافة (اختياري).
- بعد 6 أيام من الثقافة ، قم بإصلاحها وتوجيهها للتلطيخ المناسب مثل von Kossa و ALP المذكورة أعلاه.
- بدلا من ذلك ، إذا كانت أسماك التجارب تحتوي على علامة الفلورسنت ، فضع اللوحة في نظام تصوير حي.
ملاحظة: في حالة استخدام نظام تصوير مباشر، تأكد من ضبطه على درجة حرارة ومستوىCO 2 مناسب للتجربة. عادة ، في هذه الدراسة ، تم استخدام 28 درجة مئوية و 5 ٪ CO2 . حدد المرشحات المناسبة والنقاط الزمنية للتصوير (هنا ، تم استخدام فاصل زمني قدره 2 أو 4 ساعات ، وهو ما يكفي لمتابعة هجرة بانيات العظم) وأهداف تكبير منخفضة (أي 4x) لضمان التصوير المتساوي للآبار بأكملها. وذلك لأن المقاييس تميل إلى التحرك داخل الآبار ، خاصة أثناء تغييرات الوسائط.
النتائج
تجديد المقياس
يمكن تتبع تجديد المقياس باستخدام مجهر مجسم فلوري قياسي عن طريق تصوير جناح الزرد. يوضح الشكل 3 أ التغيرات في تعبير sp7 / osx للمقاييس أثناء تجديد المقياس في سمكة الزرد البالغة من العمر 4 أشهر. النقاط الزمنية لتصوير الجناح الموضحة في الشكل 3 أ هي الجينات (المقاييس الأصلية ، قبل الحصاد) ، واليوم 2 ، واليوم 4 ، واليوم 10 بعد الحصاد. عادة ما نستخدم خطوط osx (المعروفة أيضا باسم osterix أو sp7) المحورة وراثيا (إما كنوع من الموجات فوق الصوتية (Tg(Ola.sp7:NLS-eGFP)19 أو mCherry Tg(osterix:mCherry-NTR)pd46)17 لتتبع التغيرات في النظام الهيكلي أثناء تسمية بانيات العظم التي تصنع العظام. يمكن رؤية النقش المبكر للمقاييس المشكلة حديثا في 2 أيام من التجديد. يتعطل هذا النمط المبكر من تجديد القشور في بعض الحالات ، خاصة في طفرات الهيكل العظمي. من خلال تتبع تقدم التجديد ، يمكن للمرء تحليل قدرة ومعدل التجديد. في يوم الحصاد على نطاق واسع ، يمكن إجراء التصوير الفردي للحراشف المحصودة بعد تصوير الجناح باستخدام نفس المجهر المجسم ، كما هو موضح في الشكل 3B. تحتوي المقاييس المجددة على تعبير osx أعلى بكثير مقارنة بالمقاييس الجينية لليوم 0 لأن بانيات العظم مطلوبة لتشكيل العظام الجديد.
ثقافة مقياس خارج الجسم الحي
على الرغم من أنه يمكن للمرء دراسة عملية تكوين العظام دي نوفو من خلال تتبع عملية التجديد على جانب السمكة ، يمكننا أيضا استخدام هذا النموذج لدراسة إصلاح وشفاء إصابات الهيكل العظمي باستخدام ثقافة خارج الجسم الحي عن طريق إحداث إصابة على المقاييس بمشرط. باستخدام نظام التصوير المباشر ، يمكن تتبع الإصلاح في الوقت الفعلي. يوضح الشكل 4 نتيجة تمثيلية لاستجابة التئام الإصابة على مقياس جيني في 3 أيام في ثقافة حيث يتم تمييز بانيات العظم ب osx: mCherry. يظهر موقع الإصابة الذي تظهره الأجزاء الداخلية في بداية المزرعة فجوة واضحة بين بانيات العظم ومقياس الدوران (الشكل 4 أ). يمكن للمرء مراقبة هجرة بانيات العظم نحو موقع الإصابة بالتصوير بفاصل زمني. بعد 3 أيام في الثقافة ، يتم تقليل عرض الفجوة ، ويمكن رؤية التعبير عنosx بين الفجوة ومقياس الدوران المشكل حديثا (الشكل 4B). بالإضافة إلى ذلك ، فإن التشكل من حيث شكل بانيات العظم ، يكون أكثر دائرية في بداية الثقافة وبعد 3 أيام ، يكون أكثر استطالة. من المحتمل أن يكون هذا التغيير في مظهر بانيات العظم بسبب التواجد في الثقافة وليس في بيئتها الطبيعية (المرتبطة بالأسماك).
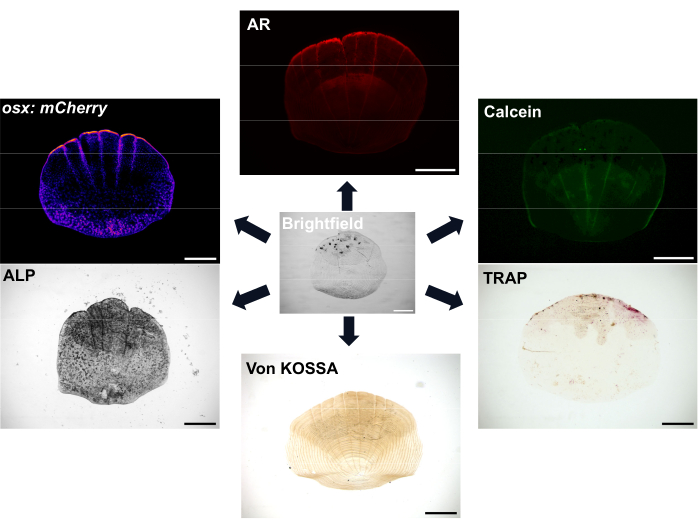
الشكل 1: أمثلة على خيارات التصوير للمقاييس. يمكن تصور بانيات العظم باستخدام خطوط مراسل osx / sp7 المعدلة وراثيا (إما في GFP أو mCherry). يمكن استخدام تلطيخ ALP لإظهار نشاط بانيات العظم. يمكن أن يظهر تلطيخ TRAP نشاط الخلايا الآكلة للعظم. Alizarin الأحمر (AR) والأخضر Calcein كلاهما أصباغ يمكن استخدامها في الأسماك الحية. AR تسميات التمعدن وتسميات Calcein العظام المشكلة حديثا. يمكن أيضا إظهار مدى التمعدن مع تلطيخ فون كوسا. قضبان المقياس: 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
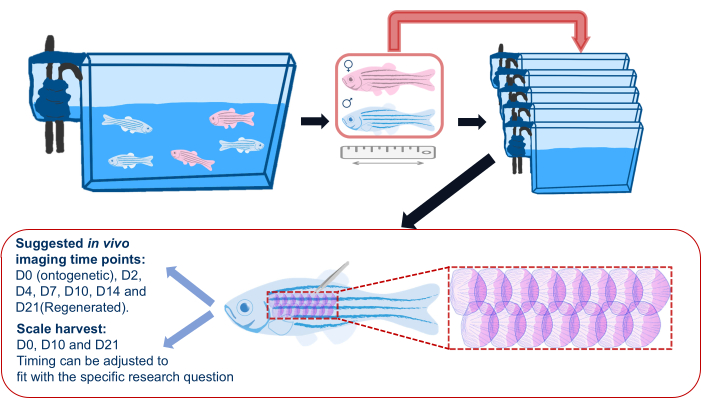
الشكل 2: رسم تخطيطي لتجربة تجديد المقياس. رسم تخطيطي عام لتجربة تجديد المقياس يوضح أن الأسماك يتم فصلها إلى أحواض فردية قبل التجربة. يتم تسجيل الطول والجنس والصحة. يظهر الرسم التخطيطي أيضا المنطقة المقترحة على جانب الأسماك لحصاد المقاييس والنقاط الزمنية المقترحة للتصوير. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
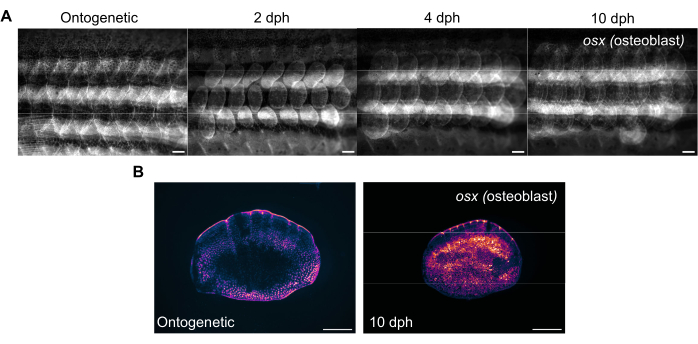
الشكل 3: صور تمثيلية لتعبير العظم (لتصور بانيات العظم) أثناء تجديد القشور المأخوذة من سمكة الزرد البالغة من العمر 4 أشهر. (أ) صور الجناح الملتقطة في اليوم 0 (ما قبل الحصاد ، المقاييس الجينية ، 2 dph (أيام ما بعد الحصاد) اليوم 2 ، 4 dph ، و 10 dph لتتبع التغييرات في تعبير osx . قضبان المقياس: 1 مم. (B) صور تمثيلية لمقياس جيني ومقياس عند 10 dph مأخوذة من نفس السمكة كما في اللوحة (A). لاحظ المستويات المتزايدة لتعبير osx كما هو موضح باللون الأرجواني في وسط مقاييس التجديد. قضبان المقياس: 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
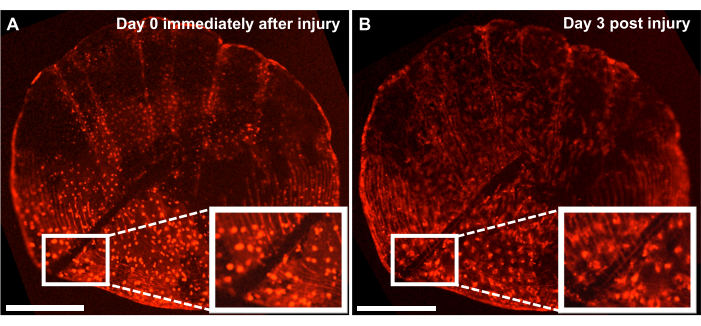
الشكل 4: النتائج التمثيلية للاستجابة لإصلاح إصابات الهيكل العظمي على نطاق جيني تم التقاطه من سمكة الزرد البالغة من العمر 4 أشهر باستخدام نظام التصوير الحي. (أ) المقاييس الجينية مع إصابة بواسطة مشرط في نفس يوم الحصاد (النقطة الزمنية 0 / اليوم 0) للثقافة. (ب) يظهر المقياس نفسه بعد 3 أيام من الإصابة. يظهر الجزء الداخلي منطقة الإصابة. قضبان المقياس: 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
تحمل قشور الزرد elasmoid ، كنموذج جديد لأبحاث الهيكل العظمي ، إمكانات كبيرة للمساعدة في فهمنا لصيانة العظام وتجديدها وإصلاح الإصابات. تسمح وفرة القشور على الأسماك بفحص مركب متوسط إلى عالي الإنتاجية مع تقليل عدد المستخدمة والحد من التباين داخل الفرد. هنا ، يتم تقديم بروتوكولات لتجديد النطاق وثقافة النطاق خارج الجسم الحي لدراسة التجديد والإصلاح.
يجب مراعاة بعض الخطوات الحاسمة عند اتباع هذا البروتوكول. تعد الإزالة الدقيقة للقشور أمرا ضروريا ، خاصة عند استخدام خط مراسل معدل وراثيا للحد من الاضطراب في عدد الخلايا الناجم عن الحصاد. إذا كان لا بد من إجراء مقارنات مع المقاييس الجينية ، فتأكد من أن المنطقة لا تحتوي على قشور متجددة تلقائيا (والتي يمكن أن تحدث بشكل طبيعي خلال عمر الأسماك). تأكد من أن البيئة والمعدات معقمة للزراعة خارج الجسم الحي لتحقيق بقاء الخلية الأمثل والحد الأدنى من العدوى في الثقافة.
اعتمادا على سؤال البحث المحدد ، يمكن إجراء تعديلات على البروتوكول ، مثل الجمع بين خطوط مراسل معدلة وراثيا مختلفة لتصور أنواع الخلايا الأخرى من ملفات تعريف التعبير الجيني أثناء التجديد والإصلاح11,14.
إن النطاق الواسع للتلطيخ الذي يمكن للمرء أن يؤديه على المقاييس يعني أنه لكل مركب أو حالة تم اختبارها يمكن للمرء أن ينظر إلى آثاره على العظام من زوايا مختلفة. بينما يمكن لمراسلي SP7 / OSX إظهار أرقام بانيات العظم ، يمكن أن يتصور تلطيخ ALP نشاط بانيات العظم ، ويمكن أن يتصور تلطيخ TRAP نشاط ناقضة العظم ، ويمكن أن يؤدي تلطيخ Calcein الأخضر الحي إلى تسمية العظام المشكلة حديثا ويمكن أن يظهر تلطيخ Alizarin الأحمر أو von Kossa تمعدن الحجم. يمكن أيضا استخدام نشاط Luciferase لتحديد بانيات العظم12. جنبا إلى جنب مع تقنيات التلوين هذه ، يمكن للمرء أن يتعلم المساهمة النسبية لبانيات العظم والخلايا الآكلة للعظم في تأثير عظمي معين. تفتقر المقاييس إلى الخلايا العظمية ، المنتشرة في عظام الثدييات وهي الدوافع الرئيسية للاستجابة الحسية الميكانيكية للعظام. يتم إصلاح المقياس وتجديده في هذا النموذج بشكل أساسي بواسطة بانيات العظم مع إعادة التشكيل اللاحقة بواسطة ناقضات العظم 8,9. من الأهمية بمكان ملاحظة أن الاختلاف يحدث بين الأفراد والفئات العمرية20. لتقليل ذلك ، يجب أن تكون مساحة الحصاد على نطاق واسع ثابتة ، حيث يمكن أن تؤدي المواقع المختلفة إلى ظهور أشكال مختلفة على نطاق واسع ، ويتم استخدام الأسماك من نفس مجموعات الأشقاء بحيث يكون العمر والحجم متسقين. ومع ذلك ، نظرا لأنه يمكن حصاد مقاييس متعددة لكل سمكة ، يمكن للمرء إجراء المزيد من التجارب باستخدام عدد أقل من الأسماك ، مما يقلل من التباين داخل الفرد.
باختصار ، تظهر هذه البروتوكولات تقنيات تجريبية يمكن تطبيقها على المقاييس الجينية والتجديدية. في الختام ، تظهر قشور elasmoid إمكانات كبيرة كنموذج هيكلي للمساعدة في فهم تكوين العظام وإصلاحها. وسوف يساعد على الحد من استخدام لفحص مركب العظم عالي الإنتاجية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
نود أن نشكر ماثيو جرين من وحدة خدمة لتربية الأسماك وكاتي جيبسون من مركز وولفسون للتصوير الحيوي. تم تمويل CLH و DB و QT من قبل Versus Arthritis (زمالة CLH العليا 21937 ، DB و QT Intermediate Fellowship 22044) ، تم تمويل RR من قبل (NHMRC APP1158758). تم دعم هذا العمل أيضا من خلال منحة BBSRC (BB / T001984 / 1).
Materials
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffered saline (PBS) | Gibco | 70013-016 | PBS |
| 12-Multichanel Pipette | Sartorius | 728230 | Multichanel pipette, Proline Plus Mechanical Pipette, 12 Channel, , 10-100 µL. |
| 15 mL Centrifuge tubes | Corning | 430791 | Centrifuge tube, CentriStar Cap, Polypropylene, RNAse/DNAse free, Non-pyrogenic |
| 4% Paraformaldehyde (PFA) | Sigma | P6148 | PFA |
| Alizarin red | Sigma | A5533 | |
| Amphotericin B | ThermoFisher Scientific | 15290026 | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher Scientific | 11772644 | Sealing film |
| Calcein powder | Sigma | C0875 | |
| Calcium Chloride | Thermo Scientific | L13191.30 | |
| Corning 96 well plate | Corning | 3596 | 96-well-plate, Clear, Flat Bottom Polystyrene TC-treated Microplates, Individually Wrapped, with Lid, Sterile |
| Cover slips | VWR | 631-0146 | |
| Cytiva HyClone Iron-Supplemented Calf Serum | Fisher Scientific | SH30072.03 | |
| Danieau | Sigma | ||
| DMEM | Life Technologies | 31053 | |
| Falcon tubes | Corning | 430828 | |
| Fast Red Violet LB stock solution | Sigma | F3381 | |
| GlutaMAX Supplement | Life Technologies | 35050 | |
| Glycerol | Sigma | 81381 | |
| Hepes | Sigma | H3375 | |
| Incubator | X | Incubator, Set up to 28 °C and 5% CO2 | |
| IncuCyte Zoom | Sartorious | X | Live Imaging System, Set up to 28 °C and 5% CO2 |
| Leica stereomicroscope | X | Sterioscope | |
| L-tartrate dibasic dihydrate | Sigma | 228729 | |
| Mgcl2 | BDH Laboratory Sup. | 261237T | |
| Microscope slides | Epredia | J2800AMNZ | |
| Mowiol 4-88 | Sigma | 9002-89-5 | |
| MQ water | X | ||
| N, N’-dimethylformamide (Merck: D4451) | Merck | D4451 | |
| NaCL | Fisher Chemical | S/3120/53 | |
| Naphthol AS-MX phosphate | Merck | N4875 | |
| NBT/BCIP solution | Sigma | #000000011681451001 | |
| Penicillin-Streptomycin | Life Technologies | 15140 | |
| Petri Dishes | Corning | 430589 | 35 mm sterile Petri dish, Non-treated, Nonpyrogenic, Polystyrene. |
| Reagent Reservoir | Startub | E2310-1025 | 25mL Reagent Reservoir |
| Silver nitrate | Sigma | 209139 | |
| Sodium acetate | Sigma | 52889 | |
| Sodium beta-glycerophosphate pentahydrate | Thermo Scientific | L03425.14 | |
| Sodium pyruvate solution | Sigma | S8636 | |
| Sodium tartrate | Sigma | S4797 | |
| Sodium thioculphate | Sigma | 563188 | |
| Tricaine methane sulfonate (MS222) | Sigma | E10521 | |
| Tris | Sigma | 252859 | |
| Triton-X100 | Sigma | T8787 | |
| Tween-20 | SLS | CHE3852 | |
| Tweezers Number 5 | Dumont | 500341 | Tweezer, INOX, biology grade |
| Zebrafish tanks | Tecniplast | ZB30BCP | 3.5 L - 28 cm x 11 cm x 17 cm |
| Zebrafish tanks | Tecniplast | ZB30BCP | 1 L - 28 cm x 7 cm x 11 cm |
References
- Tobias, J. H., et al. Opportunities and challenges in functional genomics research in osteoporosis: report from a workshop held by the causes working group of the osteoporosis and bone research academy of the Royal Osteoporosis Society on October 5th 2020,". Frontiers in Endocrinology. 11, (2021).
- Busse, B., Galloway, J. L., Gray, R. S., Harris, M. P., Kwon, R. Y. Zebrafish: An emerging model for orthopedic research. Journal of Orthopaedic Research. 38 (5), 925-936 (2020).
- Dietrich, K., et al. Skeletal biology and disease modeling in zebrafish. Journal of Bone and Mineral Research. 36 (3), 436-458 (2021).
- McGowan, L. M., Kague, E., Vorster, A., Newham, E., Cross, S., Hammond, C. L. Wnt16 elicits a protective effect against fractures and supports bone repair in zebrafish. JBMR Plus. 5 (3), 10461 (2021).
- Sehring, I., Weidinger, G. Zebrafish fin: Complex molecular interactions and cellular mechanisms guiding regeneration. Cold Spring Harbor Perspectives in Biology. 14 (7), 040758 (2022).
- Bergen, D. J. M., Kague, E., Hammond, C. L. Zebrafish as an emerging model for osteoporosis: a primary testing platform for screening new osteo-active compounds. Frontiers in Endocrinology. 10 (6), (2019).
- Aman, A. J., Fulbright, A. N., Parichy, D. M. Wnt/β-catenin regulates an ancient signaling network during zebrafish scale development. Elife. 7, 37001 (2018).
- Iwasaki, M., Kuroda, J., Kawakami, K., Wada, H. Epidermal regulation of bone morphogenesis through the development and regeneration of osteoblasts in the zebrafish scale. Developmental Biology. 437 (2), 105-119 (2018).
- Metz, J. R., de Vrieze, E., Lock, E. J., Schulten, I. E., Flik, G. Elasmoid scales of fishes as model in biomedical bone research. Journal of Applied Ichthyology. 28 (3), 382-387 (2012).
- Cox, B. D., De Simone, A., Tornini, V. A., Singh, S. P., Di Talia, S., Poss, K. D. In toto imaging of dynamic osteoblast behaviors in regenerating skeletal bone. Current Biology. 28 (24), 3937-3947 (2018).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders,". Frontiers in Endocrinology. 11, (2020).
- de Vrieze, E., Zethof, J., Schulte-Merker, S., Flik, G., Metz, J. R. Identification of novel osteogenic compounds by an ex-vivo sp7: Luciferase zebrafish scale assay. Bone. 74, 106-113 (2015).
- De Vrieze, E., Moren, M., Metz, J. R., Flik, G., Lie, K. K. Arachidonic acid enhances turnover of the dermal skeleton: Studies on zebrafish scales. PLoS One. 9 (2), 89347 (2014).
- Bergen, D. J. M., et al. Regenerating zebrafish scales express a subset of evolutionary conserved genes involved in human skeletal disease. BMC Biology. 20 (1), 21 (2022).
- Bergen, D. J. M., et al. High bone mass disorders: New insights from connecting the clinic and the bench. Journal of Bone and Mineral Research. , (2022).
- Pasqualetti, S., Banfi, G., Mariotti, M. Osteoblast and osteoclast behavior in zebrafish cultured scales. Cell and Tissue Research. 350 (1), 69-75 (2012).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Developmental Cell. 22 (4), 879-886 (2012).
- Ethiraj, L. P., Fong, E. L. S., Liu, R., Chan, M., Winkler, C., Carney, T. J. Colorimetric and fluorescent TRAP assays for visualising and quantifying fish osteoclast activity. European Journal of Histochemistry. 66 (2), 3369 (2022).
- DeLaurier, A., et al. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505 (2010).
- Carnovali, M., Banfi, G., Mariotti, M. Age-dependent modulation of bone metabolism in zebrafish scales as new model of male osteoporosis in lower vertebrates. Geroscience. 43 (2), 927-940 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved