Method Article
斑马鱼鳞片再生 在多多 和 离体 鳞片培养中
摘要
该协议描述了斑马鱼在 体内 再生过程中弹性鳞片的收获和可视化。此外,这些鳞片的 体外 培养在收获后长达7天。
摘要
骨骼疾病的病因通常很复杂,影响着全世界数百万人。由于人口老龄化,需要新的治疗方法来减轻医疗保健系统的负担。由于这些疾病很复杂,因此在实验室环境中准确模拟骨病理生理学既困难又昂贵。该领域面临的挑战是建立一个具有成本效益的、生物学相关的平台来模拟骨病,可用于测试潜在的治疗化合物。理想情况下,这样的平台应该允许动态可视化在其矿化基质环境中起作用的骨构建成骨细胞和骨降解破骨细胞的细胞行为。由于遗传工具的可用性,包括转基因报告细胞系,以及一些骨骼组织(包括鳞片)在成年后保持半透明,斑马鱼越来越多地被用作模型,从而允许动态成像选择。由于斑马鱼鳞片同时具有成骨细胞和破骨细胞,并且非常丰富,因此它们提供了易于获取且丰富的独立骨骼单位资源。此外,一旦去除,成年斑马鱼鳞片就会完全再生,因此提供了一种研究体内矿化组织的时空生长的方法 。 在这里,我们详细介绍了用于收获和跟踪鳞片再生的协议。最后,还提出了一种 离体 稳定培养鳞片一周的方案,并在随着时间的推移对鳞片的矿化基质进行受控损伤后遵循愈合反应。
引言
骨骼是一种坚硬的结缔组织,是骨骼的主要部分,能够运动并充当体内的矿物质储备。为了保持骨骼健康, 通过 成骨细胞(合成代谢)和破骨细胞(吸收骨骼)的耦合活性,骨形成和降解之间的微妙平衡至关重要。这种平衡被衰老或荷尔蒙失调所破坏,通常会导致骨质疏松症等骨脆性疾病1.尽管现有药物已被批准用于靶向骨脆性疾病,但许多药物都有副作用;因此,需要新的治疗方法1.因此,仍然需要丰富的生物学相关骨组织来源,可用于测试潜在的治疗化合物。
传统上,啮齿动物模型和细胞培养系统已被用于研究骨骼生物学。然而,斑马鱼正日益成为另一种选择的模型。虽然不是哺乳动物系统,但斑马鱼在骨骼研究方面比啮齿动物具有一定的优势;这些包括它们的繁殖力和幼虫的半透明性;即使在成年期,一些骨骼组织(包括鳞片和鳍)仍保持半透明,从而可以进行高分辨率的体内成像并增加骨骼突变体的可用性2,3。斑马鱼的鳍和鳞片在去除后都能够完全再生。斑马鱼鳍的骨骼再生和损伤修复已被广泛研究4,5,而斑马鱼鳞片是该领域较新的骨骼模型,但为离体培养提供了优势6。
鳞片非常丰富,每条鱼身上至少有 300 片鳞片,作为鱼的保护层。每个鳞片都是一个小的矿化板,由富含胶原蛋白的骨骼基质的成骨细胞和骨吸收破骨细胞组成7。斑马鱼鳞片和人体骨骼的骨化过程都需要间充质干细胞分化为成骨细胞以形成矿化基质。斑马鱼鳞片具有很强的再生能力,可用于研究骨骼再生和修复,为骨骼研究提供了很大的优势。然而,尽管同时存在成骨细胞和破骨细胞,斑马鱼鳞片缺乏对人体骨骼重塑和机械感觉很重要的骨细胞;鳞片的表面位置意味着它们可以很容易地用一把镊子去除。移除鳞片后,会发生一连串事件,鳞片再生开始 8,9。有多种染色和成像选项可用于可视化成骨细胞和破骨细胞的活性以及鳞片的矿化,如图 1 所示。此外,斑马鱼的许多相关荧光转基因报告基因品系的可用性意味着人们可以可视化再生过程中的细胞动力学 7,10,11。这个过程使人们可以通过观察鱼侧翼鳞片再生的早期模式来研究这些再生鳞片的形态、细胞活动和遗传特征,从而更多地了解从头骨的形成。鳞片形成和再生的生物学已经得到了很好的表征。重要的是,鳞片可以显示出对治疗相关化合物的良好预测能力12,并且用糖皮质激素治疗鱼类会导致鳞片再生以显示骨质疏松表型13。再生鳞片的转录组显示,在鳞片再生中激活的基因对于与人类骨骼疾病相关的基因富集,进一步证明了它们作为模型系统的相关性6,14。
最后,这些鳞片可以在体外培养长达 7 天。与通常由单一细胞类型组成的细胞系培养相比,体外规模培养在其自然环境中提供了体外骨骼研究机会,该环境中含有成骨细胞和破骨细胞,其天然细胞外基质为 8,12,15,16。
鳞片培养还使我们能够对新的骨合成代谢靶点进行药物筛选。鱼身上鳞片的丰富性意味着人们可以从一条鱼中填充至少两块 96 孔板,从而允许以多孔形式进行复合筛选,其中每个孔都包含一个鳞片及其天然细胞生态位。此外,由于鳞片很薄,药物吸收是可预测的12.综上所述,斑马鱼的弹性鳞片在骨骼研究中具有巨大的潜力,可以帮助我们更深入地了解骨骼形成和修复过程中的细胞事件。在这里,我们描述了收获鳞片以跟踪 体内 再生和 离体培养鳞片的方案。
研究方案
大学动物科学部门 (ASU) 在斑马鱼饲养指南的指导下负责斑马鱼护理。所有程序,包括鳞片采集、活体骨染色和活体成像,均在英国内政部项目许可证 (PP4700996) 下获得批准和执行。对于这份手稿,使用了来自sp7:mCherry [Tg(osterix:mCherry-NTR)pd46]系的年轻成年转基因斑马鱼17。这些鱼包括4个月大的雄性和雌性。
1. 体内 规模再生
- 在开始鳞片再生实验之前,将斑马鱼从其主水箱转移到单独的水箱中(见 材料表),并在整个实验过程中成像后返回这些单独的水箱,如 图2所示。这是为了确保所有再生鳞片都是为实验收获的鳞片;由于其他鱼类造成的伤害,群居会导致鳞片的零星脱落。
注意:鱼是单独放置的,以避免鱼之间的战斗和随后的鳞片损失。 - 根据实验设计记录每种实验鱼的信息(即基因型、年龄和性别)。使用相机(智能手机相机工作正常)在尺子旁边拍摄每条鱼的图像,以记录鱼的大小/长度和健康状况。
- 在实验当天,使用0.05%(v / v)三卡因甲烷磺酸盐(MS222,见 材料表)浸泡麻醉斑马鱼,然后将其放置在带有湿组织的培养皿上,以避免鱼在成像或收获过程中移动。
- 将鱼侧放(通常使用左翼以保持一致性)。使用具有适当放大倍率的体视显微镜进行侧翼成像(通常,本研究使用 2 倍、4 倍和/或 6.3 倍和 8 倍来捕获整体再生区域和放大区域以进行详细观察)。
注意:侧翼成像时间点取决于实验目的和转基因报告基因的选择。例如,为了在鳞片再生期间跟踪成骨细胞,建议的时间点是第 0 天(个体发育)、收获后 2 天 (dph)、4 dph、7 dph、10 dph、14 dph、21 dph。为了减少重复麻醉的影响,请将成像时间点保持在实验所需的最少时间。 - 在立体显微镜下使用细镊子和镊子收获鳞片。将收获的鳞片转移到收集管中,以便稍后进行鳞片染色。
注意:可以收获的最大秤数量将取决于当地的道德批准。我们通常收获大约 20 到 30 个鳞片,并将它们收集到单独的收集管中,以便稍后进行鳞片染色,例如 ALP、von Kossa14。 - 将鳞片收集到 1.5 mL 或 2 mL 收集管中。这取决于所使用的染色技术。
- 对于ALP和von Kossa染色,将鳞片转移到含有去离子水的收集管中,而对于TRAP染色或免疫组化,将鳞片转移到含有4%PFA(固定溶液)的收集管中。
- 可选:在将鳞片转移到试管中之前,如果需要,可以捕获单个收获的鳞片的图像。
注意:建议的鳞片收获时间点是第 0 天(个体发育)、第 10 天和第 21 天(再生鳞片)。
2.活体骨染色
注意:当实验鱼不是荧光报告基因的转基因或携带单色转基因报告基因时,可以进行活骨骼染色。活染色可用于补充转基因;例如,可以使用一种颜色(例如GFP)的成骨细胞报告基因(例如sp7 / osx ),然后用茜素红(AR)将骨染成红色。AR和钙黄绿可以一起用于同一条鱼;在这种情况下,AR通过与老化骨的矿化基质结合来标记原始或个体发育的骨,而钙黄绿素则与新形成的骨中丰富的钙离子结合。例如,当对个体发育鳞片进行染色时,可以观察到 AR,但钙黄绿可能不存在或很少,因为个体发育鳞片的新骨形成水平较低。
- 进行实时茜素红 (AR) 染色。
- 通过将 0.5% (w/v) 原液茜素溶液 (10 mL) 与 10 mL 1 M 原液 HEPES(终浓度,10 mM)混合来制备一瓶 2x AR 染色溶液(参见 材料表)。
- 用 1x Danieau 溶液加注至 1 L(参见 材料表)。溶液必须保持在黑暗中或用箔纸包裹。
- 在实验当天,将 500 mL 的 2x AR 溶液带到斑马鱼设施中,并加入 500 mL 系统水(来自水族箱)制成 1x 工作 AR 溶液。
- 将鱼从鱼缸中转移到 1x 工作 AR 染色溶液中,静置 15-20 分钟。在系统水中"洗涤"15分钟,洗掉鱼上多余的污渍。
- 进行活焦绿绿素染色。
- 通过将 45 mg 钙黄绿素粉末加入 900 mL 1x Danieau 溶液中来制备一瓶 2x 钙黄绿绿染色溶液(参见 材料表)。使用磁力搅拌器使粉末完全溶解。
- 将pH值调节至8。这是 2x 库存钙黄绿素溶液。该溶液可以在黑暗中储存/用箔纸包裹长达 1 个月。
- 在实验当天,将 500 mL 的 2x 钙黄绿绿溶液带到斑马鱼设施中,并加入 500 mL 系统水制成 1x 工作钙黄绿素溶液。建议使用新鲜制备的钙黄绿素染色液。
- 将鱼从水箱中转移到1x工作钙黄绿染色溶液中,并放置1-2小时。根据鱼的大小,可能需要更长的染色时间。
- 在系统水中"洗涤"15分钟,洗掉鱼身上多余的污渍。
注意:尽快对钙黄绿染色的鱼进行成像,因为这种染色会在几个小时内褪色。
3. 收获后鳞片上的碱性磷酸酶(ALP)染色
- 通过将 100 mM Tris(pH 9.5 与 HCl)与 100 mM NaCl 和 50 mM MgCl2 混合来制备 ALP 染色溶液。
- 使用市售的NBT/BCIP储备溶液(见 材料表)。
- 将秤转移到装有去离子水的试管中。
- 在ALP染色溶液中冲洗鳞片5分钟。
- 同时,将 200 μL NBT/BCIP 溶液加入 10 mL ALP 染色缓冲液中,制备工作染色溶液。这需要在染色时新鲜制备。
- 用有效的ALP染色溶液染色秤15分钟。
- 用去离子水冲洗鳞片,停止反应。
4. 收获后对鳞片进行 Von KOSSA 染色
- 制备5%(w / v)硝酸银溶液。
- 制备5%(w / v)硫代硫酸钠溶液。
- 将收获的鳞片转移到装有去离子水的试管中。
- 将鳞片在硝酸银溶液中在强光下孵育40分钟。
注意: 穿戴 PPE(个人防护设备),因为硝酸银会留下难以去除的污渍。 - 用去离子水清洗秤两次,持续5分钟。
注意:硝酸银废物必须根据当地指南进行收集和处置。 - 将鳞片在硫代硫酸钠中孵育5分钟。
- 用去离子水清洗秤两次,持续5分钟。
5. 比色TRAP染色
注:有关详细程序,请参阅以前发表的工作18。
- 准备染色溶液。
- 制备 10 mg/mL 萘酚 AS-MX 磷酸盐溶液。
- 称取5mg萘酚AS-MX磷酸盐(见 材料表)。
- 在通风橱中,制备装有0.5mL N,N'-二甲基甲酰胺的试管,并将5mg萘酚AS-MX磷酸盐溶解在0.5mL N,N'-二甲基甲酰胺中,制成10mg / mL萘酚AS-MX磷酸盐的储备溶液(轻轻摇动)。
- 在 50 mM 酒石酸钠中制备 1.6 mM Fast Red Violet LB 储备溶液。
- 在 pH 5 下制备 50 mL 0.1 M 乙酸钠(在 50 mL 去离子水中加入 0.41015 g 乙酸钠,并用 100% 乙酸调节 pH 至 5)。
- 将0.575g酒石酸钠二水合物(参见 材料表)溶于50mL0.1M乙酸钠缓冲液(pH=5)中。
- 加入 30 毫克快速红紫 LB 盐。
- 制备PBS-0.1Tx(将500μLTriton-X溶解在500mL PBS中)。
- 制备PBS-0.1Tw(将500μL吐温-20溶解在500mL PBS中)。
- 制备 10 mg/mL 萘酚 AS-MX 磷酸盐溶液。
- 准备一个有效的 TRAP 溶液。
- 在通风橱中将两种储备溶液混合在一起(0.5 mL 10 mg/mL 萘酚 AS-MX 磷酸盐溶液和 50 mL 1.6 mM Fast Red Violet LB 储备溶液在 50 mM 酒石酸钠中)。
注意: 工作溶液现在可以在通风橱外使用。它可以存放在冰箱中(用箔纸包裹)长达一个月。与抗体或其他对固定剂敏感的试剂分开存放。尽可能远离光线。 - 可选:在PBS和0.1%Tween-20(PBS-0.1%Tw)中制备漂白溶液(在经过TRAP染色的后固定样品上)。
- 制备 0.5% 氢氧化钾 (KOH)(来自 10% 储备溶液 (w/v))和 3% 过氧化氢 (H2O2)(33% 储备溶液,储存在冰箱中)的最终浓度混合物。
- 在通风橱中将两种储备溶液混合在一起(0.5 mL 10 mg/mL 萘酚 AS-MX 磷酸盐溶液和 50 mL 1.6 mM Fast Red Violet LB 储备溶液在 50 mM 酒石酸钠中)。
- 执行样品固定。
- 在室温(RT)下将刻度固定在1x PBS中的4%PFA中,摇摆或旋转40分钟。
- 除去 4% PFA,用 PBS-0.1Tx 洗涤至少 3 次,每次洗涤 5 分钟。
- 直接移至 TRAP 染色(最佳方法)或在 PBS-0.1 Tx 中储存过夜。
- 对鳞片进行TRAP染色。
- 取出PBS-0.1 Tx溶液并加入比色TRAP工作溶液(步骤5.2.1)以完全覆盖样品(即在1.5mL微量离心管中加入1mL)。
- 在室温下孵育1-2小时,在黑暗中摇晃。
- 除去染色溶液,用PBS-0.1 Tw洗涤至少3次,每次洗涤5分钟。
- 在室温下将样品后固定在 4% PFA 中 30 分钟,在黑暗中轻轻摇晃。
- 每步用PBS-0.1 Tw洗涤3次,每次5分钟,除去PFA溶液。
注意:样品可以在4°C的黑暗中无限期地储存(在储存溶液中/安装在显微镜载玻片上)。
6. 染色鳞片的安装
- 通过向6g甘油中加入2.4g Mowiol 4-88晶体来制备封固剂(参见 材料表)。可以使用任何首选的安装介质。
- 加入 6 mL 去离子水,在磁力搅拌器上放置一个小时。
- 加入12mL的0.2M Tris(pH 8.5),并在约53°C下孵育至Mowiol晶体完全溶解。
- 通过在室温下以2000× g 离心20分钟来澄清溶液。
- 将解决方案传输到存储容器。封装介质可以在冰箱中保存约 12 个月。解冻后的 Mowiol 溶液可稳定保存长达 1 个月。
- 将鳞片安装在显微镜载玻片上,安装介质,用盖玻片盖住它们并在显微镜下观察它们。
7. 鳞片 的离体 培养
注:此步骤改编自 de Vrieze 等人 12。
- 在无菌环境中收获鳞片之前,准备成骨培养基和培养板。
- 成骨培养基 (OCM):在无菌离心管中,在标准细胞培养基(高葡萄糖、无谷氨酰胺、无酚红)中制备 15 mL OCM,终浓度为 1% 牛犊血清、1%(200 mM L-丙氨酰-L-谷氨酰胺二肽在 0.85% NaCl 中的溶液)、1% 抗生素/抗真菌溶液 (100x) 溶液、4 mM CaCl2、10 mM β-甘油磷酸盐、1 nM 丙酮酸钠和 1% 两性霉素 B(可选)(参见 材料表)。
- 将OCM倒入无菌试剂储液器中,并使用多通道移液管向96孔板的每个孔中加入100μL。
- 密封 96 孔板并储存板。OCM可以在冰箱中短期储存(过夜至1周),并在使用前保持在28°C。
- 进行鳞片收集和PBS清洗。
- 使用无菌镊子/镊子收获鳞片,并将其存放在含有无菌PBS溶液的培养皿中。
- 执行板设置。
- 使用无菌镊子将每个刻度从培养皿转移到96孔板上的每个孔中,用100μLOCM(加热至28°C)。
- 将所有鳞片转移到板上后,将板置于体视显微镜下。使用精细的无菌移液器吸头将每个刻度轻轻移动到孔底部,并使其远离孔的侧面,以避免在图像采集过程中出现光反射。
注意:仅当执行实时成像时,才需要此步骤。 - 小心地将板转移到培养箱或实时成像系统(LIS,参见 材料表)(设定在28°C,5%CO2)中,在那里鳞片可以培养长达7天。
- 刷新 OCM(可选)。
- 将存放在冰箱中的OCM加热至28°C。
- 小心地将 96 孔板转移到无菌环境中。使用多通道移液器,从每个孔中吸出 50 μL。为此,请将尖端压在墙壁上,不要将它们浸入底部,以避免吸气/移动/移除鳞片。针对不同条件使用新提示。
- 将 OCM 倒入无菌试剂储液槽中,并使用多通道移液器向每个孔中加入 60 μL OCM。
- 将板放在立体显微镜下,检查是否有放错位置的鳞片(离壁太近、漂浮或介质内的垂直位置)。如果需要,用细小的无菌移液器吸头重新定位它们。
- 将板放回培养箱/LIS中。
注意:如果实验涉及昼夜节律 (CR),请勿刷新培养基,因为血清休克会影响生物钟。请注意,如果研究 CR 注意到光照条件也会重置时钟。
- 进行培养后鳞片染色和成像(可选)。
- 培养 6 天后,固定它们并指导它们进行适当的染色,例如上面提到的 von Kossa 和 ALP。
- 或者,如果实验鱼有荧光标签,则将板放入实时成像系统中。
注意: 如果使用实时成像系统,请确保将其设置为适合实验的温度和 CO2 水平。通常,在这项研究中,使用28°C和5%CO2 。选择适当的滤光片和成像时间点(此处使用2或4小时的间隔,足以跟踪成骨细胞迁移)和低放大倍率物镜(即4倍),以确保整个孔的均匀成像。这是因为秤往往会在井内移动,尤其是在介质变化期间。
结果
鳞片再生
通过对斑马鱼的侧面进行成像,可以使用标准荧光体视显微镜跟踪鳞片再生。图 3A 显示了 4 个月大斑马鱼鳞片再生过程中鳞片 sp7/osx 表达的变化。图3A所示的侧翼成像时间点是个体发育(收获前的原始鳞片)、收获后第2天、第4天和第10天。我们通常使用 osx(也称为 osterix 或 sp7)转基因系(作为 GFP (Tg(Ola.sp7:NLS-eGFP)19 或 mCherry Tg(osterix:mCherry-NTR)pd46)17 来跟踪骨骼系统的变化,因为它标记了造骨成骨细胞。在再生的 2 天时可以看到新形成的鳞片的早期图案。在某些情况下,这种鳞片再生的早期模式被破坏,特别是在骨骼突变体中。通过跟踪再生进度,可以分析再生的能力和速率。在鳞片收获日,可以在使用相同的体视显微镜进行侧翼成像后对收获的鳞片进行单独成像,如图3B所示。与第 0 天个体发育鳞片相比,再生鳞片具有更高的 osx 表达,因为新骨形成需要成骨细胞。
体外 规模培养
虽然人们可以通过跟踪鱼侧翼的再生过程来研究从头骨形成过程,但我们也可以使用这个模型通过用手术刀在鳞片上造成损伤来研究离 体 鳞片培养骨骼损伤的修复和愈合。使用实时成像系统,可以实时跟踪维修情况。图 4 显示了 3 天内个体发育规模损伤愈合反应的代表性结果,该培养物用 osx:mCherry 标记了成骨细胞。培养开始时的插图显示的损伤部位显示成骨细胞和鳞片环之间有明显的间隙(图4A)。人们可以通过延时成像监测成骨细胞向损伤部位的迁移。培养3天后,间隙的宽度减小,在间隙和新形成的鳞片环之间可以看到osx 的表达(图4B)。此外,就成骨细胞的形状而言,形态在培养开始时更加圆形,3天后更加细长。成骨细胞外观的这种变化可能是由于在培养中而不是在其自然环境中(附着在鱼身上)。
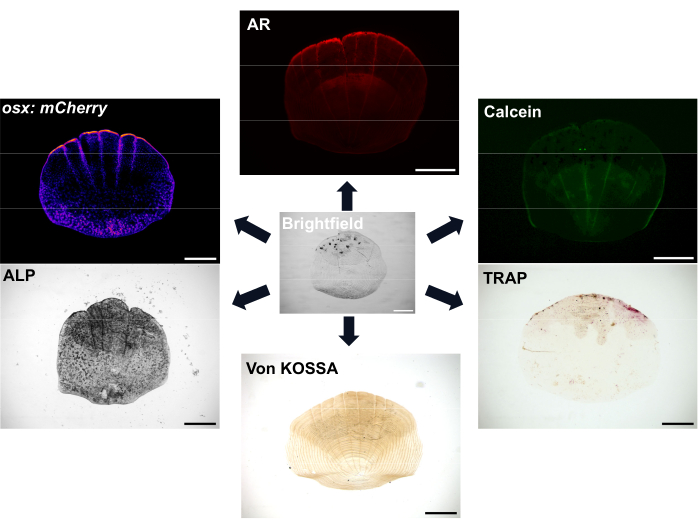
图 1:秤的成像选项示例。 成骨细胞可以用 osx/sp7 转基因报告细胞系(在 GFP 或 mCherry 中)可视化。ALP染色可用于显示成骨细胞活性。TRAP染色可以显示破骨细胞的活性。茜素红(AR)和钙黄绿素都是可用于活鱼的染料;AR 标记矿化,钙黄绿素标记新形成的骨骼。矿化程度也可以用 von Kossa 染色显示。比例尺:500μm。 请点击这里查看此图的较大版本.
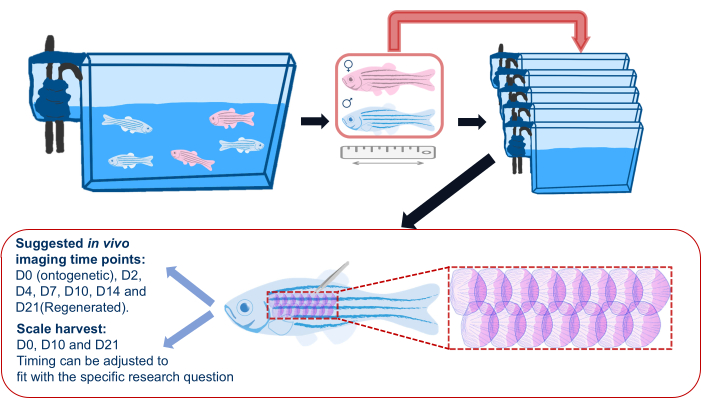
图 2:鳞片再生实验示意图。 鳞片再生实验的通用示意图,显示在实验前将鱼分成单独的水箱。记录身长、性别和健康状况。该示意图还显示了鱼侧翼上的建议区域,以收获鳞片和建议的成像时间点。 请点击这里查看此图的较大版本.
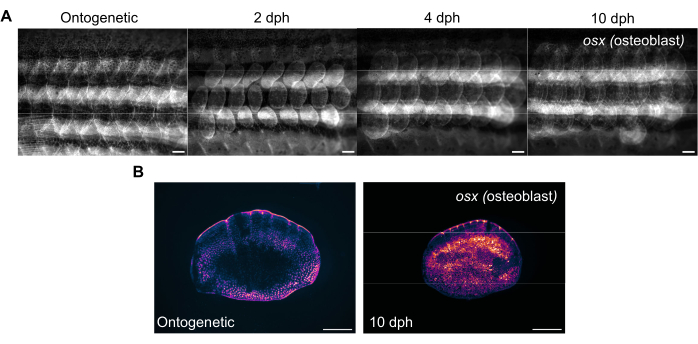
图 3:从 4 个月大的斑马鱼身上采集的鳞片再生过程中 的 osterix 表达(可视化成骨细胞)的代表性图像。 (A) 在第 0 天(收获前、个体发育鳞片)、2 dph(收获后天)、第 2 天、4 dph 和 10 dph 捕获的侧翼图像,用于跟踪 osx 表达的变化。比例尺:1 mm。 (B) 个体发育鳞片和 10 dph 鳞片的代表性图像,取自与图 (A) 中的同一条鱼。请注意 osx 表达水平的增加,如再生刻度中心的洋红色所示。比例尺:500μm。 请点击这里查看此图的较大版本.
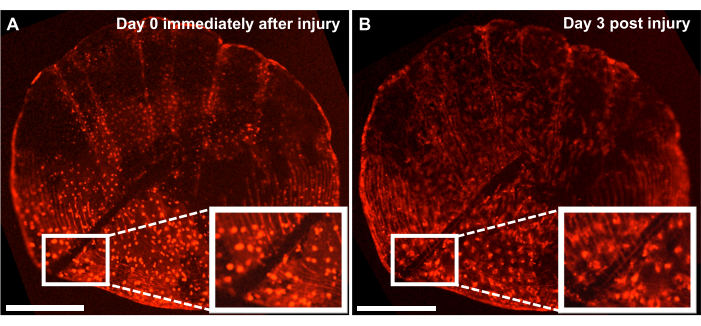
图 4:使用实时成像系统从 4 个月大的斑马鱼身上捕获的个体发育规模骨骼损伤修复反应的代表性结果。 (A) 在培养物收获的同一天(时间点 0/day0)用手术刀造成的损伤的个体发育鳞片。(B) 受伤后 3 天显示相同的量表。插图显示了受伤区域。比例尺:500μm。 请点击这里查看此图的较大版本.
讨论
斑马鱼的弹性鳞片作为骨骼研究的新模型,具有帮助我们理解骨骼维护、再生和损伤修复的巨大潜力。鱼类上鳞片的丰富性允许中高通量化合物筛选,同时减少使用的动物数量并限制个体内变异。在这里,提出了鳞片再生和离体鳞片培养的方案,以研究再生和修复。
遵循此协议时需要考虑一些关键步骤。小心去除鳞片是必不可少的,特别是当使用转基因报告细胞系来限制收获对细胞群造成的干扰时。如果要与个体发育鳞片进行比较,请确保该区域不包含自发再生的鳞片(这些鳞片可以在鱼的一生中自然发生)。确保离 体 培养的环境和设备是无菌的,以实现最佳的细胞存活和最小的培养感染。
根据具体的研究问题,可以对方案进行调整,例如结合不同的转基因报告细胞系,以在再生和修复过程中可视化其他细胞类型的基因表达谱11,14。
人们可以在秤上进行广泛的染色,这意味着对于每种测试的化合物或条件,人们可以从不同的角度观察其对骨骼的影响;sp7/osx 报告基因可以显示成骨细胞数量,ALP 染色可以显示成骨细胞活性,TRAP 染色可以显示破骨细胞活性,钙黄绿活染色可以标记新形成的骨,茜素红色或 von Kossa 染色可以显示鳞屑矿化。荧光素酶活性也可用于定量成骨细胞12。结合这些染色技术,人们可以了解成骨细胞和破骨细胞对给定骨效应的相对贡献。鳞片缺乏骨细胞,骨细胞在哺乳动物骨骼中普遍存在,是骨机械感觉反应的主要驱动因素;该模型中的鳞屑修复和再生主要由成骨细胞驱动,随后由破骨细胞重塑 8,9。需要注意的是,个体和年龄组之间存在差异 20.为了尽量减少这种情况,鳞片捕捞区域必须恒定,因为不同的位置会产生不同的鳞片形态,并且使用来自同一兄弟群体的鱼,以便年龄和大小一致。然而,由于每条鱼可以收获多个鳞片,因此可以使用更少的鱼进行更多的实验,从而减少个体内部的变异性。
总之,这些协议显示了可应用于个体发育和再生尺度的实验技术。总之,弹性鳞片作为骨骼模型显示出巨大的潜力,有助于理解骨骼的形成和修复;并将有助于减少动物在高通量骨合成代谢化合物筛选中的使用。
披露声明
作者没有需要披露的利益冲突。
致谢
我们要感谢动物服务部门的马修·格林(Mathew Green)和沃尔夫森生物成像中心的凯蒂·杰普森(Katy Jepson)。CLH、DB 和 QT 由 Versus Arthritis 资助(CLH 高级奖学金 21937,DB 和 QT 中级奖学金 22044),RR 由 (NHMRC APP1158758) 资助。这项工作也得到了BBSRC赠款(BB/T001984/1)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffered saline (PBS) | Gibco | 70013-016 | PBS |
| 12-Multichanel Pipette | Sartorius | 728230 | Multichanel pipette, Proline Plus Mechanical Pipette, 12 Channel, , 10-100 µL. |
| 15 mL Centrifuge tubes | Corning | 430791 | Centrifuge tube, CentriStar Cap, Polypropylene, RNAse/DNAse free, Non-pyrogenic |
| 4% Paraformaldehyde (PFA) | Sigma | P6148 | PFA |
| Alizarin red | Sigma | A5533 | |
| Amphotericin B | ThermoFisher Scientific | 15290026 | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher Scientific | 11772644 | Sealing film |
| Calcein powder | Sigma | C0875 | |
| Calcium Chloride | Thermo Scientific | L13191.30 | |
| Corning 96 well plate | Corning | 3596 | 96-well-plate, Clear, Flat Bottom Polystyrene TC-treated Microplates, Individually Wrapped, with Lid, Sterile |
| Cover slips | VWR | 631-0146 | |
| Cytiva HyClone Iron-Supplemented Calf Serum | Fisher Scientific | SH30072.03 | |
| Danieau | Sigma | ||
| DMEM | Life Technologies | 31053 | |
| Falcon tubes | Corning | 430828 | |
| Fast Red Violet LB stock solution | Sigma | F3381 | |
| GlutaMAX Supplement | Life Technologies | 35050 | |
| Glycerol | Sigma | 81381 | |
| Hepes | Sigma | H3375 | |
| Incubator | X | Incubator, Set up to 28 °C and 5% CO2 | |
| IncuCyte Zoom | Sartorious | X | Live Imaging System, Set up to 28 °C and 5% CO2 |
| Leica stereomicroscope | X | Sterioscope | |
| L-tartrate dibasic dihydrate | Sigma | 228729 | |
| Mgcl2 | BDH Laboratory Sup. | 261237T | |
| Microscope slides | Epredia | J2800AMNZ | |
| Mowiol 4-88 | Sigma | 9002-89-5 | |
| MQ water | X | ||
| N, N’-dimethylformamide (Merck: D4451) | Merck | D4451 | |
| NaCL | Fisher Chemical | S/3120/53 | |
| Naphthol AS-MX phosphate | Merck | N4875 | |
| NBT/BCIP solution | Sigma | #000000011681451001 | |
| Penicillin-Streptomycin | Life Technologies | 15140 | |
| Petri Dishes | Corning | 430589 | 35 mm sterile Petri dish, Non-treated, Nonpyrogenic, Polystyrene. |
| Reagent Reservoir | Startub | E2310-1025 | 25mL Reagent Reservoir |
| Silver nitrate | Sigma | 209139 | |
| Sodium acetate | Sigma | 52889 | |
| Sodium beta-glycerophosphate pentahydrate | Thermo Scientific | L03425.14 | |
| Sodium pyruvate solution | Sigma | S8636 | |
| Sodium tartrate | Sigma | S4797 | |
| Sodium thioculphate | Sigma | 563188 | |
| Tricaine methane sulfonate (MS222) | Sigma | E10521 | |
| Tris | Sigma | 252859 | |
| Triton-X100 | Sigma | T8787 | |
| Tween-20 | SLS | CHE3852 | |
| Tweezers Number 5 | Dumont | 500341 | Tweezer, INOX, biology grade |
| Zebrafish tanks | Tecniplast | ZB30BCP | 3.5 L - 28 cm x 11 cm x 17 cm |
| Zebrafish tanks | Tecniplast | ZB30BCP | 1 L - 28 cm x 7 cm x 11 cm |
参考文献
- Tobias, J. H., et al. Opportunities and challenges in functional genomics research in osteoporosis: report from a workshop held by the causes working group of the osteoporosis and bone research academy of the Royal Osteoporosis Society on October 5th 2020,". Frontiers in Endocrinology. 11, (2021).
- Busse, B., Galloway, J. L., Gray, R. S., Harris, M. P., Kwon, R. Y. Zebrafish: An emerging model for orthopedic research. Journal of Orthopaedic Research. 38 (5), 925-936 (2020).
- Dietrich, K., et al. Skeletal biology and disease modeling in zebrafish. Journal of Bone and Mineral Research. 36 (3), 436-458 (2021).
- McGowan, L. M., Kague, E., Vorster, A., Newham, E., Cross, S., Hammond, C. L. Wnt16 elicits a protective effect against fractures and supports bone repair in zebrafish. JBMR Plus. 5 (3), 10461 (2021).
- Sehring, I., Weidinger, G. Zebrafish fin: Complex molecular interactions and cellular mechanisms guiding regeneration. Cold Spring Harbor Perspectives in Biology. 14 (7), 040758 (2022).
- Bergen, D. J. M., Kague, E., Hammond, C. L. Zebrafish as an emerging model for osteoporosis: a primary testing platform for screening new osteo-active compounds. Frontiers in Endocrinology. 10 (6), (2019).
- Aman, A. J., Fulbright, A. N., Parichy, D. M. Wnt/β-catenin regulates an ancient signaling network during zebrafish scale development. Elife. 7, 37001 (2018).
- Iwasaki, M., Kuroda, J., Kawakami, K., Wada, H. Epidermal regulation of bone morphogenesis through the development and regeneration of osteoblasts in the zebrafish scale. Developmental Biology. 437 (2), 105-119 (2018).
- Metz, J. R., de Vrieze, E., Lock, E. J., Schulten, I. E., Flik, G. Elasmoid scales of fishes as model in biomedical bone research. Journal of Applied Ichthyology. 28 (3), 382-387 (2012).
- Cox, B. D., De Simone, A., Tornini, V. A., Singh, S. P., Di Talia, S., Poss, K. D. In toto imaging of dynamic osteoblast behaviors in regenerating skeletal bone. Current Biology. 28 (24), 3937-3947 (2018).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders,". Frontiers in Endocrinology. 11, (2020).
- de Vrieze, E., Zethof, J., Schulte-Merker, S., Flik, G., Metz, J. R. Identification of novel osteogenic compounds by an ex-vivo sp7: Luciferase zebrafish scale assay. Bone. 74, 106-113 (2015).
- De Vrieze, E., Moren, M., Metz, J. R., Flik, G., Lie, K. K. Arachidonic acid enhances turnover of the dermal skeleton: Studies on zebrafish scales. PLoS One. 9 (2), 89347 (2014).
- Bergen, D. J. M., et al. Regenerating zebrafish scales express a subset of evolutionary conserved genes involved in human skeletal disease. BMC Biology. 20 (1), 21 (2022).
- Bergen, D. J. M., et al. High bone mass disorders: New insights from connecting the clinic and the bench. Journal of Bone and Mineral Research. , (2022).
- Pasqualetti, S., Banfi, G., Mariotti, M. Osteoblast and osteoclast behavior in zebrafish cultured scales. Cell and Tissue Research. 350 (1), 69-75 (2012).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Developmental Cell. 22 (4), 879-886 (2012).
- Ethiraj, L. P., Fong, E. L. S., Liu, R., Chan, M., Winkler, C., Carney, T. J. Colorimetric and fluorescent TRAP assays for visualising and quantifying fish osteoclast activity. European Journal of Histochemistry. 66 (2), 3369 (2022).
- DeLaurier, A., et al. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505 (2010).
- Carnovali, M., Banfi, G., Mariotti, M. Age-dependent modulation of bone metabolism in zebrafish scales as new model of male osteoporosis in lower vertebrates. Geroscience. 43 (2), 927-940 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。