Method Article
Rigenerazione delle squame di zebrafish in toto e cultura delle squame ex vivo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive la raccolta e la visualizzazione delle squame elasmoidi del pesce zebra durante la rigenerazione in vivo . Inoltre, viene presentata la coltura ex vivo di queste scaglie fino a 7 giorni dopo la raccolta.
Abstract
Le malattie scheletriche sono spesso complesse nella loro eziologia e colpiscono milioni di persone in tutto il mondo. A causa dell'invecchiamento della popolazione, c'è bisogno di nuove terapie che potrebbero alleggerire il carico sui sistemi sanitari. Poiché queste malattie sono complesse, è difficile e costoso modellare accuratamente la fisiopatologia ossea in un ambiente di laboratorio. La sfida per il campo è quella di stabilire una piattaforma economicamente vantaggiosa e biologicamente rilevante per la modellazione delle malattie ossee che possa essere utilizzata per testare potenziali composti terapeutici. Tale piattaforma dovrebbe idealmente consentire la visualizzazione dinamica dei comportamenti cellulari degli osteoblasti che costruiscono l'osso e degli osteoclasti che degradano l'osso che agiscono nel loro ambiente di matrice mineralizzata. I pesci zebra sono sempre più utilizzati come modelli a causa della disponibilità di strumenti genetici, comprese le linee reporter transgeniche, e del fatto che alcuni tessuti scheletrici (comprese le squame) rimangono traslucidi fino all'età adulta, consentendo opzioni di imaging dinamico. Poiché le squame di zebrafish hanno sia osteoblasti che osteoclasti e sono molto abbondanti, forniscono una risorsa facilmente accessibile e abbondantemente disponibile di unità ossee indipendenti. Inoltre, una volta rimosse, le squame adulte di zebrafish si rigenerano completamente, offrendo quindi un modo per studiare la crescita spazio-temporale del tessuto mineralizzato in vivo. Qui descriviamo in dettaglio i protocolli per la raccolta e il monitoraggio della rigenerazione delle squame. Infine, viene presentato anche un protocollo per la coltura stabile di scaglie ex vivo per una settimana e a seguito della risposta di guarigione dopo un danno controllato alla matrice mineralizzata della cocciniglia nel tempo.
Introduzione
L'osso è un tessuto connettivo duro che costituisce una parte importante dello scheletro, consentendo la locomozione e agendo come riserva minerale nel corpo. Al fine di mantenere l'osso sano, uno squisito equilibrio tra la formazione e la degradazione ossea è essenziale attraverso l'attività accoppiata degli osteoblasti (che sono anabolizzanti) e degli osteoclasti (che riassorbono l'osso). Questo equilibrio è interrotto dall'invecchiamento o dallo squilibrio ormonale, che spesso porta a malattie da fragilità ossea come l'osteoporosi1. Sebbene i farmaci esistenti siano stati approvati per colpire le malattie da fragilità ossea, molti hanno effetti collaterali; Pertanto, c'è bisogno di nuove terapie1. Pertanto, rimane la necessità di abbondanti fonti di tessuto osseo biologicamente rilevante che possano essere utilizzate per testare potenziali composti terapeutici.
Tradizionalmente, i modelli di roditori e i sistemi di coltura cellulare sono stati utilizzati per studiare la biologia ossea. Tuttavia, il pesce zebra sta diventando sempre più un altro modello di scelta. Pur non essendo un sistema di mammiferi, il pesce zebra offre alcuni vantaggi per la ricerca sulle ossa rispetto ai roditori; Questi includono la loro fecondità e la traslucenza delle larve; Anche in età adulta, alcuni tessuti scheletrici, tra cui le squame e le pinne, rimangono traslucidi, consentendo l'imaging in vivo ad alta risoluzione e una maggiore disponibilità di mutanti scheletrici 2,3. Sia le pinne che le squame del pesce zebra sono in grado di rigenerarsi completamente dopo la rimozione. La rigenerazione scheletrica e la riparazione delle lesioni delle pinne del pesce zebra sono state ampiamente studiate 4,5, mentre le squame di pesce zebra sono un modello osseo più recente sul campo, ma offrono vantaggi per la coltura ex vivo 6.
Le squame sono molto abbondanti, con almeno 300 squame su ogni pesce che fungono da copertura protettiva per il pesce. Ogni squama è una piccola placca mineralizzata costituita da osteoblasti che formano l'osso e osteoclasti che riassorbono l'osso di una matrice scheletrica ricca di collagene7. Il processo di ossificazione sia delle squame di zebrafish che delle ossa umane richiede la differenziazione delle cellule staminali mesenchimali in osteoblasti per formare la matrice mineralizzata. Le squame di zebrafish offrono un grande vantaggio per la ricerca scheletrica con la loro forte capacità rigenerativa che può essere utilizzata per studiare la rigenerazione e la riparazione ossea. Tuttavia, nonostante la presenza sia di osteoblasti che di osteoclasti, le squame di zebrafish mancano di osteociti che sono importanti per il rimodellamento osseo umano e la meccanosensazione; La posizione superficiale delle squame fa sì che possano essere facilmente rimosse con un paio di pinze. Dopo la rimozione della scala, si verifica una cascata di eventi e inizia la rigenerazione della scala 8,9. Sono disponibili varie opzioni di colorazione e imaging per visualizzare l'attività degli osteoblasti e degli osteoclasti e la mineralizzazione delle squame, come mostrato nella Figura 1. Inoltre, la disponibilità di molte linee reporter transgeniche fluorescenti rilevanti di zebrafish significa che è possibile visualizzare le dinamiche cellulari durante la rigenerazione 7,10,11. Questo processo consente di ottenere una maggiore comprensione della formazione ossea de novo osservando il modello precoce di rigenerazione delle squame sul fianco del pesce per studiare la morfologia, l'attività cellulare e i profili genetici di queste squame rigenerate. La biologia della formazione e della rigenerazione delle incrostazioni è stata ben caratterizzata. È importante sottolineare che le squame possono mostrare una buona capacità predittiva per i composti terapeuticamente rilevanti12 e il trattamento dei pesci con glucocorticoidi porta a una scala che si rigenera per mostrare fenotipi osteoporotici13. Il trascrittoma delle squame rigeneranti mostra che i geni attivati nella rigenerazione delle scaglie sono arricchiti per quelli legati a malattie scheletriche umane, dimostrando ulteriormente la loro rilevanza come sistema modello 6,14.
Infine, queste squame possono essere coltivate ex vivo per un massimo di 7 giorni. Rispetto alle colture di linee cellulari che sono tipicamente composte da un singolo tipo di cellula, la coltura su scala ex vivo offre opportunità di studio osseo in vitro all'interno del suo ambiente naturale contenente sia osteoblasti che osteoclasti con la sua matrice extracellulare naturale 8,12,15,16.
La coltura su scala ci consente anche di eseguire lo screening farmacologico per nuovi bersagli osteoanabolizzanti. L'abbondanza di squame sul pesce significa che si possono riempire almeno due piastre della piastra a 96 pozzetti da un solo pesce, consentendo lo screening del composto in un formato multipozzetto in cui ogni singolo pozzetto contiene una squama insieme alla sua nicchia naturale di cellule. Inoltre, poiché le squame sono sottili, l'assorbimento del farmaco è prevedibile12. In sintesi, le scaglie elasmoidi del pesce zebra hanno un grande potenziale nella ricerca scheletrica e possono aiutarci a ottenere maggiori informazioni sugli eventi cellulari durante la formazione e la riparazione ossea. Qui descriviamo i protocolli per la raccolta delle scaglie per seguire la rigenerazione in vivo e coltivare le cocciniglie ex vivo.
Protocollo
L'Unità Scientifica Universitaria per gli Animali (ASU) è responsabile della cura del pesce zebra sotto la guida delle linee guida per l'allevamento del pesce zebra. Tutte le procedure, tra cui la raccolta delle incrostazioni, la colorazione delle ossa vive e l'imaging dal vivo, sono state approvate ed eseguite con una licenza di progetto del Ministero degli Interni del Regno Unito (PP4700996). Per questo manoscritto è stato utilizzato un pesce zebra transgenico giovane adulto della linea sp7:mCherry [Tg(osterix:mCherry-NTR)pd46]17. Il pesce comprendeva sia maschi che femmine di 4 mesi.
1. Rigenerazione su scala in vivo
- Prima di iniziare l'esperimento di rigenerazione delle incrostazioni, trasferire i pesci zebra dalle loro vasche principali alle vasche individuali (vedere la tabella dei materiali) e tornare a queste singole vasche dopo l'imaging durante l'esperimento, come mostrato nella Figura 2. Questo per garantire che tutte le scaglie rigeneranti siano quelle raccolte per l'esperimento; L'alloggio in gruppo può portare a una sporadica perdita di squame a causa di lesioni causate da altri pesci.
NOTA: I pesci sono posizionati singolarmente per evitare combattimenti e la successiva perdita di squame tra i pesci. - Registrare le informazioni per ogni pesce dell'esperimento (ad esempio, genotipo, età e sesso) in base al disegno dell'esperimento. Usa una fotocamera (le fotocamere degli smartphone funzionano bene) per scattare un'immagine di ogni pesce accanto a un righello per registrare le dimensioni/lunghezza e le condizioni di salute del pesce.
- Il giorno dell'esperimento, anestetizzare il pesce zebra utilizzando tricaina metano solfonato allo 0,05% (v/v) (MS222, vedi Tabella dei materiali) per immersione, quindi posizionarlo su una capsula di Petri con un tessuto umido per evitare il movimento del pesce durante l'imaging o la raccolta.
- Posiziona il pesce su un lato (in genere qui viene utilizzato il fianco sinistro per coerenza). Eseguire l'imaging del fianco utilizzando uno stereomicroscopio con un ingrandimento appropriato (tipicamente, 2x, 4x e/o 6,3x e 8x sono stati utilizzati per il presente studio per catturare sia l'area di rigenerazione complessiva che l'area ingrandita per un'osservazione dettagliata).
NOTA: I timepoint dell'imaging del fianco dipendono dallo scopo sperimentale e dalla scelta dei reporter transgenici. Ad esempio, per monitorare gli osteoblasti durante la rigenerazione delle incrostazioni, i punti temporali suggeriti sono Giorno 0 (ontogenetico), 2 giorni dopo il prelievo (dph), 4 dph, 7 dph, 10 dph, 14 dph, 21 dph. Per ridurre gli effetti dell'anestesia ripetuta, mantenere i timepoint di imaging al minimo richiesto per l'esperimento. - Raccogli le scaglie usando pinzette sottili e pinze sotto lo stereomicroscopio. Trasferire le squame raccolte in provette di raccolta per la successiva colorazione delle incrostazioni.
NOTA: Il numero massimo di scaglie che possono essere raccolte dipenderà dalle approvazioni etiche locali in vigore. In genere raccogliamo da 20 a 30 cocciniglie e le raccogliamo in singole provette di raccolta per la successiva colorazione delle cocciniglie, come ALP, von Kossa14. - Raccogliere le squame in una provetta di raccolta da 1,5 mL o 2 mL. Questo dipende dalla tecnica di colorazione utilizzata.
- Sia per la colorazione ALP che per la colorazione di von Kossa, trasferire le incrostazioni in provette di raccolta contenenti acqua deionizzata, mentre per la colorazione TRAP o l'immunoistochimica, trasferire le incrostazioni in provette di raccolta contenenti il 4% di PFA (soluzione di fissaggio).
- Opzionale: prima di trasferire le squame nelle provette, acquisire immagini delle singole scaglie raccolte, se necessario.
NOTA: I punti temporali suggeriti per la raccolta delle cocciniglie sono il giorno 0 (ontogenetico), il giorno 10 e il giorno 21 (cocciniglie rigenerate).
2. Colorazione dell'osso vivo
NOTA: La colorazione scheletrica viva può essere eseguita sia quando i pesci da esperimento non sono transgenici per i reporter fluorescenti sia quando trasportano reporter transgenici monocolore. La colorazione viva può essere utilizzata per integrare i transgenici; ad esempio, si potrebbe usare un reporter per osteoblasti come sp7/osx in un colore (ad esempio, GFP), quindi colorare l'osso in rosso con il rosso di alizarina (AR). AR e calceina verde possono essere utilizzati per lo stesso pesce insieme; in questo scenario, l'AR viene utilizzato per marcare l'osso originale o ontogenetico legandosi alla matrice mineralizzata dell'osso invecchiato e la calceina si lega agli ioni calcio che sono abbondanti nell'osso di nuova formazione. Ad esempio, quando si colora una scala ontogenetica, l'AR può essere visualizzata, ma il verde calceina può essere assente o minimo poiché le scale ontogenetiche hanno bassi livelli di formazione di nuovo osso.
- Eseguire la colorazione dal vivo con Alizarin Red (AR).
- Preparare un flacone di 2 soluzioni coloranti AR mescolando una soluzione di alizarina allo 0,5% (p/v) (10 ml) con 10 mL di HEPES (concentrazione finale, 10 mM) (vedere la tabella dei materiali).
- Rabboccare fino a 1 L con 1x soluzione Danieau (vedi Tabella dei materiali). La soluzione deve essere conservata al buio o avvolta in un foglio.
- Il giorno dell'esperimento, portare 500 ml di soluzione AR 2x nella struttura zebrafish e aggiungere 500 ml di acqua di sistema (dall'acquario) per creare una soluzione AR funzionante.
- Trasferire i pesci dalle loro vasche in una soluzione colorante AR funzionante 1x e lasciare agire per 15-20 minuti. Lavare via la macchia in eccesso sul pesce con 15 minuti di "lavaggio" nell'acqua del sistema.
- Eseguire la colorazione dal vivo Calcein Green.
- Preparare un flacone di 2x soluzione colorante Calcein Green aggiungendo 45 mg di polvere di Calceina in 900 mL di 1x soluzione Danieau (vedere Tabella dei materiali). Utilizzare un agitatore magnetico per consentire alla polvere di dissolversi completamente.
- Regolare il pH a 8. Questa è la soluzione Calcein Green 2x stock. La soluzione può essere conservata al buio/avvolta con un foglio per un massimo di 1 mese.
- Il giorno dell'esperimento, portare 500 ml di soluzione 2x Calcein Green nella struttura zebrafish e aggiungere 500 mL di acqua di sistema per fare 1x soluzione Calcein Green funzionante. Si consiglia di utilizzare una soluzione colorante di Calceina appena preparata.
- Trasferire i pesci dalle loro vasche in 1x soluzione colorante Calcein Green funzionante e lasciare agire per 1-2 ore. A seconda delle dimensioni del pesce, potrebbe essere necessario un tempo di colorazione più lungo.
- Lavare via la macchia in eccesso sul pesce entro 15 minuti di "lavaggio" nell'acqua del sistema.
NOTA: Immagina il pesce macchiato di Calcein Green il prima possibile poiché questa macchia svanirà in poche ore.
3. Colorazione della fosfatasi alcalina (ALP) sulle squame dopo la raccolta
- Preparare la soluzione colorante ALP mescolando 100 mM Tris (pH 9,5 con HCl) con 100 mM di NaCl e 50 mM di MgCl2.
- Utilizzare una soluzione madre NBT/BCIP disponibile in commercio (vedere la tabella dei materiali).
- Trasferire le incrostazioni in provette contenenti acqua deionizzata.
- Sciacquare le squame in una soluzione colorante ALP per 5 minuti.
- Nel frattempo, preparare una soluzione colorante di lavoro aggiungendo 200 μL della soluzione NBT/BCIP a 10 mL di tampone colorante ALP. Questo deve essere preparato al momento della colorazione.
- Colorare le squame con la soluzione colorante ALP di lavoro per 15 min.
- Arrestare la reazione sciacquando le incrostazioni con acqua deionizzata.
4. Colorazione di Von KOSSA sulle squame dopo la raccolta
- Preparare una soluzione di nitrato d'argento al 5% (p/v).
- Preparare una soluzione di tiosolfato di sodio al 5% (p/v).
- Trasferire le scaglie raccolte in provette contenenti acqua deionizzata.
- Incubare le squame nella soluzione di nitrato d'argento per 40 minuti sotto una luce intensa.
NOTA: Indossare i DPI (dispositivi di protezione individuale) poiché il nitrato d'argento lascia una macchia difficile da rimuovere. - Lavare la bilancia due volte per 5 minuti con acqua deionizzata.
NOTA: I rifiuti di nitrato d'argento devono essere raccolti e smaltiti secondo le linee guida locali. - Incubare le squame nel tiosolfato di sodio per 5 min.
- Lavare la bilancia due volte per 5 minuti con acqua deionizzata.
5. Colorazione colorimetrica TRAP
NOTA: Per la procedura dettagliata, si rimanda ai lavori pubblicati in precedenza18.
- Preparare le soluzioni coloranti.
- Preparare 10 mg/mL di soluzione di naftolo fosfato AS-MX.
- Pesare 5 mg di naftolo fosfato AS-MX (vedere la tabella dei materiali).
- Nella cappa aspirante, preparare una provetta con 0,5 mL di N, N'-dimetilformammide e sciogliere 5 mg di naftolo AS-MX fosfato in 0,5 mL di N, N'-dimetilformammide per ottenere una soluzione madre di 10 mg/mL di naftolo fosfato AS-MX (agitare delicatamente).
- Preparare 1,6 mM di soluzione madre Fast Red Violet LB in 50 mM di tartrato di sodio.
- Preparare 50 mL di acetato di sodio 0,1 M a pH 5 (aggiungere 0,41015 g di acetato di sodio in 50 mL di acqua deionizzata e regolare il pH a 5 con acido acetico al 100%).
- Sciogliere 0,575 g di L-tartrato di sodio bibasico diidrato (vedi tabella dei materiali) in 50 mL di tampone in acetato di sodio 0,1 M (pH = 5).
- Aggiungere 30 mg di sale rosso viola veloce LB.
- Preparare PBS-0.1Tx (sciogliere 500 μL di Triton-X in 500 mL di PBS).
- Preparare PBS-0.1Tw (sciogliere 500 μL di Tween-20 in 500 mL di PBS).
- Preparare 10 mg/mL di soluzione di naftolo fosfato AS-MX.
- Preparare una soluzione TRAP funzionante.
- Miscelare entrambe le soluzioni madre nella cappa aspirante (0,5 mL di soluzione fosfato AS-MX di naftolo 10 mg/mL e 50 mL di soluzione madre di 1,6 mM Fast Red Violet LB in 50 mM di tartrato di sodio).
NOTA: La soluzione di lavoro può ora essere utilizzata all'esterno della cappa aspirante. Può essere conservato in frigorifero (avvolto in un foglio) per un massimo di un mese. Conservare in contenitori separati dagli anticorpi o da altri reagenti sensibili ai fissativi. Tenere il più possibile al riparo dalla luce. - Facoltativo: preparare la soluzione sbiancante (su campioni post-fissati che sono stati colorati con TRAP) in PBS e 0,1% Tween-20 (PBS-0,1%Tw).
- Preparare una miscela di concentrazione finale di idrossido di potassio (KOH) allo 0,5% (da soluzione madre al 10% (p/v)) e perossido di idrogeno al 3% (H2O2 ) (soluzione madre al 33%, conservata in frigorifero).
- Miscelare entrambe le soluzioni madre nella cappa aspirante (0,5 mL di soluzione fosfato AS-MX di naftolo 10 mg/mL e 50 mL di soluzione madre di 1,6 mM Fast Red Violet LB in 50 mM di tartrato di sodio).
- Eseguire la fissazione del campione.
- Fissare le scale in PFA al 4% in 1x PBS oscillando o ruotando per 40 minuti a temperatura ambiente (RT).
- Rimuovere il 4% di PFA e lavare con PBS-0.1Tx almeno 3 volte per 5 minuti ciascuno.
- Passare direttamente alla colorazione TRAP (l'approccio migliore) o conservare in PBS-0.1 Tx durante la notte.
- Eseguire la colorazione TRAP delle squame.
- Rimuovere la soluzione PBS-0.1 Tx e aggiungere la soluzione di lavoro colorimetrica TRAP (passaggio 5.2.1) per coprire completamente i campioni (ad esempio, 1 mL in una provetta per microcentrifuga da 1,5 mL).
- Incubare per 1-2 ore a RT, dondolando al buio.
- Rimuovere la soluzione colorante e lavare almeno 3 volte con PBS-0.1 Tw per 5 minuti ciascuno.
- Post-fissare i campioni in PFA al 4% per 30 minuti a RT, dondolando delicatamente al buio.
- Rimuovere la soluzione di PFA lavando 3 volte con PBS-0.1 Tw per 5 minuti ogni passaggio.
NOTA: I campioni possono essere conservati (in soluzioni di conservazione/montati su vetrini da microscopio) a 4 °C al buio per un periodo indefinito.
6. Montaggio di bilance macchiate
- Preparare il mezzo di montaggio aggiungendo 2,4 g di cristalli Mowiol 4-88 a 6 g di glicerolo (vedere la tabella dei materiali). È possibile utilizzare qualsiasi supporto di montaggio preferito.
- Aggiungere 6 mL di acqua deionizzata e lasciare agire su un agitatore magnetico per un'ora.
- Aggiungere 12 mL di Tris 0,2 M (pH 8,5) e incubare a circa 53°C fino a quando i cristalli di Mowiol non si dissolvono completamente.
- Chiarificare la soluzione centrifugando a 2000 x g per 20 minuti a temperatura ambiente.
- Trasferire la soluzione in un contenitore di stoccaggio. Il mezzo di montaggio può essere conservato nel congelatore per circa 12 mesi. La soluzione Mowiol scongelata è stabile fino a 1 mese.
- Montare le bilance su un vetrino da microscopio montando il supporto, coprirle con un vetrino coprioggetto e visualizzarle al microscopio.
7. Coltura ex vivo delle squame
NOTA: Questo passaggio è adattato da de Vrieze et al.12.
- Prima di raccogliere le squame in un ambiente sterile, preparare il terreno osteogenico e la piastra di coltura.
- Terreno di coltura osteogenico (OCM): in una provetta da centrifuga sterile, preparare 15 mL di OCM in terreno di coltura cellulare standard (alto contenuto di glucosio, senza glutammina, senza rosso fenolo) alle concentrazioni finali di 1% di siero di vitello bovino, 1% (200 mM di L-alanil-L-glutammina dipeptide in NaCl allo 0,85%), soluzione antibiotica/antimicotica all'1% (100x), 4 mM di CaCl2, 10 mM di β-glicerofosfato, 1 nM di piruvato di sodio e 1 % di amfotericina B (opzionale) (vedere la tabella dei materiali).
- Versare l'OCM in un serbatoio sterile per reagenti e, utilizzando una pipetta multicanale, aggiungere 100 μL a ciascun pozzetto della piastra a 96 pozzetti.
- Sigillare la piastra a 96 pozzetti e conservare la piastra. L'OCM può essere conservato in frigorifero per un breve periodo (da una notte a 1 settimana) e conservato a 28 °C prima dell'uso.
- Eseguire la raccolta delle incrostazioni e il lavaggio PBS.
- Raccogliere le squame utilizzando pinzette/pinze sterili e depositarle in una capsula di Petri contenente una soluzione sterile di PBS.
- Eseguire l'impostazione della piastra.
- Trasferire ciascuna bilancia dalla capsula di Petri a ciascun pozzetto sulla piastra a 96 pozzetti con 100 μL di OCM (riscaldato a 28 °C) utilizzando una pinza sterile.
- Una volta che tutte le squame sono state trasferite sulla piastra, portare la piastra sotto uno stereomicroscopio. Utilizzando una punta di pipetta fine e sterile per spostare delicatamente ogni scala sul fondo del pozzetto e tenerla lontana dal lato dei pozzetti per evitare riflessi di luce durante l'acquisizione dell'immagine.
NOTA: Questo passaggio è necessario solo se si esegue l'imaging dal vivo. - Trasferire con cautela la piastra nell'incubatore o nel Live Imaging System (LIS, vedere la tabella dei materiali) (impostato a 28 °C, 5% CO2 ), dove le squame possono essere coltivate per un massimo di 7 giorni.
- Aggiorna OCM (facoltativo).
- Scaldare l'OCM conservato in frigorifero a 28 °C.
- Trasferire con cautela la piastra a 96 pozzetti in un ambiente sterile. Utilizzando una pipetta multicanale, aspirare 50 μL da ciascun pozzetto. Per questo, premere le punte contro le pareti e non immergerle fino al fondo per evitare di aspirare/spostare/rimuovere le squame. Usa nuovi suggerimenti per condizioni diverse.
- Versare l'OCM in un serbatoio sterile per reagenti e, utilizzando la pipetta multicanale, aggiungere 60 μL di OCM a ciascun pozzetto.
- Posizionare la piastra sotto lo stereomicroscopio e verificare la presenza di squame fuori posto (troppo vicino alle pareti, fluttuante o in posizione verticale all'interno del supporto). Se necessario, riposizionarli con un puntale di pipetta fine e sterile.
- Riposizionare la piastra nell'incubatrice/LIS.
NOTA: Non aggiornare il terreno se l'esperimento coinvolge il ritmo circadiano (CR), poiché lo shock sierico può influenzare l'orologio biologico. Nota: se si studia CR, si nota che le condizioni di luce azzerano anche l'orologio.
- Eseguire la colorazione e l'imaging delle incrostazioni post-colturali (opzionale).
- Dopo 6 giorni di coltura, fissarli e dirigerli per una colorazione appropriata come von Kossa e ALP di cui sopra.
- In alternativa, se i pesci sperimentali hanno un'etichetta fluorescente, inserire la piastra in un sistema di imaging dal vivo.
NOTA: Se si utilizza un sistema di imaging dal vivo, assicurarsi che sia impostato su una temperatura e un livello di CO2 appropriati per l'esperimento. Tipicamente, in questo studio, sono stati utilizzati 28 °C e il 5% di CO2 . Selezionare i filtri e i timepoint di imaging appropriati (in questo caso è stato utilizzato un intervallo di 2 o 4 ore, sufficiente per seguire la migrazione degli osteoblasti) e gli obiettivi a basso ingrandimento (cioè 4x) per garantire un'immagine uniforme dell'intero pozzetto. Questo perché le bilance tendono a muoversi all'interno dei pozzetti, in particolare durante i cambi di fluido.
Risultati
Rigenerazione delle incrostazioni
La rigenerazione delle squame può essere monitorata con uno stereomicroscopio fluorescente standard mediante imaging del fianco del pesce zebra. La Figura 3A mostra i cambiamenti nell'espressione sp7/osx delle squame durante la rigenerazione delle squame in un pesce zebra di 4 mesi. I punti temporali per l'imaging del fianco mostrati nella Figura 3A sono ontogenetici (squame originali, prima della raccolta), giorno 2, giorno 4 e giorno 10 dopo la raccolta. In genere utilizziamo linee transgeniche osx (note anche come osterix o sp7) (sia come GFP (Tg(Ola.sp7:NLS-eGFP)19 che come mCherry Tg(osterix:mCherry-NTR)pd46)17 per tenere traccia dei cambiamenti nel sistema scheletrico mentre etichetta gli osteoblasti che producono ossa. I primi modelli di squame appena formate possono essere visti dopo 2 giorni di rigenerazione. Questo modello precoce di rigenerazione delle scaglie è interrotto in alcuni casi, specialmente nei mutanti scheletrici. Monitorando l'avanzamento della rigenerazione, è possibile analizzare la capacità e la velocità di rigenerazione. Il giorno della raccolta delle cocciniglie, l'imaging individuale delle cocciniglie raccolte può essere eseguito dopo l'imaging del fianco utilizzando lo stesso stereomicroscopio, come mostrato nella Figura 3B. Le squame rigenerate hanno un'espressione osx molto più elevata rispetto alle scale ontogenetiche del giorno 0 perché gli osteoblasti sono necessari per la formazione di nuovo osso.
Coltura su scala ex vivo
Sebbene sia possibile studiare il processo di formazione ossea de novo tracciando il processo di rigenerazione sul fianco del pesce, possiamo anche utilizzare questo modello per studiare la riparazione e la guarigione delle lesioni scheletriche con la coltura ex vivo della scaglia eseguendo una lesione sulle squame con un bisturi. Utilizzando un sistema di imaging in tempo reale, la riparazione può essere monitorata in tempo reale. La Figura 4 mostra un risultato rappresentativo di una risposta di guarigione della lesione su scala ontogenetica in 3 giorni in una coltura in cui gli osteoblasti sono marcati con osx: mCherry. Il sito della lesione mostrato dai riquadri all'inizio della coltura mostra un chiaro divario tra gli osteoblasti e i circolari di cocciniglie (Figura 4A). È possibile monitorare la migrazione degli osteoblasti verso il sito della lesione con l'imaging time-lapse. Dopo 3 giorni di coltura, l'ampiezza della fessura si riduce e l'espressionedell'osx può essere vista tra la lacuna e i circolari di scala appena formati (Figura 4B). Inoltre, la morfologia in termini di forma degli osteoblasti, è più circolare all'inizio della coltura e dopo 3 giorni è più allungata. Questo cambiamento nell'aspetto degli osteoblasti è probabilmente dovuto al fatto che si trova in coltura e non nel suo ambiente naturale (attaccato al pesce).
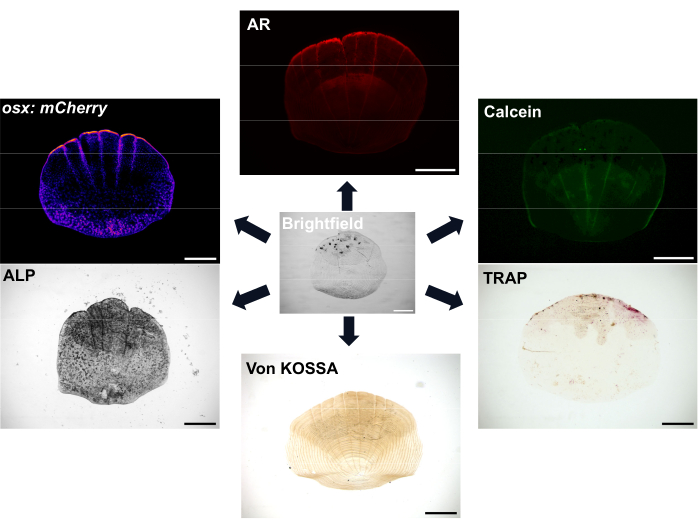
Figura 1: Esempi di opzioni di imaging per le scale. Gli osteoblasti possono essere visualizzati con linee reporter transgeniche osx/sp7 (sia in GFP che in mCherry). La colorazione ALP può essere utilizzata per mostrare l'attività degli osteoblasti. La colorazione TRAP può mostrare l'attività degli osteoclasti. Il rosso di alizarina (AR) e il verde di calceina sono entrambi coloranti che possono essere utilizzati nei pesci vivi; AR etichetta la mineralizzazione e Calcein etichetta l'osso di nuova formazione. L'entità della mineralizzazione può essere mostrata anche con la colorazione di von Kossa. Barre della scala: 500 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
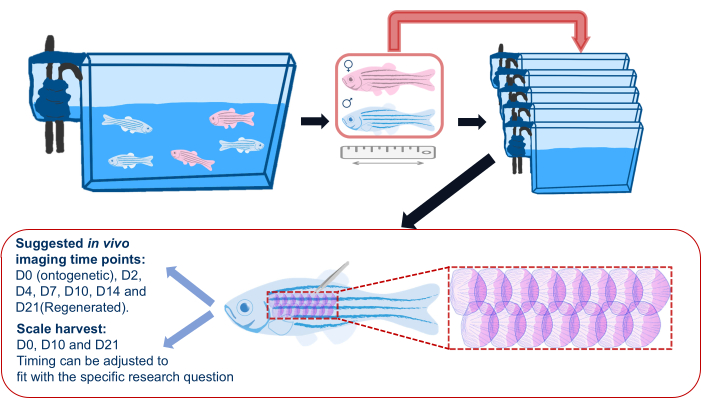
Figura 2: Illustrazione schematica di un esperimento di rigenerazione di scala. Schema generico di un esperimento di rigenerazione su scala che mostra che i pesci vengono separati in singole vasche prima dell'esperimento. Vengono registrati la durata, il sesso e la salute. Lo schema mostra anche l'area suggerita sul fianco del pesce per raccogliere le squame e i punti temporali di imaging suggeriti. Fare clic qui per visualizzare una versione più grande di questa figura.
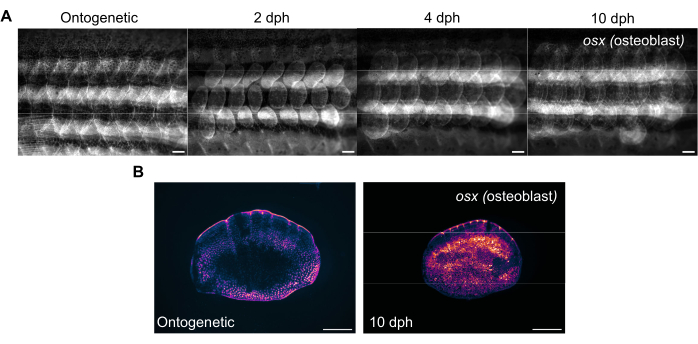
Figura 3: Immagini rappresentative dell'espressione di osterix (per visualizzare gli osteoblasti) durante la rigenerazione delle squame scattate da un pesce zebra di 4 mesi. (A) Le immagini di fianco catturate il giorno 0 (pre-raccolta, scale ontogenetiche), 2 dph (giorni post-raccolta), il giorno 2, 4 dph e 10 dph per tenere traccia dei cambiamenti nell'espressione osx . Barre della scala: 1 mm. (B) Immagini rappresentative di una scala ontogenetica e di una scala a 10 dph prese dallo stesso pesce del pannello (A). Si noti l'aumento dei livelli di espressione osx come mostrato in magenta al centro delle scale rigeneranti. Barre della scala: 500 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
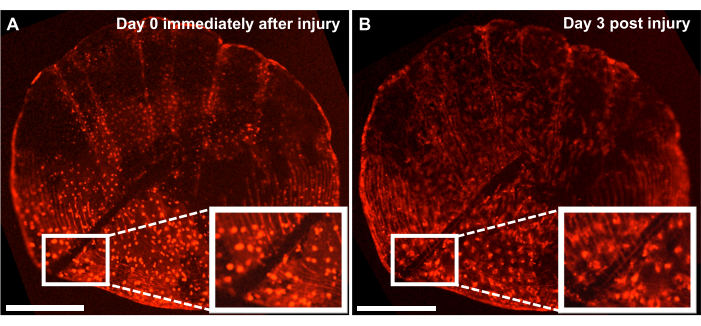
Figura 4: Risultati rappresentativi della risposta alla riparazione delle lesioni scheletriche su scala ontogenetica catturati da un pesce zebra di 4 mesi utilizzando un sistema di imaging dal vivo. (A) Scale ontogenetiche con una lesione provocata dal bisturi lo stesso giorno della raccolta (timepoint 0/day0) della coltura. (B) La stessa scala viene mostrata 3 giorni dopo l'infortunio. Il riquadro mostra la regione della lesione. Barre della scala: 500 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Le scaglie elasmoidi del pesce zebra, come nuovo modello per la ricerca scheletrica, hanno un grande potenziale per aiutare la nostra comprensione del mantenimento osseo, della rigenerazione e della riparazione delle lesioni. L'abbondanza di squame sui pesci consente uno screening dei composti a produttività medio-alta, riducendo al contempo il numero di animali utilizzati e limitando le variazioni intraindividuali. Qui, vengono presentati i protocolli per la rigenerazione delle incrostazioni e la coltura su scala ex vivo per studiare la rigenerazione e la riparazione.
Alcuni passaggi critici devono essere considerati quando si segue questo protocollo. Un'attenta rimozione delle squame è essenziale, soprattutto quando si utilizza una linea reporter transgenica per limitare il disturbo alla popolazione cellulare causato dal prelievo. Se si devono fare confronti con le squame ontogenetiche, assicurarsi che la regione non contenga squame che si rigenerano spontaneamente (che possono verificarsi naturalmente per tutta la durata della vita del pesce). Assicurarsi che l'ambiente e le attrezzature siano sterili per la coltura ex vivo per ottenere una sopravvivenza cellulare ottimale e un'infezione minima in coltura.
A seconda della specifica domanda di ricerca, possono essere apportati adattamenti al protocollo, come la combinazione di diverse linee reporter transgeniche per visualizzare altri tipi di profili di espressione genica durante la rigenerazione e la riparazione11,14.
L'ampia gamma di colorazioni che si possono eseguire sulla bilancia significa che per ogni composto o condizione testata si possono osservare i suoi effetti sull'osso da diverse angolazioni; mentre i reporter sp7/osx possono mostrare i numeri degli osteoblasti, la colorazione ALP può visualizzare l'attività degli osteoblasti, la colorazione TRAP può visualizzare l'attività degli osteoclasti, la colorazione viva verde Calceina può etichettare l'osso di nuova formazione e la colorazione rossa Alizarina o von Kossa può mostrare la mineralizzazione delle incrostazioni. L'attività della luciferasi per quantificare gli osteoblasti può essere utilizzata anche12. In combinazione con queste tecniche di colorazione, si può apprendere il contributo relativo degli osteoblasti e degli osteoclasti a un dato effetto osseo. Le squame mancano di osteociti, che sono prevalenti nelle ossa dei mammiferi e sono i principali motori della risposta meccanosensoriale ossea; La riparazione e la rigenerazione delle squame in questo modello sono guidate principalmente dagli osteoblasti con successivo rimodellamento da parte degli osteoclasti 8,9. È fondamentale notare che la variazione si verifica tra gli individui e le fasce d'età20. Per ridurre al minimo questo problema, l'area di raccolta delle cocciniglie deve essere costante, poiché luoghi diversi possono dare origine a morfologie di squame diverse, e vengono utilizzati pesci degli stessi gruppi di fratelli in modo che l'età e le dimensioni siano coerenti. Tuttavia, poiché è possibile raccogliere più squame per pesce, è possibile eseguire più esperimenti utilizzando meno pesci, riducendo la variabilità intra-individuale.
In sintesi, questi protocolli mostrano tecniche sperimentali che possono essere applicate a scale ontogenetiche e rigeneranti. In conclusione, le scaglie elasmoidi mostrano un grande potenziale come modello scheletrico per aiutare la comprensione della formazione e della riparazione ossea; e contribuirà a ridurre l'uso di animali per lo screening di composti osteoanabolizzanti ad alto rendimento.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Vorremmo ringraziare Mathew Green dell'Animal Service Unit per l'allevamento ittico e Katy Jepson del Wolfson Bioimaging Centre. CLH, DB e QT sono stati finanziati da Versus Arthritis (CLH Senior Fellowship 21937, DB and QT Intermediate Fellowship 22044), RR è stato finanziato da (NHMRC APP1158758). Questo lavoro è stato sostenuto anche dalla sovvenzione BBSRC (BB/T001984/1).
Materiali
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffered saline (PBS) | Gibco | 70013-016 | PBS |
| 12-Multichanel Pipette | Sartorius | 728230 | Multichanel pipette, Proline Plus Mechanical Pipette, 12 Channel, , 10-100 µL. |
| 15 mL Centrifuge tubes | Corning | 430791 | Centrifuge tube, CentriStar Cap, Polypropylene, RNAse/DNAse free, Non-pyrogenic |
| 4% Paraformaldehyde (PFA) | Sigma | P6148 | PFA |
| Alizarin red | Sigma | A5533 | |
| Amphotericin B | ThermoFisher Scientific | 15290026 | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher Scientific | 11772644 | Sealing film |
| Calcein powder | Sigma | C0875 | |
| Calcium Chloride | Thermo Scientific | L13191.30 | |
| Corning 96 well plate | Corning | 3596 | 96-well-plate, Clear, Flat Bottom Polystyrene TC-treated Microplates, Individually Wrapped, with Lid, Sterile |
| Cover slips | VWR | 631-0146 | |
| Cytiva HyClone Iron-Supplemented Calf Serum | Fisher Scientific | SH30072.03 | |
| Danieau | Sigma | ||
| DMEM | Life Technologies | 31053 | |
| Falcon tubes | Corning | 430828 | |
| Fast Red Violet LB stock solution | Sigma | F3381 | |
| GlutaMAX Supplement | Life Technologies | 35050 | |
| Glycerol | Sigma | 81381 | |
| Hepes | Sigma | H3375 | |
| Incubator | X | Incubator, Set up to 28 °C and 5% CO2 | |
| IncuCyte Zoom | Sartorious | X | Live Imaging System, Set up to 28 °C and 5% CO2 |
| Leica stereomicroscope | X | Sterioscope | |
| L-tartrate dibasic dihydrate | Sigma | 228729 | |
| Mgcl2 | BDH Laboratory Sup. | 261237T | |
| Microscope slides | Epredia | J2800AMNZ | |
| Mowiol 4-88 | Sigma | 9002-89-5 | |
| MQ water | X | ||
| N, N’-dimethylformamide (Merck: D4451) | Merck | D4451 | |
| NaCL | Fisher Chemical | S/3120/53 | |
| Naphthol AS-MX phosphate | Merck | N4875 | |
| NBT/BCIP solution | Sigma | #000000011681451001 | |
| Penicillin-Streptomycin | Life Technologies | 15140 | |
| Petri Dishes | Corning | 430589 | 35 mm sterile Petri dish, Non-treated, Nonpyrogenic, Polystyrene. |
| Reagent Reservoir | Startub | E2310-1025 | 25mL Reagent Reservoir |
| Silver nitrate | Sigma | 209139 | |
| Sodium acetate | Sigma | 52889 | |
| Sodium beta-glycerophosphate pentahydrate | Thermo Scientific | L03425.14 | |
| Sodium pyruvate solution | Sigma | S8636 | |
| Sodium tartrate | Sigma | S4797 | |
| Sodium thioculphate | Sigma | 563188 | |
| Tricaine methane sulfonate (MS222) | Sigma | E10521 | |
| Tris | Sigma | 252859 | |
| Triton-X100 | Sigma | T8787 | |
| Tween-20 | SLS | CHE3852 | |
| Tweezers Number 5 | Dumont | 500341 | Tweezer, INOX, biology grade |
| Zebrafish tanks | Tecniplast | ZB30BCP | 3.5 L - 28 cm x 11 cm x 17 cm |
| Zebrafish tanks | Tecniplast | ZB30BCP | 1 L - 28 cm x 7 cm x 11 cm |
Riferimenti
- Tobias, J. H., et al. Opportunities and challenges in functional genomics research in osteoporosis: report from a workshop held by the causes working group of the osteoporosis and bone research academy of the Royal Osteoporosis Society on October 5th 2020,". Frontiers in Endocrinology. 11, (2021).
- Busse, B., Galloway, J. L., Gray, R. S., Harris, M. P., Kwon, R. Y. Zebrafish: An emerging model for orthopedic research. Journal of Orthopaedic Research. 38 (5), 925-936 (2020).
- Dietrich, K., et al. Skeletal biology and disease modeling in zebrafish. Journal of Bone and Mineral Research. 36 (3), 436-458 (2021).
- McGowan, L. M., Kague, E., Vorster, A., Newham, E., Cross, S., Hammond, C. L. Wnt16 elicits a protective effect against fractures and supports bone repair in zebrafish. JBMR Plus. 5 (3), 10461 (2021).
- Sehring, I., Weidinger, G. Zebrafish fin: Complex molecular interactions and cellular mechanisms guiding regeneration. Cold Spring Harbor Perspectives in Biology. 14 (7), 040758 (2022).
- Bergen, D. J. M., Kague, E., Hammond, C. L. Zebrafish as an emerging model for osteoporosis: a primary testing platform for screening new osteo-active compounds. Frontiers in Endocrinology. 10 (6), (2019).
- Aman, A. J., Fulbright, A. N., Parichy, D. M. Wnt/β-catenin regulates an ancient signaling network during zebrafish scale development. Elife. 7, 37001 (2018).
- Iwasaki, M., Kuroda, J., Kawakami, K., Wada, H. Epidermal regulation of bone morphogenesis through the development and regeneration of osteoblasts in the zebrafish scale. Developmental Biology. 437 (2), 105-119 (2018).
- Metz, J. R., de Vrieze, E., Lock, E. J., Schulten, I. E., Flik, G. Elasmoid scales of fishes as model in biomedical bone research. Journal of Applied Ichthyology. 28 (3), 382-387 (2012).
- Cox, B. D., De Simone, A., Tornini, V. A., Singh, S. P., Di Talia, S., Poss, K. D. In toto imaging of dynamic osteoblast behaviors in regenerating skeletal bone. Current Biology. 28 (24), 3937-3947 (2018).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders,". Frontiers in Endocrinology. 11, (2020).
- de Vrieze, E., Zethof, J., Schulte-Merker, S., Flik, G., Metz, J. R. Identification of novel osteogenic compounds by an ex-vivo sp7: Luciferase zebrafish scale assay. Bone. 74, 106-113 (2015).
- De Vrieze, E., Moren, M., Metz, J. R., Flik, G., Lie, K. K. Arachidonic acid enhances turnover of the dermal skeleton: Studies on zebrafish scales. PLoS One. 9 (2), 89347 (2014).
- Bergen, D. J. M., et al. Regenerating zebrafish scales express a subset of evolutionary conserved genes involved in human skeletal disease. BMC Biology. 20 (1), 21 (2022).
- Bergen, D. J. M., et al. High bone mass disorders: New insights from connecting the clinic and the bench. Journal of Bone and Mineral Research. , (2022).
- Pasqualetti, S., Banfi, G., Mariotti, M. Osteoblast and osteoclast behavior in zebrafish cultured scales. Cell and Tissue Research. 350 (1), 69-75 (2012).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Developmental Cell. 22 (4), 879-886 (2012).
- Ethiraj, L. P., Fong, E. L. S., Liu, R., Chan, M., Winkler, C., Carney, T. J. Colorimetric and fluorescent TRAP assays for visualising and quantifying fish osteoclast activity. European Journal of Histochemistry. 66 (2), 3369 (2022).
- DeLaurier, A., et al. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505 (2010).
- Carnovali, M., Banfi, G., Mariotti, M. Age-dependent modulation of bone metabolism in zebrafish scales as new model of male osteoporosis in lower vertebrates. Geroscience. 43 (2), 927-940 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon