Method Article
Regeneración de escamas de pez cebra en cultivo de escamas en su totalidad y ex vivo
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe la recolección y visualización de las escamas elasmoides del pez cebra durante la regeneración in vivo . Además, se presenta el cultivo ex vivo de estas escamas hasta 7 días después de la cosecha.
Resumen
Las enfermedades esqueléticas suelen ser complejas en su etiología y afectan a millones de personas en todo el mundo. Debido al envejecimiento de la población, existe la necesidad de nuevas terapias que puedan aliviar la carga de los sistemas sanitarios. Como estas enfermedades son complejas, es difícil y costoso modelar con precisión la fisiopatología ósea en un entorno de laboratorio. El desafío para el campo es establecer una plataforma rentable y biológicamente relevante para modelar la enfermedad ósea que pueda usarse para probar posibles compuestos terapéuticos. Idealmente, una plataforma de este tipo debería permitir la visualización dinámica de los comportamientos celulares de los osteoblastos formadores de hueso y los osteoclastos degradadores de hueso que actúan en su entorno de matriz mineralizada. El pez cebra se utiliza cada vez más como modelo debido a la disponibilidad de herramientas genéticas, incluidas las líneas reporteras transgénicas, y al hecho de que algunos tejidos esqueléticos (incluidas las escamas) permanecen translúcidos hasta la edad adulta, lo que permite opciones de imágenes dinámicas. Dado que las escamas del pez cebra tienen osteoblastos y osteoclastos y son muy abundantes, proporcionan un recurso fácilmente accesible y abundantemente disponible de unidades óseas independientes. Además, una vez retiradas, las escamas adultas del pez cebra se regeneran por completo, lo que ofrece una forma de estudiar el crecimiento espacio-temporal del tejido mineralizado in vivo. A continuación, detallamos los protocolos de recolección y seguimiento de la regeneración de las escamas. Por último, también se presenta un protocolo para el cultivo estable de escamas ex vivo durante una semana y después de la respuesta de cicatrización después de un daño controlado a la matriz mineralizada de la escama a lo largo del tiempo.
Introducción
El hueso es un tejido conectivo duro que forma una parte importante del esqueleto, lo que permite la locomoción y actúa como una reserva mineral en el cuerpo. Para mantener un hueso sano, es esencial un equilibrio exquisito entre la formación y la degradación ósea a través de la actividad acoplada de los osteoblastos (que son anabólicos) y los osteoclastos (que reabsorben el hueso). Este equilibrio se ve alterado por el envejecimiento o el desequilibrio hormonal, lo que a menudo conduce a enfermedades de fragilidad ósea como la osteoporosis1. Aunque los medicamentos existentes han sido aprobados para tratar las enfermedades de fragilidad ósea, muchos tienen efectos secundarios; Por lo tanto, existe la necesidad de nuevas terapias1. Por lo tanto, sigue siendo necesario contar con abundantes fuentes de tejido óseo biológicamente relevante que puedan utilizarse para probar posibles compuestos terapéuticos.
Tradicionalmente, los modelos de roedores y los sistemas de cultivo celular se han utilizado para estudiar la biología ósea. Sin embargo, el pez cebra se está convirtiendo cada vez más en otro modelo de elección. Si bien no es un sistema de mamíferos, el pez cebra ofrece ciertas ventajas para la investigación de huesos sobre los roedores; entre ellos se encuentran su fecundidad y la translucidez de las larvas; Incluso en la edad adulta, algunos tejidos esqueléticos, incluyendo las escamas y las aletas, permanecen translúcidos, lo que permite la obtención de imágenes in vivo de alta resolución y la mayor disponibilidad de mutantes esqueléticos 2,3. Tanto las aletas como las escamas del pez cebra son capaces de regenerarse por completo después de su eliminación. La regeneración esquelética y la reparación de lesiones de las aletas del pez cebra se han estudiado ampliamente 4,5, mientras que las escamas del pez cebra son un modelo óseo más nuevo en el campo, pero ofrecen ventajas para el cultivo ex vivo 6.
Las escamas son muy abundantes, con al menos 300 escamas en cada pez que sirven como cubierta protectora para los peces. Cada escama es una pequeña placa mineralizada que consiste en osteoblastos formadores de hueso y osteoclastos de reabsorción ósea de una matriz esquelética rica en colágeno7. El proceso de osificación tanto de las escamas de pez cebra como de los huesos humanos requiere la diferenciación de las células madre mesenquimales en osteoblastos para formar la matriz mineralizada. Las escamas de pez cebra ofrecen una gran ventaja para la investigación esquelética con su fuerte capacidad regenerativa que se puede utilizar para estudiar la regeneración y reparación ósea. Sin embargo, a pesar de la presencia tanto de osteoblastos como de osteoclastos, las escamas del pez cebra carecen de osteocitos que son importantes para la remodelación ósea humana y la mecanosensación; La ubicación superficial de las escamas significa que se pueden quitar fácilmente con un par de fórceps. Tras la eliminación de la incrustación, se produce una cascada de eventos y comienza la regeneración de la incrustación 8,9. Hay varias opciones de tinción e imágenes disponibles para visualizar la actividad de los osteoblastos y osteoclastos y la mineralización de las escamas, como se muestra en la Figura 1. Además, la disponibilidad de muchas líneas reporteras transgénicas fluorescentes relevantes del pez cebra significa que se puede visualizar la dinámica celular durante la regeneración 7,10,11. Este proceso permite obtener una mayor comprensión de la formación ósea de novo mediante la observación del patrón temprano de regeneración de escamas en el flanco de los peces para estudiar la morfología, la actividad celular y los perfiles genéticos de estas escamas regeneradas. La biología de la formación y regeneración de escamas ha sido bien caracterizada. Es importante destacar que las escamas pueden mostrar una buena capacidad predictiva de compuestos terapéuticamente relevantes12 y el tratamiento de peces con glucocorticoides conduce a una escama que se regenera para mostrar fenotipos osteoporóticos13. El transcriptoma de las escamas regeneradoras muestra que los genes activados en la regeneración de escamas están enriquecidos para aquellos vinculados a enfermedades esqueléticas humanas, lo que demuestra aún más su relevancia como sistema modelo 6,14.
Finalmente, estas escamas se pueden cultivar ex vivo durante un máximo de 7 días. En comparación con los cultivos de líneas celulares que normalmente están compuestos por un solo tipo de célula, el cultivo a escala ex vivo ofrece oportunidades de estudio óseo in vitro dentro de su entorno natural que contiene osteoblastos y osteoclastos con su matriz extracelular natural 8,12,15,16.
El cultivo a escala también nos permite realizar el cribado de fármacos para nuevas dianas osteoanabólicas. La abundancia de escamas en los peces significa que se pueden llenar al menos dos placas de la placa de 96 pocillos de un solo pez, lo que permite el cribado compuesto en un formato de pocillos múltiples en el que cada pocillo contiene una escama junto con su nicho natural de células. Además, dado que las escamas son delgadas, la absorción del fármaco es predecible12. En resumen, las escamas elasmoides del pez cebra tienen un gran potencial en la investigación esquelética y pueden ayudarnos a obtener más información sobre los eventos celulares durante la formación y reparación ósea. Aquí, describimos los protocolos para la cosecha de escamas para seguir la regeneración in vivo y cultivar las escamas ex vivo.
Protocolo
La Unidad Científica Universitaria de Animales (ASU) es responsable del cuidado del pez cebra bajo la guía de las pautas de cría de pez cebra. Todos los procedimientos, incluida la recolección de incrustaciones, la tinción de huesos vivos y las imágenes en vivo, fueron aprobados y realizados bajo una Licencia de Proyecto del Ministerio del Interior (PP4700996) del Reino Unido. Para este manuscrito se utilizó pez cebra transgénico adulto joven de la línea sp7:mCherry [Tg(osterix:mCherry-NTR)pd46]17. Los peces incluyeron machos y hembras de 4 meses de edad.
1. Regeneración de incrustaciones in vivo
- Antes de comenzar el experimento de regeneración de incrustaciones, transfiera el pez cebra de sus tanques principales a tanques individuales (ver Tabla de materiales) y regrese a estos tanques individuales después de obtener imágenes durante todo el experimento, como se muestra en la Figura 2. Esto es para garantizar que todas las escamas regeneradoras sean las cosechadas para el experimento; El alojamiento en grupo puede conducir a la pérdida esporádica de escamas debido a lesiones causadas por otros peces.
NOTA: Los peces se colocan individualmente para evitar peleas y la consiguiente pérdida de escamas entre los peces. - Registre la información de cada pez del experimento (es decir, genotipo, edad y sexo) de acuerdo con el diseño del experimento. Use una cámara (las cámaras de los teléfonos inteligentes funcionan bien) para tomar una imagen de cada pez junto a una regla para registrar el tamaño/longitud y el estado de salud de los peces.
- El día del experimento, anestesiar al pez cebra con sulfonato de metano tricaína al 0,05% (v/v) (MS222, ver Tabla de Materiales) por inmersión, luego colocarlo en una placa de Petri con un pañuelo húmedo para evitar el movimiento de los peces durante la obtención de imágenes o la recolección.
- Coloque el pescado de lado (por lo general, aquí se usa el flanco izquierdo para mantener la consistencia). Realizar imágenes de flanco utilizando un microscopio estereoscópico con el aumento adecuado (por lo general, se utilizaron 2x, 4x y/o 6,3x y 8x para el presente estudio para capturar tanto el área de regeneración general como el área ampliada para una observación detallada).
NOTA: Los puntos de tiempo de las imágenes de flanco dependen del propósito experimental y de la elección de los reporteros transgénicos. Por ejemplo, para realizar un seguimiento de los osteoblastos durante la regeneración de las escamas, los puntos de tiempo sugeridos son el día 0 (ontogenético), 2 días después de la cosecha (dph), 4 dph, 7 dph, 10 dph, 14 dph, 21 dph. Para reducir los efectos de la anestesia repetida, mantenga los puntos de tiempo de obtención de imágenes al mínimo necesario para el experimento. - Extraiga las escamas con pinzas finas y pinzas bajo el microscopio estereoscópico. Transfiera las escamas cosechadas a tubos de recolección para teñirlas más tarde.
NOTA: El número máximo de escamas que se pueden cosechar dependerá de las aprobaciones éticas locales que estén vigentes. Por lo general, cosechamos alrededor de 20 a 30 escamas y las recolectamos en tubos de recolección individuales para la tinción de incrustaciones más tarde, como ALP, von Kossa14. - Recoja las básculas en un tubo de recolección de 1,5 ml o 2 ml. Esto depende de la técnica de tinción utilizada.
- Tanto para la tinción de ALP como para la de von Kossa, transfiera las escamas a tubos de recolección que contengan agua desionizada, mientras que para la tinción TRAP o inmunohistoquímica, transfiera las escamas a tubos de recolección que contengan PFA al 4% (solución de fijación).
- Opcional: Antes de transferir las escamas a los tubos, capture imágenes de las escamas individuales cosechadas si es necesario.
NOTA: Los puntos de tiempo sugeridos para la cosecha de escamas son el día 0 (ontogenético), el día 10 y el día 21 (escamas regeneradas).
2. Tinción de hueso vivo
NOTA: La tinción de esqueletos vivos se puede realizar cuando los peces experimentales no son transgénicos para los reporteros fluorescentes o cuando llevan reporteros transgénicos de un solo color. La tinción viva se puede utilizar para complementar los transgénicos; por ejemplo, se puede usar un indicador de osteoblastos como sp7/osx en un color (p. ej., GFP) y luego teñir el hueso en rojo con rojo de alizarina (AR). El AR y el verde de calceína se pueden usar para el mismo pescado juntos; en este escenario, la RA se utiliza para marcar el hueso original u ontogenético mediante la unión a la matriz mineralizada del hueso envejecido, y la calceína se une a los iones de calcio que son abundantes en el hueso recién formado. Por ejemplo, cuando se tiñe una escala ontogenética, se puede visualizar AR, pero el verde de calceína puede estar ausente o ser mínimo, ya que las escalas ontogenéticas tienen bajos niveles de formación de hueso nuevo.
- Realice una tinción con rojo de alizarina (AR) en vivo.
- Prepare un frasco de 2 soluciones de tinción AR mezclando una solución de alizarina al 0,5 % (p/v) (10 ml) con 10 ml de HEPES (concentración final, 10 mM) (consulte la tabla de materiales).
- Rellene hasta 1 L con 1 solución Danieau (consulte la tabla de materiales). La solución debe mantenerse en la oscuridad o envolverse con papel de aluminio.
- El día del experimento, lleve 500 ml de 2 soluciones de RA a las instalaciones de pez cebra y agregue 500 ml de agua del sistema (del acuario) para hacer 1 solución de RA que funcione.
- Transfiera los peces de sus tanques a una solución de tinción AR que funcione 1x y déjelos actuar durante 15-20 minutos. Lave el exceso de manchas en el pescado con 15 minutos de "lavado" en el agua del sistema.
- Realice una tinción en vivo con Calceína Verde.
- Prepare un frasco de 2 soluciones de tinción de Calcein Green añadiendo 45 mg de polvo de calceína en 900 ml de 1 solución de Danieau (consulte la Tabla de materiales). Use un agitador magnético para permitir que el polvo se disuelva por completo.
- Ajusta el pH a 8. Esta es la solución 2x stock Calcein Green. La solución se puede almacenar en la oscuridad / envolver con papel de aluminio hasta por 1 mes.
- El día del experimento, lleve 500 ml de 2 soluciones de Calcein Green a las instalaciones de pez cebra y agregue 500 ml de agua del sistema para hacer 1 solución de Calcein Green que funcione. Se recomienda utilizar una solución de tinción de calceína recién hecha.
- Transfiera los peces de sus tanques a 1 solución de tinción de Calcein Green que funcione y déjelos actuar durante 1-2 h. Dependiendo del tamaño del pez, puede ser necesario un tiempo de tinción más largo.
- Lave el exceso de manchas en el pescado durante 15 minutos de "lavado" en el agua del sistema.
NOTA: Imagine el pescado teñido de verde calceína lo antes posible, ya que esta mancha se desvanecerá en unas pocas horas.
3. Tinción de fosfatasa alcalina (ALP) en básculas después de la cosecha
- Prepare la solución de tinción de ALP mezclando 100 mM de Tris (pH 9,5 con HCl) con 100 mM de NaCl y 50 mM de MgCl2.
- Utilice una solución madre de NBT/BCIP disponible en el mercado (consulte la Tabla de materiales).
- Transfiera las escamas a tubos que contengan agua desionizada.
- Enjuague las escamas con una solución de tinción de ALP durante 5 min.
- Mientras tanto, prepare una solución de tinción que funcione agregando 200 μL de la solución NBT/BCIP a 10 ml de tampón de tinción ALP. Esto debe estar recién preparado en el momento de la tinción.
- Tiñir las escamas con la solución de tinción de ALP en funcionamiento durante 15 min.
- Detenga la reacción enjuagando las escamas con agua desionizada.
4. Tinción de Von KOSSA en básculas postcosecha
- Prepare una solución de nitrato de plata al 5% (p/v).
- Prepare una solución de tiosulfato de sodio al 5% (p/v).
- Transfiera las escamas cosechadas a tubos que contengan agua desionizada.
- Incubar las escamas en la solución de nitrato de plata durante 40 minutos bajo una luz intensa.
NOTA: Use EPP (equipo de protección personal) ya que el nitrato de plata deja una mancha que es difícil de eliminar. - Lave las escamas dos veces durante 5 minutos con agua desionizada.
NOTA: Los residuos de nitrato de plata deben recolectarse y eliminarse de acuerdo con las pautas locales. - Incubar las escamas en tiosulfato de sodio durante 5 min.
- Lave las escamas dos veces durante 5 minutos con agua desionizada.
5. Tinción colorimétrica TRAP
NOTA: Para conocer el procedimiento detallado, consulte el trabajo publicado anteriormente18.
- Prepara las soluciones de tinción.
- Prepare 10 mg/mL de solución de fosfato de naftol AS-MX.
- Pesar 5 mg de fosfato de naftol AS-MX (ver Tabla de Materiales).
- En la campana extractora, prepare un tubo con 0,5 ml de N, N'-dimetilformamida y disuelva 5 mg de fosfato de naftol AS-MX en 0,5 ml de N, N'-dimetilformamida para hacer una solución madre de 10 mg/ml de fosfato de naftol AS-MX (agitar suavemente).
- Prepare 1,6 mM de solución madre Fast Red Violet LB en 50 mM de tartrato de sodio.
- Preparar 50 mL de acetato de sodio 0,1 M a pH 5 (añadir 0,41015 g de acetato de sodio en 50 mL de agua desionizada y ajustar el pH a 5 con ácido acético al 100%).
- Disolver 0,575 g de L-tartrato de sodio dibásico dihidratado (ver Tabla de Materiales) en 50 mL de tampón de acetato de sodio 0,1 M (pH = 5).
- Agregue 30 mg de sal LB roja violeta rápida.
- Prepare PBS-0.1Tx (disuelva 500 μL de Triton-X en 500 mL de PBS).
- Preparar PBS-0.1Tw (disolver 500 μL de Tween-20 en 500 mL de PBS).
- Prepare 10 mg/mL de solución de fosfato de naftol AS-MX.
- Prepare una solución TRAP que funcione.
- Mezcle ambas soluciones madre en la campana extractora (0,5 ml de solución de fosfato de naftol AS-MX de 10 mg/ml y 50 ml de solución madre de 1,6 mM de solución madre rápida de rojo violeta LB en tartrato de sodio de 50 mM).
NOTA: La solución de trabajo ahora se puede usar fuera de la campana extractora. Se puede almacenar en el refrigerador (envuelto en papel de aluminio) hasta por un mes. Almacenar en recipientes separados de anticuerpos u otros reactivos sensibles a los fijadores. Manténgase alejado de la luz tanto como sea posible. - Opcional: preparar la solución blanqueadora (en muestras postfijadas que se tiñeron con TRAP) en PBS y Tween-20 al 0,1 % (PBS-0,1 % Tw).
- Preparar una mezcla de concentración final de hidróxido de potasio (KOH) al 0,5% (a partir de solución madre al 10% (p/v)) y peróxido de hidrógeno al 3% (H2O2) (solución madre al 33 %, almacenada en la nevera).
- Mezcle ambas soluciones madre en la campana extractora (0,5 ml de solución de fosfato de naftol AS-MX de 10 mg/ml y 50 ml de solución madre de 1,6 mM de solución madre rápida de rojo violeta LB en tartrato de sodio de 50 mM).
- Realice la fijación de la muestra.
- Fije las escalas en PFA al 4% en 1x PBS balanceándose o girando durante 40 minutos a temperatura ambiente (RT).
- Retire el PFA al 4% y lave con PBS-0.1Tx al menos 3 veces durante 5 minutos cada lavado.
- Pase directamente a la tinción TRAP (el mejor enfoque) o guárdelo en PBS-0.1 Tx durante la noche.
- Realice la tinción TRAP de las escamas.
- Retire la solución de PBS-0.1 Tx y agregue la solución de trabajo colorimétrica TRAP (paso 5.2.1) para cubrir las muestras por completo (es decir, 1 ml en un tubo de microcentrífuga de 1,5 ml).
- Incubar durante 1-2 h a RT, meciéndose en la oscuridad.
- Retire la solución de tinción y lave al menos 3 veces con PBS-0.1 Tw durante 5 minutos cada lavado.
- Fije las muestras en PFA al 4% durante 30 minutos en RT, meciéndose suavemente en la oscuridad.
- Retire la solución de PFA lavando 3 veces con PBS-0.1 Tw durante 5 minutos en cada paso.
NOTA: Las muestras pueden almacenarse (en soluciones de almacenamiento/montadas en portaobjetos de microscopio) a 4 °C en la oscuridad indefinidamente.
6. Montaje de escamas manchadas
- Prepare el medio de montaje añadiendo 2,4 g de cristales de Mowiol 4-88 a 6 g de glicerol (véase la tabla de materiales). Se puede utilizar cualquier medio de montaje preferido.
- Añadir 6 mL de agua desionizada y dejar en un agitador magnético durante una hora.
- Añadir 12 mL de Tris 0,2 M (pH 8,5) e incubar a 53°C aproximadamente hasta que los cristales de Mowiol se disuelvan por completo.
- Clarificar la solución centrifugando a 2000 x g durante 20 min a temperatura ambiente.
- Transfiera la solución a un contenedor de almacenamiento. El medio de montaje se puede conservar en el congelador durante unos 12 meses. La solución descongelada de Mowiol es estable hasta por 1 mes.
- Monte las escamas en un portaobjetos de microscopio en el montaje del medio, cúbralas con un cubreobjetos y obsérvelas bajo un microscopio.
7. Cultivo ex vivo de escamas
NOTA: Este paso es una adaptación de de De Vrieze et al.12.
- Antes de cosechar las escamas en un ambiente estéril, prepare el medio osteogénico y la placa de cultivo.
- Medio de cultivo osteogénico (OCM): En un tubo de centrífuga estéril, realice 15 ml de OCM en medio de cultivo celular estándar (alto contenido de glucosa, sin glutamina, sin rojo de fenol) a las concentraciones finales de suero de ternero bovino al 1%, 1% (200 mM de dipéptido L-alanil-L-glutamina en NaCl al 0,85%), solución antibiótica/antimicótica al 1% (100x), 4 mM de CaCl2, 10 mM de β-glicerofosfato, 1 nM de piruvato de sodio y 1 % de anfotericina B (opcional) (ver Tabla de materiales).
- Vierta el OCM en un depósito de reactivo estéril y, con una pipeta multicanal, agregue 100 μL a cada pocillo de la placa de 96 pocillos.
- Selle la placa de 96 pocillos y guárdela. El OCM puede almacenarse en el frigorífico durante un breve periodo de tiempo (de la noche a 1 semana) y mantenerse a 28 °C antes de su uso.
- Realice la recolección de incrustaciones y el lavado de PBS.
- Recoja las escamas con pinzas/pinzas estériles y deposíguelas en una placa de Petri que contenga una solución estéril de PBS.
- Realice la configuración de la placa.
- Transfiera cada escama de la placa de Petri a cada pocillo en la placa de 96 pocillos con 100 μL de OCM (calentado a 28 °C) utilizando pinzas estériles.
- Una vez que todas las escamas se hayan transferido a la placa, coloque la placa bajo un microscopio estereoscópico. Usar una punta de pipeta fina y estéril para mover suavemente cada escama al fondo del pocillo y mantenerlas alejadas del costado de los pocillos para evitar el reflejo de la luz durante la adquisición de imágenes.
NOTA: Este paso solo es necesario si se realizan imágenes en vivo. - Transfiera con cuidado la placa a la incubadora o al sistema de imágenes en vivo (LIS, consulte la tabla de materiales) (ajustado a 28 °C, 5% de CO2), donde las escamas se pueden cultivar hasta por 7 días.
- Actualice OCM (opcional).
- Calentar el OCM almacenado en la nevera a 28 °C.
- Transfiera con cuidado la placa de 96 pocillos a un ambiente estéril. Con una pipeta multicanal, aspire 50 μL de cada pocillo. Para ello, presione las puntas contra las paredes y no las sumerja hasta el fondo para evitar aspirar/mover/quitar las escamas. Use nuevas puntas para diferentes condiciones.
- Vierta el OCM en un depósito de reactivo estéril y, con la pipeta multicanal, agregue 60 μL de OCM a cada pocillo.
- Coloque la placa bajo el microscopio estereoscópico y compruebe si hay escamas mal colocadas (demasiado cerca de las paredes, flotando o en posición vertical dentro del medio). Vuelva a colocarlos con una punta de pipeta fina y estéril si es necesario.
- Vuelva a colocar la placa en la incubadora/LIS.
NOTA: No refresque el medio si el experimento involucra ritmo circadiano (RC), ya que el choque sérico puede afectar el reloj biológico. Tenga en cuenta que si estudia CR, observe que las condiciones de luz también reinician el reloj.
- Realice la tinción y la obtención de imágenes a escala posteriores al cultivo (opcional).
- Después de 6 días de cultivo, fíjelos y diríjalos para una tinción adecuada, como von Kossa y ALP mencionados anteriormente.
- Alternativamente, si los peces experimentales tienen una etiqueta fluorescente, coloque la placa en un sistema de imágenes en vivo.
NOTA: Si utiliza un sistema de imágenes en vivo, asegúrese de que esté ajustado a una temperatura y un nivel deCO2 apropiados para el experimento. Típicamente, en este estudio, se utilizaron 28 °C y 5% de CO2 . Seleccionar filtros y puntos de tiempo de imagen apropiados (en este caso, se utilizó un intervalo de 2 o 4 h, que es suficiente para seguir la migración de los osteoblastos) y objetivos de bajo aumento (es decir, 4x) para garantizar una obtención de imágenes uniforme de todos los pocillos. Esto se debe a que las básculas tienden a moverse dentro de los pozos, particularmente durante los cambios de medios.
Resultados
Regeneración de incrustaciones
La regeneración de las escamas se puede rastrear con un microscopio estereoscópico fluorescente estándar mediante la obtención de imágenes del flanco del pez cebra. La Figura 3A muestra los cambios en la expresión de sp7/osx de las escamas durante la regeneración de escamas en un pez cebra de 4 meses de edad. Los puntos de tiempo para las imágenes del flanco que se muestran en la Figura 3A son ontogenéticos (escamas originales, antes de la cosecha), el día 2, el día 4 y el día 10 después de la cosecha. Por lo general, utilizamos líneas transgénicas osx (también conocidas como osterix o sp7) (ya sea como GFP (Tg(Ola.sp7:NLS-eGFP)19 o mCherry Tg(osterix:mCherry-NTR)pd46)17 para rastrear los cambios en el sistema esquelético a medida que etiqueta los osteoblastos que forman hueso. El patrón temprano de las escamas recién formadas se puede ver a los 2 días de la regeneración. Este patrón temprano de regeneración de escamas se ve interrumpido en algunos casos, especialmente en mutantes esqueléticos. Al rastrear el progreso de la regeneración, se puede analizar la capacidad y la tasa de regeneración. El día de la recolección de la báscula, se pueden realizar imágenes individuales de las escamas cosechadas después de la obtención de imágenes de flanco utilizando el mismo microscopio estereoscópico, como se muestra en la Figura 3B. Las escamas regeneradas tienen una expresión de osx mucho más alta en comparación con las escamas ontogenéticas del día 0 porque los osteoblastos son necesarios para la formación de hueso nuevo.
Cultivo a escala ex vivo
Aunque se puede estudiar el proceso de formación ósea de novo mediante el seguimiento del proceso de regeneración en el flanco de los peces, también podemos utilizar este modelo para estudiar la reparación y curación de lesiones esqueléticas con cultivo de escamas ex vivo haciendo una lesión en las escamas con un bisturí. Utilizando un sistema de imágenes en vivo, se puede realizar un seguimiento de la reparación en tiempo real. La Figura 4 muestra un resultado representativo de una respuesta de cicatrización de lesiones a escala ontogenética en 3 días en un cultivo donde los osteoblastos están marcados con osx: mCherry. La localización de la lesión que muestran los recuadros al inicio del cultivo muestra un claro espacio entre los osteoblastos y los círculos de escala (Figura 4A). Se puede controlar la migración de los osteoblastos hacia el lugar de la lesión con imágenes de lapso de tiempo. Después de 3 días en cultivo, el ancho de la brecha se reduce y se puede ver la expresión de laosx entre la brecha y los círculos de escamas recién formados (Figura 4B). Además, la morfología en cuanto a la forma de los osteoblastos, es más circular al inicio del cultivo y después de 3 días, es más alargada. Es probable que este cambio en la apariencia de los osteoblastos se deba a que están en cultivo y no en su entorno natural (adherido a los peces).
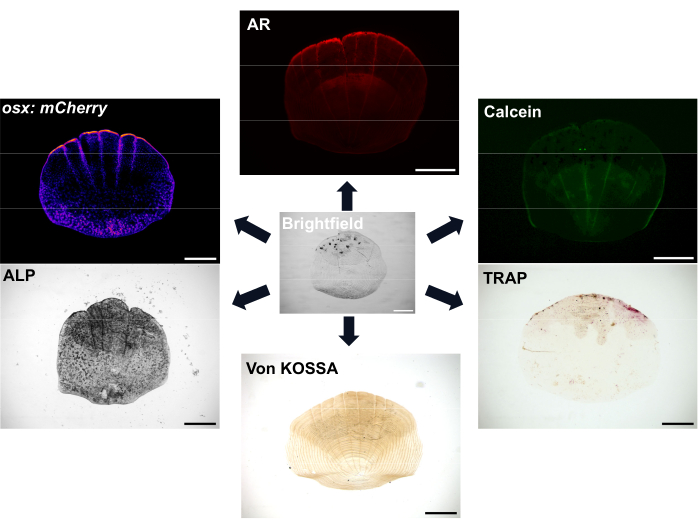
Figura 1: Ejemplos de opciones de imágenes para básculas. Los osteoblastos se pueden visualizar con líneas reporteras transgénicas osx/sp7 (ya sea en GFP o mCherry). La tinción de ALP se puede utilizar para mostrar la actividad osteoblástica. La tinción TRAP puede mostrar la actividad de los osteoclastos. El rojo de alizarina (AR) y el verde de calceína son colorantes que se pueden usar en peces vivos; AR etiqueta la mineralización y Calcein etiqueta el hueso recién formado. El grado de mineralización también se puede demostrar con la tinción de von Kossa. Barras de escala: 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
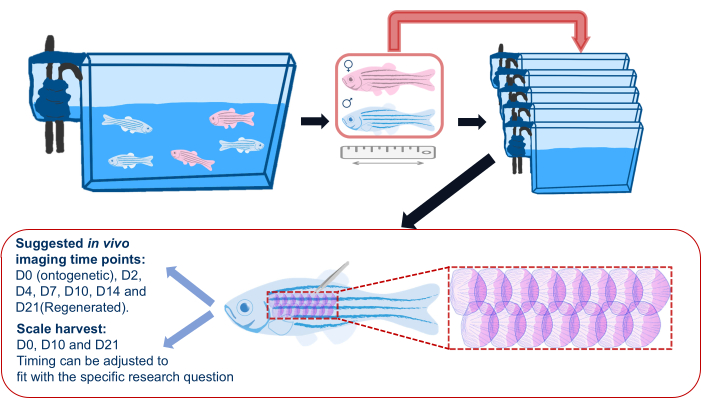
Figura 2: Ilustración esquemática de un experimento de regeneración de escalas. Esquema genérico de un experimento de regeneración de escamas que muestra que los peces se separan en tanques individuales antes del experimento. Se registran la longitud, el sexo y la salud. El esquema también muestra el área sugerida en el flanco del pez para cosechar escamas y los puntos de tiempo sugeridos para la obtención de imágenes. Haga clic aquí para ver una versión más grande de esta figura.
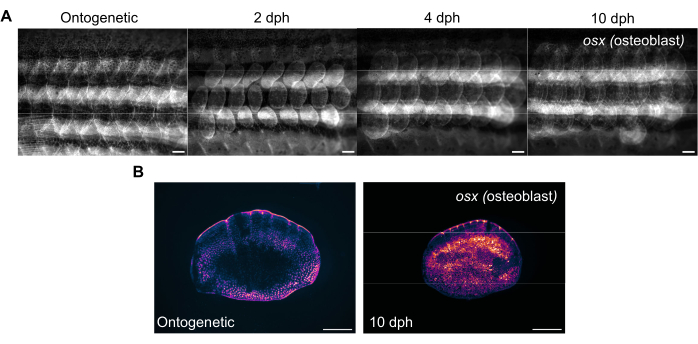
Figura 3: Imágenes representativas de la expresión de osterix (para visualizar osteoblastos) durante la regeneración de escamas tomadas de un pez cebra de 4 meses de edad. (A) Las imágenes de flanco capturadas en el día 0 (antes de la cosecha, escalas ontogenéticas), 2 dph (días después de la cosecha), día 2, 4 dph y 10 dph para rastrear los cambios en la expresión de osx . Barras de escamas: 1 mm. (B) Imágenes representativas de una escama ontogenética y una escama a 10 dph tomadas del mismo pez que en el panel (A). Obsérvese el aumento de los niveles de expresión de osx como se muestra en magenta en el centro de las escalas de regeneración. Barras de escala: 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
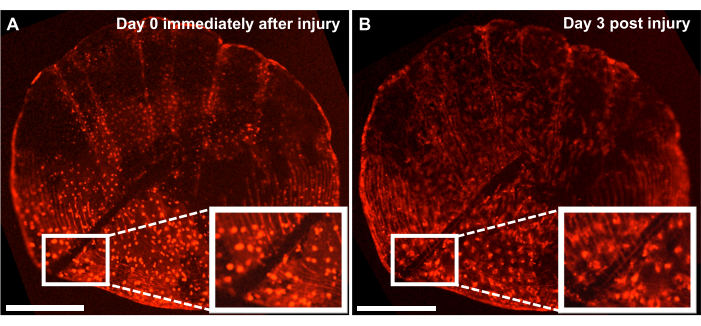
Figura 4: Resultados representativos de la respuesta de reparación de lesiones esqueléticas a escala ontogenética capturadas de un pez cebra de 4 meses de edad utilizando un sistema de imágenes en vivo. (A) Escamas ontogenéticas con una lesión realizada con bisturí el mismo día de la cosecha (punto de tiempo 0/día0) del cultivo. (B) La misma escala se muestra 3 días después de la lesión. El recuadro muestra la región de la lesión. Barras de escala: 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Las escamas elasmoides del pez cebra, como modelo novedoso para la investigación esquelética, tienen un gran potencial para ayudar a nuestra comprensión del mantenimiento óseo, la regeneración y la reparación de lesiones. La abundancia de escamas en los peces permite un cribado de compuestos de rendimiento medio a alto, al tiempo que reduce el número de animales utilizados y limita la variación intraindividual. Aquí, se presentan protocolos para la regeneración de escamas y el cultivo de escamas ex vivo para estudiar la regeneración y reparación.
Es necesario tener en cuenta algunos pasos críticos a la hora de seguir este protocolo. La eliminación cuidadosa de las escamas es esencial, especialmente cuando se utiliza una línea reportera transgénica para limitar la perturbación de la población celular causada por la recolección. Si se van a hacer comparaciones con las escamas ontogenéticas, asegúrese de que la región no contenga escamas que se regeneran espontáneamente (lo que puede ocurrir naturalmente a lo largo de la vida útil de los peces). Asegúrese de que el entorno y el equipo sean estériles para el cultivo ex vivo a fin de lograr una supervivencia celular óptima y una infección mínima en el cultivo.
Dependiendo de la pregunta de investigación específica, se pueden realizar adaptaciones al protocolo, como la combinación de diferentes líneas reporteras transgénicas para visualizar otros tipos celulares de perfiles de expresión génica durante la regeneración y reparación11,14.
El amplio rango de tinción que se puede realizar en las básculas significa que para cada compuesto o condición probada se pueden observar sus efectos en el hueso desde diferentes ángulos; mientras que los reporteros sp7/osx pueden mostrar el número de osteoblastos, la tinción de ALP puede visualizar la actividad de los osteoblastos, la tinción de TRAP puede visualizar la actividad de los osteoclastos, la tinción viva de verde de calceína puede etiquetar el hueso recién formado y la tinción de rojo de alizarina o von Kossa puede mostrar mineralización de escamas. También se puede utilizar la actividad de la luciferasa para cuantificar los osteoblastos12. En combinación con estas técnicas de tinción, se puede conocer la contribución relativa de los osteoblastos y osteoclastos a un efecto óseo determinado. Las escamas carecen de osteocitos, que son prevalentes en el hueso de mamíferos y son los principales impulsores de la respuesta mecanosensorial ósea; La reparación y regeneración de las incrustaciones en este modelo son impulsadas principalmente por los osteoblastos con la posterior remodelación por osteoclastos 8,9. Es crucial tener en cuenta que la variación ocurre entre individuos y grupos de edad20. Para minimizar esto, el área de cosecha de escamas debe ser constante, ya que diferentes ubicaciones pueden dar lugar a diferentes morfologías de escamas, y se utilizan peces de los mismos grupos hermanos para que la edad y el tamaño sean consistentes. Sin embargo, debido a que se pueden cosechar múltiples escamas por pez, se pueden realizar más experimentos con menos peces, lo que reduce la variabilidad intraindividual.
En resumen, estos protocolos muestran técnicas experimentales que pueden aplicarse a escalas ontogenéticas y de regeneración. En conclusión, las escamas elasmoides muestran un gran potencial como modelo esquelético para ayudar a la comprensión de la formación y reparación ósea; y ayudará a reducir el uso de animales para el cribado de compuestos osteoanabólicos de alto rendimiento.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Nos gustaría agradecer a Mathew Green de la Unidad de Servicio Animal para la cría de peces y a Katy Jepson del Centro de Bioimágenes Wolfson. CLH, DB y QT fueron financiados por Versus Arthritis (CLH Senior Fellowship 21937, DB and QT Intermediate Fellowship 22044), RR fue financiado por (NHMRC APP1158758). Esta labor también contó con el apoyo de la subvención del BBSRC (BB/T001984/1).
Materiales
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffered saline (PBS) | Gibco | 70013-016 | PBS |
| 12-Multichanel Pipette | Sartorius | 728230 | Multichanel pipette, Proline Plus Mechanical Pipette, 12 Channel, , 10-100 µL. |
| 15 mL Centrifuge tubes | Corning | 430791 | Centrifuge tube, CentriStar Cap, Polypropylene, RNAse/DNAse free, Non-pyrogenic |
| 4% Paraformaldehyde (PFA) | Sigma | P6148 | PFA |
| Alizarin red | Sigma | A5533 | |
| Amphotericin B | ThermoFisher Scientific | 15290026 | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher Scientific | 11772644 | Sealing film |
| Calcein powder | Sigma | C0875 | |
| Calcium Chloride | Thermo Scientific | L13191.30 | |
| Corning 96 well plate | Corning | 3596 | 96-well-plate, Clear, Flat Bottom Polystyrene TC-treated Microplates, Individually Wrapped, with Lid, Sterile |
| Cover slips | VWR | 631-0146 | |
| Cytiva HyClone Iron-Supplemented Calf Serum | Fisher Scientific | SH30072.03 | |
| Danieau | Sigma | ||
| DMEM | Life Technologies | 31053 | |
| Falcon tubes | Corning | 430828 | |
| Fast Red Violet LB stock solution | Sigma | F3381 | |
| GlutaMAX Supplement | Life Technologies | 35050 | |
| Glycerol | Sigma | 81381 | |
| Hepes | Sigma | H3375 | |
| Incubator | X | Incubator, Set up to 28 °C and 5% CO2 | |
| IncuCyte Zoom | Sartorious | X | Live Imaging System, Set up to 28 °C and 5% CO2 |
| Leica stereomicroscope | X | Sterioscope | |
| L-tartrate dibasic dihydrate | Sigma | 228729 | |
| Mgcl2 | BDH Laboratory Sup. | 261237T | |
| Microscope slides | Epredia | J2800AMNZ | |
| Mowiol 4-88 | Sigma | 9002-89-5 | |
| MQ water | X | ||
| N, N’-dimethylformamide (Merck: D4451) | Merck | D4451 | |
| NaCL | Fisher Chemical | S/3120/53 | |
| Naphthol AS-MX phosphate | Merck | N4875 | |
| NBT/BCIP solution | Sigma | #000000011681451001 | |
| Penicillin-Streptomycin | Life Technologies | 15140 | |
| Petri Dishes | Corning | 430589 | 35 mm sterile Petri dish, Non-treated, Nonpyrogenic, Polystyrene. |
| Reagent Reservoir | Startub | E2310-1025 | 25mL Reagent Reservoir |
| Silver nitrate | Sigma | 209139 | |
| Sodium acetate | Sigma | 52889 | |
| Sodium beta-glycerophosphate pentahydrate | Thermo Scientific | L03425.14 | |
| Sodium pyruvate solution | Sigma | S8636 | |
| Sodium tartrate | Sigma | S4797 | |
| Sodium thioculphate | Sigma | 563188 | |
| Tricaine methane sulfonate (MS222) | Sigma | E10521 | |
| Tris | Sigma | 252859 | |
| Triton-X100 | Sigma | T8787 | |
| Tween-20 | SLS | CHE3852 | |
| Tweezers Number 5 | Dumont | 500341 | Tweezer, INOX, biology grade |
| Zebrafish tanks | Tecniplast | ZB30BCP | 3.5 L - 28 cm x 11 cm x 17 cm |
| Zebrafish tanks | Tecniplast | ZB30BCP | 1 L - 28 cm x 7 cm x 11 cm |
Referencias
- Tobias, J. H., et al. Opportunities and challenges in functional genomics research in osteoporosis: report from a workshop held by the causes working group of the osteoporosis and bone research academy of the Royal Osteoporosis Society on October 5th 2020,". Frontiers in Endocrinology. 11, (2021).
- Busse, B., Galloway, J. L., Gray, R. S., Harris, M. P., Kwon, R. Y. Zebrafish: An emerging model for orthopedic research. Journal of Orthopaedic Research. 38 (5), 925-936 (2020).
- Dietrich, K., et al. Skeletal biology and disease modeling in zebrafish. Journal of Bone and Mineral Research. 36 (3), 436-458 (2021).
- McGowan, L. M., Kague, E., Vorster, A., Newham, E., Cross, S., Hammond, C. L. Wnt16 elicits a protective effect against fractures and supports bone repair in zebrafish. JBMR Plus. 5 (3), 10461 (2021).
- Sehring, I., Weidinger, G. Zebrafish fin: Complex molecular interactions and cellular mechanisms guiding regeneration. Cold Spring Harbor Perspectives in Biology. 14 (7), 040758 (2022).
- Bergen, D. J. M., Kague, E., Hammond, C. L. Zebrafish as an emerging model for osteoporosis: a primary testing platform for screening new osteo-active compounds. Frontiers in Endocrinology. 10 (6), (2019).
- Aman, A. J., Fulbright, A. N., Parichy, D. M. Wnt/β-catenin regulates an ancient signaling network during zebrafish scale development. Elife. 7, 37001 (2018).
- Iwasaki, M., Kuroda, J., Kawakami, K., Wada, H. Epidermal regulation of bone morphogenesis through the development and regeneration of osteoblasts in the zebrafish scale. Developmental Biology. 437 (2), 105-119 (2018).
- Metz, J. R., de Vrieze, E., Lock, E. J., Schulten, I. E., Flik, G. Elasmoid scales of fishes as model in biomedical bone research. Journal of Applied Ichthyology. 28 (3), 382-387 (2012).
- Cox, B. D., De Simone, A., Tornini, V. A., Singh, S. P., Di Talia, S., Poss, K. D. In toto imaging of dynamic osteoblast behaviors in regenerating skeletal bone. Current Biology. 28 (24), 3937-3947 (2018).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders,". Frontiers in Endocrinology. 11, (2020).
- de Vrieze, E., Zethof, J., Schulte-Merker, S., Flik, G., Metz, J. R. Identification of novel osteogenic compounds by an ex-vivo sp7: Luciferase zebrafish scale assay. Bone. 74, 106-113 (2015).
- De Vrieze, E., Moren, M., Metz, J. R., Flik, G., Lie, K. K. Arachidonic acid enhances turnover of the dermal skeleton: Studies on zebrafish scales. PLoS One. 9 (2), 89347 (2014).
- Bergen, D. J. M., et al. Regenerating zebrafish scales express a subset of evolutionary conserved genes involved in human skeletal disease. BMC Biology. 20 (1), 21 (2022).
- Bergen, D. J. M., et al. High bone mass disorders: New insights from connecting the clinic and the bench. Journal of Bone and Mineral Research. , (2022).
- Pasqualetti, S., Banfi, G., Mariotti, M. Osteoblast and osteoclast behavior in zebrafish cultured scales. Cell and Tissue Research. 350 (1), 69-75 (2012).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Developmental Cell. 22 (4), 879-886 (2012).
- Ethiraj, L. P., Fong, E. L. S., Liu, R., Chan, M., Winkler, C., Carney, T. J. Colorimetric and fluorescent TRAP assays for visualising and quantifying fish osteoclast activity. European Journal of Histochemistry. 66 (2), 3369 (2022).
- DeLaurier, A., et al. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505 (2010).
- Carnovali, M., Banfi, G., Mariotti, M. Age-dependent modulation of bone metabolism in zebrafish scales as new model of male osteoporosis in lower vertebrates. Geroscience. 43 (2), 927-940 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados