Method Article
Régénération d’écailles de poisson-zèbre Culture d’écailles in toto et ex vivo
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit la récolte et la visualisation d’écailles d’élasmoïdes de poisson-zèbre au cours de la régénération in vivo . De plus, la culture ex vivo de ces cochenilles jusqu’à 7 jours après la récolte est présentée.
Résumé
Les maladies squelettiques sont souvent complexes dans leur étiologie et touchent des millions de personnes dans le monde. En raison du vieillissement de la population, il est nécessaire de trouver de nouveaux traitements qui pourraient alléger le fardeau des systèmes de santé. Comme ces maladies sont complexes, il est difficile et coûteux de modéliser avec précision la physiopathologie osseuse en laboratoire. Le défi pour le domaine est d’établir une plate-forme rentable et biologiquement pertinente pour la modélisation des maladies osseuses qui peut être utilisée pour tester des composés thérapeutiques potentiels. Une telle plate-forme devrait idéalement permettre une visualisation dynamique des comportements cellulaires des ostéoblastes qui construisent les os et des ostéoclastes qui dégradent les os agissant dans leur environnement matriciel minéralisé. Les poissons-zèbres sont de plus en plus utilisés comme modèles en raison de la disponibilité d’outils génétiques, y compris des lignées rapporteures transgéniques, et du fait que certains tissus squelettiques (y compris les écailles) restent translucides à l’âge adulte, ce qui permet des options d’imagerie dynamiques. Étant donné que les écailles de poisson-zèbre ont à la fois des ostéoblastes et des ostéoclastes et qu’elles sont très abondantes, elles fournissent une ressource facilement accessible et abondamment disponible d’unités osseuses indépendantes. De plus, une fois retirées, les écailles de poisson-zèbre adultes se régénèrent complètement, offrant ainsi un moyen d’étudier la croissance spatio-temporelle des tissus minéralisés in vivo. Ici, nous détaillons les protocoles de récolte et de suivi de la régénération des écailles. Enfin, un protocole de culture stable de cochenilles ex vivo pendant une semaine et suivant la réponse de cicatrisation après des dommages contrôlés à la matrice minéralisée de la cochenille au fil du temps est également présenté.
Introduction
L’os est un tissu conjonctif dur qui forme une partie importante du squelette, permettant la locomotion et agissant comme une réserve minérale dans le corps. Afin de maintenir un os sain, un équilibre exquis entre la formation et la dégradation osseuse est essentiel via l’activité couplée des ostéoblastes (qui sont anabolisants) et des ostéoclastes (qui résorbent l’os). Cet équilibre est perturbé par le vieillissement ou le déséquilibre hormonal, entraînant souvent des maladies de fragilité osseuse telles que l’ostéoporose1. Bien que les médicaments existants aient été approuvés pour cibler les maladies de fragilité osseuse, beaucoup ont des effets secondaires ; Par conséquent, il est nécessaire de mettre au point de nouvelles thérapies1. Il reste donc nécessaire de disposer de sources abondantes de tissu osseux biologiquement pertinent qui peuvent être utilisées pour tester des composés thérapeutiques potentiels.
Traditionnellement, les modèles de rongeurs et les systèmes de culture cellulaire ont été utilisés pour étudier la biologie osseuse. Cependant, le poisson-zèbre devient de plus en plus un autre modèle de choix. Bien qu’il ne s’agisse pas d’un système de mammifères, le poisson-zèbre offre certains avantages pour la recherche sur les os par rapport aux rongeurs ; Il s’agit notamment de leur fécondité et de la translucidité des larves ; Même à l’âge adulte, certains tissus squelettiques, y compris les écailles et les nageoires, restent translucides, ce qui permet une imagerie in vivo à haute résolution et une disponibilité accrue de mutants squelettiques 2,3. Les nageoires et les écailles du poisson-zèbre sont capables de se régénérer complètement après leur prélèvement. La régénération squelettique et la réparation des blessures des nageoires du poisson-zèbre ont fait l’objet d’études approfondies 4,5, tandis que les écailles de poisson-zèbre sont un modèle osseux plus récent sur le terrain, mais offrent des avantages pour la culture ex vivo 6.
Les écailles sont très abondantes, avec au moins 300 écailles sur chaque poisson qui servent de couverture protectrice pour le poisson. Chaque écaille est une petite plaque minéralisée constituée d’ostéoblastes formant des os et d’ostéoclastes résorbant les os d’une matrice squelettique riche en collagène7. Le processus d’ossification des écailles de poisson-zèbre et des os humains nécessite la différenciation des cellules souches mésenchymateuses en ostéoblastes pour former la matrice minéralisée. Les écailles de poisson-zèbre offrent un grand avantage pour la recherche sur le squelette grâce à leur forte capacité de régénération qui peut être utilisée pour étudier la régénération et la réparation osseuses. Cependant, malgré la présence d’ostéoblastes et d’ostéoclastes, les écailles du poisson-zèbre manquent d’ostéocytes qui sont importants pour le remodelage osseux humain et la mécanosensation ; L’emplacement superficiel des écailles signifie qu’elles peuvent être facilement retirées avec une paire de pinces. Lors de l’enlèvement de la tartre, une cascade d’événements se produit et la régénération de la cochenille commence 8,9. Il existe différentes options de coloration et d’imagerie pour visualiser l’activité des ostéoblastes et des ostéoclastes et la minéralisation des écailles, comme le montre la figure 1. De plus, la disponibilité de nombreuses lignées rapporteures transgéniques fluorescentes pertinentes de poissons-zèbres permet de visualiser la dynamique cellulaire au cours de la régénération 7,10,11. Ce processus permet de mieux comprendre la formation osseuse de novo en observant la structuration précoce de la régénération des écailles sur le flanc du poisson afin d’étudier la morphologie, l’activité cellulaire et les profils génétiques de ces écailles régénérées. La biologie de la formation et de la régénération des cochenilles a été bien caractérisée. Il est important de noter que les écailles peuvent montrer une bonne capacité prédictive pour les composés thérapeutiquement pertinents12 et que le traitement des poissons avec des glucocorticoïdes conduit à une cochenille qui se régénère pour montrer les phénotypes ostéoporotiques13. Le transcriptome des échelles de régénération montre que les gènes activés dans la régénération des écailles sont enrichis pour ceux liés aux maladies du squelette humain, démontrant ainsi leur pertinence en tant que système modèle 6,14.
Enfin, ces écailles peuvent être cultivées ex vivo jusqu’à 7 jours. Par rapport aux cultures de lignées cellulaires qui sont généralement composées d’un seul type de cellule, la culture ex vivo à l’échelle offre des possibilités d’étude osseuse in vitro dans son environnement naturel contenant à la fois des ostéoblastes et des ostéoclastes avec sa matrice extracellulaire naturelle 8,12,15,16.
La culture à l’échelle nous permet également d’effectuer un criblage de médicaments pour de nouvelles cibles ostéoanabolisantes. L’abondance d’écailles sur le poisson signifie que l’on peut remplir au moins deux plaques de la plaque à 96 puits à partir d’un seul poisson, ce qui permet un criblage composé dans un format multipuits où chaque puits contient une écaille ainsi que sa niche naturelle de cellules. De plus, comme les écailles sont minces, l’absorption du médicament est prévisible12. En résumé, les écailles élasmoïdes du poisson-zèbre ont un grand potentiel dans la recherche sur le squelette et peuvent nous aider à mieux comprendre les événements cellulaires lors de la formation et de la réparation des os. Nous décrivons ici les protocoles de prélèvement des écailles pour suivre la régénération in vivo et cultiver les écailles ex vivo.
Protocole
L’Unité scientifique animale de l’Université (ASU) est responsable des soins aux poissons-zèbres sous la direction des directives d’élevage des poissons-zèbres. Toutes les procédures, y compris le prélèvement de tartres, la coloration d’os vivants et l’imagerie en direct, ont été approuvées et effectuées dans le cadre d’une licence de projet du ministère de l’Intérieur du Royaume-Uni (PP4700996). Pour ce manuscrit, de jeunes poissons-zèbres transgéniques adultes de la lignée sp7 :mCherry [Tg(osterix :mCherry-NTR)pd46] ont été utilisés17. Les poissons comprenaient des mâles et des femelles âgés de 4 mois.
1. Régénération à l’échelle in vivo
- Avant de commencer l’expérience de régénération des écailles, transférez les poissons-zèbres de leurs bassins principaux dans des bassins individuels (voir le tableau des matériaux) et retournez dans ces bassins individuels en suivant l’imagerie tout au long de l’expérience, comme le montre la figure 2. Il s’agit de s’assurer que toutes les écailles régénératrices sont celles récoltées pour l’expérience ; Le logement en groupe peut entraîner une perte sporadique d’écailles en raison de blessures causées par d’autres poissons.
REMARQUE : Les poissons sont placés individuellement pour éviter les combats et la perte d’écailles subséquente entre les poissons. - Consigner l’information sur chaque poisson expérimental (c.-à-d. génotype, âge et sexe) selon le plan de l’expérience. Utilisez un appareil photo (les appareils photo des smartphones fonctionnent bien) pour prendre une image de chaque poisson à côté d’une règle afin d’enregistrer la taille/longueur et l’état de santé des poissons.
- Le jour de l’expérience, anesthésier le poisson-zèbre à l’aide de 0,05 % (v/v) de sulfonate de méthane de tricaïne (MS222, voir tableau des matériaux) par immersion, puis le placer sur une boîte de Pétri avec un tissu humide pour éviter le mouvement du poisson pendant l’imagerie ou la récolte.
- Placez le poisson sur le côté (généralement le flanc gauche est utilisé ici pour plus de cohérence). Effectuer une imagerie de flanc à l’aide d’un stéréomicroscope avec un grossissement approprié (en général, 2x, 4x et/ou 6,3x et 8x ont été utilisés pour la présente étude afin de capturer à la fois la zone de régénération globale et la zone agrandie pour une observation détaillée).
NOTE : Les points temporels de l’imagerie de flanc dépendent de l’objectif expérimental et du choix des rapporteurs transgéniques. Par exemple, pour suivre les ostéoblastes pendant la régénération des cochenilles, les points de temps suggérés sont le jour 0 (ontogénétique), 2 jours après la récolte (dph), 4 dph, 7 dph, 10 dph, 14 dph, 21 dph. Pour réduire les effets de l’anesthésie répétée, limitez les points de temps d’imagerie au minimum requis pour l’expérience. - Prélever des écailles à l’aide d’une pince fine et d’une pince sous le stéréomicroscope. Transférez les écailles récoltées dans des tubes de collecte pour la coloration ultérieure des tartres.
REMARQUE : Le nombre maximal de cochenilles pouvant être récoltées dépendra des approbations éthiques locales en vigueur. Nous récoltons généralement environ 20 à 30 cochenilles et les collectons dans des tubes de collecte individuels pour une coloration ultérieure des cochenilles, comme ALP, von Kossa14. - Recueillir les écailles dans un tube de collecte de 1,5 ml ou de 2 ml. Cela dépend de la technique de coloration utilisée.
- Pour la coloration ALP et von Kossa, transférez les écailles dans des tubes de collecte contenant de l’eau déminéralisée, tandis que pour la coloration TRAP ou l’immunohistochimie, transférez les écailles dans des tubes de collecte contenant 4% de PFA (solution de fixation).
- Facultatif : Avant de transférer les écailles dans les tubes, capturez des images de chaque écaille récoltée si nécessaire.
REMARQUE : Les points temporels de récolte suggérés sont le jour 0 (ontogénétique), le jour 10 et le jour 21 (écailles régénérées).
2. Coloration osseuse vivante
NOTA : La coloration des squelettes vivants peut être effectuée soit lorsque les poissons expérimentaux ne sont pas transgéniques pour les rapporteurs fluorescents, soit lorsqu’ils transportent des rapporteurs transgéniques unicolores. La coloration vivante peut être utilisée en complément des transgéniques ; par exemple, on peut utiliser un rapporteur d’ostéoblastes tel que sp7/osx dans une couleur (par exemple, GFP), puis colorer l’os en rouge avec du rouge d’alizarine (AR). L’AR et le vert de calcéine peuvent être utilisés pour le même poisson ensemble ; dans ce scénario, l’AR est utilisée pour marquer l’os d’origine ou ontogénétique en se liant à la matrice minéralisée de l’os âgé, et la calcéine se lie aux ions calcium qui sont abondants dans l’os nouvellement formé. Par exemple, lors de la coloration d’une échelle ontogénétique, l’AR peut être visualisé, mais le vert de calcéine peut être absent ou minime car les échelles ontogénétiques ont de faibles niveaux de formation de nouveaux os.
- Effectuer une coloration en direct au rouge d’alizarine (AR).
- Préparer un flacon de solution de coloration AR 2x en mélangeant une solution d’alizarine à 0,5 % (p/v) (10 mL) avec 10 mL de 1 M de HEPES (concentration finale, 10 mM) (voir le tableau des matériaux).
- Complétez jusqu’à 1 L avec 1x solution de Danieau (voir tableau des matériaux). La solution doit être conservée à l’abri de la lumière ou enveloppée de papier d’aluminium.
- Le jour de l’expérience, apportez 500 mL de solution AR 2x à l’installation de poisson-zèbre et ajoutez 500 mL d’eau du système (de l’aquarium) pour obtenir une solution AR 1x fonctionnelle.
- Transférez les poissons de leurs aquariums dans une solution de coloration AR 1x et laissez agir pendant 15 à 20 minutes. Lavez l’excès de tache sur le poisson avec 15 minutes de « lavage » dans l’eau du système.
- Effectuer une coloration en direct du vert calcéine.
- Préparer un flacon de 2x solution colorante Calcein Green en ajoutant 45 mg de poudre de Calcein dans 900 mL de solution 1x Danieau (voir le tableau des matériaux). Utilisez un agitateur magnétique pour permettre à la poudre de se dissoudre complètement.
- Ajustez le pH à 8. Il s’agit de la solution Calcein Green 2x stock. La solution peut être conservée dans l’obscurité / enveloppée dans du papier d’aluminium jusqu’à 1 mois.
- Le jour de l’expérience, apportez 500 mL de solution 2x Calcein Green à l’installation de poisson-zèbre et ajoutez 500 mL d’eau du système pour obtenir 1x solution Calcein Green fonctionnelle. Il est recommandé d’utiliser une solution de coloration Calcein fraîchement préparée.
- Transférez les poissons de leur aquarium dans 1x solution de coloration Calcein Green et laissez-les agir pendant 1 à 2 h. Selon la taille du poisson, un temps de coloration plus long peut être nécessaire.
- Lavez l’excès de tache sur le poisson en 15 minutes de « lavage » dans l’eau du système.
REMARQUE : Imaginez le poisson taché de vert calcéine dès que possible car cette tache s’estompera en quelques heures.
3. Coloration de la phosphatase alcaline (ALP) sur les écailles après la récolte
- Préparez la solution de coloration ALP en mélangeant 100 mM de Tris (pH 9,5 avec HCl) avec 100 mM de NaCl et 50 mM de MgCl2.
- Utiliser une solution mère NBT/BCIP disponible dans le commerce (voir le tableau des matériaux).
- Transvasez les écailles dans des tubes contenant de l’eau déminéralisée.
- Rincez les écailles dans la solution de coloration ALP pendant 5 min.
- Entre-temps, préparez une solution de coloration fonctionnelle en ajoutant 200 μL de solution NBT/BCIP à 10 mL de tampon de coloration ALP. Celui-ci doit être fraîchement préparé au moment de la coloration.
- Colorez les écailles avec la solution de coloration ALP pendant 15 min.
- Arrêtez la réaction en rinçant les écailles avec de l’eau déminéralisée.
4. Coloration de Von KOSSA sur les écailles après la récolte
- Préparer une solution de nitrate d’argent à 5 % (p/v).
- Préparer une solution de thiosulfate de sodium à 5 % (p/v).
- Transférez les écailles récoltées dans des tubes contenant de l’eau déminéralisée.
- Incuber les écailles dans la solution de nitrate d’argent pendant 40 min sous une forte lumière.
REMARQUE : Portez un EPI (équipement de protection individuelle) car le nitrate d’argent laisse une tache difficile à enlever. - Lavez les écailles deux fois pendant 5 min avec de l’eau déminéralisée.
REMARQUE : Les déchets de nitrate d’argent doivent être collectés et éliminés conformément aux directives locales. - Incuber les écailles dans du thiosulfate de sodium pendant 5 min.
- Lavez les écailles deux fois pendant 5 min avec de l’eau déminéralisée.
5. Colorimétrie TRAP colorimétrique
NOTE : Pour la procédure détaillée, veuillez vous référer aux travaux publiés précédemment18.
- Préparez les solutions de coloration.
- Préparer une solution de phosphate de naphtol AS-MX à 10 mg/mL.
- Peser 5 mg de phosphate de naphtol AS-MX (voir le tableau des matériaux).
- Dans la hotte, préparez un tube contenant 0,5 mL de N,N'-diméthylformamide et dissolvez 5 mg de phosphate de naphtol AS-MX dans 0,5 mL de N,5 mL de N,N,-diméthylformamide pour obtenir une solution mère de 10 mg/mL de phosphate de naphtol AS-MX (agiter doucement).
- Préparer 1,6 mM de solution mère Fast Red Violet LB dans 50 mM de tartrate de sodium.
- Préparez 50 mL d’acétate de sodium 0,1 M à pH 5 (ajouter 0,41015 g d’acétate de sodium dans 50 mL d’eau déminéralisée et ajuster le pH à 5 avec de l’acide acétique à 100 %).
- Dissoudre 0,575 g de L-tartrate de sodium dibasique dihydraté (voir le tableau des matériaux) dans 50 mL de tampon d’acétate de sodium 0,1 M (pH = 5).
- Ajouter 30 mg de sel LB violet rouge rapide.
- Préparer PBS-0.1Tx (dissoudre 500 μL de Triton-X dans 500 mL de PBS).
- Préparer PBS-0.1Tw (dissoudre 500 μL de Tween-20 dans 500 mL de PBS).
- Préparer une solution de phosphate de naphtol AS-MX à 10 mg/mL.
- Préparez une solution TRAP qui fonctionne.
- Mélanger les deux solutions mères dans la hotte (0,5 mL de solution de phosphate de naphtol AS-MX à 10 mg/mL et 50 mL de solution mère de 1,6 mM de Fast Red Violet LB dans 50 mM de tartrate de sodium).
REMARQUE : La solution de travail peut maintenant être utilisée à l’extérieur de la hotte. Il peut être conservé au réfrigérateur (enveloppé dans du papier d’aluminium) jusqu’à un mois. Conserver dans des récipients séparés des anticorps ou d’autres réactifs sensibles aux fixateurs. Tenir à l’abri de la lumière autant que possible. - Facultatif : préparer une solution de blanchiment (sur des échantillons post-fixés qui ont été colorés au TRAP) dans du PBS et 0,1 % Tween-20 (PBS-0,1 % Tw).
- Préparer un mélange de concentration finale composé de 0,5 % d’hydroxyde de potassium (KOH) (à partir d’une solution mère à 10 % (p/v)) et de peroxyde d’hydrogène à 3 % (H2O2) (solution mère à 33 %, conservée au réfrigérateur).
- Mélanger les deux solutions mères dans la hotte (0,5 mL de solution de phosphate de naphtol AS-MX à 10 mg/mL et 50 mL de solution mère de 1,6 mM de Fast Red Violet LB dans 50 mM de tartrate de sodium).
- Effectuez la fixation de l’échantillon.
- Fixez les échelles dans 4% PFA dans 1x PBS en les balançant ou en les faisant tourner pendant 40 min à température ambiante (RT).
- Retirez les 4 % de PFA et lavez avec PBS-0.1Tx au moins 3 fois pendant 5 min à chaque lavage.
- Passez directement à la coloration TRAP (la meilleure approche) ou stockez-la dans du PBS-0.1 Tx pendant la nuit.
- Effectuez la coloration des écailles par TRAP.
- Retirer la solution de PBS-0.1 Tx et ajouter la solution de travail colorimétrique TRAP (étape 5.2.1) pour recouvrir complètement les échantillons (c’est-à-dire 1 mL dans un tube de microcentrifugation de 1,5 mL).
- Incuber pendant 1 à 2 h à RT, en se balançant dans l’obscurité.
- Retirez la solution de teinture et lavez au moins 3 fois avec PBS-0.1 Tw pendant 5 min à chaque lavage.
- Post-fixez les échantillons dans du PFA à 4 % pendant 30 min à RT, en les balançant doucement dans l’obscurité.
- Retirez la solution de PFA en lavant 3 fois avec PBS-0.1 Tw pendant 5 min à chaque étape.
REMARQUE : Les échantillons peuvent être conservés (dans des solutions de stockage/montés sur des lames de microscope) à 4 °C dans l’obscurité indéfiniment.
6. Montage des écailles tachées
- Préparez le support d’enrobage en ajoutant 2,4 g de cristaux Mowiol 4-88 à 6 g de glycérol (voir tableau des matériaux). N’importe quel support de montage préféré peut être utilisé.
- Ajouter 6 mL d’eau déminéralisée et laisser agir sur un agitateur magnétique pendant une heure.
- Ajouter 12 mL de 0,2 M Tris (pH 8,5) et incuber à environ 53 ° C jusqu’à ce que les cristaux de Mowiol se dissolvent complètement.
- Clarifier la solution en centrifugeant à 2000 x g pendant 20 min à température ambiante.
- Transférez la solution dans un récipient de stockage. Le support de montage peut être conservé au congélateur pendant environ 12 mois. La solution Mowiol décongelée est stable jusqu’à 1 mois.
- Montez les écailles sur une lame de microscope dans le montage du support, couvrez-les d’une lamelle et regardez-les au microscope.
7. Culture ex vivo des écailles
NOTE : Cette étape est adaptée de de Vrieze et al.12.
- Avant de récolter les cochenilles dans un environnement stérile, préparez le milieu ostéogénique et la plaque de culture.
- Milieu de culture ostéogénique (OCM) : Dans un tube à centrifuger stérile, préparer 15 mL d’OCM dans un milieu de culture cellulaire standard (glucose élevé, sans glutamine, sans rouge de phénol) aux concentrations finales de 1 % de sérum de veau bovin, 1 % (200 mM de L-alanyl-L-glutamine dipeptide dans 0,85 % de NaCl), 1 % de solution antibiotique/antimycosique (100x), 4 mM de CaCl2, 10 mM de β-glycérophosphate, 1 nM de pyruvate de sodium et 1 % d’amphotéricine B (facultatif) (voir le tableau des matériaux).
- Versez l’OCM dans un réservoir de réactif stérile et, à l’aide d’une pipette multicanaux, ajoutez 100 μL dans chaque puits de la plaque à 96 puits.
- Scellez la plaque à 96 puits et rangez-la. L’OCM peut être conservé au réfrigérateur pendant une courte période (une nuit à 1 semaine) et conservé à 28 °C avant utilisation.
- Effectuer la récolte des tartres et le lavage du PBS.
- Prélevez les écailles à l’aide d’une pince à épiler stérile et déposez-les dans une boîte de Pétri contenant une solution stérile de PBS.
- Effectuez la configuration de la plaque.
- Transférer chaque écaille de la boîte de Pétri dans chaque puits de la plaque à 96 puits avec 100 μL d’OCM (réchauffée à 28 °C) à l’aide d’une pince stérile.
- Une fois que toutes les écailles sont transférées sur la plaque, amenez-la sous un stéréomicroscope. À l’aide d’une pointe de pipette fine et stérile, déplacez doucement chaque écaille vers le fond du puits et éloignez-les du côté des puits afin d’éviter la réflexion de la lumière pendant l’acquisition de l’image.
REMARQUE : Cette étape n’est requise que si vous effectuez des images en direct. - Transférez délicatement la plaque dans l’incubateur ou le système d’imagerie en direct (LIS, voir tableau des matériaux) (réglé à 28 °C, 5 % de CO2), où les écailles peuvent être cultivées jusqu’à 7 jours.
- Actualiser OCM (facultatif).
- Réchauffez l’OCM qui a été conservé au réfrigérateur à 28 °C.
- Transférez délicatement la plaque à 96 puits dans un environnement stérile. À l’aide d’une pipette multicanaux, aspirer 50 μL de chaque puits. Pour cela, appuyez les pointes contre les parois et ne les trempez pas jusqu’au fond pour éviter d’aspirer/déplacer/enlever les écailles. Utilisez de nouveaux embouts pour différentes conditions.
- Versez l’OCM dans un réservoir de réactif stérile et, à l’aide de la pipette multicanal, ajoutez 60 μL d’OCM dans chaque puits.
- Placez la plaque sous le stéréomicroscope et vérifiez qu’il n’y a pas d’écailles mal placées (trop près des murs, flottantes ou en position verticale dans le support). Repositionnez-les à l’aide d’un embout de pipette fin et stérile si nécessaire.
- Replacez la plaque dans l’incubateur/LIS.
REMARQUE : Ne rafraîchissez pas le milieu si l’expérience implique le rythme circadien (RC), car le choc sérique peut affecter l’horloge biologique. Notez que si vous étudiez CR, notez que les conditions d’éclairage réinitialisent également l’horloge.
- Effectuer une coloration et une imagerie à l’échelle post-culture (facultatif).
- Après 6 jours de culture, fixez-les et dirigez-les vers une coloration appropriée telle que von Kossa et ALP mentionnées ci-dessus.
- Alternativement, si les poissons expérimentaux ont une étiquette fluorescente, placez la plaque dans un système d’imagerie en direct.
REMARQUE : Si vous utilisez un système d’imagerie en direct, assurez-vous qu’il est réglé à une température et à un niveau de CO2 appropriés pour l’expérience. En règle générale, dans cette étude, 28 °C et 5 % de CO2 ont été utilisés. Sélectionner des filtres et des points de temps d’imagerie appropriés (ici, un intervalle de 2 ou 4 h, qui est suffisant pour suivre la migration des ostéoblastes, a été utilisé) et des objectifs à faible grossissement (c’est-à-dire 4x) pour assurer une imagerie uniforme de l’ensemble des puits. En effet, les écailles ont tendance à se déplacer à l’intérieur des puits, en particulier lors des changements de milieu.
Résultats
Régénération de l’échelle
La régénération des écailles peut être suivie à l’aide d’un stéréomicroscope fluorescent standard en imageant le flanc du poisson-zèbre. La figure 3A montre les changements dans l’expression sp7/osx des écailles au cours de la régénération des écailles chez un poisson-zèbre âgé de 4 mois. Les points temporels pour l’imagerie des flancs illustrés à la figure 3A sont ontogénétiques (écailles d’origine, avant la récolte), le jour 2, le jour 4 et le jour 10 après la récolte. Nous utilisons généralement des lignées transgéniques osx (également connues sous le nom d’osterix ou sp7) (soit sous forme de GFP (Tg(Ola.sp7 :NLS-eGFP)19 ou mCherry Tg(osterix :mCherry-NTR)46)17 pour suivre les changements dans le système squelettique lorsqu’il marque les ostéoblastes qui fabriquent des os. Des motifs précoces d’écailles nouvellement formées peuvent être observés sur 2 jours de régénération. Ce modèle précoce de régénération des écailles est perturbé dans certains cas, en particulier chez les mutants squelettiques. En suivant les progrès de la régénération, on peut analyser la capacité et le taux de régénération. Le jour de la récolte des cochenilles, l’imagerie individuelle des cochenilles récoltées peut être effectuée après l’imagerie des flancs à l’aide du même stéréomicroscope, comme le montre la figure 3B. Les écailles régénérées ont une expression d’osx beaucoup plus élevée que les écailles ontogénétiques du jour 0 car les ostéoblastes sont nécessaires à la formation du nouvel os.
Culture à l’échelle ex vivo
Bien que l’on puisse étudier le processus de formation osseuse de novo en suivant le processus de régénération sur le flanc du poisson, nous pouvons également utiliser ce modèle pour étudier la réparation et la cicatrisation des blessures squelettiques avec une culture à l’échelle ex vivo en faisant une blessure sur les écailles avec un scalpel. À l’aide d’un système d’imagerie en direct, la réparation peut être suivie en temps réel. La figure 4 montre un résultat représentatif d’une réponse de cicatrisation à l’échelle ontogénétique en 3 jours dans une culture où les ostéoblastes sont marqués avec osx : mCherry. Le site de la lésion indiqué par les encarts au début de la culture montre un écart évident entre les ostéoblastes et les cercles d’écailles (figure 4A). On peut surveiller la migration des ostéoblastes vers le site de la blessure avec l’imagerie en accéléré. Après 3 jours de culture, la largeur de l’espace est réduite et l’expression del’osx peut être observée entre l’espace et les cercles d’écailles nouvellement formés (Figure 4B). De plus, la morphologie en termes de forme des ostéoblastes, est plus circulaire au début de la culture et après 3 jours, elle est plus allongée. Ce changement dans l’apparence des ostéoblastes est probablement dû au fait qu’ils sont en culture et non dans leur environnement naturel (attaché au poisson).
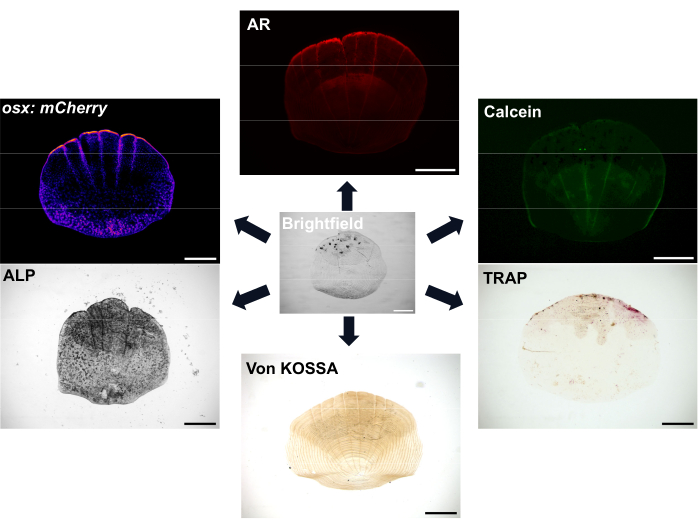
Figure 1 : Exemples d’options d’imagerie pour les balances. Les ostéoblastes peuvent être visualisés avec des lignées rapporteures transgéniques osx/sp7 (soit dans GFP, soit dans mCherry). La coloration ALP peut être utilisée pour montrer l’activité des ostéoblastes. La coloration TRAP peut montrer l’activité des ostéoclastes. Le rouge d’alizarine (AR) et le vert de calcéine sont tous deux des colorants qui peuvent être utilisés dans les poissons vivants ; L’AR marque la minéralisation et la calcéine marque l’os nouvellement formé. L’étendue de la minéralisation peut également être démontrée par la coloration de von Kossa. Barres d’échelle : 500 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
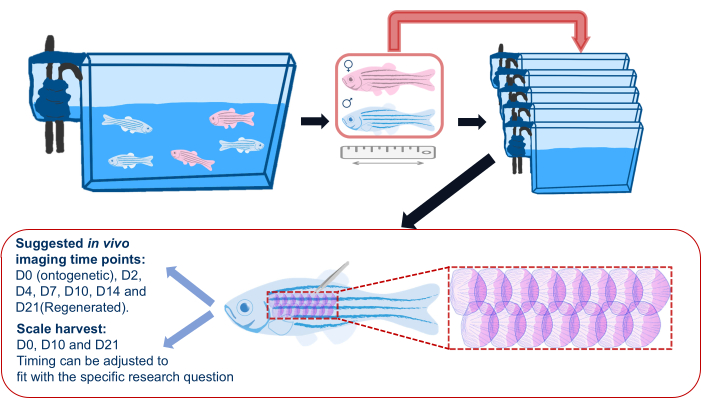
Figure 2 : Illustration schématique d’une expérience de régénération à l’échelle. Schéma générique d’une expérience de régénération à l’échelle montrant que les poissons sont séparés dans des bassins individuels avant l’expérience. La durée, le sexe et l’état de santé sont enregistrés. Le schéma montre également la zone suggérée sur le flanc du poisson pour récolter les écailles et les points temporels d’imagerie suggérés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
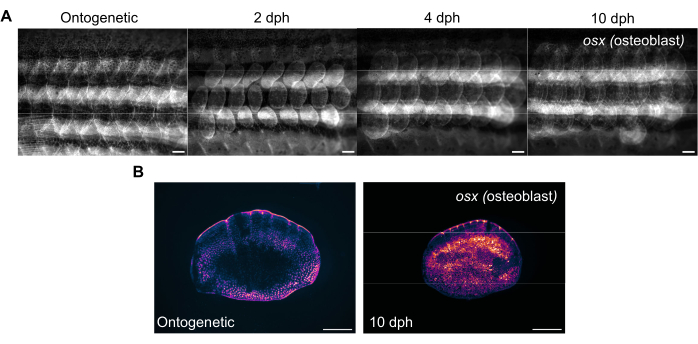
Figure 3 : Images représentatives de l’expression d’osterix (pour visualiser les ostéoblastes) au cours de la régénération des écailles prises sur un poisson-zèbre de 4 mois. (A) Les images de flanc capturées le jour 0 (avant la récolte, échelles ontogénétiques), 2 dph (jours après la récolte), le jour 2, 4 dph et 10 dph pour le suivi des changements dans l’expression d’osx. Barres d’échelle : 1 mm. (B) Images représentatives d’une échelle ontogénétique et d’une échelle à 10 dph prises sur le même poisson que dans le panneau (A). Notez l’augmentation des niveaux d’expression d’osx comme indiqué en magenta au centre des échelles de régénération. Barres d’échelle : 500 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
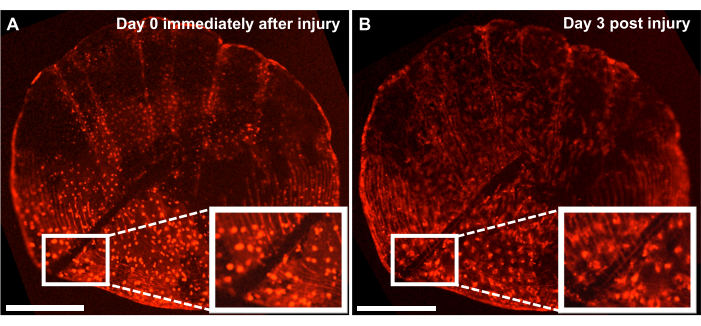
Figure 4 : Résultats représentatifs de la réponse à la réparation des lésions squelettiques à l’échelle ontogénétique capturées sur un poisson-zèbre de 4 mois à l’aide d’un système d’imagerie en direct. (A) Écailles ontogénétiques avec une blessure faite par le scalpel le même jour que la récolte (point temporel 0/jour0) de la culture. (B) La même échelle est affichée 3 jours après la blessure. L’encart montre la région de la blessure. Barres d’échelle : 500 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les écailles élasmoïdes du poisson-zèbre, en tant que nouveau modèle pour la recherche sur le squelette, ont un grand potentiel pour aider à notre compréhension du maintien osseux, de la régénération et de la réparation des blessures. L’abondance d’écailles sur les poissons permet un criblage de composés à débit moyen à élevé tout en réduisant le nombre d’animaux utilisés et en limitant les variations intra-individuelles. Ici, des protocoles de régénération à l’échelle et de culture à l’échelle ex vivo sont présentés pour étudier la régénération et la réparation.
Certaines étapes critiques doivent être prises en compte lors de l’application de ce protocole. L’élimination soigneuse des écailles est essentielle, en particulier lors de l’utilisation d’une lignée rapporteure transgénique afin de limiter la perturbation de la population cellulaire causée par le prélèvement. Si des comparaisons doivent être faites avec des écailles ontogénétiques, assurez-vous que la région ne contient pas d’écailles qui se régénèrent spontanément (ce qui peut se produire naturellement tout au long de la vie du poisson). S’assurer que l’environnement et l’équipement sont stériles pour la culture ex vivo afin d’obtenir une survie cellulaire optimale et une infection minimale en culture.
En fonction de la question de recherche spécifique, des adaptations peuvent être apportées au protocole, telles que la combinaison de différentes lignées rapporteures transgéniques pour visualiser d’autres types de profils d’expression génique au cours de la régénération et de la réparation11,14.
La large gamme de coloration que l’on peut effectuer sur les balances signifie que pour chaque composé ou condition testé, on peut examiner ses effets sur l’os sous différents angles ; tandis que les rapporteurs sp7/osx peuvent afficher le nombre d’ostéoblastes, la coloration ALP peut visualiser l’activité des ostéoblastes, la coloration TRAP peut visualiser l’activité des ostéoclastes, la coloration vivante au vert calcéine peut marquer l’os nouvellement formé et la coloration au rouge d’alizarine ou à von Kossa peut montrer la minéralisation à l’échelle du tartre. L’activité de la luciférase pour quantifier les ostéoblastes peut également être utilisée12. Combiné à ces techniques de coloration, on peut apprendre la contribution relative des ostéoblastes et des ostéoclastes à un effet osseux donné. Les écailles manquent d’ostéocytes, qui sont répandus dans les os des mammifères et sont les principaux moteurs de la réponse mécanosensorielle osseuse ; Dans ce modèle, la réparation et la régénération du tartre sont principalement pilotées par les ostéoblastes, puis par les ostéoclastes 8,9. Il est essentiel de noter qu’il existe des variations entre les individus et les groupes d’âge20. Pour minimiser ce phénomène, la zone de récolte des cochenilles doit être constante, car différents endroits peuvent donner lieu à des morphologies d’écailles différentes, et des poissons des mêmes groupes frères et sœurs sont utilisés afin que l’âge et la taille soient cohérents. Cependant, comme il est possible de récolter plusieurs écailles par poisson, il est possible d’effectuer plus d’expériences en utilisant moins de poissons, ce qui réduit la variabilité intraindividuelle.
En résumé, ces protocoles montrent des techniques expérimentales qui peuvent être appliquées à des échelles ontogénétiques et régénératrices. En conclusion, les écailles d’élasmoïde présentent un grand potentiel en tant que modèle squelettique pour aider à la compréhension de la formation et de la réparation osseuses ; et contribuera à réduire l’utilisation d’animaux pour le criblage de composés ostéoanabolisants à haut débit.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous tenons à remercier Mathew Green, de l’Unité des services animaliers pour l’élevage des poissons, et Katy Jepson, du Centre de bioimagerie Wolfson. CLH, DB et QT ont été financés par Versus Arthritis (CLH Senior Fellowship 21937, DB and QT Intermediate Fellowship 22044), RR a été financé par (NHMRC APP1158758). Ce travail a également été soutenu par la subvention du BBSRC (BB/T001984/1).
matériels
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffered saline (PBS) | Gibco | 70013-016 | PBS |
| 12-Multichanel Pipette | Sartorius | 728230 | Multichanel pipette, Proline Plus Mechanical Pipette, 12 Channel, , 10-100 µL. |
| 15 mL Centrifuge tubes | Corning | 430791 | Centrifuge tube, CentriStar Cap, Polypropylene, RNAse/DNAse free, Non-pyrogenic |
| 4% Paraformaldehyde (PFA) | Sigma | P6148 | PFA |
| Alizarin red | Sigma | A5533 | |
| Amphotericin B | ThermoFisher Scientific | 15290026 | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher Scientific | 11772644 | Sealing film |
| Calcein powder | Sigma | C0875 | |
| Calcium Chloride | Thermo Scientific | L13191.30 | |
| Corning 96 well plate | Corning | 3596 | 96-well-plate, Clear, Flat Bottom Polystyrene TC-treated Microplates, Individually Wrapped, with Lid, Sterile |
| Cover slips | VWR | 631-0146 | |
| Cytiva HyClone Iron-Supplemented Calf Serum | Fisher Scientific | SH30072.03 | |
| Danieau | Sigma | ||
| DMEM | Life Technologies | 31053 | |
| Falcon tubes | Corning | 430828 | |
| Fast Red Violet LB stock solution | Sigma | F3381 | |
| GlutaMAX Supplement | Life Technologies | 35050 | |
| Glycerol | Sigma | 81381 | |
| Hepes | Sigma | H3375 | |
| Incubator | X | Incubator, Set up to 28 °C and 5% CO2 | |
| IncuCyte Zoom | Sartorious | X | Live Imaging System, Set up to 28 °C and 5% CO2 |
| Leica stereomicroscope | X | Sterioscope | |
| L-tartrate dibasic dihydrate | Sigma | 228729 | |
| Mgcl2 | BDH Laboratory Sup. | 261237T | |
| Microscope slides | Epredia | J2800AMNZ | |
| Mowiol 4-88 | Sigma | 9002-89-5 | |
| MQ water | X | ||
| N, N’-dimethylformamide (Merck: D4451) | Merck | D4451 | |
| NaCL | Fisher Chemical | S/3120/53 | |
| Naphthol AS-MX phosphate | Merck | N4875 | |
| NBT/BCIP solution | Sigma | #000000011681451001 | |
| Penicillin-Streptomycin | Life Technologies | 15140 | |
| Petri Dishes | Corning | 430589 | 35 mm sterile Petri dish, Non-treated, Nonpyrogenic, Polystyrene. |
| Reagent Reservoir | Startub | E2310-1025 | 25mL Reagent Reservoir |
| Silver nitrate | Sigma | 209139 | |
| Sodium acetate | Sigma | 52889 | |
| Sodium beta-glycerophosphate pentahydrate | Thermo Scientific | L03425.14 | |
| Sodium pyruvate solution | Sigma | S8636 | |
| Sodium tartrate | Sigma | S4797 | |
| Sodium thioculphate | Sigma | 563188 | |
| Tricaine methane sulfonate (MS222) | Sigma | E10521 | |
| Tris | Sigma | 252859 | |
| Triton-X100 | Sigma | T8787 | |
| Tween-20 | SLS | CHE3852 | |
| Tweezers Number 5 | Dumont | 500341 | Tweezer, INOX, biology grade |
| Zebrafish tanks | Tecniplast | ZB30BCP | 3.5 L - 28 cm x 11 cm x 17 cm |
| Zebrafish tanks | Tecniplast | ZB30BCP | 1 L - 28 cm x 7 cm x 11 cm |
Références
- Tobias, J. H., et al. Opportunities and challenges in functional genomics research in osteoporosis: report from a workshop held by the causes working group of the osteoporosis and bone research academy of the Royal Osteoporosis Society on October 5th 2020,". Frontiers in Endocrinology. 11, (2021).
- Busse, B., Galloway, J. L., Gray, R. S., Harris, M. P., Kwon, R. Y. Zebrafish: An emerging model for orthopedic research. Journal of Orthopaedic Research. 38 (5), 925-936 (2020).
- Dietrich, K., et al. Skeletal biology and disease modeling in zebrafish. Journal of Bone and Mineral Research. 36 (3), 436-458 (2021).
- McGowan, L. M., Kague, E., Vorster, A., Newham, E., Cross, S., Hammond, C. L. Wnt16 elicits a protective effect against fractures and supports bone repair in zebrafish. JBMR Plus. 5 (3), 10461 (2021).
- Sehring, I., Weidinger, G. Zebrafish fin: Complex molecular interactions and cellular mechanisms guiding regeneration. Cold Spring Harbor Perspectives in Biology. 14 (7), 040758 (2022).
- Bergen, D. J. M., Kague, E., Hammond, C. L. Zebrafish as an emerging model for osteoporosis: a primary testing platform for screening new osteo-active compounds. Frontiers in Endocrinology. 10 (6), (2019).
- Aman, A. J., Fulbright, A. N., Parichy, D. M. Wnt/β-catenin regulates an ancient signaling network during zebrafish scale development. Elife. 7, 37001 (2018).
- Iwasaki, M., Kuroda, J., Kawakami, K., Wada, H. Epidermal regulation of bone morphogenesis through the development and regeneration of osteoblasts in the zebrafish scale. Developmental Biology. 437 (2), 105-119 (2018).
- Metz, J. R., de Vrieze, E., Lock, E. J., Schulten, I. E., Flik, G. Elasmoid scales of fishes as model in biomedical bone research. Journal of Applied Ichthyology. 28 (3), 382-387 (2012).
- Cox, B. D., De Simone, A., Tornini, V. A., Singh, S. P., Di Talia, S., Poss, K. D. In toto imaging of dynamic osteoblast behaviors in regenerating skeletal bone. Current Biology. 28 (24), 3937-3947 (2018).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders,". Frontiers in Endocrinology. 11, (2020).
- de Vrieze, E., Zethof, J., Schulte-Merker, S., Flik, G., Metz, J. R. Identification of novel osteogenic compounds by an ex-vivo sp7: Luciferase zebrafish scale assay. Bone. 74, 106-113 (2015).
- De Vrieze, E., Moren, M., Metz, J. R., Flik, G., Lie, K. K. Arachidonic acid enhances turnover of the dermal skeleton: Studies on zebrafish scales. PLoS One. 9 (2), 89347 (2014).
- Bergen, D. J. M., et al. Regenerating zebrafish scales express a subset of evolutionary conserved genes involved in human skeletal disease. BMC Biology. 20 (1), 21 (2022).
- Bergen, D. J. M., et al. High bone mass disorders: New insights from connecting the clinic and the bench. Journal of Bone and Mineral Research. , (2022).
- Pasqualetti, S., Banfi, G., Mariotti, M. Osteoblast and osteoclast behavior in zebrafish cultured scales. Cell and Tissue Research. 350 (1), 69-75 (2012).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Developmental Cell. 22 (4), 879-886 (2012).
- Ethiraj, L. P., Fong, E. L. S., Liu, R., Chan, M., Winkler, C., Carney, T. J. Colorimetric and fluorescent TRAP assays for visualising and quantifying fish osteoclast activity. European Journal of Histochemistry. 66 (2), 3369 (2022).
- DeLaurier, A., et al. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505 (2010).
- Carnovali, M., Banfi, G., Mariotti, M. Age-dependent modulation of bone metabolism in zebrafish scales as new model of male osteoporosis in lower vertebrates. Geroscience. 43 (2), 927-940 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon