Method Article
Zebra Balığı Pul Rejenerasyonu Toto ve Ex Vivo Pul Kültürü
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, in vivo rejenerasyon sırasında zebra balığının elasmoid pullarının toplanmasını ve görselleştirilmesini açıklar. Ayrıca hasattan sonra 7 güne kadar bu ölçeklerin ex vivo kültürü sunulmaktadır.
Özet
İskelet hastalıkları genellikle etiyolojilerinde karmaşıktır ve dünya çapında milyonlarca insanı etkiler. Yaşlanan nüfus nedeniyle, sağlık sistemleri üzerindeki yükü hafifletebilecek yeni terapötiklere ihtiyaç vardır. Bu hastalıklar karmaşık olduğundan, laboratuvar ortamında kemik patofizyolojisini doğru bir şekilde modellemek zor ve pahalıdır. Alanın zorluğu, potansiyel terapötik bileşikleri test etmek için kullanılabilecek kemik hastalığını modellemek için uygun maliyetli, biyolojik olarak ilgili bir platform oluşturmaktır. Böyle bir platform ideal olarak, mineralize matriks ortamlarında hareket eden kemik yapıcı osteoblastların ve kemik parçalayıcı osteoklastların hücre davranışlarının dinamik olarak görselleştirilmesine izin vermelidir. Zebra balıkları, transgenik raportör çizgileri de dahil olmak üzere genetik araçların mevcudiyeti ve bazı iskelet dokularının (pullar dahil) yetişkinliğe kadar yarı saydam kalması ve dinamik görüntüleme seçeneklerine izin vermesi nedeniyle model olarak giderek daha fazla kullanılmaktadır. Zebra balığı pulları hem osteoblastlara hem de osteoklastlara sahip olduklarından ve oldukça bol olduklarından, bağımsız kemik birimlerinin kolay erişilebilir ve bol miktarda bulunabilen bir kaynağını sağlarlar. Ayrıca, bir kez çıkarıldıktan sonra, yetişkin zebra balığı pulları tamamen yenilenir, bu nedenle mineralize dokunun uzay-zamansal büyümesini in vivo olarak incelemenin bir yolunu sunar.Burada, kantarların yenilenmesini ve hasat edilmesini izlemek için protokolleri detaylandırıyoruz. Son olarak, bir hafta boyunca ex vivo olarak stabil ölçek kültürü için bir protokol ve zaman içinde ölçeğin mineralize matrisinde kontrollü hasar gördükten sonra iyileşme tepkisini takip etmek de sunulmaktadır.
Giriş
Kemik, iskeletin büyük bir bölümünü oluşturan, hareketi sağlayan ve vücutta bir mineral rezervi görevi gören sert bir bağ dokusudur. Sağlıklı kemiği korumak için, osteoblastların (anabolik olan) ve osteoklastların (kemiği emilleştiren) birleşik aktivitesi yoluyla kemik oluşumu ve yıkımı arasında mükemmel bir denge gereklidir. Bu denge, yaşlanma veya hormonal dengesizlik nedeniyle bozulur ve genellikle osteoporoz gibi kemik kırılganlığı hastalıklarına yol açar1. Mevcut ilaçların kemik kırılganlığı hastalıklarını hedef alması onaylanmış olsa da, birçoğunun yan etkileri vardır; Bu nedenle, yeni terapötiklere ihtiyaç vardır1. Bu nedenle, potansiyel terapötik bileşikleri test etmek için kullanılabilecek bol miktarda biyolojik olarak ilgili kemik dokusu kaynaklarına ihtiyaç duyulmaktadır.
Geleneksel olarak, kemik biyolojisini incelemek için kemirgen modelleri ve hücre kültürü sistemleri kullanılmıştır. Bununla birlikte, zebra balığı giderek daha fazla tercih edilen başka bir model haline geliyor. Bir memeli sistemi olmasa da, zebra balığı kemirgenlere göre kemik araştırması için belirli avantajlar sunar; bunlar doğurganlıklarını ve larvaların yarı saydamlığını; Yetişkinlikte bile, pullar ve yüzgeçler de dahil olmak üzere bazı iskelet dokuları yarı saydam kalır, bu da yüksek çözünürlüklü in vivo görüntülemeye ve iskelet mutantlarının artan kullanılabilirliğine izin verir 2,3. Zebra balığının hem yüzgeçleri hem de pulları, çıkarıldıktan sonra tamamen yenilenebilir. Zebra balığı yüzgeçlerinin iskelet rejenerasyonu ve yaralanma onarımı kapsamlı bir şekilde incelenmiştir 4,5, zebra balığı pulları ise sahada daha yeni bir kemik modelidir ancak ex vivo kültür için avantajlar sunar6.
Pullar oldukça bol miktarda bulunur ve her balıkta balıklar için koruyucu bir örtü görevi gören en az 300 pul bulunur. Her ölçek, kemik oluşturan osteoblastlardan ve kollajen açısından zengin bir iskelet matrisinin kemik emici osteoklastlarından oluşan küçük bir mineralize plakadır7. Hem zebra balığı pullarının hem de insan kemiklerinin kemikleşme süreci, mineralize matrisi oluşturmak için mezenkimal kök hücrelerin osteoblastlara farklılaşmasını gerektirir. Zebra balığı pulları, kemik yenilenmesi ve onarımını incelemek için kullanılabilecek güçlü rejeneratif yetenekleri ile iskelet araştırmaları için büyük bir avantaj sunar. Bununla birlikte, hem osteoblastların hem de osteoklastların varlığına rağmen, zebra balığı pulları, insan kemiğinin yeniden şekillenmesi ve mekanosensasyonu için önemli olan osteositlerden yoksundur; Ölçeklerin yüzeysel konumu, bir çift forseps ile kolayca çıkarılabilecekleri anlamına gelir. Ölçeğin çıkarılması üzerine, bir dizi olay meydana gelir ve ölçek rejenerasyonubaşlar 8,9. Şekil 1'de gösterildiği gibi, osteoblastların ve osteoklastların aktivitesini ve pulların mineralizasyonunu görselleştirmek için çeşitli boyama ve görüntüleme seçenekleri mevcuttur. Ek olarak, zebra balığının birçok ilgili floresan transgenik raportör hattının mevcudiyeti, rejenerasyon 7,10,11 sırasında hücre dinamiklerini görselleştirebileceği anlamına gelir. Bu süreç, bu rejenere pulların morfolojisini, hücresel aktivitesini ve genetik profillerini incelemek için balığın yan tarafındaki pul rejenerasyonunun erken modelini gözlemleyerek de novo kemik oluşumunun daha iyi anlaşılmasını sağlar. Ölçek oluşumu ve rejenerasyonunun biyolojisi iyi karakterize edilmiştir. Daha da önemlisi, pullar terapötik olarak ilgili bileşikler12 için iyi bir öngörü yeteneği gösterebilir ve balıkların glukokortikoidlerle muamelesi, osteoporotik fenotipleri13 göstermek için yenilenen bir ölçeğe yol açar. Yenileyici ölçeklerin transkriptomu, ölçek rejenerasyonunda aktive olan genlerin, insan iskelet hastalıklarıyla bağlantılı olanlar için zenginleştirildiğini ve bunların bir model sistem olarak alaka düzeyini daha da gösterdiğini göstermektedir 6,14.
Son olarak, bu pullar 7 güne kadar ex vivo olarak kültürlenebilir. Tipik olarak tek bir hücre tipinden oluşan hücre hattı kültürleri ile karşılaştırıldığında, ex vivo ölçekli kültür, doğal hücre dışı matriksi 8,12,15,16 ile hem osteoblast hem de osteoklast içeren doğal ortamında in vitro kemik çalışma olanakları sağlar.
Ölçek kültürü ayrıca yeni osteoanabolik hedefler için ilaç taraması yapmamızı sağlar. Balık üzerindeki pulların bolluğu, 96 oyuklu plakanın en az iki plakasını sadece tek bir balıktan doldurabileceği anlamına gelir, bu da her bir kuyucuğun doğal hücre nişiyle birlikte bir ölçek içerdiği çok kuyulu bir formatta bileşik taramaya izin verir. Ek olarak, ölçekler ince olduğundan, ilaç emilimi tahmin edilebilir12. Özetle, zebra balıklarının elasmoid pulları iskelet araştırmalarında büyük bir potansiyele sahiptir ve kemik oluşumu ve onarımı sırasındaki hücresel olaylar hakkında daha fazla bilgi edinmemize yardımcı olabilir. Burada, in vivo rejenerasyonu takip etmek ve pulları ex vivo kültürlemek için kantar hasadı protokollerini açıklıyoruz.
Protokol
Üniversite Hayvan Bilimsel Birimi (ASU), zebra balığı yetiştiriciliği yönergelerinin rehberliğinde zebra balığı bakımından sorumludur. Ölçek toplama, canlı kemik boyama ve canlı görüntüleme dahil olmak üzere tüm prosedürler onaylandı ve Birleşik Krallık İçişleri Bakanlığı Proje Lisansı (PP4700996) kapsamında gerçekleştirildi. Bu el yazması için sp7:mCherry [Tg(osterix:mCherry-NTR)pd46] hattından genç ergin transgenik zebra balığıkullanılmıştır 17. Balıklar 4 aylık hem erkek hem de dişileri içeriyordu.
1. İn vivo ölçek rejenerasyonu
- Ölçek rejenerasyon deneyine başlamadan önce, zebra balıklarını ana tanklarından ayrı tanklara aktarın (Malzeme Tablosuna bakın) ve Şekil 2'de gösterildiği gibi deney boyunca görüntülemeyi takiben bu ayrı tanklara geri dönün. Bu, tüm yenilenen ölçeklerin deney için hasat edilenler olmasını sağlamak içindir; Grup barınağı, diğer balıkların neden olduğu yaralanmalar nedeniyle sporadik pul kaybına neden olabilir.
NOT: Balıklar, balıklar arasında kavga ve ardından pul kaybını önlemek için ayrı ayrı yerleştirilir. - Deney tasarımına göre her deney balığı için bilgileri (yani genotip, yaş ve cinsiyet) kaydedin. Balık boyutunu/uzunluğunu ve sağlık durumunu kaydetmek için bir cetvelin yanındaki her balığın görüntüsünü almak için bir kamera kullanın (akıllı telefon kameraları iyi çalışır).
- Deney gününde, zebra balığını %0,05 (h/h) trikain metan sülfonat (MS222, bkz . Malzeme Tablosu) kullanarak daldırarak uyuşturun, ardından görüntüleme veya hasat sırasında balığın hareket etmesini önlemek için nemli bir mendil ile bir Petri kabına yerleştirin.
- Balığı yan yatırın (burada kıvam için tipik olarak sol kanat kullanılır). Uygun büyütme oranına sahip bir stereomikroskop kullanarak yan görüntüleme gerçekleştirin (tipik olarak, ayrıntılı gözlem için hem genel yenilenme alanını hem de yakınlaştırılmış alanı yakalamak için bu çalışma için 2x, 4x ve/veya 6.3x ve 8x kullanılmıştır).
NOT: Yan görüntüleme zaman noktaları, deneysel amaca ve transgenik raportörlerin seçimine bağlıdır. Örneğin, ölçek rejenerasyonu sırasında osteoblastları izlemek için önerilen zaman noktaları Gün 0 (ontogenetik), hasattan 2 gün sonra (dph), 4 dph, 7 dph, 10 dph, 14 dph, 21 dph'dir. Tekrarlanan anestezinin etkilerini azaltmak için, görüntüleme zaman noktalarını deney için gereken en az seviyede tutun. - Stereomikroskop altında ince cımbız ve forseps kullanarak terazileri hasat edin. Hasat edilen pulları daha sonra kireç boyama için toplama tüplerine aktarın.
NOT: Hasat edilebilecek maksimum ölçek sayısı, yürürlükte olan yerel etik onaylara bağlı olacaktır. Tipik olarak yaklaşık 20 ila 30 ölçek hasat ediyoruz ve bunları daha sonra ALP, von Kossa14 gibi ölçek boyama için ayrı toplama tüplerine topluyoruz. - Ölçekleri 1.5 mL veya 2 mL'lik bir toplama tüpünde toplayın. Bu, kullanılan boyama tekniğine bağlıdır.
- Hem ALP hem de von Kossa boyaması için, ölçekleri deiyonize su içeren toplama tüplerine aktarırken, TRAP boyama veya immünohistokimya için ölçekleri %4 PFA (sabitleme solüsyonu) içeren toplama tüplerine aktarın.
- İsteğe bağlı: Terazileri tüplere aktarmadan önce, gerekirse tek tek hasat edilen kantarların görüntülerini yakalayın.
NOT: Önerilen ölçek hasat zaman noktaları 0. gün (ontogenetik), 10. gün ve 21. gündür (yenilenen ölçekler).
2. Canlı kemik boyama
NOT: Canlı iskelet boyama, deney balıkları floresan raportörler için transgenik olmadığında veya tek renkli transgenik raportörler taşırken gerçekleştirilebilir. Transgenikleri tamamlamak için canlı boyama kullanılabilir; örneğin, sp7 / osx gibi bir osteoblast raportörünü tek renkte (örneğin, GFP) kullanabilir, ardından kemiği Alizarin kırmızısı (AR) ile kırmızıya boyayabilir. AR ve kalsein yeşili aynı balıklar için birlikte kullanılabilir; Bu senaryoda AR, yaşlı kemiğin mineralize matrisine bağlanarak orijinal veya ontogenetik kemiği etiketlemek için kullanılır ve kalsein, yeni oluşan kemikte bol miktarda bulunan kalsiyum iyonlarına bağlanır. Örneğin, bir ontogenetik skala boyanırken, AR görselleştirilebilir, ancak ontogenetik pullar düşük seviyelerde yeni kemik oluşumuna sahip olduğundan kalsein yeşili olmayabilir veya minimal olabilir.
- Canlı Alizarin Kırmızısı (AR) boyama gerçekleştirin.
- % 0,5 (a/h) stok Alizarin çözeltisini (10 mL) 10 mL 1 M stok HEPES (son konsantrasyon, 10 mM) ile karıştırarak bir şişe 2x AR boyama çözeltisi hazırlayın (bkz.
- 1x Danieau solüsyonu ile 1 L'ye kadar doldurun ( Malzeme Tablosuna bakın). Çözelti karanlıkta tutulmalı veya folyo ile sarılmalıdır.
- Deney gününde, zebra balığı tesisine 500 mL 2x AR solüsyonu getirin ve 1x çalışan AR solüsyonu yapmak için 500 mL sistem suyu (akvaryumdan) ekleyin.
- Balıkları tanklarından 1x çalışan bir AR boyama solüsyonuna aktarın ve 15-20 dakika bekletin. Balıktaki fazla lekeyi sistem suyunda 15 dakika 'yıkama' ile yıkayın.
- Canlı Calcein Green boyama gerçekleştirin.
- 900 mL 1x Danieau çözeltisine 45 mg Calcein tozu ekleyerek bir şişe 2x Calcein Green boyama solüsyonu hazırlayın (Malzeme Tablosuna bakınız). Tozun tamamen çözülmesini sağlamak için manyetik bir karıştırıcı kullanın.
- PH'ı 8'e ayarlayın. Bu, 2x stok Calcein Green çözümüdür. Çözelti karanlıkta saklanabilir/folyo ile sarılabilir 1 aya kadar.
- Deney gününde, zebra balığı tesisine 500 mL 2x Calcein Green solüsyonu getirin ve 1x çalışan Calcein Green solüsyonu yapmak için 500 mL sistem suyu ekleyin. Taze yapılmış Calcein boyama solüsyonu kullanılması tavsiye edilir.
- Balıkları tanklarından 1x çalışan Calcein Green boyama solüsyonuna aktarın ve 1-2 saat bekletin. Balığın büyüklüğüne bağlı olarak, daha uzun bir boyama süresi gerekebilir.
- Balıktaki fazla lekeyi sistem suyunda 15 dakika 'yıkayarak' yıkayın.
NOT: Calcein Green lekeli balığı mümkün olan en kısa sürede hayal edin, çünkü bu leke birkaç saat içinde solacaktır.
3. Hasat sonrası pullarda alkalin fosfataz (ALP) boyaması
- 100 mM Tris'i (HCl ile pH 9.5) 100 mM NaCl ve 50 mM MgCl2 ile karıştırarak ALP boyama çözeltisini hazırlayın.
- Piyasada bulunan NBT/BCIP stok çözeltisini kullanın (Malzeme Tablosuna bakın).
- Terazileri deiyonize su içeren tüplere aktarın.
- Pulları ALP boyama solüsyonunda 5 dakika durulayın.
- Bu arada, 10 mL ALP boyama tamponuna 200 μL NBT/BCIP çözeltisi ekleyerek çalışan bir boyama çözeltisi hazırlayın. Bunun boyama sırasında taze olarak hazırlanması gerekir.
- Pulları 15 dakika boyunca çalışan ALP boyama solüsyonu ile boyayın.
- Teraziyi deiyonize suyla durulayarak reaksiyonu durdurun.
4. Hasat sonrası pullarda Von KOSSA boyama
- % 5 (a / h) gümüş nitrat çözeltisi hazırlayın.
- % 5 (a / h) sodyum tiyosülfat çözeltisi hazırlayın.
- Hasat edilen terazileri deiyonize su içeren tüplere aktarın.
- Pulları gümüş nitrat çözeltisinde güçlü ışık altında 40 dakika inkübe edin.
NOT: Gümüş nitrat çıkarılması zor bir leke bıraktığı için KKD (kişisel koruyucu ekipman) kullanın. - Terazileri iki kez 5 dakika boyunca deiyonize suyla yıkayın.
NOT: Gümüş nitrat atıkları yerel yönergelere göre toplanmalı ve bertaraf edilmelidir. - Ölçekleri sodyum tiyosülfatta 5 dakika inkübe edin.
- Terazileri iki kez 5 dakika boyunca deiyonize suyla yıkayın.
5. Kolorimetrik TUZAK boyama
NOT: Ayrıntılı prosedür için lütfen daha önce yayınlanmış çalışmayabakın 18.
- Boyama solüsyonlarını hazırlayın.
- 10 mg / mL Naphthol AS-MX fosfat çözeltisi hazırlayın.
- 5 mg Naphthol AS-MX fosfat tartın (Malzeme Tablosuna bakınız).
- Çeker ocakta, 0,5 mL N, N'-dimetilformamid içeren bir tüp hazırlayın ve 10 mg/mL Naphthol AS-MX fosfat stok çözeltisi yapmak için 5 mg Naphthol AS-MX fosfatı 0,5 mL N, N'-dimetilformamid içinde çözün (hafifçe çalkalayın).
- 50 mM sodyum tartrat içinde 1,6 mM Fast Red Violet LB stok çözeltisi hazırlayın.
- pH 5'te 50 mL 0.1 M sodyum asetat hazırlayın (50 mL deiyonize suya 0.41015 g sodyum asetat ekleyin ve pH'ı %100 asetik asit ile 5'e ayarlayın).
- 0.575 g sodyum L-tartrat dibazik dihidratı (Malzeme Tablosuna bakınız) 50 mL 0.1 M sodyum asetat tamponunda (pH = 5) çözün.
- 30 mg hızlı kırmızı menekşe LB tuzu ekleyin.
- PBS-0.1Tx'i hazırlayın (500 μL Triton-X'i 500 mL PBS'de çözün).
- PBS-0.1Tw'yi hazırlayın (500 mL PBS'de 500 μL Tween-20'yi çözün).
- 10 mg / mL Naphthol AS-MX fosfat çözeltisi hazırlayın.
- Çalışan bir TRAP çözümü hazırlayın.
- Her iki stok çözeltisini çeker ocakta karıştırın (50 mM sodyum tartrat içinde 0,5 mL 10 mg/mL Naftol AS-MX fosfat çözeltisi ve 50 mL 1,6 mM Fast Red Violet LB stok çözeltisi).
NOT: Çalışma çözümü artık çeker ocak dışında kullanılabilir. Buzdolabında (folyoya sarılı) bir aya kadar saklanabilir. Antikorlardan veya fiksatiflere duyarlı diğer reaktiflerden ayrı kaplarda saklayın. Mümkün olduğunca ışıktan uzak tutun. - İsteğe bağlı: PBS ve% 0.1 Tween-20 (PBS-0.1% Tw) içinde ağartma solüsyonu (TRAP boyanmış sonradan sabitlenmiş numunelerde) hazırlayın.
- %0,5 potasyum hidroksit (KOH) (%10 stok çözeltisinden (a/h)) ve %3 hidrojen peroksit (H2O2) (%33 stok çözeltisi, buzdolabında saklanan) içeren bir nihai konsantrasyon karışımı hazırlayın.
- Her iki stok çözeltisini çeker ocakta karıştırın (50 mM sodyum tartrat içinde 0,5 mL 10 mg/mL Naftol AS-MX fosfat çözeltisi ve 50 mL 1,6 mM Fast Red Violet LB stok çözeltisi).
- Örnek fiksasyon gerçekleştirin.
- Terazileri oda sıcaklığında (RT) 4 dakika boyunca sallanan veya dönen 1x PBS'de %40 PFA'da sabitleyin.
- %4 PFA'yı çıkarın ve PBS-0.1Tx ile her yıkamada 5 dakika boyunca en az 3 kez yıkayın.
- Doğrudan TRAP boyamaya geçin (en iyi yaklaşım) veya gece boyunca PBS-0.1 Tx'te saklayın.
- Ölçeklerin TRAP boyamasını gerçekleştirin.
- PBS-0.1 Tx çözeltisini çıkarın ve numuneleri tamamen kaplamak için kolorimetrik TRAP çalışma çözeltisini (adım 5.2.1) ekleyin (yani, 1.5 mL'lik bir mikrosantrifüj tüpünde 1 mL).
- RT'de 1-2 saat inkübe edin, karanlıkta sallayın.
- Leke solüsyonunu çıkarın ve her yıkamada 5 dakika boyunca PBS-0.1 Tw ile en az 3 kez yıkayın.
- Numuneleri RT'de 30 dakika boyunca karanlıkta hafifçe sallanarak %4 PFA'da sonradan sabitleyin.
- Her adımda 5 dakika boyunca PBS-0.1 Tw ile 3 kez yıkayarak PFA çözeltisini çıkarın.
NOT: Numuneler (saklama solüsyonlarında/mikroskop lamlarına monte edilmiş) karanlıkta 4 °C'de süresiz olarak saklanabilir.
6. Lekeli pulların montajı
- 6 g gliserole 2,4 g Mowiol 4-88 kristali ekleyerek montaj ortamını hazırlayın (bkz. Tercih edilen herhangi bir montaj ortamı kullanılabilir.
- 6 mL deiyonize su ekleyin ve manyetik bir karıştırıcıda bir saat bekletin.
- 12 mL 0.2 M Tris (pH 8.5) ekleyin ve Mowiol kristalleri tamamen eriyene kadar yaklaşık 53 ° C'de inkübe edin.
- Oda sıcaklığında 20 dakika boyunca 2000 x g'da santrifüjleyerek çözeltiyi berraklaştırın.
- Çözeltiyi bir saklama kabına aktarın. Montaj ortamı dondurucuda yaklaşık 12 ay saklanabilir. Çözülmüş Mowiol solüsyonu 1 aya kadar stabildir.
- Ortamı monte ederken terazileri bir mikroskop lamına monte edin, üzerlerini bir lamel ile örtün ve mikroskop altında görüntüleyin.
7. Ex vivo ölçek kültürü
NOT: Bu adım de Vrieze ve ark.12'den uyarlanmıştır.
- Pulları steril bir ortamda toplamadan önce, osteojenik ortamı ve kültür plakasını hazırlayın.
- Osteojenik Kültür Ortamı (OCM): Steril bir santrifüj tüpünde, %1 sığır buzağı serumu, %1 (%0.85 NaCl içinde 200 mM L-alanil-L-glutamin dipeptid), %1 antibiyotik/antimikotik çözelti (100x) çözeltisi, 4 mM CaCl2, 10 mM β-Gliserofosfat, 1 nM sodyum piruvat ve %1 Amfoterisin B (isteğe bağlı) (bkz.
- OCM'yi steril bir reaktif haznesine dökün ve çok kanallı bir pipet kullanarak 96 oyuklu plakanın her bir oyuğuna 100 μL ekleyin.
- 96 oyuklu plakayı kapatın ve plakayı saklayın. OCM buzdolabında kısa bir süre (gece boyunca 1 haftaya kadar) saklanabilir ve kullanımdan önce 28 °C'de saklanabilir.
- Kireç hasadı ve PBS yıkama gerçekleştirin.
- Terazileri steril cımbız/forseps kullanarak hasat edin ve steril bir PBS solüsyonu içeren bir Petri kabına koyun.
- Plaka kurulumunu gerçekleştirin.
- Steril forseps kullanarak her bir ölçeği Petri kabından 100 μL OCM (28 °C'ye ısıtılmış) ile 96 oyuklu plaka üzerindeki her bir oyuğa aktarın.
- Tüm ölçekler plakaya aktarıldıktan sonra, plakayı stereomikroskop altına getirin. Her bir teraziyi nazikçe kuyunun dibine taşımak için ince, steril bir pipet ucu kullanın ve görüntü alımı sırasında ışık yansımasını önlemek için kuyuların kenarından uzak tutun.
NOT: Bu adım yalnızca canlı görüntüleme gerçekleştiriliyorsa gereklidir. - Plakayı, pulların 7 güne kadar kültürlenebileceği inkübatöre veya Canlı Görüntüleme Sistemine (LIS, Malzeme Tablosuna bakın) (28 °C, %5 CO2'ye ayarlanmış) dikkatlice aktarın.
- OCM'yi yenileyin (isteğe bağlı).
- Buzdolabında saklanan OCM'yi 28 °C'ye ısıtın.
- 96 oyuklu plakayı dikkatlice steril bir ortama aktarın. Çok kanallı bir pipet kullanarak, her oyuktan 50 μL aspire edin. Bunun için uçları duvarlara bastırın ve pulları aspire etmekten/hareket ettirmekten/çıkarmaktan kaçınmak için dibe kadar daldırmayın. Farklı koşullar için yeni ipuçları kullanın.
- OCM'yi steril bir reaktif haznesine dökün ve çok kanallı pipeti kullanarak her bir oyuğa 60 μL OCM ekleyin.
- Plakayı stereomikroskobun altına yerleştirin ve yanlış yerleştirilmiş ölçekler olup olmadığını kontrol edin (duvarlara çok yakın, yüzer veya ortam içinde dikey konumda). Gerekirse ince, steril bir pipet ucuyla yeniden konumlandırın.
- Plakayı inkübatöre/LIS'e geri yerleştirin.
NOT: Deney sirkadiyen ritim (CR) içeriyorsa ortamı yenilemeyin, çünkü serum şoku biyolojik saati etkileyebilir. CR'yi okurken, ışık koşullarının da saati sıfırladığını not edin.
- Kültür sonrası ölçek boyama ve görüntüleme gerçekleştirin (isteğe bağlı).
- 6 günlük kültürden sonra bunları sabitleyin ve yukarıda bahsedilen von Kossa ve ALP gibi uygun boyamalar için yönlendirin.
- Alternatif olarak, deney balığının floresan etiketi varsa, plakayı canlı bir görüntüleme sistemine koyun.
NOT: Canlı görüntüleme sistemi kullanıyorsanız, deney için uygun bir sıcaklık veCO2 seviyesine ayarlandığından emin olun. Tipik olarak, bu çalışmada 28 °C ve% 5 CO2 kullanılmıştır. Tüm kuyucukların eşit şekilde görüntülenmesini sağlamak için uygun filtreleri ve görüntüleme zaman noktalarını (burada, osteoblast göçünü takip etmek için yeterli olan 2 veya 4 saatlik bir aralık kullanılmıştır) ve düşük büyütme hedeflerini (yani 4x) seçin. Bunun nedeni, terazilerin, özellikle ortam değişiklikleri sırasında kuyuların içinde hareket etme eğiliminde olmasıdır.
Sonuçlar
Ölçek rejenerasyonu
Ölçek rejenerasyonu, zebra balığının kanadını görüntüleyerek standart bir floresan stereomikroskop ile izlenebilir. Şekil 3A , 4 aylık bir zebra balığında pul rejenerasyonu sırasında pulların sp7/osx ekspresyonundaki değişiklikleri göstermektedir. Şekil 3A'da gösterilen yan görüntüleme için zaman noktaları ontogenetik (hasattan önceki orijinal ölçekler), hasattan sonraki 2. gün, 4. gün ve 10. gündür. Kemik yapan osteoblastları etiketlerken iskelet sistemindeki değişiklikleri izlemek için tipik olarak osx ( osterix veya sp7 olarak da bilinir) transgenik çizgiler (GFP (Tg(Ola.sp7:NLS-eGFP)19 veya mCherry Tg(osterix:mCherry-NTR)pd46)17 kullanırız. Yeni oluşan pulların erken örüntüsü, rejenerasyonun 2 gününde görülebilir. Bu erken ölçek rejenerasyonu modeli, bazı durumlarda, özellikle iskelet mutantlarında bozulur. Rejenerasyonun ilerlemesini takip ederek, rejenerasyon kapasitesi ve hızı analiz edilebilir. Ölçek hasat gününde, Şekil 3B'de gösterildiği gibi, aynı stereomikroskop kullanılarak yan görüntülemeden sonra hasat edilen ölçeklerin bireysel görüntülenmesi gerçekleştirilebilir. Rejenere pullar, Day 0 ontogenetik skalalara kıyasla çok daha yüksek osx ekspresyonuna sahiptir, çünkü yeni kemik oluşumu için osteoblastlar gereklidir.
Ex vivo ölçekli kültür
Balığın yan tarafındaki rejenerasyon sürecini takip ederek de novo kemik oluşum sürecini inceleyebilsek de, bu modeli neşter ile pullarda yaralanma yaparak ex vivo ölçekli kültürle iskelet yaralanmalarının onarımını ve iyileşmesini incelemek için de kullanabiliriz. Canlı bir görüntüleme sistemi kullanılarak, onarım gerçek zamanlı olarak izlenebilir. Şekil 4 , osteoblastların osx: mCherry ile etiketlendiği bir kültüre 3 gün içinde ontogenetik ölçekte bir yaralanma iyileşme yanıtının temsili bir sonucunu göstermektedir. Kültürün başlangıcındaki ekler tarafından gösterilen yaralanma bölgesi, osteoblastlar ve ölçek sirküleri arasında açık bir boşluk olduğunu göstermektedir (Şekil 4A). Osteoblastların yaralanma bölgesine doğru göçü hızlandırılmış görüntüleme ile izlenebilir. Kültürde 3 gün sonra, boşluğun genişliği azalır veosx'in ekspresyonu, boşluk ile yeni oluşan ölçek sirküleri arasında görülebilir (Şekil 4B). Ek olarak, osteoblastların şekli açısından morfoloji, kültürün başlangıcında daha daireseldir ve 3 gün sonra daha uzundur. Osteoblast görünümündeki bu değişiklik muhtemelen doğal ortamında (balığa bağlı) değil, kültürde olmasından kaynaklanmaktadır.
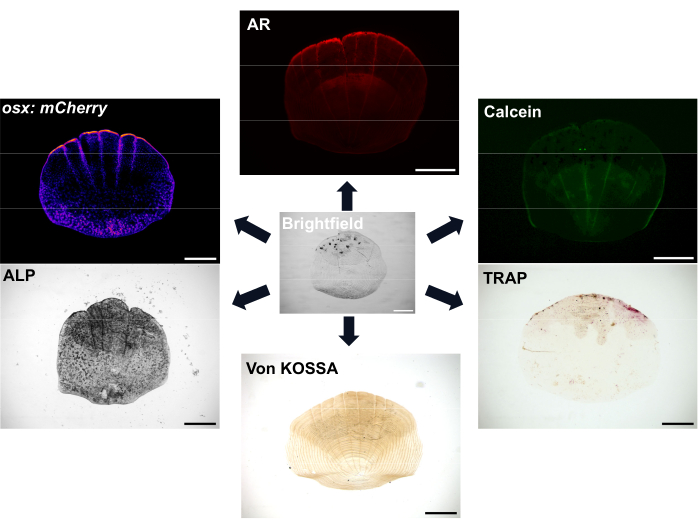
Şekil 1: Ölçekler için görüntüleme seçeneklerine örnekler. Osteoblastlar, osx/sp7 transgenik raportör çizgileri (GFP veya mCherry'de) ile görselleştirilebilir. Osteoblast aktivitesini göstermek için ALP boyaması kullanılabilir. TRAP boyama, osteoklastların aktivitesini gösterebilir. Alizarin kırmızısı (AR) ve Calcein yeşili, canlı balıklarda kullanılabilen boyalardır; AR mineralizasyonu etiketler ve Calcein yeni oluşan kemiği etiketler. Mineralizasyonun derecesi von Kossa boyama ile de gösterilebilir. Ölçek çubukları: 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
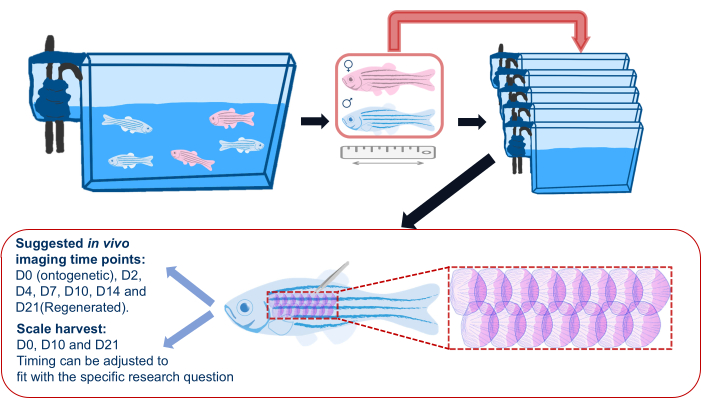
Şekil 2: Bir ölçek rejenerasyon deneyinin şematik gösterimi. Balıkların deneyden önce ayrı tanklara ayrıldığını gösteren bir ölçek rejenerasyon deneyinin genel şeması. Uzunluk, cinsiyet ve sağlık kaydedilir. Şematik ayrıca, pulları ve önerilen görüntüleme zaman noktalarını hasat etmek için balığın yan tarafında önerilen alanı da gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
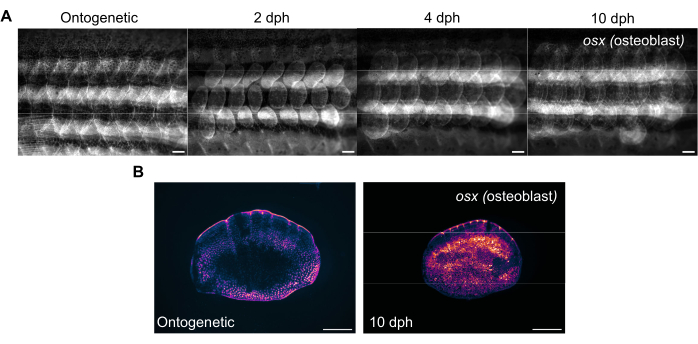
Şekil 3: 4 aylık bir zebra balığından alınan pul rejenerasyonu sırasında osterix ekspresyonunun (osteoblastları görselleştirmek için) temsili görüntüleri. (A) OSX ifadesindeki değişiklikleri izlemek için 0. gün (hasat öncesi, ontogenetik ölçekler), 2. gün (hasat sonrası günler), 2. gün, 4 dph ve 10 dph'de yakalanan yan görüntüler. Ölçek çubukları: 1 mm. (B) Panel (A)'dakiyle aynı balıktan alınan ontogenetik ölçeğin ve 10 dph'de bir ölçeğin temsili görüntüleri. Yenilenen ölçeklerin ortasındaki macenta ile gösterildiği gibi artan osx ekspresyon seviyelerine dikkat edin. Ölçek çubukları: 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
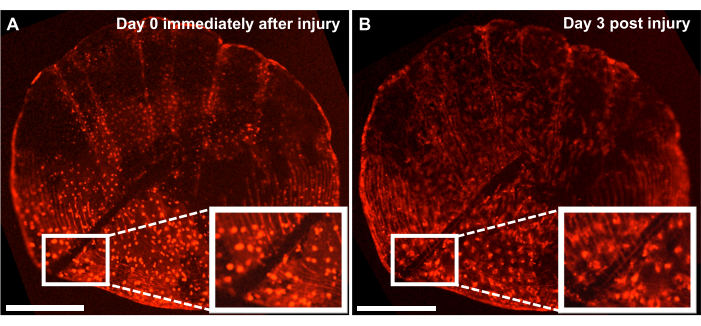
Şekil 4: Canlı bir görüntüleme sistemi kullanılarak 4 aylık bir zebra balığından alınan ontogenetik ölçekte iskelet yaralanması onarım yanıtının temsili sonuçları. (A) Kültürün hasadı ile aynı gün (zaman noktası 0/gün0) neşter tarafından yapılan bir yaralanma ile ontogenetik ölçekler. (B) Aynı ölçek yaralanmadan 3 gün sonra gösterilir. İç kısım yaralanma bölgesini gösterir. Ölçek çubukları: 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
İskelet araştırmaları için yeni bir model olan zebra balığının elasmoid pulları, kemik bakımı, rejenerasyonu ve yaralanma onarımını anlamamıza yardımcı olmak için büyük bir potansiyele sahiptir. Balıklardaki pulların bolluğu, kullanılan hayvan sayısını azaltırken ve birey içi varyasyonu sınırlarken orta ila yüksek verimli bileşik taramaya izin verir. Burada, rejenerasyon ve onarımı incelemek için ölçek rejenerasyonu ve ex vivo ölçek kültürü için protokoller sunulmaktadır.
Bu protokolü takip ederken bazı kritik adımların dikkate alınması gerekir. Ölçeklerin dikkatli bir şekilde çıkarılması, özellikle hasadın neden olduğu hücre popülasyonundaki rahatsızlığı sınırlamak için transgenik bir raportör hattı kullanıldığında çok önemlidir. Ontogenetik ölçeklerle karşılaştırmalar yapılacaksa, bölgenin kendiliğinden yenilenen pullar içermediğinden emin olun (bu, balığın ömrü boyunca doğal olarak oluşabilir). Optimal hücre sağkalımı ve kültürde minimum enfeksiyon elde etmek için ortamın ve ekipmanın ex vivo kültür için steril olduğundan emin olun.
Spesifik araştırma sorusuna bağlı olarak, rejenerasyon ve onarım sırasında gen ekspresyon profillerinin diğer hücre tiplerini görselleştirmek için farklı transgenik raportör hatlarının birleştirilmesi gibi protokole uyarlamalar yapılabilir11,14.
Ölçeklerde gerçekleştirilebilecek geniş boyama yelpazesi, test edilen her bileşik veya koşul için kemik üzerindeki etkilerine farklı açılardan bakılabileceği anlamına gelir; sp7 / osx raportörleri osteoblast sayılarını gösterebilirken, ALP boyaması osteoblast aktivitesini görselleştirebilir, TRAP boyaması osteoklast aktivitesini görselleştirebilir, Calcein yeşili canlı boyama yeni oluşan kemiği etiketleyebilir ve Alizarin kırmızısı veya von Kossa boyaması ölçek mineralizasyonunu gösterebilir. Osteoblastları ölçmek için lusiferaz aktivitesi de kullanılabilir12. Bu boyama teknikleriyle birlikte, osteoblastların ve osteoklastların belirli bir kemik etkisine göreceli katkısı öğrenilebilir. Pullar, memeli kemiğinde yaygın olan ve kemik mekanosensoriyel yanıtının ana itici güçleri olan osteositlerden yoksundur; Bu modeldeki ölçek onarımı ve rejenerasyonu, öncelikle osteoblastlar tarafından yönlendirilir ve ardından osteoklastlar 8,9 tarafından yeniden şekillendirilir. Bireyler ve yaş grupları arasında farklılıklar olduğunu belirtmek çok önemlidir20. Bunu en aza indirmek için, farklı konumlar farklı ölçek morfolojilerine yol açabileceğinden ve yaş ve büyüklük tutarlı olacak şekilde aynı kardeş gruplarından balıklar kullanıldığından, ölçek hasat alanı sabit olmalıdır. Bununla birlikte, balık başına birden fazla ölçek hasat edilebildiğinden, daha az balık kullanarak daha fazla deney yapılabilir ve bu da birey içi değişkenliği azaltır.
Özetle, bu protokoller ontogenetik ve yenileyici ölçeklere uygulanabilecek deneysel teknikleri göstermektedir. Sonuç olarak, elasmoid ölçekler, kemik oluşumu ve onarımının anlaşılmasına yardımcı olmak için bir iskelet modeli olarak büyük potansiyel göstermektedir; ve yüksek verimli osteoanabolik bileşik taraması için hayvan kullanımını azaltmaya yardımcı olacaktır.
Açıklamalar
Yazarların ifşa edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Balık yetiştiriciliği için Hayvan Hizmetleri Birimi'nden Mathew Green'e ve Wolfson Biyogörüntüleme Merkezi'nden Katy Jepson'a teşekkür ederiz. CLH, DB ve QT, Versus Arthritis (CLH Kıdemli Bursu 21937, DB ve QT Orta Bursu 22044), RR (NHMRC APP1158758) tarafından finanse edildi. Bu çalışma aynı zamanda BBSRC hibesi (BB/T001984/1) tarafından da desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffered saline (PBS) | Gibco | 70013-016 | PBS |
| 12-Multichanel Pipette | Sartorius | 728230 | Multichanel pipette, Proline Plus Mechanical Pipette, 12 Channel, , 10-100 µL. |
| 15 mL Centrifuge tubes | Corning | 430791 | Centrifuge tube, CentriStar Cap, Polypropylene, RNAse/DNAse free, Non-pyrogenic |
| 4% Paraformaldehyde (PFA) | Sigma | P6148 | PFA |
| Alizarin red | Sigma | A5533 | |
| Amphotericin B | ThermoFisher Scientific | 15290026 | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher Scientific | 11772644 | Sealing film |
| Calcein powder | Sigma | C0875 | |
| Calcium Chloride | Thermo Scientific | L13191.30 | |
| Corning 96 well plate | Corning | 3596 | 96-well-plate, Clear, Flat Bottom Polystyrene TC-treated Microplates, Individually Wrapped, with Lid, Sterile |
| Cover slips | VWR | 631-0146 | |
| Cytiva HyClone Iron-Supplemented Calf Serum | Fisher Scientific | SH30072.03 | |
| Danieau | Sigma | ||
| DMEM | Life Technologies | 31053 | |
| Falcon tubes | Corning | 430828 | |
| Fast Red Violet LB stock solution | Sigma | F3381 | |
| GlutaMAX Supplement | Life Technologies | 35050 | |
| Glycerol | Sigma | 81381 | |
| Hepes | Sigma | H3375 | |
| Incubator | X | Incubator, Set up to 28 °C and 5% CO2 | |
| IncuCyte Zoom | Sartorious | X | Live Imaging System, Set up to 28 °C and 5% CO2 |
| Leica stereomicroscope | X | Sterioscope | |
| L-tartrate dibasic dihydrate | Sigma | 228729 | |
| Mgcl2 | BDH Laboratory Sup. | 261237T | |
| Microscope slides | Epredia | J2800AMNZ | |
| Mowiol 4-88 | Sigma | 9002-89-5 | |
| MQ water | X | ||
| N, N’-dimethylformamide (Merck: D4451) | Merck | D4451 | |
| NaCL | Fisher Chemical | S/3120/53 | |
| Naphthol AS-MX phosphate | Merck | N4875 | |
| NBT/BCIP solution | Sigma | #000000011681451001 | |
| Penicillin-Streptomycin | Life Technologies | 15140 | |
| Petri Dishes | Corning | 430589 | 35 mm sterile Petri dish, Non-treated, Nonpyrogenic, Polystyrene. |
| Reagent Reservoir | Startub | E2310-1025 | 25mL Reagent Reservoir |
| Silver nitrate | Sigma | 209139 | |
| Sodium acetate | Sigma | 52889 | |
| Sodium beta-glycerophosphate pentahydrate | Thermo Scientific | L03425.14 | |
| Sodium pyruvate solution | Sigma | S8636 | |
| Sodium tartrate | Sigma | S4797 | |
| Sodium thioculphate | Sigma | 563188 | |
| Tricaine methane sulfonate (MS222) | Sigma | E10521 | |
| Tris | Sigma | 252859 | |
| Triton-X100 | Sigma | T8787 | |
| Tween-20 | SLS | CHE3852 | |
| Tweezers Number 5 | Dumont | 500341 | Tweezer, INOX, biology grade |
| Zebrafish tanks | Tecniplast | ZB30BCP | 3.5 L - 28 cm x 11 cm x 17 cm |
| Zebrafish tanks | Tecniplast | ZB30BCP | 1 L - 28 cm x 7 cm x 11 cm |
Referanslar
- Tobias, J. H., et al. Opportunities and challenges in functional genomics research in osteoporosis: report from a workshop held by the causes working group of the osteoporosis and bone research academy of the Royal Osteoporosis Society on October 5th 2020,". Frontiers in Endocrinology. 11, (2021).
- Busse, B., Galloway, J. L., Gray, R. S., Harris, M. P., Kwon, R. Y. Zebrafish: An emerging model for orthopedic research. Journal of Orthopaedic Research. 38 (5), 925-936 (2020).
- Dietrich, K., et al. Skeletal biology and disease modeling in zebrafish. Journal of Bone and Mineral Research. 36 (3), 436-458 (2021).
- McGowan, L. M., Kague, E., Vorster, A., Newham, E., Cross, S., Hammond, C. L. Wnt16 elicits a protective effect against fractures and supports bone repair in zebrafish. JBMR Plus. 5 (3), 10461 (2021).
- Sehring, I., Weidinger, G. Zebrafish fin: Complex molecular interactions and cellular mechanisms guiding regeneration. Cold Spring Harbor Perspectives in Biology. 14 (7), 040758 (2022).
- Bergen, D. J. M., Kague, E., Hammond, C. L. Zebrafish as an emerging model for osteoporosis: a primary testing platform for screening new osteo-active compounds. Frontiers in Endocrinology. 10 (6), (2019).
- Aman, A. J., Fulbright, A. N., Parichy, D. M. Wnt/β-catenin regulates an ancient signaling network during zebrafish scale development. Elife. 7, 37001 (2018).
- Iwasaki, M., Kuroda, J., Kawakami, K., Wada, H. Epidermal regulation of bone morphogenesis through the development and regeneration of osteoblasts in the zebrafish scale. Developmental Biology. 437 (2), 105-119 (2018).
- Metz, J. R., de Vrieze, E., Lock, E. J., Schulten, I. E., Flik, G. Elasmoid scales of fishes as model in biomedical bone research. Journal of Applied Ichthyology. 28 (3), 382-387 (2012).
- Cox, B. D., De Simone, A., Tornini, V. A., Singh, S. P., Di Talia, S., Poss, K. D. In toto imaging of dynamic osteoblast behaviors in regenerating skeletal bone. Current Biology. 28 (24), 3937-3947 (2018).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders,". Frontiers in Endocrinology. 11, (2020).
- de Vrieze, E., Zethof, J., Schulte-Merker, S., Flik, G., Metz, J. R. Identification of novel osteogenic compounds by an ex-vivo sp7: Luciferase zebrafish scale assay. Bone. 74, 106-113 (2015).
- De Vrieze, E., Moren, M., Metz, J. R., Flik, G., Lie, K. K. Arachidonic acid enhances turnover of the dermal skeleton: Studies on zebrafish scales. PLoS One. 9 (2), 89347 (2014).
- Bergen, D. J. M., et al. Regenerating zebrafish scales express a subset of evolutionary conserved genes involved in human skeletal disease. BMC Biology. 20 (1), 21 (2022).
- Bergen, D. J. M., et al. High bone mass disorders: New insights from connecting the clinic and the bench. Journal of Bone and Mineral Research. , (2022).
- Pasqualetti, S., Banfi, G., Mariotti, M. Osteoblast and osteoclast behavior in zebrafish cultured scales. Cell and Tissue Research. 350 (1), 69-75 (2012).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Developmental Cell. 22 (4), 879-886 (2012).
- Ethiraj, L. P., Fong, E. L. S., Liu, R., Chan, M., Winkler, C., Carney, T. J. Colorimetric and fluorescent TRAP assays for visualising and quantifying fish osteoclast activity. European Journal of Histochemistry. 66 (2), 3369 (2022).
- DeLaurier, A., et al. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505 (2010).
- Carnovali, M., Banfi, G., Mariotti, M. Age-dependent modulation of bone metabolism in zebrafish scales as new model of male osteoporosis in lower vertebrates. Geroscience. 43 (2), 927-940 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır