Method Article
ゼブラフィッシュの鱗の再生 TOTO および Ex Vivo の鱗の培養
要約
このプロトコルは生体 内の 再生の間にゼブラフィッシュのelasmoidスケールの収穫そして視覚化を記述する。さらに、これらの鱗屑の収穫後最大7日間の 生体外 培養が提示されます。
要約
骨格疾患は病因が複雑であることが多く、世界中で何百万人もの人々が罹患しています。人口の高齢化により、医療システムの負担を軽減できる新しい治療法が求められています。これらの疾患は複雑であるため、実験室で骨の病態生理を正確にモデル化することは困難であり、費用がかかります。この分野の課題は、潜在的な治療用化合物の試験に使用できる、骨疾患をモデル化するための費用対効果が高く、生物学的に関連性のあるプラットフォームを確立することです。このようなプラットフォームは、理想的には、石灰化したマトリックス環境で作用する骨形成骨芽細胞と骨分解破骨細胞の細胞挙動を動的に可視化できるはずです。ゼブラフィッシュは、トランスジェニックレポーター系統などの遺伝的ツールが利用できることや、一部の骨格組織(鱗を含む)が成体になっても半透明のままであり、動的なイメージングオプションが可能であることから、モデルとして使用されることが増えています。ゼブラフィッシュの鱗は骨芽細胞と破骨細胞の両方を持ち、非常に豊富に存在するため、独立した骨単位の容易で豊富なリソースを提供します。さらに、ゼブラフィッシュの成魚の鱗片は一度取り除かれると完全に再生するため、 in vivoでの 石灰化組織の時空間的成長を研究する方法を提供します。ここでは、鱗屑の回収と再生を追跡するためのプロトコルについて詳しく説明します。最後に、スケールをex vivo で1週間安定培養し、スケールの石灰化マトリックスへの損傷を制御した後の治癒反応を経時的に追跡するためのプロトコルも提示されます。
概要
骨は骨格の主要な部分を形成する硬い結合組織であり、移動を可能にし、体内のミネラル貯蔵庫として機能します。健康な骨を維持するためには、骨芽細胞(同化)と破骨細胞(骨を吸収する)の結合活性 により 、骨の形成と劣化の絶妙なバランスが不可欠です。このバランスは、加齢やホルモンの不均衡によって乱れ、骨粗鬆症などの骨の脆弱性疾患につながることがよくあります1。骨脆弱性疾患を標的とする既存薬が承認されていますが、多くは副作用があります。したがって、新しい治療薬1が必要です。したがって、潜在的な治療用化合物の試験に使用できる生物学的に関連性のある骨組織の豊富な供給源が依然として必要とされています。
従来、げっ歯類モデルと細胞培養システムは、骨生物学の研究に使用されてきました。しかし、ゼブラフィッシュはますます別のモデルとして選ばれるようになってきています。ゼブラフィッシュは哺乳類ではありませんが、げっ歯類よりも骨の研究に一定の利点があります。これらには、それらの繁殖力と幼虫の半透明が含まれます。成人期になっても、鱗や鰭などの一部の骨格組織は半透明のままであるため、高解像度のin vivoイメージングが可能になり、骨格変異体の利用可能性が高まります2,3。ゼブラフィッシュのヒレと鱗は、除去後に完全に再生することができます。ゼブラフィッシュのヒレの骨格再生と損傷修復は広く研究されており4,5、ゼブラフィッシュの鱗はこの分野では新しい骨モデルですが、生体外での培養には利点があります6。
鱗は非常に豊富で、各魚には少なくとも300の鱗があり、魚の保護カバーとして機能します。各鱗屑は、コラーゲンに富む骨格マトリックスの骨形成骨芽細胞と骨吸収破骨細胞からなる小さな石灰化プレートである7。ゼブラフィッシュの鱗と人間の骨の両方の骨化プロセスでは、間葉系幹細胞を骨芽細胞に分化させて石灰化したマトリックスを形成する必要があります。ゼブラフィッシュの鱗は、骨の再生や修復の研究に使用できる強力な再生能力を備えているため、骨格研究に大きな利点をもたらします。しかし、骨芽細胞と破骨細胞の両方が存在するにもかかわらず、ゼブラフィッシュの鱗には、ヒトの骨のリモデリングと機械感覚に重要な骨細胞がありません。鱗の表面的な位置は、鉗子のペアで簡単に取り外すことができることを意味します。鱗が除去されると、イベントのカスケードが発生し、鱗の再生成が始まります8,9。図1に示すように、骨芽細胞と破骨細胞の活性、およびスケールの石灰化を視覚化するために利用できるさまざまな染色およびイメージングオプションがあります。さらに、ゼブラフィッシュの多くの関連する蛍光トランスジェニックレポーター株が利用できるということは、再生中の細胞動態を可視化できることを意味します7,10,11。このプロセスにより、魚の脇腹の鱗の再生の初期パターンを観察し、これらの再生された鱗の形態、細胞活動、および遺伝的プロファイルを研究することにより、de novo骨形成をより深く理解することができます。スケールの形成と再生の生物学はよく特徴付けられています。重要なことに、スケールは治療上重要な化合物12の優れた予測能力を示すことができ、グルココルチコイドによる魚の治療は、骨粗鬆症の表現型を示すために再生するスケールにつながります13。再生鱗のトランスクリプトームは、鱗屑再生で活性化された遺伝子がヒトの骨格疾患に関連する遺伝子に富んでいることを示しており、モデルシステムとしての関連性をさらに実証しています6,14。
最後に、これらのスケールは、最大7日間、ex vivoで培養することができます。通常、単一細胞タイプで構成される細胞株培養と比較して、ex vivoスケール培養は、天然の細胞外マトリックス8,12,15,16を有する骨芽細胞と破骨細胞の両方を含む自然環境内でのin vitro骨研究の機会を提供します。
スケール培養により、新しい骨同化標的の薬物スクリーニングを行うこともできます。魚の鱗が豊富であるということは、1匹の魚から96ウェルプレートの少なくとも2つのプレートを満たすことができることを意味し、すべてのウェルに1つの鱗と細胞の自然なニッチを含むマルチウェルフォーマットでの化合物スクリーニングを可能にします。さらに、鱗屑が薄いため、薬物の吸収は予測可能です12。要約すると、ゼブラフィッシュのエラスモイド鱗は骨格研究において大きな可能性を秘めており、骨の形成と修復中の細胞イベントについてより多くの洞察を得るのに役立ちます。ここでは、 in vivo での再生に追従する鱗屑を採取し、 ex vivoで鱗を培養するためのプロトコルについて説明します。
プロトコル
大学動物科学ユニット(ASU)は、ゼブラフィッシュの飼育ガイドラインの指導の下、ゼブラフィッシュのケアを担当しています。スケール採取、生きた骨染色、ライブイメージングを含むすべての手順は、英国内務省プロジェクトライセンス(PP4700996)の下で承認され、実施されました。この原稿では、sp7:mCherry [Tg(osterix:mCherry-NTR)pd46] 系統の若年成体のトランスジェニックゼブラフィッシュを用いた17。魚には生後4ヶ月のオスとメスの両方が含まれていました。
1. in vivo スケール再生
- 鱗屑再生実験を開始する前に、図2に示すように、ゼブラフィッシュをメインの水槽から個々の水槽に移し(材料表を参照)、実験中のイメージング後にこれらの個々の水槽に戻します。これは、再生するすべての鱗が実験のために採取されたものであることを確認するためです。グループハウスでは、他の魚による怪我により、散発的に鱗がなくなる可能性があります。
注:魚は、魚同士の争いやその後の鱗の減少を避けるために、個別に配置されています。 - 実験デザインに従って、各実験魚の情報(遺伝子型、年齢、性別)を記録します。カメラ(スマートフォンのカメラは正常に機能します)を使用して、定規の横で各魚の画像を撮影し、魚のサイズ/長さと健康状態を記録します。
- 実験当日は、0.05%(v/v)トリカインメタンスルホン酸塩(MS222、 材料表参照)を用いてゼブラフィッシュに浸漬麻酔し、イメージング中や収穫中にゼブラフィッシュが動かないように、湿らせた組織でペトリ皿に置きます。
- 魚を横向きに置きます(通常、ここでは一貫性のために左脇腹が使用されます)。実体顕微鏡を用いて適切な倍率で側面イメージングを行う(本研究では、通常、2倍、4倍、および/または6.3倍と8倍を使用して、再生領域全体とズームイン領域の両方をキャプチャして詳細に観察します)。
注:フランクイメージングのタイムポイントは、実験目的とトランスジェニックレポーターの選択によって異なります。例えば、スケール再生中の骨芽細胞を追跡するために、推奨される時点は、0日目(個体発生)、収穫後2日(dph)、4 dph、7 dph、10 dph、14 dph、21 dphです。繰り返しの麻酔による影響を軽減するために、実験に必要なイメージングの時点を最小限に保ちます。 - 実体顕微鏡下で細いピンセットと鉗子を使用して鱗を採取します。収穫した鱗屑をコレクションチューブに移し、後で鱗屑を染色します。
注:収穫できる鱗の最大数は、実施されている地域の倫理的承認によって異なります。通常、約20〜30個の鱗を収穫し、ALP、von Kossa14などのスケール染色のために個々の収集チューブに収集します。 - スケールを1.5 mLまたは2 mLのコレクションチューブに集めます。これは、使用する染色技術によって異なります。
- ALP染色とvon Kossa染色では、脱イオン水を含むコレクションチューブにスケールを移しますが、TRAP染色または免疫組織化学では、スケールを4%PFA(固定液)を含むコレクションチューブに移します。
- オプション:スケールをチューブに移す前に、必要に応じて、採取した個々のスケールの画像を撮影します。
注:推奨されるスケールの収穫時点は、0日目(個体発生)、10日目、および21日目(再生スケール)です。
2.生きた骨染色
注:生きた骨格染色は、実験魚が蛍光レポーター用にトランスジェニックされていない場合、または単色のトランスジェニックレポーターを運搬している場合に実行できます。生染色は、トランスジェニックを補完するために使用できます。例えば、SP7/OSX などの骨芽細胞レポーターを1色(GFPなど)で使用し、骨をアリザリンレッド(AR)で赤色に染色します。ARとカルセイングリーンは、同じ魚に一緒に使用できます。このシナリオでは、ARを使用して、老化した骨の石灰化マトリックスに結合することにより、元の骨または個体発生的な骨を標識し、カルセインは新しく形成された骨に豊富に存在するカルシウムイオンに結合します。例えば、個体発生学的スケールを染色する場合、ARは可視化され得るが、個体発生学的スケールは新しい骨形成のレベルが低いため、カルセイングリーンが存在しないか、または最小限であり得る。
- アリザリンレッド(AR)の生染色を行います。
- 0.5%(w/v)ストックアリザリン溶液(10 mL)と10 mLの1 MストックHEPES(最終濃度、10 mM)を混合して、2x AR染色溶液のボトルを調製します( 材料表を参照)。
- 1x Danieau溶液で最大1 Lを補充します( 材料表を参照)。溶液は暗所に保管するか、ホイルで包む必要があります。
- 実験当日、ゼブラフィッシュの施設に2倍のAR溶液500mLを持参し、水槽の水500mLを加えて1倍のAR溶液を作ります。
- 魚を水槽から1倍のAR染色溶液に移し、15〜20分間放置します。システム水で15分間「洗浄」して、魚の余分な汚れを洗い流します。
- カルセイングリーン染色をライブで行います。
- 45 mgのカルセイン粉末を1x Danieau溶液900 mLに添加して、2x Calcein Green染色溶液のボトルを調製します( 材料表を参照)。マグネチックスターラーを使用して、粉末を完全に溶解させます。
- pHを8に調整します。これは、カルセイングリーンの2倍のストックソリューションです。溶液は暗所で保存するか、ホイルで最大1か月間包むことができます。
- 実験当日、500 mLの2x Calcein Green溶液をゼブラフィッシュ施設に持参し、500 mLのシステム水を加えて1x Calcein Green溶液を作ります。作りたてのカルセイン染色液の使用をお勧めします。
- 水槽から1xのCalcein Green染色液に魚を移し、1〜2時間放置します。魚の大きさによっては、染色時間が長くなる場合があります。
- システム水で15分間「洗浄」して、魚の余分な汚れを洗い流します。
注:この染みは数時間で消えるので、カルセイングリーンで染色された魚をできるだけ早く画像化してください。
3. 収穫後の鱗屑のアルカリホスファターゼ(ALP)染色
- 100 mM Tris(pH 9.5 with HCl)を100 mM NaClおよび50 mM MgCl2と混合してALP染色溶液を調製します。
- 市販のNBT/BCIP原液をご使用ください( 材料表参照)。
- スケールを脱イオン水の入ったチューブに移します。
- 鱗屑をALP染色液で5分間すすぎます。
- その間、10 mLのALP染色バッファーに200 μLのNBT/BCIP溶液を添加して、作業染色溶液を調製します。これは、染色時に新たに調製する必要があります。
- 鱗屑をALP染色液で15分間染色します。
- スケールを脱イオン水ですすいで反応を停止します。
4. 収穫後の鱗屑のフォン・コッサ染色
- 5%(w/v)の硝酸銀溶液を調製する。
- 5%(w / v)チオ硫酸ナトリウム溶液を調製します。
- 収穫したスケールを脱イオン水の入ったチューブに移します。
- 鱗屑を硝酸銀溶液中で強い光の下で40分間インキュベートします。
注意: 硝酸銀は取り除くのが難しい汚れを残すため、PPE(個人用保護具)を着用してください。 - はかりを脱イオン水で5分間2回洗浄します。
注意: 硝酸銀廃棄物は、地域のガイドラインに従って収集および廃棄する必要があります。 - 鱗屑をチオ硫酸ナトリウム中で5分間インキュベートします。
- はかりを脱イオン水で5分間2回洗浄します。
5. 比色TRAP染色
注:詳細な手順については、以前に公開された作品18を参照してください。
- 染色液を調製します。
- 10 mg/mL Naphthol AS-MX リン酸溶液を調製します。
- 5 mg のナフトール AS-MX リン酸を秤量します( 材料表を参照)。
- ドラフト内で、0.5 mL の N,N'-ジメチルホルムアミドを含むチューブを調製し、5 mg の Naphthol AS-MX リン酸塩を 0.5 mL の N,N'-ジメチルホルムアミドに溶解して、10 mg/mL の Naphthol AS-MX リン酸塩のストック溶液を作ります (穏やかに振とう)。
- 50 mM 酒石酸ナトリウムに 1.6 mM の Fast Red Violet LB ストック溶液を調製します。
- pH 5 で 0.1 M 酢酸ナトリウム 50 mL を調製します (50 mL の脱イオン水に 0.41015 g の酢酸ナトリウムを加え、100% 酢酸で pH を 5 に調整します)。
- 0.575 g の酒石酸 L-酒石酸ナトリウム二水和物( 材料表を参照)を 50 mL の 0.1 M 酢酸ナトリウム緩衝液(pH = 5)に溶解します。
- 30mgのファストレッドバイオレットLB塩を加えます。
- PBS-0.1Txを調製する(Triton-X500 μLをPBS500 mLに溶解する)。
- PBS-0.1Twを調製する(500 μLのTween-20を500 mLのPBSに溶解する)。
- 10 mg/mL Naphthol AS-MX リン酸溶液を調製します。
- 実用的な TRAP ソリューションを準備します。
- 両方のストック溶液をドラフト内で混合します(0.5 mL の 10 mg/mL ナフトール AS-MX リン酸溶液と 50 mM 酒石酸ナトリウム中の 1.6 mM Fast Red Violet LB ストック溶液 50 mL)。
注意: 作業溶液は、ドラフトの外で使用できるようになりました。冷蔵庫(ホイルで包んだもの)で最長1ヶ月間保存できます。固定剤に敏感な抗体やその他の試薬とは別の容器に保管してください。できるだけ光を避けてください。 - オプション:PBSおよび0.1% Tween-20(PBS-0.1%Tw)で漂白溶液(TRAP染色した固定後サンプル)を調製します。
- 0.5%水酸化カリウム(KOH)(10%原液(w / v)から)および3%過酸化水素(H2O2)(33%原液、冷蔵庫に保管)の最終濃度混合物を調製する。
- 両方のストック溶液をドラフト内で混合します(0.5 mL の 10 mg/mL ナフトール AS-MX リン酸溶液と 50 mM 酒石酸ナトリウム中の 1.6 mM Fast Red Violet LB ストック溶液 50 mL)。
- 試料固定を行います。
- 4% PFAの4%スケールを室温(RT)で40分間揺動または回転させる1x PBSで固定します。
- 4%PFAを除去し、PBS-0.1Txで5分間、少なくとも3回洗浄します。
- 直接TRAP染色(最良のアプローチ)に移行するか、PBS-0.1 Txで一晩保存します。
- 鱗屑のTRAP染色を行います。
- PBS-0.1 Tx溶液を除去し、比色TRAPワーキング溶液(ステップ5.2.1)を加えて、サンプルを完全に覆います(つまり、1.5 mLの微量遠心チューブに1 mL)。
- RTで1〜2時間インキュベートし、暗闇で揺れます。
- 染色液を除去し、PBS-0.1 Twで5分間以上3回洗浄してください。
- サンプルを 4% PFA で 30 分間室温で後固定し、暗所で静かに揺動させます。
- PBS-0.1 Twで各工程5分間3回洗浄し、PFA溶液を除去する。
注:サンプルは、暗所で4°Cで無期限に保管できます(保存溶液中/顕微鏡スライドに取り付けます)。
6. ステンドスケールの取り付け
- 2.4gのMowiol 4-88結晶を6gのグリセロールに添加して封入剤を調製します( 材料表を参照)。任意の好ましい封入媒体を使用することができる。
- 6 mLの脱イオン水を加え、マグネチックスターラーに1時間放置します。
- 12 mLの0.2 Mトリス(pH 8.5)を加え、Mowiol結晶が完全に溶解するまで約53°Cでインキュベートします。
- 室温で2000 x g で20分間遠心分離することにより、溶液を清澄化します。
- 溶液を保管容器に移します。封入剤は冷凍庫で約12ヶ月間保管できます。解凍したMowiol溶液は、最大1か月間安定しています。
- 培地に体重計を顕微鏡スライドに取り付け、カバーガラスで覆い、顕微鏡で観察します。
7. 鱗の 生体外 培養
注:このステップは、de Vrieze et al.12から引用しています。
- 無菌環境で鱗屑を採取する前に、骨形成培地と培養プレートを準備します。
- 骨形成培養培地(OCM):滅菌遠心チューブ内で、1%ウシ血清、1%(0.85%NaCl中の200 mM L-アラニル-L-グルタミンジペプチド)、1%抗生物質/抗真菌剤溶液(100x)溶液、4 mM CaCl2、10 mM β-グリセロリン酸、1 nMピルビン酸ナトリウム、および1%アムホテリシンB(オプション)の最終濃度で、標準的な細胞培養培地(高グルコース、グルタミンなし、フェノールレッドなし)で15 mLのOCMを調製します( 材料表を参照)。
- OCMを滅菌試薬リザーバーに流し込み、マルチチャンネルピペットを使用して、96ウェルプレートの各ウェルに100 μLを添加します。
- 96ウェルプレートを密封し、プレートを保管します。OCMは冷蔵庫で短期間(一晩から1週間)保存し、使用前に28°Cに保つことができます。
- スケールハーベスティングとPBS洗浄を行います。
- 滅菌ピンセット/鉗子を使用して鱗を採取し、滅菌PBS溶液を含むペトリ皿に入れます。
- プレートのセットアップを実行します。
- 滅菌鉗子を使用して、100 μLのOCM(28°Cに加温)でペトリ皿から96ウェルプレート上の各ウェルに各スケールを移します。
- すべてのスケールがプレートに移されたら、プレートを実体顕微鏡下に持ち込みます。微細な滅菌ピペットチップを使用して、各スケールをウェルの底に静かに移動させ、ウェルの側面から遠ざけて、画像取得中の光の反射を防ぎます。
メモ: この手順は、ライブイメージングを実行する場合にのみ必要です。 - プレートをインキュベーターまたはライブイメージングシステム(LIS、 材料表を参照)(28°C、5%CO2に設定)に慎重に移し、スケールを最大7日間培養します。
- OCMをリフレッシュします(オプション)。
- 冷蔵庫で保管していたOCMを28°Cに温める。
- 96ウェルプレートを無菌環境に慎重に移します。マルチチャンネルピペットを使用して、各ウェルから50μLを吸引します。このためには、先端を壁に押し付け、スケールを吸引/移動/除去しないように、底まで浸さないでください。さまざまな条件で新しいヒントを使用します。
- OCMを滅菌試薬リザーバーに注ぎ、マルチチャンネルピペットを使用して各ウェルに60 μLのOCMを加えます。
- プレートを実体顕微鏡の下に置き、スケールの位置が間違っていないか(壁に近すぎる、浮いている、またはメディア内の垂直位置にある)を確認します。必要に応じて、無菌の細いピペットチップで再配置します。
- プレートをインキュベーター/LISに戻します。
注:実験に概日リズム(CR)が含まれる場合は、血清ショックが体内時計に影響を与える可能性があるため、培地を更新しないでください。CRを研究する場合は、光の状態も時計をリセットすることに注意します。
- 培養後のスケール染色とイメージングを行います(オプション)。
- 6日間の培養後、それらを固定し、上記のvon KossaやALPなどの適切な染色に指示します。
- あるいは、実験魚に蛍光タグが付いている場合は、プレートをライブイメージングシステムに入れます。
注:ライブイメージングシステムを使用する場合は、実験に適した温度とCO2 レベルに設定されていることを確認してください。通常、この研究では、28°Cおよび5%CO2 を使用しました。適切なフィルターとイメージングのタイムポイント(ここでは、骨芽細胞の移動を追跡するのに十分な2時間または4時間の間隔を使用しました)および低倍率の対物レンズ(つまり、4倍)を選択して、ウェル全体のイメージングを均一に行えるようにします。これは、スケールがウェル内を移動する傾向があり、特に培地交換時に発生するためです。
結果
スケールの再生成
鱗の再生は、標準的な蛍光実体顕微鏡でゼブラフィッシュの脇腹をイメージングすることで追跡できます。 図3A は、生後4ヶ月のゼブラフィッシュの鱗再生中の鱗の sp7/osx 発現の変化を示しています。 図3A に示す側面イメージングの時点は、個体発生(収穫前の元のスケール)、収穫後2日目、4日目、および10日目です。通常、osx ( osterix または sp7としても知られる)トランスジェニック系統(GFP(Tg(Ola.sp7:NLS-eGFP)19 またはmCherry Tg(osterix:mCherry-NTR)pd46)17 のいずれかとして、骨を作る骨芽細胞を標識する骨格系の変化を追跡します。新しく形成された鱗屑の初期のパターンは、再生の2日間で見ることができます。この鱗屑再生の初期のパターンは、特に骨格変異体において、場合によっては破壊される。再生の進行状況を追跡することで、再生の能力と速度を分析できます。スケール採取日には、 図3Bに示すように、同じ実体顕微鏡を使用して側面イメージングを行った後、採取したスケールの個々のイメージングを行うことができます。再生された鱗屑は、骨芽細胞が新しい骨形成に必要であるため、0日目の個体発生学的スケールと比較して はるかに高いosx 発現を有する。
Ex vivo スケールの培養
魚の脇腹の再生過程を追跡することで、de novo骨の形成過程を研究することができますが、このモデルを用いて、メスで鱗に傷をつけることにより、 ex vivo スケール培養による骨格損傷の修復と治癒を研究することもできます。ライブイメージングシステムを使用して、修理をリアルタイムで追跡できます。図4 は、骨芽細胞を osx:mCherryで標識した培養物への3日間における個体発生学的スケールでの損傷治癒反応の代表的な結果を示しています。培養開始時の挿入図で示される損傷部位は、骨芽細胞と鱗屑循環の間に明確なギャップを示しています(図4A)。骨芽細胞の損傷部位への移動は、タイムラプスイメージングで監視できます。培養で3日後、ギャップの幅が狭くなり、ギャップと新しく形成されたスケールサーキュリの間にosx の発現が見られます(図4B)。さらに、骨芽細胞の形状に関する形態は、培養の開始時および3日後には、より細長い。この骨芽細胞の外観の変化は、自然環境(魚に付着している)ではなく、培養中にあることが原因である可能性があります。
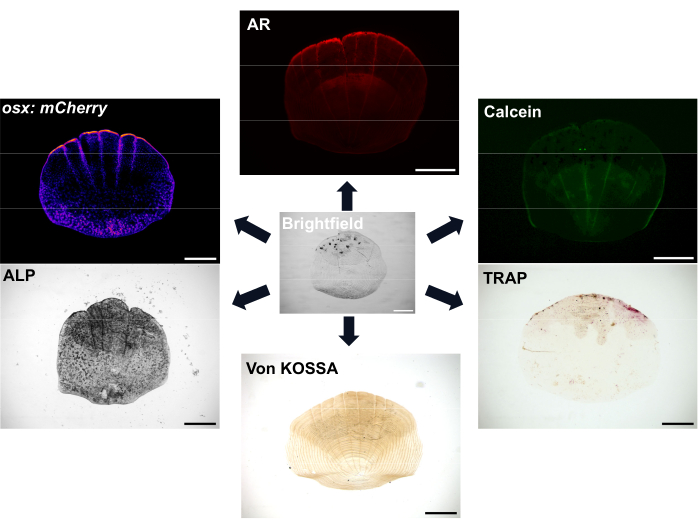
図1:スケールのイメージングオプションの例。 骨芽細胞は、 osx/sp7 トランスジェニックレポーターライン(GFPまたはmCherryのいずれか)で可視化できます。ALP染色は、骨芽細胞活性を示すために使用できます。TRAP染色は破骨細胞の活性を示すことができます。アリザリンレッド(AR)とカルセイングリーンはどちらも生きた魚に使用できる染料です。ARは石灰化作用を標識し、カルセインは新しく形成された骨を標識します。鉱化作用の程度は、フォン・コッサ染色でも示すことができます。スケールバー:500 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
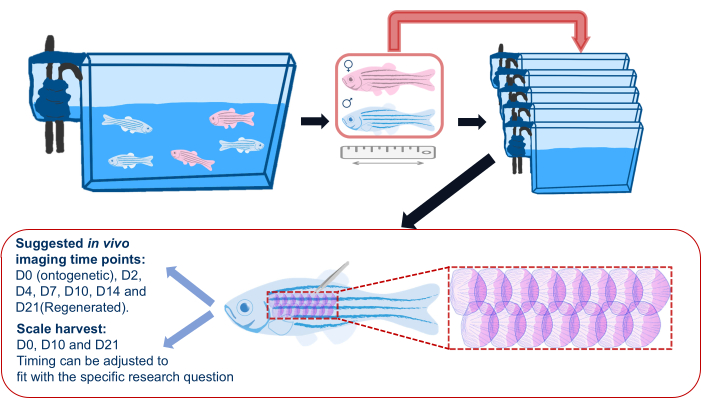
図2:スケール再生実験の模式図。 鱗屑再生実験の一般的な概略図は、実験前に魚が個々の水槽に分離されていることを示しています。長さ、性別、健康状態が記録されます。また、この概略図には、魚の脇腹で鱗を採取するための推奨領域と、推奨されるイメージングの時点も示されています。 この図の拡大版をご覧になるには、ここをクリックしてください。
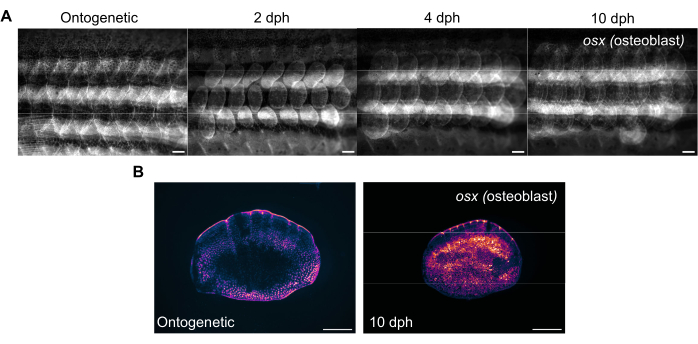
図3:生後4ヶ月のゼブラフィッシュから撮影した鱗屑再生時の骨芽細胞発現(骨芽細胞を可視化するため)の代表的な画像。 (A)osx発現の変化を追跡するために、0日目(収穫前、個体発生学的スケール)、2 dph(収穫後日数)、2日目、4 dph、および10 dphで撮影された側面画像。スケールバー:1 mm。 (B)パネル(A)と同じ魚から撮影された個体発生学的スケールと10 dphのスケールの代表的な画像。osxの表現レベルが上昇していることに注目し、再生スケールの中央にマゼンタで表示します。スケールバー:500 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
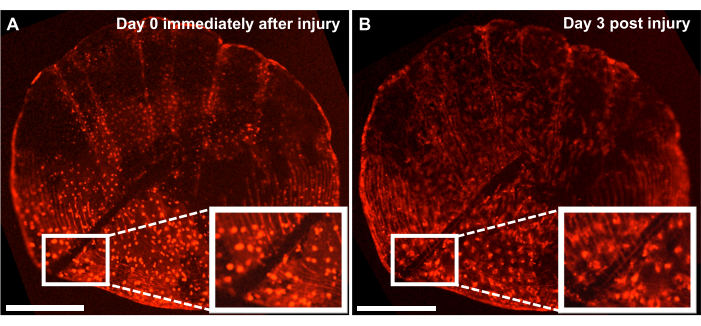
図4:生後4ヶ月のゼブラフィッシュからライブイメージングシステムを用いて撮影した個体発生学的スケールでの骨格損傷修復反応の代表的な結果。 (A)培養の収穫と同じ日(時点0/day0)にメスによって損傷を受けた個体発生学的スケール。(B)受傷後3日でも同じスケールが示されています。挿入図は、損傷の領域を示します。スケールバー:500 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
ゼブラフィッシュのエラスモイド鱗は、骨格研究のための新しいモデルとして、骨の維持、再生、損傷の修復の理解に役立つ大きな可能性を秘めています。魚類の鱗屑が豊富であるため、使用する動物の数を減らし、個体内のばらつきを抑えながら、中程度からハイスループットの化合物スクリーニングが可能になります。ここでは、再生と修復を研究するために、スケール再生と生体外スケール培養のプロトコルが提示されます。
このプロトコルに従う際には、いくつかの重要なステップを考慮する必要があります。特にトランスジェニックレポーターラインを使用して、収穫によって引き起こされる細胞集団への撹乱を制限する場合は、スケールの慎重な除去が不可欠です。個体発生の鱗と比較する場合は、その領域に自然再生する鱗屑(魚の寿命を通じて自然に発生する可能性がある)が含まれていないことを確認してください。最適な細胞生存率と培養中の感染を最小限に抑えるために、 ex vivo 培養のための環境と機器が無菌であることを確認してください。
特定の研究課題に応じて、再生および修復中の他の細胞タイプの遺伝子発現プロファイルを視覚化するために、異なるトランスジェニックレポーター株を組み合わせるなど、プロトコルに適応させることができます11,14。
スケールで実行できる幅広い染色は、テストされた化合物または状態ごとに、骨への影響をさまざまな角度から見ることができることを意味します。SP7/OSXレポーターは骨芽細胞の数を示すことができますが、ALP染色は骨芽細胞活性を可視化し、TRAP染色は破骨細胞活性を可視化し、カルセイングリーンライブ染色は新たに形成された骨を標識し、アリザリンレッドまたはフォンコッサ染色はスケール石灰化を示すことができます。骨芽細胞を定量するためのルシフェラーゼ活性も使用することができる12。これらの染色技術と組み合わせることで、骨芽細胞と破骨細胞の特定の骨効果に対する相対的な寄与を知ることができます。鱗屑には、哺乳類の骨に多く存在し、骨の機械感覚反応の主な推進力である骨細胞がありません。このモデルにおける鱗屑の修復と再生は、主に骨芽細胞によって駆動され、その後の破骨細胞によるリモデリング8,9。個人と年齢層20の間でばらつきが生じることに注意することが重要です。これを最小限に抑えるには、場所が異なればスケールの形態も異なるため、スケールの収穫面積を一定にする必要がありますが、年齢とサイズが一致するように同じ兄弟グループの魚が使用されます。しかし、1匹の魚に複数の鱗を採取できるため、より少ない魚でより多くの実験を行うことができ、個体内のばらつきを減らすことができます。
要約すると、これらのプロトコルは、個体発生および再生スケールに適用できる実験技術を示しています。結論として、エラスモイドスケールは、骨の形成と修復の理解を助ける骨格モデルとして大きな可能性を示しています。また、ハイスループットの骨同化化合物スクリーニングのための動物の使用を減らすのに役立ちます。
開示事項
著者には開示すべき利益相反はありません。
謝辞
魚飼育のアニマルサービスユニットのマシュー・グリーン氏とウォルフソン・バイオイメージング・センターのケイティ・ジェプソン氏に感謝します。CLH、DB、およびQTは、Versus Arthritis(CLHシニアフェローシップ21937、DBおよびQT中級フェローシップ22044)によって資金提供され、RRは(NHMRC APP1158758)によって資金提供されました。この研究は、BBSRC助成金(BB/T001984/1)の支援も受けました。
資料
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffered saline (PBS) | Gibco | 70013-016 | PBS |
| 12-Multichanel Pipette | Sartorius | 728230 | Multichanel pipette, Proline Plus Mechanical Pipette, 12 Channel, , 10-100 µL. |
| 15 mL Centrifuge tubes | Corning | 430791 | Centrifuge tube, CentriStar Cap, Polypropylene, RNAse/DNAse free, Non-pyrogenic |
| 4% Paraformaldehyde (PFA) | Sigma | P6148 | PFA |
| Alizarin red | Sigma | A5533 | |
| Amphotericin B | ThermoFisher Scientific | 15290026 | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher Scientific | 11772644 | Sealing film |
| Calcein powder | Sigma | C0875 | |
| Calcium Chloride | Thermo Scientific | L13191.30 | |
| Corning 96 well plate | Corning | 3596 | 96-well-plate, Clear, Flat Bottom Polystyrene TC-treated Microplates, Individually Wrapped, with Lid, Sterile |
| Cover slips | VWR | 631-0146 | |
| Cytiva HyClone Iron-Supplemented Calf Serum | Fisher Scientific | SH30072.03 | |
| Danieau | Sigma | ||
| DMEM | Life Technologies | 31053 | |
| Falcon tubes | Corning | 430828 | |
| Fast Red Violet LB stock solution | Sigma | F3381 | |
| GlutaMAX Supplement | Life Technologies | 35050 | |
| Glycerol | Sigma | 81381 | |
| Hepes | Sigma | H3375 | |
| Incubator | X | Incubator, Set up to 28 °C and 5% CO2 | |
| IncuCyte Zoom | Sartorious | X | Live Imaging System, Set up to 28 °C and 5% CO2 |
| Leica stereomicroscope | X | Sterioscope | |
| L-tartrate dibasic dihydrate | Sigma | 228729 | |
| Mgcl2 | BDH Laboratory Sup. | 261237T | |
| Microscope slides | Epredia | J2800AMNZ | |
| Mowiol 4-88 | Sigma | 9002-89-5 | |
| MQ water | X | ||
| N, N’-dimethylformamide (Merck: D4451) | Merck | D4451 | |
| NaCL | Fisher Chemical | S/3120/53 | |
| Naphthol AS-MX phosphate | Merck | N4875 | |
| NBT/BCIP solution | Sigma | #000000011681451001 | |
| Penicillin-Streptomycin | Life Technologies | 15140 | |
| Petri Dishes | Corning | 430589 | 35 mm sterile Petri dish, Non-treated, Nonpyrogenic, Polystyrene. |
| Reagent Reservoir | Startub | E2310-1025 | 25mL Reagent Reservoir |
| Silver nitrate | Sigma | 209139 | |
| Sodium acetate | Sigma | 52889 | |
| Sodium beta-glycerophosphate pentahydrate | Thermo Scientific | L03425.14 | |
| Sodium pyruvate solution | Sigma | S8636 | |
| Sodium tartrate | Sigma | S4797 | |
| Sodium thioculphate | Sigma | 563188 | |
| Tricaine methane sulfonate (MS222) | Sigma | E10521 | |
| Tris | Sigma | 252859 | |
| Triton-X100 | Sigma | T8787 | |
| Tween-20 | SLS | CHE3852 | |
| Tweezers Number 5 | Dumont | 500341 | Tweezer, INOX, biology grade |
| Zebrafish tanks | Tecniplast | ZB30BCP | 3.5 L - 28 cm x 11 cm x 17 cm |
| Zebrafish tanks | Tecniplast | ZB30BCP | 1 L - 28 cm x 7 cm x 11 cm |
参考文献
- Tobias, J. H., et al. Opportunities and challenges in functional genomics research in osteoporosis: report from a workshop held by the causes working group of the osteoporosis and bone research academy of the Royal Osteoporosis Society on October 5th 2020,". Frontiers in Endocrinology. 11, (2021).
- Busse, B., Galloway, J. L., Gray, R. S., Harris, M. P., Kwon, R. Y. Zebrafish: An emerging model for orthopedic research. Journal of Orthopaedic Research. 38 (5), 925-936 (2020).
- Dietrich, K., et al. Skeletal biology and disease modeling in zebrafish. Journal of Bone and Mineral Research. 36 (3), 436-458 (2021).
- McGowan, L. M., Kague, E., Vorster, A., Newham, E., Cross, S., Hammond, C. L. Wnt16 elicits a protective effect against fractures and supports bone repair in zebrafish. JBMR Plus. 5 (3), 10461 (2021).
- Sehring, I., Weidinger, G. Zebrafish fin: Complex molecular interactions and cellular mechanisms guiding regeneration. Cold Spring Harbor Perspectives in Biology. 14 (7), 040758 (2022).
- Bergen, D. J. M., Kague, E., Hammond, C. L. Zebrafish as an emerging model for osteoporosis: a primary testing platform for screening new osteo-active compounds. Frontiers in Endocrinology. 10 (6), (2019).
- Aman, A. J., Fulbright, A. N., Parichy, D. M. Wnt/β-catenin regulates an ancient signaling network during zebrafish scale development. Elife. 7, 37001 (2018).
- Iwasaki, M., Kuroda, J., Kawakami, K., Wada, H. Epidermal regulation of bone morphogenesis through the development and regeneration of osteoblasts in the zebrafish scale. Developmental Biology. 437 (2), 105-119 (2018).
- Metz, J. R., de Vrieze, E., Lock, E. J., Schulten, I. E., Flik, G. Elasmoid scales of fishes as model in biomedical bone research. Journal of Applied Ichthyology. 28 (3), 382-387 (2012).
- Cox, B. D., De Simone, A., Tornini, V. A., Singh, S. P., Di Talia, S., Poss, K. D. In toto imaging of dynamic osteoblast behaviors in regenerating skeletal bone. Current Biology. 28 (24), 3937-3947 (2018).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders,". Frontiers in Endocrinology. 11, (2020).
- de Vrieze, E., Zethof, J., Schulte-Merker, S., Flik, G., Metz, J. R. Identification of novel osteogenic compounds by an ex-vivo sp7: Luciferase zebrafish scale assay. Bone. 74, 106-113 (2015).
- De Vrieze, E., Moren, M., Metz, J. R., Flik, G., Lie, K. K. Arachidonic acid enhances turnover of the dermal skeleton: Studies on zebrafish scales. PLoS One. 9 (2), 89347 (2014).
- Bergen, D. J. M., et al. Regenerating zebrafish scales express a subset of evolutionary conserved genes involved in human skeletal disease. BMC Biology. 20 (1), 21 (2022).
- Bergen, D. J. M., et al. High bone mass disorders: New insights from connecting the clinic and the bench. Journal of Bone and Mineral Research. , (2022).
- Pasqualetti, S., Banfi, G., Mariotti, M. Osteoblast and osteoclast behavior in zebrafish cultured scales. Cell and Tissue Research. 350 (1), 69-75 (2012).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Developmental Cell. 22 (4), 879-886 (2012).
- Ethiraj, L. P., Fong, E. L. S., Liu, R., Chan, M., Winkler, C., Carney, T. J. Colorimetric and fluorescent TRAP assays for visualising and quantifying fish osteoclast activity. European Journal of Histochemistry. 66 (2), 3369 (2022).
- DeLaurier, A., et al. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505 (2010).
- Carnovali, M., Banfi, G., Mariotti, M. Age-dependent modulation of bone metabolism in zebrafish scales as new model of male osteoporosis in lower vertebrates. Geroscience. 43 (2), 927-940 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved