Method Article
إنشاء بسيط لمكانة نخاع العظم العظمي الوعائي باستخدام الهلاميات المائية المصنوعة مسبقا من البولي (جلايكول الإثيلين) (PEG) في صفيحة تصوير دقيقة
In This Article
Summary
يتم إنشاء نموذج في المختبر من مكانة الأوعية الدموية نخاع العظم عن طريق زرع خلايا اللحمة المتوسطة والبطانية على الهلاميات المائية 3D PEG المصبوبة مسبقا. تختلف الشبكات البطانية ومكونات ECM ونشاط ALP للمنافذ اعتمادا على عامل النمو المستخدم. يمكن استخدام المنصة لنماذج السرطان المتقدمة.
Abstract
العظام ونخاع العظم هي أعضاء شديدة الأوعية الدموية ومعقدة هيكليا ، وهي مواقع للسرطان وتشكيل ورم خبيث. النماذج في المختبر التي تلخص الوظائف الخاصة بالعظام ونخاع العظام ، بما في ذلك الأوعية الدموية ، المتوافقة مع فحص الأدوية مرغوبة للغاية. يمكن لمثل هذه النماذج سد الفجوة بين النماذج ثنائية الأبعاد (2D) المبسطة وغير ذات الصلة هيكليا في المختبر والنماذج الأكثر تكلفة وتحديا أخلاقيا في الجسم الحي . توضح هذه المقالة مقايسة ثقافة مشتركة ثلاثية الأبعاد (3D) يمكن التحكم فيها بناء على مصفوفات البولي (جلايكول الإثيلين) (PEG) المهندسة لتوليد منافذ نخاع العظام الوعائية العظمية. يسمح تصميم مصفوفة PEG بتطوير ثقافات الخلايا 3D من خلال خطوة بسيطة لبذر الخلايا لا تتطلب أي تغليف ، مما يتيح تطوير أنظمة زراعة مشتركة معقدة. علاوة على ذلك ، فإن المصفوفات شفافة ومصبوبة مسبقا على لوحات تصوير زجاجية ذات 96 بئرا ، مما يجعل النظام مناسبا للفحص المجهري. بالنسبة للفحص الموصوف هنا ، يتم استزراع الخلايا اللحمية المتوسطة المشتقة من نخاع العظم البشري (hBM-MSCs) أولا حتى يتم تشكيل شبكة خلايا 3D متطورة بما فيه الكفاية. بعد ذلك ، تتم إضافة الخلايا البطانية للوريد السري البشري المعبرة عن GFP (HUVECs). يتبع تطور الثقافة الفحص المجهري للمجال الساطع والتألق. يدعم وجود شبكة hBM-MSC تكوين هياكل شبيهة بالأوعية الدموية لن تتشكل لولا ذلك وتظل مستقرة لمدة 7 أيام على الأقل. يمكن بسهولة قياس مدى تكوين الشبكة الشبيهة بالأوعية الدموية. يمكن ضبط هذا النموذج نحو مكانة نخاع العظم العظمي من خلال استكمال وسط الاستزراع بالبروتين المورفولوجي العظمي 2 (BMP-2) ، والذي يعزز التمايز العظمي ل hBM-MSCs ، كما تم تقييمه من خلال زيادة نشاط الفوسفاتيز القلوي (ALP) في اليوم 4 واليوم 7 من الثقافة المشتركة. يمكن استخدام هذا النموذج الخلوي كمنصة لزراعة الخلايا السرطانية المختلفة ودراسة كيفية تفاعلها مع منافذ الأوعية الدموية الخاصة بالعظام ونخاع العظام. علاوة على ذلك ، فهي مناسبة للأتمتة وتحليلات المحتوى العالي ، مما يعني أنها ستمكن من فحص أدوية السرطان في ظل ظروف ثقافة قابلة للتكرار للغاية.
Introduction
العظام ونخاع العظام هي أجهزة معقدة هيكليا ووظيفيا مركزية لصحة الإنسان. وينعكس هذا من خلال وجود منافذ متميزة تنظم تكون الدم وصيانة العظام1. من المقبول الآن على نطاق واسع أنه في نخاع العظم السليم ، يتم التحكم في صيانة وتوسيع الخلايا الجذعية المكونة للدم والهيكل العظمي ، وكذلك ذريتها ، من خلال منافذ متميزة. تشتمل هذه المنافذ على أنواع مختلفة من الخلايا ، بما في ذلك خلايا السلالة العظمية ، والخلايا الجذعية الوسيطة ، والخلايا البطانية وحول الأوعية الدموية ، والخلايا العصبية والدبقية ، والخلايا الشحمية ، والخلايا الآكلة للعظم ، والبلاعم ، والعدلات2. ليس من المستغرب أن تشارك هذه المنافذ المرتبطة بالأوعية الدموية في الغالب في تطوير أنواع مختلفة من سرطان الدم3 وهي موقع ورم خبيث لسرطانات مختلفة4. نظرا لأدوارها المحددة في تكوين العظام وإعادة تشكيلها وصيانة العظام (النخاع) ، فإن الأوعية الدموية المرتبطة بالعظام لها هياكل متخصصة متميزة تختلف عن الأوعية الدموية الموجودة في أماكن أخرى من الجسم5،6،7. وبالتالي ، فإن الأدوية المضادة لتولد الأوعية أو تعديل الأوعية الدموية المطبقة بشكل منهجي قد يكون لها تأثيرات مختلفة داخل هذه البيئات المتخصصة8. لذلك ، فإن نماذج التحقيق في الآليات الجزيئية المشاركة في الحفاظ على الخصائص الفسيولوجية للعظام ونخاع العظم ، وتجديد العظام ونخاع العظام ، والاستجابات للعلاجات العلاجية مرغوبة للغاية.
قدمت مزارع الأنسجة الكلاسيكية ثنائية الأبعاد (2D) والتحقيقات في الجسم الحي باستخدام النماذج الحيوانية نظرة ثاقبة لا تقدر بثمن في أدوار الخلايا المختلفة واللاعبين الجزيئيين المشاركين في تطوير العظام ونخاع العظام9،10. يمكن للنماذج التي تسمح بإجراء تجارب عالية الإنتاجية مع الخلايا البشرية ذات الصلة أن تحسن فهمنا لكيفية تعديل المعلمات المختارة في هذه الأنظمة المعقدة للغاية.
في العقد الماضي ، تم استخدام المبادئ المستمدة من هندسة الأنسجة لتوليد نماذج الأنسجة ثلاثية الأبعاد11,12. وقد اعتمدت هذه في الغالب على تغليف الخلايا ذات الصلة بالأنسجة في المواد الحيوية لإنشاء 3D أحادي أو الثقافات المشتركة13. من بين المواد الحيوية الأكثر استخداما الفيبرين 14 والكولاجين15 و Matrigel16,17 ، وكلها متوافقة حيويا للغاية وتوفر الظروف المناسبة لنمو العديد من أنواع الخلايا. هذه المواد الحيوية لديها القدرة على توليد نماذج في المختبر تلخص الجوانب الرئيسية لمنافذ الأوعية الدموية المختلفة الموجودة في الجسم الحي18. علاوة على ذلك ، ساهم استخدام أجهزة الموائع الدقيقة لتوليد نماذج العظام ونخاع العظام الوعائية في توليد نماذج في المختبر ذات تعقيد أعلى19،20،21،22.
ألهمت صعوبة التحكم في تكوين وهندسة خصائص المواد الحيوية التي تحدث بشكل طبيعي تطوير نظائر اصطناعية يمكن تصميمها بشكل عقلاني مع خصائص فيزيائية وكيميائية وبيولوجية يمكن التنبؤ بها23,24. لقد قمنا بتطوير هلاميات مائية قائمة على البولي (جلايكول الإثيلين) (PEG) الاصطناعية بالكامل (FXIII) ، والتي تعمل مع ببتيدات RGD ومواقع انقسام مصفوفة ميتالوبروتياز (MMP) لتسهيل ارتباط الخلية وإعادة تشكيل25,26. تم استخدام التصميم المعياري لهذه المواد الحيوية بنجاح لتحسين الظروف لتشكيل نماذج العظام ونخاع العظام الوعائية 3D27,28.
لاختبار أعداد أكبر من ظروف المزرعة المختلفة والعلاجات الجديدة ، هناك حاجة إلى نماذج ذات قدرة إنتاجية أعلى. لقد أظهرنا مؤخرا أنه يمكن التحكم في الربط المتقاطع FXIII لهيدروجيل PEG الخاص بنا من خلال عملية كهروكيميائية بحيث يتم تشكيل تدرج صلابة هيدروجيل متعمق29. عندما تضاف الخلايا فوق هذه الهلاميات المائية ، فإنها تهاجر نحو الداخل وتتطور تدريجيا إلى شبكات خلوية ثلاثية الأبعاد مترابطة للغاية30. إن القضاء على الحاجة إلى تغليف الخلايا في هيدروجيل ، والذي يوجد عادة مع سقالات 3D الأخرى ، لا يبسط التصميم التجريبي فحسب ، بل يسمح أيضا بالإضافة المتسلسلة لأنواع الخلايا المختلفة في نقاط زمنية مختلفة لتوليد أنظمة زراعة مشتركة معقدة. تتوفر هذه الهلاميات المائية مصبوبة مسبقا على ألواح تصوير 96 بئرا ذات قاع زجاجي ، مما يجعل إنشاء ثقافات 3D قابلا للتحقيق عن طريق بروتوكولات بذر الخلايا اليدوية والآلية. الشفافية البصرية للهلاميات المائية PEG تجعل المنصة متوافقة مع الفحص المجهري.
هنا ، نقدم طريقة مباشرة لتوليد وتوصيف منافذ عظمية منشأ الأوعية الدموية داخل هذه المنصة الاصطناعية الجاهزة للاستخدام للتوصيل والتشغيل. نظهر أنه يمكن تحفيز تطور شبكات الأوعية الدموية بعامل نمو شائع الاستخدام لتحفيز تكوين العظم في المختبر ، البروتين المورفولوجي للعظام -2 (BMP-2) ، بينما يمكن منع التمايز العظمي عن طريق مكملات عامل نمو الخلايا الليفية 2 (FGF-2)27,31. تختلف الشبكات المتكونة عند مقارنتها بالشبكات المحفزة FGF-2 من حيث المظهر العام ، وكذلك توزيع الخلية و ECM. علاوة على ذلك ، قمنا بمراقبة الحث العظمي باستخدام الفوسفاتيز القلوي كعلامة. نوضح التعبير المتزايد لهذه العلامة بمرور الوقت ونقارن التعبير بالتعبير في الشبكات المحفزة FGF-2 باستخدام الأساليب النوعية والكمية. أخيرا ، نوضح مدى ملاءمة المنافذ التي تم إنشاؤها لهذا النموذج لتطبيقين محتملين. أولا ، أجرينا مقايسة حساسية الدواء لإثبات المفهوم عن طريق إضافة بيفاسيزوماب إلى منافذ مسبقة التكوين ومراقبة تدهور شبكات الأوعية الدموية في وجودها. ثانيا ، أضفنا سرطان الثدي MDA-MB-231 وخلايا الساركوما العظمية U2OS إلى منافذ عظمية مسبقة التكوين ، مما يدل على أنه يمكن استخدام المنافذ لدراسة التفاعلات بين الخلايا السرطانية وبيئتها.
Protocol
يلخص الشكل 1 أقسام البروتوكول التالية.
1. إنشاء الزراعة الأحادية اللحمية 3D
- تحضير تعليق خلية hBM-MSC.
- تنمو hBM-MSCs إلى مستوى التقاء 70٪ -90٪ في MEMα مع 10٪ FBS ، 1٪ البنسلين - الستربتومايسين ، و 5 نانوغرام / مل FGF-2 في حاضنة عند 37 درجة مئوية و 5٪ CO2 في جو مرطب. يمكن استخدام الخلايا حتى الممر 6.
- اغسل الخلايا باستخدام برنامج تلفزيوني ، وافصلها باستخدام 0.05٪ Trypsin-EDTA لمدة 3-5 دقائق عند 37 درجة مئوية. إيقاف عملية الانفصال عن طريق التنظيف باستخدام الوسط القاعدي (MEMα مكمل ب 10٪ FBS و 1٪ بنسلين ستربتومايسين). اجمع الخلايا العالقة في أنبوب طرد مركزي مخروطي سعة 50 مل.
- عد الخلايا باستخدام مقياس الدم الخلوي أو عداد الخلايا الآلي ، وحدد العدد الإجمالي للخلايا في التعليق.
- بيليه الخلايا عن طريق الطرد المركزي في 200 × غرام لمدة 5 دقائق. إزالة بعناية طفا.
- أعد تعليق الخلايا في حجم مناسب من الوسط القاعدي لتحقيق تركيز 1 × 107 خلايا / مل من محلول المخزون.
- إعداد أنابيب طرد مركزي مخروطية سعة 50 مل تحتوي على الحجم المطلوب من الوسط القاعدي المكمل بعوامل النمو ذات الصلة (FGF-2 و BMP-2 بتركيزات محددة ، على سبيل المثال ، 0 نانوغرام / مل ، 25 نانوغرام / مل ، 50 نانوغرام / مل ، 100 نانوغرام / مل ، أو 200 نانوغرام / مل). لكل بئر ، مطلوب 200 ميكرولتر. إذا كان سيتم إجراء بذر الخلايا باستخدام معالج سائل آلي ، فضع في اعتبارك أيضا الحجم الميت للأداة. بالنسبة للبذر اليدوي للخلايا ، يكفي زيادة الحجم بنسبة 10٪.
- أضف hBM-MSCs من محلول المخزون بتخفيف 1: 66.67 لتحقيق تركيز 1.5 × 105 خلايا / مل.
- تحضير لوحة للبذر.
- قم بإزالة فيلم لاصق البولي بروبلين الذي يغطي لوحة هيدروجيل 96 بئرا.
- قم بشفط المخزن المؤقت الذي يغطي الهلاميات المائية بعناية. لهذه المهمة ، استخدم غسالة الصفائح الدقيقة ؛ ومع ذلك ، فإن المناولة اليدوية ممكنة.
- عند استخدام شفاط يدوي أو ماصة متعددة القنوات ، ضع الطرف على جدار البئر ، وتحرك ببطء نحو حافة البئر الداخلية أثناء شفط المخزن المؤقت. هذا سوف تجنب إتلاف سطح هيدروجيل.
- عند استخدام غسالة الألواح الآلية ، اضبط فوهات الشفط على بعد 3.8 مم على الأقل من حامل اللوحة (وهذا يتوافق مع 0.8 مم من الحلقة الداخلية للوحة الهيدروجيل) وباتجاه حافة البئر. راجع دليل الشركة المصنعة للحصول على إرشادات أكثر تفصيلا وللحصول على رسومات اللوحة الخاصة بلوحة هيدروجيل 96 بئرا.
- أضف 200 ميكرولتر / بئر من معلق الخلية المحضر في الخطوة 1.1.7 بعد الخلط الجيد لضمان توزيع الخلايا بشكل متجانس. أثناء البذر ، لتجنب الترسيب غير المتكافئ للخلايا في منطقة واحدة من الركيزة ، لا تقم بإمالة اللوحة. للبذر اليدوي ، قم بخلط تعليق الخلية بشكل دوري (بعد بذر ثلاثة آبار) للحفاظ على تجانس الخليط. للبذر الآلي ، امزج مع ماصة مصلية مباشرة قبل الاستغناء من أجل توزيع الأحجام التي تحتوي على أعداد متساوية من الخلايا.
- الحفاظ على الثقافات عند 37 درجة مئوية و 5٪ CO2 في جو مرطب.
- مراقبة تطور الثقافات عن طريق الفحص المجهري مشرق المجال مع هدف 5x حسب الرغبة. احصل على صور مرجعية بعد حوالي 30 دقيقة من البذر لتقييم عدد الخلايا المضافة.
2. إنشاء ثقافة مشتركة للخلايا البطانية اللحمية ثلاثية الأبعاد
- تحضير تعليق الخلية GFP-HUVEC.
- تحضير القوارير لاستزراع HUVEC عن طريق الطلاء بمحلول يتكون من 150 ميكروغرام / مل من الكولاجين ذي ذيل الجرذ I في 0.02 M حمض الخليك لمدة 30 دقيقة عند 37 درجة مئوية. شطف مرة واحدة مع برنامج تلفزيوني قبل الاستخدام.
- قم بتنمية GFP-HUVECs إلى مستوى التقاء 80٪ -100٪ في EGM-2 مع 10٪ FBS في حاضنة عند 37 درجة مئوية و 5٪ CO2 في جو رطب. يمكن استخدام الخلايا حتى المقطع 7.
- اغسل الخلايا باستخدام PBS ، وافصلها باستخدام 0.05٪ Trypsin-EDTA لمدة 2-3 دقائق عند 37 درجة مئوية. إيقاف عملية الانفصال عن طريق التنظيف باستخدام الوسط القاعدي (MEMα مكمل ب 10٪ FBS و 1٪ بنسلين ستربتومايسين). اجمع الخلايا العالقة في أنبوب طرد مركزي مخروطي سعة 50 مل.
- عد الخلايا باستخدام مقياس الدم أو عداد الخلايا الآلي ، وحدد العدد الإجمالي للخلايا الموجودة في التعليق.
- بيليه الخلايا عن طريق الطرد المركزي في 200 × غرام لمدة 5 دقائق. إزالة بعناية طفا.
- أعد تعليق الخلايا في حجم مناسب من الوسط القاعدي لتحقيق تركيز 1 × 107 خلايا / مل من محلول المخزون.
- تحضير أنابيب طرد مركزي مخروطية سعة 50 مل تحتوي على الحجم المطلوب من الوسط القاعدي المكمل بعوامل النمو ذات الصلة (FGF-2 و BMP-2 بتركيزات محددة ، على سبيل المثال ، 0 نانوغرام / مل ، 25 نانوغرام / مل ، 50 نانوغرام / مل ، 100 نانوغرام / مل ، أو 200 نانوغرام / مل) كما هو موضح ل hBM-MSCs في الخطوة 1.1.6.
- أضف GFP-HUVECs من محلول المخزون بتخفيف 1: 66.67 لتحقيق تركيز 1.5 × 105 خلايا / مل ، كما هو موضح ل hBM-MSCs في الخطوة 1.1.7.
- قم بشفط الوسط من اللوحة التي تحتوي على الزراعة الأحادية اللحمية ، كما هو موضح لإزالة المخزن المؤقت في الخطوة 1.2.2.
- أضف 200 ميكرولتر/بئر من معلق الخلية GFP-HUVEC المحضر في الخطوة 2-1-8 كما هو موضح لإضافة hBM-MSC في الخطوة 1.3.
- احتضان في 37 درجة مئوية و 5 ٪ CO2 في جو مرطب. تغيير الوسيط كل 3-4 أيام.
- راقب تطور الثقافة بواسطة المجهر الساطع والفلوري باستخدام هدف 5x حسب الرغبة. حافظ على الثقافات حتى اليوم 4 أو اليوم 7 من الثقافة المشتركة للتوصيف المبكر أو المتوسط ، على التوالي ، أو حسب الرغبة.
3. إجراء التوصيف 1: القياس الكمي لتشكيل شبكة الخلايا البطانية
- في النقاط الزمنية المطلوبة ، احصل على إشارة GFP من GFP-HUVECs باستخدام المجهر الفلوري باستخدام إعدادات مناسبة للقياس الكمي (أي أفضل تركيز ، وتباين عال ، وتكبير منخفض [على سبيل المثال ، 5x] لمجالات رؤية أكبر).
- المعالجة المسبقة لجميع الصور التي تم الحصول عليها في نفس اليوم بالتساوي (على سبيل المثال ، باستخدام Fiji32) لزيادة تحسين التباين. لاحظ أن إشارة GFP قد تصبح باهتة مع وقت الثقافة ؛ لذلك ، قد تحتاج الصور التي تم الحصول عليها في أيام مختلفة إلى معالجة مختلفة.
- إذا كنت تستخدم Fiji أو ImageJ ، فافتح جميع صور قناة GFP لنفس النقطة الزمنية ، وافتح قائمة السطوع والتباين . حدد صورة تمثل حالة وسيطة (ليست الإشارة الأكثر خفوتا وليست الأكثر سطوعا)، واضبط التباين تلقائيا بتحديد تلقائي. حدد تعيين، وحدد نشر لكل الصور المفتوحة الأخرى.
- قم بتقييم ما إذا كان النطاق المحدد تلقائيا يناسب جميع صور النقطة الزمنية الحالية بصريا ، وأعد ضبطه وإعادة نشره يدويا لجميع الصور حسب الحاجة.
- احفظ الصور المعدلة كملفات TIF ، وكرر الخطوة 3.2.1 والخطوة 3.2.2 للنقاط الزمنية الأخرى المكتسبة.
- قم بتطبيق مرشح ضبابية متوسط (على سبيل المثال ، نصف القطر 3 لصور 2048 × 2048) على جميع الصور لتجنب التعرف على القطع الأثرية في اتجاه مجرى النهر ، وبالتالي تسهيل التعرف الدقيق على الشبكة. قم بتقليل الحجم عن طريق التجميع (2x2) واحفظ جميع الصور المعالجة مسبقا كملفات RGB Color TIF بتدرج الرمادي في مجلد للقياس الكمي. يمكن تنفيذ هذه الخطوات يدويا أو في وضع الدفعات باستخدام وحدات الماكرو التي سيشاركها المؤلفون عند الطلب.
- حلل كل الصور الموجودة في المجلد الذي تم إنشاؤه في الخطوات 3.1-3.3 باستخدام وضع العملية الدفعية في محلل تكوين الأوعية ل ImageJ33. لاحظ أنه بناء على حجم الصور والذاكرة العاملة المتوفرة ، قد يستغرق ذلك بضع دقائق لكل صورة.
- التحقق من صحة نتائج القياس الكمي من خلال فحص تراكبات الهياكل المعترف بها والصور الأصلية. إذا تعرفت الخوارزمية على الهياكل الاصطناعية ، حيث لا يمكن رؤية سوى عدد قليل من الخلايا أو لا يمكن رؤيتها في الصورة الأصلية ، فاضبط معلمات المعالجة المسبقة ، وأعد تحليل الصور الأصلية ، أو استبعد مثل هذه المناطق الإشكالية و / أو تكرار الصور من التحليل.
- تطبيع القيم التي تم الحصول عليها إلى مساحة 1 مم 2 بضرب قيم كل عينة بنسبة المنطقة التي تم تحليلها إلى 1 مم2. هذه الخطوة ذات أهمية خاصة إذا تم استخدام صور بأحجام مختلفة.
- استخراج معلمات الشبكة المختلفة ، مثل إجمالي طول الشبكة ، وعدد التقاطعات ، وعدد الأجزاء ، وعدد الأجزاء المعزولة ، والفاصل الزمني المتفرع ، ومتوسط حجم الشبكة ، من التحليل ، واستخدامها لتوصيف الشبكة البطانية في نقاط زمنية مختلفة وتحت ظروف ثقافة مختلفة.
4. إجراء التوصيف 2: تقييم ترسب ECM
- في النقاط الزمنية النهائية المرغوبة ، قم بتقييم ترسب ECM باستخدام التألق المناعي. أضف أجساما مضادة أولية ضد جزيئات ECM المختلفة في 100 ميكرولتر من وسط الاستزراع خلال آخر 6 ساعات من الثقافة أو بعد التثبيت ، كما هو موضح أدناه.
- اغسل المستنبتات مرة واحدة باستخدام 200 ميكرولتر / بئر من PBS لمدة 5 دقائق في RT ، وقم بإصلاحها ب 100 ميكرولتر / بئر من 4٪ بارافورمالدهيد تحت غطاء دخان كيميائي لمدة 30 دقيقة في RT. لاحظ أنه ينصح بإصلاح جميع آبار الصفيحة في نفس الوقت ، حيث قد تتلف الثقافات المحيطة خلال هذه الخطوة. اغسل المزارع الثابتة ب 200 ميكرولتر / بئر من PBS عند RT ثلاث مرات لمدة 5 دقائق في كل مرة ، وقم بتخزينها عند 4 درجات مئوية في 200 ميكرولتر / بئر من PBS ، أو انتقل فورا إلى الخطوة التالية.
- قبل التحضين بالأجسام المضادة الأولية ضد جزيئات ECM بعد التثبيت ، احتضان المزارع الثابتة ب 200 ميكرولتر / بئر من 1٪ BSA في PBS كحل مانع لمدة 30 دقيقة في RT.
- نضح محلول الحجب ، واحتضان 100 ميكرولتر / بئر من محلول الأجسام المضادة الأولية في 1٪ BSA في PBS طوال الليل عند 4 درجات مئوية. اغسل ب 200 ميكرولتر / بئر من PBS ثلاث مرات لمدة 5 دقائق ، على الأقل 3 ساعات ، و 5 دقائق ، على التوالي ، في RT.
ملاحظة: خطوة الغسيل الطويلة مطلوبة للنشر الكامل للجسم المضاد غير المرتبط خارج الهيدروجيل.
- نضح محلول الحجب ، واحتضان 100 ميكرولتر / بئر من محلول الأجسام المضادة الأولية في 1٪ BSA في PBS طوال الليل عند 4 درجات مئوية. اغسل ب 200 ميكرولتر / بئر من PBS ثلاث مرات لمدة 5 دقائق ، على الأقل 3 ساعات ، و 5 دقائق ، على التوالي ، في RT.
- لتسهيل تغلغل محلول التلوين الثانوي ، بما في ذلك البقع المضادة داخل الخلايا ، تتخلل الثقافات باستخدام 0.3٪ Triton X-100 و 1٪ BSA في PBS لمدة 30-90 دقيقة في RT ، اعتمادا على الكثافة الخلوية للثقافات.
ملاحظة: بالنسبة للتلطيخ القائم على الأجسام المضادة للجزيئات داخل الخلايا ، يجب تنفيذ هذه الخطوة قبل الحضانة بالجسم المضاد الأساسي الموصوف في الخطوة 4.1.2. - قم بإعداد محاليل تلطيخ ثانوية تحتوي على الأجسام المضادة الثانوية والبقع المضادة حسب الرغبة (على سبيل المثال ، بقعة نووية مثل DAPI وبقعة هيكلية خلوية مثل phalloidin-rhodamine).
- قم بإعداد مخزن مؤقت للتلوين يتكون من 0.1٪ Triton X-100 ، و 1٪ BSA في PBS ، والبقع المضادة (على سبيل المثال ، 1 ميكروغرام / مل DAPI و 1: 4000 phalloidin-rhodamine) ، وأضف الأجسام المضادة الثانوية المعنية في التخفيفات الموصى بها.
- أضف 100 ميكرولتر / بئر من محلول التلوين الثانوي ، واحتضان طوال الليل عند 4 درجات مئوية. على غرار الإجراء بعد حضانة الأجسام المضادة الأولية ، اغسل ب 200 ميكرولتر / بئر من PBS ثلاث مرات لمدة 5 دقائق ، على الأقل 3 ساعات ، و 5 دقائق ، على التوالي ، في RT.
- لحل 3D للهياكل ، احصل على مداخن متحدة البؤر تبدأ من القاع الزجاجي بخطوة z تبلغ 2.5 ميكرومتر تصل إلى ارتفاع نهائي يبلغ 500 ميكرومتر ، واستخدم هدفا 10x ، وتقريب رقمي 0.75x. لإنشاء إعادة بناء ثلاثية الأبعاد لإشارة GFP و F-actin في فيجي ، قم بعتبة كل قناة على حدة قبل إنشاء مركب وتوليد إعادة الإعمار باستخدام Fiji 3D Viewer.
- لتصور ECM المترسب من البقع المناعية ، احصل على مداخن متحدة البؤر بارتفاع 100 ميكرومتر مع خطوة z تبلغ 5 ميكرومتر ، وهدف 10x ، وتقريب رقمي 1.5x. قم بإنشاء إسقاطات قصوى الكثافة ، واضبط السطوع والتباين لكل قناة على حدة في فيجي قبل إنشاء مركب.
- أداء بقع اللون المباشر للبيئة خارج الخلية.
- أضف 200 ميكرولتر / بئر من محلول تلطيخ Picrosirius Red إلى الآبار الثابتة ببارافورمالدهايد ، واحتضانها لمدة 1 ساعة في RT.
- بعد ذلك ، اغسل الآبار الملطخة خمس مرات بالماء المقطر ، متبوعا بالغسيل مرتين كل يوم أو كل يومين لمدة 3-4 أيام أثناء مراقبة إزالة لون العينة. احتفظ بالألواح عند 4 درجات مئوية أثناء خطوات الغسيل الطويلة (أي أي شيء يتجاوز 6 ساعات).
- احصل على صور للعينات الملطخة باستخدام مجهر المجال الساطع المزود بكاميرا ملونة ، وحافظ على توازن اللون الأبيض المتساوي عبر الظروف. للحصول على لمحات عامة عن العينات ، استخدم تكبيرا منخفضا (على سبيل المثال ، 2.5x) لمسح البئر بالكامل. إذا لم يكن المجهر مزودا ببرنامج يدعم الخياطة الآلية ، فقم بذلك يدويا (على سبيل المثال ، باستخدام Pairwise Stitch في فيجي34).
ملاحظة: يمكن استخدام الآبار المستخدمة سابقا للتألق المناعي لهذا الغرض ، بشرط اكتمال الحصول على صورة مضان. - اتبع نفس الخطوات الموضحة لتلطيخ Picrosirius Red في الخطوات 4.2.1-4.2.3 لإجراء تلطيخ Alizarin Red والغسيل والتصوير.
5. إجراء التوصيف 3: تقييم التمايز العظمي من خلال مراقبة نشاط ALP
- في نقاط زمنية مختلفة لنهاية الاستزراع (على سبيل المثال، اليوم 4 واليوم 7 من الاستزراع المشترك)، قم بتقييم نشاط ALP كميا باستخدام تلطيخ 5-برومو-4-كلورو-3-إندوليل فوسفات (BCIP)/نيترو بلو تيترازوليوم (NBT).
- اغسل المستنبتات مرة واحدة باستخدام 200 ميكرولتر / بئر من PBS قبل الحضانة بمحلول الركيزة BCIP / NBT ، والذي يجب تحضيره باتباع تعليمات الشركة المصنعة. احتضان في 37 درجة مئوية مع مراقبة تطور اللون بشكل دوري. بمجرد أن يبدأ اللون في التطور في ظروف غير عظمية ، اغسل على الفور مرة واحدة باستخدام 200 ميكرولتر / بئر من PBS قبل التثبيت باستخدام 4٪ بارافورمالدهيد ، كما هو موضح في الخطوة 4.1.1.
- احصل على صور ملونة للعينات الملطخة ، كما هو موضح في الخطوة 4.2.3 لتلطيخ Picrosirius Red.
- في نقاط زمنية مختلفة لنهاية الثقافة (على سبيل المثال ، اليوم 4 واليوم 7 من الثقافة المشتركة) ، حدد نشاط ALP في تحلل الخلية.
- اغسل المستنبتات ثلاث مرات باستخدام 200 ميكرولتر / بئر من PBS قبل الحضانة ب 200 ميكرولتر / بئر من 0.25٪ Trypsin-EDTA عند 37 درجة مئوية. كل 10 دقائق ، قم بتحريك الثقافات عن طريق سحب السحب بقوة لأعلى ولأسفل لتسهيل عملية الهضم ، ومراقبة مورفولوجيا الثقافة باستخدام مجهر زراعة الخلايا القياسي.
- بمجرد الحصول على معلق سائل أحادي الخلية بدون هياكل خلوية ممدودة في الآبار (عادة بعد 20-30 دقيقة) ، انقل العينات إلى أنابيب سعة 2 مل ، وأضف 200 ميكرولتر من الوسط القاعدي MSC لتثبيط التربسين ، وأجهزة الطرد المركزي عند 500 × جم لمدة 5 دقائق لتكوير الخلايا المسترجعة. صب المادة الطافية, وقم بتجميد الكريات عند -80 درجة مئوية, أو انتقل مباشرة إلى الخطوة 5.2.3.
- قم بإذابة كريات الخلايا التي تم الحصول عليها في الخطوة 5.2.2 ، واحتضانها ب 500 ميكرولتر من محلول التحلل الذي يتكون من 0.56 م 2-أمينو-2-ميثيل-1-بروبانول ، 0.2٪ Triton X-100 ، درجة الحموضة 10 ، لمدة 30 دقيقة على الجليد. بعد ذلك ، أجهزة الطرد المركزي عند 16100 × جم لمدة 10 دقائق عند 4 درجات مئوية ، واحتفظ بالعينات على الجليد. بعد القياسات الموصوفة في الخطوة 5.2.7 ، قم بتجميد العينات عند -20 درجة مئوية أو -80 درجة مئوية ، أو تابع مباشرة مع تحديد كمية الحمض النووي ، كما هو موضح في الخطوة 5.2.8.
ملاحظة: يمكن تحضير المخزن المؤقت للتحلل مسبقا وتصفيته وتعقيمه وتخزينه عند 4 درجات مئوية. - تحضير كاشف ALP الذي يتكون من 20 mM 4-Nitrophenyl فوسفات ملح الصوديوم سداسي هيدرات و 4 mM MgCl2 في محلول التحلل.
ملاحظة: من الأفضل تحضير هذا المحلول طازجا في يوم القياس الكمي. - دون الإخلال بأي حطام حبيبي ، قم بتوزيع 50 ميكرولتر من طاف الخلية المحللة المحضر في الخطوة 5.2.3 في آبار صفيحة قياسية وشفافة وزراعة الأنسجة 96 بئرا في نسخ. أضف مخزن التحلل المؤقت إلى بئرين كعناصر تحكم فارغة.
- باستخدام ماصة متعددة القنوات ، أضف 50 ميكرولتر / بئر من كاشف ALP إلى الآبار المملوءة في الخطوة 5.2.5. هز الطبق لفترة وجيزة ، واحتضانه على حرارة 37 درجة مئوية لمدة 10 دقائق محمية من الضوء. ستظهر الآبار ذات النشاط العالي ل ALP باللون الأصفر. أوقف التفاعل بإضافة 100 ميكرولتر / بئر من 1 M NaOH باستخدام ماصة متعددة القنوات.
- اقرأ الكثافة البصرية عند 410 نانومتر باستخدام قارئ اللوحة. متوسط التكرارات التقنية، واطرح متوسط عناصر التحكم الفارغة.
- قم بإجراء القياس الكمي للحمض النووي لتطبيع نشاط ALP المحدد في الخطوات السابقة مقابل إجمالي عدد الخلايا. هنا ، يتم وصف طريقة تعتمد على قياسات مضان ، ولكن أي طريقة أخرى لقياس كمية الحمض النووي في محللات الخلية متوافقة مع الفحص. إعداد الكواشف ومعايير الحمض النووي المطلوبة لقياس كمية الحمض النووي باستخدام مجموعات متوفرة تجاريا وفقا لتعليمات الشركات المصنعة.
ملاحظة: يوصى باستخدام محلول التحلل لإعداد معايير الحمض النووي. - إذا تم تجميد العينات المستخدمة في القياس الكمي ل ALP الموصوفة في الخطوة 5.2.3 ، قم بإذابتها ، وأجهزة الطرد المركزي عند 16100 × g لمدة دقيقتين عند 4 درجات مئوية ، وضعها على الجليد. دون إزعاج أي حطام محفور ، قم بتوزيع 50 ميكرولتر من الخلية المحللة للطاف في آبار صفيحة سوداء مكونة من 96 بئرا في نسخ. قم بتجميد العينات عند -20 درجة مئوية أو -80 درجة مئوية ، وكرر تقديرات ALP والحمض النووي إذا لزم الأمر. أضف معايير الحمض النووي في نسخ مكررة.
- باستخدام ماصة متعددة القنوات ، أضف 50 ميكرولتر من عامل تلطيخ الحمض النووي ، واحتضان ، وقراءة شدة التألق وفقا لتعليمات الشركة المصنعة. باستخدام قيم المنحنى القياسية ، حدد وطبق تحويل قيم الشدة المقاسة إلى تركيزات الحمض النووي.
- تطبيع قيم ALP التي تم الحصول عليها في الخطوة 5.2.7 بتقسيمها على تركيز الحمض النووي لكل عينة.
6. التطبيق 1: إجراء فحوصات حساسية الدواء
- عندما يتم تطوير الشبكات البطانية بالكامل (عادة في اليوم 4 من الثقافات المشتركة للخلايا البطانية اللحمية) ، أضف مركبات مضادة لتولد الأوعية ، مثل بيفاسيزوماب ، إلى الثقافات في وسط استزراع جديد ، واختبر نشاطها بمرور الوقت وتحت ظروف مختلفة (على سبيل المثال ، تركيزات مختلفة من FGF-2 أو BMP-2).
- قم بإعداد وسط استزراع جديد يحتوي على نفس عوامل النمو المستخدمة للثقافات المعنية حتى تلك النقطة.
- قم بإعداد محلول تحكم يتكون من مخفف المركب محل الاهتمام (على سبيل المثال ، لبيفاسيزوماب: 60 مجم / مل α تريهالوز ثنائي الهيدرات ، 0.4 مجم / مل توين 20 ، 5.8 مجم / مل فوسفات الصوديوم ، أحادي القاعدة وأحادي الهيدرات ، و 1.2 مجم / مل فوسفات الصوديوم ثنائي القاعدة ، لا مائي) ، وقم بترشيحه بشكل معقم.
- أضف مركب الفائدة عند التركيز المطلوب (على سبيل المثال ، 10 ميكروغرام / مل بيفاسيزوماب) وحجم متساو من محلول التحكم إلى وسط الاستزراع المخصص لظروف الاختبار والتحكم ، على التوالي.
- قم بإعداد وسط استزراع جديد يحتوي على نفس عوامل النمو المستخدمة للثقافات المعنية حتى تلك النقطة.
- نضح الوسط من المستنبت، وأضف 200 ميكرولتر/بئر من الوسط المحضر حديثا في الخطوة 6.1.1. احتضان لفترة مناسبة للمركب المراد اختباره (على سبيل المثال ، لبيفاسيزوماب: 2 أيام). مراقبة تطور الثقافة، وتوصيف الشبكات البطانية كما هو موضح في القسم 3. تقييم فعالية المركب في تثبيط تكوين الأوعية أو إزالة الهياكل المشكلة مسبقا باستخدام صور GFP ومعلمات الشبكة الكمية المستخرجة من التحليل الموضح في الخطوة 3.7.
7. التطبيق 2: إنشاء أنظمة زراعة مشتركة متقدمة مع أنواع مختلفة من الخلايا السرطانية
- في اليوم 4 من الثقافة المشتركة ، عندما يتم إنشاء الشبكات البطانية في الغالب ، أضف أنواعا أخرى من الخلايا ، مثل خلايا سرطان MDA-MB-231 أو U2OS ، إلى الثقافات في وسط ثقافة جديد.
- قم بتسمية الخلايا السرطانية باستخدام صبغة حية متوافقة مع الخلايا وفقا لتعليمات الشركة المصنعة حتى تتمكن من تمييزها عن HUVECs التي تحمل علامة GFP و hBM-MSCs غير المسماة في الثقافات المشتركة.
- تحضير معلق للخلايا السرطانية بتركيز 1.5 × 104 خلايا / مل في وسط استزراع طازج يحتوي على نفس عوامل النمو المستخدمة في المزارع المعنية حتى تلك النقطة.
- مراقبة تطور الثقافة وتوطين الخلايا السرطانية حسب الرغبة.
ملاحظة: اعتمادا على نوع السرطان ونشاطه وبيئته ، قد يستغرق الأمر بضعة أيام حتى يصل إلى الهياكل الوعائية في الثقافات المشتركة للخلايا البطانية اللحمية (على سبيل المثال ، يومين ل MDA-BM-231 و U2OS). لذلك ، يجب توقيت التصوير بفاصل زمني لتصور تفاعلات الخلايا السرطانية الوعائية وفقا لذلك.
النتائج
تم إنشاء الثقافات المتخصصة الوعائية عن طريق البذر المتسلسل hBM-MSCs و GFP-HUVECs على الهلاميات المائية القائمة على PEG مسبقة الصب مع تدرج صلابة داخل لوحة تصوير 96 بئرا (الشكل 1). تم رصد الثقافات طوليا عبر الفحص المجهري الحي للتألق وتم توصيفها في نقاط زمنية مختارة. تم تقييم المقصورة خارج الخلية عن طريق تلطيخ الألوان المباشر والبقع القائمة على الأجسام المضادة. تم قياس نشاط ALP بعد استرجاع الخلايا وتحليلها من المنافذ المتولدة. علاوة على ذلك ، نثبت مدى ملاءمة هذه المنصة لفحوصات حساسية الأدوية المضادة لتولد الأوعية وكأساس لنماذج الثقافة المشتركة للسرطان.
تم إنشاء الاستزراع المشترك ل hBM-MSCs و HUVECs المعبرة عن GFP عن طريق بذر 3 × 104 خلايا / بئر في غياب عوامل النمو أو في وجود FGF-2 أو BMP-2 عند 50 نانوغرام / مل ، كما هو موضح في البروتوكول. منذ نقطة زمنية مبكرة ، يمكن ملاحظة الاختلافات بين الثقافات من كل من صور المجال الساطع والفلورة التي تظهر فقط GFP-HUVECs (الشكل 2 أ). من خلال مراقبة نفس المناطق طوليا ، يمكن ملاحظة الاختلافات في تطور الثقافات ، مثل التطور الأسرع في وجود FGF-2. بشكل عام ، بدت الثقافات أقل تطورا في غياب أي عامل نمو ، مع انتشار عدد أقل من الخلايا من كلا النوعين ووجود مناطق غير خلوية. في المقابل ، أظهرت صور المجال الساطع الثقافات الأكثر كثافة في وجود BMP-2. ومع ذلك ، تشكلت الشبكات الشبيهة بالأوعية الدموية في كل من الظروف المحتوية على عامل النمو ، وتم تشكيل الشبكات الأكثر شمولا وترابطا مع FGF-2. يمكن أيضا قياس هذه الاختلافات المرصودة باستخدام محلل تكوين الأوعية ل ImageJ. في الواقع ، كان إجمالي طول الشبكة أعلى في وجود FGF-2 وأدنى في غياب عوامل النمو (الشكل 2B). اتبع عدد التقاطعات التي تشير إلى نقاط التفرع في الشبكات نفس اتجاه الطول الإجمالي (الشكل 2C). وعلى العكس من ذلك، فإن كلا الشرطين المحتويين على عامل النمو يظهران عددا أقل بكثير من القطاعات المعزولة، مما يشير إلى ترابط أعلى، مقارنة بالحالة التي لا تحتوي على أي عامل نمو (الشكل 2 د). بالإضافة إلى ذلك ، كشف التصوير ثلاثي البؤر عن تغلغل أقوى للخلايا البطانية من حيث العمق في حالة تحفيز FGF-2 (الشكل 2E).
تم الحفاظ على الزراعات المشتركة HBM-MSC / GFP-HUVEC لمدة 7 أيام في وجود FGF-2 أو BMP-2 قبل تثبيتها وتلطيخها لمكونات ECM. أظهرت الصبغات المناعية الكيميائية متبوعة بالفحص المجهري بالليزر متحد البؤر اختلافات مذهلة في مورفولوجيا الثقافة اعتمادا على نوع مكملات عامل النمو (الشكل 3 أ). مع FGF-2 ، تم تنظيم الثقافة في هياكل مكثفة تشبه الأوعية الدموية الدقيقة ، والتي كانت كثيفة في كل من الخلايا البطانية والوسيطة ، بينما في وجود BMP-2 ، امتدت hBM-MSCs على مساحة أكبر بكثير ، كما يتضح من المناطق الأكثر اتساعا إيجابية F-actin و GFP السلبية. تم توطين بروتينات ECM الفبرونيكتين والكولاجين I بطريقة مماثلة ، بينما كان اللامينين والكولاجين الرابع أكثر تركيزا حول الهياكل البطانية. ومع ذلك ، كان هذا التركيز المتزايد حول الهياكل البطانية أكثر وضوحا في وجود FGF-2 منه في وجود BMP-2. بالإضافة إلى البقع القائمة على الأجسام المضادة ، تم إجراء تلطيخ اللون المباشر لتقييم الحالة الليفية العامة ل ECM (Picrosirius Red staining; الشكل 3B) ، وكذلك ترسب الكالسيوم على ECM (تلطيخ Alizarin الأحمر ؛ الشكل 3 ج) من المنافذ المشكلة. كان تلطيخ Picrosirius Red أقوى وأكثر شمولا في المنافذ المستزرعة باستخدام BMP-2 ، واتبع تلطيخ Alizarin Red نفس الاتجاه.
بعد ذلك ، تم تمييز الثقافات من حيث إمكاناتها العظمية من خلال تقييم نشاط ALP كعلامة عظمية مبكرة. في اليوم 4 واليوم 7 من الاستزراع المشترك ، تم استرداد الخلايا من المنافذ عن طريق هضم الهلاميات المائية مع التربسين. لتحديد نشاط ALP ، تم تحليل الخلايا المستردة ، وتم إجراء فحص pNPP. تمت تسوية القيم التي تم الحصول عليها مقابل إجمالي الحمض النووي لكل عينة لحساب الاختلافات المحتملة في أعداد الخلايا عبر الظروف. في الواقع ، يمكن ملاحظة اختلافات صغيرة بين محتوى الحمض النووي للظروف ، وتم استرداد أقل عدد من الخلايا من الحالة دون أي عامل نمو (غير معروض). ومع ذلك ، فإن نشاط ALP الطبيعي يختلف اختلافا كبيرا عبر الظروف ، مع اتجاه لزيادة النشاط بتركيزات أعلى من BMP-2 وهضبة عند 100 نانوغرام / مل (الشكل 4 أ ، ب). تم تحديد أدنى مستويات النشاط للحالة التي تحتوي على 50 نانوغرام / مل FGF-2. في حين يمكن ملاحظة اتجاهات مماثلة لكل من النقاط الزمنية التي تم تقييمها ، زادت جميع القيم بشكل كبير بمرور الوقت في الثقافة من اليوم 4 إلى اليوم 7. بالإضافة إلى الفحص الكمي ، يمكن تصور نشاط ALP نوعيا باستخدام تلطيخ اللون المباشر بناء على تحويل الركيزة BCIP / NBT. لوحظ تلطيخ أرجواني أكثر شمولا وأكثر كثافة في وجود BMP-2 مقارنة ب FGF-2 (الشكل 4C).
لإثبات تطبيقين محتملين للمنافذ العظمية المميزة ، تم إجراء دراسة حساسية الأدوية لإثبات المفهوم والثقافات المشتركة للسرطان. بالنسبة لمقايسة حساسية الدواء ، تمت إضافة بيفاسيزوماب أو محلول تحكم يتكون من مخفف تركيبة بيفاسيزوماب إلى وسط الاستزراع الذي يحتوي على BMP-2 طازج. في اليوم 4 ، عندما تم تشكيل الشبكات القائمة في وجود 50 نانوغرام / مل BMP-2 ، تمت إضافة إما محلول التحكم أو الوسط المحتوي على بيفاسيزوماب أثناء التغيير المتوسط المنتظم ، وتم مراقبة الثقافات باستخدام التصوير الفلوري. أدت إضافة 10 ميكروغرام / مل بيفاسيزوماب إلى تراجع أو استئصال الشبكة المشكلة سابقا ، في حين أن حالة التحكم لا تزال تتميز بشبكات واسعة النطاق بعد يومين من التغيير المتوسط (الشكل 5 أ ، ب). يمكن أيضا قياس هذه التغييرات من خلال تتبع الطول الإجمالي للشبكات باستخدام محلل تكوين الأوعية ل ImageJ على صور مضان يتم الحصول عليها يوميا (الشكل 5C). بدلا من ذلك ، يمكن أيضا إضافة بيفاسيزوماب أو أي مركب آخر من بداية الثقافة المشتركة لتقييم تأثيرها على تكوين الشبكات. في حالة بيفاسيزوماب ، هذا يمنع تماما تشكيل الشبكات البطانية (غير معروض).
بالنسبة للتطبيق الثاني ، تمت إضافة سرطان الثدي MDA-MB-231 أو خلايا الساركوما العظمية U2OS إلى المزارع المشتركة لليوم الرابع بكثافة 1.5 × 103 خلايا / بئر في وسط استزراع طازج يحتوي على 50 نانوغرام / مل BMP-2. لتمييزها عن HUVECs التي تحمل علامة GFP و hBM-MSCs غير المصنفة ، تم تحضين الخلايا السرطانية باستخدام CellTrace FarRed قبل البذر مباشرة على منافذ العظم. تمت مراقبة الثقافات بواسطة المجهر الفلوري. في البداية ، معظم الخلايا السرطانية المترجمة بالقرب من سطح الركيزة ، ولكن بعد 2 أيام ، يمكن العثور عليها على مقربة من الطبقات التي تحتوي على الثقافات المشتركة الوعائية. وهكذا ، تم اختيار اليوم 2 كنقطة انطلاق للفحص المجهري بفاصل زمني لإظهار ديناميكيات التفاعلات بين الخلايا السرطانية والخلايا داخل مكانة الأوعية الدموية. ومن المثير للاهتمام ، أنه يمكن رؤية خلايا MDA-MB-231 تقترب وتبتعد عن الهياكل البطانية ، وبالتالي ، ربما كانت تبحث أو تعيد تشكيل بيئتها (الشكل 5D). باستخدام CellTrace FarRed كتسمية للخلايا السرطانية ، و GFP كملصق ل HUVECs ، وتلطيخ إضافي ل F-actin ، يمكن تمييز جميع أنواع الخلايا باستخدام مجهر المسح بالليزر متحد البؤر (الشكل 5E).
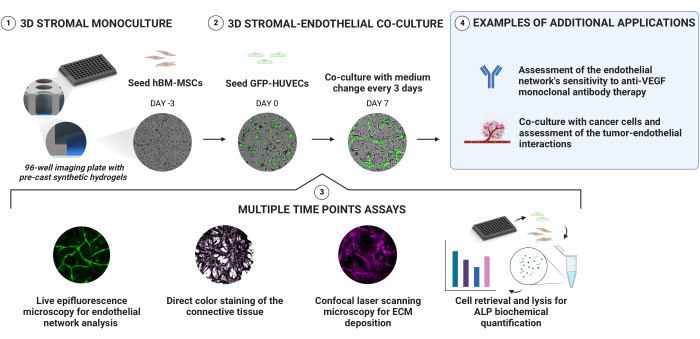
الشكل 1: نهج بسيط لتوليد موثوق من منافذ الأوعية الدموية والعظمية. تسمح الهلاميات المائية الاصطناعية مسبقة الصب ذات التدرج الصلابة المتعمق بتوليد ثقافات 3D عبر بذر الخلايا المتسلسل دون الحاجة إلى تغليف مباشر. يتم استزراع hBM-MSCs مسبقا لمدة 3 أيام قبل إضافة HUVECs التي تعبر عن GFP. تتم مراقبة الثقافات من خلال الحصول على إشارات المجال الساطع و GFP طوليا. في نقاط زمنية محددة ، يتم تقييم المنافذ بشكل أكبر لترسب ECM وحالة العظم. يتم تقييم نشاط الفوسفاتيز القلوي عن طريق تلطيخ اللون المباشر وعن طريق استرجاع الخلايا من المنافذ وإجراء مقايسة pNPP على محللات الخلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
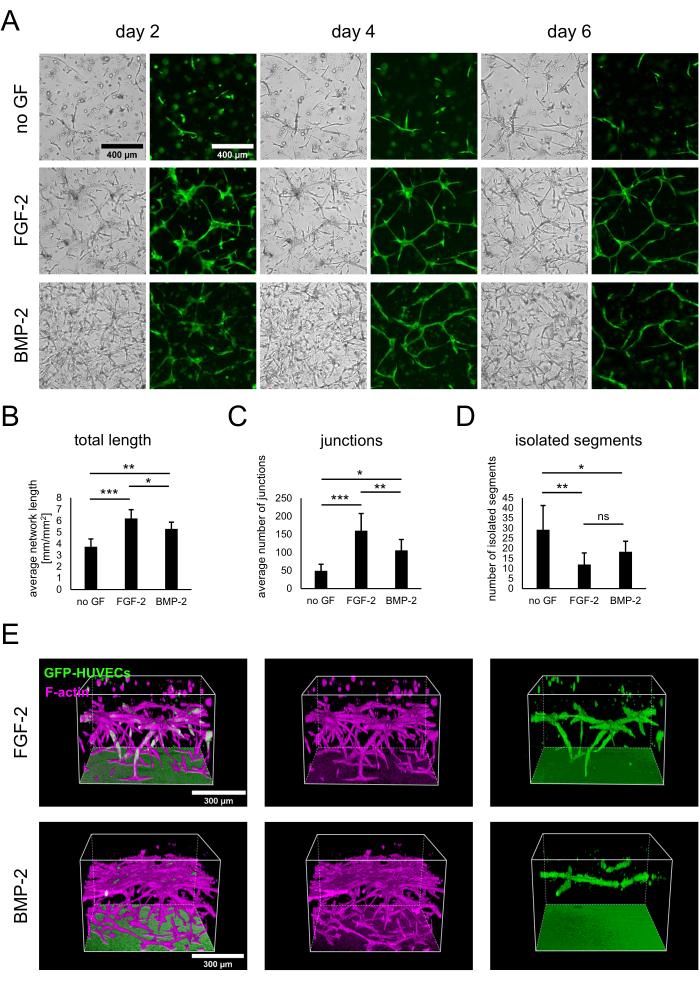
الشكل 2: تحفيز الشبكات الشبيهة بالأوعية الدموية باستخدام FGF-2 أو BMP-2. (أ) تم الحصول على صور المجال الساطع والتألق (GFP) في اليوم 2 واليوم 4 واليوم 6 من المزرعة المشتركة للخلايا المزروعة في غياب عوامل النمو أو في وجود FGF-2 أو BMP-2 ، كلاهما عند 50 نانوغرام / مل. شريط المقياس: 400 ميكرومتر. (B-D) المعلمات الكمية لشبكات GFP-HUVEC التي تم تصويرها في اليوم 4 من الثقافة المشتركة ، تم تحليلها باستخدام محلل تكوين الأوعية ل ImageJ. يتم تمثيل البيانات كمتوسط ± الانحراف المعياري. تم إجراء التحليل الإحصائي باستخدام GraphPad Prism 9.5.1. تم إجراء ANOVA عادي أحادي الاتجاه مع اختبار مقارنات Dunnett المتعددة مع n ≥ 4 ؛ * ف < 0.05 ؛ ** P < 0.01; P < 0.001. (ه) عمليات إعادة البناء ثلاثية الأبعاد المتولدة من مداخن متحدة البؤر (الارتفاع الكلي: 547.5 ميكرومتر ؛ الخطوة z: 2.5 ميكرومتر) لإشارات GFP و F-actin لظروف FGF-2- (الصف العلوي) و BMP-2- (الصف السفلي). شريط المقياس: 300 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
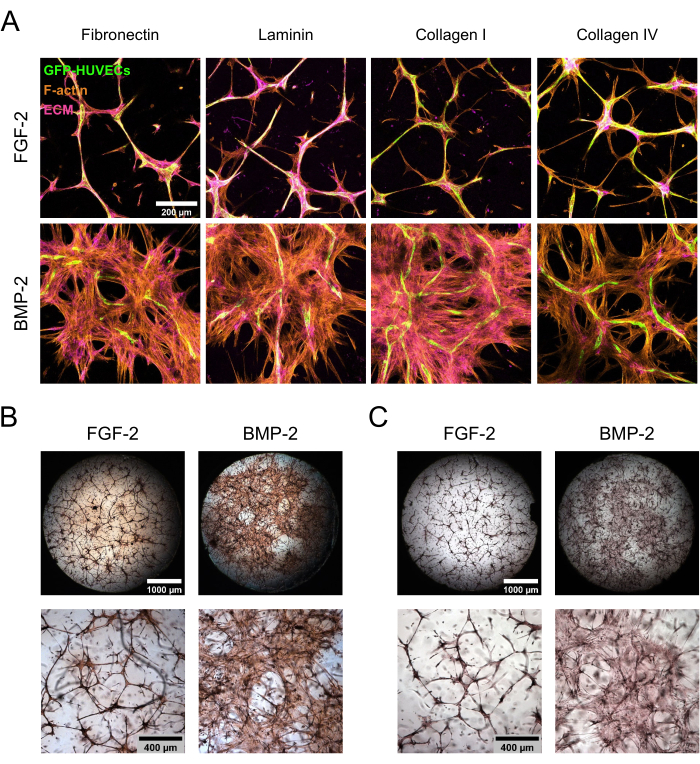
الشكل 3: تحريض انتشار hBM-MSC غير المتمركز وترسب ECM بواسطة BMP-2. (أ-ج) تعرضت المزارع المشتركة لمدة 7 أيام التي نمت في وجود FGF-2 أو BMP-2 إلى (A) التألق المناعي أو (B ، C) تلطيخ اللون المباشر. (أ) تم تلوين المستنبتات من أجل F-actin وبروتينات ECM الفبرونيكتين واللامينين والكولاجين الأول والكولاجين الوريدي. تصور الصور الإسقاطات القصوى للكثافة للمكدسات متحدة البؤر (الارتفاع الإجمالي: 100 ميكرومتر ؛ الخطوة z: 5 ميكرومتر). شريط المقياس: 200 ميكرومتر. (ب ، ج) تم تلطيخ الثقافات باستخدام (ب) أحمر بيكروسيروس و (ج) أحمر أليزارين. يصور الصف العلوي لمحات عامة مخيطة وكاملة للصور التي تم التقاطها بتكبير 2.5x (شريط المقياس: 1000 ميكرومتر) ، بينما يصور الصف السفلي مجال رؤية واحدا تم الحصول عليه بتكبير 5x (شريط المقياس: 400 ميكرومتر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
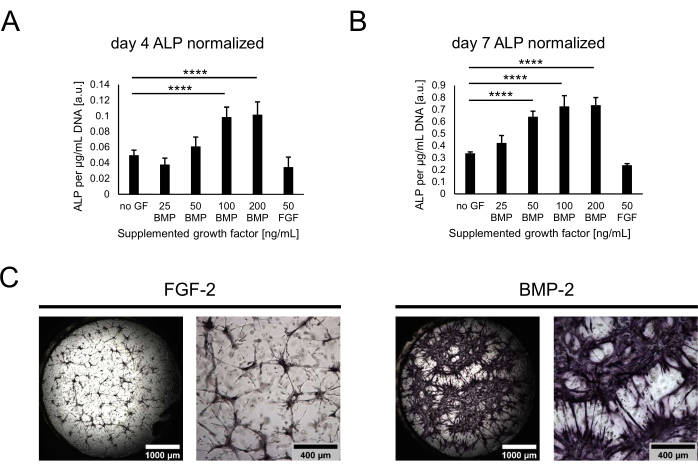
الشكل 4: التقييم الكيميائي الحيوي لنشاط ALP الناجم عن BMP-2 من خلال تلطيخ اللون المباشر. (أ ، ب) تم تحديد نشاط ALP في محللات الخلايا للمزارع المزروعة في غياب عوامل النمو أو في وجود BMP-2 بتركيزات مختلفة أو FGF-2 عند 50 نانوغرام / مل لمدة (أ) 4 أيام أو (ب)) 7 أيام من الثقافة المشتركة. يظهر نشاط ALP طبيعيا لمحتوى الحمض النووي لكل عينة محللة. يتم تمثيل البيانات كمتوسط ± الانحراف المعياري. تم إجراء التحليل الإحصائي باستخدام GraphPad Prism 9.5.1. تم إجراء ANOVA عادي أحادي الاتجاه مع اختبار مقارنات Dunnett المتعددة باستخدام n = 5 ؛ P < 0.0001. (ج) تلطيخ اللون المباشر لنشاط ALP في منافذ نمت في وجود 50 نانوغرام / مل FGF-2 أو BMP-2 لمدة 7 أيام من الاستزراع المشترك. تصور الصور الموجودة على الجانب الأيسر لمحات عامة كاملة عن الصور التي تم التقاطها بتكبير 2.5x (شريط المقياس: 1000 ميكرومتر) ، بينما تصور الصور الموجودة على الجانب الأيمن مجال رؤية واحدا تم الحصول عليه بتكبير 5x (شريط المقياس: 400 ميكرومتر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
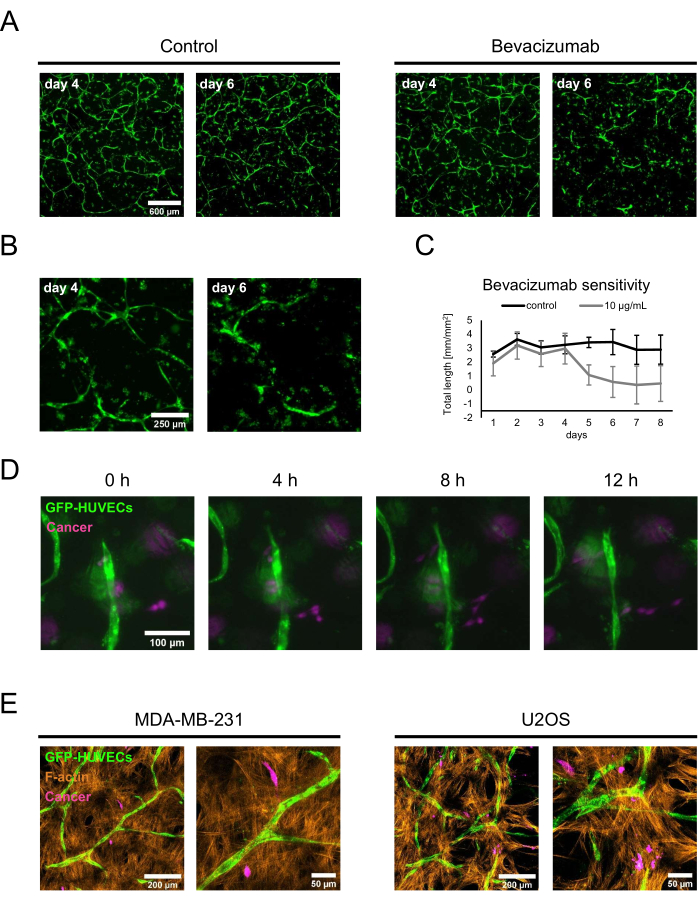
الشكل 5: توظيف منافذ عظمية وعائية في نماذج السرطان المتقدمة. (أ) تم تصوير إشارات GFP للمزارع المزروعة في وجود BMP-2 في اليوم الرابع من الاستزراع المشترك قبل إضافة محلول تحكم (يسار) أو بيفاسيزوماب عند 10 ميكروغرام / مل (يمين) لمدة يومين ، وبعد ذلك تم تصوير الثقافات مرة أخرى (اليوم 6 من الثقافة المشتركة). شريط المقياس: 600 ميكرومتر. (ب) تظهر صور تكبير أعلى للثقافات المعالجة ببيفاسيزوماب في A. شريط المقياس: 250 ميكرومتر. (ج) تم تحديد الطول الإجمالي للشبكات البطانية كما هو موضح في A باستخدام محلل تكوين الأوعية ل ImageJ من الصور التي يتم الحصول عليها يوميا ؛ ن ≥ 3. (د) تمت إضافة خلايا سرطان الثدي MDA-MB-231 التي تحمل علامة CellTrace FarRed إلى الثقافات المشتركة لمدة 4 أيام التي نمت في وجود BMP-2 ، وتم الحصول على صور الفاصل الزمني بدءا من يومين بعد إضافة الخلايا السرطانية. شريط المقياس: 100 ميكرومتر. (ه) إسقاطات الكثافة القصوى للمداخن متحدة البؤر (الارتفاع الإجمالي: 70 ميكرومتر ؛ الخطوة z: 2.4 ميكرومتر) من المزارع المشتركة الثلاثية المتولدة كما هو موضح في D وثابتة وملطخة ل F-actin. على اليسار: منافذ تضم خلايا سرطان الثدي MDA-MB-231 ؛ على اليمين: منافذ تضم خلايا الساركوما العظمية U2OS. أشرطة القياس للصور على اليسار: 200 ميكرومتر ؛ أشرطة المقياس للصور على اليمين: 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
هنا ، وصفنا بروتوكولا لإنشاء نموذج في المختبر لمنافذ العظام ونخاع العظام عالية الأوعية الدموية في مصفوفة 3D PEG الاصطناعية بالكامل والتي يمكن التحكم فيها ، والتي لها مجموعة متنوعة من التطبيقات في أبحاث بيولوجيا العظام ونخاع العظام ، وهندسة الأنسجة ، وأبحاث السرطان. يعتمد هذا النموذج على هيدروجيل اصطناعي قائم على PEG يعمل مع ببتيدات RGD ومواقع انقسام MMP ويتم صبه بتدرج كثافة متعمق على ألواح تصوير 96 بئرا ذات قاع زجاجي30. وقد تبين أن منصة التوصيل والتشغيل هذه تسمح بإنشاء شبكات خلوية 3D مترابطة للغاية دون الحاجة إلى تغليف الخلايا في هيدروجيل. على غرار بروتوكول تغليف الخلايا الموصوف سابقا ، في هذا العمل ، نعرض إعادة تشكيل الركيزة بواسطة ECM28 المتأصل في الخلية لإنشاء بيئة دقيقة خاصة بنوع الخلية. وبالتالي ، مع هذه الطريقة ، يمكن إجراء فحوصات فحص الأدوية وتحليلات المحتوى العالي بسهولة في ظل ظروف ثقافة 3D العضوية القابلة للتكرار للغاية. تجعل الألواح الزجاجية ذات القاع 96 بئرا والهلاميات المائية الشفافة بصريا المنصة متوافقة مع أتمتة معالجة السوائل والفحص المجهري عالي الإنتاجية.
الخطوة الأولى في توليد مكانة نخاع العظم الوعائي هي ما قبل زراعة hBM-MSCs على هيدروجيل PEG لمدة 3 أيام على الأقل. خلال هذا الوقت ، يعلقون على هيدروجيل ، ويخترقونه ، ويبدأون في إنشاء اتصالات خلية خلية وترسب ECM. قبل زرع hBM-MSCs ، يجب إزالة المخزن المؤقت للتخزين. نظرا لأن الهيدروجيل يقع داخل بئر داخلي داخل البئر القياسي للوحة التصوير المكونة من 96 بئرا ، فمن الآمن إدخال طرف الشفط على طول جانب البئر حتى يلامس حلقة البئر الداخلية. يمكن استخدام مضخة التفريغ للشفط إذا تم ضبطها على أقل قوة شفط ممكنة. بدلا من ذلك ، يمكن استخدام غسالة الألواح الآلية مع ضبط ارتفاع الفوهة على 0.8 مم على الأقل فوق حلقة البئر الداخلية لشفط المخزن المؤقت من لوحة الهيدروجيل. يمكن أن يؤدي استخدام الأتمتة لمعالجة السوائل إلى تقليل الأضرار التي تلحق بسطح الهيدروجيل ويؤدي إلى زيادة قابلية استنساخ الثقافات الناتجة. تصبح العيوب الصغيرة على سطح الهيدروجيل مرئية بمجرد أن تستقر الخلايا على الهيدروجيل وتظهر على مستوى تركيز منخفض في مناطق هيدروجيل معيبة. لذلك ، فإن الحصول على الصور المرجعية في اليوم 0 بمثابة مراقبة جيدة للجودة لتجانس بذر الخلايا وسلامة سطح الهيدروجيل. في حين أن عيوب سطح الهيدروجيل الصغيرة لا تمنع الاستخدام الإضافي للبئر ، تميل الخلايا إلى التجمع في المناطق المعيبة وقد تنمو إلى أنماط غير تمثيلية أو تصل بسرعة أكبر إلى الزجاج السفلي ، حيث تنمو لتصبح طبقة أحادية. يجب ملاحظة هذه القطع الأثرية عند استخدام / تقييم هذه الآبار. تنطبق اعتبارات مماثلة على أي تغييرات متوسطة يتم إجراؤها خلال مدة الفحص بأكملها.
تتضمن الخطوة الثانية من البروتوكول إضافة GFP-HUVECs إلى الزراعة الأحادية hBM-MSC المشكلة مسبقا (اليوم 0 من الثقافة المشتركة). يوفر ECM المودع بواسطة hBM-MSC سقالة كبيرة لنمو الخلايا البطانية ، والتي في هذا العمل ، حتى في وجود وسط مكيف hBM-MSC ، يمكن أن تشكل فقط مجموعات خلايا مستديرة على الهلاميات المائية (غير معروضة). عند البذر على ثقافات hBM-MSC ، تدمج HUVECs وتشكل هياكل تشبه الأوعية الدقيقة مماثلة لتلك التي لوحظت في الثقافات المشتركة الناتجة عن تغليف الخلايا27,28. عادة ، تتشكل شبكات شبيهة بالأوعية الدموية الدقيقة 3D متطورة في غضون 4 أيام من الثقافة المشتركة ، ويمكن مراقبة ذلك طوليا باستخدام HUVECs التي تحمل علامة GFP. يمكن الحفاظ على هذه الهياكل لمدة 7 أيام على الأقل في الثقافة ، مما يعني أن هناك وقتا كافيا لمتابعة التغييرات في تنظيم شبكة الأوعية الدموية استجابة للعلاجات ، مثل فحص الأدوية المضادة لتولد الأوعية. يمكن قياس العناصر المورفولوجية للشبكة البطانية في وضع الدفعات عن طريق تقسيم صور GFP باستخدام أدوات راسخة ، مثل المكون الإضافي Angiogenesis Analyzer ل ImageJ33 ، ويمكن استخدام معلماتها لتقييم ، على سبيل المثال ، فعالية الدواء والديناميكا الدوائية.
إحدى المزايا المهمة للنموذج الخلوي الموصوف للعديد من التطبيقات المحتملة هي اللدونة. إن مجرد استكمال وسط الاستزراع بعوامل نمو مختلفة يمكن أن يغير مظهر الثقافة المشتركة. على سبيل المثال ، فإن وجود BMP-2 طوال فترة الثقافة الأحادية والمشتركة يخلق مكانة وعائية عظمية المنشأ ، مما يدل على زيادة نشاط ALP ، وترسب الكالسيوم خارج الخلية ، وكذلك تجميع ECM وترسبه. على العكس من ذلك ، في وجود FGF-2 ، تكون العلامات العظمية غائبة ، وتشكل الثقافة المشتركة عددا أقل من ارتباطات الخلايا الجانبية ولكنها تظهر نموا أكثر وضوحا للخلايا ثلاثية الأبعاد. حقيقة أن FGF-2 يثبط نشاط ALP بينما يثير BMP-2 نشاط ALP أقوى مقارنة بعدم وجود علاج عامل النمو يتوافق مع الملاحظات السابقة27. ومع ذلك ، على الرغم من هذه الاختلافات الكبيرة في المكون اللحمي hBM-MSC ، كان مدى شبكة الأوعية الدموية الدقيقة مشابها جدا للحالتين المعالجتين بعامل النمو في هذا العمل. في ثقافات التحكم ، تشكلت فقط عدد قليل من شبكات الأوعية الدموية القصيرة ، والتي ربما تمثل مكانة نخاع العظم سيئة الأوعية الدموية. يشير هذا إلى أنه بمجرد تغيير نوع وتركيز وتوقيت عوامل النمو المضافة إلى وسط الاستزراع ، يمكن إنتاج مجموعة من منافذ نخاع العظم الوعائية المحددة جيدا ، كما هو مطلوب للدراسات المقارنة. ومع ذلك ، لضمان نتائج قابلة للتكرار ، من المهم ملاحظة أن تقدم الثقافة والتشكل قد يختلف اعتمادا على تاريخ الخلايا المستخدمة (على سبيل المثال ، رقم المرور وطريقة الانفصال المستخدمة أثناء الصيانة الروتينية للاستزراع) ، ومن المستحسن التحكم في مثل هذه العوامل أثناء تصميم الفحص.
هنا ، كأول تطبيق لهذا النموذج ، نوضح حساسية شبكات الأوعية الدموية الدقيقة المهندسة للعلاج باستخدام 10 ميكروغرام / مل بيفاسيزوماب. والجدير بالذكر أنه من المهم التأكد من أن الخوارزمية المستخدمة يمكنها التعرف بدقة على الشبكة البطانية ، حيث يتم إنشاء القطع الأثرية غالبا في الصور ذات الشبكات ضعيفة التطور. إذا كانت هذه هي الحالة ، فيجب ضبط المعلمات المستخدمة لمعالجة الصور (قبل وأثناء التجزئة) ، غالبا على أساس التجربة والخطأ.
كتطبيق ثان ، نقدم نموذجا متقدما للثقافة المشتركة يتكون من البذر المتسلسل للخلايا الوسيطة والبطانية والسرطانية. يسمح هذا النموذج بدراسة التفاعلات بين الخلايا السرطانية والسدى والأوعية الدموية لنخاع العظم ، والتي قد تكون عوامل مهمة أثناء ورم خبيث. بالإضافة إلى ذلك ، يمكن استخدام هذا النموذج لتطبيقات فحص الأدوية واختبار المركبات ذات الأهداف التي تتجاوز تكوين الأوعية.
في الثقافات ثنائية الأبعاد ، لا تتلقى الخلايا إشارات فسيولوجية ميكروبيئية ، ولا تكتسب مورفولوجيا خلوية تحدث بشكل طبيعي ، وبالتالي ، تتمايز بشكل مختلف مقارنة بالخلايا في بيئات 3D الأصلية35. عندما تزرع في الهلاميات المائية ثلاثية الأبعاد المهندسة ، تودع الخلايا ECM متأصلا في وقت مبكر ، والذي يوفر مواقع التصاق ويمكن إعادة تشكيله بنشاط28,36. هنا ، لإنشاء نموذج 3D مبسط لتطبيقات الفحص ، تم زرع الخلايا المكونة للأوعية على سطح الهلاميات المائية المهندسة وسمح لها بإنشاء شبكات الأوعية الدموية في غياب التروية. أجريت التقييمات القائمة على التصوير على إسقاطات 2D للخلايا البطانية المساهمة في الهياكل الوعائية. ومع ذلك ، كشفت الصور متحدة البؤر فقط عن نمو أقل وضوحا لشبكات الأوعية الدموية ثلاثية الأبعاد في العينات المحفزة BMP-2 عند مقارنتها بالعينات المحفزة FGF-2. هذا يشير إلى أن طول الهياكل الوعائية المشكلة قد تم التقليل من شأنه ، في حين تم المبالغة في تقدير اتصالها. بالإضافة إلى ذلك ، لم يتم التحقيق في التفاعلات بين الخلايا المحيطة بالأوعية الدموية والخلايا البطانية وتشكيل تجويف الأوعية الدموية. وستتطلب هذه الجوانب، ولا سيما فيما يتعلق بالاستجابات للعلاج من تعاطي المخدرات، مزيدا من الاهتمام. أخيرا ، سيكون من المرغوب فيه إنشاء بروتوكولات مصقولة لإنشاء شبكات وعائية 3D واسعة النطاق وعندها فقط تحفيز تمايزها العظمي لتوليد المزيد من نماذج العظام ونخاع العظام الفسيولوجية.
بشكل عام ، النموذج المعروض هنا متعدد الاستخدامات ويمكن تخصيصه بسهولة لتطبيقات محددة. على سبيل المثال ، يمكن استخدام خلايا اللحمة المتوسطة والبطانية من مصادر مختلفة. من المعروف أن MSCs الأنسجة الدهنية و MSCs الحبل السري تعبر عن عوامل وعائية مختلفة مقارنة ب BM-MSCs ، ويمكن استبدالها بسهولة كمكون انسجة بديل37. يمكن أيضا استخدام الخلايا البطانية المعزولة من منافذ نخاع العظم المحددة بالفعل بدلا من HUVECs. يمكن للمرء أيضا إنشاء ثقافة مشتركة مع الخلايا الوسيطة والبطانية المشتقة من المريض والمطابقة لنخاع العظم لتطبيقات الطب الشخصي ، كما تم اقتراحه مؤخرا للمزارع المشتركة للعضلات الوعائية38. بالإضافة إلى ذلك ، يسمح تصميم لوحة الهيدروجيل بالمراقبة الطولية للثقافة باستخدام كل من المجهر الساطع والفلوري ، مما يوفر للمستخدم إمكانية تقصير أو تمديد وقت الاستزراع اعتمادا على التطبيق. بدلا من ذلك ، يمكن تعديل كثافات الخلايا المستخدمة في البذر وفقا لذلك لتسريع أو تأخير تكوين شبكة الخلية إذا كانت هناك حاجة إلى أوقات مراقبة أقصر أو أطول من تلك الموجودة في هذا البروتوكول. على أي حال ، هناك حاجة إلى الحذر لتجنب فرط نمو الخلايا في هياكل تشبه الورقة ، والتي يمكن أن تؤدي إلى تقلص هيدروجيل وانفصال الخلية في نهاية المطاف.
أخيرا ، يمكن إجراء مجموعة واسعة من المقايسات باستخدام هذا النموذج. بالإضافة إلى التألق المناعي والفحص المجهري الذي يتم إجراؤه في الثقافات الحية أو الثابتة ، يمكن هضم الثقافات 3D إنزيميا ، ويمكن استرداد الخلايا وتعريضها لأي نوع من المقايسة الكيميائية الحيوية. هنا ، نوضح تحديد نشاط ALP وتقدير محتوى الحمض النووي في محللات الخلية باستخدام المقايسات اللونية / الفلورومترية ، لكن النظام متوافق مع العديد من التقنيات الأخرى ، بما في ذلك PCR و RNAseq والبروتينات. إذا لم تكن حساسية الفحص المطلوب عالية جدا ، فيمكن للمرء تجميع العينات من أكثر من بئر واحد لزيادة كمية العينة المتاحة للفحص. إذا كان التطبيق المطلوب يتطلب إذابة هلام أسرع ، فيمكن تطبيق الاهتزاز المداري للوحة مع أحجام أصغر من المحلول الهضمي لضمان تكوين دوامة في الآبار ، على افتراض أن جميع الآبار الموجودة على اللوحة ستستخدم بهذه الطريقة (الثقافات الحية حساسة لمثل هذا التعامل القاسي). باختصار ، نقدم هنا بروتوكولا ، إذا تم استخدامه كما هو موضح ، يضمن إنشاء نموذج في المختبر يلخص الجوانب الرئيسية لمنافذ الأوعية الدموية العظمية ولكنه أيضا متعدد الاستخدامات بما يكفي ليتم تعديله للتطبيقات المصممة خصيصا.
Disclosures
Ectica Technologies AG هي الشركة المصنعة للوحة بئر هيدروجيل 3DProSeed ولها مصالح تجارية. بنيامين آر سيمونا ومارتن إهربار مساهمان في شركة Ectica Technologies AG.
Acknowledgements
يود المؤلفون أن يشكروا ريكاردو أوربانيت على المساعدة التقنية في أجهزة مناولة السوائل ورودي أوداباسي على الدعم في الفحص المجهري الفلوري. تم تمويل هذا العمل من قبل المؤسسة الوطنية السويسرية للعلوم (أرقام المنح 310030E_202429 و 205321_204318) و Ectica Technologies AG.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco | 25200-072 | |
| 2 mL microtubes | Eppendorf | 30120094 | |
| 2-Amino-2-methyl-1-propanol | Sigma | A9199 | |
| 3DProSeed hydrogel well plate | Ectica Technologies | ECT.PS1.001.096 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate | Sigma | 71768 | |
| Alizarin Red S | Sigma | A5533 | |
| Anti-Collagen IV antibody | Abcam | ab6311 | |
| Anti-Laminin 1+2 antibody | Abcam | ab7463 | |
| Automated plate washer | Agilent Biotek | ELχ50 | |
| Automated washer/dispenser | Agilent Biotek | MULTIFLO FX equipped with a peristaltic pump 5uL cassette | |
| Bevacizumab | Evidentic | ID PS-E07-2019-00119 A009 | |
| BMP-2 | Peprotech | 120-02C | |
| BSA | AppliChem | A1391 | |
| Centrifuge | Eppendorf | 5415 R | To centrifuge 2 mL tubes at 16100 x g during ALP analysis |
| Confocal laser scanning microscope | Leica | Stellaris 5 | |
| Conical 50 mL centrifuge tubes | TPP | 91050 | |
| DAPI | Sigma | D9542 | |
| DyLight 649 Donkey anti-rabbit IgG (minimal x-reactivity) Antibody | Biolegend | 406406 | |
| DyLight 649 Goat anti-mouse IgG (minimal x-reactivity) Antibody | Biolegend | 405312 | |
| EGM-2 | Lonza | CC-3162 | |
| Epifluorescence microscope | Leica | DMI6000B | |
| FBS | Gibco | 10500-064 | |
| FGF-2 | Peprotech | 100-18B | |
| Fibronectin (IST-9) | Santa Cruz | sc-59826 | |
| GFP-HUVECs | PELOBiotech | PB-CAP-0001GFP | |
| hBM-MSCs | - | - | Isolated at University Hospital Basel; Papadimitropoulos A, Piccinini E, Brachat S, et al. Expansion of human mesenchymal stromal cells from fresh bone marrow in a 3D scaffold-based system under direct perfusion. PLoS One. 2014;9(7):e102359 |
| Inverted microscope | Zeiss | 200M | |
| Magnesium chloride | Sigma | M8266 | |
| MDA-MB-231 breast cancer cell line | - | Kindly obtained from J Massagué at the Memorial Sloan-Kettering Cancer Center | |
| MEMα | Gibco | 22571-038 | |
| Multimode imaging reader | Agilent Biotek | Cytation 1 | For automated imaging |
| Multimode imaging reader - fluorescence and absorbance | Agilent Biotek | Cytation 5 | For measuring absorbance and fluorescence intensity duing ALP analysis |
| Paraformaldehyde | Artechemis | US 040 | |
| PBS | Gibco | 10010-015 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Phalloidin-rhodamine | Invitrogen | R415 | |
| Picro-Sirius Red Solution | Abcam | ab246832 | |
| Quant-iT PicoGreen dsDNA Assay kit | ThermoFisher Scientific | P7589 | |
| Recombinant Anti-Collagen I antibody | Abcam | ab260043 | |
| SIGMAFAST BCIP/NBT | Sigma | B5655-25TAB | |
| Sodium hydroxide | Sigma | 1064981000 | |
| Sodium phosphate dibasic, anhydrous | Sigma | S-0876 | |
| Sodium phosphate monobasic, monohydrate | Merck | 1.06346 | |
| Triton X-100 | Sigma | T8787 | |
| Tween20 | AppliChem | A4974 | |
| U2OS osteosarcoma cell line | - | Kindly obtained from J Snedeker at the Institute for Biomechanics, Zurich | |
| α-trehalose dihydrate | Sigma | 90208 |
References
- Mendez-Ferrer, S., et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466 (7308), 829-834 (2010).
- Calvi, L. M., Link, D. C. Cellular complexity of the bone marrow hematopoietic stem cell niche. Calcified Tissue International. 94 (1), 112-124 (2014).
- Behrmann, L., Wellbrock, J., Fiedler, W. Acute myeloid leukemia and the bone marrow niche-take a closer look. Frontiers in Oncology. 8, 444 (2018).
- Yip, R. K. H., et al. Mammary tumour cells remodel the bone marrow vascular microenvironment to support metastasis. Nature Communications. 12 (1), 6920 (2021).
- Potente, M., Makinen, T. Vascular heterogeneity and specialization in development and disease. Nature Reviews Molecular Cell Biology. 18 (8), 477-494 (2017).
- Augustin, H. G., Koh, G. Y. Organotypic vasculature: From descriptive heterogeneity to functional pathophysiology. Science. 357 (6353), (2017).
- Kusumbe, A. P., Ramasamy, S. K., Adams, R. H. Coupling of angiogenesis and osteogenesis by a specific vessel subtype in bone. Nature. 507 (7492), 323-328 (2014).
- Barillari, G. The anti-angiogenic effects of anti-human immunodeficiency virus drugs. Frontiers in Oncology. 10, 806 (2020).
- Owen, M., Friedenstein, A. J. Stromal stem-cells - Marrow-derived osteogenic precursors. Ciba Foundation Symposia. 136, 42-60 (1988).
- Sacchetti, B., et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment. Cell. 131 (2), 324-336 (2007).
- Traore, M. A., George, S. C. Tissue engineering the vascular tree. Tissue Engineering. Part B, Reviews. 23 (6), 505-514 (2017).
- Bessy, T., Itkin, T., Passaro, D. Bioengineering the bone marrow vascular niche. Frontiers in Cell and Developmental Biology. 9, 645496 (2021).
- Bray, L. J., et al. A three-dimensional ex vivo tri-culture model mimics cell-cell interactions between acute myeloid leukemia and the vascular niche. Haematologica. 102 (7), 1215-1226 (2017).
- Montano, I., et al. Formation of human capillaries in vitro: The engineering of prevascularized matrices. Tissue Engineering Part A. 16 (1), 269-282 (2010).
- Sun, Z. Y., Kemp, S. S., Lin, P. K., Aguera, K. N., Davis, G. E. Endothelial k-RasV12 expression induces capillary deficiency attributable to marked tube network expansion coupled to reduced pericytes and basement membranes. Arteriosclerosis Thrombosis and Vascular Biology. 42 (2), 205-222 (2022).
- Kleinman, H. K., et al. Basement-membrane complexes with biological-activity. Biochemistry. 25 (2), 312-318 (1986).
- Kubota, Y., Kleinman, H. K., Martin, G. R., Lawley, T. J. Role of laminin and basement-membrane in the morphological-differentiation of human-endothelial cells into capillary-like structures. Journal of Cell Biology. 107 (4), 1589-1598 (1988).
- Davis, G. E., et al. Control of vascular tube morphogenesis and maturation in 3D extracellular matrices by endothelial cells and pericytes. Methods in Molecular Biology. 1066, 17-28 (2013).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
- Bersini, S., et al. A microfluidic 3D in vitro model for specificity of breast cancer metastasis to bone. Biomaterials. 35 (8), 2454-2461 (2014).
- Wang, X. L., et al. Engineering anastomosis between living capillary networks and endothelial cell-lined microfluidic channels. Lab on a Chip. 16 (2), 282-290 (2016).
- Phan, D. T. T., et al. A vascularized and perfused organ-on-a-chip platform for large-scale drug screening applications. Lab Chip. 17 (3), 511-520 (2017).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nature Biotechnology. 23 (1), 47-55 (2005).
- Kyburz, K. A., Anseth, K. S. Synthetic mimics of the extracellular matrix: How simple is complex enough. Annals of Biomedical Engineering. 43 (3), 489-500 (2015).
- Ehrbar, M., et al. Enzymatic formation of modular cell-instructive fibrin analogs for tissue engineering. Biomaterials. 28 (26), 3856-3866 (2007).
- Ehrbar, M., et al. Biomolecular hydrogels formed and degraded via site-specific enzymatic reactions. Biomacromolecules. 8 (10), 3000-3007 (2007).
- Blache, U., et al. Dual role of mesenchymal stem cells allows for microvascularized bone tissue-like environments in PEG hydrogels. Advanced Healthcare Materials. 5 (4), 489-498 (2016).
- Blache, U., et al. Notch-inducing hydrogels reveal a perivascular switch of mesenchymal stem cell fate. Embo Reports. 19 (8), e45964 (2018).
- Simona, B. R., et al. Density gradients at hydrogel interfaces for enhanced cell penetration. Biomaterials Science. 3 (4), 586-591 (2015).
- Zhang, N., et al. Soft hydrogels featuring in-depth surface density gradients for the simple establishment of 3d tissue models for screening applications. SLAS Discovery. 22 (5), 635-644 (2017).
- Martin, I., Muraglia, A., Campanile, G., Cancedda, R., Quarto, R. Fibroblast growth factor-2 supports ex vivo expansion and maintenance of osteogenic precursors from human bone marrow. Endocrinology. 138 (10), 4456-4462 (1997).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Carpentier, G., Martinelli, M., Courty, J., Cascone, I. Angiogenesis Analyzer for ImageJ. 4th ImageJ User and Developer Conference. , 198-201 (2012).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Yamada, K. M., Cukierman, E. Modeling tissue morphogenesis and cancer in 3D. Cell. 130 (4), 601-610 (2007).
- Loebel, C., Mauck, R. L., Burdick, J. A. Local nascent protein deposition and remodelling guide mesenchymal stromal cell mechanosensing and fate in three-dimensional hydrogels. Nature Materials. 18 (8), 883-891 (2019).
- Curtis, M. B., Kelly, N., Hughes, C. C. W., George, S. C. Organotypic stromal cells impact endothelial cell transcriptome in 3D microvessel networks. Scientific Reports. 12 (1), 20434 (2022).
- Wust, R., Terrie, L., Muntefering, T., Ruck, T., Thorrez, L. Efficient co-isolation of microvascular endothelial cells and satellite cell-derived myoblasts from human skeletal muscle. Frontiers in Bioengineering and Biotechnology. 10, 964705 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved